剪接因子SF3B4在制备肾透明细胞癌诊断及预后评估试剂盒中的应用
文献发布时间:2023-06-19 19:30:30
技术领域
本发明涉及生物技术领域,具体涉及剪接因子SF3B4在制备肾透明细胞癌诊断及预后评估试剂盒中的应用。
背景技术
肾细胞癌(renal cell carcinoma,RCC)起源于肾小管上皮细胞的恶变,是人类最常见的恶性肿瘤之一(Hsieh JJ,Purdue MP,Signoretti S,et al.Renal cellcarcinoma.Nature reviews Di sease primers 2017;3:17009.)。2021年,美国约有79,000例新发肾癌病例,超过13,920例死亡(Siegel RL,Miller KD,Fuchs HE,JemalA.Cancer statistics,2022.CA Cancer J C lin 2022;72(1):7-33.)。RCC的发病率在世界范围内呈上升趋势,预后仍然很差。透明细胞RCC(ccRCC)是RCC最常见的组织学亚型,占RCC病例的75%至80%[Jonasch E,Walker CL,Rathmell WK.Clear cell renal cellcarcinoma ontogeny and mechanisms of leth ality.Nat Rev Nephrol 2021;17(4):245-261.]。早期或局部RCC通常采用部分或根治性肾切除术治疗,以延长患者生存期[Jabaji RB,Fischer H,Kern T,Chien GW.Trend of Surgical Treatment of LocalizedRenal Cell Carcinoma.Perm J 2019;23:18-108.]。然而,超过25%的患者被诊断为转移性RCC(mRCC),包括接受过肾切除术的患者[Feng C,Li Y,Li K,Lyu Y,Zhu W,Jiang H,etal.PFKFB4 is overexpressed in clear-cell renal cell carcinoma promotingpentose phosphate pathway that mediates Sunitinib resistance.J Exp ClinCancer Res 2021;40(1):308.]。尽管酪氨酸激酶抑制剂(CTKI)、雷帕霉素蛋白(mTOR)抑制剂和免疫疗法显示出治疗RCC的前景,但大多数患者仍会经历癌症进展并最终死亡[Choueiri TK,Motzer RJ.Systemic Therapy for Metastatic Renal-Cell Carcinoma.NEngl J Med 2017;376(4):354-366.]。因此,我们迫切需要更准确地了解预测ccRCC的发生发展生物标志物,通过检测这些标志物判断预后并以制定更好的治疗策略。
剪接因子3B亚基4(SF3B4)是SF3B复合物的核心亚基,是U2型剪接体的一部分[Cretu C,Schmitzova J,Ponce-Salvatierra A,Dybkov O,De Laurentiis EI,Sharma K,et al.Molecular Architecture of SF3b and Structural Consequences of ItsCancer-Related Mutatio ns.Mol Cell 2016;64(2):307-319.]。最近的研究表明,SF3B4除了前体mRNA剪接之外,在转录、翻译和细胞信号传导的调节中也发挥着重要作用。重要的是,新出现的证据表明,基因突变或其他因素导致的SF3B4表达失调与多种疾病有关,包括肿瘤发生和Nager综合征(NS)[Liu Z,Li W,Pang Y,Zhou Z,Liu S,Cheng K,et al.SF3B4is regulated by mi croRNA-133b and promotes cell proliferation and metastasisin hepatocellular carcinoma.EB ioMedicine 2018;38:57-68.]。例如,SF3B4的上调促进肝细胞癌(HCC)、食管鳞状细胞癌(E SCC)[Kidogami S,Iguchi T,Sato K,Yoshikawa Y,Hu Q,Nambara S,et al.SF3B4 Plays an Oncogenic Role in Esophageal SquamousCell Carcinoma.Anticancer Res 2020;40(5):2941-2946.]和卵巢癌(OC)[Diao Y,Li Y,Wang Z,Wang S,Li P,Kong B.SF3B4 promot es ovarian cancer progression byregulating alternative splicing of RAD52.Cell Death Dis2022;13(2):179.]的肿瘤发生,而其下调或耗竭导致胰腺癌[Zhou W,Ma N,Jiang H,Ron g Y,Deng Y,Feng Y,etal.SF3B4 is decreased in pancreatic cancer and inhibits the grow th andmigration of cancer cells.Tumour Biol 2017;39(3):1010428317695913.]和NS患者的乳腺癌[Denu RA,Burkard ME.Synchronous Bilateral Breast Cancer in a PatientWith Nager Syndrome.Clin Breast Cancer 2017;17(3):e151-e153.]。这些发现表明SF3B4在不同环境和不同癌细胞中发挥不同的功能作用,强烈表明SF3B4在细胞生长中的重要作用以及精细调节的SF3B4水平对调节肿瘤细胞稳定的重要性。然而目前尚无SF3B4在肾透明细胞癌中相关的研究报道,SF3B4在肾透明细胞癌发生发展中的分子机制仍不清楚。并且目前还未见剪接因子SF3B4在制备肾透明细胞癌诊断或预测肾透明细胞癌患者预后的应用的研究报道。
发明内容
针对现有技术中的不足,本发明的目的,一方面在于寻找可有效用于肾透明细胞癌诊断、治疗方案选择、肾透明细胞癌预后评估的标志基因;另一方面,利用SF3B4在肾透明细胞癌中高表达并促进肿瘤细胞的增殖及迁移,提供SF3B4作为肾透明细胞癌的治疗靶点及诊断标志物在临床检测试剂盒中的应用。
本发明提供剪接因子SF3B4在制备用于肾透明细胞癌的诊断、预测或预后的试剂中的用途。
本发明提供一种检测SF3B4的试剂,用于诊断肾透明细胞癌的进展或评价肾透明细胞癌恶化程度和预计后的基因标志物,并用于在制备试剂盒。
本发明提供一种检测SF3B4的试剂盒,其中含有检测SF3B4的试剂,所述试剂包括特异性引物和特异性抗体等。
其中,所述特异性引物包括:SF3B4-forward:GGGAAGCCAATACGGGTGAA;SF3B4-reward:AAGCCCAGACCCCAATGATG;内参引物GAPDH-forward:AATGGGCAGCCGTTA GGAAA;GAPDH-reward:GCGCCCAATACGACCAAATC。
在本发明中,SF3B4基因在肾透明细胞癌组织中水平显著高于癌旁或正常组织,SF3B4基因的表达水平与肾透明细胞癌grade、stage、N stage及M stage分级呈正相关关系。
本发明提供一种采用实时定量PCR方法检测SF3B4基因的mRNA在肾透明细胞癌组织及相应的正常组织中的表达,,判断肾透明细胞癌样本的方法。
其中,所述方法包括(1)取肾组织,并提取它们的RNA;(2)对这些组织RNA进行逆转录,得到组织的cDNA;(3)以上述cDNA为模板,及上述引物进行实时量PCR反应,测定SF3B4基因的表达。
上述方法中,实时量PCR反应的条件为:55℃1分钟,95℃2分钟,1个循环;95℃15秒,55℃30秒,72℃30秒,40个循环。
上述方法中,肾组织SF3B4基因在PCR反应的结果利用2
本发明提供一种判断肾透明细胞癌样本的方法,含有如下步骤:
总RNA的提取(利用Total mRNA Extract kit(Omiga)提取及参照操作手册进行)
将50mg的-80℃保存的肾癌及相应的癌旁组织加入1mL裂解液,使用研磨器充裂解组织,向组织裂解液中加入200μL的氯仿,剧烈震荡15s后,冰上静置10分钟,待溶液出现明显的分层后,放入4℃离心机12,000g离心15min,这时溶液便分为三层,使用移液枪小心转移上层水相到一个新的无RNA酶EP管中,并加入1/3倍体积的无水乙醇,用枪充分吹打混匀,将混合液体转移到HiBind RNA离心柱中,室温10,000g离心1min,将流出液弃掉,将离心柱放置于新的收集管中,并加入300μL的RNA洗杂缓冲液Ⅰ,10,000g离心1min,将流出液弃掉,在离心柱中再次加入400μL RNA洗杂缓冲液Ⅰ,10,000g离心1min,将流出液弃掉,在离心柱中加入500μL用无水乙醇稀释的RNA洗杂缓冲液Ⅱ,10,000g离心1min,将流出液弃掉,再次在离心柱中加入500μL用无水乙醇稀释的RNA洗杂缓冲液Ⅱ,10,000g离心1min,将流出液弃掉,将离心柱放置在空的收集管中,13,000g离心2min,将残余液体充分除去,将离心柱置于新的1.5mL无RNA酶离心管中,在离心柱中加入50μL DEPC水,室温静置2min,13,000g离心1min,重新将离心出的液体吸回离心柱中,重复离心一次,最后收集的洗脱液即为提取的RNA,放置在-80℃保存,取2μL提取的RNA溶液,进行1%琼脂糖凝胶电泳,在紫外灯下观察RNA完整性,28S、18S条带完整、清晰,5S条带几乎看不见,并且28S亮度是18S的2倍,表明RNA提取完整没有降解,使用核酸定量仪对所提取的RNA进行检测,可以得到RNA浓度和总量,并且OD260/280比值在1.8~2.0范围内,表明所得的RNA纯度比较高,可以进行后续实验,
按照ThermoFisher逆转录试剂盒使用说明将反应体系混合,各组分配制如下:
将上述反应体系放到PCR仪中,65℃,5min后,立即从PCR仪中拿出放置冰上,再加入以下试剂:
将上述反应体系放到PCR仪中,按照如下条件进行逆转录反应:
实时定量荧光PCR(Real-time quantitative PCR)将上一步反转录所得的cDNA(即由总RNA中mRNA反转录所得到的)按照1:5稀释,并按照如下比例配制反应的体系:
离心混匀后,按照以下反应条件,进行实时定量PCR反应:
相对定量法采用比较Ct法,GAPDH作为内参,采用ΔΔCt(Ct目的-Ct内参)法进行相对定量分析,用2
本发明提供一种采用Western blot检测SF3B4蛋白质在肾透明细胞癌患者肿瘤组织或正常肾组织中的表达量的方法。
其中,上述方法需要使用试剂盒,所述试剂盒是将SF3B4蛋白作为分子标记,包含有SF3B4特异抗体(abcam,ab157117)、SDS-PAGE、电泳缓冲液、蛋白质Marker、聚偏二氟乙烯(PVDF)膜(Millipore),脱脂奶粉,HRP标记的二抗(1:10000,Rockland)、膜用Immo bilon
本发明提供一种判断肾透明细胞癌样本的方法,其特征在于使用上述试剂盒,并将肾组织SF3B4蛋白质在Western blot的结果利用灰度值扫描进行分析,肿瘤组织中SF3B4的蛋白质表达与正常肾组织中SF3B4蛋白质表达量进行对比,当样本中SF3B4蛋白质表达量高于正常组织中SF3B4蛋白质表达量时,该样本为肾透明细胞癌样本。
本发明提供一种判断肾透明细胞癌样本的方法,其特征在于含有如下步骤:
(1)组织总蛋白的提取及处理:
利用研磨器将50mg-80℃保存的癌和癌旁组织在RIPA裂解液下充分裂解,然后4℃,8000rpm离心10min,收集上清,上清即为总蛋白的提取液,取少量总蛋白提取液,以牛血清白蛋白为标准物,采用改良Bradford法进行蛋白定量,其余样品置于-20℃冰箱保存,用于Western Blot分析的蛋白,各组均取等质量的蛋白提取液,用RIPA裂解液补齐体积,与5×loading buffer(0.1mM Tris-HCl,pH 6.8,20%甘油,0.1%溴酚蓝,10%β-巯基乙醇,4%SDS)混合均匀,沸水浴5min使蛋白变性,12000g离心5min,4℃保存,
(2)Western Blot分析:
取上述等量各组蛋白质样品及marker分别加入凝胶的上样孔内,电泳至溴酚蓝前缘移动到距离凝胶底部约0.5cm处停止,SDS-PAGE电泳完毕后,取出PAGE将蛋白转到PVDF膜,转膜完毕取出PVDF膜,置于含5%脱脂奶粉的TTBS(10mM Tris-HCl,pH 8.0,150mMNaCl,0.05%Tween-20)中,于37℃封闭2h,将封闭后的PVDF膜进行一抗在4℃孵育过夜,次日用化学发光二抗室温下反应2h,取出PVDF膜放入盛有适量TTBS的平皿中剧烈晃动洗膜,最后利用化学发光仪自动曝光,检测抗体特异结合条带,然后灰度值扫描,所得的结果中,肿瘤组织中SF3B4表达的数值比上癌旁组织中表达的数值大于1且有统计意义(t检验,p>0.05),证明SF3B4在肾癌细胞中高表达。
本发明提供一种采用免疫组化技术检测SF3B4蛋白质在肾透明细胞癌患者肿瘤组织或正常肾组织中的表达量,判断肾透明细胞癌患者预后的方法,其中采用SF3B4特异抗体(abca m,ab157117)进行免疫组织化学染色。
其中,上述方法需要使用试剂盒,所述试剂盒是将SF3B4蛋白作为分子标记,利用SF3B4特异抗体(abcam,ab157117),以及免疫组化试剂,分析SF3B4蛋白在肾透明细胞癌患者肿瘤组织中的表达量,预测肾透明细胞癌患者的预后。
其中,所述的免疫组化学染试剂包括二甲苯类似物,乙醇,3%H
SF3B4蛋白质表达高的肾透明细胞癌患者预后较差,SF3B4蛋白低表达的肾透明细胞癌患者预后较好。根据上述方法检测肾透明细胞癌组织中SF3B4表达情况,进行评分,Hscore低于100分为低表达,H-score等于或高于100分为高表达,肾透明细胞癌组织中SF3B4高表达的肾透明细胞癌患者预后较差。
本发明提供一种判断肾透明细胞癌患者预后的方法,其特征在于含有如下步骤:
(1)组织切片经二甲苯脱蜡后置于梯度酒精中脱水至水化:(切片经二甲苯Ⅰ5min;二甲苯Ⅱ5min;无水酒精Ⅰ30s;无水酒精Ⅱ30s;95%酒精Ⅰ30s;95%酒精Ⅱ30s;90%酒精30s;80%酒精30s;70%酒精30s;自来水洗)(2)3%H
采用H-score评分方法,即高倍镜下综合染色强度和阳性细胞比例进行半定量分析,具体评分标准如下:
(1)染色强度评分标准:阴性0分,弱阳性1分,中等阳性2分,强阳性3分,
(2)阳性细胞所占比例评分标准:分别评估弱阳性、中等阳性、强阳性细胞的百分比,
(3)染色强度评分与对应评分的阳性细胞百分比相乘,得出H-score评分,范围0-300分,H-SCORE=∑(PI×I)=(强度较弱的细胞百分比×1)+(中等强度细胞百分比×2)+(高强度细胞百分比×3),式中pi表示阳性细胞数量占切片中所有细胞数量的百分数;i代表着色强度,
以上评分超过150为高表达强阳性,患者预后不良。
本发明的优点在于:
1.本发明研究发现,剪接因子SF3B4基因的表达通常在肾透明细胞癌组织中上调,为预测肾透明细胞癌患者预后提供了全新的生物标志物,SF3B4基因高表达的肾透明细胞癌患者不良预后有关。
2.本发明利用实时定量PCR、Western blot、免疫组化技术结合H-scoee评分测定肾透明细胞癌组织中SF3B4基因的表达量,并结合术后随访信息,确定SF3B4蛋白表达量与肾透明细胞癌患者的生存时间存在相关性,SF3B4蛋白能用于判断肾透明细胞癌患者预后的生物标志物。对于肾透明细胞癌患者,可以利用穿刺或手术后获得肾透明细胞癌组织进行SF3B4表达水平的检测,从而评估患者的预后。
3.本发明中本试剂盒中检测的肾透明细胞癌组织中SF3B4基因的表达,SF3B4作为一种肾透明细胞癌生物标志物及其检测方法,为肾透明细胞癌的诊断、进展、预后与免疫治疗方案提供参考数据。本发明提供的基因标志物SF3B4在肾透明细胞癌中具有特异性,可以作为新型标志物用于肾透明细胞癌预后评价。
本发明的创新点在于:
1.SF3B4在不同环境和不同癌细胞中发挥不同的功能作用,大量研究表明SF3B4在细胞生长中的重要作用以及精细调节的SF3B4水平对调节肿瘤细胞稳定的重要性。然而目前尚无SF3B4在肾透明细胞癌中相关的研究报道,SF3B4在肾透明细胞癌发生发展中的分子机制仍不清楚。并且目前还未见剪接因子SF3B4在制备肾透明细胞癌诊断或预测肾透明细胞癌患者预后的应用的研究报道。
2.本发明研究发现,剪接因子SF3B4基因的表达通常在肾透明细胞癌组织中上调,为预测肾透明细胞癌患者预后提供了全新的生物标志物,SF3B4基因高表达的肾透明细胞癌患者不良预后有关。
3.本发明利用实时定量PCR、Western blot、免疫组化技术、显微镜拍照和H-scoee评分半定量测定肾透明细胞癌组织中SF3B4基因的表达量,并结合术后随访信息,确定SF3B4蛋白表达量与肾透明细胞癌患者的生存时间存在相关性,SF3B4蛋白能用于判断肾透明细胞癌患者预后的生物标志物。对于肾透明细胞癌患者,可以利用穿刺或手术后获得肾透明细胞癌组织进行SF3B4表达水平的检测,从而评估患者的预后。
4.本发明中本试剂盒中检测的肾透明细胞癌组织中SF3B4基因的表达,SF3B4作为一种肾透明细胞癌生物标志物及其检测方法,为肾透明细胞癌的诊断、进展、预后与免疫治疗方案提供参考数据。本发明提供的基因标志物SF3B4在肾透明细胞癌中具有特异性,可以作为新型标志物用于肾透明细胞癌预后评价。
5.本发明同时从基因转录,蛋白质表达及组织原位表达等三个方面检剪接因子SF3B4基因的表达,多维度、多手段、不同实验技术检测基因的表达,确保的SF3B4基因在肾透明细胞癌中的表达。
附图说明
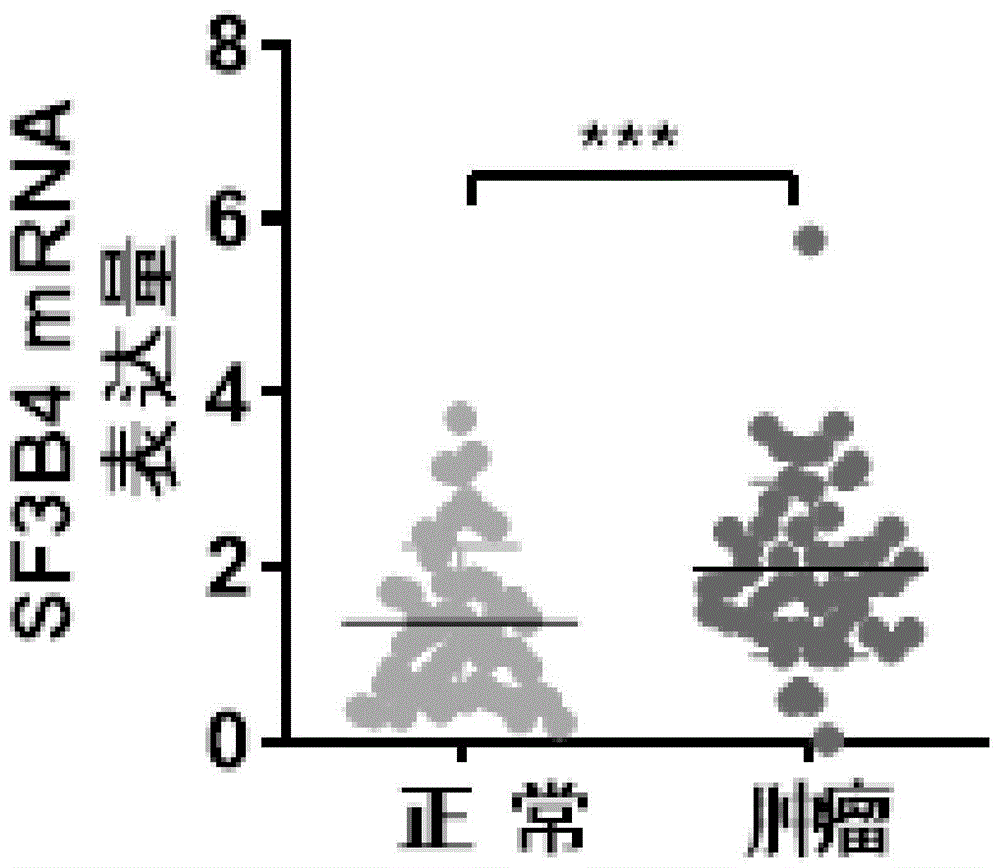
图1 RT-qPCR检测在临床样本中SF3B4的mRNA表达。***表示正常组织和肿瘤组织中该基因表达差异具有显著差异。
图2蛋白质印迹检测Western Blot在临床样本中SF3B4蛋白质表达。T表示肿瘤组织表达,N表示正常组织。
图3免疫组织化学染色检查了临床样本中的SF3B4表达。上排两个小图为放大200X的图,下面一排两个小图为选取局部再放大的的图。
图4正常组织及肿瘤组织进行H-score统计评分,该肿瘤组织的H-score评分为188,超过150,为高表达强阳性,预示着患者预后不良。**表示正常组织和肿瘤组织中该基因表达差异具有显著差异
具体实施方式
下面结合具体实施例来进一步描述本发明,以便更明确的阐述其优点和特点。但实施例仅为范例,并不对本发明的范围构成任何限制。本领域技术人员在不偏离本发明的精神和范围下可对本发明的技术方案细节和形式进行修改或替换,但均属本发明的保护范。
收集新鲜的肾癌及相应的癌旁或正常组织,并进行不同的处理:(1)收集手术过程得到的肾癌及相应的癌旁组织,分别进行液氮急冻处理,然后转移到-80℃冰箱保存,用于后续的实时定量PCR及Western blot分析;(2)收集活检穿刺获得新鲜的肾癌及相应的癌旁组织用4%的多聚甲醛固定,为后续的免疫组织化学染色分析。
1、实时定量PCR检测:
总RNA的提取(利用Total mRNA Extract kit(Omiga)提取及参照操作手册进行)
将50mg的-80℃保存的肾癌及相应的癌旁组织加入1mL裂解液,使用研磨器充裂解组织。向组织裂解液中加入200μL的氯仿,剧烈震荡15s后,冰上静置10分钟。待溶液出现明显的分层后,放入4℃离心机12,000g离心15min,这时溶液便分为三层。使用移液枪小心转移上层水相到一个新的无RNA酶EP管中,并加入1/3倍体积的无水乙醇,用枪充分吹打混匀。将混合液体转移到HiBind RNA离心柱中,室温10,000g离心1min,将流出液弃掉。将离心柱放置于新的收集管中,并加入300μL的RNA洗杂缓冲液Ⅰ,10,000g离心1min,将流出液弃掉。在离心柱中再次加入400μL RNA洗杂缓冲液Ⅰ,10,000g离心1min,将流出液弃掉。在离心柱中加入500μL用无水乙醇稀释的RNA洗杂缓冲液Ⅱ,10,000g离心1min,将流出液弃掉。再次在离心柱中加入500μL用无水乙醇稀释的RNA洗杂缓冲液Ⅱ,10,000g离心1min,将流出液弃掉。将离心柱放置在空的收集管中,13,000g离心2min,将残余液体充分除去。将离心柱置于新的1.5mL无RNA酶离心管中,在离心柱中加入50μL DEPC水,室温静置2min,13,000g离心1min,重新将离心出的液体吸回离心柱中,重复离心一次,最后收集的洗脱液即为提取的RNA,放置在-80℃保存。取2μL提取的RNA溶液,进行1%琼脂糖凝胶电泳,在紫外灯下观察RNA完整性,28S、18S条带完整、清晰,5S条带几乎看不见,并且28S亮度是18S的2倍,表明RNA提取完整没有降解。使用核酸定量仪对所提取的RNA进行检测,可以得到RNA浓度和总量,并且OD260/280比值在1.8~2.0范围内,表明所得的RNA纯度比较高,可以进行后续实验。
按照ThermoFisher逆转录试剂盒使用说明将反应体系混合,各组分配制如下:
将上述反应体系放到PCR仪中。65℃,5min后,立即从PCR仪中拿出放置冰上,再加入以下试剂:
将上述反应体系放到PCR仪中,按照如下条件进行逆转录反应:
实时定量荧光PCR(Real-time quantitative PCR)将上一步反转录所得的cDNA(即由总RNA中mRNA反转录所得到的)按照1:5稀释,并按照如下比例配制反应的体系:
离心混匀后,按照以下反应条件,进行实时定量PCR反应:
相对定量法采用比较Ct法,GAPDH作为内参,采用ΔΔCt(Ct目的-Ct内参)法进行相对定量分析,用2
表1 SF3B4的表达与临床病理特征关系
2、Western Blot检测SF3B4在组织中的表达
组织总蛋白的提取及处理
利用研磨器将50mg-80℃保存的癌和癌旁组织在RIPA裂解液下充分裂解。然后4℃,8000rpm离心10min,收集上清,上清即为总蛋白的提取液。取少量总蛋白提取液,以牛血清白蛋白为标准物,采用改良Bradford法进行蛋白定量,其余样品置于-20℃冰箱保存。用于Western Blot分析的蛋白,各组均取等质量的蛋白提取液,用RIPA裂解液补齐体积,与5×loading buffer(0.1mM Tris-HCl,pH 6.8,20%甘油,0.1%溴酚蓝,10%β-巯基乙醇,4%SDS)混合均匀,沸水浴5min使蛋白变性,12000g离心5min,4℃保存。
Western Blot分析
取上述等量各组蛋白质样品及marker分别加入凝胶的上样孔内,电泳至溴酚蓝前缘移动到距离凝胶底部约0.5cm处停止。SDS-PAGE电泳完毕后,取出PAGE将蛋白转到PVDF膜。转膜完毕取出PVDF膜,置于含5%脱脂奶粉的TTBS(10mM Tris-HCl,pH 8.0,150mMNaCl,0.05%Tween-20)中,于37℃封闭2h。将封闭后的PVDF膜进行一抗在4℃孵育过夜。次日用化学发光二抗室温下反应2h。取出PVDF膜放入盛有适量TTBS的平皿中剧烈晃动洗膜。最后利用化学发光仪自动曝光,检测抗体特异结合条带。然后灰度值扫描,所得的结果中,肿瘤组织中SF3B4表达的数值比上癌旁组织中表达的数值大于1且有统计意义(t检验,p>0.05),证明SF3B4在肾癌细胞中高表达。
3、免疫组化检测SF3B4表达
免疫组化检测具体方案如下:
(1)组织切片经二甲苯脱蜡后置于梯度酒精中脱水至水化:(切片经二甲苯Ⅰ5min;二甲苯Ⅱ5min;无水酒精Ⅰ30s;无水酒精Ⅱ30s;95%酒精Ⅰ30s;95%酒精Ⅱ30s;90%酒精30s;80%酒精30s;70%酒精30s;自来水洗)(2)3%H
采用H-score评分方法,即高倍镜下综合染色强度和阳性细胞比例进行半定量分析,具体评分标准如下:
(1)染色强度评分标准:阴性0分,弱阳性1分,中等阳性2分,强阳性3分。
(2)阳性细胞所占比例评分标准:分别评估弱阳性、中等阳性、强阳性细胞的百分比。
(3)染色强度评分与对应评分的阳性细胞百分比相乘,得出H-score评分,范围0-300分。H-SCORE=∑(PI×I)=(强度较弱的细胞百分比×1)+(中等强度细胞百分比×2)+(高强度细胞百分比×3),式中pi表示阳性细胞数量占切片中所有细胞数量的百分数;i代表着色强度。
以上评分超过150为高表达强阳性,患者预后不良。参见图4。
上述实施例的说明只是用于理解本发明的方法及其核心思想。应当指出,对于本领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以对本发明进行若干改进和修饰,这些改进和修饰也将落入本发明权利要求的保护范围内。
- D-丝氨酸作为标志物在制备抑郁症诊断试剂盒中的应用及抑郁症诊断试剂盒
- 一组蛋白作为肿瘤标志物在制备恶性肿瘤诊断试剂和试剂盒中的用途
- 预测急性高山病发病风险的血浆蛋白标志物及其在制备诊断AMS易感性试剂盒中的应用
- 一种基因序列组合物及其在制备分枝杆菌肺病检测试剂盒中的应用
- miRNA在制备高级浆液性上皮性卵巢癌化疗耐药性评价试剂盒中的应用
- DAAM1蛋白在制备肾透明细胞癌诊断及预后评估试剂盒中的应用
- DAAM1蛋白在制备肾透明细胞癌诊断及预后评估试剂盒中的应用
