用于结直肠癌甲基化双位点检测的引物探针组合及其试剂盒
文献发布时间:2024-04-18 19:53:33
技术领域
本发明属于生物技术和DNA检测技术领域,涉及一种用于结直肠癌甲基化双位点检测的引物探针组合及其试剂盒。
背景技术
结直肠癌(Colorectal Cancer,CRC)是常见的恶性肿瘤之一,根据世界卫生组织国际癌症研究中心发布的2020年全球最新癌症数据,2020年结直肠癌在全球新发病例排名第三、死亡病例排名第二。2020年,我国新发癌症病例1929万例,其中结直肠癌新发病例数仅次于肺癌,达56万例,占比12.2%。
结直肠癌分期较为清晰,也是为数不多的可能通过筛查来预防的癌种之一。结直肠癌发病隐匿,周期较长,而且有明确的癌前阶段,从息肉发展为腺瘤通常需要10年左右。0到Ⅱ期是肠癌诊断的黄金阶段,无症状患者可以通过筛查发现癌前腺瘤,通过手术切除可以实现完全根治,早期(0/Ⅰ)结直肠癌患者的5年生存率可以达到90%以上;晚期确诊则需要通过手术治疗,效果差,复发风险高,晚期(IV期)结直肠癌患者的5年生存率不足10%。
但是我国对结直肠癌的筛查结果并不理想。根据《中国结直肠癌早诊早治专家共识(2020)》,中国各个地区和医院诊治水平参差不齐,总体诊断的早期结直肠癌患者占比约20-30%,大部分患者诊断时已是中晚期。
除整体筛查意识薄弱外,缺乏有效筛查方法也是造成筛查人口渗透率低的原因之一。作为金标准的肠镜检查能力低,患者依从性低,筛查率不足。便潜血检测(FOBT)和粪便免疫化学法(FIT)等方法的灵敏度低,对进展期息肉的灵敏度仅为20~25%。
近些年,大量新技术为普及肠癌早筛提供了新的非侵入的方法。主要包括血液和粪便DNA检测。其中血液检测具有很大的局限性,早期肠道病变组织向外增生,病变细胞很难进入血液中,虽然Septin9甲基化检测在2014年版的《中国早期结直肠癌筛查及内镜诊治指南(2014)》被推荐作为筛查手段之一,但是检测灵敏度不理想。粪便检测的灵敏度和特异性都显著高于传统方法,目前看是最为理想的检测方法。
与结直肠癌发病相关的甲基化位点是粪便检测的重要依据。目前已上市的产品使用的位点包括KRAS、SDC2、SRFP2等基因,虽然总体特异性和灵敏度已经高于传统方法,但是单个位点的检测假阴性率较高,容易漏检,位点联合检出可以在保证特异度的同时,提高检测灵敏度。如CN 112553302 A专利所述SDC2位点在结直肠癌中的灵敏度为86.9%,特异性为95.9%,TFPI2位点的敏感度为90.3%,特异性为94.0%,联合检测效果未知。本发明提供了一个新的联合检测位点组合SDC2和LIFR,不仅各自检测效果好,而且在结直肠癌检测中两位点联合检测的灵敏度和特异性都较高。
多配体蛋白聚糖2(Syndecan-2,SDC2)基因位于人类8号染色体上,编码Syndecan-2蛋白。研究发现此蛋白可介导肠癌细胞的粘附等功能,与结直肠癌细胞增殖密切相关。研究证实,相对于正常结直肠组织,SDC2基因在不同分期的结直肠癌中呈现高水平的甲基化现象,提示其具有结直肠癌检测的临床价值。
白血病抑制因子受体(leukemia inhibitory factor receptor,LIFR)是近年来炎症相关因子研究的热点之一。LIFR在上世纪90年代首次报道,早期的研究主要集中在其在炎症反应中炎症因子的作用。随着人们重视炎症相关因子与肿瘤的发生发展的关系,LIFR开始重新进入人们的视线。LIFR是白血病抑制因子(leukemia inhibitory factor,LIF)的受体,与跨膜130kD糖蛋白(glycoprotein 130,gp130)高度同源,LIFR基因定位于人染色体5p12-p13。它的功能通过与gp130形成异源二聚体,介导由白细胞介素6(interleukin-6,IL-6)相关因子引起的信号,包括LIF、心肌营养素1(cardiotrophin-1,CT-1)、抑瘤素M(oncostatin M,OSM)和睫状神经营养因子(ciliary neurotrophicfactor,CNTF)。这些细胞因子的生物学作用差异很大,从维持干细胞多能性,保肝作用,葡萄糖的吸收,到调节细胞的增殖和分化。
粪便基质成分非常复杂,其中含有种类众多的细菌基因组DNA、植物来源DNA和动物来源DNA,肠道或其他消化道位置的脱落细胞含量相对较少,肠道脱落细胞DNA只占从粪便中回收到的总DNA的0.1%到0.01%,而人类DNA本身是高度异源的,肠道肿瘤细胞又只占肠道脱落细胞的1%,对于癌症早期的人体,还不到1%。
目前,肠道肿瘤细胞DNA的提取主要有2种方法:粪便样本总核酸提取和分子杂交捕获法。一方面,对于总核酸提取方法来说,粪便中含有多聚糖、胆盐、腐殖质、胆酸等PCR抑制物,如果从粪便中提取全部基因组,庞大的基因背景和PCR抑制物将非常不利于肿瘤脱落细胞DNA的检测;另一方面,现有分子杂交捕获技术操作繁杂,并且多数采用磁珠与探针先偶联的方法,再用该复合体去杂交捕获目的基因,该方法捕获效率低。
发明内容
为了解决结直肠癌筛查和诊断的关键问题——灵敏度高、特异性好,本发明公开了一种用于结直肠癌甲基化双位点检测的引物探针组合,为检测LIFR基因甲基化cg08392199位点的引物探针组合和检测SDC2基因甲基化cg13096260位点的引物探针组合;LIFR基因cg08392199位点和SDC2基因cg13096260位点的甲基化与结直肠癌存在相关性;
所述检测LIFR基因甲基化cg08392199位点的引物探针组合包括LIFR-F上游引物、LIFR-R下游引物和LIFR-P探针;所述LIFR-F上游引物、LIFR-R下游引物和LIFR-P探针为LIFR-F4、LIFR-R1和LIFR-P2;其中LIFR-F4的核苷酸序列如SEQ ID NO.4所示、LIFR-R4的核苷酸序列如SEQ ID NO.5所示、LIFR-P2的核苷酸序列如SEQ ID NO.6所示;
所述检测SDC2基因甲基化cg13096260位点的引物探针组合包括SDC2-F上游引物、SDC2-R下游引物和SDC2-P探针;所述SDC2-F上游引物、SDC2-R下游引物和SDC2-P探针为SDC2-F1、SDC2-R1和SDC2-P1;其中,SDC2-F1的核苷酸序列如SEQ ID NO.1所示、SDC2-R1的核苷酸序列如SEQ ID NO.2所示、SDC2-P1的核苷酸序列如SEQ ID NO.3所示。
另一方面,本发明公开了一种试剂盒,包括如上所述的用于结直肠癌甲基化双位点检测的引物探针组合。
在一些实施方案中,还包括阳性对照;所述阳性对照包括含有LIFR基因亚硫酸盐修饰后的甲基化位点核苷酸序列和SDC2基因亚硫酸盐修饰后的甲基化位点核苷酸序列的质粒,和/或结直肠癌细胞株;所述LIFR基因亚硫酸盐修饰后的甲基化位点核苷酸序列如SEQ ID NO.10所示;所述SDC2基因亚硫酸盐修饰后的甲基化位点核苷酸序列如SEQ IDNO.11所示。
在一些实施方案中,所述含有LIFR基因亚硫酸盐修饰后的甲基化位点核苷酸序列和SDC2基因亚硫酸盐修饰后的甲基化位点核苷酸序列的质粒的载体质粒选自pUC57、pUC57-Kan、pUC57-Simple、pUC57-mini、pUC18、pUC19。
在一些实施方案中,所述结直肠细胞株选自阳性细胞株SW48、HCT116、LoVo、SW480、SW620。阳性细胞株来源均为美国模式培养物集存库(ATCC)。
在一些实施方案中,还包括质控基因的引物对和质控基因的探针;所述质控基因为肌动蛋白(Actin)。
进一步地,所述质控基因为β肌动蛋白(β-actin)。所述质控基因的引物对为:质控基因正向引物和质控基因反向引物;所述质控基因正向引物的核苷酸序列如SEQ ID NO.7所示,所述质控基因反向引物的核苷酸序列如SEQ ID NO.8所示,所述质控基因的探针的核苷酸序列如SEQ ID NO.9所示。
在一些实施方案中,还包括阴性对照;所述阴性对照为正常人基因DNA。
在一些实施方案中,所述质控基因的探针的报告荧光基团、所述用于结直肠癌甲基化双位点检测的引物探针组合中的探针的报告荧光基团各自独立地选自自FAM、VIC、HEX、JOE、Cy3、ROX和Cy5中的一种;所述质控基因的探针的报告淬灭基团、所述用于结直肠癌甲基化双位点检测的引物探针组合中的探针的报告淬灭基团各自独立地选自BHQ1、BHQ2、BHQ3、TAMRA和MGB中的一种。
在一些实施方案中,还包括粪便DNA提取试剂、亚硫酸盐转化试剂、实时荧光PCR扩增反应试剂。
其中,所述粪便DNA提取试剂包括絮凝剂、洗涤液、杂交缓冲液和洗脱液;
所述亚硫酸盐转化试剂包括亚硫酸盐溶液、结合液、脱硫溶液、洗涤液和洗脱液;
所述实时荧光PCR扩增反应试剂包括聚合酶和扩增缓冲液。
在一些实施方案中,所述聚合酶为2×Premix Ex Taq(Probe qPCR);所述扩增缓冲液为50×RoxⅡ。2×Premix Ex Taq(Probe qPCR)含有dNTP。
在一些实施方案中,所述用于结直肠癌甲基化双位点检测的引物探针组合中每一引物对的各引物的终浓度均为100~300nM,各探针的终浓度均为100~200nM。
进一步,筛查结果以所述的用于结直肠癌甲基化双位点检测的引物探针组合进行qPCR的结果为判定标准:LIFR的Ct值>38,结果判定为cg08392199位点甲基化阴性;LIFR的Ct值≤38,结果判定为cg08392199位点甲基化阳性;SDC2的Ct值>38,结果判定为cg13096260位点甲基化阴性;SDC2的Ct值≤38,结果判定为cg13096260位点甲基化阳性;将cg08392199位点甲基化阳性和/或cg13096260位点甲基化阳性的检测样本,判定为联合检测甲基化阳性;将cg08392199位点甲基化阴性和cg13096260位点甲基化阴性的检测样本,判定为联合检测甲基化阴性;所述联合检测甲基化阳性对应的评价结果是结直肠癌阳性;所述联合检测甲基化阴性,对应的评价结果是结直肠癌阴性。
在一些实施方案中,所述结果判定标准还包括:质控基因的Ct≤36,表明DNA模板的上样量在允许范围内,结果可信;质控基因的Ct>36,表明DNA模板的上样量不在允许范围内,结果不可信。所述质控基因为肌动蛋白(Actin)。所述质控基因为β肌动蛋白(β-actin)。
在一些实施方案中,所述qPCR为实时荧光qPCR,其反应条件为:96℃预变性3分钟;15个循环:95℃变性15秒,70℃退火延伸20秒,64℃退火延伸20秒,72℃延伸10秒;35个循环,95℃变性15秒,70℃退火延伸20秒,60℃退火延伸34秒,72℃延伸10秒;并且35个循环在退火时,检测荧光信号。
在一些实施方案中,所述qPCR的扩增体系为:2×Premix Ex Taq(Probe qPCR)20μL、50×RoxⅡ0.8μL、各条引物终浓度0.2~0.3μM、探针终浓度0.2μM、DNA模板>10ng,用水补足至40μL。
本发明的试剂盒检测样本为患者粪便,取样方便、对患者无创,采用分子杂交捕获的方法,利用探针特异性地捕获目标基因,同时起到了纯化和富集DNA的目的,提高了DNA提取率和纯度。
荧光PCR检测技术,只需要一个PCR管即可完成检测,两位点联合检测具有高灵敏度和特异性的优点,结果直观反应PCR过程中的变化,并对整个检测过程进行了优化,检测速度快,步骤简单,与现有方法比较,敏感度好,特异性更具有明显优势,更适合用于结直肠癌早筛。
本发明与现有技术相比,具有如下的优点和有益效果:
1、本发明首次采用SDC2和LIFR两位点联合检测,具有创新性,在结直肠癌检测中两位点联合检测的灵敏度达到了92%,特异性高达100%,提供一个高灵敏度同时具备高特异性的结直肠癌早筛引物探针组合以及试剂盒。
2、本发明的试剂盒,用于粪便样本进行早期结直肠癌基因甲基化检测,其临床样本为患者粪便,取样方便、对患者无创。
3、采用多重荧光PCR检测技术,只需要一个PCR管即可完成检测,具有qPCR高灵敏度和特异性的优点,结果直观反应qPCR过程中的变化,操作简便,成本降低。
附图说明
以下将结合附图对本发明的构思、具体结构及产生的技术效果作进一步说明,以充分地了解本发明的目的、特征和效果。
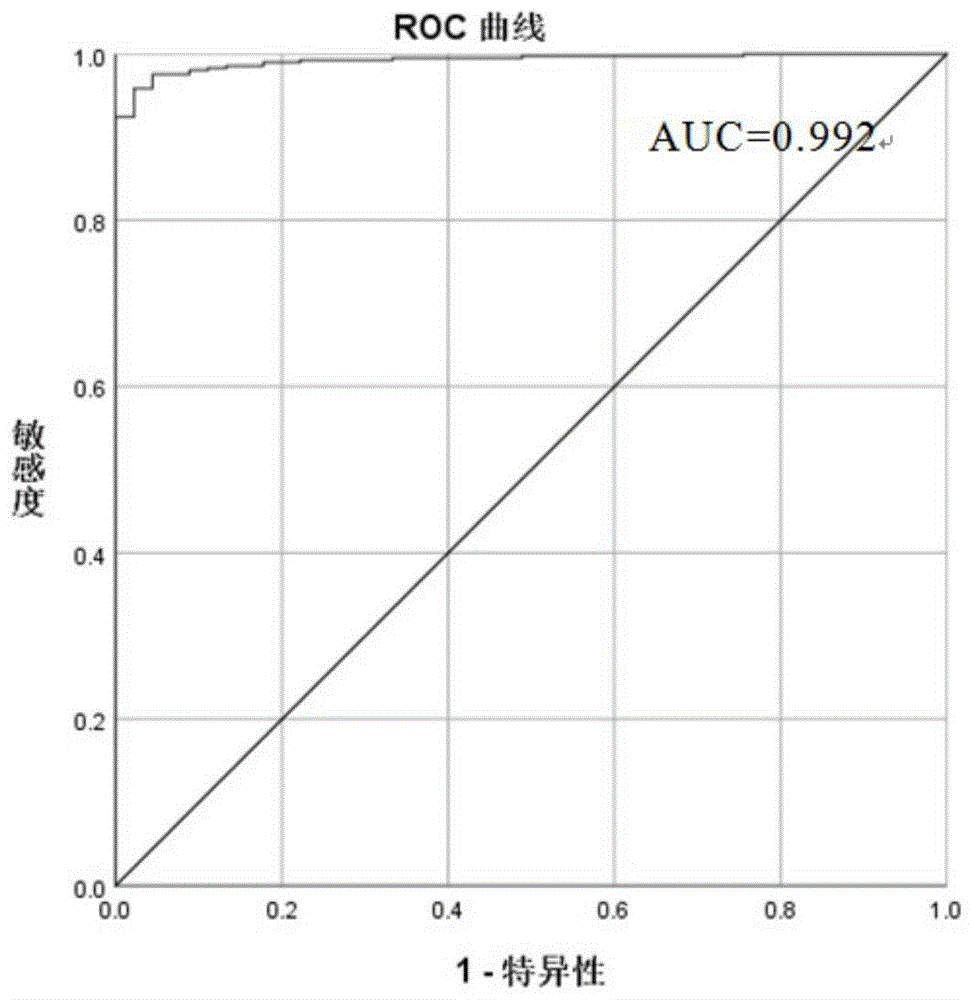
图1是cg12587766(LIFR)和cg13096260(SDC2)联合检测ROC曲线。
图2是cg08392199(LIFR)和cg25664438(SDC2)联合检测ROC曲线。
图3是cg13096260(SDC2)和cg08392199(LIFR)联合检测ROC曲线。
图4是cg04261408(SDC2)和cg12587766(LIFR)联合检测ROC曲线。
图5是LIFR位点在癌和癌旁组织中差异分析。其中,T表示癌组织;N表示癌旁组织。
图6是SDC2位点在癌和癌旁组织中差异分析。其中,T表示癌组织;N表示癌旁组织。
具体实施方式
为了使发明实现的技术手段、创造特征、达成目的和功效易于明白了解,下结合具体图示,进一步阐述本发明。但本发明不仅限于以下实施的案例。
须知,本说明书所附图式所绘示的结构、比例、大小等,均仅用以配合说明书所揭示的内容,以供熟悉此技术的人士了解与阅读,并非用以限定本发明可实施的限定条件,故不具技术上的实质意义,任何结构的修饰、比例关系的改变或大小的调整,在不影响本发明所能产生的功效及所能达成的目的下,均应仍落在本发明所揭示的技术内容得能涵盖的范围内。
实施例1位点筛选流程
本发明的重点和难点在于找到既可以保证筛查特异性又能提高检测灵敏度的两个位点,为了确定这种位点组合,在研发过程中利用数据库进行了33种肿瘤类型近13000例肿瘤的甲基化数,具体步骤为:
1.1选择癌症基因组图谱(The Cancer Genome Atlas,TCGA)数据库中结直肠癌数据库(Colorectal adenocarcinoma,COADREAD)的453例样本(408例肿瘤样本(tumor),45例正常样本(normal)),将485,578个位点进行维尔克松(Wilcoxon)秩和检验,设阈值条件:p值(p value)<0.01,β均值(meanβ)≥0.2,β差值(Δβ)≥0.2。满足阈值条件的位点19,862个。
1.2加入人群血液甲基化数据库(GSE40279和GSE41169)的样本数据(751例正常样本(normal))做差异分析,保留甲基化差异值大于25%的位点,即15,404个位点。
1.3按照β差值(Δβ)≥0.5、β差值(Δβ)≥0.3、β差值(Δβ)≥0.2降序排列,在453例TCGA数据库样本数据中,筛选出与重点关注基因相关的甲基化程度高的CpG位点(胞嘧啶-磷酸-鸟嘌呤位点,即DNA序列中胞嘧啶后紧连鸟嘌呤的位点)。脊椎动物的DNA甲基化一般发生在CpG位点。
1.4将步骤1.3筛选出的16个位点,进行两两组合,按照β差值(Δβ)≥0.3降序排列,优选出组合频率大于95%的4个组合(见表1),并使用癌症基因组图谱数据库中数据做这4个组合的ROC曲线图(见图1、图2、图3和图4),其结果与表1一致,进一步进行细胞、组织和粪便样本检测,从中优选出高灵敏度高特异性的位点组合。表1中的4个组合的筛选见实施例2和对比例1,最后筛选出最优组合——表1中的组合3(LIFR基因的cg08392199位点和SDC2基因的cg13096260位点)进行后续研究。
表1降序排列后组合频率大于95%的组合
实施例2引物探针设计及筛选
本发明分别以构建的含有LIFR和SDC2基因亚硫酸盐修饰后的甲基化位点核苷酸序列的质粒和阳性细胞株SW48的DNA为模板,构建LIFR和SDC2基因甲基化实时荧光qPCR检测体系,以VIC和FAM为荧光信号检测对象,通过LIFR和SDC2基因甲基化引物的优化组合以及荧光探针优化检测体系,从而实现快速准确检测。具体步骤如下:
其中,所述质粒为人工设计好目的基因序列片段,交金斯瑞公司插入到分子克隆载体质粒上,得到的合成质粒,以下简称合成质粒。该目的基因序列包括LIFR基因亚硫酸盐修饰后的甲基化位点核苷酸序列和SDC2基因亚硫酸盐修饰后的甲基化位点核苷酸序列。
LIFR基因亚硫酸盐修饰后的甲基化位点核苷酸序列(SEQ ID NO.10,LIFR-S-L(cg08392199)含有cg08392199位点):
LIFR-S-L(cg08392199):
GCGGAGTAGGGGAGTCGCGGAGTTTCGAGCGGGGTTTTTAGGGGCGGTTCGGGCGGGGTGGGGTAGCGTTTTTAGTTTTGCGGAGCGTTTTAGGGGAGTGATTTCGGAGAGCGTCGTTTCGGGTTTCGTCGTTTTTCGCGCGTTTTTGGGTTATTTTCGTGTTTTGGGGGACGCGGATTTTAGCGTTTAGAATTTTTGTTTTACGTAGGGTAGTGAGTTTTGAGGTTAGAGGTTATTTGGGGGATGGGAGGGAGTTTGAAATGTTTTTTTTTCGGAGAGGTGATTTGTTAGGTGATTTCGTGTTTTTTTGTTTTAATTTTTTTTTA
SDC2基因亚硫酸盐修饰后的甲基化位点核苷酸序列(SEQ ID NO.11,SDC2-S-L(cg13096260)含有cg13096260位点):
SDC2-S-L(cg13096260):
TAATTTTTATGAATTGGCGATTTATGAATATTTTATATTGTTTGAAAGTATTTTATATTTTTTTTTTTTTTTAATTTATAAAGTAGTTTTTTTTTATTGGTCGAATTTTTAAGGTAGAAAAGTTATATACGTTTTTCGTTTTTTTATTAATTGTTTTTTAGAAAAGGGAAAGTGAAGAAGGGAAAGAGAAAAGATAACGGGGAAGAAAAGAGTATAGAGGAGAGAGGAAAAGTGGGGAGAGAAAGGAAGAAAAGGATTGAGAAAACGTAGGAGTTTTGGTTTGTCGGTGAGTAGAGTCGGCGTAGTTATAGCGCGGAGTCGCGGCGTTTATTGGTTTTCGGAGTTGTTAATCGGCGTGTAATTTTGTAGGAATTTTTTTCGGGTTTATTTGGGAGTTATATTGTCGTTTTTTTTTTTTAGTCGTTTAGGGGAGTTCGGAGAAGTAGGTTTAGGAGGGAGGGAGTTAGAGGAAAAGAAGAGGAGGAGAAGGAGGAGGATTCGGGGAGGGAGGCGCGGCGCGGGAGGAGGAGGGGCGTAGTCGCGGAGTTAGTGGTTTCGTTTGGACGCGTTGTTTTTTAGATATTTTCGGAGTTTTAGTCGCG
分子克隆载体质粒使用pUC57。
阳性细胞株SW48来源为美国模式培养物集存库(ATCC)。
1.针对LIFR基因和SDC2基因甲基化的检测,使用Primer 5软件分别设计了26组引物探针组合。针对阳性细胞株、组织或粪便(比如实施例2、3、4和对比例1),均以肌动蛋白(Actin)作为质控基因(或者称为内参基因),其中,引物Actin-F和Actin-R作为质控基因引物,探针Actin-P作为质控基因探针,进行质控。常用的肌动蛋白一般有β肌动蛋白(β-actin,ACTB),但不限于β-actin,也可以是α肌动蛋白、γ肌动蛋白等。本实施例以ACTB为质控基因为例进行说明。
质控基因正向引物(ACTB-F):5’-GGTGTTTAAGATAGTGTTGTGGGTG-3’(SEQ ID NO.7)
质控基因反向引物(ACTB-R):5’-CACACTCCAAAACCGCTTTACA-3’(SEQ ID NO.8)
质控基因的探针(ACTB-P)为:5’-ACCTCATAACCTTATCACAC-3’(SEQ ID NO.9)
2.以2×10
2×Premix Ex Taq(Probe qPCR)20μL、RoxⅡ(50×)0.8μL、各条引物终浓度0.2~0.3μM、探针终浓度0.2μM、DNA模板,用水补足至40μL。
其中,所述实时荧光qPCR扩增中使用的2×Premix Ex Taq(Probe qPCR)和RoxⅡ(50×)来自TAKARA公司。
实时荧光qPCR反应条件为:
96℃预变性3分钟;15个循环:95℃变性15秒,70℃退火延伸20秒,64℃退火延伸20秒,72℃延伸10秒;35个循环,95℃变性15秒,70℃退火延伸20秒,60℃退火延伸34秒,72℃延伸10秒;并且35个循环在退火时,检测荧光信号。
引物探针组合及检测结果见表2。优选1套SDC2的引物探针组合(组合1)和1套LIFR的引物探针组合(组合26)在阳性细胞株中进行第二轮探针引物筛选。
表2引物探针组
/>
3.以10ng阳性细胞株SW48的DNA作为模板,使用上一步骤中优选的LIFR的引物探针组合和SDC2的引物探针组合进行qPCR扩增,qPCR体系和反应条件与上一步骤相同。
引物探针组合及检测结果见表3,LIFR的组合26(LIFR-F4、LIFR-R4和LIFR-P2)在结直肠癌阳性细胞系中呈高度甲基化,并且该引物探针组合扩增曲线呈“S”型,荧光信号较强。SDC2的组合1(SDC2-F1、SDC2-R1和SDC2-P1)在结直肠癌阳性细胞系中呈高度甲基化,并且该引物探针组合扩增曲线呈“S”型,荧光信号较强。探针和引物序列如下:
LIFR的优选探针引物:
LIFR-F4:5’-TCGTTTCGGGTTTCGTCG-3’(SEQ ID NO.4)
LIFR-R4:5’-CTCTAACCTCAAAACTCACTACCCT-3’(SEQ ID NO.5)
LIFR-P2:
SDC2的优选探针引物:
SDC2-F1:5’-GAGAAAGGAAGAAAAGGATTGAGA-3’(SEQ ID NO.1)
SDC2-R1:5’-GATTAACAACTCCGAAAACCAATA-3’(SEQ ID NO.2)
SDC2-P1:5’-AGAGTCGGCGTAGTTAT-3’(SEQ ID NO.3)
表2中的其他序列如下:
LIFR-F1:5’-GGAGCGTTTTAGGGGAGTGATT-3’(SEQ ID NO.12)
LIFR-F2:5’-GGGGAGTGATTTCGGAGAGCGTCG-3’(SEQ ID NO.13)
LIFR-F3:5’-CGTGTTTTGGGGGACG-3’(SEQ ID NO.14)
LIFR-R1:5’-CCCCCAAATAACCTCTAACC-3’(SEQ ID NO.15)
LIFR-R2:5’-CATCCCCCAAATAACCTCTAACC-3’(SEQ ID NO.16)
LIFR-R3:5’-ACTCCCTCCCATCCCCC-3’(SEQ ID NO.17)
LIFR-P1:5’-CGGATTTTAGCGTTTAGAA-3’(SEQ ID NO.18)
SDC2-R2:5’-TCCTCTCTCCTCTATACTCTTTTCTTCC-3’(SEQ ID NO.19)
SDC2-R6:5’-CCCGTTATCTTTTCTCTTTCC-3’(SEQ ID NO.20)
SDC2-P2:5’-GAATTTTTAAGGTAGAAAAGTTATATACG-3’(SEQ ID NO.21)
SDC2-R7:5’-CCGTTATCTTTTCTCTTTCCCT-3’(SEQ ID NO.23)
SDC2-F2:5’-TAAAGTAGTTTTTTTTTATTGGTCGAA-3’(SEQ ID NO.22)
SDC2-F3:5’-ATGAATTGGCGATTTATGAA-3’(SEQ ID NO.24)
SDC2-R3:5’-CCCCGTTATCTTTTCTCTTT-3’(SEQ ID NO.25)
SDC2-R4:5’-TTCCCCGTTATCTTTTCTCT-3’(SEQ ID NO.26)
SDC2-R5:5’-TCTTCCCCGTTATCTTTTCT-3’(SEQ ID NO.27)
表3阳性细胞株中筛选的探针和引物组合及筛选结果
4.灵敏度分析:将质粒模板从10000个拷贝开始稀释,直至稀释至5个拷贝,然后分别对其进行检测,结果表明本发明的荧光PCR方法灵敏度高,引物检测对应质粒样本,5拷贝/40微升即可检出(如表4所示)。
表4质粒梯度稀释结果
实施例3组织和粪便样本检测
1.以组织为样本
选择手术或肠镜切除的结直肠癌和癌旁组织标本,并定量检测SDC2和LIFR基因的甲基化水平。标本为16对结直肠癌和癌旁配对的组织。利用本发明中优选的引物探针组合和实时荧光qPCR反应体系对癌组织和与其配对的癌旁组织样本进行检测。
步骤1,样本处理、DNA提取和转化:
采用细胞DNA提取试剂盒(购自QIAGEN)提取组织细胞的DNA,具体操作参考试剂盒说明书。
步骤2,亚硫酸盐修饰:
采用EZ DNA甲基化试剂盒(EZ DNA methylation Kit,购自ZYMO RESEARCH)对提取的细胞DNA进行亚硫酸盐修饰,具体操作参考试剂盒说明书。
步骤3,按照如下扩增体系进行qPCR扩增(总体积40μL)
2×Premix Ex Taq(Probe qPCR)20μL、RoxⅡ(50×)0.8μL、各条引物终浓度0.2~0.3μM、探针终浓度0.2μM、DNA模板>10ng,用水补足至40μL。以步骤2获得的经过亚硫酸盐修饰后的细胞DNA为模板。
qPCR扩增中的2×Premix Ex Taq(Probe qPCR)和RoxⅡ(50×)来自TAKARA公司。
实时荧光qPCR反应条件为:
96℃预变性3分钟;15个循环:95℃变性15秒,70℃退火延伸20秒,64℃退火延伸20秒,72℃延伸10秒;35个循环,95℃变性15秒,70℃退火延伸20秒,60℃退火延伸34秒,72℃延伸10秒;并且35个循环在退火时,检测荧光信号。
步骤4,检测荧光信号,根据Ct值作为结果判断的标准。
以内参基因(肌动蛋白)荧光信号达到设定的阈值时所需要的循环次数Ct≤36,则表明上样DNA量在允许范围内,结果可信;如果内参基因(肌动蛋白)荧光信号达到设定的阈值时所需要的循环次数CT值>36,视为无效样本。在检测有效情况下,若SDC2基因的CT值≤38或LIFR基因的CT值≤38,则样本的测试结果为“阳性”;若SDC2基因的CT值>38和LIFR基因的CT值>38,则样本的测试结果为“阴性”。
结果显示(表5):本发明组织样本的位点单独检测的灵敏度均为100%,联合检测结果灵敏度为100%。癌组织(T)和癌旁组织(N)检出Ct值做差异分析,如图5和图6所示,SDC2位点和LIFR位点均在癌组织(T)和癌旁组织(N)中具有显著差异。
表5组织样本检测结果
2.以粪便为样本
选择114例粪便标本,其中经肠镜检查59例为肠癌、26例进展期腺瘤、29例为正常,定量检测SDC2和LIFR基因的甲基化水平。利用本发明优选的引物探针组合和qPCR反应体系对59例临床结直肠癌病人粪便样本、26例进展期腺瘤病人粪便样本和29例健康人粪便样本进行检测,样本信息见表6-8。
表6结直肠癌粪便样本临床诊断信息
/>
/>
表7进展期腺瘤粪便样本临床诊断信息
表8结直肠癌粪便样本临床诊断信息
/>
实验过程:
步骤1,分子杂交捕获。
1.1核酸粗提
1、收集粪便样本1g于4mL粪便保存液(ZYMO RESEARCH,R1101)中,震荡混匀后,5000rpm离心10min,取上清,再进行一次离心操作。
2、取1mL处理后粪便上清,向管中加入裂解液,漩涡混匀,70℃保温10min。
3、加入絮凝剂,置冰上5min,漩涡混匀。
5、15 000g离心3min,转移上清到离心管中,加入0.6倍上清体积的异丙醇,上下颠倒混匀。
6、15 000g离心5min回收基因组DNA沉淀。
7、加入123μL纯化水溶解DNA
1.2杂交捕获
1、取上步溶解的DNA溶液于PCR管中,加入探针、杂交缓冲液和水。
2、按照如下参数设置PCR程序:
①98℃5min;
②65℃1hour;
③65℃Hold(保温)。
1.3纯化回收
1、取出链霉亲和素磁珠,置于磁力架,吸弃上清。
2、加入清洗液,漩涡震荡,置于磁力架,小心吸弃上清。
3、加入结合液,将1.2步骤中的溶液加入含有结合液的磁珠中,置于旋转混匀仪上室温旋转30min。
4、旋转孵育结束后,加入漂洗液WB1,置于磁力架,小心吸弃上清。
5、加入漂洗液WB2,置于磁力架,小心吸弃上清。
6、加入80%乙醇,置于磁力架,小心吸弃上清。
7、打开管盖,室温静置5分钟,使剩余的酒精完全挥发干净,将离心管从磁力架上取下,向离心管中加入45μL纯化水,涡旋混匀使磁珠完全分散,所得溶液可用于后续亚硫酸盐转化。
步骤2,对上述提取的DNA样本进行亚硫酸盐转化(EZ DNAmethylation Kit,购自ZYMO RESEARCH)。
步骤3,按照如下扩增体系进行qPCR扩增(总体积40μL)。
2×Premix Ex Taq(Probe qPCR)20μL、RoxⅡ(50×)0.8μL、各条引物终浓度0.2~0.3μM、探针终浓度0.2μM、DNA模板>10ng,用水补足至40μL。以步骤2获得的经过亚硫酸盐修饰后的DNA为模板。
qPCR扩增中的2×Premix Ex Taq(Probe qPCR)和RoxⅡ(50×)来自TAKARA公司。
qPCR反应条件为:
96℃预变性3分钟;15个循环:95℃变性15秒,70℃退火延伸20秒,64℃退火延伸20秒,72℃延伸10秒;35个循环,95℃变性15秒,70℃退火延伸20秒,60℃退火延伸34秒,72℃延伸10秒;并且35个循环在退火时,检测荧光信号。
步骤4,检测荧光信号,根据Ct值作为结果判断的标准。
以内参基因(肌动蛋白)荧光信号达到设定的阈值时所需要的循环次数Ct≤36,则表明上样DNA量在允许范围内,结果可信;如果内参基因(肌动蛋白)荧光信号达到设定的阈值时所需要的循环次数CT值>36,视为无效样本。在检测有效情况下,若SDC2基因的CT值≤38或LIFR基因的CT值≤38,则样本的测试结果为“阳性”;若SDC2基因的CT值>38和LIFR基因的CT值>38,则样本的测试结果为“阴性”。
在114例粪便标本中(59例肠癌、26例进展期腺瘤、29例正常),检测SDC2和LIFR的甲基化水平,结果显示(表9),本发明LIFR基因单独检测灵敏度分别为69.2%(进展期腺瘤)、89.8%(结直肠癌),特异性均为100%;SDC2基因单独检测灵敏度分别为57.7%(进展期腺瘤)、88.1%(结直肠癌),特异性均为100%;两个基因联合检测结果灵敏度分别为73.1%(进展期腺瘤)、91.5%(结直肠癌),特异性均为100%。
表9粪便样本检测结果
对比例1
根据β差值(Δβ)≥0.3降序排列结果(表1),针对组合1、2和4相应位点设计了引物和探针,序列如下:
SDC2-1408-F:5’-GGGAGCGTTATTTGGGGAATTT-3’(SEQ ID NO.28)
SDC2-1408-R:5’-CAATTCTCGATACCCCCATTCC-3’(SEQ ID NO.31)
SDC2-1408-P:5’-TATCGGAGATTCGTTGGGA-3’(SEQ ID NO.34)
SDC2-4438-F:5’-GTAATTTTTATGAATTGGCGATTTATGA-3’(SEQ ID NO.29)
SDC2-4438-R:5’-TCTTTCCCTTCTTCACTTTCCCT-3’(SEQ ID NO.32)
SDC2-4438-P:
LIFR-7766-F:5’-GGGGATTTCGTTCGGGG-3’(SEQ ID NO.30)
LIFR-7766-R:5’-AACCCCGAAACGACGACC-3’(SEQ ID NO.33)
LIFR-7766-P:5’-CGTCGCGTTTATTC-3’(SEQ ID NO.36)
利用优选的引物探针组合和实时荧光qPCR反应体系对结直肠癌病人粪便样本进行检测。
步骤如下:
选择24例粪便标本,其中经肠镜检查9例为肠癌、9例进展期腺瘤、6例为正常,定量检测相关基因的甲基化水平。
步骤1,分子杂交捕获。
1.1核酸粗提
3、收集粪便样本1g于4mL粪便保存液(ZYMO RESEARCH,R1101)中,震荡混匀后,5000rpm离心10min,取上清,再进行一次离心操作。
4、取1mL处理后粪便上清,向管中加入裂解液,漩涡混匀,70℃保温10min。
3、加入絮凝剂,置冰上5min,漩涡混匀。
5、15 000g离心3min,转移上清到离心管中,加入0.6倍上清体积的异丙醇,上下颠倒混匀。
6、15 000g离心5min回收基因组DNA沉淀。
7、加入123μL纯化水溶解DNA。
1.2杂交捕获
3、取上步溶解的DNA溶液于PCR管中,加入探针、杂交缓冲液和水。
4、按照如下参数设置PCR程序:
④98℃5min;
⑤65℃1hour;
⑥65℃Hold(保温)。
1.3纯化回收
8、取出链霉亲和素磁珠,置于磁力架,吸弃上清。
9、加入清洗液,漩涡震荡,置于磁力架,小心吸弃上清。
10、加入结合液,将1.2步骤中的溶液加入含有结合液的磁珠中,置于旋转混匀仪上室温旋转30min。
11、旋转孵育结束后,加入漂洗液WB1,置于磁力架,小心吸弃上清。
12、加入漂洗液WB2,置于磁力架,小心吸弃上清。
13、加入80%乙醇,置于磁力架,小心吸弃上清。
14、打开管盖,室温静置5分钟,使剩余的酒精完全挥发干净,将离心管从磁力架上取下,向离心管中加入45μL纯化水,涡旋混匀使磁珠完全分散,所得溶液可用于后续亚硫酸盐转化。
步骤2,对上述提取的DNA样本进行亚硫酸盐转化(EZ DNAmethylation Kit,购自ZYMO RESEARCH)。
步骤3,按照如下扩增体系进行qPCR扩增(总体积40μL)。
2×Premix Ex Taq(Probe qPCR)20μL、RoxⅡ(50×)0.8μL、各条引物终浓度0.2~0.3μM、探针终浓度0.2μM、DNA模板>10ng,用水补足至40μL。以步骤2获得的经过亚硫酸盐修饰后的DNA为模板。
qPCR扩增中的2×Premix Ex Taq(Probe qPCR)和RoxⅡ(50×)来自TAKARA公司。
qPCR反应条件为:
96℃预变性3分钟;15个循环:95℃变性15秒,70℃退火延伸20秒,64℃退火延伸20秒,72℃延伸10秒;35个循环,95℃变性15秒,70℃退火延伸20秒,60℃退火延伸34秒,72℃延伸10秒;并且35个循环在退火时,检测荧光信号。
步骤4,检测荧光信号,根据Ct值作为结果判断的标准。
以内参基因(肌动蛋白)荧光信号达到设定的阈值时所需要的循环次数Ct≤36,则表明上样DNA量在允许范围内,结果可信;如果内参基因(肌动蛋白)荧光信号达到设定的阈值时所需要的循环次数CT值>36,视为无效样本。在检测有效情况下,若SDC2基因的CT值≤38或LIFR基因的CT值≤38,则样本的测试结果为“阳性”;若SDC2基因的CT值>38和LIFR基因的CT值>38,则样本的测试结果为“阴性”。
检测结果(表10)显示,四个组合中组合3(cg08392199(LIFR)和cg13096260(SDC2))即本发明中所用位点组合及其组合2和3在健康人中的假阳性最低,组合4假阳性过高,故不作为优选位点;另外,组合1、组合2和组合3在结直肠癌和进展期腺瘤中的检测效果较高,组合4在进展期腺瘤中的阳性检出结果过低,故不作为优选位点。
表10四个联合检测组合在粪便样本中的对比检测结果
以上详细描述了本发明的较佳具体实施例。应当理解,本领域的普通技术无需创造性劳动就可以根据本发明的构思作出诸多修改和变化。因此,凡本技术领域中技术人员依本发明的构思在现有技术的基础上通过逻辑分析、推理或者有限的实验可以得到的技术方案,皆应在由权利要求书所确定的保护范围内。
- 用于检测PIK3CD基因E1021K位点突变的探针和引物组合及试剂盒
- 一种用于粪便检测进展期腺瘤、结直肠癌相关基因甲基化位点的试剂盒
- 用于检测人类结直肠癌BRAF基因V600E突变的引物、检测方法及试剂盒
- 一种基于BTNAA体系检测犬瘟热病毒的引物对、引物和探针组合物、试剂及试剂盒
- 一种基于BTNAA体系检测犬细小病毒的引物对、引物和探针组合物、试剂及试剂盒
- 一种多位点结直肠癌甲基化检测引物、探针及试剂盒
- 用于数字PCR检测结直肠癌基因甲基化的引物探针组合及其试剂盒和应用
