嵌合ABC转运蛋白及筛选方法
文献发布时间:2024-04-18 19:58:30
相关申请的交叉引用
本申请要求2022年3月1日提交的美国临时申请号63/315,255、2021年6月22日提交的美国临时申请号63/213,652和2021年4月28日提交的美国临时申请号63/181,118的优先权,出于任何目的通过引用以其整体并入本文。
技术领域
本公开涉及关于嵌合ABC转运蛋白和使用嵌合ABC转运蛋白筛选与ABC转运蛋白的周质面、细胞外面和/或腔面结合的分子的方法。例如,在一些实施例中,筛选方法涉及提供嵌合ABC转运蛋白,其中ABC转运蛋白的周质面、细胞外面和/或腔面的一个或多个区域由不同ABC转运蛋白的周质面、细胞外面和/或腔面的一个或多个等效区域取代,并选择与该ABC转运蛋白结合但不与该嵌合ABC转运蛋白结合的分子。本公开也涉及关于与例如在此类筛选中所鉴别的ABC转运蛋白的周质面、细胞外面和/或腔面结合的分子。
背景技术
ATP结合盒(“ABC”)转运蛋白构成了在原核生物和真核生物中以及在真核胞器中发现的膜主体蛋白的超家族,其负责跨膜的多种底物的ATP动力易位。ABC转运蛋白具有跨膜孔,其可从膜的内表面(面向内的构象)或从膜的外表面(面外构象)通行。ATP水解驱动蛋白质的构象改变,导致跨膜孔从膜的内侧“翻转”膜的外侧,反之亦然,以供底物跨膜运输。参见例如,图6。
革兰氏阳性细菌细胞具有单一细胞质膜。革兰氏阴性细菌细胞具有外膜和内/细胞质膜。外膜与内膜之间的空间为周质。例如,在革兰氏阴性细菌细胞中,ABC转运蛋白可用于将特定底物从外膜翻转到内膜,反之亦然,诸如脂多糖(LPS)在外膜与内(细胞质)膜之间的运输。相反,真核细胞具有将细胞外部与胞质液隔开的单一膜。真核胞器通常也具有将胞质液与细胞器腔隔开的单一膜。
出于各种原因,可能需要抑制ABC转运蛋白的活性。例如,可以抑制细菌中某些ABC转运蛋白的分子可能是有效的抗生素。一个可能的抗生素标靶为MsbA,一种在肠杆菌科(Enterobacteriaceae)(革兰氏阴性)中高度保留的ABC转运蛋白,其将脂多糖(LPS)从细胞质跨内膜/细胞质膜转运到周质以并入外膜中。MsbA为外膜的主要组分并且对革兰氏阴性细菌生长至关重要;MsbA的消耗破坏LPS转运并导致细胞裂解,并且阻断MsbA ATP酶活性抑制细菌生长。MsbA可能成为抗生素的标靶,因为它与人类ABC转运蛋白的同一性较低;例如,人类P-gp与MsbA仅约30%相同。
先前在革兰氏阴性细菌中进行以鉴定与ABC转运蛋白(诸如MsbA)结合并抑制其活性的分子的高通量筛选工作利用了具有更高渗透性外膜的突变型细胞类型,例如imp大肠杆菌(imp Escherichia coli)菌株。图3E.这些筛选倾向于朝向鉴定与细菌ABC转运蛋白的面向内的构象结合的分子偏置。这带来了一个问题,因为为了与革兰氏阴性细胞中的面向内的构象结合,该分子将会首先需要穿过外膜和内/细胞质膜两者,而大多数已鉴定的分子都无法做到这一点,并且因此在没有非典型可渗透的外膜的情况下,它们在抑制野生型细胞中ABC转运蛋白的活性方面无效。图6.类似地,在革兰氏阳性细菌细胞或真核细胞中结合面向内的构象的分子必须在结合其标靶之前穿过细胞膜。需要一种能够适应高通量筛选技术的药物发现方法,该技术选择与ABC转运蛋白上的溶剂可通行区域结合的分子,该区域在面外构象时暴露:周质面、细胞外面和/或腔面,包括在蛋白质的周质面、细胞外面和/或腔面内发现的周质间隙、细胞外隙和/或腔隙。与ABC转运蛋白的该部分结合的分子不需要穿过如此多的膜以结合其标靶,但在一些情况下也可用作ABC转运蛋白的抑制剂,例如,通过与转运蛋白的正常底物竞争结合或通过阻断通行蛋白质外表面上的正常底物结合位点。
发明内容
为了筛选与ABC转运蛋白的周质面、细胞外面和/或腔面结合的分子,发明人开发了一种使用嵌合ABC转运蛋白的筛选策略,其中ABC转运蛋白的周质面、细胞外面和/或腔面的一个或多个区域由不同ABC转运蛋白的周质面、细胞外面和/或腔面的一个或多个等效区域取代。此类分子可用于例如反选择筛选,其中在筛选条件下与ABC转运蛋白结合但不与嵌合ABC转运蛋白结合的分子经鉴定为与ABC转运蛋白的周质面、细胞外面和/或腔面结合的分子。本文描述了嵌合ABC转运蛋白和使用它们来鉴定与ABC转运蛋白的周质面、细胞外面和/或腔面区域结合的测试分子的方法以及相关的结合分子、分子复合物、试剂盒和使用经鉴定的分子的方法。
本公开包括例如以下实施例中的任一者或其组合:
实施例1.一种确定测试分子是否与亲本ABC转运蛋白的周质面、细胞外面和/或腔面结合的方法,其包括:a)提供嵌合ABC转运蛋白,其中亲本ABC转运蛋白的周质面、细胞外面和/或腔面的一个或多个区域由不同ABC转运蛋白的周质面、细胞外面和/或腔面的一个或多个等效区域取代;以及b)使嵌合ABC转运蛋白接触与面外构象的亲本ABC转运蛋白结合的测试分子,其中如果测试分子不与嵌合ABC转运蛋白结合,则将测试分子确定为与亲本ABC转运蛋白的周质面、细胞外面和/或腔面结合。
实施例2.一种确定测试分子是否与亲本ABC转运蛋白的周质面、细胞外面和/或腔面结合的方法,其包括:a)将亲本ABC转运蛋白捕集于面外构象;b)选择与面外构象的亲本ABC转运蛋白结合的测试分子;c)提供嵌合ABC转运蛋白,其中亲本ABC转运蛋白的周质面、细胞外面和/或腔面的一个或多个区域由不同ABC转运蛋白的周质面、细胞外面和/或腔面的一个或多个等效区域取代;以及d)使嵌合ABC转运蛋白接触与面外构象的亲本ABC转运蛋白结合的(b)的测试分子,其中如果测试分子不与嵌合ABC转运蛋白结合,则将测试分子确定为与亲本ABC转运蛋白的周质面、细胞外面和/或腔面结合。
实施例3.根据实施例1或2所述的方法,进一步包括在使嵌合ABC转运蛋白接触测试分子之前将嵌合ABC转运蛋白捕集于面外构象。
实施例4.根据实施例2至3中任一项所述的方法,其中通过使亲本ABC转运蛋白和/或嵌合ABC转运蛋白接触Mg
实施例5.根据实施例1至4中任一项所述的方法,其中亲本ABC转运蛋白为第IV型或第V型ABC转运蛋白。
实施例6.根据实施例1至5中任一项所述的方法,其中亲本ABC转运蛋白为第IV型ABC转运蛋白。
实施例7.根据实施例1至6中任一项所述的方法,其中亲本ABC转运蛋白来自革兰氏阴性细菌。
实施例8.根据实施例7所述的方法,其中革兰氏阴性细菌选自大肠杆菌(Escherichia coli)、阴沟肠杆菌(Enterobacter cloacae)、克雷伯氏肺炎杆菌(Klebsiella pneumoniae)、绿脓杆菌(Pseudomonas aeruginosa)、耐冷假单胞菌(Pseudomonas psychrotolerans)、候选累积杆菌(Candidatus Accumulibacter)、损蘑菇紫色杆菌(Janthinobacterium agaricidamnosum)、循环硫微螺菌(Thiomicrospiracyclica)或磁螺菌属(Magnetospira sp.)株-QH-2。
实施例9.根据实施例8所述的方法,其中亲本ABC转运蛋白来自大肠杆菌。
实施例10.根据实施例7至9中任一项所述的方法,其中亲本ABC转运蛋白为MsbA。
实施例11.根据实施例7至10中任一项所述的方法,其中不同ABC转运蛋白来自革兰氏阴性细菌。
实施例12.根据实施例11所述的方法,其中革兰氏阴性细菌选自大肠杆菌(Escherichia coli)、阴沟肠杆菌(Enterobacter cloacae)、克雷伯氏肺炎杆菌(Klebsiella pneumoniae)、绿脓杆菌(Pseudomonas aeruginosa)、耐冷假单胞菌(Pseudomonas psychrotolerans)、候选累积杆菌(Candidatus Accumulibacter)、损蘑菇紫色杆菌(Janthinobacterium agaricidamnosum)、循环硫微螺菌(Thiomicrospiracyclica)或磁螺菌属(Magnetospira sp.)株-QH-2。
实施例13.根据实施例1至12中任一项所述的方法,其中嵌合ABC转运蛋白与亲本ABC转运蛋白的不同之处在于至少一个周质面环、细胞外面环或腔面环以及在该环的任一侧上至多50%的跨膜区段由不同ABC转运蛋白的等效区域替换。
实施例14.根据实施例13所述的方法,其中嵌合ABC转运蛋白与
亲本ABC转运蛋白的不同之处在于至少一个面向周质面环、细胞外面环或腔面环以及在该环的任一侧上50%的跨膜区段由不同ABC转运蛋白的等效区域替换。
实施例15.根据实施例13所述的方法,其中嵌合ABC转运蛋白与
亲本ABC转运蛋白的不同之处在于至少一个面向周质面环、细胞外面环或腔面环以及在该环的任一侧上至多25%的跨膜区段由不同ABC转运蛋白的等效区域替换。
实施例16.根据实施例13所述的方法,其中嵌合ABC转运蛋白与
亲本ABC转运蛋白的不同之处在于至少一个面向周质面环、细胞外面环或腔面环以及在该环的任一侧上至多10%的跨膜区段由不同ABC转运蛋白的等效区域替换。
实施例17.根据实施例13所述的方法,其中嵌合ABC转运蛋白与
亲本ABC转运蛋白的不同之处在于面向周质面环、细胞外面环或腔面环中的至少一者、至少两者、至少三者或全部以及在每一个环的任一侧上至多50%的跨膜区段由不同ABC转运蛋白的等效区域替换。
实施例18.根据实施例1至17中任一项所述的方法,其中亲本ABC转运蛋白和不同ABC转运蛋白分别由来自两个不同物种的同源基因编码。
实施例19.根据实施例1至12中任一项所述的方法,其中亲本ABC转运蛋白为大肠杆菌(E.coli)MsbA(EcMsbA),并且嵌合ABC转运蛋白为EcMsbA,其中周质面环1(L1)中的EcMsbA残基Leu47-Pro68、周质面环3(L3)中的EcMsbA残基Met159-Leu171以及周质面环5(L5)中的EcMsbA残基Ala262-Ile292中的一者或多者由耐冷假单胞菌的等效区域(PpMsbA)替换。
实施例20.根据实施例1至12中任一项所述的方法,其中亲本ABC转运蛋白为EcMsbA,并且嵌合ABC转运蛋白为EcMsbA,其中周质面环1(L1)中的EcMsbA残基Leu47-Pro68、周质面环3(L3)中的EcMsbA残基Met159-Leu171以及周质面环5(L5)中的EcMsbA残基Ala262-Ile292中的一者或多者由候选累积杆菌的等效区域(CaMsbA)替换。
实施例21.根据实施例1至12中任一项所述的方法,其中亲本ABC转运蛋白为EcMsbA,并且嵌合ABC转运蛋白为EcMsbA,其中周质面环1(L1)中的EcMsbA残基Leu47-Pro68、周质面环3(L3)中的EcMsbA残基Met159-Leu171以及周质面环5(L5)中的EcMsbA残基Ala262-Ile292中的一者或多者由损蘑菇紫色杆菌的等效区域(JaMsbA)替换。
实施例22.根据实施例1至12中任一项所述的方法,其中亲本ABC转运蛋白为EcMsbA,并且嵌合ABC转运蛋白为EcMsbA,其中周质面环1(L1)中的EcMsbA残基Leu47-Pro68、周质面环3(L3)中的EcMsbA残基Met159-Leu171以及周质面环5(L5)中的EcMsbA残基Ala262-Ile292中的一者或多者由循环硫微螺菌的等效区域(TcMsbA)替换。
实施例23.根据实施例1至12中任一项所述的方法,其中亲本ABC转运蛋白为EcMsbA,并且嵌合ABC转运蛋白为EcMsbA,其中周质面环1(L1)中的EcMsbA残基Leu47-Pro68、周质面环3(L3)中的EcMsbA残基Met159-Leu171以及周质面环5(L5)中的EcMsbA残基Ala262-Ile292中的一者或多者由磁螺菌属(Magnetospira)株QH-2的等效区域(MqMsbA)替换。
实施例24.根据实施例1至23中任一项所述的方法,其中该分子与亲本ABC转运蛋白的周质间隙、细胞外隙或腔隙结合。
实施例25.根据实施例1至24中任一项所述的方法,其中该方法进一步包括在该分子存在下进行亲本ABC转运蛋白的ATP酶测定。
实施例26.根据实施例1至25中任一项所述的方法,其中该方法进一步包括在该分子存在下进行亲本ABC转运蛋白的细胞活力或生长测定和/或ABC转运蛋白功能测定。
实施例27.一种通过实施例1至26中任一项所述μM的方法鉴定的分子,其中该分子以20μM或更低的K
实施例28.根据实施例27所述的分子,其中该分子以10μM或更低的K
实施例29.根据实施例27所述的分子,其中该分子以20nM或更低的K
实施例30.根据实施例27所述的分子,其中该分子以500nM或更低的K
实施例31.根据实施例27所述的分子,其中该分子以1nM或更低的K
实施例32.根据实施例27所述的分子,其中该分子以1至20μM的K
实施例33.根据实施例27所述的分子,其中该分子以10至20μM的K
实施例34.根据实施例27所述的分子,其中该分子以1nM至20μM的K
实施例35.根据实施例27所述的分子,其中该分子以1nM至500nM的K
实施例36.一种通过实施例1至26中任一项所述的方法鉴定的分子,其中该分子为肽。
实施例37.一种通过实施例1至26中任一项所述的方法鉴定的分子,其中该分子为小分子。
实施例38.一种通过实施例1至26中任一项所述的方法鉴定的分子,其中该分子为抗体。
实施例39.一种通过实施例1至26中任一项所述的方法鉴定的分子,其中该分子为肽、小分子或抗体的结合片段。
实施例40.根据实施例36所述的肽,其中该肽为巨环。
实施例41.根据实施例40所述的巨环,其中该巨环为6-14-mer、6-10-mer、6-8-mer或8-10-mer巨环。
实施例42.根据实施例40或41所述的巨环,其中该巨环具有至少一个亲脂侧链和至少一个带正电荷的侧链。
实施例43.根据实施例27至42中任一项所述的分子,其中该分子与亲本ABC转运蛋白的周质间隙、细胞外隙或腔裂结合。
实施例44.一种巨环肽G1118、G1119或G1122。
实施例45.一种巨环肽G1365。
实施例46.一种分子,当通过以Mg
实施例47.根据实施例46所述的分子,其中该分子在竞争测定中将G1118、G1119和/或G1122与亲本ABC转运蛋白的结合抑制至少50%、60%、70%、80%、90%或100%。
实施例48.一种分子,当通过以Mg
实施例49.根据实施例48所述的分子,其中该分子在竞争测定中将G1365与亲本ABC转运蛋白的结合抑制至少50%、60%、70%、80%、90%或100%。
实施例50.一种制备嵌合ABC转运蛋白的方法,其包括将亲本ABC转运蛋白的至少一个周质面环、细胞外面环或腔面环以及在该环的任一侧上高达50%的跨膜片段替换成不同ABC转运蛋白的等效区域。
实施例51.根据实施例50所述的方法,其中亲本ABC转运蛋白的至少一个面向周质面环、细胞外面环或腔面环以及在该环的任一侧上50%的跨膜区段由不同ABC转运蛋白的等效区域替换。
实施例52.根据实施例50所述的方法,其中亲本ABC转运蛋白的至少一个面向周质面环、细胞外面环或腔面环以及在该环的任一侧上至多25%的跨膜区段由不同ABC转运蛋白的等效区域替换。
实施例53.根据实施例50所述的方法,其中亲本ABC转运蛋白的至少一个面向周质面环、细胞外面环或腔面环以及在该环的任一侧上至多10%的跨膜区段由不同ABC转运蛋白的等效区域替换。
实施例54.根据实施例50所述的方法,其中亲本ABC转运蛋白的面向周质面环、细胞外面环或腔面环中的至少两者、至少三者或全部以及在每个环的任一侧上至多50%的跨膜区段由不同ABC转运蛋白的等效区域替换。
实施例55.根据实施例50至54中任一项所述的方法,其中亲本和不同ABC转运蛋白各自为第IV型或第V型ABC转运蛋白。
实施例56.根据实施例50至55中任一项所述的方法,其中亲本和不同ABC转运蛋白各自为第IV型ABC转运蛋白。
实施例57.根据实施例50至56中任一项所述的方法,其中亲本ABC转运蛋白来自革兰氏阴性细菌。
实施例58.根据实施例57所述的方法,其中革兰氏阴性细菌选自大肠杆菌、阴沟肠杆菌、克雷伯氏肺炎杆菌、绿脓杆菌、耐冷假单胞菌、候选累积杆菌、损蘑菇紫色杆菌、循环硫微螺菌或磁螺菌属株-QH-2。
实施例59.根据实施例58所述的方法,其中革兰氏阴性细菌为大肠杆菌。
实施例60.根据实施例57至59中任一项所述的方法,其中亲本ABC转运蛋白为MsbA。
实施例61.根据实施例57至60中任一项所述的方法,其中不同ABC转运蛋白来自革兰氏阴性细菌。
实施例62.根据实施例61所述的方法,其中不同ABC转运蛋白来自选自大肠杆菌、阴沟肠杆菌、克雷伯氏肺炎杆菌、绿脓杆菌、耐冷假单胞菌、候选累积杆菌、损蘑菇紫色杆菌、环状硫微或磁螺菌属株-QH-2的细菌。
实施例63.根据实施例50至62中任一项所述的方法,其中亲本ABC转运蛋白和不同ABC转运蛋白分别由来自两个不同物种的同源基因编码。
实施例64.根据实施例63所述的方法,其中亲本和不同ABC转运蛋白为来自两种不同革兰氏阴性细菌物种的MsbA转运蛋白。
实施例65.一种嵌合ABC转运蛋白,其中亲本ABC转运蛋白的至少一个周质面环、细胞外面环或腔面环以及在该环的任一侧上高达50%的跨膜片段由不同ABC转运蛋白的等效区域替换。
实施例66.根据实施例65所述的嵌合ABC转运蛋白,其中亲本ABC转运蛋白的至少一个面向周质面环、细胞外面环或腔面环以及在该环的任一侧上50%的跨膜区段由不同ABC转运蛋白的等效区域替换。
实施例67.根据实施例65所述的嵌合ABC转运蛋白,其中亲本ABC转运蛋白的至少一个面向周质面环、细胞外面环或腔面环以及在该环的任一侧上至多25%的跨膜区段由不同ABC转运蛋白的等效区域替换。
实施例68.根据实施例65所述的嵌合ABC转运蛋白,其中亲本ABC转运蛋白的至少一个面向周质面环、细胞外面环或腔面环以及在该环的任一侧上至多10%的跨膜区段由不同ABC转运蛋白的等效区域替换。
实施例69.根据实施例65所述的嵌合ABC转运蛋白,其中亲本ABC转运蛋白的面向周质面环、细胞外面环或腔面环中的至少两者、至少三者或全部以及在每个环的任一侧上至多50%的跨膜区段由不同ABC转运蛋白的等效区域替换。
实施例70.根据实施例65至69中任一项所述的嵌合ABC转运蛋白,其中亲本ABC转运蛋白来自革兰氏阴性细菌。
实施例71.根据实施例70所述的嵌合ABC转运蛋白,其中革兰氏阴性细菌选自大肠杆菌、阴沟肠杆菌、克雷伯氏肺炎杆菌、绿脓杆菌、耐冷假单胞菌、候选累积杆菌、损蘑菇紫色杆菌、循环硫微螺菌或磁螺菌属株-QH-2。
实施例72.根据实施例71所述的嵌合ABC转运蛋白,其中亲本ABC转运蛋白来自大肠杆菌。
实施例73.根据实施例70至72中任一项所述的嵌合ABC转运蛋白,其中亲本ABC转运蛋白为MsbA。
实施例74.根据实施例70至73中任一项所述的嵌合ABC转运蛋白,其中不同ABC转运蛋白来自革兰氏阴性细菌。
实施例75.根据实施例74所述的嵌合ABC转运蛋白,其中革兰氏阴性细菌选自大肠杆菌、阴沟肠杆菌、克雷伯氏肺炎杆菌、绿脓杆菌、耐冷假单胞菌、候选累积杆菌、损蘑菇紫色杆菌、循环硫微螺菌或磁螺菌属株-QH-2。
实施例76.根据实施例70至75中任一项所述的嵌合ABC转运蛋白,其中不同ABC转运蛋白为MsbA。
实施例77.根据实施例65至76中任一项所述的嵌合ABC转运蛋白,其中亲本ABC转运蛋白和不同ABC转运蛋白分别由来自两个不同物种的同源基因编码。
实施例78.根据实施例77所述的嵌合ABC转运蛋白,其中亲本和不同ABC转运蛋白为来自两种不同革兰氏阴性细菌物种的MsbA转运蛋白。
实施例79.一种嵌合ABC转运蛋白,其包含亲本ABC转运蛋白大肠杆菌MsbA(EcMsbA),其中周质面环1(L1)中的EcMsbA残基Leu47-Pro68、周质面环3(L3)中的EcMsbA残基Met159-Leu171以及周质面环5(L5)中的EcMsbA残基Ala262-Ile292中的一者或多者由耐冷假单胞菌的等效区域(PpMsbA)替换。
实施例80.一种嵌合ABC转运蛋白,其包含EcMsbA,其中周质面环1(L1,EcMsbA残基Leu47-Pro68)、周质面环3(L3,EcMsbA残基Met159-Leu171)以及周质面环5(L5,EcMsbA残基Ala262-Ile292)由候选累积杆菌(CaMsbA)的等效区域替换。
实施例81.一种嵌合ABC转运蛋白,其包含EcMsbA,其中周质面环1(L1)中的EcMsbA残基Leu47-Pro68、周质面环3(L3)中的EcMsbA残基Met159-Leu171以及周质面环5(L5)中的EcMsbA残基Ala262-Ile292中的一者或多者由损蘑菇紫色杆菌(JaMsbA)的等效区域替换。
实施例82.一种嵌合ABC转运蛋白,其包含EcMsbA,其中周质面环1(L1)中的EcMsbA残基Leu47-Pro68、周质面环3(L3)中的EcMsbA残基Met159-Leu171以及周质面环5(L5)中的EcMsbA残基Ala262-Ile292中的一者或多者由循环硫微螺菌(TcMsbA)的等效区域替换。
实施例83.一种嵌合ABC转运蛋白,其包含EcMsbA,其中周质面环1(L1)中的EcMsbA残基Leu47-Pro68、周质面环3(L3)中的EcMsbA残基Met159-Leu171以及周质面环5(L5)中的EcMsbA残基Ala262-Ile292中的一者或多者由磁螺菌属株-QH-2的等效区域(TcMsbA)替换。
实施例84.一种分子复合物,其包含与肽、小分子、抗体、肽的结合片段、小分子的结合片段或抗体的结合片段结合的根据实施例65至83中任一项所述的嵌合ABC转运蛋白。
实施例85.根据实施例84所述的复合物,其中该肽为巨环。
实施例86.根据实施例85所述的复合物,其中该巨环为6-14-mer巨环。
实施例87.一种分子复合物,其包含亲本ABC转运蛋白和根据实施例27至49中任一项所述的分子。
实施例88.根据实施例87所述的复合物,其中该肽为巨环。
实施例89.根据实施例88所述的复合物,其中该巨环为6-14-mer巨环。
实施例90.根据实施例89所述的复合物,其中该巨环为G1118、G1119、G1122或G1365。
实施例91.一种试剂盒,其包含根据实施例65至83中任一项所述的嵌合ABC转运蛋白以及用于实施实施例1至26中任一项所述的方法的试剂,任选地其中该嵌合ABC转运蛋白接附至基质或珠粒,并且任选地其中该试剂盒进一步包含以下一项或多项:
a.亲本ABC转运蛋白和/或由该嵌合ABC转运蛋白经工程改造的不同ABC转运蛋白;
b.用于附着ABC转运蛋白的基质或珠粒,任选地为经链霉抗生物素蛋白包被的珠粒、经抗生物素蛋白包被的珠粒或经去糖基化的抗生物素蛋白包被的珠粒或磁珠;
c.一种或多种洗涤剂,其用于溶解基质或珠粒上的ABC转运蛋白;
d.至少一种洗涤缓冲液;
e.至少一种洗脱缓冲液;
f.至少一种阳性或阴性对照分子。
实施例92.根据实施例91所述的试剂盒,其进一步包括使用说明。
实施例93.一种治疗受试者的细菌感染的方法,其包括向该个体施用有效量的根据实施例27至49中任一项所述的分子。
实施例94.根据实施例27至49中任一项所述的分子的用途,其用于治疗个体的细菌感染。
实施例95.一种肽,其包含以下序列:
ClacF-X1-X2-L-X3-X4-D-X5-X6-X7-X8-MeF-V-C,其中:
i.X1为W、V或Y;
ii.X2为W或Y;
iii.X3为W或Y;
iv.X4为S、D、V或H;
v.X5为N,其中N选自除C以外的任何天然氨基酸或选自Bph((S)-3-([1,1'-联苯]-4-基)-2-氨基丙酸)、多巴(L-3,4-二羟基苯丙氨酸)、MeF(N-甲基-L-苯丙氨酸)和MeG(N-甲基-L-甘氨酸)的非天然氨基酸;
vi.X6为Y、K、A、S、D、R或V;
vii.X7为W、Y或Bph;并且
viii.X8为W或Y;
任选地其中该肽在C末端的C残基之后进一步包含G残基,并且其中ClacF为N-氯乙酰基L-苯丙氨酸,Bph为(S)-3-([1,1'-联苯]-4-基)-2-氨基丙酸,多巴为L-3,4-二羟基苯丙氨酸,MeF为N-甲基-L-苯丙氨酸,并且MeG为N-甲基-L-甘氨酸。
实施例96.根据实施例95所述的肽,其中X1为W或Y。
实施例97.根据实施例96所述的肽,其中X1为W。
实施例98.根据实施例95至97中任一项所述的肽,其中X2为W。
实施例99.根据实施例95至98中任一项所述的肽,其中X3为W。
实施例100.根据实施例95至99中任一项所述的肽,其中X4为S、D、V或H。
实施例101.根据实施例100所述的肽,其中X4为D。
实施例102.根据实施例95至101中任一项所述的肽,其中X5为V、D、H、G或Y。
实施例103.根据实施例102所述的肽,其中X5为V或H。
实施例104.根据实施例103所述的肽,其中X5为V。
实施例105.根据实施例95至104中任一项所述的肽,其中X6为D或S。
实施例106.根据实施例105所述的肽,其中X6为S。
实施例107.根据实施例95至106中任一项所述的肽,其中X7为W。
实施例108.根据实施例95至107中任一项所述的肽,其中X8为W。
实施例109.一种巨环,其由根据实施例95至108中任一项所述酰的肽形成,其中该巨环由于ClacF的N-末端氯乙基与C残基的巯基之间的硫醚键联而环化。
实施例110.一种肽,其包含以下氨基酸序列:
ClacF-X1-Y-Bph-MeF-X2-V-C,其中:
i.X1为V、S、Y、W、多巴、L、V、A、R、K或D;并且
ii.X2为R、V、多巴或Y;
其中ClacF为N-氯乙酰基L-苯丙氨酸,Bph为(S)-3-([1,1'-联苯]-4-基)-2-氨基丙酸,多巴为L-3,4-二羟基苯丙氨酸,并且MeF为N-甲基-L-苯丙氨酸。
实施例111.根据实施例110所述的肽,其中X1为S、Y、L、V、A、R、K或D。
实施例112.根据实施例111所述的肽,其中X1为V或Y。
实施例113.根据实施例110至112中任一项所述的肽,其中X1为V。
实施例114.根据实施例110至113中任一项所述的肽,其中X2为R或Y。
实施例115.根据实施例114所述的肽,其中X2为R。
实施例116.一种巨环,其由根据实施例110至115中任一项所述酰的肽形成,其中该巨环由于ClacF的N-末端氯乙基与C残基的巯基之间的硫醚键联而环化。
实施例117.根据实施例95至116中任一项所述的肽或巨环,其中该肽或巨环结合至另一分子,诸如抗生素或抗微生物剂,任选地其中结合为在该序列的C-末端氨基酸残基处。
实施例118.根据实施例117所述的肽或巨环,其中该抗生素或抗微生物剂为多黏菌素,诸如多黏菌素B或多黏菌素E。
附图说明
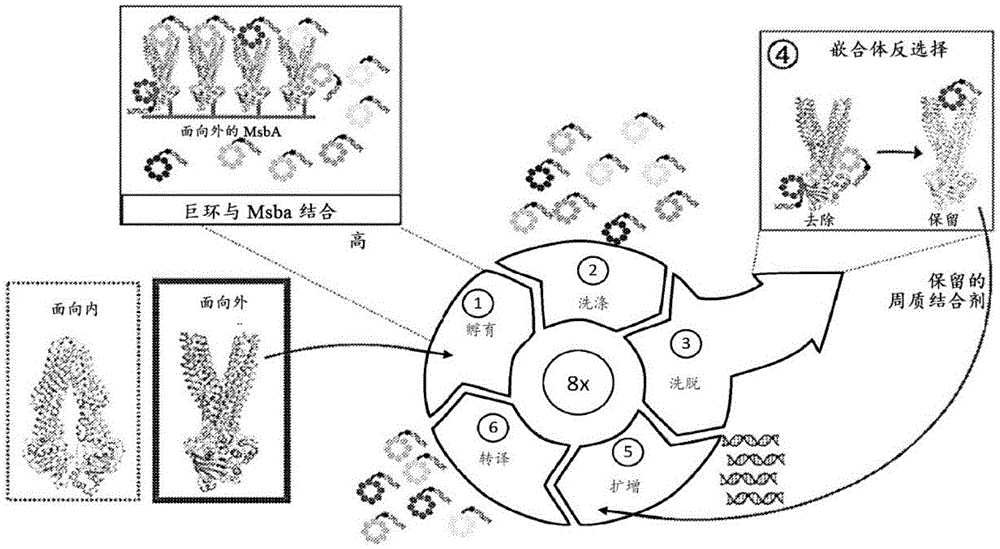
图1A-C示出三种不同ABC转运蛋白的蛋白质结构以及蛋白质如何相对于周质/细胞外空间和细胞质/胞质液而处于膜中的示意图。每个单独的氨基酸由一个圆圈表示,该圆圈内含有由一个字母代码识别的氨基酸。该链上的一些氨基酸位置也被编号,例如位置50和位置60。图1A示出来自大肠杆菌的MsbA ABC转运蛋白。图1B示出人类ABC转运蛋白ABCD4。它与MsbA具有约25-30%的序列同一性。图1C示出人类ABC转运蛋白ABCC1。它与MsbA具有约25-30%的序列同一性。图1A-C示出并标记可取代不同ABC转运蛋白的等效区域以制备嵌合ABC转运蛋白的周质面环或细胞外面环区域。还示出蛋白质的穿过膜的区域(“跨膜区段”或“TM区段”),它们可以取代来自不同ABC转运蛋白的ABC转运蛋白的等效区域。矩形框指示每个蛋白质中可能被取代的区域。
图2A-C示出ABC转运蛋白和嵌合ABC转运蛋白以及它们如何相对于周质/细胞外空间和细胞质/胞质液而处于膜中的三维表示。图2A,左屏,示出处于细胞膜(与结构相交的深色条带)中的革兰氏阴性细菌MsbA的三维表示。图2A,中屏,示出巨环-MsbA复合物的三维表示,其中巨环与蛋白质的周质面结合,具体地在周质间隙中。图2A,右屏,示出嵌合MsbA(MsbA-嵌合体5),其中在带状图顶部处的较深色的、填充的氨基酸取自不同ABC转运蛋白中的等效区域。例如,这种嵌合体可用于帮助选择与MsbA的周质面(包括周质间隙)结合的分子,诸如中屏中所示的巨环。图2B,中屏,示出嵌合人类ABCD4转运蛋白(PDB:6JBJ),其中蛋白质的填充的氨基酸取自不同ABC转运蛋白中的等效区域。图2B的左屏再次示出嵌合MsbA蛋白,指示两种蛋白质的架构的相似性。图2B,右屏,示出嵌合人类ABCC1转运蛋白(PDB:6BHU),其中在带状图顶部处的填充的氨基酸取自不同ABC转运蛋白中的等效区域。图2C示出来自周质或细胞外透视的三种嵌合蛋白中的每一者的表示。每个周质面环或细胞外面环都被标记。带状图中填充的氨基酸来自不同ABC转运蛋白中的等效区域。每个细胞外环也被标记。
图3A-N示出用于表征巨环MsbA抑制剂的策略。图3A示出INSITE筛选策略的示意图,用于鉴定靶向EcMsbA周质面的巨环。图3B示出示例性巨环抑制剂G1118和G1365。这些抑制剂含有所指示的硫醚键(非天然氨基酸:Clac-F,N-氯乙酰基L-苯丙氨酸;MeF,N-甲基-L-苯丙氨酸;Bph,(S)-3-([1,1'-联苯]-4-基)-2-氨基丙酸。图3C-D示出G1118(图3C)和G1365(图3D)对WT大肠杆菌MsbA和MsbA-chim5的剂量反应曲线。通过拟合非线性四参数抑制模型(参见实例3)来确定IC
图4A-N示出G1118和G1365结合在MsbA周质间隙中。图4A示出G1118-EcMsbA复合物的cryo-EM地图。G1118和LPS已在地图上指示。图4B示出G1118结合在MsbA的周质间隙中的视图。为清楚起见,省略了GKK尾部。图4C-D示出G1118与MsbA之间选择交互作用的放大视图。图4E示出在最后一轮富集后定序期间在G1118家族中观察到的巨环cDNA的频率图(非天然氨基酸为:MeF=F
图5A-E示出LPS在面外构象中的必需周边结合位点处结合。图5A示出内膜的内小叶上MsbA上的周边LPS结合位点。图5B示出LPS结合位点的放大视图,突出示出了LPS与MsbA之间的交互作用。标记了2'-羟基肉豆蔻酸酯(2'-C14)和2”-月桂酸酯酰基(2”-C12)链。为清楚起见,省略了Kdo残基。图5C示出表达所指示的来自低复本质粒(表1)的大肠杆菌MsbA的WT或突变型等位基因的大肠杆菌MG1655 msbA-cKO lptD(imp4213)的生长曲线。数据为来自三个独立实验的平均值±s.e.m.。图5D示出代表性薄切片电子显微照片,其将msbA
图6示出用于通过MsbA进行LPS的选择性识别和运输的模型。屏1-在面外构象中,LPS可以沿着内膜结合周边结合位点。成熟的Kdo2-LipidA选择性地与LPS的4'-磷酸酯侧的带正电和芳香族残基结合。屏2-MsbA回到面向内的构象,并且LPS在从周边结合位点释放后经局部富集(PDB:6BL6)。沿着MsbA上的带正电残基的脊发生LPS向中心腔的促进扩散。屏3-LPS被封闭在中央前庭内,如先前所述(PDB:5TV4)。屏4-ATP结合导致大的构象改变,导致面向外的状态,将LPS释放到内膜的外小叶中。LPS从MsbA扩散出来以进行后续处理并运输到外膜。
图7示出晶体学数据收集和精化统计。
图8示出cryo-EM数据采集参数和模型精化统计的总结。
图9A-B示出选择MsbA同源物的多序列比对。在图9A中,大肠杆菌MsbA序列示出为参考,并且包括选自嵌合转运蛋白设计的来自其他物种的推定同源物。在图9A中,SEQ IDNO:4为大肠杆菌MsbA蛋白序列(第一行),SEQ ID NO:5为耐冷假单胞菌(P.psychrotolerans)MsbA蛋白序列(第二行),SEQ ID NO:6为候选累积杆菌(C.accumulibacter)MsbA蛋白序列(第三行),SEQ ID NO:7为损蘑菇紫色杆菌(J.agaricidamnosum)MsbA蛋白序列(第四行),SEQ ID NO:8为循环硫微螺菌(T.cyclica)MsbA蛋白序列(第五行),并且SEQ ID NO:9为磁螺菌属QH-2MsbA蛋白序列(第六行)。图9B示出图9A中MsbA同源物的整体序列同一性。
图10A-B示出嵌合MsbA转运蛋白构建体。图10A示出基于大肠杆菌MsbA的嵌合体的示例性序列。标记为“环1”、“环2”和“环3”的区域指示在生成工程化嵌合转运蛋白时被取代的跨膜螺旋和和环的周质区域。在图10A中,SEQ ID NO:4为大肠杆菌MsbA蛋白序列(第一行),SEQ ID NO:12为大肠杆菌MsbA-嵌合体1蛋白序列(第二行),SEQ ID NO:13为大肠杆菌MsbA-嵌合体2蛋白序列,SEQ ID NO:14为大肠杆菌MsbA-嵌合体3蛋白序列(第三行),SEQID NO:15为大肠杆菌MsbA-嵌合体4蛋白序列(第四行),并且SEQ ID NO:16为大肠杆菌MsbA-嵌合体5蛋白序列(第五行)。图10B示出面向外的大肠杆菌MsbA和MsbA-嵌合体。侧视图示出在顶屏中,并且顶视图示出在底屏中。在MsbA-嵌合体中,指示了在环1-3处具有氨基酸取代的区域(如图10A所示)。
图11A-E示出EcMsbA嵌合体的纯化和评估。图11A示出经纯化的EcMsbA嵌合体的SDS-PAGE分析,用考马斯亮蓝染色进行可视化。图11B示出粒径筛析层析图谱的叠加,其中示出了UV(280nm)曲线。图11C示出与WT蛋白相比,递减浓度的EcMsbA嵌合体的ATP酶活性的比较。图11D示出喹啉和二苯甲酮抑制剂的示例性化学结构(Alexander等人,2018;Ho等人,2018)。图11E示出化合物在经纯化的EcMsbA和EcMsbA-chim5上的剂量反应曲线。数据为来自三个独立实验的平均值±s.e.m.(图11C-E)。IC
图12A-B示出MsbA-嵌合体5的晶体结构,其揭示推定的二苯甲酮受体位点。图12A示出面向内的构象的MsbA-chim5的整体结构。LPS以球体示出。指定的二苯甲酮G758示出为棒状。Fo-Fc地图(1.5σ,网格)为在将G758包括在模型中并精化之前计算的。图12B示出MsbA上推定的二苯甲酮结合位点的放大视图,带有来自图12A的Fo-Fc地图以及2Fo-Fc地图(1.5σ,网格)。G758推定结合在浅的疏水袋内,该袋围绕残基,其通过抗性图谱研究鉴定(数据未示出)。
图13A-D示出对MsbA巨环抑制剂的生化和表达型活性的评估。图13A示出G1118在来自大肠杆菌、阴沟肠杆菌(E.cloacae)、克雷伯氏肺炎杆菌(K.Pneumoniae)和绿脓杆菌(P.aeruginosa)的经纯化和amphipol重组的MsbA同源物上的剂量反应曲线。图13B示出G1118在大肠杆菌CFT073(WT)和CFT073 lptD(imp4213)(imp)菌株上的剂量反应曲线。图13C示出G1365在来自大肠杆菌、阴沟肠杆菌、克雷伯氏肺炎杆菌和绿脓杆菌的经纯化和amphipol重组的MsbA同源物上的剂量反应曲线。图13D示出G1118在大肠杆菌CFT073(WT)和CFT073 lptD(imp4213)(imp)菌株上的剂量反应曲线。数据为来自三个独立实验的平均值±s.e.m.(图13A-D)。IC
图14A-G示出对用于结构研究的复合物的生化评估。图14A示出用于结构研究和用于分离PD-1365抗性突变体(G1365·I2,多巴3)的G1118和G1365衍生物的化学结构。不同于G1118或G1365亲本巨环的衍生物区域,即KK、R2、I2、多巴3和L2
图15A-E示出MsbA与G1118复合物的cryo-EM数据处理。图15A示出处理线程。图15B示出在Relion中计算的局部解析度图。图15C示出来自最后一轮3D精化的全部颗粒的方向分布。图15D示出cisTEM中经精化的FSC图。用于比对的最大解析度为
图16A-D示出巨环结合在MsbA周质间隙中。在图16A-B中,与G1118结合的MsbA的静电表面突出了巨环结合位点的复杂化学环境。近似膜边界和非强制C2对称轴经标记。图16C-D示出与G1365结合的MsbA的静电表面。
图17A-E示出MsbA与G1365复合物的cryo-EM数据处理。图17A示出处理线程。图17B示出来自最后一轮3D精化的全部颗粒的方向分布。图17C示出cisTEM中经精化的FSC图。用于比对的最大解析度为
图18A-D示出保留的周边LPS结合位点。图18A示出具有对称相关的LPS结合位点的MsbA-G1118-LPS复合物。图18B示出EcMsbA的序列保留分析。图18C示出面向内的LPS结合构象的MsbA(PDB:5TV4)表面上的静电位。从LPS结合位点朝向中心腔存在一条正电荷运行线。通过Maestro中的蛋白质准备向导(Protein Preparation Wizard)添加缺失的侧链原子。示出了LPS在面向外的G1118结合结构中的结合位置。在图18D中,MsbA-G1118-LPS(蓝色)的结构与面向内的MsbA(白色,PDB:5TV4)对准。LPS的
图19A-J示出对MsbA周边LPS结合位点突变体的细胞生长表达型的评估。图19A示出在2%阿拉伯糖存在下(在这些条件下,未经标签化的WTEcMsbA也被表达),来自表达来自pLMG18载体的大肠杆菌MsbA的WT或所指示的突变体的大肠杆菌MG1655 msbA-cKO lptD(imp4213)的经溶解的提取物的α-FLAG-MsbA和α-GroEL蛋白质印迹。印记代表n=2个独立实验。图19B-I示出在阿拉伯糖存在或不存在下,表达所指示的大肠杆菌MsbA或无质粒对照的WT或突变型等位基因的大肠杆菌MG1655msbA-cKO lptD(imp4213)的生长曲线。2%阿拉伯糖用于诱导来自染色体的WT大肠杆菌MsbA的表达,而在阿拉伯糖不存在下,MsbA的唯一来源为来自表达大肠杆菌MsbA的WT或所指示的突变体的pLMG18载体的组成表达。图19J示出与WT蛋白相比,递减浓度的EcMsbA突变体的ATP酶活性的比较。数据(图19B-J)为来自三个独立实验的平均值±s.e.m.。
具体实施方式
I.定义
除非另有定义,否则与本发明结合使用的科学和技术术语应具有普通技术人员所一般理解的含义。如根据本公开所使用的,除非另外指出,否则以下术语应理解是具有以下含义:
在本申请案中,除非另外陈述,否则所用的“或”意指“和/或”。在多重附属权利要求的背景中,所用的“或”仅以替代形式重新提及多于一个前述独立或附属权利要求。同样,除非另外具体陈述,否则诸如“要素”或“组分”等术语涵盖包含一个单元的要素和组分以及包含多于一个亚单元的要素和组分两种情况。
如本文中所使用的过渡术语“基本上由...组成”,当涉及所要求保护的方法的步骤时,表示该方法除了规定的那些将实质上影响该方法的基本和新颖特征的步骤之外,不包括其他步骤。如本文中所使用的过渡术语“基本上由...组成”,当涉及诸如试剂盒的组成物或产品时,表示其不包含除了规定的那些将实质上影响其基本和新颖特征的组分以外的其他组分。
如本文所用,除非上下文另外明确指出,否则单数形式的“一种(a)”、“一个(an)”和“该(the)”包括复数指示内容。因此,例如,对“ABC转运蛋白”的提及包括复数个此类转运蛋白,而对“该细胞”的提及包括对本领域技术人员已知的一个或多个细胞(或对复数个细胞)和其等效物的提及,以此类推。
如本文所述,除非另外指示,否则任何浓度范围、百分比范围、比率范围或整数范围应理解为包括于所引述范围和(在适当时)其分数部分(诸如整数的十分之一和百分之一)内的任何整数值。
单位、前缀、和符号以其国际单位制(Système International de Unite,SI)接受的形式来表示。数字范围包括定义范围的数字。本文提供的标题不是对本公开的各个方面的限制,可以通过引用整个说明书来获得本公开的各个方面。据此,通过整体引用说明书更完整地定义了下面直接定义的术语。
如本文所用,“ABC转运蛋白”是指ATP结合盒(“ABC”)转运蛋白。ABC转运蛋白构成了在原核生物和真核生物中发现的膜主体蛋白超家族,其等负责由ATP驱动的许多底物的跨膜运输,从小的无机和有机分子,诸如氨基酸、糖、核苷、维生素和金属簇,到更大的有机化合物,包括肽、脂质分子、寡核苷酸和多糖。ABC转运蛋白通常可以分为“输出蛋白”和“输入蛋白”,但一些ABC转运蛋白可能属于另一组非转运蛋白ABC蛋白。
ABC转运蛋白具有特征结构,通常包括至少四个域:两个嵌入膜中的跨膜域(TMD)和两个核苷酸结合域(NBD)。NBD上的ATP水解驱动TMD的构象改变,导致从膜的内侧和膜的外侧交替通行,以供底物跨膜的单向运输。每个TMD由跨膜α螺旋组成;每个TMD通常具有6至10个跨膜α-螺旋,并且大多数输出蛋白的每个TMD具有6个跨膜α-螺旋。NBD被高度保留。相比之下,产生易位途径的TMD则更加多变,例如,取决于ABC转运蛋白正在转运的底物。
Thomas等人,“Structural and functional diversity calls for a newclassification of ABC transporters,”594FEBS Letters3767-3775(2020)(通过引用全文并入,关于其对于ABC转运蛋白分类系统的描述)描述的一种分类系统,基于ABC转运蛋白的TMD折叠将其分为七种不同的类型,即第I至第VII。该命名系统可以普遍应用,并且基于通过序列分析、同源性建模、X射线晶体学和单粒子低温电子显微镜等信息确定的ABC转运蛋白结构信息。第I型转运蛋白具有以下跨膜螺旋组织:(5-6)+(5-6/8)。第II型转运蛋白具有以下跨膜螺旋组织:10+10。第III型转运蛋白具有以下跨膜螺旋组织:4-8(T)+6-7(S)。第IV型转运蛋白具有以下跨膜螺旋组织:6+6。第V型转运蛋白还具有6+6跨膜螺旋组织,并基于序列相似性和已知的底物特异性进一步定义为ABCG/ABCA/Wzm型。第VI型转运蛋白还具有6+6跨膜螺旋组织,并且基于不同的结构特征进一步定义为LptB2FG型。第VII型转运蛋白具有以下跨膜螺旋组织:4+4。因此,如本文所用,例如,“第IV型”ABC转运蛋白是指在该分类系统下将被分类为第IV型的ABC转运蛋白,“第V型”是指该系统下的第V型转运蛋白,等等。
如本文所用,术语“面外构象”和“面向内的构象”是指ABC转运蛋白的两个跨膜域或区域(TMD)的α-螺旋的构象,其以它们形成跨膜孔的方式包装,该跨膜孔可或从膜的内部区(面向内)或从膜的外部(面向外)通行。例如,在革兰氏阴性细菌细胞中,整合到内膜中的ABC转运蛋白具有孔向细胞质开放的面内向的构象以及孔向周质(在内膜与外膜的间的空间)开放的面外构象。例如,在革兰氏阳性细菌细胞中或在真核细胞中,整合到细胞膜中的ABC转运蛋白具有孔向细胞质开放的面内向的构象以及孔向细胞外部开放的面外构象。在整合到亚细胞的胞器(诸如粒线体)膜中的ABC转运蛋白中,ABC转运蛋白具有面外构象(其中孔向亚细胞的胞器的管腔开放)和面向内的构象(其中孔向细胞质/胞质液开放)。因此,面外构象为其中孔向胞器的管腔开放的构象。
ABC转运蛋白的术语“周质面、细胞外面和/或腔面”是指当转运蛋白处于面外构象时可通行的ABC转运蛋白的表面或区域,这取决于转运蛋白所在的膜。“周质间隙、细胞外隙和/或腔隙”是指由α-螺旋堆积形成的袋或孔,其在蛋白质的面外构象时可通行。在一些情况下,ABC转运蛋白的向外部分面向周质,例如,在革兰氏阴性细菌ABC转运蛋白中,而在其他情况下,它面向细胞外部(例如,细胞外)或面向管腔内,其中ABC转运蛋白位于亚细胞的胞器(例如,管腔)中。因此,如本文所用“周质间隙”是指ABC转运蛋白中的袋或孔,由跨膜域的α-螺旋的堆积形成,其可通行至周质。“细胞外隙(extracellular clef)”是指ABC转运蛋白中的袋或孔,由跨膜域的α-螺旋的堆积形成,其可通行至细胞外部环境。如本文所用,“腔隙(luminal cleft)”是指ABC转运蛋白中的袋或孔,由跨膜域的α-螺旋的堆积形成,其可通行至亚细胞的胞器的管腔诸如粒线体、内质网状体、高基体等。
如本文所用“嵌合ABC转运蛋白”是指一种ABC转运蛋白,其中面向周质面环、细胞外面环或腔面环中的一者或多者以及所讨论的一个或多个环的任一侧上至多50%的跨膜区段由不同ABC转运蛋白的等效区域替换。例如,图1A-B中的示意图示出三个面向周质(或细胞外或管腔)的环,每个环连接两个穿过膜的α螺旋。如本文所用,从不同ABC转运蛋白插入的“等效区域”(也称为“对应区”)当折叠时在蛋白质内处于与从亲本ABC转运蛋白去除的残基相同位置。在一些情况下,可以使用两种蛋白质的序列比对和结构信息来确定ABC转运蛋白中要去除并由来自嵌合ABC转运蛋白的区域替换的区域。
在一些情况下,嵌合ABC转运蛋白由亲本ABC转运蛋白和来自“不同物种的同源基因”的不同ABC转运蛋白形成。如本文所用,该片语表示两个基因为同一基因家族的成员,并且也可以运输相同的分子,诸如代表来自两种不同细菌物种诸如大肠杆菌和另一种革兰氏阴性细菌物种的MsbA蛋白。
如本文所用,术语“革兰氏阴性细菌”是指在采用革兰氏染色法时不保留结晶紫染料的细菌。革兰氏染色为用于一般细菌鉴定的常用方法。在革兰氏染色法中,细菌可以热固定在载玻片上,用结晶紫染料染色,用碘冲洗,用醇或其他有机溶剂脱色,然后用番红复染。革兰氏反应反映了细菌的生化和结构特性的根本性差异。革兰氏阳性细菌保持紫色,因为它们有不易被溶剂穿透的厚细胞壁。革兰氏阴性细菌被脱色是因为它们的细胞壁较薄,可以通过溶剂去除染料。在最后一步,番红将革兰氏阴性细胞染成红色。
如本文所用,术语“革兰氏阳性细菌”是指在采用革兰氏染色法时保留结晶紫染料的细菌。革兰氏染色为用于一般细菌鉴定的常用方法。在革兰氏染色法中,细菌可以热固定在载玻片上,用结晶紫染料染色,用碘冲洗,用醇或其他有机溶剂脱色,然后用番红复染。革兰氏反应反映了细菌的生化和结构特性的根本性差异。革兰氏阳性细菌保持紫色,因为它们有不易被溶剂穿透的厚细胞壁。革兰氏阴性细菌被脱色是因为它们的细胞壁较薄,可以通过溶剂去除染料。在最后一步,番红将革兰氏阴性细胞染成红色。
如本文所用,术语“肽”是指通过肽键连接的五十个或更少氨基酸的链,包括2至50、2至15、2至10、2至8或6至14个氨基酸的氨基酸链。
如本文所用,术语“小分子”是指具有50道尔顿至2500道尔顿的分子量的有机分子。
如本文所用,术语“巨环”或“巨环分子”是指环状大分子或大分子的大分子环状部分。巨环的大小在500道尔顿到2000道尔顿范围内。在本文的一些情况下,巨环是环状肽或肽衍生物。
如本文所用,术语“结合片段”是指预期直接与ABC转运蛋白接触的较大分子的一部分,诸如小分子、肽或抗体。结合片段可用于高通量筛选。
在本公开中,“结合(binds)”或“结合(binding)”或“特异性结合”和类似术语,当是指与ABC转运蛋白或嵌合ABC转运蛋白“结合”时,例如,意指结合亲和力足够强烈,使得结合对成员之间的交互作用不能归因于随机分子结合(即,“非特异性结合”)。因此,该结合是选择性的或特异性的。此结合通常需要100μM或更小的解离常数(K
如本文所用,术语“竞争测定”是指一种测定,其中被测试分子阻止或抑制参考分子与共同标靶的特异性结合。
术语“ATP酶测定”是指用于测量通过蛋白质诸如ABC转运蛋白将ATP转化为ADP的程度的测定。
如本文所用,术语“治疗”以及源自其的词不一定暗示100%或完全治疗。相反,存在不同程度的治疗,包括例如减少至少一种症状或病况,在一些情况下,例如约100%、约90%、约80%、约70%、约60%、约50%、约40%、约30%、约20%或约10%。此外,治疗也包括预防、改善或抑制病症的一种或多种病况或症状,以及延迟病症或其症状的发作。
如本文所用,术语“有效量”或“治疗有效量”是指所施用的本文所公开的分子的足够量,其将在某种程度上缓解所治疗的疾病或病况(例如,感染)的一种或多种症状。
其他定义酌情包括在以下部分中。
II.嵌合ABC转运蛋白
在一些实施例中,本发明包括嵌合ABC转运蛋白。
在一些实施例中,为了制备嵌合ABC转运蛋白,起始材料为特异性ABC转运蛋白(“亲本”ABC转运蛋白)。在一些实施例中,亲本ABC转运蛋白来自真核细胞。在一些实施例中,亲本ABC转运蛋白为人类ABC转运蛋白。在一些实施例中,亲本ABC转运蛋白来自革兰氏阳性细菌。在一些实施例中,亲本ABC转运蛋白来自革兰氏阴性细菌。在一些实施例中,亲本ABC转运蛋白为一种可以嵌入在亚细胞的胞器膜中的转运蛋白。在一些实施例中,亲本ABC转运蛋白是在选自大肠杆菌、阴沟肠杆菌、克雷伯氏肺炎杆菌、绿脓杆菌、耐冷假单胞菌、候选累积杆菌、损蘑菇紫色杆菌、循环硫微螺菌或磁螺旋菌属株-QH-2的特定细菌物种中发现的转运蛋白。在一些实施例中,亲本ABC转运蛋白为MsbA,例如大肠杆菌MsbA。
在一些实施例中,在选择亲本ABC转运蛋白后,鉴定出等效但不同的ABC转运蛋白,在一些实施例中,其来自不同的生物体或物种,从其提取氨基酸序列或区域以便形成具有亲本转运蛋白的嵌合体。在一些情况下,目标为鉴定序列上足够不同的不同ABC转运蛋白,使得与亲本ABC转运蛋白结合的测试分子不会在等效区域与该不同ABC转运蛋白结合,但在其他方面足够相似,以使嵌合体将会正确折叠成正确的架构。在一些实施例中,人们通过搜索与亲本ABC转运蛋白享有20-99%序列同一性的不同ABC转运蛋白来鉴定不同ABC转运蛋白。在一些实施例中,不同ABC转运蛋白来自与被测基因同源的基因,但来自不同的、任选地相关的物种或生物体。例如,在一些情况下,嵌合体可以由来自两种不同细菌物种或属、或来自人和小鼠、或人类和灵长类等物种的同源基因的ABC转运蛋白,诸如来自两种不同细菌物种的MsbA蛋白构建。在一些实施例中,将亲本ABC转运蛋白的三维结构与已知的不同ABC转运蛋白的三维结构进行比较。
在一些实施例中,其中亲本ABC转运蛋白为人类蛋白质,不同ABC转运蛋白来自不同真核物种的同源基因。在一些实施例中,不同ABC转运蛋白来自不同哺乳动物物种的同源基因。在一些实施例中,其中亲本ABC转运蛋白来自革兰氏阳性细菌,不同ABC转运蛋白来自另一种革兰氏阳性细菌,并且任选地来自该其他物种中的同源基因。在一些实施例中,其中亲本ABC转运蛋白来自革兰氏阴性细菌,不同ABC转运蛋白来自革兰氏阴性细菌,并且任选地来自该其他物种中的同源基因。在一些实施例中,亲本ABC转运蛋白和不同ABC转运蛋白选自两个不同的物种,该物种选自:大肠杆菌、阴沟肠杆菌、克雷伯氏肺炎杆菌、绿脓杆菌、耐冷假单胞菌、候选累积杆菌、损蘑菇紫色杆菌、循环硫微螺菌和磁螺菌属株-QH-2。在一些实施例中,嵌合ABC转运蛋白包含选自真核细胞、革兰氏阳性细菌、革兰氏阴性细菌、大肠杆菌、阴沟肠杆菌、克雷伯氏肺炎杆菌、绿脓杆菌、耐冷假单胞菌、候选累积杆菌、损蘑菇紫色杆菌、循环硫微螺菌和磁螺菌属株-QH-2的亲本ABC嵌合转运蛋白,和/或MsbA以及选自真核细胞、革兰氏阳性细菌、革兰氏阴性细菌、大肠杆菌、阴沟肠杆菌、克雷伯氏肺炎杆菌、绿脓杆菌、耐冷假单胞菌、候选累积杆菌、损蘑菇紫色杆菌、循环硫微螺菌和磁螺菌属株-QH-2的不同ABC转运蛋白的区域,和/或MsbA。
在一些实施例中,选择与亲本ABC转运蛋白相同类型的不同ABC转运蛋白可能是有利的,如Thomas等人“Structural and functional diversity calls for a newclassification of ABC transporters,”594FEBS Letters 3767-3775(2020)(通过引用全文并入,关于其对于ABC转运蛋白分类系统的描述)中的分类系统所定义,基于ABC转运蛋白的跨膜域(TMD)折叠将其分为七种不同的类型,即第I至第VII。例如,在一些实施例中,亲本ABC转运蛋白为第I型ABC转运蛋白,并且不同ABC转运蛋白为第I型ABC转运蛋白。在一些实施例中,亲本ABC转运蛋白为第II型ABC转运蛋白,并且不同ABC转运蛋白为第II型ABC转运蛋白。在一些实施例中,亲本ABC转运蛋白为第III型ABC转运蛋白,并且不同ABC转运蛋白为第III型ABC转运蛋白。在一些实施例中,亲本ABC转运蛋白为第IV型ABC转运蛋白,并且不同ABC转运蛋白为第IV型ABC转运蛋白。在一些实施例中,亲本ABC转运蛋白为第V型ABC转运蛋白,并且不同ABC转运蛋白为第V型ABC转运蛋白。在一些实施例中,亲本ABC转运蛋白为第IV型ABC转运蛋白,并且不同ABC转运蛋白为第IV型ABC转运蛋白。在一些实施例中,亲本ABC转运蛋白为第VII型ABC转运蛋白,并且不同ABC转运蛋白为第VII型ABC转运蛋白。
ABC转运蛋白具有特征结构,通常包括至少四个域:两个嵌入膜中的跨膜域(TMD)(跨膜区段可以为TMD的一部分)和两个核苷酸结合域(NBD)。每个TMD由跨膜α螺旋组成;每个TMD通常具有6至10个跨膜α-螺旋,并且大多数输出蛋白的每个TMD具有6个跨膜α-螺旋。在一些实施例中,ABC转运蛋白具有当分子处于面外构象时面向周质、细胞外或管腔空间内的环,以及连接到此类环的任一侧的跨膜区段。(参见图1A-1C。)在一些实施例中,转运蛋白具有三个此类环。在一些实施例中,转运蛋白具有六个此类环。
图1A示出来自大肠杆菌的ABC转运蛋白的图示。TMD为穿过膜区域的氨基酸链的部分——其通常为α螺旋。图示中的六个TMD经标记为1到6。该图示还示出膜的周质侧的环和膜的细胞质侧的环。这些环各自具有连接至TMD的第一端、连接至TMD的第二端和伸入周质或细胞质中的部分。所示的ABC转运蛋白具有三个面向周质的环(例如,环1、2和3,对应于MsbA的环1、3和5(并且MsbA的环2、4和6面向细胞质))。矩形框指示可以由来自不同ABC转运蛋白的等效区域取代的区域,即至少一个面向周质的环,或全部三个环,以及至多50%的TMD区段。
图1B示出来自人类ABC转运蛋白ABCD4的ABC转运蛋白的图示。图示中的六个TMD经标记为1到6。该图示还示出膜的细胞外侧的环和膜的胞质液侧的环。在图示中,细胞外侧的环经标记为l到3。矩形框指示可以由来自不同ABC转运蛋白的等效区域取代的区域。
图1C示出来自人类ABC转运蛋白ABCC1的ABC转运蛋白的图示。该ABC转运蛋白的结构不同于大肠杆菌和人类ABCD4的ABC转运蛋白,还显示于图1A和1B中,但存在许多相同的鉴定特征。例如,存在细胞外环,但并非如ABCD4中的三个细胞外环,而是六个细胞外环,在图示中经标记为1到6。同样,存在十二个TMD,在图示中经标记为1到12。矩形框指示可以由来自不同ABC转运蛋白的等效区域取代的区域。
在图1A-C中的三个图示的每一者中,矩形框指示可以由来自不同ABC转运蛋白的等效区域取代的区域。在一些实施例中,在嵌合体中经替换的环的任一侧上至多50%、0-50%、10-50%、25-50%、0-10%、0-25%或10-25%的TMD也被替换。在一些实施例中,本公开包括嵌合ABC转运蛋白,其中至少一个面向周质面环、细胞外面环或腔面环以及该环任一侧上至多50%(即,50%、0-50%、10-50%、25-50%、0-10%、0-25%或10-25%)的跨膜区段由不同ABC转运蛋白的等效区域替换。在一些实施例中,本发明包括嵌合ABC转运蛋白,其中至少一个面向周质面环、细胞外面环或腔面环以及该环任一侧上50%的跨膜区段由不同ABC转运蛋白的等效区域替换。在一些实施例中,本发明包括嵌合ABC转运蛋白,其中至少一个面向周质面环、细胞外面环或腔面环以及该环任一侧上至多25%的跨膜区段由不同ABC转运蛋白的等效区域替换。在一些实施例中,本发明包括嵌合ABC转运蛋白,其中至少一个面向周质面环、细胞外面环或腔面环以及该环任一侧上至多10%的跨膜区段由不同ABC转运蛋白的等效区域替换。在一些实施例中,本发明包括嵌合ABC转运蛋白,其中两个或更多个、或全部面向周质面环、细胞外面环或腔面环以及每个环任一侧上至多50%(即,50%、0-50%、10-50%、25-50%、0-10%、0-25%或10-25%)的跨膜区段由不同ABC转运蛋白的等效区域替换。
在一些实施例中,当可用时,可以基于来自蛋白质数据库(PDB)的可用实验结构模板来预测亲本ABC转运蛋白和不同ABC转运蛋白中的环和跨膜区段的位置(即,边界);或者,可替代地,通过使用最接近的可用PDB结构模板以及标准同源建模方法和软体(即Swiss-Modell、Phyre2、MOE)。在一些实施例中,在合适的PDB模板不存在下,也可使用标准数据库或算法(即Uniprot、TMHMM伺服器等)来预测亲本ABC转运蛋白以及不同ABC转运蛋白中的环和跨膜区段的位置(即,边界)。
在一些实施例中,一旦鉴定了ABC转运蛋白和不同ABC转运蛋白以以及每一者中至少一个环和/或跨膜区段的位置,ABC转运蛋白的区域即可由来自该不同ABC转运蛋白的区域替换以创建嵌合ABC转运蛋白。在一些实施例中,例如,如果来自ABC转运蛋白的区域为环1,则来自不同ABC转运蛋白的等效区域也为环1。在一些实施例中,例如,如果来自ABC转运蛋白的区域为跨膜区段/TMD 1的25%,则来自不同ABC转运蛋白的等效区域也为跨膜片段/TMD 1的25%。
在一些实施例中,其中ABC转运蛋白为MsbA,嵌合ABC转运蛋白包含EcMsbA(在Uniprot P60752可获得的氨基酸序列),其中周质面环1(L1)中的EcMsbA残基Leu47-Pro68、周质面环3(L3)中的EcMsbA残基Met159-Leu171、周质面环5(L5)中的EcMsbA残基Ala262-Ile292中的一者或多者由耐冷假单胞菌的等效区域(PpMsbA;Uniprot A0A1G5PEL0)替换。(此处的环命名法同时考虑周质面环和细胞质面环,其中L1、L3和L5面向周质,L2、L4和L6面向细胞质。因此,EcMsbA的L1、L3和L5等效于图1A中所示的环1、2和3。)序列基于大肠杆菌蛋白质的氨基酸序列,其登录号为Uniprot P60752(参见www(dot)uniprot(dot)org entryP60752),通过引用并入本文。还参见本文的序列表(表7)。
在一些实施例中,嵌合ABC转运蛋白包含EcMsbA,其中周质面环1(L1,EcMsbA残基Leu47-Pro68)、周质面环3(L3,EcMsbA残基Met159-Leu171)以及周质面环5(L5,EcMsbA残基Ala262-Ile292)由候选累积杆菌属SK-12的等效区域(CaMsbA;Uniprot A0A011NLL4)替换。
在一些实施例中,嵌合ABC转运蛋白包含EcMsbA,其中周质面环1(L1)中的EcMsbA残基Leu47-Pro68、周质面环3(L3)中的EcMsbA残基Met159-Leu171以及周质面环5(L5)中的EcMsbA残基Ala262-Ile292中的一者或多者由损蘑菇紫色杆菌的等效区域(JaMsbA;Uniprot A0A3G2E7N4)替换。
在一些实施例中,嵌合ABC转运蛋白包含EcMsbA,其中周质面环1(L1)中的EcMsbA残基Leu47-Pro68、周质面环3(L3)中的EcMsbA残基Met159-Leu171以及周质面环5(L5)中的EcMsbA残基Ala262-Ile292中的一者或多者由来自菌株DSM 14477的循环硫微螺菌的等效区域(TcMsbA;Uniprot F6DCY0)替换。
在一些实施例中,嵌合ABC转运蛋白包含,周质面环1(L1)中的EcMsbA残基Leu47-Pro68、周质面环3(L3)中的EcMsbA残基Met159-Leu171以及周质面环5(L5)中的EcMsbA残基Ala262-Ile292由磁螺菌属株-QH-2的等效区域(MqMsbA;Uniprot W6KCN7)替换。
III.使用嵌合ABC转运蛋白的筛选方法
本公开尤其涵盖使用如上所述的该蛋白质的嵌合形式来鉴定与特定ABC转运蛋白的周质面、细胞外面和/或腔面结合的分子的方法。在一些情况下,这些方法鉴定了与蛋白质的周质间隙、细胞外隙和/或腔隙结合的分子。
在一些实施例中,这些方法包括确定测试分子是否与亲本ABC转运蛋白的周质面、细胞外面和/或腔面结合,其包括:(a)提供嵌合ABC转运蛋白,如上所述,其中亲本ABC转运蛋白的周质面、细胞外面和/或腔面的一个或多个区域由不同ABC转运蛋白的周质面、细胞外面和/或腔面的一个或多个等效区域取代;以及(b)使嵌合ABC转运蛋白接触与面外构象的亲本ABC转运蛋白结合的测试分子,其中如果测试分子不与嵌合ABC转运蛋白结合,则将测试分子确定为与亲本ABC转运蛋白的周质面、细胞外面和/或腔面结合。
在一些情况下,首先测试一个分子以确定其是否与面外构象的亲本ABC转运蛋白结合,例如,通过(a)将亲本ABC转运蛋白捕集于面外构象,然后(b)选择在完成上述步骤之前与面外构象的亲本ABC转运蛋白结合的测试分子。因此,在该选择之后,该方法包括:(c)提供嵌合ABC转运蛋白,如上所述,其中亲本ABC转运蛋白的周质面、细胞外面和/或腔面的一个或多个区域由不同ABC转运蛋白的周质面、细胞外面和/或腔面的一个或多个等效区域取代;以及(d)使嵌合ABC转运蛋白接触(b)的与面外构象的亲本ABC转运蛋白结合的测试分子,其中如果测试分子不与嵌合ABC转运蛋白结合,则将测试分子确定为与ABC转运蛋白的周质面、细胞外面和/或腔面结合。在这些方法的任一者中,在一些实施例中,这些方法进一步包含在使嵌合ABC转运蛋白接触测试分子之前将嵌合ABC转运蛋白捕集于面外构象。在上述方法中,可以通过用Mg
例如,这些基本步骤也在图6中说明。如图6所示,ABC转运蛋白具有面内和面外两种构象。先前鉴定的ABC转运蛋白结合剂,诸如喹啉类中的那些与面向内的构象结合,如图6左起第二屏所示。如本文所述,转运蛋白也可通过用诸如Mg
在一些实施例中,该方法在测试分子或ABC转运蛋白经固定诸如在珠粒或基质平台上的情况下进行。在一些情况下,亲本ABC转运蛋白和/或嵌合ABC转运蛋白经固定在珠粒或基质平台上,诸如使用生物素/链霉抗生物素子或类似的试剂组。在使用珠进行固定的情况下,它们可以具有任何形状,诸如薄片或碎片、球体、丸粒等。基质可以由珠粒或更小的颗粒组成,并且可以是例如浆液或凝胶,其继而可以放置在板或晶片诸如微孔板等上。在一些实施例中,基质或珠粒用链霉抗生物素蛋白、抗生物素蛋白或去糖基化抗生物素蛋白包被。在一些实施例中,珠粒为磁性珠粒,例如,以在通过使用磁性仪器的测定期间促进其的收集。例如,在一些情况下,蛋白质可以经生物素化,然后暴露于经链霉抗生物素蛋白包被的基质或珠粒,因此允许蛋白质变为接附在基质或珠粒上。
在本文的某些测定中,诸如其中亲本和/或嵌合ABC转运蛋白经固定而测试分子处于溶液中的那些测定中,经确定为与特定转运蛋白结合的分子可以鉴定为在孵育并洗涤经固定的转运蛋白后在这些测定条件下保持与该经固定的转运蛋白结合,并且因此在添加洗脱缓冲液后从蛋白质结合的基质或珠粒洗脱。在测定中不与特定转运蛋白结合的分子可以鉴定为在添加洗脱缓冲液时未经洗脱(例如,超过痕量含量),并且因此在洗涤该蛋白质结合的基质或珠粒后从经固定的蛋白质中去除。
在一些实施例中,亲本ABC转运蛋白或嵌合ABC转运蛋白溶解在模拟生物膜的洗涤剂或类似分子中,以使其维持适当的折叠并维持形成正确的面外构象的能力。用于溶解ABC转运蛋白和/或嵌合ABC转运蛋白的示例性洗涤剂或相关分子或系统包括月桂基麦芽糖新戊二醇(LMNG),以及,在一些实施例中,0.02% LMNG,以及十二烷基-β-D-麦芽糖苷(DDM),brij-35、乙二醇-薯蓣皂苷元、洋地黄皂苷、两亲物(amphiphol)诸如两亲物A8-35和脂质奈米盘。例如,洗涤剂可以溶解转运蛋白以使其稳定,而两亲物可以有效地包裹蛋白质的疏水部分以使其稳定,并且蛋白质也可经稳定在由脂质奈米盘创建的脂质双层中。
在一些实施例中,筛选测试分子文库。该文库可以与基质或珠粒上的嵌合ABC转运蛋白接触,然后用洗涤缓冲液洗涤至少一次以去除非结合分子。然后洗脱并分析经结合的测试分子。与相关的处于其面外构象的嵌合ABC转运蛋白相比,优先与面外构象的ABC转运蛋白结合的分子可以鉴定为与ABC转运蛋白的周质面、细胞外面和/或腔面结合,因为那些区域在嵌合ABC转运蛋白中为经突变。
在一些实施例中,对在上述筛选中选择的分子进行进一步实验,例如以确定它们对于亲本ABC转运蛋白和嵌合ABC转运蛋白中的每一者的结合亲和力,并确定它们如何影响ABC转运蛋白的功能。因此,例如,在一些实施例中,进行ATP酶测定以确定在经鉴定的分子存在下ABC转运蛋白的ATP到ADP活性。在一些实施例中,与ABC转运蛋白的周质面、细胞外面和/或腔面结合的经鉴定分子可以用作ABC转运蛋白的ATP酶活性的抑制剂。ATP酶测定为本领域中已知的并且各种商业试剂盒可用,诸如Tanscreener ADP2测定(BellBrook Labs,目录号#3010-1K)和Molecular Probes ATP确定试剂盒(Thermofisher,目录号#A22066)。
在一些实施例中,可以确定经鉴定的分子对于亲本ABC转运蛋白和/或嵌合ABC转运蛋白的结合亲和力。在一些情况下,这可以在类似于初始筛选中使用的ELISA测定中完成,以获得例如IC
在一些实施例中,可以进行一种或多种功能测定以测试在筛选中经鉴定的分子在亲本ABC转运蛋白功能上的效应。例如,在一些情况下,与ABC转运蛋白的周质面、细胞外面和/或腔面结合的分子用作转运蛋白的抑制剂。例如,如果抑制ABC转运蛋白活性预期会导致细胞活力丧失或细胞生长减少,例如,则可以执行细胞活力或生长测定以确定经鉴定的分子的存在是否影响这些参数。在一些情况下,可以执行其他测定以确定分子对于转运蛋白功能的影响。在一些情况下,可以测试转运蛋白底物在该分子存在和不存在下的转运。例如,在以下实例中测试的MsbA的情况下,根据电子显微镜(EM)分析,发现某些结合分子减缓了蛋白质的LPS运输。缺乏LPS运输会造成细菌细胞表面处的内膜和外膜叠堆,通过EM可以清楚地看到该叠堆。例如,参见图3E。用于所讨论的ABC转运蛋白的适当功能测定为已知的或可以基于本领域的知识容易地开发。
IV.用于筛选方法的测试分子
在一些实施例中,本公开包括测试特定类型的分子的筛选方法,以及通过本文所述的任何筛选方法鉴定的与特定ABC转运蛋白的周质面、细胞外面和/或腔面或裂隙结合的分子。在一些情况下,经鉴定的分子不与筛选方法中所使用的嵌合ABC转运蛋白结合,但与嵌合体所基于的亲本ABC转运蛋白结合。在一些情况下,经鉴定的分子与亲本ABC转运蛋白的结合亲和力至少比筛选中所使用的嵌合ABC转运蛋白紧密10倍。在一些情况下,经鉴定的分子与亲本ABC转运蛋白的结合亲和力至少比筛选中所使用的嵌合ABC转运蛋白紧密100倍。在一些情况下,经鉴定的分子与亲本ABC转运蛋白的结合亲和力至少比筛选中所使用的嵌合ABC转运蛋白紧密1000倍。
在一些实施例中,待测试的分子为肽。在一些实施例中,肽是6-14-mer肽,诸如6-12-mer、6-10-mer、6-8-mer、8-12-mer、8-10-mer等。在一些实施例中,肽是14-mer。参见表3和图3F。在一些实施例中,肽是6-10mer。在一些实施例中,肽是8-10mer。在一些实施例中,肽是6-8mer。在一些实施例中,肽是8-mer。参见图3E和3G-L以及表5。在一些实施例中,肽是3-40-mer、3-20-mer、4-16-mer、4-14-mer或6-14-mer,诸如3-mer、4-mer、5-mer、6-mer、7-mer、8-mer、9-mer、10-mer、11-mer、12-mer、13-mer、14-mer、15-mer、16-mer、17-mer、18-mer、19-mer、20-mer、21-mer、22-mer、23-mer、24-mer、25-mer、26-mer、27-mer、28-mer、29-mer、30-mer、31-mer、32-mer、33-mer、34-mer、35-mer、36-mer、37-mer、38-mer、39-mer或40-mer。
在一些实施例中,肽是巨环。在一些实施例中,巨环是6-14-mer巨环,诸如6-12-mer、6-10-mer、6-8-mer、8-12-mer、8-10-mer等。在一些实施例中,巨环是14-mer巨环。参见表3和图3F。在一些实施例中,巨环是6-10-mer巨环。在一些实施例中,巨环是8-10-mer巨环。在一些实施例中,巨环是6-8-mer巨环。在一些实施例中,巨环是8-mer巨环。参见图3E和3G-L以及表5。在一些实施例中,巨环是3-40-mer、3-20-mer、4-16-mer、4-14-mer或6-14-mer,诸如3-mer、4-mer、5-mer、6-mer、7-mer、8-mer、9-mer、10-mer、11-mer、12-mer、13-mer、14-mer、15-mer、16-mer、17-mer、18-mer、19-mer、20-mer、21-mer、22-mer、23-mer、24-mer、25-mer、26-mer、27-mer、28-mer、29-mer、30-mer、31-mer、32-mer、33-mer、34-mer、35-mer、36-mer、37-mer、38-mer、39-mer或40-mer巨环。在一些实施例中,巨环具有至少一个亲脂侧链和至少一个带正电荷的侧链。
在一些实施例中,本文筛选中待测试的分子是小分子。在一些实施例中,待测试的分子是抗体,其不仅可以包括任何IgG、IgM、IgA、IgD和IgE的全长抗体,而且可以包括抗体的抗原结合片段,诸如Fv,Fab'、(Fab')2、scFv等、奈米抗体、单链抗体、双特异性或多特异性抗体。
在一些实施例中,待测试的分子是肽的结合片段、小分子的结合片段或抗体的结合片段(例如,抗原结合片段)。
本文也涵盖在用于大肠杆菌MsbA结合剂的筛选中鉴定的特定巨环。在一些实施例中,巨环为G1118,其为14-mer巨环。参见图3F、4A-D和6-。G1118经鉴定为与大肠杆菌MsbA结合,例如,在与imp大肠杆菌菌株(其中外膜为可渗透)中的MsbA结合的IC
所测试的巨环肽活化剂包括14-mer G1118(SEQ ID NO:1或2),以及巨环肽G1119(ClAc-FWWLWSDMeGDWWMeFVC-NH2;SEQ ID NO:10)和G1122(ClAc-FRYLWMeAWGLVWDNC-NH2;SEQ ID NO:11)和8-mer G1365(SEQ ID NO:3)。
在一些实施例中,本文的筛选中鉴定的分子以20μM或更小的K
在一些实施例中,经鉴定为与特定ABC转运蛋白结合的分子可以在用于筛选其他测试分子的测定中用作阳性对照或竞争物。例如,在一些方法中,通过确定分子与已知与ABC转运蛋白的周质、细胞外或管腔面或裂隙结合的分子竞争,将该分子鉴定为与同一ABC转运蛋白的周质面、细胞外面或腔面或裂隙结合。例如,在大肠杆菌MsbA的情况下,巨环G1118和G1365以及G1119和G1122可在测定中用作竞争剂或阳性对照,以寻找额外的结合剂。在一些此类实施例中,筛选可以鉴定与G1118、G1119和/或G1122竞争结合在捕集于面外构象(诸如通过Mg
在一些实施例中,14-mer巨环肽可包含如下序列:ClacF-X1-X2-L-X3-X4-D-X5-X6-X7-X8-MeF-V-C,其中:X1为W、V或Y;X2为W或Y;X3为W或Y;X4为S、D、V或H;X5为N,其中N选自除C以外的任何天然氨基酸,或选自Bph((S)-3-([1,1'-联苯]-4-基)-2-氨基丙酸)、多巴(L-3,4-二羟基苯丙氨酸)、MeF(N-甲基-L-苯丙氨酸)和MeG(N-甲基-L-甘氨酸)的非天然氨基酸;X6为Y、K、A、S、D、R或V;X7为W、Y或Bph;并且X8为W或Y;任选地,其中肽在C末端的C残基之后进一步包含G残基,并且其中ClacF为N-氯乙酰基L-苯丙氨酸,Bph为(S)-3-([1,1'-联苯]-4-基)-2-氨基丙酸,多巴为L-3,4-二羟基苯丙氨酸,MeF为N-甲基-L-苯丙氨酸,并且MeG为N-甲基-L-甘氨酸。在一些情况下,X1为W或Y。在一些情况下,X1为W。在一些情况下,X2为W。在一些情况下,X3为W。在一些情况下,X4为S、D、V或H。在一些情况下,X4为D。在一些情况下,X5为V、D、H、G或Y。在一些情况下,X5为V或H。在一些情况下,X5为V。在一些情况下,X6为D或S。在一些情况下,X6为S。在一些情况下,X7为W。在一些情况下,X8为W。在一些上述实施例中,巨环由于ClacF的N-末端氯乙酰基与C残基的巯基之间的硫醚键联而环化。
在一些实施例中,8-mer巨环肽可包含如下序列:ClacF-X1-Y-Bph-MeF-X2-V-C,其中:X1为V、S、Y、W、多巴、L、V、A、R、K或D;并且X2为R、V、多巴或Y;其中ClacF为N-氯乙酰基L-苯丙氨酸,Bph为(S)-3-([1,1'-联苯]-4-基)-2-氨基丙酸,多巴为L-3,4-二羟基苯丙氨酸,并且MeF为N-甲基-L-苯丙氨酸。在一些情况下,X1为S、Y、L、V、A、R、K或D。在一些情况下,X1为V或Y。在一些情况下,X1为V。在一些情况下,X2为R或Y。在一些情况下,X2为R。在一些实施例中,巨环由于ClacF的N-末端氯乙酰基与C残基的巯基之间的硫醚键联而环化。
在其他情况下,巨环具有G1118、G1119或G1122(SEQ ID Nos:1或2(对于G1118),10(G1119),或11(G1122))的序列。在又其他情况下,巨环具有G1365(SEQ ID NO:3)的序列。
在一些实施例中,肽或巨环结合至另一分子,诸如抗生素或抗微生物剂,任选地其中结合为在该序列的C-末端氨基酸残基处。在一些此类情况下,抗生素或抗微生物剂为多黏菌素,诸如多黏菌素B或多黏菌素E。
V.分子复合物
在一些实施例中,本公开包括分子复合物,该分子复合物包含与分子(诸如肽、小分子、抗体,或者肽、小分子或抗体的结合片段)结合的如本文所述的ABC转运蛋白。在一些实施例中,本发明包括分子复合物,该分子复合物包含ABC转运蛋白和巨环,在一些实施例中,该巨环为6-14-mer、6-10-mer、6-8-mer或8-10-mer巨环。在一些实施例中,分子以20μM或更小、10μM或更小、20nM或更小、500nM或更小、1nM或更小、1至20μM、10至20μM、1nM至20μM、和/或1nM至500nM的K
在一些实施例中,该分子是肽。在一些实施例中,肽是6-14-mer肽,诸如6-12-mer、6-10-mer、6-8-mer、8-12-mer、8-10-mer等。在一些实施例中,肽是14-mer。参见表3和图3F。在一些实施例中,肽是6-10mer。在一些实施例中,肽是8-10mer。在一些实施例中,肽是6-8mer。在一些实施例中,肽是8-mer。参见图3E和3G-L以及表5。在一些实施例中,肽是3-40-mer、3-20-mer、4-16-mer、4-14-mer或6-14-mer,诸如3-mer、4-mer、5-mer、6-mer、7-mer、8-mer、9-mer、10-mer、11-mer、12-mer、13-mer、14-mer、15-mer、16-mer、17-mer、18-mer、19-mer、20-mer、21-mer、22-mer、23-mer、24-mer、25-mer、26-mer、27-mer、28-mer、29-mer、30-mer、31-mer、32-mer、33-mer、34-mer、35-mer、36-mer、37-mer、38-mer、39-mer或40-mer。
在一些实施例中,肽是巨环。在一些实施例中,巨环是6-14-mer巨环,诸如6-12-mer、6-10-mer、6-8-mer、8-12-mer、8-10-mer等。在一些实施例中,巨环是14-mer巨环。参见表3和图3F。在一些实施例中,巨环是6-10-mer巨环。在一些实施例中,巨环是8-10-mer巨环。在一些实施例中,巨环是6-8-mer巨环。在一些实施例中,巨环是8-mer巨环。参见图3E和3G-L以及表5。在一些实施例中,巨环是3-40-mer、3-20-mer、4-16-mer、4-14-mer或6-14-mer,诸如3-mer、4-mer、5-mer、6-mer、7-mer、8-mer、9-mer、10-mer、11-mer、12-mer、13-mer、14-mer、15-mer、16-mer、17-mer、18-mer、19-mer、20-mer、21-mer、22-mer、23-mer、24-mer、25-mer、26-mer、27-mer、28-mer、29-mer、30-mer、31-mer、32-mer、33-mer、34-mer、35-mer、36-mer、37-mer、38-mer、39-mer或40-mer巨环。在一些实施例中,巨环具有至少一个亲脂侧链和至少一个带正电荷的侧链。
在一些实施例中,复合物中的该分子是小分子。在一些实施例中,该分子是抗体,其不仅可以包括任何IgG、IgM、IgA、IgD和IgE的全长抗体,而且可以包括抗体的抗原结合片段,诸如Fv,Fab'、(Fab')2、scFv等、奈米抗体、单链抗体、双特异性或多特异性抗体。
在一些实施例中,该分子是肽的结合片段、小分子的结合片段或抗体的结合片段(例如,抗原结合片段)。
在一些实施例中,复合物中的该分子为G1118、G1365、G1119或G1122。在一些实施例中,复合物中的该分子与巨环G1118、G1119和/或G1122竞争结合ABC转运蛋白诸如大肠杆菌MsbA的周质面,例如,当通过用Mg
Ⅵ.用途
在一些实施例中,ABC转运蛋白为细菌ABC转运蛋白。例如,在一些情况下,细菌ABC转运蛋白为抗生素的潜在标靶,例如,由于与哺乳动物ABC转运蛋白的序列同源性相对较低。在一些情况下,细菌ABC转运蛋白为来自细菌物种或病原体的MsbA转运蛋白。在一些情况下,本文的筛选方法可用于鉴定抑制细菌ABC转运蛋白的分子。此类分子可能具有抗生素活性。例如,发现本文所述的巨环G1118和G1365各自抑制大肠杆菌MsbA的LPS运输活性并且也抑制细胞生长。因此,本公开也涵盖在本文的筛选中鉴定的针对细菌ABC转运蛋白的分子在治疗个体的感染诸如细菌感染中的用途。
Ⅶ.试剂盒
本公开也包括包含与本文的筛选方法相关的试剂的试剂盒。在一些情况下,试剂盒包含嵌合ABC转运蛋白。在一些情况下,试剂盒包含用于本文的筛选方法的试剂,具有或不具有特定的嵌合ABC转运蛋白。在一些情况下,试剂盒包含亲本(非嵌合)ABC转运蛋白。
在一些实施例中,本文的试剂盒可包含接附至基质的亲本或嵌合ABC转运蛋白。在一些实施例中,本文的试剂盒可包含接附至基质颗粒诸如珠粒的ABC转运蛋白。此类珠可以具有任何形状,诸如薄片或碎片、球体、丸粒等。在一些实施例中,此类珠为经链霉抗生物素蛋白包被的珠粒、经抗生物素蛋白包被的珠粒或经去糖基化的抗生物素蛋白包被的珠粒。在一些实施例中,此类珠是磁珠。ABC转运蛋白可以或可以不预先接附至基质。在一些实施例中,包括试剂以促进ABC转运蛋白接附至珠粒或接附至基质,诸如通过生物素-链霉抗生物素蛋白或类似系统。
在一些实施例中,试剂盒可包含与本文的筛选方法相关的试剂。在一些实施例中,试剂盒可包括用于确定测试分子是否与ABC转运蛋白的周质面、细胞外面和/或腔面结合的必要试剂中的一些或全部。试剂盒可包含例如一种或多种用于溶解ABC转运蛋白和/或嵌合ABC转运蛋白的洗涤剂。用于溶解ABC转运蛋白和/或嵌合ABC转运蛋白的示例性洗涤剂或相关分子或系统包括月桂基麦芽糖新戊二醇(LMNG),以及,在一些实施例中,0.02% LMNG,以及十二烷基-β-D-麦芽糖苷(DDM),brij-35、乙二醇-薯蓣皂苷元、洋地黄皂苷、两亲物(amphiphol)诸如两亲物A8-35和脂质奈米盘。试剂盒可包含例如ATP、Mg2+、钒酸盐和/或正钒酸钠,或将ABC转运蛋白捕集于面外构象的其他试剂。试剂盒可包含例如一种或多种洗涤缓冲液。在一些实施例中,洗涤缓冲液可包含Tris、MgCl
在一些实施例中,试剂盒可包含测试分子或测试分子文库,诸如肽、小分子和/或抗体。在一些实施例中,试剂盒中的肽可以是巨环。在一些实施例中,试剂盒可包含测试分子,这些测试分子是肽、小分子或抗体的结合片段。试剂盒也可包括对照分子,诸如已知与特定ABC转运蛋白的周质面、细胞外面和/或腔面结合的阳性对照,或不在该位置处结合或者与嵌合ABC转运蛋白结合而非与其亲本ABC转运蛋白结合的阴性对照。
试剂盒可包含例如用于检测结合的检测试剂。试剂盒也可包含对照分子和待与对照分子一起使用的试剂。
在一些实施例中,试剂盒也可包括使用说明。
实例
以下是本公开的方法和组成物的实例。应理解,这些实例并非旨在限制本公开,而仅用于举例说明,并且在给出以上提供的一般描述的情况下可以实施各种其他实施例。
简介
MsbA为革兰氏阴性细菌中必不可少的ATP结合盒(ABC)转运蛋白,其负责将脂多糖(LPS)翻转穿过内膜(IM)以供随后转运至细胞表面。结构研究已经定义了MsbA传输LPS的交替通行机制,但如何实现底物选择性尚不清楚。apo MsbA的先前结构表明面向内的构象,其中LPS结合在中央前庭中,与庞大的磷脂双层隔离。在这个经封装的位置,LPS由保留碱性残基的环配位,并且全部酰基链都封闭在疏水腔中。
用经纯化的WTEcMsbA进行无偏高通量筛选。通过监测MsbA ATP酶活性,发现喹啉和二苯甲酮类抑制剂通过靶向暴露于膜的结合位点来捕集面向内的构象。虽然这些工作证实MsbA为潜在的抗菌标靶,但由于两个小分子系列的高亲脂性和不良的生理化学特性,其无一取得进展。值得注意的是,迄今为止已在结构上表征的ABC转运蛋白的小分子调节剂全部也与面向内的状态结合,这增加了传统药物发现方法固有地偏向这些面向内的状态的可能性。因此,MsbA运输周期的任何状态是否允许药物发现是一个根本性的悬而未决的问题。
为了克服与靶向MsbA中疏水性、膜嵌入结合位点相关的挑战,设计了一种新抑制剂发现策略。针对MsbA的周质面上的溶剂可通行区域,以便发现具有改善的生理化学特性的抑制剂。值得注意的是,MsbA运输循环的一个关键方面为从面向内的状态到面向外的状态的显著转变,这使周质暴露出大的溶剂可通行的裂隙(图6,屏1)。在生化条件下,MsbA可捕集于面外构象中,该构象可以使该周质间隙稳定,以用于发现潜在抑制剂。Id和图3A。为了使选择偏向暴露于溶剂的周质间隙,采用了使用MsbA嵌合体的反选择策略,在该嵌合体中,跨膜区段的周质面由来自遥远相关ABC转运蛋白的序列整体替换(图3A和9A-12B,以及实例7)。在多轮富集筛选之后,G1118和G1365经鉴定为两种与MsbA结合的巨环化合物。G1118和G1365在它们与MsbA的结合中具有选择性和状态依赖性,并表达出有效的生化和表达型活性。这些与MsbA复合物的巨环的高解析度结构定义了它们的状态依赖性抑制的分子基础,并代表了第一个已知的靶向ABC转运蛋白中面向外的裂隙的拮抗剂。因此,我们的策略为开发MsbA的选择性调节剂和其他具有挑战性的药物标靶提供了一个模板。
实例1:用于制备和表达嵌合MsbA转运蛋白的材料和方法
a.嵌合蛋白的设计
来自大肠杆菌(Escherichia coli(E.coli))MsbA(EcMsbA;UniProtKB:P60752)的野生型MsbA转运蛋白序列用于BLAST搜索以鉴定其他革兰氏阴性细菌物种中的同源蛋白。通过反覆多轮的BLAST搜索,选择与EcMsbA具有约40%的整体序列同一性的候选MsbA转运蛋白,包括处于周质面环区域内,以供进一步考虑。然后手动分析推定的MsbA同源物的多序列比对和结构同源模型(SWISSPROT),以选择用于后续嵌合构建体工程的候选者。基于这些分析,选择来自以下革兰氏阴性细菌株的推定的MsbA转运蛋白用于与EcMsbA的嵌合:耐冷假单胞菌(Pseudomonas psychrotolerans)(PpMsbA)、候选累积杆菌(CandidatusAccumulibacter)(CaMsbA)、损蘑菇紫色杆菌(Janthinobacteriumagaricidamnosum)(JaMsbA)、循环硫微螺菌(Thiomicrospira cyclica)(TcMsbA)和磁螺菌属(Magnetospira)株-QH-2(MqMsbA)。为了生成嵌合体,用推定的MsbA同源物的等效区域同时替换周质面环1(L1,EcMsbA残基Leu47-Pro68)、周质面环3(L3,EcMsbA残基Met159-Leu171)和周质面环5(L5,EcMsbA残基Ala262-Ile292)的对应序列,生成嵌合构建体(图10A)。
合成了五种嵌合构建体(Genscript)并克隆到pET-52b表达载体(EMD Millipore)中,该载体经修饰以进行限制非依赖性克隆。然后通过使用大肠杆菌宿主Rosetta 2(DE3;EMD Millipore)在17℃自诱导发酵64小时来过表达嵌合体。如先前针对野生型大肠杆菌(Escherichia coli(E.coli))MsbA所述,收获细胞并纯化嵌合体(EcMsbA;Ho等人,Nature557(7704):196-201(2018))。使用来自推定的CaMsbA(MsbA
b.蛋白质表达与纯化
来自大肠杆菌(Escherichia coli(E.coli))的野生型(WT)MsbA转运蛋白(EcMsbA)以及周质嵌合体,如前所述(Ho等人,2018)进行表达基纯化,使用正十二烷基-α-D-麦芽糖苷(αDDM,用于cryo-EM结构研究和一些生化分析,如所指示;Anatrace)、月桂基麦芽糖新戊二醇(LMNG,用于生化分析;Anatrace)或3α-羟基-7α,12α-di-((O-β-D-麦芽糖基)-2-羟基乙氧基)-胆烷(FA3,用于晶体学研究)作为增溶洗涤剂。使用LMNG作为增溶洗涤剂,来自阴沟肠杆菌(Enterobacter cloacae(E.cloacae);EnMsbA)、克雷伯氏肺炎杆菌(Klebsiella pneumoniae(K.pneumoniae);KpMsbA)和绿脓杆菌(Pseudomonas aeruginosa(P.aeruginosa);PaMsbA)的WT MsbA得以类似的表达并纯化。用于经纯化的野生型MsbA蛋白的最终缓冲液为20mM Tris pH 8.0、100mM NaCl和0.03%(wt/v)DDM或0.02% LMNG(wt/v)。将蛋白质等分试样快速冷冻并储存在-80℃。
在一些情况下,在氨基末端FLAG亲和标签序列之间包含大肠杆菌BirA生物素连接酶(GLNDIFEAQKIEWHE)的识别模体,以允许对经纯化的MsbA(Avidity)进行有效的位点特异性生物素化。对嵌合体的ATP酶活性和药理学的评估表明,可以耐受这些大的序列改变,而不会显著丧失生化活性或发生已知拮抗剂受体位点的明显结构改变。特别地,MsbA
对于大肠杆菌MsbA点突变体的生化评估,合成了WT EcMsbA以及Tyr87Ala/Trp91Ala(EcMsbA Y87A/W91A)和Lys95Ala/Arg238Ala(EcMsbA K95A/R238A)突变体(Genscript)并克隆到经修饰的p15A质粒(pLMG18)中,位于Ptac启动子下游(Storek等人,2018)。
使用大肠杆菌宿主BL21过表达MsbA,并在37℃使用1mM IPTG进行诱导3小时。
收获表达MsbA的细胞并重新悬浮于50mM Tris,pH 8.0、500mM NaCl(缓冲液A)中,以cOmplete
c.重组到两亲物中
在指示使用合并有两亲物的MsbA的情况下,将洗涤剂中经纯化的MsbA调整为1mg/mL并重组到A8-35两亲物(Zoonens和Popot,2014)(Anatrace)中,如前所述(Ho等人,2018)。用于经纯化、合并有两亲物的MsbA蛋白的最终缓冲液为20mM Tris pH 8.0和100mM NaCl。将蛋白质等分试样快速冷冻并储存在-80℃。
d.序列保留分析
来自革兰氏阴性细菌肠杆菌科的MsbA序列(taxid:543)被使用EcMsbA作为查询序列(Uniprot ID:P60752)使用针对refseq_select数据库的BLAST搜索鉴定。使用基于约束的多重比对工具(COBALT)(Papadopoulos和Agarwala,2007)对来自该搜索的总共118个序列注释为MsbA同源物进行比对。将多序列比对加载到ChimeraX中,并使用AL2CO(Pei和Grishin,2001)中的对总和方法确定序列保留性。
实例2:用于鉴定MsbA结合巨环的筛选材料和方法
a.巨环肽文库设计
使用以嵌合MsbA蛋白进行的反选择(图3A),对肽巨环进行测试,以鉴定与EcMsbA周质面结合的分子。在经基因程式改写的活体外翻译系统中,使用N-氯乙酰基L-苯丙氨酸(ClAc-F)作为起始剂,构建硫醚-巨环肽文库(Kashiwagi等人,2013)。遗传密码被设计为除了具有除半胱氨酸外的全部20种天然氨基酸以外,还添加了N-甲基-L-苯丙氨酸(MeF)和(S)-3-([1,1'-联苯]-4-基)-2-氨基丙酸(Bph)。在活体外翻译后,起始剂L-苯丙氨酸残基的N末端ClAc基团与下游半胱氨酸残基的巯基之间自发形成硫醚键,以生成巨环肽。
b.周质MsbA结合分子的选择
使用溶解在0.02% LMNG中通过在整个选择过程中包含50μM ATP、10mM Mg
对于亲和力选择,将肽-mRNA/cDNA溶液与250nM经生物素化的EcMsbA和500nMEcMsbAChim5作为储库在4℃孵育60分钟。进一步添加经链霉抗生物素蛋白包被的珠粒(Dynabeads
c.G1118和G1365巨环的突变扫描
对于G1118(下表4)和G1365(下表6)巨环的突变扫描,基于这些亲本序列,通过汇集多个DNA模板来构建位点饱和DNA文库,每个模板在不同位置含有一个“NNU”简并密码子,使得在翻译后,对亲本序列的每一个氨基酸改变都进行采样。遗传密码被设计为除了具有亲本肽中使用的氨基酸外,还添加了Pro、Lys、Ala、多巴(L-3,4-二羟基苯丙氨酸)和MeG(N-甲基-L-甘氨酸)。在活体外翻译后,使用如上所述的两个巨环文库独立进行一轮亲和力选择。输入和经恢复的输出DNA汇集物通过NGS进行深度定序。每个单个突变体的富集因子计算如下:输出汇集物中的NGS频率除以输入汇集物中的NGS频率,由亲本值标准化。
实例3:用于表征MsbA酶变异体和细菌菌株的材料和方法
a.质粒
以下质粒(表1)用于大肠杆菌表达型研究。
b.MsbA ATP酶测定
使用Transcreener ADP2 FP Assay(BellBrook Labs)测量MsbA的ATP酶活性。为了确定MsbA抑制剂的IC
c.细胞IC
确定了各种细菌菌株的细胞IC
使用回波液体处理仪(Echo Liquid Handler)(Labcyte)将每种化合物的八个2倍稀释的200nL等分试样一式两份地分配到384孔板中。菌株在具有0.002% Tween的经阳离子调节的Mueller Hinton培养液中培养隔夜16小时,用PBS洗涤,以OD
d.与MsbA等位基因互补的大肠杆菌生长的时间过程
将携带表达WT或大肠杆菌MsbA的突变等位基因的pLMG18载体的大肠杆菌MG1655msbA-cKO lptD(imp4213)的培养物在37℃在含有10μg/ml氯霉素和2%阿拉伯糖的5mL LB中培养隔夜,以诱导来自染色体的WT大肠杆菌MsbA的表达。将隔夜培养物沉淀,用5ml磷酸盐缓冲盐水洗涤,并以OD600=1时重新悬浮在LB中。然后将每种培养物以1:100的比例稀释到5mL LB、5mL LB+2%阿拉伯糖中。全部培养物都在37℃在滚筒上生长,并且每小时测量一次OD600。生长曲线在不同的日子重复三次。
e.蛋白印记法
将携带表达WT或大肠杆菌MsbA的突变等位基因的pLMG18载体的大肠杆菌MG1655msbA-cKOlptD(imp4213)的培养物在37℃在含有10μg/ml氯霉素和2%阿拉伯糖的5mL LB中培养隔夜,以诱导来自染色体的WT大肠杆菌MsbA的表达。无质粒对照菌株在相同但没有氯霉素的条件下生长。在50mL锥形管中将隔夜培养物以1:100稀释在15mL相同培养基中,并在37℃振荡培养3小时。将这些培养物沉淀,用15mL PBS洗涤,并在LB中以OD600=1重新悬浮。然后,将每种培养物以1:100稀释在20mL LB中(对于表达大肠杆菌MsbA等位基因的菌株或无质粒对照)或20mL LB+1mM IPTG中(对于表达鲍曼氏不动杆菌MsbA等位基因的菌株)。将7.5mL的OD=1细胞中的每一者沉淀并裂解为2%阿拉伯糖样品。使经稀释的培养物在37℃生长3小时,然后沉淀并裂解。
为了生成裂解物,将每个样品重新悬浮于500μl MSD裂解缓冲液(150mM NaCl、20mM Tris、pH 7.5、1mM EDTA、1mM EGTA、1%Triton X-100)+15mg/mL溶菌酶中并在37℃孵育30分钟。将裂解物在4℃在微量离心机中全速沉淀10分钟,然后将上清液转移到干净的试管中。样品在20孔4-12% Bis-Tris midi凝胶(BioRad)上的MES缓冲液中解析,并使用GroEL作为加载对照将加载正规化为OD
f.MIC测定
如前所述(Ho等人,2018),培养液MIC在含有0.002% Tween-80的经阳离子调节的Mueller-Hinton培养液中确定。
g.PD-1365抗性突变体的分离
将MG1655 lptD(imp4213)以0.005的OD
实例4:电子显微镜材料和方法
用表达所指示的大肠杆菌MsbA突变体的pLMG18质粒拯救的大肠杆菌CFT073 lptD(imp4213)或CFT073 lptD(imp4213)msbA-cond-ko细胞如先前所述进行(Ho等人,2018)。在指示使用MsbA的巨环或小分子抑制剂的情况下,将在LB中生长的CFT073 lptD(imp4213)隔夜培养物以1:100稀释在LB中并在37℃生长2.5小时进入对数期,然后沉淀,用PBS洗涤两次,并以OD
实例5:巨环化合物的合成
a.二苯甲酮(G758)的合成
步骤1:2-(4-甲基哌啶-1-基)乙酸三级丁酯。
将4-甲基哌啶(25.0g,252.1mmol)、碳酸钾(104.5g,756.3mmol)和溴乙酸三级丁酯(49.2g,252.1mmol)在乙腈(400mL)中的混合物在25℃搅拌12小时,并在减压下浓缩。残余物通过管柱层析纯化(以0%至30%乙酸乙酯在石油醚中洗脱),以得到2-(4-甲基-1-哌啶基)乙酸三级丁酯(45.0g,189.9mmol,75.3%产率),为淡黄色固体。
步骤2:2-(4-甲基哌啶-1-基)乙酸。
将2-(4-甲基-1-哌啶基)乙酸三级丁酯(45.0g,211.0mmol)和盐酸(4N,369.2mL,1476.7mmol)在乙酸(150mL)中的溶液在25℃搅拌14小时,并在减压下浓缩以得到粗产物。该粗制品不经进一步纯化即直接使用。1H NMR(400MHz,DMSO-d6):δ4.07p.p.m.(s,2H),3.42(br.s.,2H),3.02(br.s.,2H),1.77(d,J=12.8Hz,2H),1.59(br.s.,1H),1.51-1.36(m,2H),0.92(d,J=6.8Hz,3H)。
步骤3:2-(4-甲基哌啶-1-基)乙酰氯。
向2-(4-甲基-1-哌啶基)乙酸(1.0g,6.7mmol)在二氯甲烷(20mL)中的混合物中添加草酰氯(1.4mL,15.9mmol)和2滴N,N-二甲基甲酰胺。将所得混合物在20℃搅拌1.5小时并在减压下浓缩,以得到粗制品2-(4-甲基-1-哌啶基)乙酰氯(1.0g,5.7mmol,89.5%产率)。粗制品不经进一步纯化即直接用于下一步骤。
/>
步骤4:(2-溴-6-氯吡啶-3-基)氨甲酸三级丁酯。
将2-溴-6-氯-吡啶-3-氨(2.5g,12.1mmol)、二碳酸二-三级丁酯(2.6g,12.1mmol)、4-二甲基氨基吡啶(294.4mg,2.4mmol)和三乙胺(2438.78mg,24.1mmol)在二氯甲烷(20mL)中的溶液在30℃搅拌12小时并用二氯甲烷(50mL)稀释。溶液用水(2×15mL)、盐水(15mL)洗涤,经无水硫酸钠干燥并在减压下浓缩。残余物通过管柱层析纯化(以0%至30%乙酸乙酯在石油醚中洗脱),以得到N-(2-溴-6-氯-3-吡啶基)氨甲酸三级丁酯(1.3g,4.2mmol,35.1%产率),为白色固体。
步骤5:(6-氯-2-((3-氟吡啶-2-基)(羟基)甲基)吡啶-3-基)氨甲酸三级丁酯。
在-78℃向N-(2-溴-6-氯-3-吡啶基)氨甲酸三级丁酯(1.0g,3.25mmol)在四氢呋喃(20mL)中的溶液中添加丁基锂(2.5M在己烷中,1.6mL,3.90mmol)。将混合物在-78℃搅拌1小时,然后添加3-氟-2-甲酰基吡啶(610.1mg,4.88mmol)。将所得混合物在-78℃搅拌4小时,并且通过添加饱和氯化铵(10mL)淬灭。溶液用乙酸乙酯(50mL)稀释并用水(2×10mL)、盐水(10mL)洗涤,经无水硫酸钠干燥并在减压下浓缩。残余物通过管柱层析纯化(以0%至40%乙酸乙酯在石油醚中洗脱),以得到N-[6-氯-2-[(3-氟-2-吡啶基)-羟基-甲基]-3-吡啶基]氨甲酸三级丁酯(550.0mg,1.55mmol,47.8%产率),为黄色油状物。
步骤6:(6-氯-2-(3-氟吡啶甲酰基)吡啶-3-基)氨甲酸三级丁酯。
将N-[6-氯-2-[(3-氟-2-吡啶基)-羟基-甲基]-3-吡啶基]氨甲酸三级丁酯(460.0mg,1.30mmol)和Dess-Martin高碘烷(2.2g,5.20mmol)在二氯甲烷(15mL)中的混合物在20℃搅拌3小时。反应混合物用二氯甲烷(20mL)稀释,用水(2×10mL)、盐水(10mL)洗涤,经无水硫酸钠干燥并在减压下浓缩。残余物通过管柱层析纯化(以0%至30%乙酸乙酯在石油醚中洗脱),以得到N-[6-氯-2-(3-氟吡啶-2-羰基)-3-吡啶基]氨甲酸三级丁酯(300.0mg,0.85mmol,65.6%产率),为白色固体。
步骤7:(6-氰基-2-(3-氟吡啶甲酰基)吡啶-3-基)氨甲酸三级丁酯。
将N-[6-氯-2-(3-氟吡啶-2-羰基)-3-吡啶基]氨甲酸三级丁酯(230.0mg,0.65mmol)、参(二亚苄基丙酮)二钯(59.9mg,0.07mmol)、氰化锌(383.9mg,3.27mmol)和环戊基(二苯基)磷烷铁(72.5mg,0.13mmol)在N,N-二甲基乙酰胺(10mL)中的混合物在微波条件下于90℃加热2小时并在减压下浓缩。残余物通过管柱层析纯化(以0%至50%乙酸乙酯在石油醚中洗脱),以得到N-[6-氰基-2-(3-氟吡啶-2-羰基)-3-吡啶基]氨甲酸三级丁酯(150.0mg,0.44mmol,67.0%产率),为白色固体。
步骤8:5-氨基-6-(3-氟吡啶甲酰基)吡啶甲腈三氟乙酸盐。
将N-[6-氰基-2-(3-氟吡啶-2-羰基)-3-吡啶基]氨甲酸三级丁酯(120.0mg,0.35mmol)和三氟乙酸(4.0mL,51.22mmol)在二氯甲烷(16mL)中的溶液在15℃搅拌1小时并在减压下浓缩,以得到粗制品5-氨基-6-(3-氟吡啶-2-羰基)吡啶-2-甲腈三氟乙酸盐(84.0mg,0.25mmol,71.4%产率),为黄色油状物。
步骤9:N-(6-氰基-2-(3-氟吡啶甲酰基)吡啶-3-基)-2-(4-甲基哌啶-1-基)乙酰胺。
将2-(4-甲基-1-哌啶基)乙酰氯(121.8mg,0.69mmol)和5-氨基-6-(3-氟吡啶-2-羰基)吡啶-2-甲腈(84.0mg,0.35mmol)在四氢呋喃(5mL)中的混合物在60℃搅拌2小时并在减压下浓缩。残余物通过反相层析(乙腈28-58/0.05% NH4OH的水溶液)纯化,以得到N-[6-氰基-2-(3-氟吡啶-2-羰基)-3-吡啶基]-2-(4-甲基-1-哌啶基)乙酰胺(9.40mg,0.02mmol,6.8%产率),为白色固体。1H NMR(400MHz,甲醇-d4):δ9.34p.p.m.(d,J=8.8Hz,1H),8.53(d,J=4.8Hz,1H),8.04(d,J=4.8Hz,1H),7.85-7.78(m,1H),7.72-7.63(m,1H),3.23(s,2H),2.95-2.85(m,2H),2.35-2.23(m,2H),1.68-1.49(m,4H),1.45-1.36(m,1H),0.96(d,J=6.4Hz,3H)。LCMS(m/z):[M+H]+计算值C20H20FN5O2,381.16;实测值382.1。
b.G1118、G1365和衍生物的合成
使用标准Fmoc固相肽合成(SPPS)合成硫醚巨环肽。在全部氨基酸偶合后,经去保护的N端在树脂上氯乙酰化之后使用三氟乙酸(TFA)去保护混合液(cocktail)进行全局去保护。然后通过添加超过10倍过量的乙醚从去保护溶液中沉淀肽。然后将粗制肽沉淀物溶解并使用乙醚再沉淀3次。最后一次洗涤后,将沉淀物晾干,然后将沉淀物重新悬浮在DMSO中,之后添加三乙胺,以供经由在半胱氨酸的硫醇与N末端氯乙酰基之间形成硫醚键进行分子内环化。一旦环化完成,即用AcOH淬灭反应,并且环肽使用标准反相HPLC方法纯化。分子量通过单四极杆LC/MS(LCMS-2020系统,岛津)确认。
c.其他14-mer肽的合成
根据以下式设计另外的14-mer肽(某些变体的图示参见例如图4E):ClacF-X1-X2-L-X3-X4-D-X5-X6-X7-X8-MeF-V-C,其中:
i.X1为W、V或Y;
ii.X2为W或Y;
iii.X3为W或Y;
iv.X4为S、D、V或H;
v.X5为N,其中N选自除C以外的任何天然氨基酸或选自Bph((S)-3-([1,1'-联苯]-4-基)-2-氨基丙酸)、多巴(L-3,4-二羟基苯丙氨酸)、MeF(N-甲基-L-苯丙氨酸)和MeG(N-甲基-L-甘氨酸)的非天然氨基酸;
vi.X6为Y、K、A、S、D、R或V;
vii.X7为W、Y或Bph;并且
viii.X8为W或Y;
任选地其中该肽在C末端的C残基之后进一步包含G残基,并且其中ClacF为N-氯乙酰基L-苯丙氨酸,Bph为(S)-3-([1,1'-联苯]-4-基)-2-氨基丙酸,多巴为L-3,4-二羟基苯丙氨酸,MeF为N-甲基-L-苯丙氨酸,并且MeG为N-甲基-L-甘氨酸。在上述实例3所述的测定中,也测试了根据该式的十一种不同分子对MsbA ATP酶活性的抑制作用,并且发现IC
实例6:关于蛋白质结构确定的材料和方法
a.蛋白质结晶
将抑制剂G758添加到MsbA-chim5中,浓度为10mg ml/L,在FA3中纯化至最终浓度为1mM,并在冰上孵育1小时。在任何时候都未添加外源性LPS。G758-LPS-MsbA-chim5复合物在19℃使用通过将复合物与母液(150mM NaF、13% PEG 3350、100mM HEPES,pH 7.0)以1:1(v/v)比率混合的沉滴蒸汽气相扩散(sitting-drop vapor diffusion)结晶。在一周内达到全尺寸后,为了改善衍射,晶体通过下述脱水:先在10%乙二醇、15% PEG 3350、100mMHEPES,pH 7.0中浸泡30分钟,然后在20%乙二醇、20% PEG 3350、100mM HEPES,pH=7.0中再浸泡30分钟,然后在液氮中快速冷冻。
b.结构确定、精化和分析
使用高级光源(Advanced Light Source)的光束线17ID在100K收集衍射数据。使用autoPROC(Vonrhein等人,2011)对X射线衍射数据进行整合和缩放,包括使用STARANISO(Tickle,等人,(2020)Global Phasing Ltd;staraniso.globalphasing.org/cgi-bin/staraniso cgi)进行的各向异性校正。使用来自PDB 6BPL的一个MsbA次单元作为搜索模型,使用PHENIX(Adams等人,2010)通过分子置换来确定结构。通过Coot(Emsley等人,2010)中的刚体运动对初始解决方案进行手动调整。通过检查省略地图来指导Coot中反复进行的几轮精化和模型构建。结合在精化的早期阶段使用省略地图,在模型中将嵌合体5序列替换为WT大肠杆菌MsbA序列。在整个精化过程中应用严格的几何形状和二级结构限制以维持严格的立体化学,然而,最终没有应用非结晶对称性限制。在非常早期的阶段,G758、LPS(中央前庭)和未指定的洗涤剂样密度的强烈省略密度很明显,但这些仅在精化的后期阶段建模。最终G758-LPS-MsbA-chim5模型的几何形状使用MolProbity进行评估(Chen等人,2010)。全部结构图都使用PyMol软体(PyMOL分子图形学系统(The PyMOL Molecular GraphicsSystem)v.1.8(
c.低温电子显微镜(Cryo-EM)样品制备和数据收集
将经纯化的MsbA与Fab 12G7以1:1w/w混合。使用由20mM Tris pH 8、100mM NaCl和0.03%αDDM组成的运行缓冲液,通过尺寸排除色谱法将MsbA-12G7复合物与游离Fab分离。将MsbA-12G7复合物与20mM MgCl
d.G1118的cryo-EM数据处理
使用cisTEM(Grant等人,2018)处理G1118的cryo-EM数据(图15A-E)。使用cisTEM对总共9,999个视频进行了全帧运动校正,并合并为
e.G1365的cryo-EM数据处理
使用cisTEM(Grant等人,2018)与RELION(Scheres,2012)的组合处理cyro-EM数据(图17A-E)。总共收集了G6671的10,273张显微照片和G3081的17,575张显微照片。使用cisTEM对每个数据集进行了全帧运动校正,并合并为
f.模型精化
大肠杆菌MsbA的同源模型基于鼠伤寒沙门氏菌(S.typhimurium)MsbA(PDB:3B60)的经AMPPNP结合的结构,使用SWISS-MODEL生成(Waterhouse等人,2018)。所得模型作为刚体拟合到G1118 cry-o-EM地图中。该模型通过在Coot(Emsley和Cowtan,2004)和ChimeraX(Goddard等人,2018;Pettersen等人,2021)中的手动调整使用ISOLDE(Croll,2018)进行精化,然后进行phenix.real_space_refinement中的真实空间精化(Afonine等人,2018)。使用Corina(Molecular Networks GmbH)对巨环进行参数化并手动拟合到密度中。G1118结构的MsbA坐标随后在迭代模型构建之前用作G1365的初始模型。该模型使用带有内置MolProbity评分的phenix.validation_cryoEM进行验证。图式使用UCSF ChimeraX生成(Goddard等人,2018;Pettersen等人,2021)。
实例7:巨环MsbA抑制剂的发现和表征
a.经和未经反选择并且捕集于和未捕集于面外构象的所选分子的比较(初步筛选)
为了评估不同选择方案鉴定与MsbA的周质面选择性地结合的14-mer巨环分子的能力,通过ELISA测定比较几种选择方案的结果(表3)。很多肽用于显示与MsbA的特异性结合。这些肽既表达出钒酸盐依赖性结合,又表达出回收率在嵌合体存在下不降低。
如表3所示,在左上角,选择(a)在钒酸盐存在下进行以将EcMsbA捕集于其面外构象并使用嵌合MsbA在溶液中进行反筛选,导致鉴定出频率为约26%至2%的巨环组(表3;%频率列,前6行)。当按下述进行筛选时鉴定出一组类似的特定巨环:(b)用钒酸盐进行但不进行反选择,在溶液中进行,(c)不使用钒酸盐但包括反选,在珠粒上进行,和(d)用钒酸盐进行但不进行反选择,在珠粒上进行。(参见表3的最左列和“%频率”列。)对经鉴定的巨环中的每一者进行后续ELISA测定,以测试在钒酸盐存在和不存在下与EcMsbA的结合和与不相关的膜蛋白OprF的结合和与链霉抗生物素蛋白珠粒(SA)的结合,以将EcMsbA蛋白捕集于面外构象。结果显示,在进行反筛选并且使用钒酸盐在溶液中进行的(a)中选择的分子,在钒酸盐存在下与EcMsbA结合良好,但在不使用钒酸盐的情况下结合不良(“+/-比率”列,前6行),并且在任何一种情况下都不能单独地与OprF或链霉抗生物素蛋白珠粒良好结合。在条件(b)、(c)和(d)中鉴定的筛选中的大多数分子与EcMsbA的结合程度相似,无论它是否使用钒酸盐捕集于面外构象,从而指示将蛋白质捕集于面外构象和使用嵌合蛋白反筛选两者都在鉴定与EcMsbA的周质面结合的分子中更有效。也进行竞争ELISA实验,以测试经鉴定的分子与珠粒上的EcMsbA在作为结合竞争物的嵌合EcMsbA蛋白存在和不存在下的结合。在EcMsbA存在和不存在下的结合程度相似,并且因此比率大于或等于1.0,指示该分子对EcMsbA具有选择性,并且嵌合体不用作与EcMsbA结合的竞争者。(参见表3的右手列。)在(a)的筛选条件下鉴定的分子在嵌合体存在和不存在下具有相似的结合程度,如该测定中等于或高于1.0的比率所指示。这与这些分子与EcMsbA的周质面的结合一致。
b.MsbA抑制剂G1118的定点发现
为了富集特异性地靶向大肠杆菌MsbA(EcMsbA)的水性周质间隙的分子,首先使用基于结构的同源性建模来指导五个独特的嵌合构建体的工程化,每个嵌合构建体都用来自远缘相关革兰氏阴性细菌的推定的MsbA转运蛋白的序列整体替换跨膜区段的周质面,如使用迭代BLAST搜索进行评估(图9A-12B)。在所构建的五个嵌合体中,嵌合体2、嵌合体4和嵌合体5(MsbA-chim5)从大肠杆菌中稳定地表达和纯化(图11A-B)。对嵌合体的ATP酶活性和药理学的评估表明,在保持生化活性的同时,可以耐受这些大的序列改变(图11C)。特别地,MsbA-chim5用来自磁螺菌属(Magnetospira spirillum)的MsbA同源物的序列替换EcMsbA的整个周质面,但仍保留可比的ATP酶活性并且展示对于先前鉴定的野生型(WT)EcMsbA的喹啉类(G247和G907)和二苯甲酮类(G758)两类小分子抑制剂的选择性(图11D-E和12A-B)。
接下来,在捕集于面外构象的经纯化的WT EcMsbA转运蛋白上进行巨环选择,然后使用类似经捕集的MsbA嵌合体进行反选择,在该嵌合体中,跨膜区段的周质面由来自远缘相关革兰氏阴性细菌的推定的MsbA转运蛋白序列整体替换(图3A和9A-12B)。选择采用经活体外翻译的肽巨环mRNA展示12-14mer文库,该文库含有10个(Karow和Georgopoulos,1993)分子,这些分子并入有天然和非天然氨基酸(实例2)。在八轮选择和反选择后,14-mer巨环G1118显示对于WT EcMsbA的显著富集(图3B)。发现G1118影响EcMsbA的ATP酶活性,其半最大抑制浓度(IC
c.MsbA抑制剂G1365的定点发现
为了发现对WT大肠杆菌菌株具有OM渗透性和生长抑制活性的巨环,鉴定了较小的巨环支架。这些小的巨环支架也通过使用8-10mer巨环文库在EcMsbA和MsbA-chim5上进行额外选择来靶向周质间隙处的MsbA。此外,由于已知含有一级氨的小和两亲的分子最有可能在细胞中积累,因此采用了偏向于亲脂和含氨的侧链的密码子表(Richter等人,2017)。
发现8-mer巨环G1365。相对于MsbA-chim5转运蛋白(IC
该数据共同将MsbA鉴定为G1365的细胞标靶,并强调了发现可以穿过完整细菌外膜的合成巨环的潜力。
d.额外的14-mer巨环肽活化剂
所测试的其他巨环肽活化剂为G1119(ClAc-FWWLWSDMeGDWWMeFVC-NH2;SEQ IDNO:10)和G1122(ClAc-FRYLWMeAWGLVWDNC-NH2;SEQ ID NO:11)。
G1119和G1122的cryo-EM分析显示,它们导致细胞外膜的叠堆程度比G1118更大(G1119和G1122的数据未显示;参见图3F的G1118数据)。进行G1118、G1119和G1122抑制MsbA的ATP酶活性的IC
也测试根据分子式ClacF-X1-X2-L-X3-X4-D-X5-X6-X7-X8-MeF-V-C(参见上述实例5)设计的十一种不同分子对MsbA的抑制作用。ATP酶活性,在如上述实例3所述的测定中,并且发现IC
实例8:G1118与MsbA结合
a.G1118的生化表征
使用上述实例1至5中所述的材料和方法,G1118经鉴定为与MsbA结合的巨环分子。在八轮富集和筛选后,鉴定出一个14残基肽巨环G1118。G1118对于EcMsbA展示出强效抑制活性(半最大抑制浓度(IC
b.G118在周质结合位点处与MsbA结合,并将MsbA捕集于面向外的状态
为了定义G1118借以拮抗MsbA的分子机制,MsbA-G1118复合物在ADP-钒酸盐存在下的
发现MsbA上用于G1118的周质受体位点位于转运蛋白中心轴附近,在膜-水界面上方和下方延伸(图4B和16A-B)。MsbA二聚物高度对称(约
上表4显示巨环G1118的突变扫描。显示每个巨环的富集因子,在巨环核心的位置2-13处含有所指示的取代(其中富集因子=(%频率[标靶]/%频率[输入]),通过亲本值正规化)。与亲本相同的氨基酸用黑色轮廓表示。天然氨基酸用标准单字母指示。非天然氨基酸如下:(1)MeF=F*,N-甲基-L-苯丙氨酸;(2)MeG=G*,N-甲基-L-甘氨酸;(3)多巴,L-3,4-二羟基苯丙氨酸;和(4)Bph=B*,(S)-3-([1,1'-联苯]-4-基)-2-氨基丙酸。总体而言,我们的生化和结构研究鉴定了ABC转运蛋白家族中的新颖药理学和受体位点。
总之,复合物的结构引导选择残基用于突变分析。IC
实例9:G1365的鉴定
a.G1365的生化表征
为了选择可以克服OM渗透屏障的较小的巨环,使用8-10mer巨环进行另一系列选择和嵌合体反选择。材料和方法如上文实例1至5中所述。也使用了偏向于亲脂性和带正电侧链的密码子表。
通过这些尝试,鉴定了G1365(实例7和图3B)。G1365展示在MsbA上的生化活性(图3D;IC
本实验中G1365的生化IC
b.G1365结合在MsbA的周质间隙深处
为了理解抑制的分子基础,确定了MsbA-12G7-G1365复合物的cryo-EM结构。材料和方法如上述实例6中所述。与G1365的强效衍生物复合物的MsbA的
G1365将MsbA捕集于与向面向内的状态的转变不相容的面外构象,将G1365鉴定为状态依赖性抑制剂。G1365的结合位点与转运蛋白的膜暴露区域相邻,其中结合位点由TM1、TM3和TM6形成,并且Arg6
上表6显示巨环G1365的突变扫描。正如上表4中,每个巨环的富集因子,在巨环核心的位置2-7处含有所指示的取代(其中富集因子=(%频率[标靶]/%频率[输入]),通过亲本值正规化)。与亲本相同的氨基酸用黑色轮廓表示。天然氨基酸用标准单字母指示。非天然氨基酸如下:(1)MeF=F*,N-甲基-L-苯丙氨酸;(2)MeG=G*,N-甲基-L-甘氨酸;(3)多巴,L-3,4-二羟基苯丙氨酸;和/或(4)Bph=B*,(S)-3-([1,1'-联苯]-4-基)-2-氨基丙酸。G1365的结合位姿也可使Asp252Asn抗性突变合理化(上面的实例7),因为这会破坏Arg296与G1365之间的交互作用(图4H)。
出乎意料的是,G1365
实例10:MsbA上意外的LPS结合位点的鉴定
现在已知MsbA如何首先接合来自膜双层内丰富的磷脂的其稀有底物LPS以实现选择性运输。在cryo-EM地图中,两个解析良好的LPS分子与MsbA的周边结合(图4A和18A-D)。这些引人注目的地图特征明确地将脂质A的特征性双磷酸葡萄糖氨头基置于MsbA二聚体上内膜小叶位准的先前未识别的对称相关配位位点处(图18A)。重要的是,经可视化的LPS分子远离先前在面向内的状态的MsbA的中央前庭内观察到的单个结合位点(Ho等人,2018;Mi等人,2017)。由于LPS未添加到用于cryo-EM的样品中,因此在面向外的状态的MsbA上鉴定出这些独特的周边LPS结合位点表明它们具有生理相关性
MsbA上的周边内膜小叶LPS结合位点由TM2、TM4'和TM5'形成,其中
由于MsbA的面外构象历来与底物释放到周质膜小叶中有关(Ho等人,2018;Mi等人,2017;Ward等人,2007),最初令人惊讶地发现LPS在此状态下沿内小叶与MsbA结合。生成了与LPS交互作用的残基的靶向双突变。评估双突变体拯救缺乏WT MsbA的大肠杆菌细胞生长的能力(图19A-J)。发现与脂质A的4'-磷酸盐配位的碱性残基(Lys95和Arg238)以及支持脂质A的2'-羟基肉豆蔻酸酯和2”-月桂酸酯链酯的芳香侧链(Tyr87和Trp91)是必不可少的。这是因为它们对丙氨酸的突变阻止了细胞生长并生成了独特的内膜精致化表达型,该表达型反映WT MsbA耗尽的细菌(图5C-E)(Doerrler等人,2001)。相比之下,与脂质A的1-磷酸盐配位的侧链(Arg188和Lys243)或近端非LPS交互作用残基是可有可无的。出乎意料的是,(1)在面外构象的MsbA内小叶上发现了必不可少的周边LPS结合位点,以及(2)确定了具有重要生理意义的以前未知的底物选择性决定因素。
实例11:讨论
本公开讨论ABC转运蛋白的强效和状态依赖性抑制剂的定点发现。本公开讨论关于MsbA的作用机制的工具和新发现。使用这些工具,克服了许多关于无偏见地发现与膜主体受体位点结合的配体的挑战。
使用经工程化的嵌合蛋白,设计了一种定点配体发现策略,以通过靶向面向外的状态的溶剂暴露裂隙来选择性地抑制ABC转运蛋白。G1118和G1365为两种巨环化合物,其靶向面向外的裂隙内前所未有的受体位点,在ABC转运蛋白超家族中定义了一种新药理学,其中这些巨环可能代表进一步抗菌剂发现的早期线索。使用经工程化的嵌合体的类似的定点配体发现工作可用于鉴定其他蛋白质类别中的新受体位点,并且可能对发现新药理学特别有用。
尽管先前研究已经阐明了MsbA采用的交替通行机制(Ho等人,2018;Mi等人,2017;Ward等人,2007),但MsbA如何相对于丰富的膜磷脂实现LPS选择性仍然存在未知。MsbA的面向内的结构表明LPS结合在中央腔中,但这些结构捕获了运输周期中的中间状态,并且无法提供关于LPS如何从庞大的磷脂双层选择性地加载到中央腔中的见解。本公开讨论在面向外的状态下的MsbA与其底物结合的发现,出乎意料地表明MsbA首先通过沿转运蛋白的内膜小叶定位的保留以及必不可少的侧链网路来识别LPS。基于这些观察结果,下面讨论若干可能构成MsbA对LPS选择性机制的原理。
迄今为止,ABC输出蛋白的面外构象与底物释放和催化周期的结束密切相关(Hollenstein等人,2007)。正如在上述实例中所讨论,数据调用了更全面的模型,借此,通过面向外的状态呈现的LPS结合位点将用于显著增加LPS在环绕转运蛋白的内小叶内的局部浓度(图6)。在面外构象中,MsbA通过与特征性双磷酸葡萄糖胺头基、六酰化链和Kdo核心糖的多点交互作用,战略性地靶向核心脂质A在周边位点处的独特化学性质,以实现相对于磷脂的LPS选择性结合(图5A-B)。靶向诱变和生理学研究确立了在先前未识别的LPS结合位点处的保留残基的基本性质。在转变为面向内的构象时的周边结合位点破坏预计会释放LPS并促进选择性加载到中央腔中,大概是沿着一组从周边结合位点延伸到前庭的碱性残基(图18C-D)。总之,MsbA将LPS释放到外小叶内与底物结合在内小叶处联合,表明先前被视为ABC输出蛋白周期最后一步的面向外的状态可能与第一步有内在以及直接的联系。
周边LPS识别复合物的可视化提供了关于MsbA如何可区分成熟与未成熟LPS物种的首次见解。Lys95和Arg238侧链是必不可少的并且与脂质A的4'-磷酸形成直接盐桥(图5B,提供了为什么前驱物1-单磷酸化脂质A物种不被运输的结构原理23。Lys95和Arg238媒介的交互作用的本质也诠释了为什么4'-激酶LpxK的抑制突变尚未被鉴定,并且解释了为什么MsbA和LpxK在染色体上是连接的24或为什么在某些细菌中作为单个并列蛋白存在25。此外,Tyr87和Trp91侧链是必不可少的并且直接构成2′-羟基肉豆蔻酸酯和2″-月桂酸酯酰基链的酯键联(图5B),其通过脂质A生物合成途径中的后期作用酶(LpxL和LpxM)添加26,27。这一观察结果提供了为什么六酰化LPS为EcMsbA28,29的首选底物的分子原理。从周边LPS识别位点出现的情况是,除了选择性地将LPS相对于磷脂浓缩之外,MsbA还采用内在品质控制来确保选择成熟的LPS物种以穿过内膜进入周质。这些位准的分子混杂将有助于确保外膜屏障的完整性不会因未成熟LPS物种的通过而受到损害。总体而言,我们的研究结果揭示了脂质的选择性识别和运输,并且介绍了ABC转运蛋白可以利用面外构象来选择性地富集并且询问潜在底物的范例。
参考文献
Adams,P.D.,Afonine,P.V.,Bunkóczi,G.,Chen,V.B.,Davis,I.W.,Echols,N.,Headd,J.J.,Hung,L.-W.,Kapral,G.J.,Grosse-Kunstleve,R.W.,McCoy,A.J.,Moriarty,N.W.,Oeffner,R.,Read,R.J.,Richardson,D.C.,Richardson,J.S.,Terwilliger,T.C.,和Zwart,P.H.(2010).PHENIX:A comprehensive Python-based system formacromolecular structure solution.Acta Crystallographica.Section D,BiologicalCrystallography,66(Pt 2),213-221.https://doi.org/10.1107/S0907444909052925
Afonine,P.V.,Poon,B.K.,Read,R.J.,Sobolev,O.V.,Terwilliger,T.C.,Urzhumtsev,A.,和Adams,P.D.(2018).Real-space refinement inPHENIX for cryo-EMand crystallography.Acta Crystallographica.Section D,Structural Biology,74(Pt6),531-544.https://doi.org/10.1107/S2059798318006551
Alexander,M.K.,Miu,A.,Oh,A.,Reichelt,M.,Ho,H.,Chalouni,C.,Labadie,S.,Wang,L.,Liang,J.,Nickerson,N.N.,Hu,H.,Yu,L.,Du,M.,Yan,D.,Park,S.,Kim,J.,Xu,M.,Sellers,B.D.,Purkey,H.E.,…Nishiyama,M.(2018).Disrupting Gram-NegativeBacterial Outer Membrane Biosynthesis through Inhibition of theLipopolysaccharide Transporter MsbA.Antimicrobial Agents and Chemotherapy,62(11),e01142-18.https://doi.org/10.1128/AAC.01142-18
Altschul,S.F.,Gish,W.,Miller,W.,Myers,E.W.,和Lipman,D.J.(1990).Basiclocal alignment search tool.Journal of Molecular Biology,215(3),403-410.https://doi.org/10.1016/S0022-2836(05)80360-2
Brown,E.D.,和Wright,G.D.(2016).Antibacterial drug discovery in theresistance era.Nature,529(7586),336-343.https://doi.org/10.1038/nature17042
Chen,V.B.,Arendall,W.B.,Headd,J.J.,Keedy,D.A.,Immormino,R.M.,Kapral,G.J.,Murray,L.W.,Richardson,J.S.,和Richardson,D.C.(2010).MolProbity:All-atomstructure validation for macromolecular crystallography.ActaCrystallographica.Section D,Biological Crystallography,66(Pt 1),12-21.https://doi.org/10.1107/S0907444909042073
Clementz,T.,Bednarski,J.J.,和Raetz,C.R.(1996).Function of the htrBhigh temperature requirement gene of Escherichia coliin the acylation oflipid A:HtrB catalyzed incorporation of laurate.The Journal of BiologicalChemistry,271(20),12095-12102.https://doi.org/10.1074/jbc.271.20.12095
Clementz,T.,Zhou,Z.,和Raetz,C.R.(1997).Function of the Escherichiacoli msbB gene,a multicopy suppressor of htrB knockouts,in the acylation oflipid A.Acylation by MsbB follows laurate incorporation by HtrB.The Journalof Biological Chemistry,272(16),10353-10360.https://doi.org/10.1074/jbc.272.16.10353
Croll,T.I.(2018).ISOLDE:A physically realistic environment for modelbuilding into low-resolution electron-density maps.ActaCrystallographica.Section D,Structural Biology,74(Pt 6),519-530.https://doi.org/10.1107/S2059798318002425
Doerrler,W.T.,和Raetz,C.R.H.(2002).ATPase activity of the MsbA lipidflippase of Escherichia coli.The Journal of Biological Chemistry,277(39),36697-36705.https://doi.org/10.1074/jbc.M205857200
Doerrler,W.T.,Reedy,M.C.,和Raetz,C.R.(2001).An Escherichia colimutant defective in lipid export.The Journal of Biological Chemistry,276(15),11461-11464.https://doi.org/10.1074/jbc.C100091200
Emsley,P.,和Cowtan,K.(2004).Coot:Model-building tools for moleculargraphics.Acta Crystallographica.Section D,Biological Crystallography,60(Pt12Pt 1),2126-2132.https://doi.org/10.1107/S0907444904019158
Emsley,P.,Lohkamp,B.,Scott,W.G.,和Cowtan,K.(2010).Features anddevelopment of Coot.Acta Crystallographica.Section D,BiologicalCrystallography,66(Pt 4),486-501.https://doi.org/10.1107/S0907444910007493
Garrett,T.A.,Kadrmas,J.L.,和Raetz,C.R.(1997).Identification of thegene encoding the Escherichia coli lipid A 4’-kinase.Facile phosphorylationof endotoxin analogs with recombinant LpxK.The Journal of BiologicalChemistry,272(35),21855-21864.https://doi.org/10.1074/jbc.272.35.21855
Garrett,T.A.,Que,N.L.,和Raetz,C.R.(1998).Accumulation of a lipid Aprecursor lacking the 4’-phosphate following inactivation of the Escherichiacoli lpxK gene.The Journal of Biological Chemistry,273(20),12457-12465.https://doi.org/10.1074/jbc.273.20.12457
Goddard,T.D.,Huang,C.C.,Meng,E.C.,Pettersen,E.F.,Couch,G.S.,Morris,J.H.,和Ferrin,T.E.(2018).UCSF ChimeraX:Meeting modern challenges invisualization and analysis.Protein Science:A Publication of the ProteinSociety,27(1),14-25.https://doi.org/10.1002/pro.3235
Goto,Y.,Katoh,T.,和Suga,H.(2011).Flexizymes for genetic codereprogramming.Nature Protocols,6(6),779-790.https://doi.org/10.1038/nprot.2011.331
Grant,T.,Rohou,A.,和Grigorieff,N.(2018).CisTEM,user-friendly softwarefor single-particle image processing.ELife,7,e35383.https://doi.org/10.7554/eLife.35383
Ho,H.,Miu,A.,Alexander,M.K.,Garcia,N.K.,Oh,A.,Zilberleyb,I.,Reichelt,M.,Austin,C.D.,Tam,C.,Shriver,S.,Hu,H.,Labadie,S.S.,Liang,J.,Wang,L.,Wang,J.,Lu,Y.,Purkey,H.E.,Quinn,J.,Franke,Y.,…Koth,C.M.(2018).Structural basis fordual-mode inhibition of the ABC transporter MsbA.Nature,557(7704),196-201.https://doi.org/10.1038/s41586-018-0083-5
Hollenstein,K.,Dawson,R.J.P.,和Locher,K.P.(2007).Structure andmechanism of ABC transporter proteins.Current Opinion in Structural Biology,17(4),412-418.https://doi.org/10.1016/j.sbi.2007.07.003
Karow,M.,和Georgopoulos,C.(1993).The essential Escherichia coli msbAgene,a multicopy suppressor of null mutations in the htrB gene,is related tothe universally conserved family of ATP-dependent translocators.MolecularMicrobiology,7(1),69-79.https://doi.org/10.1111/j.1365-2958.1993.tb01098.x
Kawakami,T.,Ishizawa,T.,Fujino,T.,Reid,P.C.,Suga,H.,和Murakami,H.(2013).In vitro selection of multiple libraries created by genetic codereprogramming to discover macrocyclic peptides that antagonize VEGFR2activityin living cells.ACS Chemical Biology,8(6),1205-1214.https://doi.org/10.1021/cb300697h
Laxminarayan,R.,Duse,A.,Wattal,C.,Zaidi,A.K.M.,Wertheim,H.F.L.,Sumpradit,N.,Vlieghe,E.,Hara,G.L.,Gould,I.M.,Goossens,H.,Greko,C.,So,A.D.,Bigdeli,M.,Tomson,G.,Woodhouse,W.,Ombaka,E.,Peralta,A.Q.,Qamar,F.N.,Mir,F.,…Cars,O.(2013).Antibiotic resistance-the need for global solutions.TheLancet.Infectious Diseases,13(12),1057-1098.https://doi.org/10.1016/S1473-3099(13)70318-9
Mi,W.,Li,Y.,Yoon,S.H.,Ernst,R.K.,Walz,T.,和Liao,M.(2017).Structuralbasis of MsbA-mediated lipopolysaccharide transport.Nature,549(7671),233-237.https://doi.org/10.1038/nature23649
Nikaido,H.(2003).Molecular basis of bacterial outer membranepermeability revisited.Microbiology and Molecular Biology Reviews:MMBR,67(4),593-656.https://doi.org/10.1128/MMBR.67.4.593-656.2003
Okuda,S.,Freinkman,E.,和Kahne,D.(2012).Cytoplasmic ATP hydrolysispowers transport of lipopolysaccharide across the periplasmin E.coli.Science(New York,N.Y.),338(6111),1214-1217.https://doi.org/10.1126/science.1228984
Onishi,H.R.,Pelak,B.A.,Gerckens,L.S.,Silver,L.L.,Kahan,F.M.,Chen,M.H.,Patchett,A.A.,Galloway,S.M.,Hyland,S.A.,Anderson,M.S.,和Raetz,C.R.(1996).Antibacterial agents that inhibit lipid A biosynthesis.Science(NewYork,N.Y.),274(5289),980-982.https://doi.org/10.1126/science.274.5289.980
Padayatti,P.S.,Lee,S.C.,Stanfield,R.L.,Wen,P.-C.,Tajkhorshid,E.,Wilson,I.A.,和Zhang,Q.(2019).Structural Insights into the Lipid A TransportPathway in MsbA.Structure(London,England:1993),27(7),1114-1123.e3.https://doi.org/10.1016/j.str.2019.04.007
Papadopoulos,J.S.,和Agarwala,R.(2007).COBALT:Constraint-basedalignment tool for multiple protein sequences.Bioinformatics(Oxford,England),23(9),1073-1079.https://doi.org/10.1093/bioinformatics/btm076
Pei,J.,和Grishin,N.V.(2001).AL2CO:Calculation of positionalconservation in a protein sequence alignment.Bioinformatics(Oxford,England),17(8),700-712.https://doi.org/10.1093/bioinformatics/17.8.700
Pettersen,E.F.,Goddard,T.D.,Huang,C.C.,Meng,E.C.,Couch,G.S.,Croll,T.I.,Morris,J.H.,和Ferrin,T.E.(2021).UCSF ChimeraX:Structure visualizationfor researchers,educators,and developers.Protein Science:A Publication of theProtein Society,30(1),70-82.https://doi.org/10.1002/pro.3943
Polissi,A.,和Georgopoulos,C.(1996).Mutational analysis and propertiesof the msbA gene of Escherichia coli,coding for an essential ABC familytransporter.Molecular Microbiology,20(6),1221-1233.https://doi.org/10.1111/j.1365-2958.1996.tb02642.x
Raetz,C.R.H.,和Whitfield,C.(2002).Lipopolysaccharideendotoxins.Annual Review of Biochemistry,71,635-700.https://doi.org/10.1146/annurev.biochem.71.110601.135414
Richter,M.F.,Drown,B.S.,Riley,A.P.,Garcia,A.,Shirai,T.,Svec,R.L.,和Hergenrother,P.J.(2017).Predictive compound accumulation rules yield a broad-spectrum antibiotic.Nature,545(7654),299-304.https://doi.org/10.1038/nature22308
Ruiz,N.,Gronenberg,L.S.,Kahne,D.,和Silhavy,T.J.(2008).Identificationof two inner-membrane proteins required for the transport oflipopolysaccharide to the outer membrane of Escherichia coli.Proceedings ofthe National Academy of Sciences of the United States of America,105(14),5537-5542.https://doi.org/10.1073/pnas.0801196105
Sampson,B.A.,Misra,R.,和Benson,S.A.(1989).Identification andcharacterization of a new gene of Escherichia coli K-12involved in outermembrane permeability.Genetics,122(3),491-501.https://doi.org/10.1093/genetics/122.3.491
Scheres,S.H.W.(2012).RELION:Implementation of a Bayesian approach tocryo-EM structure determination.Journal of Structural Biology,180(3),519-530.https://doi.org/10.1016/j.jsb.2012.09.006
Sievers,F.,Wilm,A.,Dineen,D.,Gibson,T.J.,Karplus,K.,Li,W.,Lopez,R.,McWilliam,H.,Remmert,M.,
Storek,K.M.,Auerbach,M.R.,Shi,H.,Garcia,N.K.,Sun,D.,Nickerson,N.N.,Vij,R.,Lin,Z.,Chiang,N.,Schneider,K.,Wecksler,A.T.,Skippington,E.,Nakamura,G.,Seshasayee,D.,Koerber,J.T.,Payandeh,J.,Smith,P.A.,和Rutherford,S.T.(2018).Monoclonal antibody targeting theβ-barrel assembly machine of Escherichiacoli is bactericidal.Proceedings of the National Academy of Sciences,115(14),3692-3697.https://doi.org/10.1073/pnas.1800043115
Studier,F.W.(2005).Protein production by auto-induction in highdensity shaking cultures.Protein Expression and Purification,41(1),207-234.https://doi.org/10.1016/j.pep.2005.01.016
Venter,J.C.,Remington,K.,Heidelberg,J.F.,Halpern,A.L.,Rusch,D.,Eisen,J.A.,Wu,D.,Paulsen,I.,Nelson,K.E.,Nelson,W.,Fouts,D.E.,Levy,S.,Knap,A.H.,Lomas,M.W.,Nealson,K.,White,O.,Peterson,J.,Hoffman,J.,Parsons,R.,…Smith,H.O.(2004).Environmental genome shotgun sequencing of the Sargasso Sea.Science(New York,N.Y.),304(5667),66-74.https://doi.org/10.1126/science.1093857
Vonrhein,C.,Flensburg,C.,Keller,P.,Sharff,A.,Smart,O.,Paciorek,W.,Womack,T.,和Bricogne,G.(2011).Data processing and analysis with the autoPROCtoolbox.Acta Crystallographica.Section D,Biological Crystallography,67(Pt 4),293-302.https://doi.org/10.1107/S0907444911007773
Wang,X.,Karbarz,M.J.,McGrath,S.C.,Cotter,R.J.,和Raetz,C.R.H.(2004).MsbA transporter-dependent lipid A 1-dephosphorylation on the periplasmicsurface of the inner membrane:Topography of francisella novicida LpxEexpressed in Escherichia coli.The Journal of Biological Chemistry,279(47),49470-49478.https://doi.org/10.1074/jbc.M409078200
Wang,X.,McGrath,S.C.,Cotter,R.J.,和Raetz,C.R.H.(2006).Expressioncloning and periplasmic orientation of the Francisella novicida lipid A 4’-phosphatase LpxF.The Journal of Biological Chemistry,281(14),9321-9330.https://doi.org/10.1074/jbc.M600435200
Ward,A.,Reyes,C.L.,Yu,J.,Roth,C.B.,和Chang,G.(2007).Flexibility inthe ABC transporter MsbA:Alternating access with a twist.Proceedings of theNational Academy of Sciences ofthe United States of America,104(48),19005-19010.https://doi.org/10.1073/pnas.0709388104
Waterhouse,A.,Bertoni,M.,Bienert,S.,Studer,G.,Tauriello,G.,Gumienny,R.,Heer,F.T.,de Beer,T.A.P.,Rempfer,C.,Bordoli,L.,Lepore,R.,和Schwede,T.(2018).SWISS-MODEL:Homology modelling of protein structures andcomplexes.Nucleic Acids Research,46(W1),W296-W303.https://doi.org/10.1093/nar/gky427
Wu,T.,McCandlish,A.C.,Gronenberg,L.S.,Chng,S.-S.,Silhavy,T.J.,和Kahne,D.(2006).Identification of a protein complex that assembleslipopolysaccharide in the outer membrane of Escherichia coli.Proceedings ofthe National Academy of Sciences of the United States of America,103(31),11754-11759.https://doi.org/10.1073/pnas.0604744103
Zhang,G.,Baidin,V.,Pahil,K.S.,Moison,E.,Tomasek,D.,Ramadoss,N.S.,Chatterjee,A.K.,McNamara,C.W.,Young,T.S.,Schultz,P.G.,Meredith,T.C.,和Kahne,D.(2018).Cell-based screen for discovering lipopolysaccharide biogenesisinhibitors.Proceedings of the National Academy of Sciences of the UnitedStates of America,115(26),6834-6839.https://doi.org/10.1073/pnas.1804670115
Zhou,Z.,White,K.A.,Polissi,A.,Georgopoulos,C.,和Raetz,C.R.(1998).Function of Escherichia coli MsbA,an essential ABC family transporter,inlipid A and phospholipid biosynthesis.The Journal of Biological Chemistry,273(20),12466-12475.https://doi.org/10.1074/jbc.273.20.12466
Zoonens,M.,和Popot,J.-L.(2014).Amphipols for each season.The Journalof Membrane Biology,247(9-10),759-796.https://doi.org/10.1007/s00232-014-9666-8
序列
下表描述本文引用的某些序列。在下面列述的某些肽的残基或官能基之间添加破折号。
/>
/>
/>
/>
尽管为了清楚理解起见,通过图示和实例的方式对上述发明进行了详细描述,但是这些描述和实例不应被解释是限制本发明的范围。本文引用的所有专利和科学文献的公开内容都以引用的方式明确纳入其所有内容。
- 一个转运石蒜碱的ABC转运蛋白及其编码基因与应用
- 一个转运石蒜碱的ABC转运蛋白及其编码基因与应用
