FXR激动剂和IFN用于治疗HBV感染的协同效果
文献发布时间:2024-04-18 19:58:30
技术领域
本发明涉及一种治疗乙型肝炎感染的方法。
背景技术
尽管实施了广泛的疫苗接种计划,但乙型肝炎仍是主要的全球公共卫生问题,有超过3.5亿慢性感染者。慢性乙型肝炎会发展为危及生命的并发症,包括肝硬化和癌症。目前的治疗方案是长期治疗(例如,聚合酶抑制剂,终身;聚乙二醇化干扰素,长达一年),并且由于它们不靶向病毒库,因此无法治愈HBV。HBV功能性治愈仍然是主要的未满足的医疗需求。
治疗慢性乙型肝炎(CHB)的主要目标是永久抑制HBV复制和预防或改善肝脏疾病。目前有七种药物可用于治疗CHB感染,即常规干扰素(IFN)、聚乙二醇化干扰素和直接抗病毒剂。直接抗病毒剂(核苷/核苷酸类似物)分为三类:L-核苷(拉米夫定(lamivudine)、替比夫定(telbivudine)和恩曲他滨(emtricitabine));脱氧鸟苷类似物(恩替卡韦(entecavir))和核苷膦酸酯(阿德福韦(adefovir)和替诺福韦(tenofovir)),它们直接干扰HBV DNA复制,主要作为链终止剂。干扰素治疗的主要局限性是副作用大,HBV DNA抑制率低,ALT正常化率低;直接抗病毒剂治疗的主要局限性是:产生耐药性;停止治疗后HBV复制反弹,从而需要长期终身治疗;HBsAg清除率非常低,从而增加了长期终身治疗下的不良事件的风险。重要的是,目前的直接抗病毒剂抑制前基因组病毒RNA逆转录到基因组DNA中。它们因此作用于病毒进入肝细胞后形成的共价闭合环状DNA(cccDNA)形成的下游。cccDNA作为附加微小染色体存在于细胞核中,在肝细胞分裂时被转录至病毒mRNA并传递到子细胞。目前的直接抗病毒剂对HBV cccDNA库和病毒基因表达没有或几乎没有影响。因此,目前可用的治疗不是最佳的,并且可能伴有严重副作用。
WO 2015/036442公开了FXR激动剂对降低HBV复制的重要性。EYP001是一种合成的非甾体非胆汁酸FXR激动剂,具有良好的耐受性曲线。EYP001是目前在慢性乙型肝炎患者的Ib期进行评估的一种口服可生物利用小分子。与本质上靶向病毒复制的终身治疗标准相反,EYP001靶向cccDNA(“病毒库”),因此旨在真正治愈HBV。Erken等人(2018,Journal ofHepatology,68,增刊1,S488-S489)公开了EYP001减少了慢性乙型肝炎患者的HBV病毒载量。Joly等人(2017,Journal of Hepatology,66,增刊1,SAT-158)公开了EYP001和核苷类似物可以安全地用于健康个体,并在细胞培养中对HBV减少/消除具有累加效果。
已经研究了若干种包含IFN和核苷/核苷酸类似物的组合疗法:即IFN-α和选自拉米夫定、阿德福韦、替布韦林(telbuvirine)、恩替卡韦和替诺福韦的药物(Woo等人,2017,Ann Transl Med,5,159)。几乎所有组合都未能显示任何益处。事实上,只有一种包含替诺福韦的组合实现了较高的HBsAg(乙型肝炎表面抗原)损失率,其百分比低于10%。然而,这种低HBsAg损失率使得治愈仍然很困难。
然而,始终需要更好的疗法以满足HBV感染,特别是CHB感染的治疗目标。
发明内容
发明人惊讶地发现,FXR激动剂与干扰素对治疗乙型肝炎,尤其是对病毒复制标记物前基因组病毒RNA和作为慢性乙型肝炎血清标记物的核心相关抗原HBcrAg具有协同效果。更特别地,EYP001(Vonafexor)和IFN在减少cccDNA转录方面具有协同效果。这些效果在仅治疗非常短的时间段,即4周后便能观察到,而EYP001或IFN在单独使用时在相同剂量下和相同时间段后均未显示显著效果。此外,令人惊讶地,在相同的日剂量下,每天施用一次EYP001与每天施用两次相比,协同效果是至少两倍。同样,在两种不同的HBV感染肝细胞模型中,观察到另一种FXR激动剂,即GW4064对细胞内HBV RNA水平以及HBeAg和HBsAg分泌有协同效果,而其它FXR激动剂,即Tropifexor、Nidufexor和奥贝胆酸(Ocaliva,OCA)对HBsAg分泌有协同效果。
因此,本发明涉及用于治疗乙型肝炎感染,尤其是慢性乙型肝炎的FXR激动剂与IFN的协同组合。
本发明涉及一种用于与干扰素α(IFN-α)或其聚乙二醇化形式组合以治疗乙型肝炎病毒感染,尤其是慢性乙型肝炎的FXR激动剂或包含其的药物组合物,其中使用所述FXR激动剂和IFN-α以获得减少HBV复制的协同效果。任选地,所述FXR激动剂不是EYP001。
本发明还涉及FXR激动剂或包含其的药物组合物用于制造与干扰素α(IFN-α)或其聚乙二醇化形式组合以治疗乙型肝炎病毒感染,尤其是慢性乙型肝炎的药物的用途,其中使用所述FXR激动剂和IFN-α以获得减少HBV复制的协同效果。本发明还涉及一种在有需要的受试者中治疗乙型肝炎病毒感染,尤其是慢性乙型肝炎的方法,所述方法包括施用治疗有效量或亚治疗量的FXR激动剂和施用治疗有效量或亚治疗量的干扰素α(IFN-α)或其聚乙二醇化形式,其中施用所述FXR激动剂和IFN-α以获得减少HBV复制的协同效果。任选地,所述FXR激动剂不是EYP001。
任选地,所述FXR激动剂选自LJN452(Tropifexor)、LMB763(Nidufexor)、GS-9674(Cilofexor)、PX-102(PX-20606)、PX-104(Phenex104)、OCA(奥贝胆酸)、EDP-297、EDP-305、TERN-101(LY2562175)、MET-409、MET-642、GW4064、WAY362450(妥芬异丙酯(Turofexorateisopropyl))、Fexaramine、AGN242266(AKN-083)和BAR502。在一个具体方面,所述FXR激动剂选自LJN452(Tropifexor)、LMB763(Nidufexor)、GS-9674(Cilofexor)、PX-102(PX-20606)、PX-104(Phenex104)、OCA(奥贝胆酸)、EDP-297、EDP-305、TERN-101(LY2562175)、MET-409、MET-642、GW4064、WAY362450(妥芬异丙酯)、Fexaramine、AGN242266(AKN-083)和BAR502,或其任何药学上可接受的盐。在一个更具体的方面,所述FXR激动剂选自Tropifexor、Nidufexor、奥贝胆酸和GW4064或其任何药学上可接受的盐。
任选地,所述FXR激动剂以亚治疗量施用。
在一个方面,所述FXR激动剂每天施用一次。在另一个方面,所述FXR激动剂每天施用两次。
在一个方面,所述IFN-α是IFN-α2a、IFN-α2b或其聚乙二醇化形式。优选地,IFN-α或其聚乙二醇化形式通过皮下途径每周施用一次。任选地,IFN-α或其聚乙二醇化形式可以以亚治疗量施用。
在一个具体方面,所述FXR激动剂和IFN-α或其聚乙二醇化形式都以亚治疗量施用。
在一个方面,所述FXR激动剂和IFN-α或其聚乙二醇化形式在5周、6周、7周或8周至52周的时间段内施用。
在一个方面,所述FXR激动剂和IFN-α或其聚乙二醇化形式与至少一种其它活性成分组合使用。更具体地,所述至少一种其它活性成分是选自L-核苷、脱氧鸟苷类似物和核苷膦酸酯的聚合酶抑制剂。在一个非常具体的方面,所述至少一种其它活性成分选自拉米夫定、替比夫定、恩曲他滨、恩替卡韦、阿德福韦和替诺福韦。
附图说明
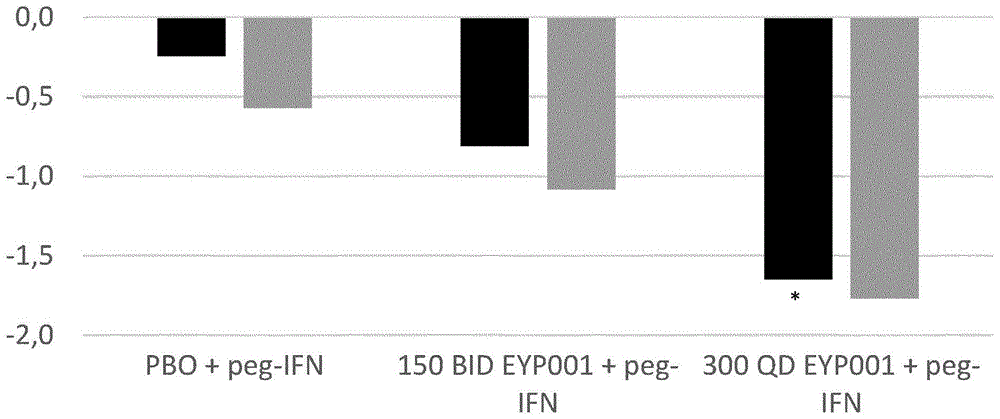
图1:FXR激动剂EYP001a或安慰剂与干扰素组合在早先未治疗的慢性感染HBV患者中的4周抗HBV治疗过程后相对于基线的HBV pgRNA(log10拷贝/mL)变化。PBO:安慰剂。peg-IFN:聚乙二醇化干扰素α2a。150BID:150mg每日两次。300QD:300mg每日一次。pgRNA:前基因组核糖核酸。黑色柱是第29天治疗结束时的变化。灰色柱是第35天治疗结束后一周的变化。*p=0.04
图2:FXR激动剂EYP001a或安慰剂与干扰素组合在早先未治疗的慢性感染HBV患者中的4周抗HBV治疗过程后相对于基线的HBcrAg(log10IU/mL)变化。PBO:安慰剂。peg-IFN:聚乙二醇化干扰素α2a。HbcrAg:乙型肝炎核心相关抗原。黑色柱是第29天治疗结束时的变化。灰色柱是第35天治疗结束后一周的变化。
图3.FXR激动剂和IFN-α对受感染的原代人肝细胞(PHH)中的HBV复制的协同效果。将新鲜制备和接种的PHH以250GE/细胞的感染复数感染HBV。从感染后第4天至第10天,将细胞用1或10μM+/-100IU/mL IFN-α或媒剂(NT)或100IU/mL IFN-α单独进行处理。在第10天收集细胞和上清液以用于细胞内HBV RNA、病毒血症和分泌抗原(HBsAg和HBeAg)定量。结果是以三个生物学重复进行的一个实验的平均值+/-SD。
图4.FXR激动剂和IFN-α对HBV感染的原代人肝细胞(PHH)中HBsAg分泌的协同效果。将新鲜制备和接种的PHH以250GE/细胞的感染复数感染HBV。从感染后第4天至第10天,将细胞用10μM Vonafexor或10μM Nidufexor或1μM Tropifexor或10μM OCA或10μMGW4064、+/-100IU/mL IFN-α(IFN)或媒剂或100IU/mL IFN-α单独进行处理。第10天收集上清液以用于分泌HBs抗原(HBsAg)定量。结果是以三个重复进行的五个实验的平均值+/-SEM。
图5.FXR激动剂和IFN-α对HBV感染的dHepaRG细胞中HBsAg分泌的协同效果。将分化的HepaRG(dHepaRG)细胞以250GE/细胞的MOI感染HBV。从感染后第7天至第14天,将细胞用10μM Vonafexor或10μM Nidufexor或1μM Tropifexor或10μM OCA或10μM GW4064、+/-25IU/mL IFN-α或媒剂或25IU/mL IFN-α单独进行处理。第14天收集上清液以用于分泌HBs抗原(HBsAg)定量。结果是以三个重复进行的三个实验的平均值+/-SEM。
具体实施方式
发明人观察到FXR激动剂与IFN-α的组合治疗令人惊讶地对慢性乙型肝炎产生了协同效果。因此,通过使用FXR激动剂与IFN-α的协同组合,可以为患者获得治疗益处。
定义
术语“FXR”是指法尼醇X受体,它是一种被超生理水平的法尼醇激活的核受体(Forman等人,Cell,1995,81,687-693)。FXR也称为NR1H4,类视黄醇X受体相互作用蛋白14(RIP14)和胆汁酸受体(BAR)。含有保守DNA结合域(DBD)和C端配体结合域(LBD)的FXR与多种天然存在的胆汁酸(BA),包括初级胆汁酸鹅脱氧胆酸(CDCA)及其牛磺酸和甘氨酸缀合物结合并被激活。激活后,FXR-RXR异二聚体结合靶基因的启动子区域并调控胆汁酸稳态涉及的若干个基因的表达。肝脏FXR靶基因主要分为两组。第一组通过增加输出和减少其合成来降低肝脏胆汁酸浓度。第二组FXR靶基因,如磷脂转运蛋白PLTP和载脂蛋白,调节血清脂蛋白水平并降低血浆甘油三酯浓度。关于FXR调控的基因的更详细列表,参见例如WO 03/016288第22-23页。美国专利6,005,086公开了编码哺乳动物FXR蛋白的核酸序列。FXR的人多肽序列以登记号NM_005123、Q96RI1、NP_005114、AAM53551、AAM53550、AAK60271存储在核苷酸和蛋白质数据库中。
在本说明书中,术语“FXR激动剂”具有其在本领域的一般含义,并且特别指通过靶向和结合法尼醇X受体(FXR)起作用并且在Maloney等人(J.Med.Chem.2000,43:2971-2974)所述的测定中激活FXR达到比背景高至少40%的化合物。
在一些实施方式中,本发明的FXR激动剂是选择性FXR激动剂。如本文所用,术语“选择性FXR激动剂”是指对由LXRα、LXRβ、PPARα、PPARγ、PPARδ、RXRα、RARγ、VDR、PXR、ERα、ERβ、GR、AR、MR和PR组成的一组核受体中的一种或多种(理想地,基本上全部)不表现出显著交叉反应性的FXR激动剂。确定显著交叉反应性的方法描述于J.Med.Chem.2009,52,904-907中。
如本文所用,术语“治疗”是指意在改善患者的健康状态的任何作用,如治疗、预防、预防和延迟疾病。在某些实施方案中,此类术语是指改善或根除疾病或与之相关的症状。在其它实施方式中,该术语是指由于向患有此类疾病的受试者施用一种或多种治疗剂而使疾病的扩散或恶化最小化。更具体地,术语“治疗”是指通过施用组合物来减轻HBV感染、阻止疾病发展和/或去除HBV。
更特别地,乙型肝炎感染,尤其是慢性乙型肝炎的治疗表现为HBV复制减少。HBV复制可以通过在受试者中测定HBeAg水平、HBsAg水平、HBcrAg水平、前基因组RNA(HBV pgRNA)水平、前核RNA水平、松弛环状DNA(HBV rcDNA)水平、HBV cccDNA水平或HBV DNA水平中的至少一项进行评估。HBsAg损失和血清转化通常是临床治疗的目标。降低意指HBeAg水平、HBsAg水平、HBcrAg水平、前基因组RNA(HBV pgRNA)水平、前核RNA水平、松弛环状DNA(HBVrcDNA)水平、HBV cccDNA水平和HBV DNA水平中至少一项的水平与未治疗时相比有所降低。
减少HBV复制优选地意指HBV复制与未治疗时的HBV复制相比减少至少10或100倍。例如,可以通过测定HBV DNA水平来评估HBV复制,该水平与不存在EYP001时的HBV复制相比降低了至少10或100倍。或者,HBV cccDNA水平与未治疗时相比降低了至少10%、15%、20%、25%、30%、35%、40%、45%或50%。
如本文所用,术语“受试者”、“个体”或“患者”可互换并且是指人类,包括成人、儿童、新生儿和胎儿阶段的人类。在一个具体方面,所述受试者或患者经历乙型肝炎感染,特别是慢性乙型肝炎。
术语“数量”、“量”和“剂量”在本文可互换使用,并且可以指分子的绝对定量。
如本文所用,术语“治疗效果”是指通过根据本发明的活性成分或药物组合物诱导的能够预防或延迟疾病或病症出现或发展或者治愈或减轻疾病或病症影响的效果。
如本文所用,术语“治疗有效量”是指预防、消除或减轻疾病,特别是感染性疾病的不利影响的活性成分或药物组合物的数量。显然,本领域技术人员可以根据所治疗的受试者、疾病的性质等来调整施用的数量。特别地,施用剂量和方案可以随所治疗的疾病的性质、阶段和严重程度,以及所治疗的受试者的体重、年龄和整体健康状况,以及医生的判断而变化。
如本文所用,术语“亚治疗量”或“亚治疗剂量”是指比在不存在其它剂的情况下施用时在受试者中产生治疗结果的剂量低的剂量。例如,“亚治疗量”或“亚治疗剂量”可以指与单独使用时的治疗有效量,尤其是用于相同适应症和相同施用途径的常规治疗剂量相比减少了25%、50%、70%、80%或90%的剂量。常规治疗剂量是药物批准机构(例如FDA或EMEA)认可的剂量。
如本文所用,术语“赋形剂或药学上可接受的载体”是指药物组合物中存在的除活性成分以外的任何成分。加入它的目的可能是旨在赋予最终产品特定的稠度或其它物理或味觉性质。赋形剂或药学上可接受的载体必须与活性成分无任何相互作用,特别是化学作用。
如本文所用,术语“聚乙二醇化形式”是指聚乙二醇化干扰素。
“协同效果”意在指减少HBV复制的效果超过各个分子单独的效果的总和。HBV复制可以通过测定表面HBV抗原(HBsAg)、HBeAg、HBV核心相关抗原(HBcrAg)、HBV DNA、HBV前基因组RNA、HBV前核心RNA和/或HBV cccDNA来评估。更特别地,观察到了对前基因组RNA(HBVpgRNA)和/或乙型肝炎核心相关抗原(HBcrAg)的影响。
组合治疗
本发明涉及FXR激动剂和IFN的组合用于治疗乙型肝炎病毒感染,尤其是慢性乙型肝炎的用途。事实上,该组合对HBV产生了协同效果。
因此,本发明涉及
-一种药物组合物,所述药物组合物包含FXR激动剂和IFN-α或其聚乙二醇化形式以及任选的药学上可接受的载体和/或其它活性成分,特别是用于治疗乙型肝炎病毒感染,尤其是慢性乙型肝炎,其中使用所述FXR激动剂和IFN-α以获得减少HBV复制的协同效果;
-一种产品或药盒,所述产品或药盒含有FXR激动剂或包含它的药物组合物和IFN-α或其聚乙二醇化形式作为组合制剂以供同时、单独或顺序使用,特别是用于治疗乙型肝炎病毒感染,尤其是慢性乙型肝炎,其中使用所述FXR激动剂和IFN-α以获得减少HBV复制的协同效果;任选地,所述产品或药盒可以包含至少一种其它活性成分;
-一种组合制剂,所述组合制剂包含FXR激动剂或包含它的药物组合物和IFN-α或其聚乙二醇化形式以供同时、单独或顺序使用,特别是用于治疗乙型肝炎病毒感染,尤其是慢性乙型肝炎,其中使用所述FXR激动剂和IFN-α以获得减少HBV复制的协同效果;任选地,所述组合制剂可以包含至少一种其它活性成分;
-一种包含FXR激动剂的药物组合物,所述药物组合物与包含IFN-α或其聚乙二醇化形式的治疗组合用于治疗乙型肝炎病毒感染,尤其是慢性乙型肝炎,其中使用所述FXR激动剂和IFN-α以获得减少HBV复制的协同效果;任选地,所述药物组合物可以包含至少一种其它活性成分;
-一种包含IFN-α或其聚乙二醇化形式的药物组合物,所述药物组合物与包含FXR激动剂的治疗组合用于治疗乙型肝炎病毒感染,尤其是慢性乙型肝炎,其中使用所述FXR激动剂和IFN-α以获得减少HBV复制的协同效果;任选地,所述药物组合物可以包含至少一种其它活性成分;
-一种包含FXR激动剂的药物组合物用于制造与包含IFN-α或其聚乙二醇化形式的治疗组合用于治疗乙型肝炎病毒感染,尤其是慢性乙型肝炎的药物的用途,其中使用所述FXR激动剂和IFN-α以获得减少HBV复制的协同效果;任选地,所述药物组合物可以包含至少一种其它活性成分;
-一种包含IFN-α或其聚乙二醇化形式的药物组合物用于制造与包含FXR激动剂的治疗组合用于治疗乙型肝炎病毒感染,尤其是慢性乙型肝炎的药物的用途,其中使用所述FXR激动剂和IFN-α以获得减少HBV复制的协同效果;任选地,所述药物组合物可以包含至少一种其它活性成分;
-一种包含FXR激动剂和IFN-α或其聚乙二醇化形式以及任选的药学上可接受的载体的药物组合物用于制造用于治疗乙型肝炎病毒感染,尤其是慢性乙型肝炎的药物的用途,其中使用所述FXR激动剂和IFN-α以获得减少HBV复制的协同效果;任选地,所述药物组合物可以包含至少一种其它活性成分;
-一种在有需要的受试者中治疗乙型肝炎病毒感染,尤其是慢性乙型肝炎的方法,所述方法包括施用有效量的包含a)FXR激动剂、b)IFN-α或其聚乙二醇化形式以及药学上可接受的载体的药物组合物,其中使用所述FXR激动剂和IFN-α以获得减少HBV复制的协同效果;任选地,所述药物组合物可以包含至少一种其它活性成分,或所述方法还可以包括施用至少一种其它活性成分;
-一种在有需要的受试者中治疗乙型肝炎病毒感染,尤其是慢性乙型肝炎的方法,所述方法包括施用有效量的包含FXR激动剂的药物组合物,和有效量的包含IFN-α或其聚乙二醇化形式的药物组合物,其中使用所述FXR激动剂和IFN-α以获得减少HBV复制的协同效果;任选地,所述药物组合物之一可以包含至少一种其它活性成分,或所述方法还可以包括施用至少一种其它活性成分。
FXR激动剂对技术人员是众所周知的。
例如,技术人员可以从以下出版物(其公开内容通过引用并入本文)中容易地发现FXR激动剂:
Abenavoli L等人,Pharmaceuticals(Basel).2018年10月11日;11(4).pii:E104。doi:10.3390/ph11040104。综述。
Adorini L等人,Drug Discov Today.2012年9月;17(17-18):988-97。doi:10.1016/j.drudis.2012.05.012。2012年5月29日电子出版。综述。
Akwabi-Ameyaw A等人,Bioorg Med Chem Lett.2009年8月15日;19(16):4733-9。doi:10.1016/j.bmcl.2009.06.062。2009年6月21日电子出版。
Akwabi-Ameyaw A等人,Bioorg Med Chem Lett.2008年8月1日;18(15):4339-43。doi:10.1016/j.bmcl.2008.06.073。2008年6月28日电子出版。
Akwabi-Ameyaw A等人,Bioorg Med Chem Lett.2011年10月15日;21(20):6154-60。doi:10.1016/j.bmcl.2011.08.034。2011年8月11日电子出版。
Baghdasaryan A等人,Hepatology.2011年10月;54(4):1303-12。doi:10.1002/hep.24537。
Bass JY等人,Bioorg Med Chem Lett.2009年6月1日;19(11):2969-73。doi:10.1016/j.bmcl.2009.04.047。2009年4月18日电子出版。
Bass JY等人,Bioorg Med Chem Lett.2011年2月15日;21(4):1206-13。doi:10.1016/j.bmcl.2010.12.089。2010年12月23日电子出版。
Buijsman等人,Curr.Med.Chem.2005,12,1017
Carino等人,Sci Rep.2017年2月16日;7:42801。doi:10.1038/srep42801。
Chiang PC等人,J Pharm Sci.2011年11月;100(11):4722-33。doi:10.1002/jps.22664。2011年6月9日电子出版。
Crawley,Expert Opin.Ther.Pat.2010,20,1047
Feng S等人,Bioorg Med Chem Lett.2009年5月1日;19(9):2595-8。doi:10.1016/j.bmcl.2009.03.008。2009年3月9日电子出版。
Festa等人,Front Pharmacol.2017年3月30日;8:162。doi:10.3389/fphar.2017.00162。2017年电子合集。
Finamore等人,Sci Rep.2016年7月6日;6:29320。doi:10.1038/srep29320。
Flatt B等人,J Med Chem.2009年2月26日;52(4):904-7。doi:10.1021/jm8014124。
Gege等人,Curr Top Med Chem.2014;14(19):2143-58。
Gege等人,Handbook ofExperimental Pharmacology,doi:10.1007/164_2019_232。
Genin等人,J Med Chem.2015年12月24日;58(24):9768-72。doi:10.1021/acs.jmedchem.5b01161。2015年12月2日电子出版。
Ghebremariam YT等人,PLoS One.2013年4月4日;8(4):e60653。doi:10.1371/journal.pone.0060653。2013年印刷。
Gioiello A等人,Bioorg Med Chem.2011年4月15日;19(8):2650-8。doi:10.1016/j.bmc.2011.03.004。2011年3月10日电子出版。
Hoekstra M等人,Mol Cell Endocrinol.2012年10月15日;362(1-2):69-75。doi:10.1016/j.mce.2012.05.010。2012年5月27日电子出版。
Iguchi Y等人,Steroids.2010年1月;75(1):95-100。doi:10.1016/j.steroids.2009.11.002。2009年11月12日电子出版。
Kinzel等人,Bioorg Med Chem Lett.2016年8月1日;26(15):3746-53。doi:10.1016/j.bmcl.2016.05.070。2016年5月24日电子出版。
Lin HR.Bioorg Med Chem Lett.2012年7月15日;22(14):4787-92。doi:10.1016/j.bmcl.2012.05.057。2012年5月23日电子出版。
Lundquist JT等人,J Med Chem.2010年2月25日;53(4):1774-87。doi:10.1021/jm901650u。
Ma Y等人,Pharm Res.2013年5月;30(5):1447-57。doi:10.1007/s11095-013-0986-7。2013年2月1日电子出版。
Marinozzi M等人,Bioorg Med Chem.2013年7月1日;21(13):3780-9。doi:10.1016/j.bmc.2013.04.038。2013年4月23日电子出版。
Massafra等人,Pharmacol Ther.2018年11月;191:162-177。doi:10.1016/j.pharmthera.2018.06.009。2018年6月20日电子出版。
Misawa T等人,Bioorg Med Chem Lett.2012年6月15日;22(12):3962-6。doi:10.1016/j.bmcl.2012.04.099。2012年4月30日电子出版。
Pellicciari等人,J Med Chem.2016年10月4日。
Richter HG等人,Bioorg Med Chem Lett.2011年2月15日;21(4):1134-40。doi:10.1016/j.bmcl.2010.12.123。2010年12月31日电子出版。
Rizzo G等人,Mol Pharmacol.2010年10月;78(4):617-30。doi:10.1124/mol.110.064501。2010年7月14日电子出版。
Roda等人,J Pharmacol Exp Ther.2014年7月;350(1):56-68。doi:10.1124/jpet.114.214650。2014年5月1日电子出版。
Schuster D等人,Bioorg Med Chem.2011年12月1日;19(23):7168-80。doi:10.1016/j.bmc.2011.09.056。2011年10月4日电子出版。
Schwabl等人,J Hepatol.2017年4月;66(4):724-733。doi:10.1016/j.jhep.2016.12.005。2016年12月18日电子出版。
Samlley等人,Bioorg Med Chem Lett.2015年1月15日;25(2):280-4。doi:10.1016/j.bmcl.2014.11.050。2014年11月26日电子出版。
Sepe等人,Expert Opin Ther Pat.2018年5月;28(5):351-364。doi:10.1080/13543776.2018.1459569。2018年4月13日电子出版。综述。
Sepe等人,Expert Opin Ther Pat.2015;25(8):885-96。doi:10.1517/13543776.2015.1045413。综述。
Soisson SM等人,Proc Natl Acad Sci U S A.2008年4月8日;105(14):5337-42。doi:10.1073/pnas.0710981105。2008年4月7日电子出版。
Townsend SA,Newsome PN.Aliment Pharmacol Ther.2017年9月;46(5):494-507。doi:10.1111/apt.14210。2017年7月4日电子出版。
Tully等人,J Med Chem.2017年12月28日;60(24):9960-9973。doi:10.1021/acs.jmedchem.7b00907。2017年12月8日电子出版。
Wang等人,J Am Soc Nephrol.2018年1月;29(1):118-137。doi:10.1681/ASN.2017020222。2017年10月31日电子出版。
Wang等人,Bioorg Med Chem Lett.2017年8月1日;27(15):3386-3390。doi:10.1016/j.bmcl.2017.06.003。2017年6月3日电子出版。
Wang H等人,Expert Opin Ther Pat.2018年11月;28(11):765-782。doi:10.1080/13543776.2018.1527906。2018年10月8日电子出版。综述
Watanabe M等人,J Biol Chem.2011年7月29日;286(30):26913-20。doi:10.1074/jbc.M111.248203。2011年6月1日电子出版。
Yu D等人,Steroids.2012年11月;77(13):1335-8。doi:10.1016/j.steroids.2012.09.002。2012年9月21日电子出版。
Zhang S等人,J Hepatol.2009年8月;51(2):380-8。doi:10.1016/j.jhep.2009.03.025。2009年5月18日电子出版。
通常,FXR激动剂包括类固醇FXR激动剂和非类固醇FXR激动剂类别。
在本发明的某些实施方式中,所述FXR激动剂选自以下出版物所公开的充当FXR调节剂的小分子化合物:EP1392714;EP1568706;JP2005281155;US20030203939;US2005080064;US2006128764;US20070015796;US20080038435;US20100184809;US20110105475;US6,984,560;WO2000037077;WO200040965;WO200076523;WO2003015771;WO2003015777;WO2003016280;WO2003016288;WO2003030612;WO2003016288;WO2003080803;WO2003090745;WO2004007521;WO2004048349;WO2004046162;WO2004048349;WO2005082925;WO2005092328;WO2005097097;WO2007076260;WO2007092751;WO2007140174;WO2007140183;WO2008002573;WO2008025539;WO2008025540;WO200802573;WO2008051942;WO2008073825;WO2008157270;WO2009005998;WO2009012125;WO2009027264;WO2009080555;WO2009127321;WO2009149795;WO2010028981;WO2010034649;WO2010034657;WO2017218330;WO2017218379;WO2017201155;WO2017201152;WO2017201150;WO2017189652;WO2017189651;WO2017189663;WO2017147137;WO2017147159;WO2017147174;WO2017145031;WO2017145040;WO2017145041;WO2017133521;WO2017129125;WO2017128896;WO2017118294;WO2017049172;WO2017049176;WO2017049173;WO2017049177;WO2016173397;WO2016173493;WO2016168553;WO2016161003;WO2016149111;WO2016131414;WO2016130809;WO2016097933;WO2016096115;WO2016096116;WO2016086115;WO2016073767;WO2015138986;WO2018152171;WO2018170165;WO2018170166;WO2018170173;WO2018170182;WO2018170167;WO2017078928;WO2014184271;WO2013007387;WO2012087519;WO2011020615;WO2010069604;WO2013037482;US2017275256;WO2005080064;WO2018190643;WO2018215070;WO2018215610;WO2018214959;WO2018081285;WO2018067704;WO2019007418;WO2018059314;WO2017218337;WO2020231917;WO2020211872;WO2020168143;WO2020168148;WO2020156241;WO2020150136;WO2020114307;WO2020061118;WO2020061114;WO2020061112;WO2020061113;WO2020061116,WO2020061117;WO2020011146;WO2020001304;WO2019160813;WO2019120088;WO2019118571;WO2019089667;WO2019089672;WO2019089665;WO2019089664;WO2019089670;它们的公开内容通过引用并入本文。
在一个方面,所述FXR激动剂可以是以下专利申请所公开的任何FXR激动剂:WO2017/049172、WO2017/049176、WO2017/049173、WO2017/049177、WO2018/170165、WO2018/170166、WO2018/170173、WO2018/170182和WO2018/170167。
FXR激动剂的具体示例包括但不限于EYP001;GW4064(如PCT公开号WO 00/37077或US2007/0015796所公开);6-乙基-鹅脱氧胆酸,尤其是3α,7α-二羟基7α-二羟基-6α-乙基-5β-胆烷-24-酸,也称为INT-747(OCA);INT-777;6-乙基-熊脱氧胆酸、INT-1103、UPF-987、WAY-362450、MFA-1、GW9662、T0901317、fexaramine、3β-叠氮基-6α-乙基-7α-羟基-5β-胆烷-24-酸、GS-9674(Cilofexor)(Phenex Pharmaceuticals股份有限公司)、Tropifexor(LJN452)、LMB763(Nidufexor)、PX-102(PX-20606)、PX-104(Phenex 104)、EDP-297、EDP-305、TERN-101(LY2562175)、MET-409、MET-642、WAY362450;Fexaramine,特别是fexaramine-3(Fex-3);AGN-242266(原AKN-083,Allergan)、BAR502、BAR704、PX20606、PX20350、3α,7α,11β-三羟基-6α-乙基-5β-胆烷-24-酸(TC-100)、6-(4-{[5-环丙基-3-(2,6-二氯苯基)异
在一些实施方式中,所述FXR激动剂选自奥贝胆酸(Intercept Pharma)、胆酸(CT-RS);GS-9674(Cilofexor)(Phenex Pharmaceuticals股份有限公司)、Tropifexor(LJN452)(Novartis Pharmaceuticals)、LMB763(Nidufexor)、PX-102(PX-20606)、PX-104(Phenex104)、EYP001、OCA、EDP-297、EDP-305、类固醇非羧酸型FXR激动剂(EnantaPharmaceuticals)、妥芬异丙酯(Pfizer)、INT-767(Intercept Pharmaceuticals)、LY-2562175(Lilly)、AGN-242266(原AKN-083,Allergan)、EP-024297(EnantaPharmaceuticals)、M-480(Metacrine)、TERN-101(LY2562175)、MET-409(Metacrine)、MET-642(Metacrine)、BAR502、RDX-023(Ardelyx)、GW4064、GW6046、WAY362450、咖啡醇、Fexaramine和通过CAS号1192171-69-9鉴定的化合物PXL007(也称为EYP001或EYP001a)(如WO 2009127321所述)。在一个具体实施方式中,所述FXR激动剂选自INT-747、通过EDP-305鉴定的化合物、类固醇非羧酸型FXR激动剂(Enanta Pharmaceuticals)和通过CAS号1192171-69-9鉴定的化合物(如WO 2009127321所述)。
在一个具体方面,所述FXR激动剂选自LJN452(Tropifexor)、GS-9674(Cilofexor)、LMB763(Nidufexor)、PX-102(PX-20606)、PX-104(Phenex 104)、OCA(奥贝胆酸)、EDP-297、EDP-305、TERN-001、MET-409、MET-642、GW4064、WAY362450(妥芬异丙酯)、Fexaramine、AGN242266(AKN-083)、BAR502和PXL007(也称为EYP001)。
在一个非常具体的方面,所述FXR激动剂选自OCA(奥贝胆酸)(Intercept)、EDP-297(Enanta)、EDP-305(Enanta)、GS-9674(Cilofexor)(Gilead)、TERN-001(TERNS)、MET-409(Metacrine)、MET-642(Metacrine)、LJN452(Tropifexor)(Novartis)、LMB763(Nidufexor)(Novartis)和AGN242266(AKN-083)(Abbvie)。
在一个具体方面,所述FXR激动剂选自表1所公开的化合物。
表1
/>
/>
及其任何药学上可接受的盐。
在一个具体方面,所述FXR激动剂选自Tropifexor、Nidufexor、奥贝胆酸和GW4064或其任何药学上可接受的盐。
在本发明的一个优选方面,所述FXR激动剂不是EYP001。
所述FXR激动剂可以每天施用一次、两次或三次,优选一次或两次,例如在早晨(例如,在上午6点至10点之间)或在晚上(例如,下午6点至10点)。在一个方面,所述FXR激动剂每天施用一次。在另一个方面,所述FXR激动剂每天施用两次。优选每天施用。然而,也可以设想每2天、3天、4天、5天、6天或7天施用。所述FXR激动剂的日剂量可以在每个成人每天1μg至1,000mg的宽范围内变化。所述FXR激动剂可以通过口服、舌下、皮下、肌肉内、静脉内、透皮、局部或直肠施用,优选口服施用来施用。
在一个具体方面,所述FXR激动剂以亚治疗量施用。任选地,所述FXR激动剂的剂量可以至少减少到1/2、1/3、1/4或1/5,优选至少减少到1/2或1/3。任选地,所述FXR激动剂的剂量可以在每天0.001至200mg或每天50至200mg或每天50至100mg的范围内。
在一个具体方面,所述FXR激动剂的剂量是与单独使用时的治疗有效量,尤其是用于相同适应症和相同施用途径的常规治疗剂量相比减少了25%、50%、70%、80%或90%的剂量。
IFN-α可以是例如IFN-α1或IFN-α2,例如IFN-α1a、IFN-α1b、IFN-α2a、IFN-α2b、IFN-α2c或复合IFN-α。在一个非常具体的方面,IFN是IFN-α2a、IFN-α2b或其聚乙二醇化形式。
任选地,IFN-α选自由以下组成的非详尽清单:复合IFN-α(例如,
在一个方面,所述IFNα或其聚乙二醇化形式通过皮下途径每周施用一次;例如,以1μg至500μg,优选10μg至500μg,更优选100μg至250μg,如100μg、110μg、120μg、130μg、140μg、150μg、160μg、170μg、180μg、190μg或200μg的剂量。
任选地,所述IFNα或其聚乙二醇化形式可以以亚治疗量施用。
任选地,所述IFNα或其聚乙二醇化形式和所述FXR激动剂以亚治疗量施用。
优选地,包含FXR激动剂和IFN-α的组合疗法对减少HBV的复制有效。
在包含FXR激动剂和IFN-α(即,IFN-α2a、IFN-α2b或其聚乙二醇化形式)的组合治疗的情况下,发明人惊讶地观察到每天施用EYP001一次时的协同效果与以相同日剂量每天施用两次相比是至少两倍。此外,发明人还观察到,令人惊讶地,当每天施用一次EYP001而不是每天两次时,瘙痒症发生率较低。因此,在一个具体方面,所述FXR激动剂每天施用一次。
优选地,为了对症调整欲治疗患者的剂量,所述组合物、剂量单位或剂型含有1μg至500mg或1000mg的FXR激动剂。
在一个方面,所述剂型可以是刻痕剂型。或者,可以通过施用若干剂型来提供日剂量。
所述FXR激动剂可以与药学上可接受的赋形剂和任选的持续释放基质如可生物降解聚合物组合以形成药物组合物。
“药学上”或“药学上可接受的”是指当视情况施用于哺乳动物,尤其是人类时不会产生不良反应、过敏反应或其它不利反应的分子实体和组合物。药学上可接受的载体或赋形剂是指任何类型的无毒固体、半固体或液体填充剂、稀释剂、包封材料或配制助剂。
包含FXR激动剂的药物组合物可能适合于口服、舌下、皮下、肌肉内、静脉内、透皮、局部或直肠施用,优选口服施用。
单独或与另一种活性成分组合使用的FXR激动剂可以作为与常规药用载体的混合物以单位施用形式施用。合适的单位施用形式包括口服途径形式,如片剂、凝胶胶囊、粉剂、颗粒剂和口服悬浮液或溶液、舌下和口腔施用形式、气雾剂、植入物、皮下、透皮、局部、腹膜内、肌肉内、静脉内、皮下、透皮、鞘内和鼻内施用形式以及直肠施用形式。
在一个优选实施方式中,所述口服剂型是胶囊或片剂。任选地,所述口服剂型是刻痕剂型。任选地,所述剂型可以分为四片、三片或两片。
任选地,治疗持续2个月至4个月直至24个月,例如在2个月与24个月之间或在2个月与12个月之间,例如2个月、3个月、4个月、5个月、6个月、7个月、8个月、9个月、10个月、11个月、12个月、13个月、14个月、15个月、16个月、17个月、18个月、19个月、20个月、21个月、22个月、23个月或24个月。在一个非常具体的方面,治疗持续12周至52周,优选45周至52周,例如48周。
FXR激动剂和IFN-α或其聚乙二醇化形式可以与至少一种其它活性成分组合使用。优选地,所述其它活性成分是抗病毒剂,更特别是具有抗HBV活性的抗病毒剂。在一个优选方面,所述至少一种其它活性成分是选自L-核苷、脱氧鸟苷类似物和核苷膦酸酯的聚合酶抑制剂。在一个非常具体的方面,所述至少一种其它活性成分选自拉米夫定、替比夫定、恩曲他滨、恩替卡韦、阿德福韦和替诺福韦。
以下实施例将描述本发明的其它方面和优点,所述实施例应被视为说明性的而非限制性的。
实施例
实施例1-FXR激动剂EYP001
HBV慢性感染患者(男性(n=39)和女性(n=34))进行了4周疗程,在研究的A部分每日口服FXR激动剂EYP001a单药疗法或安慰剂或恩替卡韦(ETV)(n=48),在B部分与干扰素组合(n=23,每周皮下注射聚乙二醇化IFNα2a,PEG-IFN)。患者特征为:平均年龄39.7岁(范围:19-63岁);73人中有6人为HBeAg阳性;70%未进行过治疗;平均基线HBV DNA 4.2(±1.5SD)log10IU/mL,HBsAg 3.5(±0.8SD)log10IU/mL,基因型A(25),基因型B(8),基因型C(10),基因型D(7)和基因型E(4)。详细的病毒学特征总结在表B和表C中。FXR与所有EYP001剂量的结合导致C4减少和FGF19增加(数据未示出)。
第29天治疗结束时,400mg QD EYP001使平均HBsAg降低了-0.1log10IU/mL(p<0.05)。令人惊讶地,当EYP001与peg-IFN组合时,HBV复制的早期标记物pgRNA和HBcrAg显示出协同降低,但在peg-IFN或EYP001单药疗法的情况下则没有(表A)。平均HBV pgRNA降低为-1.7log10拷贝/mL(p<0.05),平均HBcrAg降低为-0.9log10IU/mL(p=0.15),而安慰剂+Peg-IFN组没有显著下降(-0.2log10拷贝/mL pgRNA,-0.4log10IU/mL HBcrAg)。该效果持续到第35天,即治疗结束(EoT)后7天(图1和图2)。与BID相比,在QD下观察到更强的协同效果。
表A
表B:A部分基线HBV感染参数的总结
/>
表C:B部分基线HBV感染参数的总结
实施例2-FXR激动剂GW4064
材料和方法
原代人肝细胞
在法国部长级授权(AC 2013-1871、DC 2013-1870、AFNOR NF 96900sept 2011)下,如Lecluyse等人(Methods Mol.Biol.Clifton NJ 640,57-82(2010))先前所述,由获自区域癌症中心(里昂)的人肝切片新鲜制备原代人肝细胞(PHH)。
病毒
根据Ladner等人(Antimicrob.Agents Chemother.41,1715–1720(1997))先前所述的方案,使用HepAD38细胞系制备HBV储备液(基因型D,Genbank ID U95551)。
使含有HBV粒子的上清液澄清(0.45μm过滤器),用8%PEG 8000(Sigma-Aldrich)浓缩。
使用AmpliPrep/
化学品
GW4064[3-(2,6-二氯苯基)-4-(3-羧基-2-氯-芪-4-基)-氧甲基-5-异丙基异
干扰素α-2(ROFERON-A)购自Roche。
HBs和HBe定量
进行必要的稀释后,使用Autobio试剂盒(Autobio,中国),根据制造商的方案对细胞上清液中分泌的HBs和HBe抗原进行定量。
通过qPCR对病毒RNA进行定量
使用NucleoSpin RNA Plus(Macherey-Nagel)制备总RNA。用TURBO DNA酶(Ambion)进行DNA消化后,使用高性能RNA-to-cDNA试剂盒(Thermo Fisher Scientific)反转录最多1000ng RNA。用引物HBV-F(5'-AGCTACTGTGGAGTTACTCTCGT-3'SEQ ID NO:1)和HBV-R(5'-CAAAGAATTGCTTGCCTGAGTG-3'SEQ ID NO:2)进行定量PCR以便对前基因组/前核HBV RNA进行定量。使用QuantiFast
结果:包含FXR调节剂和IFN-α的组合治疗协同抑制PHH中的HBV复制。
为了确定FXR激动剂和干扰素-α(IFN-α)对HBV感染的组合影响,在原代人肝细胞(PHH)中进行了体外感染。PHH在天然情况下易受体外产生的HBV病毒体感染,导致病毒复制水平非常高。
使用2种浓度的GW4064和单一浓度的IFN-α来测定FXR激动剂和干扰素-α(IFN-α)对HBV复制的组合影响(图3)。单独使用时,GW4064仅能以剂量反应方式降低细胞内HBV RNA水平和HBeAg分泌;它不能显著影响病毒血症和HBsAg分泌。单独的100IU/mL IFN-α能够减少病毒血症和HBeAg分泌,而它对细胞内HBV RNA水平和HBsAg分泌几乎没有效果。两种分子的组合对细胞内HBV RNA水平以及HBeAg和HBsAg分泌产生了协同效果;所述协同效果对HBsAg分泌特别强。
结论
在PHH模型中观察FXR激动剂(GW4064)与IFN-α之间的协同作用。这种协同作用对HBsAg分泌特别明显。
实施例3–与其它FXR激动剂的协同效果
材料和方法
HepaRG
来源于人肝细胞癌的HepaRG细胞系在限定的条件下培养4周后可以分化并恢复肝细胞的许多表型性状(Hantz,O.等人,J.Gen.Virol.90,127-135(2009))。如先前所述对HepaRG细胞进行培养、分化和通过HBV感染(Gripon,P.等人,Proc.Natl.Acad.Sci.U.S.A.99,15655–15660(2002);Alfaiate,D等人,AntiviralRes.136,19-31(2016))。简而言之,为了分化,将细胞在标准培养基中保持2周,然后在补充有1.8%DMSO的标准培养基中保持至少2周。标准培养基的组成如下:威廉姆氏E培养基,补充有10%HyCLone FetalClone II血清(Thermo Fisher Scientific)、青霉素/链霉素、L-谷氨酰胺、胰岛素-转铁蛋白-硒(Gibco)和50μM氢化可的松半琥珀酸酯。
原代人肝细胞
在法国部长级授权(AC 2013-1871、DC 2013-1870、AFNOR NF 96900sept 2011)下,如先前所述(Lecluyse,E.L.和Alexandre,E.Methods Mol.Biol.Clifton NJ 640,57-82(2010)),由获自区域癌症中心(里昂)的人肝切片新鲜制备原代人肝细胞(PHH)。
病毒
根据先前所述的方案(Ladner,S.K.等人,Antimicrob.Agents Chemother.41,1715-1720(1997)),使用HepAD38细胞系制备HBV储备液(基因型D,Genbank ID U95551)。
使含有HBV粒子的上清液澄清(0.45μm过滤器),用8%PEG 8000(Sigma-Aldrich)浓缩。
使用AmpliPrep/
HBs定量
进行必要的稀释后,使用Autobio试剂盒(Autobio,中国),根据制造商的方案对细胞上清液中分泌的HBs抗原进行定量。
结果:包含FXR激动剂和IFN-α的组合治疗协同抑制HBV感染的PHH和HBV感染的HepaRG细胞的HBsAg分泌。
为了确定FXR激动剂和干扰素-α(IFN-α)对HBV感染的组合影响,在原代人肝细胞(PHH)中和分化的HepaRG细胞(dHepaRG)中进行了体外感染。PHH在天然情况下易受体外产生的HBV病毒体感染,导致病毒复制水平非常高。分化后,HepaRG细胞也易受体外产生的HBV病毒体感染,但复制水平低于在PHH观察到的复制水平。
在PHH模型中,评估了五种不同的FXR激动剂(Vonafexor、Nidufexor、Tropifexor、OCA和GW4064)单独或与IFN-α组合时对HBsAg分泌的影响(图4)。尽管被测FXR激动剂之间在结构上存在显著差异,但五种FXR激动剂中的每一种与IFN-α的组合均可对HBsAg分泌产生协同效果。
在HepaRG模型中也观察到了FXR激动剂和IFN-α之间的相同类型的协同效果,对所有FXR激动剂进行了评估(图5)。
结论
在PHH和HepaRG模型中均观察到不同的FXR激动剂与IFN-α之间对HBsAg分泌抑制的协同作用。由于降低慢性感染患者血液中的HBsAg水平被认为是改善人类HBV治疗的下一步,因此所获得的结果有望用于改善HBV慢性感染患者的治疗。
序列表
<110> 埃尼奥制药公司(ENYO PHARMA)等
<120> FXR激动剂和IFN用于治疗HBV感染的协同效果
<130> B3466PC
<160> 4
<170> PatentIn版本3.5
<210> 1
<211> 23
<212> DNA
<213> 人工的
<220>
<223> 引物
<400> 1
agctactgtg gagttactct cgt 23
<210> 2
<211> 22
<212> DNA
<213> 人工的
<220>
<223> 引物
<400> 2
caaagaattg cttgcctgag tg 22
<210> 3
<211> 20
<212> DNA
<213> 人工的
<220>
<223> 引物
<400> 3
ccgcgtgaag aggaagaatg 20
<210> 4
<211> 21
<212> DNA
<213> 人工的
<220>
<223> 引物
<400> 4
ttggcaggaa aacgagacaa t 21
- EYP001与IFN用于治疗HBV感染的协同效应
- EYP001与IFN用于治疗HBV感染的协同效应
