氧化的双(3-吲哚基)甲烷及其用途
文献发布时间:2023-06-19 09:30:39
相关申请的交叉引用
本申请要求2018年3月22日提交的美国临时专利申请第62/646,841号“氧化的双(3-吲哚基)甲烷及其用途”的优先权。所述美国临时专利申请以全文引用的方式并入本文中。
联邦资助研究的声明
本发明是在美国政府的支持下完成的,国家卫生研究院项目R01CA198982和R01CA179379、加州乳腺癌研究计划CBCRP20IB-0138。政府拥有本发明的某些权利。
技术领域
本文描述了Nur77/Bcl-2凋亡通路的调节剂,制备此类化合物的方法,包含此类化合物的药物组合物和药物组成物,以及使用此类化合物治疗与Nur77/Bcl-2通路相关的病状、疾病或病症的方法,包括与Bcl-2和Nur77异常水平相关的癌症。
背景技术
Bcl-2通常在肿瘤细胞中异常表达,在疾病和癌症的发展以及癌细胞对化学药物治疗和γ-射线治疗的耐受起关键作用。Nur77(也称为TR3或NGFI-B)是核受体超家族的孤儿受体,可以通过靶向线粒体并与Bcl-2相互作用来诱导细胞凋亡。Nur77与Bcl-2之间的相互作用可用于调节包括凋亡通路在内的重要的生物通路,该相互作用通过诱导Bcl-2构象变化将Bcl-2从抗凋亡分子转换为促凋亡分子。Nur77/Bcl-2相互作用介导的生物活性可能在决定细胞存亡中起关键作用。因此,鉴定靶向Nur77/Bcl-2途径的化合物具有临床意义。
发明内容
本文描述了能够调节Nur77/Bcl-2相互作用水平的化合物和组合物,以及使用这些化合物和组合物的方法。
在一个方面,本文描述了具有结构式(I)的化合物:
其中:
环A是芳基、杂芳基;
每一R
或相邻原子上的两个R
n为0-5;
R
R
R
或R
X
每一R
每一R
其中每一烷基、烯基、炔基、杂烷基、环烷基、杂环烷基、芳基、杂芳基分别独立地未被取代或任选地被1个、2个、或3个卤素、羟基、C
每一R
或同一氮原子上的两个R
本文考虑以上或以下针对各种变量描述的任何组合基团。在整个说明书中,本领域技术人员可选择基团和取代基以提供稳定的结构和化合物。
在另一方面,本文描述了治疗哺乳动物疾病的方法,其中所述疾病包括Bcl-2、Nur77或其组合的异常水平,所述方法包括施用本文所述的化合物。
在另一方面,本文描述了诱导细胞凋亡的方法,该方法包括使细胞与本文描述的化合物接触。
在另一方面,本文描述了用于调节细胞中Nur77活性的方法,该方法包括使细胞与本文描述的化合物接触。
附图说明
结合附图与以下本发明的详细描述和所附权利要求,本发明的优点和特征将将变得更加清楚,其中:
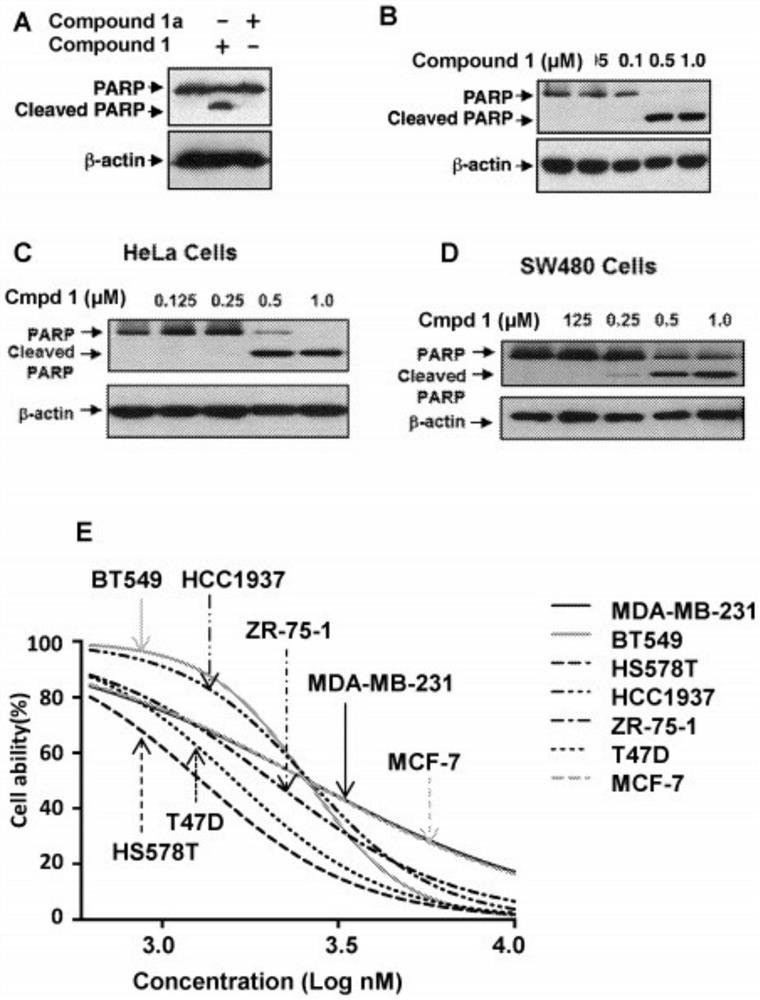
图1A显示了0.5μM化合物1或化合物1a处理HCT116细胞6小时后,通过Western印迹测定PARP切割带。图1B显示了用不同浓度化合物1处理HCT116细胞6小时后,通过Western印迹测定PARP切割带。图1C显示了不同浓度化合物1处理Hela细胞6小时后,通过Western印迹测定PARP切割带。图1D显示了所示浓度化合物1处理SW480结肠癌细胞6小时后,通过Western印迹测定PARP切割带。图1E显示了用各种浓度化合物1处理MDA-MB-231、HS578T、BT549、HCC1937、MCF-7、T47D、ZR-75-1细胞24小时后,通过比色MTT评价细胞存活率。
图2显示了所示浓度化合物1处理的MDA-MB-231细胞6小时后,用Western印迹法测定半胱天冬酶3切割带。
图3A显示了用0.75μM化合物1处理MDA-MB-231细胞6小时后,通过Western印迹测定PARP切割带。Western印迹结果中也显示了mTOR标记p-4EBP1的表达水平降低。图3B显示了用0.5μM化合物1、1a、28a、28、47a、47、48a、48、73a、73、39a、39处理MDA-MB-231细胞6小时后,通过Western印迹测定PARP切割带。图3C显示了用0.5μM化合物70a、70、103a、103、89a、89、88a、88处理MDA-MB-231细胞6小时后,通过Western印迹测定PARP切割带。
图4A显示了用指定浓度的化合物1处理MDA-MB-231细胞6小时,通过流式细胞术分析线粒体功能障碍。细胞用JC-1染色,通过流式细胞仪测量显示红色荧光(PE)的聚集JC-1和绿色荧光(FITC)的单体JC-1。统计数据为5幅独立图像的平均值±SEM。*P<0.1,***P<0.001(Student’s/-test)。图4B显示了用所示浓度的化合物1处理MDA-MB-231细胞6小时,流式细胞仪检测线粒体ROS产物的结果。
图5显示了用化合物1(0.5μM)和/或BI2030(1μM)处理2小时的HeLa细胞制备的WCL和HM组分的蛋白质印迹。
图6A显示每天施用一次指定剂量的化合物1、注射SW620(2×10
图7A显示了化合物1对PyMT肿瘤的生长抑制。将12周大的雌性野生型MMTV-PyMT小鼠随机分为两组(n=7),每天口服化合物1(5mg/kg)18天,肿瘤称重(n=7))。图7B显示化合物1或化合物28对PyMT肿瘤的生长抑制。雌性野生型MMTV-PyMT小鼠每天口服化合物1或化合物28(3mg/kg)18天,肿瘤称重(n=7)。
图8显示用所示浓度化合物1处理MEF和Nur77
图9显示化合物1与纯化的Nur77-LBD(10mM)的结合CD光谱。
图10显示用所示浓度化合物1、9-顺式-RA处理Gal-4报告质粒、Gal-4-RXR-LBD、Gal-4-RXR-LBD-E453-6A以及Myc-Nur77转染的HCT116细胞,用双重荧光素酶报告基因测定系统测试报告转录活性。
图11显示GST-下拉测定的蛋白质印迹结果,纯化的Nur77-LBD使用或者不使用1μM化合物1孵育后,用GST或GST-Bcl-2蛋白下拉。
具体实施方式
Nur77(NR4A1),又称NGFI-B和TR3,属于核受体超家族。其作为一种孤儿核受体在细胞增殖、分化、凋亡、发育、代谢和免疫等方面发挥着重要作用。对人类肿瘤标本的分析显示,Nur77的表达在几种原发性炎症疾病和实体肿瘤的生长和转移中发挥了重要作用。Nur77的死亡效应最初是在研究未成熟胸腺细胞(T细胞杂交瘤)的凋亡时发现的。之后,研究发现Nur77介导维A酸衍生物AHPN(CD437)的癌症细胞死亡效应;Nur77对AHPN癌细胞死亡效应的介导作用是通过其非基因型作用发挥的:Nur77被诱导出核定位到线粒体,诱发细胞色素c的释放,从而导致细胞凋亡。通过对多种癌细胞的多种凋亡刺激实验验证,上述的Nur77-线粒体细胞凋亡通路是通过Nur77与Bcl-2(抗凋亡Bcl-2家族成员)结合发挥作用的。Nur77与Bcl-2的相互作用介导了Nur77的线粒体靶向作用。更重要的是,这种相互作用通过诱导Bcl-2构象的改变,将Bcl-2从抗凋亡分子转变为促凋亡分子。由于Bcl-2在多种肿瘤细胞中过表达,且在肿瘤发生和肿瘤细胞中,对化疗药物和放射线治疗的耐药性起着关键作用,因此,这一由Nur77/Bcl-2相互作用介导的凋亡通路,可能对肿瘤细胞的发生发展起着关键性作用。随着Bcl-2的新生物学功能(包括其在自噬和mTOR激活中的作用)的发现,Nur77/Bcl-2相互作用在许多人类疾病的发生发展过程中具有重要决定作用,如异常炎症反应和细胞生长相关疾病。因此,开发靶向Nur77/Bcl-2通路的药物具有重要的治疗意义。
一种含有9个氨基酸的Nur77衍生肽(NuBCP-9)及其对映异构体,是一种Bcl-2转化多肽,在体外和动物体内可通过依赖Bcl-2的方式诱导癌细胞凋亡(Kolluri SK,etal.Cancer Cell.2008;14:285-98)。值得注意的是,在体内注射NuBCP-9纳米粒使艾氏同基因小鼠模型的实体瘤中完全消退(Kapoor S,et al.International Journal ofPharmaceutics.2016;511:876-89.24;Kumar M,et al.Cancer Res.2014;74:3271-81.),这证明了靶向Nur77-Bcl-2凋亡途径策略的有效性和选择性。然而,寻找直接结合Nur77并激活通路的小分子充满挑战。作为孤核受体,Nur77缺乏经典配体结合袋(LBP),使得小分子无法通过经典的LBP结合机制与Nur77结合来调节Nur77的功能。
此外,mTOR(雷帕霉素在哺乳动物中的靶点)是治疗干预治疗癌症的主要靶点。越来越明显的是,mTOR信号会影响大多数主要的细胞功能。mTOR控制许多基因的转录,并正向调控线粒体活性。由于mTOR的激活通常在癌症中起负面作用,因此mTOR抑制剂可用于癌症的治疗。
吲哚-3-甲醇(indole-3-carbinol,I3C)是从十字花科蔬菜中发现的关键生物活性成分,如西兰花、羽衣甘蓝、花椰菜等,具有多种抗肿瘤特性。在胃中,I3C迅速转化为包括3,3’-二吲哚甲烷(DIM)在内的缩合产物。DIM在包括前列腺癌、乳腺癌、结肠直肠癌和胰腺癌在内的各种癌细胞中显示出抗增殖和抗癌活性。
本文提供DIM中心碳取代衍生物的氧化盐形式。这些衍生物对癌细胞的凋亡作用显著增强。本文公开的化合物以亚微摩尔浓度结合Nur77,诱导Nur77和Bcl-2依赖的凋亡。本文公开的化合物能有效抑制动物体内肿瘤细胞的生长,促进Nur77线粒体靶向作用,并与Bcl-2相互作用。此外,本文描述的化合物也抑制mTOR通路。
化合物
本文描述的是具有调控Nur77/Bcl-2相互作用功能的化合物。一方面,本文描述了结构式(I)的化合物:
其中:
环A是芳基、杂芳基;
每一R
或相邻原子上的两个R
n为0-5;
R
R
R
或R
X
每一R
每一R
其中每一烷基、烯基、炔基、杂烷基、环烷基、杂环烷基、芳基、杂芳基分别独立地未被取代或任选地被1个、2个、或3个卤素、羟基、C
每一R
或同一氮原子上的两个R
其中当A环为苯基,且n为0时,R
对于所有实施例,取代基选自所列替代方案。
在一些实例中,X
在一些实例中,X
在一些实例中,X
在一些实例中,环A是芳香环。在一些实例中,环A是苯基。
在一些实例中,环A是多元环。在一些实例中,环A是萘基或芴基。在一些实例中,环A是萘基。在一些实例中,环A是芴基。
在一些实例中,环A是芳杂环。
在一些实例中,环A是单环。在一些实例中,环A是吡咯基、呋喃基、噻吩基、吡唑基、咪唑基、三唑基、噁唑基、异噁唑基、噻唑基、异噻唑基、噁二唑基、或噻二唑基。在一些实例中,环A是是吡啶基、哒嗪基、嘧啶基、吡嗪基或三嗪基。在一些实例中,环A为吡啶基。
在一些实例中,环A是双环芳杂基。在一些实例中,A环选自吲哚基、异吲哚基、吲哚嗪基、吲唑基、苯并咪唑基、氮杂吲哚基、氮杂吲唑基、嘌呤基、苯并呋喃基、异苯并呋喃基、苯并[b]噻吩、苯并[c]噻吩,苯并噁唑基、苯并异噁唑基、苯并噻唑基、苯并异噻唑基、喹啉基、异喹啉基、喹喔啉基、酞嗪基、喹唑啉基、噌啉基、萘啶基、吡啶嘧啶基、吡啶吡嗪基、蝶啶基。在一些实例中,A环选自吲哚基、苯并[b]噻吩、喹啉基。
在一些实例中,每一R
在一些实例中,每个R
在一些实例中,每个R
在一些实例中,n等于0到1、0到2、0到3、0到4、0到5、1到2、1到3、1到4、1到5、2到3、2到4、2到5、3到4、3到5、或4到5。在一些实例中,n等于0、1、2、3、4、5。在一些实例中,n等于0、1、2、3。在一些实例中,n等于1。在一些实例中,n等于2。在一些实例中,n等于3。
在一些实例中,相邻原子上的两个R
在一些实例中,
在一些实例中,
在一些实例中,
在一些实例中
在一些实例中,
在一些实例中,
在一些实例中,R
在一些实例中,R
在一些实例中,R
在一些实例中,R
在一些实例中,R
在一些实例中,每个R
在一些实例中,R
在一些实例中,R
在一些实例中,R
在一些实例中,R
在一些实例中,R
在一些实例中,R
在一些实例中,R
在一些实例中,R
在一些实例中,每个R
在一些实例中,结构式(Ⅰ)代表的化合物如结构式(Ⅱa)所示:
其中:n为1-5。
在一些实例中,n为1到2、1到3、1到4、1到5、2到3、2到4、2到5、3到4、3到5、4到5。在一些实例中,n为1、2、3、4、5。在一些实例中,n为1、2、3。在一些实例中,n为1。在一些实例中,n为2。在一些实例中,n为3。
在一些实例中,结构式(Ⅰ)代表的化合物如结构式(Ⅱb)所示:
其中:
R
在一些实例中,结构式(Ⅰ)代表的化合物如结构式(Ⅱc)、结构式(Ⅱd)、结构式(Ⅱe)、结构式(Ⅱf)所示:
其中:
R
在一些实例中,R
在一些实例中,R
在一些实例中,结构式(Ⅰ)代表的化合物如结构式(Ⅲa)、结构式(Ⅲc)、结构式(Ⅲd)、结构式(Ⅲe)、结构式(Ⅲf)所示:
其中:
环A是杂芳基。
本文考虑了上述各种变量的组合。在本说明书中,由本领域技术人员选择其基团和取代基,以提供稳定的结构和化合物。
在一些实例中,结构式(Ⅰ)所代表的化合物包括但不仅限于表1。
表1
在一些实例中,结构式(Ⅰ)代表的化合物由但不仅限于表2所示正离子和一个合适的阴离子构成。在一些实例中,合适的阴离子是单价阴离子。在一些实例中,合适的阴离子是二价阴离子。在一些实例中,合适的阴离子是多价阴离子。在一些实例中,合适的阴离子是二价或多价阴离子,并且所述阴离子的当量少于一个。在一些实例中,合适的阴离子选自无机酸形成的阴离子和由有机酸形成的阴离子。在一些实例中,合适的阴离子选自卤化物、氯酸盐、硫酸盐、硝酸盐、磷酸盐、羧酸盐、磺酸盐和硼酸盐。在一些实例中,合适的阴离子选自醋酸盐、苯甲酸盐、苯磺酸盐、硼酸盐、溴化物、樟脑磺酸盐、氯化物、柠檬酸盐、乙二磺酸盐、富马酸盐、葡萄糖酸盐、葡萄糖酸盐、葡萄糖醛酸盐、马尿酸盐、碘化物、羟乙基磺酸盐、乳酸盐、乳糖酸盐、十二烷基硫酸酯、苹果酸盐、马来酸盐、甲磺酸酯、硫酸甲酯、萘甲酸酯、萘磺酸盐、硝酸盐,十八酸盐、油酸盐、草酸盐、双羟萘酸盐、磷酸盐、琥珀酸盐、硫酸盐、磺基水杨酸盐、酒石酸盐、四氢硼酸盐、四氟硼酸盐、甲苯磺酸盐或三氟乙酸盐。
表2
在一些实例中,如本文所公开的实例和方案所示,结构式(I)化合物由相应的未氧化中心碳取代的DIM衍生物合成。在一些实例中,用酸处理相应的中心碳取代的DIM衍生物。在一些实例中,酸是无机酸,例如氢氟酸、盐酸、氢溴酸、氢碘酸、硫酸、硝酸、磷酸、硼酸、高氯酸。在一些实例中,酸是无机酸,例如盐酸、氢溴酸、硫酸。在一些实例中,该酸系有机酸,例如甲磺酸、三氟甲基磺酸、苯磺酸、对甲苯磺酸、乙酸、三氟乙酸、苯甲酸。在一些实例中,该酸系有机酸,例如甲磺酸、对甲苯磺酸。在一些实例中,用金属或有机氧化剂处理相应中心碳取代的DIM衍生物。在一些实例中,氧化剂是有机氧化剂,例如Ph
中心碳取代的DIM衍生物被氧化生成如结构式(Ⅰ)所示化合物,包括已知的中心碳取代的DIM衍生物,例如美国专利第7232843号,美国专利第7709520号,美国专利第8148547号,美国专利第8389563号和美国专利第8580843号等专利披露的。
在一些实例中,中心碳取代的DIM衍生物被氧化产生结构式(I)所示化合物,包括但不限于表3。
表3
在一些实例中,合适的阴离子是合适的单价阴离子。在一些实例中,合适的阴离子选自无机酸形成的阴离子和由有机酸形成的阴离子。在一些实例中,合适的阴离子选自卤化物、氯酸盐、硫酸盐、硝酸盐、磷酸盐、羧酸盐、磺酸盐、硼酸盐。
化合物的进一步形式
在一些方面,本文公开的化合物具有一个或多个立体中心,并且每个立体中心独立地存在R或S构型。本文提出的化合物包括所有非对映体、对映体和差向异构体以及它们的适当混合物。本文提供的化合物和方法包括所有顺式、反式、同、反、entgegen(E)、zusammen(Z)异构体及其适当混合物。在某些实例中,通过使化合物的外消旋混合物与光学活性拆分剂反应形成一对非对映异构体化合物/盐,分离非对映异构体并回收光学纯对映体,从而制备本文所述化合物的立体异构体。在一些实例中,使用本文所述化合物的共价非对映体衍生物来实现对映体的拆分。在另一实例中,通过基于溶解度差异的分离/拆分技术来分离非对映体。在其它实例中,立体异构体的分离是通过色谱或通过形成非对映体盐,通过重结晶、色谱或其任何组合来分离(Jean-Jacques,Andre Collet,Samuel H.Wilen,“Enantiomers,Racemates and Resolutions”,John Wiley and Sons,Inc.,1981)。在一方面,立体异构体通过立体选择性合成获得。
在一些实例中,本文所述化合物制备为前药。“前药”是指在体内转化为母体药物的制剂。前药通常是有用的,因为在某些情况下,它们可能比母体药物更容易给药。例如,在母体不能用于口服时,前药可以通过口服给药获得生物利用度。与母体药物相比,前药在药物制剂中的溶解度也可能有所改善。在一些实例中,前药的设计增加了有效水溶性。以本文所述之化合物为例(但不限于),将化合物制备为酯(“前药”)降低水溶性以改善其细胞膜透过性,此时水溶性对其在体内的转运是不利的;但前药一旦进入细胞内,其便会被代谢水解为水溶性更好的羧酸,也就是活性实体,此时溶解性是有益的。前药的另一个例子是:将短肽(聚酰胺酸)结合到一个羧基上,之后在体内,短肽被代谢以释放活性部分。在某些实例中,在体内给药时,前药被化学转化为该化合物的生物、药学、治疗活性物形式。在某些实例中,前药通过一个或多个步骤或过程被酶代谢为该化合物的生物、药学、治疗活性物形式。
在一个方面,前药设计用于改变药物的代谢稳定性、转运特性、掩盖副作用、毒性、改善药物的味道、改变药物的其他特性。借助于对药代动力学、药效学过程、体内药物代谢的了解,一旦已知具有药物活性的化合物,便可进行该化合物前药的设计。(例子可见于:NogRady(1985)Medicinal Chemistry A Biochemical Approach,Oxford UniversityPress,New York,pages 388-392;Silverman(1992),The Organic Chemistry of DrugDesign and Drug Action,Academic Press,Inc.,San Diego,pages 352-401,Rooseboomet al.,Pharmacological Reviews,56:53–102,2004;Aesop Cho,“Recent Advances inOR
在一些实例中,本文所述的化合物可以为其他衍生物或者活性化合物的前药。
在一些实例中,本文所述化合物的芳环部分上的位点易受各种代谢反应的影响,因此在芳环结构上加入适当的取代基将减少、最小化、消除该代谢途径。在具体实例中,减少、消除芳环对代谢反应的敏感性的适当取代基是卤素或烷基(仅作为示例)。
在另一实例中,本文所述化合物以同位素(例如,用放射性同位素)或其它方式标记,包括但不限于使用生色团或荧光基团、生物发光标签或化学发光标签。
本文所述的化合物包括同位素标记化合物,其结构与本文所述的各种公式和结构中所述的相同,但其一个或多个原子被具有不同于自然界中常见的原子质量或质量数的原子所取代。本发明包含的化合物同位素实例包括氢、碳、氮、氧、硫、氟、氯、碘的同位素,例如
在进一步实例中,当需要产生代谢物发挥作用时,本文所述化合物在用药后被代谢成需要的化合物,所述代谢物随后用于产生包括治疗效果在内期望的效果。
本文所指的“医药上可接受”是指一种材料,例如载体或稀释剂;其不会消除化合物的生物活性或性质,并且是相对无毒的,可将该材料应用于个体而不会造成不良生物效应,或以有害方式与其所含组合物的任何成分发生相互作用。
术语“医药上可接受的盐”是指化合物的配方,该配方不会对施用它的生物体造成显著刺激,并且不会消除该化合物的生物活性和理化性质。在一些实例中,将本文公开的化合物与酸反应以离子交换的方式获得医药上可接受的盐。
本文所述化合物可形成为和/或用作医药上可接受的盐。医药上可接受的盐的类型,包括但不限于由化合物的未氧化形式与医药上可接受的无机酸反应而形成的酸加成盐,例如,盐酸、氢溴酸、硫酸、磷酸、偏磷酸等;或与有机酸,例如乙酸、丙酸、己酸、环戊烷丙酸、乙醇酸、丙酮酸、乳酸、丙二酸、琥珀酸、苹果酸、马来酸、富马酸、三氟乙酸、酒石酸、柠檬酸、苯甲酸、3-(4-羟基苯甲酰)苯甲酸、肉桂酸,扁桃酸、甲磺酸、乙磺酸、1,2-乙二磺酸、2-羟基乙磺酸、苯磺酸、甲苯磺酸、2-萘磺酸、4-甲基双环-[2.2.2]辛-2-烯-1-羧酸、葡萄糖庚酸、4,4′-亚甲基双-(3-羟基-2-烯-1-羧酸)、3-苯基丙酸,三甲基乙酸、叔丁酸、十二烷基硫酸、葡萄糖酸、谷氨酸、羟基萘甲酸、水杨酸、硬脂酸、粘酸、丁酸、苯乙酸、苯丁酸、丙戊酸等。关于合成DIM氧化盐进一步实例和实验细节可在以下合成方法和实例中找到。
应当理解,当提及医药上可接受的盐,应包括溶剂添加形式,尤其是溶剂化物。溶剂化物包含化学计量或非化学计量的溶剂,可以在结晶过程中与医药上可接受的溶剂(例如水、乙醇等)一起形成。当溶剂是水时形成水合物,或当溶剂为醇时形成醇化物。本文所述化合物的溶剂化物可用本文所述方法方便地制备。此外,本文提供的化合物可以以未溶剂化和溶剂化形式存在。一般而言,就本文提供的化合物和方法而言,溶剂化形式被视为等同于未溶剂化形式。
合成方法
在一些实例中,本文所述化合物的合成是使用化学文献中描述的方法、本文描述的方法、其组合来完成。此外,本文所述的溶剂、温度和其他反应条件可能会有所不同。
在其他实例中,用于合成本文所述化合物的起始材料和试剂是合成的,或来自商业来源,例如但不限于Sigma-Aldrich、Fisher Scientific(Fisher Chemicals)、AcrosOrganics。
在进一步的实例中,本文所述的化合物和具有不同取代基的其他相关化合物是使用本文所述的技术和材料,以及在本领域中被承认的技术和材料合成的,例如:in Fieserand Fieser’s Reagents for Organic Synthesis,Volumes 1-17(John Wiley and Sons,1991);Rodd’s Chemistry of Carbon Compounds,Volumes 1-5and Supplementals(Elsevier Science Publishers,1989);Organic Reactions,Volumes 1-40(John Wileyand Sons,1991),Larock’s Comprehensive Organic TR
在所述反应中,需要对在最终产品中的反应活性官能团进行可能必要的保护,以避免它们参与反应,例如羟基、氨基、亚氨基、巯基、羧基。适用于制备这些基团的保护基以及相应的脱保护基的方法详见于:Greene and Wuts,Protective Groups in OrganicSynthesis,3rd Ed.,John Wiley&Sons,New York,NY,1999,and Kocienski,ProtectiveGroups,Thieme Verlag,New York,NY,1994,其内容已纳入本文作为参考).
一方面,本文所述化合物可通过方案1所示方法合成。
方案1
试剂和条件:(a)路易斯酸;(b)活性炭,H–X
简而言之,吲哚衍生物A1和苯甲醛衍生物A2经路易斯酸处理后反应得到中间体A3。在一些实例中,路易斯酸是选自铝盐、硼盐、铈盐、铁盐、锡盐、钛盐等的金属盐。在一些实例中,路易斯酸是铈盐。在一些实例中,路易斯酸为CeCl
一方面,本文所述化合物可通过方案2所示方法合成。
方案2
试剂和条件:(a)酸;(b)重铬酸吡啶鎓,H–X
简而言之,吲哚衍生物B1和芳醛衍生物B5经酸处理后反应得到中间体B6。在一些实例中,酸是无机酸,例如氢氟酸、盐酸、氢溴酸、氢碘酸、硫酸、硝酸、磷酸、硼酸、高氯酸。在一些实例中,所述酸为盐酸。然后在酸存在下用重铬酸吡啶鎓处理中间体B6,得到DIM的氧化成盐产物B7。在一些实例中,酸是无机酸,例如氢氟酸、盐酸、氢溴酸、氢碘酸、硫酸、硝酸、磷酸、硼酸或高氯酸。在一些实例中,酸是无机酸,例如盐酸、氢溴酸或硫酸。在一些实例中,该酸系有机酸,例如甲磺酸、三氟甲基磺酸、苯磺酸、对甲苯磺酸、乙酸、三氟乙酸、苯甲酸。在一些实例中,该酸系有机酸,例如甲磺酸或对甲苯磺酸。
一方面,本文所述化合物可通过方案3所示方法合成。
方案3
试剂和条件:(a)酸;(b)DDQ;(c)H–X
简而言之,吲哚衍生物C1(其中R1为H)和苯甲醛衍生物C2经酸处理后反应得到中间体C8。在一些实例中,酸是无机酸,例如氢氟酸、盐酸、氢溴酸、氢碘酸、硫酸、硝酸、磷酸、硼酸、高氯酸。在一些实例中,所述酸为盐酸。在一些实例中,用酸处理中间体C8以产生如上文方案1中所述的产物A4(步骤b)。在其它实例中,用DDQ处理中间体C8以得到中间体C9。然后用酸处理中间体C9,得到DIM的氧化成盐产物C10。在一些实例中,酸是无机酸,例如氢氟酸、盐酸、氢溴酸、氢碘酸、硫酸、硝酸、磷酸、硼酸、高氯酸。在一些实例中,酸是无机酸,例如盐酸、氢溴酸或硫酸。在一些实例中,该酸是有机酸,例如甲磺酸、三氟甲基磺酸、苯磺酸、对甲苯磺酸、乙酸、三氟乙酸、苯甲酸。在一些实例中,该酸是有机酸,例如甲磺酸或对甲苯磺酸。
在另一方面,为了获得不对称DIM的氧化盐产物,本文所述的化合物可如方案4所示来合成。
方案4
试剂和条件:(a)四甲基胍;(b)2,2,2-三氟乙醇,回流;(c)重铬酸吡啶鎓,H–X
吲哚衍生物D1和芳醛衍生物D5经四甲基胍处理后反应得到中间体D11。然后用第二吲哚衍生物D1'处理中间体D11,得到中间体D12。然后在酸存在下,用重铬酸吡啶鎓处理中间体D12,得到DIM的氧化成盐产物D13。在一些实例中,酸是无机酸,例如氢氟酸、盐酸、氢溴酸、氢碘酸、硫酸、硝酸、磷酸、硼酸、高氯酸。在一些实例中,酸是无机酸,例如盐酸、氢溴酸、硫酸。在一些实例中,该酸系有机酸,例如甲磺酸、三氟甲基磺酸、苯磺酸、对甲苯磺酸、乙酸、三氟乙酸、苯甲酸。在一些实例中,该酸系有机酸,例如甲磺酸或对甲苯磺酸。
在一些其它实例中,通过使用金属或有机氧化剂处理,双吲哚被氧化成DIM成盐产物。在一些实例中,氧化剂是有机氧化剂,例如Ph
在一些实例中,DIM成盐产物进行离子交换。在一些实例中,使用离子交换柱色谱法进行离子交换。在一些实例中,交换离子使得最终产物是氯化盐、溴化盐或碘化盐。在一些实例中,使用NaCl处理离子交换色谱柱,产物为氯化盐。
在一些实例中,DIM成盐产物包括但不限于含有合适阴离子的化合物。在一些实例中,合适的阴离子是合适的单价阴离子。在一些实例中,合适的阴离子是二价阴离子。在一些实例中,合适的阴离子是多价阴离子。在一些实例中,合适的阴离子是二价或多价阴离子,并且所述阴离子的当量少于一。在一些实例中,合适的阴离子选自无机酸形成的阴离子和由有机酸形成的阴离子。在一些实例中,合适的阴离子选自卤化物、氯酸盐、硫酸盐、硝酸盐、磷酸盐、羧酸盐、磺酸盐和硼酸盐。在一些实例中,合适的阴离子选自醋酸盐、苯甲酸盐、苯磺酸盐、硼酸盐、溴化物、樟脑磺酸盐、氯化物、柠檬酸盐、乙二磺酸盐、富马酸盐、葡萄糖酸盐、葡萄糖酸盐、葡萄糖醛酸盐、马尿酸盐、碘化物、羟基乙磺酸盐、乳酸盐、乳糖酸盐、十二烷基硫酸酯、苹果酸盐、马来酸盐、甲磺酸酯、甲磺酸甲酯、萘甲酸酯、萘磺酸盐、硝酸盐,十八酸盐、油酸盐、草酸盐、双羟萘酸盐、磷酸盐、琥珀酸盐、硫酸盐、磺基水杨酸盐、酒石酸盐、四氢硼酸盐、四氟硼酸盐、甲苯磺酸盐或三氟乙酸盐。
本领域的技术人员应清楚地理解,可以使用其他类似的程序和试剂,并且上述方案仅作为非限制性示例。
定义
如本说明书和所附权利要求书中所用,除非内容另有明确规定,“或”一词的含义通常包括“和/或”。此外,本文提供的标题仅为方便起见,并不解释所要求保护的发明的范围或含义。
除非另有说明,本协议中使用的下列术语具有以下含义:
“Oxo”指代取代基:=O
“烷基”是指直链或支链烃自由基,具有1到20个碳原子,并通过单键连接到分子的其余部分。尽管本定义包括未指定数值范围的术语“烷基”,在本文中出现“C
“亚烷基”是指将分子其余部分与基团连接的直链或支链二价链烃自由基。在一些实例中,亚烷基为-CH
“烷氧基”是指结构式如-OR的自由基,其中R是上述定义的烷基自由基。除非本说明书中另有特别说明,烷氧基可任选地如下所述被取代。代表性烷氧基包括但不限于:甲氧基、乙氧基、丙氧基、丁氧基、戊氧基。在一些实例中,烷氧基为甲氧基。在一些实例中,烷氧基为乙氧基。
“烷基氨基”是指结构式如-NHR或-NRR的自由基,其中每个R独立选自上述定义的烷基自由基。除非说明书中另有特别说明,烷基氨基可任选地如下所述被取代。
“芳香族”是指具有由4n+2个π电子构成的离域共平面电子云系统的平面环结构,其中n是整数。芳烃可以选择性地被取代。“芳香族”包括芳基(例如,苯基、萘基)和杂芳基(例如,吡啶基、喹啉基)。
“芳基”是指芳香环,其中形成该环的每个原子都是碳原子。芳基可以选择性地被取代。芳基的实例包括但不限于苯基和萘基。在一些实例中,芳基是苯基。根据结构的不同,芳基可以是单自由基或双自由基(即亚芳基)。除非本说明书中另有特别说明,否则术语“芳基”或前缀“Ar”(例如在“芳烷基”中)意指包括任选地被取代的芳基。
“羧基”系指-CO
“环烷基”是指单环或多环非芳香族自由基,其中形成环的每个原子(即骨架原子)是碳原子。环烷基可以是饱和的,也可以是部分不饱和的。环烷基可与芳环稠合(环烷基通过非芳环碳原子键合)。环烷基包括具有3到10个环原子的基团。代表性环烷基包括但不限于:具有3至10个碳原子、3至8个碳原子、3至6个碳原子、3至5个碳原子的环烷基。单环环烷基自由基包括:例如,环丙基、环丁基、环戊基、环己基、环庚基、环辛基。在一些实例中,单环环烷基为环丙基、环丁基、环戊基、环己基。在一些实例中,单环环烷基为环戊基。多环自由基包括:例如,金刚烷基、降冰片基、十烷基、3,4-二氢萘-1(2H)-酮。除非说明书中另有特别说明,环烷基可任选地被取代。
“稠合”指本文所述的任何环形结构与现有的环结构稠合。当稠合环是杂环基环或杂芳基环时,现有稠合杂环或稠合芳杂环上的任何碳原子都可替换为氮原子。
“卤”或“卤素”是指溴、氯、氟、碘。
“卤代烷基”是指由一个或多个如上定义的卤自由基取代的烷基自由基,例如,三氟甲基、二氟甲基、氟甲基、三氯甲烷、2,2,2-三氟乙基、1,2-二氟乙基、3-溴-2氟丙基、1,2-二溴乙基等。除非说明书中另有特别说明,卤代烷基可任选地被取代。
“卤代烷氧基”是指由一个或多个如上定义的卤代自由基取代的烷氧基自由基,例如,三氟甲氧基、二氟甲氧基、氟甲氧基、三氯甲烷氧基、2,2,2-三氟乙氧基、1,2-二氟乙氧基、3-溴-2-氟丙氧基、1,2-二溴甲氧基等。除非说明书中另有特别说明,卤代烷氧基可任选地被取代。
“杂烷基”是指如上所述的烷基自由基,其中烷基的一个或多个碳原子被O、N(即NH、N-烷基)、S原子取代。“杂亚烷基”是指将分子剩余部分连接至自由基的直链或支链二价杂烷基。除非说明书中另有特别说明,杂烷基或杂亚烷基可任选地如下所述取代。代表性杂烷基包括但不限于:-OCH
“杂环烷基”或“杂环基”或“杂环”是指包含2至10个碳原子和选自氮、氧、硫的1至4个杂原子组成的稳定的3至14元非芳香环自由基。除非说明书中另有特别说明,杂环烷基自由基可为单环或双环系统,其可包括稠合(当与芳基或杂芳基环稠合时,杂环烷基通过非芳环原子键合)或桥联环系统。杂环自由基中的氮、碳、硫原子可任选地氧化。氮原子可以选择性地季铵化。杂环烷基自由基可部分或完全饱和。此类杂环烷基自由基的实例包括但不限于:二氧杂戊环基、噻吩基[1,3]二噻吩基、十氢异喹啉基、咪唑啉基、咪唑烷基、异噻唑烷基、异恶唑烷基、吗啉基、八氢吲哚基、八氢异吲哚基、2-恶哌嗪基、2-恶哌啶基、2-恶吡咯烷基、恶唑烷基、哌啶基、哌嗪基,4-哌啶酮、吡咯烷基、吡唑烷基、奎宁环基、噻唑烷基、四氢呋喃基、三噻吩基、四氢吡喃基、硫吗啉基、噻吗啉基、1-氧代硫吗啉基、1,1-二氧代硫吗啉基。术语杂环烷基还包括所有环状碳水化合物,包括但不限于:单糖、双糖、低聚糖。除非另有说明,杂环烷基在环中有2到10个碳。在一些实例中,杂环烷基在环中具有2到8个碳。在一些实例中,杂环烷基在环中具有2到8个碳原子,以及1个或2个N原子。在一些实例中,杂环烷基在环中具有2至10个碳原子、0-2个N原子、0-2个O原子、0-1个S原子。在一些实例中,杂环烷基在环中具有2至10个碳原子、1-2个N原子、0-1个O原子、0-1个S原子。应当理解,当提及杂环烷基中的碳原子数时,杂环烷基中的碳原子数与构成杂环烷基的原子(包括杂原子)的总数(即杂环烷基环的骨架原子)不同。除非说明书中另有特别说明,杂环烷基可任选地被取代。
“杂芳基”是指包括一个或多个选自氮、氧、硫杂原子的环状芳基。杂芳基是单环或双环的。单环杂环芳基的说明性实例包括:吡啶基、咪唑基、嘧啶基、吡唑基、三唑基、吡嗪基、四唑基、呋喃基、噻吩基、异噁唑基、噻唑基、噁唑基、异噻唑基、吡咯基、哒嗪基、三嗪基、噁二唑基、噻二唑基、呋喃唑基、氮茚、吲哚、苯并呋喃、苯并噻吩、吲哚唑、苯并咪唑,嘌呤、喹嗪、喹啉、异喹啉、噌啉、酞嗪、喹唑啉、喹恶啉、1,8-萘啶、蝶啶。单环杂芳基的说明性实例包括:吡啶基、咪唑基、嘧啶基、吡唑基、三唑基、吡嗪基、四唑基、呋喃基、噻吩基、异噁唑基、噻唑基、噁唑基、异噻唑基、吡咯基、哒嗪基、三嗪基、恶二唑基、噻二唑基、呋喃唑基。双环杂芳基的说明性实例包括:氮茚、吲哚、苯并呋喃、苯并噻吩、吲唑、苯并咪唑、嘌呤、喹嗪、喹啉、异喹啉、噌啉、酞嗪、喹唑啉、喹恶啉、1,8-萘啶、蝶啶。在一些实例中,杂芳基为吡啶基、吡嗪基、嘧啶基、噻唑基、噻吩基、噻二唑基、呋喃基。在一些实例中,杂芳基在环中包含0-4个N原子。在一些实例中,杂芳基在环中包含1-4个N原子。在一些实例中,杂芳基在环中包含0-4个N原子、0-1个O原子、0-1个S原子。在一些实例中,杂芳基在环中包含1-4个N原子、0-1个O原子、0-1个S原子。在一些实例中,杂芳基是C
术语“任选地被取代”或“被取代”意指所述基团可被一个或多个单独且独立地选自烷基、卤代烷基、环烷基、芳基、杂芳基、杂环烷基、羟基、烷氧基、芳氧基、烷基硫基、芳基硫醇、烷基亚砜、芳基亚砜、、烷基砜、芳基砜、氰基、炔烃、C
“互变异构体”是指质子从一个分子的一个原子转移到同一分子的另一个原子。本文提出的化合物可以作为互变异构体存在。互变异构体是一种通过氢原子的迁移,伴随着单键和相邻双键的转换而相互转化的化合物。在化合键的重排中,互变异构体可能存在化学平衡。本文所公开之化合物之所有互变异构形式均被考虑在内。互变异构体的确切比例取决于几个因素,包括温度、溶剂、pH。一些互变异构体例子包括:
本文中使用的术语“共同给药”等指包括向单个患者施用所选治疗剂,并且在包括通过相同或不同的给药途径或在相同或不同时间施用所述制剂的治疗方案。
本文所使用的术语“有效量”或“治疗有效量”是指被给予足够量的药剂或化合物,可在一定程度上缓解所治疗疾病的一种或多种症状。其结果可以减少和/或减轻疾病的迹象、症状、病因,或任何其他生物系统的预期改变。例如,用于治疗用途的“有效量”是指包含本文所公开的化合物的组合物用量,其可在临床上显著缓解疾病症状。在任何个别情况下,适当的“有效”量可以使用技术来确定,例如剂量递增研究。“有效量”是指施用一种化合物足以实现一个明确目的量(例如,达到施用效果、治疗疾病、降低酶活性、增加酶活性、减弱信号通路、减少一种或多种疾病或病症)。“有效量”的一个例子是足以有助于治疗、预防或减少一种或多种疾病症状的量,也可以称为“治疗有效量”。症状的“减少”(以及该短语语法上的等价说法)意味着症状的严重程度或频率的减轻或症状的消除。药物的“预防有效量”是指当给受试者服用时,将具有预期预防效果的药物量,例如,防止或延迟损伤、疾病、变异或病症的发生(或复发),再或者降低损伤、疾病、变异、病症发生(或复发)的可能性。完全的预防作用不一定是通过给一剂药而产生的,而且可能只有在给一系列剂量药后才会发生。因此,预防有效量可在一次或多次给药中施用。如本文所使用的“活性降低量”是指相较于没有拮抗剂时使酶活性降低所需的拮抗剂量。这里所指的拮抗剂的作用量或所需的数量,在这里是指中断酶的功能。本文使用的“功能阻断用量”是指相较于没有使用拮抗剂时阻断酶或者蛋白质功能所需的拮抗剂用量。确切的量将取决于治疗的目的,并且将由本领域技术人员使用已知技术来确定。(例如:Lieberman,Pharmaceutical Dosage Forms(vols.1-3,1992);Lloyd,The Art,Science and Technology of Pharmaceutical Compounding(1999);Pickar,Dosage Calculations(1999);and Remington:The Science andPR
本文所用术语“组合用药”是指由一种以上活性成分混合或组合而成的产品,包括活性成分的固定和非固定组合。术语“固定组合”是指以单一实体或剂量的形式同时向患者施用活性成分(例如结构式(I)化合物)和辅助剂。术语“非固定组合”是指活性成分(例如结构式(I))和辅助剂作为单独的实体同步、同时或顺序地施用给患者,且没有特定的干预时间限制,,所述给药在患者体内提供两种化合物的有效水平。后者也适用于鸡尾酒疗法,例如服用三种或三种以上的活性成分。
术语“受试者”或“患者”包括哺乳动物。哺乳动物的例子包括但不限于人类。在一实例中,哺乳动物是人类。
本文中使用的术语“治疗”包括减轻或改善疾病或病症的至少一种症状,防止额外症状,抑制疾病或病症,例如,阻止疾病或病症的发展、缓解疾病或病症、缓解一种由疾病或者病症导致的症状、预防性地或者治疗性地阻止疾病或病症的症状。
药物组合物
在一个方面,本文所述的化合物被调配成药物组合物。药物组方以常规方式配制,使用一种或多种医药上可接受的非活性成分,将活性化合物加工成可用于医药的制剂。适当的配方取决于所选择的给药途径。本文所述药物组方可在如下的例子找到:Remington:The Science and Practice of Pharmacy、Nineteenth Ed(Easton,Pa.:Mack PublishingCompany,1995);Hoover,John E、Remington’s Pharmaceutical Sciences,MackPublishing Co.,Easton,Pennsylvania 1975;Liberman,H.A.and Lachman,L.,Eds.,Pharmaceutical Dosage Forms,Marcel Decker,New York,N.Y.,1980;andPharmaceutical Dosage Forms and Drug Delivery Systems,Seventh Ed.(LippincottWilliams&Wilkins1999),这些组方通过引用的方式并入本说明。
本文所使用的药物组合物是指本文所公开的化合物与其他化学成分(即药学上可接受的非活性成分)的混合物,例如载体、赋形剂、粘合剂、填充剂、悬浮剂、调味剂、甜味剂、崩解剂、分散剂、表面活性剂、润滑剂、着色剂、稀释剂、增溶剂、润湿剂、增塑剂、稳定剂、渗透促进剂、润湿剂、消泡剂、抗氧化剂、防腐剂或其一种或多种的组合。该药物组合物将有助于将该化合物施用于生物体。
本文所述的药物制剂可通过多种给药途径以多种方式应用于给药对象,包括但不限于口服、肠外注射(例如静脉注射、皮下注射、肌肉注射、髓内注射、鞘内注射、直接脑室内注射、腹腔内注射、淋巴注射,鼻内注射)、鼻、颊、局部、经皮给药途径。本文所述的药物制剂包括但不限于水性液体分散体、自乳化分散体、固体溶液、脂质体分散体、气雾剂、固体剂型、粉末、速释制剂、控释制剂、速熔制剂、片剂、胶囊剂、丸剂、延迟释放剂制剂、缓释制剂、脉冲释放制剂、多颗粒制剂、混合速释和控释制剂。
在一些实例中,本文所披露的化合物是通过口服给药的。
在一些实例中,本文公开的化合物是局部施用的。在这些实例中,本文所公开化合物调配成各种可局部施用的组合物,例如溶液、悬浮液、乳液、凝胶、糊状物、洗发水、磨砂膏、涂布剂、药棒、药物绷带、香膏、乳膏、软膏。在一个方面,本文公开之化合物经局部施用于皮肤。
在另一方面,通过吸入途径施用本文所揭示的化合物。
在另一方面,本文所公开的化合物调配为经鼻给药。此类制剂包括鼻喷雾剂、鼻雾等。
在另一方面,本文所公开化合物制剂成滴眼液。
在上述任何方面中的进一步的实例中,本文公开的化合物的有效量为:(a)哺乳动物全身给药,和/或(b)哺乳动物口服给药,和/或(c)哺乳动物静脉给药,和/或(d)哺乳动物吸入给药,和/或(e)哺乳动物鼻腔给药,或和/或(f)哺乳动物注射给药,和/或(g)哺乳动物局部给药,和/或(h)哺乳动物眼科给药,和/或(i)哺乳动物直肠给药,和/或(j)哺乳动物非系统或局部给药。
在上述任一方面中,进一步实例包含本文公开化合物有效剂量的单一给药途径,包括以下进一步实例,其中(i)该化合物给药一次;(ii)该化合物在一天内多次给药;(iii)该化合物频繁给药;或(iv)该化合物连续给药。
在上述任一方面中的进一步实例包含本文公开化合物有效剂量的多重给药途径,包括以下进一步实例:(i)以单剂量连续或间歇地化合物给药方式;(ii)多次给药之间的间隔时间为每6小时一次;(iii)每8小时的化合物给药方式;(iv)每12小时的化合物给药方式;(v)每24小时的化合物给药方式。在进一步或可选实例中,所述方法包括药物假日,其中药物假日指暂时中止对本文所公开化合物的施用或暂时减少正在施用的化合物的剂量;在药物假日结束时,恢复给药该化合物。在一个实例中,药物假日的长度从2天到1年不等。
在一些实例中,以局部方式而非全身方式给药本文所示化合物。
在一些实例中,本文公开化合物局部给药。在一些实例中,本文公开的化合物全身给药。
在一些实例中,药物制剂为片剂形式。在其它实例中,本文所公开化合物的药物制剂为胶囊形式。
在一个方面,口服给药的液体制剂剂型为水悬浮液或溶液形式,包括但不限于水性口服分散液、乳剂、溶液、酏剂、凝胶、糖浆。
对于吸入给药,本文公开的化合物被配制成气雾剂、雾剂、粉末。
对于经口或舌下给药方式,所述组方可采取常规方式配制的片剂、锭剂、凝胶形式。
在一些实例中,本文公开的化合物制备为经皮剂型。
在一个方面,本文公开的化合物配制成适于肌肉内、皮下、静脉注射的药物组合物。
在一些实例中,本文所公开化合物经局部施用,且可调配成各种可局部施用组合物,例如溶液、悬浮液、乳液、凝胶、糊剂、药棒、香膏、乳膏、软膏。
在一些实例中,本文所公开化合物制剂成直肠方式给药的药剂,例如灌肠剂、直肠凝胶、直肠泡沫、直肠气溶胶、栓剂、果冻栓剂、保留灌肠剂。
治疗方法
在另一方面,本文描述的是一种治疗哺乳动物疾病的方法,该疾病包括Bcl-2、Nur77或其组合的异常水平,该方法包括施用本文所述的化合物或组合物。在一些实例中,细胞包含异常水平的Bcl-2、Nur77或二者都是。在一些实例中,所述异常水平包括Bcl-2、Nur77或二者的水平上升。在一些实例中,所述异常水平包括Bcl-2、Nur77或二者的水平降低。在一些实例中,所述异常水平是指Bcl-2、Nur77的活性水平、表达水平或二者都是。在一些实例中,所述异常水平是指Bcl-2依赖性凋亡途径的活性水平。
在一些实例中,细胞是癌细胞。在一些实例中,癌细胞选自肾上腺皮质癌细胞、肛门癌细胞、胆管癌细胞、骨癌细胞、骨转移细胞、脑癌细胞、宫颈癌细胞、非霍奇金淋巴瘤细胞、直肠癌症细胞、食管癌细胞、眼癌细胞、胆囊癌细胞、胃肠道类癌细胞、妊娠滋养细胞疾病细胞、霍奇金病细胞、卡波西氏肉瘤细胞、肾癌细胞、喉和下咽癌细胞、白血病细胞、肝癌细胞、肺癌细胞、肺类癌细胞、恶性间皮瘤细胞、转移癌细胞、多发性骨髓瘤细胞、骨髓增生异常综合征细胞、鼻腔和鼻窦癌细胞、鼻咽癌细胞、神经母细胞瘤细胞、口腔和口咽癌细胞、骨肉瘤细胞、卵巢癌细胞、胰腺癌细胞、前列腺癌细胞、乳腺癌细胞、结直肠癌细胞、结肠癌细胞、膀胱癌细胞、阴茎癌细胞、垂体癌细胞、视网膜母细胞瘤细胞、唾液腺癌细胞、肉瘤细胞、皮肤癌细胞、胃癌细胞、睾丸癌细胞、胸腺癌细胞、甲状腺癌细胞、子宫肉瘤细胞、阴道癌细胞、外阴癌细胞、肾母细胞瘤细胞。在一些实例中,癌症对化疗、放疗或其组合具有耐药性。在一些实施例中,癌症包括Bcl-2、Nur77或其组合水平升高。在一些实例中,由于Bcl-2、Nur77或其组合水平异常,癌症对化疗、放疗或其组合具有耐药性。在一些实例中,癌细胞选自前列腺癌细胞、乳腺癌细胞、结直肠癌细胞、胰腺癌细胞。
在一些实例中,化合物与Nur77结合。在一些实例中,该化合物是Nur77的调节剂。在一些实例中,该化合物是Nur77的激动剂。在一些实例中,该化合物促进Nur77的线粒体靶向性。在一些实例中,该化合物调节细胞中的线粒体活性。在一些实例中,该化合物诱导Nur77和Bcl-2的相互作用。
在一些实例中,哺乳动物是人类。
在一些实例中,哺乳动物是黑猩猩、猴、狗、猪、大鼠或小鼠。在一些实例中,哺乳动物是转基因哺乳动物。在一些实例中,哺乳动物包括异种移植体。在一些实例中,异种移植体包括人类癌细胞或人类肿瘤。
诱导细胞凋亡的方法
在另一方面,本文描述的是诱导细胞凋亡的方法,该方法包括使细胞接触本文所述的化合物。
在一些实例中,化合物与Nur77结合。在一些实例中,该化合物是Nur77的调节剂。在一些实例中,该化合物是Nur77的激动剂。在一些实例中,该化合物促进Nur77的线粒体靶向性。在一些实例中,该化合物调节细胞中的线粒体活性。在一些实例中,该化合物诱导Nur77和Bcl-2的相互作用。
在一些实例中,细胞是癌细胞。在一些实例中,癌细胞选自肾上腺皮质癌细胞、肛门癌细胞、胆管癌细胞、骨癌细胞、骨转移细胞、脑癌细胞、宫颈癌细胞、非霍奇金淋巴瘤细胞、直肠癌症细胞、食管癌细胞、眼癌细胞、胆囊癌细胞、胃肠道类癌细胞、妊娠滋养细胞疾病细胞、霍奇金病细胞、卡波西氏肉瘤细胞、肾癌细胞、喉和下咽癌细胞、白血病细胞、肝癌细胞、肺癌细胞、肺类癌细胞、恶性间皮瘤细胞、转移癌细胞、多发性骨髓瘤细胞、骨髓增生异常综合征细胞、鼻腔和鼻窦癌细胞、鼻咽癌细胞、神经母细胞瘤细胞、口腔和口咽癌细胞、骨肉瘤细胞、卵巢癌细胞、胰腺癌细胞、前列腺癌细胞、乳腺癌细胞、结直肠癌细胞、结肠癌细胞、膀胱癌细胞、阴茎癌细胞、垂体癌细胞、视网膜母细胞瘤细胞、唾液腺癌细胞、肉瘤细胞、皮肤癌细胞、胃癌细胞、睾丸癌细胞、胸腺癌细胞、甲状腺癌细胞、子宫肉瘤细胞、阴道癌细胞、外阴癌细胞、肾母细胞瘤细胞。在一些实例中,癌细胞选自前列腺癌细胞、乳腺癌细胞、结直肠癌细胞、胰腺癌细胞。
在一些实例中,细胞是人类或非人类哺乳动物细胞。在一些实例中,所述细胞是人类细胞。在一些实例中,细胞是黑猩猩细胞、猴细胞、狗细胞、猪细胞、大鼠细胞、小鼠细胞。
在一些实例中,细胞在体内或体外。在一些实例中,细胞在体内。在一些实例中,细胞是在体外的。
在一些实例中,细胞包含异常水平的Bcl-2、Nur77或二者都是。在一些实例中,所述异常水平包括Bcl-2、Nur77或二者的水平上升。在一些实例中,所述异常水平包括Bcl-2、Nur77或二者的水平降低。在一些实例中,所述异常水平是指Bcl-2、Nur77的活性水平、表达水平或二者都是。在一些实例中,所述异常水平是指Bcl-2依赖性凋亡途径的活性水平。
调节Nur77活性的方法
在另一方面,本文描述的是调节细胞中Nur77活性的方法,该方法包括使细胞接触本文所述的化合物。在一些实例中,该化合物诱导激活Nur77。在一些实例中,该化合物促进Nur77的线粒体靶向性。在一些实例中,该化合物调节细胞中的线粒体活性。在一些实例中,该化合物诱导Nur77和Bcl-2的相互作用。
在一些实例中,细胞是癌细胞。在一些实例中,癌细胞选自肾上腺皮质癌细胞、肛门癌细胞、胆管癌细胞、骨癌细胞、骨转移细胞、脑癌细胞、宫颈癌细胞、非霍奇金淋巴瘤细胞、直肠癌症细胞、食管癌细胞、眼癌细胞、胆囊癌细胞、胃肠道类癌细胞、妊娠滋养细胞疾病细胞、霍奇金病细胞、卡波西氏肉瘤细胞、肾癌细胞、喉和下咽癌细胞、白血病细胞、肝癌细胞、肺癌细胞、肺类癌细胞、恶性间皮瘤细胞、转移癌细胞、多发性骨髓瘤细胞、骨髓增生异常综合征细胞、鼻腔和鼻窦癌细胞、鼻咽癌细胞、神经母细胞瘤细胞、口腔和口咽癌细胞、骨肉瘤细胞、卵巢癌细胞、胰腺癌细胞、前列腺癌细胞、乳腺癌细胞、结直肠癌细胞、结肠癌细胞、膀胱癌细胞、阴茎癌细胞、垂体癌细胞、视网膜母细胞瘤细胞、唾液腺癌细胞、肉瘤细胞、皮肤癌细胞、胃癌细胞、睾丸癌细胞、胸腺癌细胞、甲状腺癌细胞、子宫肉瘤细胞、阴道癌细胞、外阴癌细胞、肾母细胞瘤细胞。在一些实例中,癌细胞选自前列腺癌细胞、乳腺癌细胞、结直肠癌细胞、胰腺癌细胞。
在一些实例中,细胞在体内或体外。在一些实例中,细胞在体内。在一些实例中,细胞是在体外的。
在一些实例中,细胞包含异常水平的Bcl-2、Nur77或二者都是。在一些实例中,所述异常水平包括Bcl-2、Nur77或二者的水平上升。在一些实例中,所述异常水平包括Bcl-2、Nur77或二者的水平降低。在一些实例中,所述异常水平是指Bcl-2、Nur77的活性水平、表达水平或二者都是。在一些实例中,所述异常水平是指Bcl-2依赖性凋亡途径的活性水平。
给药方法和治疗方案
在一个方面,本文所公开的化合物用于制备治疗本文所述疾病或病症的药物。另外,在需要这种治疗的受试者中,本文所述治疗任何疾病或病症的方法涉及施用具有治疗效果的药物组合物,其中所述药物组合物应包括对受试者来说为有效剂量的至少一种本文公开的化合物或医药上可接受的盐、活性代谢物、前药、溶剂化物。
在某些实例中,施用含有本文所公开化合物的组合物,以进行预防及/或治疗。在某些治疗应用中,向已经患有疾病或症状的患者施用该组合物,其量足以治愈或至少部分地阻止该疾病或病症的至少一种症状。这种用法的有效量取决于疾病或病情的严重程度、先前的治疗、患者的健康状况、体重、对药物的反应以及治疗医生的判断。治疗有效量可选择通过包括但不限于剂量递增临床试验的方法来确定。
在预防性应用中,将含有本文所揭示化合物的组合物施用于易患或具有特定疾病、紊乱或病状风险的患者。
在某些实例中,正在施用的药物剂量可暂时减少或暂停一定时间(即,“药物假日”)。
用于成人治疗的剂量通常为每天0.01mg-5000mg,或每天约1mg-1000mg。在一个实例中,期望剂量以单剂量或分剂量呈现。
组合治疗
在某些情况下,本文所公布的至少一种化合物与另一治疗剂组合施用。
在一个具体实例中,本文所公开的化合物与第二治疗剂共同给药,其中本文公开化合物与第二治疗剂调节治疗疾病、病症、病状的不同方面,从而可以达到比单独施用任何一种治疗剂更大的整体效果。
对于本文所述的联合疗法,共同给药化合物的剂量取决于所使用的联合药物类型、所使用的特定药物、所治疗的疾病或病状等。在其他实例中,当与一种或多种其它治疗剂共同给药时,本文所提供之化合物可与一种或多种其它治疗剂同时给药或依次给药。如果同时给药,以单一、统一形式或多种形式提供多种治疗剂(仅作为示例)。
在一些实例中,第二治疗剂是化学治疗剂。在一些实例中,第二治疗剂的实例包括但不限于:烷基化剂、抗生素剂、抗代谢剂、激素剂、植物衍生剂、生物制剂。烷基化剂实例包括但不限于:二氯乙胺(氮芥类,例如,苯丁酸氮芥、环磷酰胺、异环磷酰胺、二氯甲基二乙胺、美法仑、尿嘧啶芥末)、氮杂环啶(例如噻替帕)、烷基烷酮磺酸盐(例如白消安)、亚硝基脲(例如卡莫司汀、洛莫司汀、链脲佐菌素),非经典烷基化剂(六甲蜜胺、达卡巴嗪和丙卡巴嗪)、铂类化合物(卡波拉汀和顺铂)。抗生素制剂实例包括但不限于:蒽环类(例如,阿霉素、柔红霉素、表阿霉素、爱达霉素和蒽二酮)、丝裂霉素C、博来霉素、达西霉素、折叠霉素。抗代谢剂的实例包括但不限于:氟尿嘧啶(5-FU)、氟尿苷(5-FUdR)、甲氨蝶呤、四氢叶酸、羟基脲、硫鸟嘌呤(6-TG)、巯基嘌呤(6-MP)、阿糖胞苷、喷司他丁、磷酸氟达拉滨、克拉屈滨(2-CDA)、天冬酰胺酶和吉西他滨。激素制剂的实例包括但不限于:合成雌激素(例如己烯雌酚)、抗雌激素(例如他莫昔芬、托瑞米芬、氟氧美斯特罗和雷洛昔芬)、抗雄激素(比卡鲁胺、尼鲁他胺、氟他胺)、芳香化酶抑制剂(例如氨基谷氨酰胺、阿那曲唑和四氮唑)、酮康唑、醋酸戈斯瑞林、亮丙瑞林、甲地孕酮和米非司酮。植物衍生制剂的实例包括但不限于:长春花生物碱(例如长春新碱、长春花碱、长春地新、长春利定和长春瑞滨)、鬼臼毒素(例如依托泊苷(VP-16)、替尼泊苷(VM-26))、紫杉烷类(例如紫杉醇和多西紫杉醇)。生物制剂的实例包括但不限于:免疫调节蛋白,例如细胞因子、抗肿瘤抗原的单克隆抗体、肿瘤抑制基因、癌症疫苗。
在一些实例中,第二治疗剂是放射疗法。在一些实例中,本文公开的化合物与放射治疗结合施用。
实例
化合物制备
缩写
DMSO:二甲基亚砜
ESI:电喷雾电离
EtOH:乙醇
H-X:任何质子酸,例如HCl、HBr、HNO3
HRMS:高分辨率质谱
h or hr(s):小时(秒)
MeSO
min(s):分钟
rt:室温
TFA:三氟乙酸
实例1:通用合成步骤A
试剂和条件:(a)CeCl
步骤a:在圆底烧瓶中,依次添加CeCl
步骤b:将化合物A3(1当量),活性炭(2当量),酸(HX,3当量)和1-丁醇添加到圆底烧瓶中。将混合物在室温搅拌21小时。然后,滤出活性炭,并将混合物用1-丁醇和水萃取。减压蒸发有机层,得到粗产物。最后,将粗产物用乙醚洗涤。
实例2:通用合成步骤B
试剂和条件:(a)HCl,甲醇;(b)重铬酸吡啶鎓,H-X,甲醇
步骤a:将吲哚衍生物B1(2当量)和醛衍生物B5(1当量)加入到含有甲醇的烧瓶中,将HCl(37%,0.1当量)稀释十倍加入混合物中。将混合物在室温搅拌直至反应完成。然后,将反应溶液用5%NaOH中和,并将甲醇减压蒸发,得到粗产物,将其通过重结晶(CH
步骤b:将化合物B6(1当量)、重铬酸吡啶鎓(1.4当量)和酸(HX,5当量)添加到装有甲醇的烧瓶中。将混合物在室温搅拌5小时。然后,减压蒸发甲醇得到混合物,并将混合物用1-丁醇和水萃取。减压蒸发有机层,得到粗产物。最后,通过硅胶柱色谱法纯化粗产物。
实例3:通用合成步骤C
试剂和条件:(a)HCl,甲醇;(b)DDQ,无水乙腈;(c)H-X,甲醇
步骤a:将吲哚衍生物C1(2当量)和苯甲醛衍生物C2(1当量)加入到含有甲醇的烧瓶中,将HCl(37%,0.1当量)稀释十倍后加入该混合物中。将该混合物在室温搅拌直至反应完成。然后,将反应溶液用5%NaOH中和,并将甲醇减压蒸发,得到粗产物,将其通过重结晶(CH
步骤b:将化合物C8(1当量)溶解在乙腈中,逐滴滴加DDQ(0.6当量)的乙腈溶液。该反应进行2小时后减压蒸发溶剂,残余物用饱和碳酸钠溶液洗涤,并将粗产物通过硅胶柱色谱法(二氯甲烷/甲醇)纯化,得到红色粉末。
步骤c:将化合物C9(1当量)和酸(HX,5当量)加入装有甲醇的烧瓶中,将混合物在室温搅拌1小时。然后,减压蒸发甲醇得到混合物,并将混合物用1-丁醇和水萃取。减压蒸发有机层,得到红色产物。
例4:通用合成步骤D
试剂和条件:(a)四甲基胍,水;b)2,2,2-三氟乙醇,回流;(c)重铬酸吡啶鎓,HX,甲醇
步骤a:将吲哚衍生物D1(1当量),醛衍生物D2(1当量)和四甲基胍(0.2当量)加入圆底烧瓶中。加入纯水,并将反应在室温下剧烈搅拌12小时。反应混合物用乙酸乙酯萃取。收集有机相,用无水硫代硫酸钠干燥,并通过硅胶柱色谱法纯化,得到白色产物。
步骤b:将化合物D11(1当量)和吲哚衍生物D1'(1.5当量)加入装有三氟乙醇的圆底烧瓶中。将反应在50℃下搅拌4h,并将溶剂减压蒸发,得到粗产物,将其通过硅胶柱色谱法纯化。
步骤c:将化合物D12(1当量),酸(H–X,5当量)和重铬酸吡啶鎓(1.4当量)添加到装有甲醇的圆底烧瓶中。将混合物在室温搅拌5小时。然后,减压蒸发甲醇以获得混合物,并将混合物用1-丁醇和水萃取。减压蒸发有机层,得到粗产物。粗产物通过硅胶柱色谱法纯化。
例5:双(1H-吲哚-3-基)[4-(三氟甲基)苯基]甲基甲磺酸盐,化合物1
使用实例2通用方法B,合成双(1H-吲哚-3-基)[4-(三氟甲基)苯基]甲基甲磺酸盐。在步骤b中使用甲磺酸。得到红色固体产物,产率为85%;
例6:双(1H-吲哚-3-基)[4-(三氟甲基)苯基]甲基盐酸盐,化合物2
使用实例2通用方法B,合成双(1H-吲哚-3-基)[4-(三氟甲基)苯基]甲基盐酸盐。在步骤b中使用HCl(37%)。得到红色固体产物,产率86%;
例7:双(1H-吲哚-3-基)[4-(三氟甲基)苯基]甲基对甲苯磺酸盐,化合物3
使用实例2通用方法B,合成双(1H-吲哚-3-基)[4-(三氟甲基)苯基]甲基对甲苯磺酸盐。在步骤b中使用对甲苯磺酸。得到红色固体产物,产率66%;
例8:双(1H-吲哚-3-基)[4-(三氟甲基)苯基]甲基硫酸氢盐,化合物4
使用实例2通用方法B,合成双双(1H-吲哚-3-基)[4-(三氟甲基)苯基]甲基硫酸氢盐。在步骤b中使用了硫酸。得到红色固体产物,产率61%。
例9:双(1H-吲哚-3-基)(4-氯苯基)甲基甲磺酸盐,化合物5
使用实例1通用方法A,合成双(1H-吲哚-3-基)(4-氯苯基)甲基甲磺酸盐。在步骤b中使用甲磺酸。得到红色固体产物,收率17%。
例10:双(1H-吲哚-3-基)(4-氯苯基)甲基盐酸盐,化合物6
使用实例2通用方法B,合成双(1H-吲哚-3-基)(4-氯苯基)甲基盐酸盐。在步骤b中使用甲磺酸,并通过离子交换柱色谱法(H
例11:双(1H-吲哚-3-基)(4-甲氧基苯基)甲基甲磺酸盐,化合物7
使用实例1通用方法A,合成双(1H-吲哚-3-基)(4-甲氧基苯基)甲基甲磺酸盐。在步骤b中使用甲磺酸。得到红色固体产物,收率20.2%。
例12:双(1H-吲哚-3-基)[4-(甲氧羰基)苯基]甲基甲磺酸盐,化合物8
使用实例1通用方法A,合成双(1H-吲哚-3-基)[4-(甲氧羰基)苯基]甲基甲磺酸盐。在步骤b中使用甲磺酸。得到红色固体产物,产率18.1%。
例13:双(1H-吲哚-3-基)[4-(甲氧羰基)苯基]甲基盐酸盐,化合物9
使用实例2通用方法B,合成双(1H-吲哚-3-基)[4-(甲氧羰基)苯基]甲基盐酸盐。在步骤b中使用HCl(37%),并将粗产物通过离子交换柱纯化进行色谱分离(H
例14:双(5-氟-1H-吲哚-3-基)[4-(三氟甲基)苯基]甲基甲磺酸盐,化合物10
使用实例1通用方法A,合成双(5-氟-1H-吲哚-3-基)[4-(三氟甲基)苯基]甲基甲磺酸盐。在步骤b中使用甲磺酸。得到红色固体产物,产率58%。
例15:双(1-甲基-1H-吲哚-3-基)[4-(三氟甲基)苯基]甲基甲磺酸盐,化合物11
使用实例2通用方法B,合成双(1-甲基-1H-吲哚-3-基)[4-(三氟甲基)苯基]甲基甲磺酸盐。在步骤b中使用甲磺酸。得到红色固体产物,产率71%;
例16:双(1-甲基-1H-吲哚-3-基)[4-(三氟甲基)苯基]甲基盐酸盐,化合物12
使用实例2通用方法B,合成双(1-甲基-1H-吲哚-3-基)[4-(三氟甲基)苯基]甲基盐酸盐。在步骤b中使用甲磺酸,并将粗产物通过离子交换色谱法进行纯化分离(H
例17:双(2-甲基-1H-吲哚-3-基)[4-(三氟甲基)苯基]甲基甲磺酸盐,化合物13
使用实例1通用方法A,合成双(2-甲基-1H-吲哚-3-基)[4-(三氟甲基)苯基]甲基甲磺酸盐。在步骤b中使用甲磺酸。得到红色固体产物,产率3%。
例18:双(2-甲基-1H-吲哚-3-基)[4-(三氟甲基)苯基]甲基盐酸盐,化合物14
使用实例2通用方法B,合成双(2-甲基-1H-吲哚-3-基)[4-(三氟甲基)苯基]甲基盐酸盐。在步骤b中使用甲磺酸,并通过离子交换色谱柱(H
例19:双(5-甲基-1H-吲哚-3-基)[4-(三氟甲基)苯基]甲基甲磺酸盐,化合物15
使用实例1通用方法A,合成双(5-甲基-1H-吲哚-3-基)[4-(三氟甲基)苯基]甲基甲磺酸盐。在步骤b中使用甲磺酸。得到红色固体产物,产率为5%;
例20:双(5-甲基-1H-吲哚-3-基)[4-(三氟甲基)苯基]甲基盐酸盐,化合物16
使用实例2中通用方法B,合成双(5-甲基-1H-吲哚-3-基)[4-(三氟甲基)苯基]甲基盐酸盐。在步骤b中使用甲磺酸,并将粗产物通过离子交换柱色谱法纯化(H
例21:双(6-甲基-1H-吲哚-3-基)[4-(三氟甲基)苯基]甲基甲磺酸盐,化合物17
使用实例1通用方法A,合成双(6-甲基-1H-吲哚-3-基)[4-(三氟甲基)苯基]甲基甲磺酸盐。在步骤b中使用甲磺酸。得到红色固体产物,产率为10%。
例22:双(6-甲基-1H-吲哚-3-基)[4-(三氟甲基)苯基]甲基盐酸盐,化合物18
使用实例2通用方法B,合成双(6-甲基-1H-吲哚-3-基)[4-(三氟甲基)苯基]甲基盐酸盐。在步骤b中使用甲磺酸,并将粗产物通过离子交换柱色谱法纯化(H
例23:双(7-甲基-1H-吲哚-3-基)[4-(三氟甲基)苯基]甲基甲磺酸盐,化合物19
使用实例1通用方法A,合成双(7-甲基-1H-吲哚-3-基)[4-(三氟甲基)苯基]甲基甲磺酸盐。在步骤b中使用甲磺酸。得到红色固体产物,产率为4%。
例24:双(7-甲基-1H-吲哚-3-基)[4-(三氟甲基)苯基]甲基盐酸盐,化合物20
使用实例2通用方法B,合成双(7-甲基-1H-吲哚-3-基)[4-(三氟甲基)苯基]甲基盐酸盐。在步骤b中使用甲磺酸,并将粗产物通过离子交换柱色谱法纯化(H
例25:双(6-氟-1H-吲哚-3-基)[4-(三氟甲基)苯基]甲基甲磺酸盐,化合物21
使用实例1通用方法A,合成双(6-氟-1H-吲哚-3-基)[4-(三氟甲基)苯基]甲基甲磺酸盐。在步骤b中使用甲磺酸。得到红色固体产物,产率为7%。
例26:双(6-氟-1H-吲哚-3-基)[4-(三氟甲基)苯基]甲基盐酸盐,化合物22
使用实例2通用方法B,合成双(6-氟-1H-吲哚-3-基)[4-(三氟甲基)苯基]甲基盐酸盐。在步骤b中使用甲磺酸,并将粗产物通过离子交换柱色谱法纯化(H
例27:双(5-氯-1H-吲哚-3-基)[4-(三氟甲基)苯基]甲基甲磺酸盐,化合物23
使用实例1通用方法A,合成双(5-氯-1H-吲哚-3-基)[4-(三氟甲基)苯基]甲基甲磺酸盐。在步骤b中使用甲磺酸。得到红色固体产物,产率为5%。
例28:双(6-氯-1H-吲哚-3-基)[4-(三氟甲基)苯基]甲基甲磺酸盐,化合物24
使用实例1通用方法A,合成双(6-氯-1H-吲哚-3-基)[4-(三氟甲基)苯基]甲基甲磺酸盐。在步骤b中使用甲磺酸。得到红色固体产物,产率为8%。
例29:双(5-溴-1H-吲哚-3-基)[4-(三氟甲基)苯基]甲基甲磺酸盐,化合物25
使用实例1通用方法A,合成双(5-溴-1H-吲哚-3-基)[4-(三氟甲基)苯基]甲基甲磺酸盐。在步骤b中使用甲磺酸。得到红色固体产物,收率3%。
例30:双(5-氟-1H-吲哚-3-基)(4-氯苯基)甲基甲磺酸盐,化合物26
使用实例1通用方法A,合成双(5-氟-1H-吲哚-3-基)(4-氯苯基)甲基甲磺酸盐。在步骤b中使用甲磺酸。得到红色固体产物,产率为12%。
例31:双(5-甲基-1H-吲哚-3-基)[4-(甲氧羰基基)苯基]甲基甲磺酸盐,化合物27
使用实例1通用方法A,合成双(5-甲基-1H-吲哚-3-基)[4-(甲氧羰基基)苯基]甲基甲磺酸盐。在步骤b中使用甲磺酸。得到红色固体产物,产率17%。
例32:(1-甲基-1H-吲哚-3-基)(1H-吲哚-3-基)[4-(三氟甲基)苯基]甲基甲磺酸盐,化合物28
使用实例4的通用方法D,合成(1-甲基-1H-吲哚-3-基)(1H-吲哚-3-基)[4-(三氟甲基)苯基]甲基甲磺酸盐。在步骤c使用甲磺酸。得到红色固体产物,产率53%。
例33:双(2-甲基-1H-吲哚-3-基)(4-氟苯基)甲基盐酸盐,化合物29
使用实例2通用方法B,合成双(2-甲基-1H-吲哚-3-基)(4-氟苯基)甲基盐酸盐。步骤b使用甲磺酸,并通过离子交换柱色谱法纯化粗产物(H
例34:双(1H-吲哚-3-基)(4-羟基苯基)甲基盐酸盐,化合物30
使用实例2的通用方法B,合成双(1H-吲哚-3-基)(4-羟基苯基)甲基盐酸盐。在步骤b中使用甲磺酸,并通过离子交换柱色谱法纯化粗产物(H
例35:双(6-甲氧基-1H-吲哚-3-基)[4-(三氟甲基)苯基]甲基酸盐,化合物31
使用实例2通用方法B,合成双(6-甲氧基-1H-吲哚-3-基)[4-(三氟甲基)苯基]甲基酸盐。在步骤b中使用HCl(37%)。得到红色固体产物,产率63%。
例36:三(1H-吲哚-3-基)甲基盐酸盐,化合物32
使用实例2通用方法B,合成三(1H-吲哚-3-基)甲基盐酸盐。在步骤b中使用HCl(37%)。得到红色固体产物,产率为92%。
例37:双(1H-吲哚-3-基)[(1,1’-联苯基)-4-基]甲基甲磺酸盐,化合物33
使用实例2通用方法B,合成双(1H-吲哚-3-基)[(1,1’-联苯基)-4-基]甲基甲磺酸盐。在步骤b中使用HCl(37%)。得到红色固体产物,产率88%。
例38:双(1H-吲哚-3-基)(4-叔丁基苯基)甲基甲磺酸盐,化合物34
使用实例2通用方法B,合成双(1H-吲哚-3-基)(4-叔丁基苯基)甲基甲磺酸盐。在步骤b中使用HCl(37%)。得到红色固体产物,产率81%。
例39:双(1H-吲哚-3-基)(4-硝基苯基)甲基甲磺酸盐,化合物35
使用实例2通用方法B,合成双(1H-吲哚-3-基)(4-硝基苯基)甲基甲磺酸盐。在步骤b中使用HCl(37%)。得到红色固体产物,产率74%。
例40:双(1H-吲哚-3-基)(4-氟苯基)甲基甲磺酸盐,化合物36
使用实例2通用方法B,合成双(1H-吲哚-3-基)(4-氟苯基)甲基甲磺酸盐。在步骤b中使用HCl(37%)。得到红色固体产物,产率为80%。
例41:双(1H-吲哚-3-基)(4-乙基苯基)甲基甲磺酸盐,化合物37
使用实例2通用方法B,合成双(1H-吲哚-3-基)(4-乙基苯基)甲基甲磺酸盐。在步骤b中使用HCl(37%),得红色固体产物,产率68%。
例42:双(4-甲基-1H-吲哚-3-基)[4-(三氟甲基)苯基]甲基盐酸盐,化合物38
使用实例2通用方法B,合成双(4-甲基-1H-吲哚-3-基)[4-(三氟甲基)苯基]甲基盐酸盐。在步骤b中使用HCl(37%),得红色固体产物,产率为84%。
例43:双(1H-吲哚-3-基)[4-(三氟甲氧基)苯基]甲基盐酸盐,化合物39
使用实例2通用方法B,合成双(1H-吲哚-3-基)[4-(三氟甲氧基)苯基]甲基盐酸盐。在步骤b中使用HCl(37%),得到红色固体产物,产率87%。
例44:双(1H-吲哚-3-基)(3-吡啶基)甲基盐酸盐,化合物40
使用实例2通用方法B,合成双(1H-吲哚-3-基)(3-吡啶基)甲基盐酸盐。在步骤b中使用HCl(37%)。得到红色固体产物,产率为92%。
例45:双(1H-吲哚-3-基)[2-(三氟甲基)苯基]甲基盐酸盐,化合物41
使用实例2通用方法B,合成双(1H-吲哚-3-基)[2-(三氟甲基)苯基]甲基盐酸盐。在步骤b中使用HCl(37%)。得到红色固体产物,产率为95%。
例46:双(1H-吲哚-3-基)[3-(三氟甲基)苯基]甲基盐酸盐,化合物42
使用实例2的通用方法B,合成双(1H-吲哚-3-基)[3-(三氟甲基)苯基]甲基盐酸盐。在步骤b中使用HCl(37%)。得到红色固体产物,产率为89%。
例47:双(4-氟-1H-吲哚-3-基)[4-(三氟甲基)苯基]甲基盐酸盐,化合物43
使用实例2通用方法B,合成双(4-氟-1H-吲哚-3-基)[4-(三氟甲基)苯基]甲基盐酸盐。在步骤b中使用HCl(37%)。得到红色固体产物,产率为91%。
例48:双(1H-吲哚-3-基)[2,4-双-(三氟甲基)苯基]甲基盐酸盐,化合物44
使用实例2通用方法B,合成双(1H-吲哚-3-基)[2,4-双-(三氟甲基)苯基]甲基盐酸盐。在步骤b中使用HCl(37%)。得到红色固体产物,产率为94%。
例49:双(6-羟基-1H-吲哚-3-基)[4-(三氟甲基)苯基]甲基盐酸盐,化合物45
使用实例3通用方法C,合成双(6-羟基-1H-吲哚-3-基)[4-(三氟甲基)苯基]甲基盐酸盐。在步骤b中使用HCl(37%)。得到红色固体产物,产率为36%。
例50:双(5-羟基-1H-吲哚-3-基)[4-(三氟甲基)苯基]甲基盐酸盐,化合物46
使用实例3的通用方法C,合成双(5-羟基-1H-吲哚-3-基)[4-(三氟甲基)苯基]甲基盐酸盐。在步骤c中使用HCl(37%)。得到红色固体产物,产率为35%。
例51:(1-乙基-1H-吲哚-3-基)(1H-吲哚-3-基)[4-(三氟甲基)苯基]甲基盐酸盐,化合物47
使用实例4的通用方法D,合成了(1-乙基-1H-吲哚-3-基)(1H-吲哚-3-基)[4-(三氟甲基)苯基]甲基盐酸盐。在步骤c中使用HCl(37%)。得到红色固体产物,产率52%;
例52:(1-丙基-1H-吲哚-3-基)(1H-吲哚-3-基)[4-(三氟甲基)苯基]甲基盐酸盐,化合物48
使用实例4的通用方法D,合成(1-丙基-1H-吲哚-3-基)(1H-吲哚-3-基)[4-(三氟甲基)苯基]甲基盐酸盐。在步骤c中使用HCl(37%)。获得的产物为红色固体,产率为71%;
例53:(1-丁基-1H-吲哚-3-基)(1H-吲哚-3-基)[4-(三氟甲基)苯基]甲基盐酸盐,化合物49
使用实例4通用方法D,合成(1-丁基-1H-吲哚-3-基)(1H-吲哚-3-基)[4-(三氟甲基)苯基]甲基盐酸盐。在步骤c中使用HCl(37%)。得到红色固体产物,产率为76%;
例54:(1-戊基-1H-吲哚-3-基)(1H-吲哚-3-基)[4-(三氟甲基)苯基]甲基盐酸盐,化合物50
使用实例4的通用方法D,合成(1-戊基-1H-吲哚-3-基)(1H-吲哚-3-基)[4-(三氟甲基)苯基]甲基盐酸盐。在步骤c中使用HCl(37%)。得到红色固体产物,产率为87%;
例55:双(1-戊基-1H-吲哚-3-基)[4-(三氟甲基)苯基]甲基盐酸盐,化合物51
使用实例2通用方法B,合成双(1-戊基-1H-吲哚-3-基)[4-(三氟甲基)苯基]甲基盐酸盐。在步骤b中使用HCl(37%)。得到红色固体产物,产率为41%;
例56:双(1H-吲哚-3-基)(噻吩-2-基)甲基盐酸盐,化合物52
使用实例2的通用方法B,合成双(1H-吲哚-3-基)(噻吩-2-基)甲基盐酸盐。在步骤b中使用HCl(37%)。得到红色固体产物,产率77%。
例57:双(1H-吲哚-3-基)(1-苯并噻吩-3-基)甲基盐酸盐,化合物53
使用实例2通用方法B,合成双(1H-吲哚-3-基)(1-苯并噻吩-3-基)甲基盐酸盐。在步骤b中使用HCl(37%)。得到红色固体产物,产率为39%;
例58:(6-甲基-1H-吲哚-3-基)(1H-吲哚-3-基)[4-(三氟甲基)苯基]甲基盐酸盐,化合物54
使用实例4通用方法D,合成(6-甲基-1H-吲哚-3-基)(1H-吲哚-3-基)[4-(三氟甲基)苯基]甲基盐酸盐。在步骤c中使用HCl(37%)。得到红色固体产物,产率83%;
例59:(7-甲基-1H-吲哚-3-基)(1H-吲哚-3-基)[4-(三氟甲基)苯基]甲基盐酸盐,化合物55
使用实例4通用方法D,合成(7-甲基-1H-吲哚-3-基)(1H-吲哚-3-基)[4-(三氟甲基)苯基]甲基盐酸盐。在步骤c中使用HCl(37%)。得到红色固体产物,产率为80%;
例60:(4-甲基-1H-吲哚-3-基)(1H-吲哚-3-基)[4-(三氟甲基)苯基]甲基盐酸盐,化合物56
使用实例4通用方法D,合成(4-甲基-1H-吲哚-3-基)(1H-吲哚-3-基)[4-(三氟甲基)苯基]甲基盐酸盐。在步骤c中使用HCl(37%)。得到红色固体产物,产率为75%;
例61:(5-甲基-1H-吲哚-3-基)(1H-吲哚-3-基)[4-(三氟甲基)苯基]甲基盐酸盐,化合物57
使用实例4通用方法D,合成(5-甲基-1H-吲哚-3-基)(1H-吲哚-3-基)[4-(三氟甲基)苯基]甲基盐酸盐。在步骤c中使用HCl(37%)。得到红色固体产物,产率为81%;
例62:双(1H-吲哚-3-基)(苯基)甲基甲磺酸盐,化合物58
使用实例1通用方法A,合成双双(1H-吲哚-3-基)(苯基)甲基甲磺酸盐。在步骤b中使用甲磺酸。得到红色固体产物,产率为18%。
例63:双(1H-吲哚-3-基)(苯基)甲基盐酸盐,化合物59
使用实例1通用方法A,合成双(1H-吲哚-3-基)(苯基)甲基盐酸盐。在步骤b中使用HCl(37%)。
例64:3-[双(1H-吲哚-3-基)甲基]-1-乙基吡啶-1-二盐酸盐,化合物60
使用实例1通用方法A,合成3-[双(1H-吲哚-3-基)甲基]-1-乙基吡啶-1-二盐酸盐。在步骤b中使用HCl(37%)。得到红色固体产物,收率2%。HRMS(ESI,m/z):175.5864.
例65:双(6-羧基-1H-吲哚-3-基)[4-(三氟甲基)苯基]甲基盐酸盐,化合物61
使用实例1通用方法A,合成双(6-羧基-1H-吲哚-3-基)[4-(三氟甲基)苯基]甲基盐酸盐。在步骤b中使用HCl(37%)。得到红色固体产物,产率93.4%。
例66:双(7-氟-1H-吲哚-3-基)[4-(三氟甲基)苯基]甲基盐酸盐,化合物62
使用实例1通用方法A,合成双(7-氟-1H-吲哚-3-基)[4-(三氟甲基)苯基]甲基盐酸盐。在步骤b中使用HCl(37%)。获得产物为红色固体,产率为92.5%。
例67:双(1H-吲哚-3-基)(呋喃-2-基)甲基盐酸盐,化合物63
使用实例1通用方法A,合成双(1H-吲哚-3-基)(呋喃-2-基)甲基盐酸盐。在步骤b中使用HCl(37%)。得到红色固体产物,产率88.3%。
例68:双(1H-吲哚-3-基)(4-甲苯基)甲基甲磺酸盐,化合物64
使用实例2通用方法B,合成双(1H-吲哚-3-基)(4-甲苯基)甲基甲磺酸盐。在步骤b中使用甲磺酸。得到红色固体产物,产率38.3%;
例69:(1-甲基-1H-吲哚-3-基)(1H-吲哚-3-基)[4-(三氟甲基)苯基]甲基盐酸盐,化合物65
使用实例4通用方法D,合成(1-甲基-1H-吲哚-3-基)(1H-吲哚-3-基)[4-(三氟甲基)苯基]甲基盐酸盐。在步骤c中使用HCl(37%)。得到红色固体产物,产率78.3%;
例70:双(1H-吲哚-3-基)(4-羟基苯基)甲基甲磺酸盐,化合物66
使用实例3通用方法C,合成双(1H-吲哚-3-基)(4-羟基苯基)甲基甲磺酸盐。在步骤c中使用甲磺酸。得到红色固体产物,产率为56%;
例71:双(6-氯-1H-吲哚-3-基)[4-(三氟甲基)苯基]甲基盐酸盐,化合物67
使用实例2通用方法B,合成双(6-氯-1H-吲哚-3-基)[4-(三氟甲基)苯基]甲基盐酸盐。在步骤b中使用甲磺酸,并将粗产物通过离子交色谱法纯化(H
例72:(5-羟基-1H-吲哚-3-基)(1H-吲哚-3-基)[4-(三氟甲基)苯基]甲基盐酸盐,化合物68
使用实例4通用方法D,合成(5-羟基-1H-吲哚-3-基)(1H-吲哚-3-基)[4-(三氟甲基)苯基]甲基盐酸盐。在步骤c中使用HCl(37%)。得到红色固体产物,产率为43%。
例73:(6-羟基-1H-吲哚-3-基)(1H-吲哚-3-基)[4-(三氟甲基)苯基]甲基盐酸盐,化合物69
使用实例4通用方法D,合成(6-羟基-1H-吲哚-3-基)(1H-吲哚-3-基)[4-(三氟甲基)苯基]甲基盐酸盐。在步骤c中使用HCl(37%)。获得产物为红色固体,产率为40%。
例74:(6-氟-1H-吲哚-3-基)(1H-吲哚-3-基)[4-(三氟甲基)苯基]甲基盐酸盐,化合物70
使用实例4通用方法D,合成(6-氟-1H-吲哚-3-基)(1H-吲哚-3-基)[4-(三氟甲基)苯基]甲基盐酸盐。在步骤c中使用HCl(37%)。得到红色固体产物,产率为49.5%。
例75:(7-氟-1H-吲哚-3-基)(1H-吲哚-3-基)[4-(三氟甲基)苯基]甲基盐酸盐,化合物71
使用实例4通用方法D,合成(7-氟-1H-吲哚-3-基)(1H-吲哚-3-基)[4-(三氟甲基)苯基]甲基盐酸盐。在步骤c中使用HCl(37%)。得到红色固体产物,产率为79%;
例76:(4-氟-1H-吲哚-3-基)(1H-吲哚-3-基)[4-(三氟甲基)苯基]甲基盐酸盐,化合物72
使用实例4通用方法D,合成(4-氟-1H-吲哚-3-基)(1H-吲哚-3-基)[4-(三氟甲基)苯基]甲基盐酸盐。在步骤c中使用HCl(37%)。得到红色固体产物,产率为60%。
例77:(5-氟-1H-吲哚-3-基)(1H-吲哚-3-基)[4-(三氟甲基)苯基]甲基盐酸盐,化合物73
使用实例4通用方法D,合成(5-氟-1H-吲哚-3-基)(1H-吲哚-3-基)[4-(三氟甲基)苯基]甲基盐酸盐。在步骤c中使用HCl(37%)。得到红色固体产物,产率为60%。
例78:双(1-苯基-1H-吲哚-3-基)[4-(三氟甲基)苯基]甲基盐酸盐,化合物74
使用实例2通用方法B,合成双(1-苯基-1H-吲哚-3-基)[4-(三氟甲基)苯基]甲基盐酸盐。在步骤b中使用HCl(37%)。得到红色固体产物,产率为20%。
例79:(1H-吲哚-3-基)(1-苯基-1H-吲哚-3-基)[4-(三氟甲基)苯基]甲基盐酸盐,化合物75
使用实例4通用方法D,合成(1H-吲哚-3-基)(1-苯基-1H-吲哚-3-基)[4-(三氟甲基)苯基]甲基盐酸盐。在步骤b中使用HCl(37%)。得到红色固体产物,产率94.5%。1H NMR(600MHz,DMSO-d
例80:双[5-(苄氧基)-1H-吲哚-3-基][4-(三氟甲基)苯基]甲基盐酸盐,化合物76
使用实例2通用方法B,合成双[5-(苄氧基)-1H-吲哚-3-基][4-(三氟甲基)苯基]甲基盐酸盐。在步骤b中使用HCl(37%)。得到红色固体产物,产率为95.6%。
例81:[5-(苄氧基)-1H-吲哚-3-基](1H-吲哚-3-基)[4-(三氟甲基)苯基]甲基盐酸盐,化合物77
使用实例4通用方法D,合成[5-(苄氧基)-1H-吲哚-3-基](1H-吲哚-3-基)[4-(三氟甲基)苯基]甲基盐酸盐。在步骤c中使用HCl(37%)。得到红色固体产物,产率95.8%。
例82:[6-(苄氧基)-1H-吲哚-3-基](1H-吲哚-3-基)[4-(三氟甲基)苯基]甲基盐酸盐,化合物78
使用实例4通用方法D,合成[6-(苄氧基)-1H-吲哚-3-基](1H-吲哚-3-基)[4-(三氟甲基)苯基]甲基盐酸盐。在步骤c中使用HCl(37%)。得到红色固体产物,产率71.3%。
例83:(1H-吲哚-3-基)(7-甲氧基-1H-吲哚-3-基)[4-(三氟甲基)苯基]甲基盐酸盐,化合物79
使用实例4通用方法D,合成(1H-吲哚-3-基)(7-甲氧基-1H-吲哚-3-基)[4-(三氟甲基)苯基]甲基盐酸盐。在步骤c中使用HCl(37%)。得到红色固体产物,产率为92%。
例84:(1H-吲哚-3-基)(6-甲氧基-1H-吲哚-3-基)[4-(三氟甲基)苯基]甲基盐酸盐,化合物80
使用实例4通用方法D,合成(1H-吲哚-3-基)(6-甲氧基-1H-吲哚-3-基)[4-(三氟甲基)苯基]甲基盐酸盐。在步骤c中使用HCl(37%)。获得产物为红色固体,产率为40.4%。
例85:(1H-吲哚-3-基)(5-甲氧基-1H-吲哚-3-基)[4-(三氟甲基)苯基]甲基盐酸盐,化合物81
使用实例4通用方法D,合成(1H-吲哚-3-基)(5-甲氧基-1H-吲哚-3-基)[4-(三氟甲基)苯基]甲基盐酸盐。在步骤c中使用HCl(37%)。得到红色固体产物,产率97.2%;
例86:双(1H-吲哚-3-基)(4-羧苯基)甲基甲磺酸盐,化合物82
使用实例1通用方法A,合成双(1H-吲哚-3-基)(4-羧苯基)甲基甲磺酸盐。在步骤b中使用甲磺酸。例87:双(5-甲基-1H-吲哚-3-基)(4-氯苯基)甲基甲磺酸盐,化合物83
使用实例1通用方法A,合成双(5-甲基-1H-吲哚-3-基)(4-氯苯基)甲基甲磺酸盐。在步骤b中使用甲磺酸。
例88:双(1H-吲哚-3-基)(4-羧苯基)甲基盐酸盐,化合物84
使用实例4通用方法D,合成双(1H-吲哚-3-基)(4-羧苯基)甲基盐酸盐。在步骤c中使用HCl(37%)。得到红色固体产物,产率为56%。
例89:双(1-烯丙基-1H-吲哚-3-基)[4-(三氟甲基)苯基]甲基盐酸盐,化合物85
使用实例4通用方法D,合成双(1-烯丙基-1H-吲哚-3-基)[4-(三氟甲基)苯基]甲基盐酸盐。在步骤c中使用HCl(37%)。得到红色固体产物,产率79%;
例90:(1-烯丙基-1H-吲哚-3-基)(1H-吲哚-3-基)[4-(三氟甲基)苯基]甲基盐酸盐,化合物86
使用实例4通用方法D,合成(1-烯丙基-1H-吲哚-3-基)(1H-吲哚-3-基)[4-(三氟甲基)苯基]甲基盐酸盐。在步骤c中使用HCl(37%)。得到红色固体产物,产率为70%。
例91:(7-氟-1-甲基-1H-吲哚-3-基)(1H-吲哚-3-基)[4-(三氟甲基)苯基]甲基盐酸盐,化合物87
使用实例4通用方法D,合成(7-氟-1-甲基-1H-吲哚-3-基)(1H-吲哚-3-基)[4-(三氟甲基)苯基]甲基盐酸盐。在步骤c中使用HCl(37%)。得到红色固体产物,产率51%。
例92:(6-氟-1-甲基-1H-吲哚-3-基)(1H-吲哚-3-基)[4-(三氟甲基)苯基]甲基盐酸盐,化合物88
使用实例4通用方法D合成(6-氟-1-甲基-1H-吲哚-3-基)(1H-吲哚-3-基)[4-(三氟甲基)苯基]甲基盐酸盐。在步骤c中使用HCl(37%)。得到红色固体产物,产率51%。
例93:(7-氟-1H-吲哚-3-基)(1-甲基-1H-吲哚-3-基)[4-(三氟甲基)苯基]甲基盐酸盐,化合物89
使用实例4通用方法D,合成(7-氟-1H-吲哚-3-基)(1-甲基-1H-吲哚-3-基)[4-(三氟甲基)苯基]甲基盐酸盐。在步骤c中使用HCl(37%)。得到红色固体产物,产率98%。
例94:(6-氟-1H-吲哚-3-基)(1-甲基-1H-吲哚-3-基)[4-(三氟甲基)苯基]甲基盐酸盐,化合物90
使用实例4通用方法D,合成(6-氟-1H-吲哚-3-基)(1-甲基-1H-吲哚-3-基)[4-(三氟甲基)苯基]甲基盐酸盐。在步骤c中使用HCl(37%)。得到红色固体产物,产率82%。
例95:(3-溴苯基)二(1H-吲哚-3-基)甲基盐酸盐,化合物91
使用实例4通用方法D,合成(3-溴苯基)二(1H-吲哚-3-基)甲基盐酸盐。在步骤c中使用HCl(37%)。得到红色固体产物,产率91%。
例96:(3-氯苯基)二(1H-吲哚-3-基)甲基盐酸盐,化合物92
使用实例4通用方法D,合成(3-氯苯基)二(1H-吲哚-3-基)甲基盐酸盐。在步骤c中使用HCl(37%)。得到红色固体产物,产率93%。
例97:(2-氯苯基)二(1H-吲哚-3-基)甲基盐酸盐,化合物93
使用实例4通用方法D,合成(2-氯苯基)二(1H-吲哚-3-基)甲基盐酸盐。在步骤c中使用HCl(37%)。得到红色固体产物,产率为80%。
例98:(2-羟苯基)二(1H-吲哚-3-基)甲基盐酸盐,化合物94
使用实例4通用方法D,合成(2-羟苯基)二(1H-吲哚-3-基)甲基盐酸盐。在步骤c中使用HCl(37%)。得到红色固体产物,产率为30%。
例99:(3-羟苯基)二(1H-吲哚-3-基)甲基盐酸盐,化合物95
使用实例4通用方法D,合成(3-羟苯基)二(1H-吲哚-3-基)甲基盐酸盐。在步骤c中使用HCl(37%)。得到红色固体产物,产率65%;
例100:(3-氟苯基)二(1H-吲哚-3-基)甲基盐酸盐,化合物96
使用实例4通用方法D,合成(3-氟苯基)二(1H-吲哚-3-基)甲基盐酸盐。在步骤c中使用HCl(37%)。得到红色固体产物,产率91%。
例101:二(1H-吲哚-3-基)(间甲苯基)甲基盐酸盐,化合物97
使用实例4通用方法D,合成二(1H-吲哚-3-基)(间甲苯基)甲基盐酸盐。在步骤c中使用HCl(37%)。得到红色固体产物,产率85%。
例102:二(1H-吲哚-3-基)(3-甲氧基苯基)甲基盐酸盐,化合物98
使用实例4通用方法D,合成二(1H-吲哚-3-基)(3-甲氧基苯基)甲基盐酸盐。在步骤c中使用HCl(37%)。得到红色固体产物,产率76%。
例103:(2-氟苯基)二(1H-吲哚-3-基)甲基盐酸盐,化合物99
使用实例4通用方法D,合成(2-氟苯基)二(1H-吲哚-3-基)甲基盐酸盐。在步骤c中使用HCl(37%)。得到红色固体产物,产率56%.
例104:二(1H-吲哚-3-基)[6-(三氟甲基)吡啶-3-基]甲基盐酸盐,化合物100
使用实例4通用方法D,合成二(1H-吲哚-3-基)[6-(三氟甲基)吡啶-3-基]甲基盐酸盐。在步骤c中使用HCl(37%)。得到红色固体产物,产率80%.
例105:[4-羟基-3-(三氟甲基)苯基]二(1H-吲哚-3-基)甲基盐酸盐,化合物101
使用实例4通用方法D,合成[4-羟基-3-(三氟甲基)苯基]二(1H-吲哚-3-基)甲基盐酸盐。在步骤c中使用HCl(37%)。得到红色固体产物,产率73%;
例106:[4-氟-3-(三氟甲基)苯基]二(1H-吲哚-3-基)甲基盐酸盐,化合物102
使用实例4通用方法D,合成[4-氟-3-(三氟甲基)苯基]二(1H-吲哚-3-基)甲基盐酸盐。在步骤c中使用HCl(37%)。得到红色固体产物,产率82%。
例107:[3-氟-4-(三氟甲基)苯基]二(1H-吲哚-3-基)甲基盐酸盐,化合物103
使用实例4通用方法D,合成[3-氟-4-(三氟甲基)苯基]二(1H-吲哚-3-基)甲基盐酸盐。在步骤c中使用HCl(37%)。得到红色固体产物,产率78%.
例108:[4-(2,2-二氟乙氧基)苯基]二(1H-吲哚-3-基)甲基盐酸盐,化合物104
使用实例4通用方法D,合成[4-(2,2-二氟乙氧基)苯基]二(1H-吲哚-3-基)甲基盐酸盐。在步骤c中使用HCl(37%)。得到红色固体产物,产率86%.
例109:二(1H-吲哚-3-基)[4-(2,2,2-三氟乙氧基)苯基]甲基盐酸盐,化合物105
使用实例4通用方法D,合成二(1H-吲哚-3-基)[4-(2,2,2-三氟乙氧基)苯基]甲基盐酸盐。在步骤c中使用HCl(37%)。得到红色固体产物,产率84%.
例110:二(1H-吲哚-3-基)(萘-1-基)甲基盐酸盐,化合物106
使用实例4通用方法D,合成二(1H-吲哚-3-基)(萘-1-基)甲基盐酸盐。在步骤c中使用HCl(37%)。得到红色固体产物,产率85.4%.
例111:双(1-乙基-1H-吲哚-3-基)[4-(三氟甲基)苯基]甲基盐酸盐,化合物107
使用实例4通用方法D,合成双(1-乙基-1H-吲哚-3-基)[4-(三氟甲基)苯基]甲基盐酸盐。在步骤c中使用HCl(37%)。得到红色固体产物,产率88.7%.
例112:(4-氰基苯基)双(1H-吲哚-3-基)甲基盐酸盐,化合物108
使用实例4通用方法D,合成(4-氰基苯基)双(1H-吲哚-3-基)甲基盐酸盐。在步骤c中使用HCl(37%)。得到红色固体产物,产率86%.
例113:双(1H-吲哚-3-基)[4-(甲磺酰基)苯基)]甲基盐酸盐,化合物109
使用实例4通用方法D,合成双(1H-吲哚-3-基)[4-(甲磺酰基)苯基)]甲基盐酸盐。在步骤c中使用HCl(37%)。得到红色固体产物,产率89%.
生物学实例
例A-1:通用生物学方法
细胞培养
在Dulbecco改良Eagle培养基(DMEM)中培养HCT116结肠癌,MDA-MB-231、HS578T、BT549、MCF-7、T47D乳腺癌,HeLa卵巢癌和HEK293T胚胎细胞,在含有10%胎牛血清(FBS)的RPMI1640培养基中培养ZR-75-1乳腺癌细胞,HCC1937和SW480结肠癌细胞。细胞系获自美国典型培养物保藏中心(ATCC)。在整个实验中采用指数生长的近汇合细胞。根据制造商的说明,使用Lipofectamin 2000进行细胞转染。
质粒
构建质粒pcmv-myc-Nur77,GFP-Nur77,GFP-Nur77/LBD,GST-Bcl-2,pcmv-myc-Bcl-2、3*Flag-cmv-Bcl-2,并用于评估和鉴定化合物对Nur77/Bcl-2相互作用的影响。
抗体和试剂
抗Myc(9E10)(Cat.Sc-40)、抗Ki67(Cat.ab15580)、抗Hsp60(Cat.ab46798)抗体来自Abcam(UK);抗b-肌动蛋白(Cat.4970S)、抗Cleaved caspase-3(Cat.9661S)、抗Nur77(Cat.3960S)抗体来自Cell Signal Technology(Beverly,MA,USA);抗Nur77(M-210)(Cat.sc-5569)、抗PCNA(Santa Cruz sc-7907)、抗α-微管蛋白(Santa Cruz sc-8035)、抗Bcl-2(Santa Cruz sc-783)、抗-PARP(Santa Cruz sc-7150)、抗GST(sc-138)抗体来自Santa Cruz Biotechnology(Santa Cruz,CA,USA);使用了来自Sigma公司(St.Louis,MO,USA)的抗Flag(Cat.F1804)抗体。
统计分析
数据表示为平均值±SD。在三个独立的实验中,一式三份地重复每个测定。组间平均值显著性差异使用Student’s-test检验法。
例A-2:GST-PULL DOWN
将GST或GST-Bcl-2融合蛋白(0.5mg)固定在谷胱甘肽琼脂糖珠上,和化合物1与纯化的His-Nur77-LBD(0.2mg)一起在室温下孵育1小时,以促进GST-Bcl-2与His-Nur77-LBD的相互作用。通过蛋白质印迹分析结合的Nur77-LBD。
例A-3:免疫印迹和免疫沉淀
采用蛋白质印迹和免疫共沉淀(co-IP)方法。简而言之,用测试化合物处理用或不用Nur77和Bcl-2表达载体转染的细胞2小时。使用适当的抗体通过共免疫沉淀法分析了化合物对内源性或转染的Nur77与Bcl-2相互作用的影响。使用适当的抗Nur77或抗Bcl-2抗体,通过蛋白质印迹来分析细胞中免疫沉淀的蛋白质。
例A-4:细胞存活率测定和细胞死亡评价
通过使用比色的3-(4,5-二甲基噻唑-二甲基噻唑-2-基)-2,5-二苯基四氮唑溴化物(MTT)测定来分析细胞存活率,通过比色法确定活细胞中的线粒体脱氢酶活性。将经测试化合物处理的细胞与MTT孵育,通过处理后的细胞将黄色四唑染料MTT还原为紫色不溶的甲瓒的能力来分析细胞的存活率。
化合物1在所分析的各种乳腺癌细胞系中均有效,无论乳腺癌细胞中激素的依赖性如何,包括MDA-MB-231细胞、BT549细胞、HCC 1937细胞、ZR-75-1细胞、T47D细胞和MCF-7细胞(图1E)。
例A-5:通过CRISPR/Cas9系统生成Nur77和Bcl-2敲除细胞
使用CRISPR/Cas9系统从HeLa细胞中敲除Nur77和Bcl-2。Nur77(5′-ACCTTCATGGACGGCTACAC-3′)和Bcl-2(5′-GAGAACAGGGTACGATAACC-3′)的gRNA靶向序列被克隆到gRNA克隆载体Px330(Addgene,71707)中,并通过测序确认。为了筛选缺少Nur77或Bcl-2的细胞,HeLa细胞先用对照载体和gRNA表达载体转染,然后进行G418选择(0.5mg/ml)。使用抗Nur77和抗Bcl-2抗体对单个克隆细胞进行Western印迹分析来选择敲除细胞。
例A-6:凋亡测定
以不同浓度的测试化合物处理以六孔板每孔1×10
表4
A:IC
氧化DIM比非氧化DIM具有更好的凋亡作用
测试了代表性氧化DIM衍生物和非氧化DIM衍生物的凋亡作用。细胞存活率测定表明,氧化形式的DIM衍生物对比同一非氧化形式DIM衍生物,抑制HCT116癌细胞生长活性显著提高(表5)。未氧化化合物以小写字母“a”标记并包含次甲基,而不是氧化的碳原子,即CH而不是C
例如,化合物1是
表5
A:IC
MDA-MB-231细胞也进行了细胞存活率测定,氧化DIM抑制MDA-MB-231癌细胞生长的活性极度优于其未氧化的对应物(表6)。未氧化的物种以小写字母“a”标记并包含次甲基,而不是氧化的碳原子,即CH而不是C
表6
A:IC
例A-7:PARP裂解分析
用Western印迹法可见,用0.5μM化合物1处理HCT116细胞6小时,有效诱导凋亡指标PARP切割。在相同条件下,化合物1a无效(图1A)。剂量依赖性研究表明,化合物1可以在HCT116细胞(图1B)和其他几种癌细胞系(包括HeLa细胞和SW480细胞)(图1C-D)中以亚微摩尔浓度诱导PARP切割。此外,浓度为1μM的化合物10、11、15、18、21、22、24、28、39、43、46、48、49、54、55、57、62、67、71、72、73和74处理MDA-MB-231细胞6小时后,能够有效诱导PARP裂解。用浓度为0.5μM的化合物1、28、47、48、73、39、70、103、89和88处理MDA-MB-231细胞6小时,能够有效诱导PARP裂解。在相同条件下,化合物1a、28a、47a、48a、73a、39a、70a、103a、89a和88a无效(图3B-C)
例A-8:DAPI凋亡染色
通过共聚焦显微镜观察,0.5μM化合物1处理细胞6小时,DAPI染色显示化合物1诱导核浓缩和断裂的强度,证明化合物1的凋亡作用。
在HCT116细胞中,当用化合物1处理细胞时,检测到约80%的凋亡细胞,而当未用化合物1处理细胞时,检测到凋亡细胞不到5%。在200个细胞中计数凋亡细胞。
在HeLa细胞中,当用化合物1处理细胞时,检测到约60%的凋亡细胞,而当未用化合物1处理细胞时检测到凋亡细胞不到5%。在200个细胞中计数凋亡细胞。
在SW480细胞中,当用化合物1处理细胞时,检测到约60%的凋亡细胞,而当未用化合物1处理细胞时,检测到凋亡细胞不到5%。在200个细胞中计数凋亡细胞。
例A-9:凋亡的半胱天冬酶3裂解试验
蛋白质印迹显示化合物1剂量依赖性诱导caspase 3裂解,进一步证明了化合物1的凋亡作用(图2)。例A-10:流式细胞仪Annexin V/Propidium Iodide(PI)凋亡测定
化合物1对细胞死亡的影响进一步使用流式细胞仪Annexin V/Propidium Iodide(PI)凋亡测定法评估(参见例A-6)。
剂量依赖性研究显示,当用1μM化合物1处理6小时后,约31.63%的MDA-MB-231细胞凋亡,而在媒介物对照细胞中仅1.31%的细胞凋亡。
例A-11:mTOR抑制
0.75μM化合物1处理MDA-MB-231细胞6小时,降低了mTOR标志物p-4EBP1的表达水平(图3)。此外,用1μM测试化合物1、10、11、15、18、21、22、24、28、39、43、46、48、49、54、55、57、62、67、71、72、73、74处理6小时后,可降低MDA-MB-231细胞中mTOR标记物、p-S6、p-4EBP1的表达水平。例A-12:ΔΨm和ROS的测定
线粒体膜电位的损失(Δψm)是代表凋亡的标志之一。JC-1探针用于测量癌细胞中线粒体的去极化。用不同浓度的测试化合物处理MDA-MB-231乳腺癌细胞6小时。在37℃下添加JC-1染色溶液(5μg/ml)20分钟。用PBS洗涤两次后,通过多重荧光读取器监测线粒体膜电位,读取仪器双重发射的相对量。通过流式细胞仪定量分析细胞中的荧光。线粒体去极化的特征在于绿色/红色荧光强度比的增加。用对氧化反应敏感的荧光探针2′7′-二氯二氢氟尿素二乙酸盐(DCF-DA)监测ROS。
正常细胞中Δψm高,JC-1形成具有强红色荧光的复合物。相反,在有着低Δψm细胞中,JC-1为显示绿色荧光的单体形式。线粒体的去极化可以以绿/红色荧光的强度比值来描述。
流式细胞仪对红色和绿色荧光发射两者的分析,揭示了化合物1对线粒体膜功能障碍的剂量依赖性诱导。用1μM化合物1处理6h后,绿色与红色的比率从100%增加至345%(图4A)。化合物1处理后的MDA-MB-231细胞中,细胞内线粒体活性氧(mito-ROS)随着化合物剂量增加而显著增加,说明了化合物对线粒体功能障碍的影响(图4B)。总的来说,这些数据表明化合物1诱导癌细胞中线粒体相关的凋亡。
例A-13:Nur77的免疫染色和线粒体靶向
将细胞固定在3.7%的多聚甲醛中。线粒体染色:将细胞与抗Hsp60山羊免疫球蛋白G(IgG)(Santa Cruz Biotechnology,Santa Cruz,CA)孵育,然后与Cy3偶联的抗山羊IgG孵育。DAPI染色将细胞核可视化。收集荧光图像并通过使用荧光显微镜或MRC-1024MP激光扫描共聚焦显微镜(Bio-Rad,Hercules,CA)进行分析。
免疫染色显示Nur77主要位于HCT116细胞核中。但是,当细胞用0.5μM的化合物1处理2小时后,Nur77主要位于细胞质中。为了证实化合物1对Nur77细胞质定位的影响,先用GFP-Nur77转染HEK293T细胞,然后用0.5μM化合物1处理。转染的GFP-Nur77驻留在细胞核中,但在化合物1处理后在细胞质和细胞核中均分散分布。
例A-14:细胞分离
细胞分离:将细胞与蛋白酶抑制剂混合物一起在冰缓冲液A(10mM HEPES-KOH(pH7.9)、1.5mM MgCl
化合物1处理细胞后,大量的转染的GFP-Nur77积累在富集线粒体的重膜(HM)组分中。共聚焦显微镜显示,在用化合物1处理细胞后,通过细胞分级测定法显示,转染GFP-Nur77定位线粒体特异Hsp60蛋白并与Hsp60蛋白共同沉积在重膜馏分中。
线粒体分级分离还显示,当用1μM化合物1或28处理细胞时,Myc-Nur77积累在富集线粒体的重膜(HM)组分中。免疫染色显示,当用化合物1和28处理细胞时,Myc-Nur77-LBD与线粒体广泛共定位。
例A-15:Nur77的线粒体靶向和凋亡诱导。
为了进一步表征化合物1对促进Nur77线粒体靶向的作用,我们研究了化合物1与BI2030对Nur77线粒体靶向和凋亡诱导的作用。BI2030是AHPN/CD437的类似物,可以诱导Nur77表达,但不能诱导其线粒体积累(图5)。相反,化合物1不能诱导Nur77表达。当将化合物1和BI2030一起使用时,通过共聚焦显微镜观察,大多数BI2030诱导的Nur77蛋白都存在于重膜部分中,并在细胞质中形成点状结构。因此,化合物1能够诱导BI2030诱导的Nur77蛋白的线粒体靶向。
我们接下来检查了由化合物1/BI2030的组合诱导的Nur77线粒体靶向是否会导致凋亡。用单独的化合物1或BI2030或其组合处理HeLa细胞,并通过DAPI染色检查细胞凋亡。当分别用0.5μM化合物1或1μM BI2030处理2小时时,约7.2%或9.1%的细胞凋亡。然而,当用化合物1和BI2030共同处理细胞时,检测到约35.5%的凋亡细胞,表明协同凋亡诱导。在200个细胞中计数凋亡细胞。
这些结果揭示了化合物1诱导Nur77线粒体靶向和凋亡的独特能力。
例A-16:动物研究
用于动物研究的方案已获厦门大学动物护理和使用委员会批准,并且所有小鼠均按照“实验动物的护理和使用指南”和“使用和护理脊椎动物原理”进行处理。
例A-17:FRO异种移植裸鼠研究
给雄性BALB/c裸鼠(6周龄)皮下注射对数生长期SW620细胞(1×10
施用化合物1的荷瘤裸鼠,对SW620异种移植肿瘤的生长抑制具有剂量和时间依赖性方式(图6A-6B)。与对照肿瘤相比,TUNEL测定显示,化合物1处理的肿瘤样品中呈现广泛的细胞凋亡。
例A-18:MMTV–PyMT小鼠乳腺癌模型
将12周龄的雌性MMTV-PyMT小鼠随机分为两组(每组n=7),每天口服测试化合物治疗18天。进行肿瘤组织的标准组织病理学分析(参见实施例A-19)。将测试化合物溶解在DMSO中,并用含有5.0%(V/V)Tween-80的生理盐水稀释至最终浓度0.5mg/ml。含DMSO和5.0%Tween-80的生理盐水媒介物作对照。
给予MMTV-PyMT小鼠化合物1(5mg/kg)、化合物1(3mg/kg)、化合物28(3mg/kg),可抑制PyMT乳腺肿瘤生长(图7A-7B)。由治疗和未治疗小鼠制备的肿瘤组织的蛋白质印迹显示,化合物1(5mg/kg)显着降低了PCNA和Ki67这两种增殖标记的表达水平。免疫染色还显示,用化合物1(5mg/kg)处理小鼠的制备肿瘤组织样本中,Ki67的表达降低,而半胱天冬酶3表达增强。此外,化合物1(3mg/kg)和化合物28(3mg/kg)均显着降低了mTOR标记物、p-S6、p-mTOR的表达水平。
例A-19:免疫组织化学
使用二甲苯和一系列浓度的乙醇(100%,95%,85%,75%,50%)对4μm厚的切片进行脱蜡和复水,然后PBS洗涤。在10mM柠檬酸钠缓冲液(pH 6.0)中进行抗原修复,将其在100℃微波处理20分钟。用PBS漂洗两次后,在室温下使用10%正常山羊血清将切片封闭1小时,然后与抗Ki-67、抗Cleaved-Caspase-3一起在4℃孵育过夜(至少17小时)。用DAB辣根过氧化物酶显色试剂盒显色。
例A-20:小鼠胚胎成纤维细胞(MEF)的凋亡效应
Nur77
在小鼠胚胎成纤维细胞(MEF)和缺少Nur77的MEF(Nur77
Bcl-2
在小鼠胚胎成纤维细胞(MEF)和缺乏Bcl-2的MEF(Bcl-2
JC1染色测量的线粒体膜电位损伤和线粒体ROS释放中,Bcl-2
例A-21:基因组敲除HeLa细胞的凋亡效应
Nur77
在CRISPR/Cas9技术敲除Nur77基因的HeLa细胞中,评估化合物1的凋亡作用(例A-5)。在Nur77
此外,在通过JC1染色测量的线粒体膜电位损伤和线粒体ROS的释放中,Nur77
Bcl2
CRISPR/Cas9技术敲除Bcl-2基因HeLa细胞中,评估化合物1的凋亡作用(例A-5)。在Bcl-2
此外,在通过JC1染色测量的线粒体膜电位损伤和线粒体ROS的释放中,Bcl-2
例A-22:过表达Nur77-LBD的HEK293T细胞的凋亡效应
将Nur77的配体结合结构域(LBD)转染到HEK293T细胞中。通过共聚焦显微镜测定,Nur77-LBD的转染增强了化合物1的凋亡作用,转染的HEK293T细胞36%凋亡,而的未转染细胞4.5%凋亡。
例A-20、A-21、A-22的结果证明化合物1靶向Nur77诱导癌细胞凋亡。
例A-23:圆二色性(CD)
将100mM的化合物乙醇溶液加入到0.5ml 1μM纯化His蛋白的PBS中(pH 7.6)。使用AVIV 62DS分光旋光仪,波长为220nm,温度为25℃至65℃之间,在0.2cm样品池中获得CD光谱。校正三个光谱的背景,并对每个样品取平均值。使用非线性回归一点结合模型拟合Kd(χ
在50℃下,纯化的Nur77-LBD蛋白谱图与化合物1孵育后的Nur77-LBD蛋白谱图发生了明显变化,表明Nur77-LBD蛋白与化合物1直接结合(图9)。
例A-24:表面等离子体共振(SPR)
在BIAcore T200(GE Healthcare)上,使用CM5芯片,25℃下分析Nur77-LBD与测试化合物之间的结合动力学。PBSP用于所有测试。对于SPR,对Nur77-LBD蛋白进行纯化,空白通道用作阴性对照。Nur77-LBD固定在芯片上的响应单位约10,000。每个循环完成数据收集后,用pH 2.5甘氨酸-盐酸再生液清洗芯片。使用浓度范围为0.15~5.0μM。使用BIAcoreT200,采用1:1Langumuir结合模式,对响应值进行拟合。
表面等离子体共振(SPR)分析显示化合物1与Nur77-LBD蛋白高亲和力结合,K
将HEK293T细胞与pG5荧光素酶报告基因,以及与Gal4 DNA结合结构域融合的编码RXRα-LBD的质粒和其他表达质粒一起共转染。转染后,将细胞用DMSO或测试化合物处理,并使用Dual-Luciferase Reporter Assay System(Promega)进行分析。转染效率根据海肾荧光素酶活性进行统一化。
当用RXRα配体9-顺式-RA处理细胞时,p-Bind-RXRα-LBD和Nur77的共转染强烈激活报告基因的转录活性(图10)。化合物1剂量依赖性地增强报告基因活性。为了排除化合物1作用于RXRα的可能性,RXRα激活功能2(AF2)区域的Glu453和Glu456用Ala取代,并使用所得的突变体RXRα-LBD/E453-6A。正如预料的那样,9-顺式-RA不能诱导Nur77和pBind-RXRα-LBD-E453-6A转染细胞中的报告基因活性。然而,化合物1仍然可以激活报告基因的转录,表明化合物1通过Nur77结合而不是RXRα诱导了报道基因的转录。
例A-26:化合物促进Nur77与Bcl-2的相互作用
Nur77线粒体凋亡途径的标志是Nur77与Bcl-2的相互作用,将Bcl-2从抗凋亡蛋白转换为凋亡诱导剂。因此,研究了测试化合物与Nur77的结合是否增强了Nur77与Bcl-2的相互作用。
体外GST-pull down测定(例A-2)显示,Nur77-LBD以化合物1浓度依赖性下拉(图11)。细胞Co-IP(例A-3)显示,当用化合物1处理细胞后,转染到HEK293T细胞中的Nur77或Nur77-LBD与Bcl-2相互作用。当用化合物1处理细胞时,使用抗Bcl-2抗体,内源性Nur77与内源性Bcl-2一起特异性免疫沉淀。共聚焦显微镜分析显示,在细胞中化合物1促进了转染的GFP-Nur77和GFP-Nur77-LBD与Bcl-2的广泛共定位。
此外,细胞Co-IP显示,用化合物1或28处理细胞后,HeLa细胞中转染的Nur77与Bcl-2相互作用。共聚焦显微镜表明,化合物1和28促进了转染的GFP-Nur77与Bcl-2在细胞中的广泛共定位。
尽管在此已经展示和描述了本发明的优选实例,显而易见,对于本领域技术人员,这些实施例仅作为示例提供。在不脱离本发明的情况下,本领域技术可以变化、改变、替换。应当理解,本文描述的本发明实施方案的各种替代方案可以用于实施本发明。本发明权利要求明确本发明的范围,涵盖权利要求范围内的方法和结构及其等同物。
- 氧化的双(3-吲哚基)甲烷及其用途
- 一种含有肼基的吲哚胺2,3-双加氧化酶抑制剂
