一种含芴及吲哚类化合物及其应用
文献发布时间:2023-06-19 10:05:17
技术领域
本发明涉及一种含芴及吲哚类化合物及其应用,属于有机电致发光材料技术领域。
背景技术
有机发光二极管(Organic light-Emitting Diode,OLED)技术近几年中受到了广泛的应用,尤其是将OLED显示技术应用于手机、电视、电脑、照明设备等。随着5G时代的来临,各种电子设备,尤其是手机,又迎来了新一轮的更新换代,OLED显示屏比传统的LCD显示屏具有发光效率高、柔性好、功耗低、响应快、清晰度高、更加轻薄等特点,在如今以及未来的手机行业中必将占领一席之地。
虽然OLED显示屏存在众多的优点,但仍然有许多需要改进的方面,最典型的一点是它对发光材料的要求比较高,有机发光层的材料须具备固态下有较强萤光、载子传输性能好、热稳定性和化学稳定性佳、量子效率高且能够真空蒸镀的特性,这就限制了大多数有机材料在OLED领域的应用。因此有必要持续不断开发新的具有高效发光效率及热稳定性好的有机发光材料。
发明内容
本发明针对现有技术存在的不足,提供一种含芴及吲哚类化合物,所述含芴及吲哚类化合物应用于OLED器件,可以提高器件的发光效率和色纯度。
本发明解决上述技术问题的技术方案如下:一种含芴及吲哚类化合物,所述的含芴及吲哚类化合物的结构式如下式(I)所示:
其中,R基团为如下基团中的任意一种:环烷基、苯基、联苯基、咔唑基、吡啶基、取代或未取代的C10-C60的稠环芳基或呋喃基、噻吩基。
优选的,所述含芴及吲哚类化合物为如下结构式中的任意一种:
本发明还公开了所述含芴及吲哚类化合物的应用,所述的含芴及吲哚类化合物应用于有机电致发光器件中,所述有机电致发光器件的有机层中包括至少一种所述的含芴及吲哚类化合物。
进一步的,所述的含芴及吲哚类化合物作为有机电致发光器件的电子传输层材料。
进一步的,所述的含芴及吲哚类化合物作为有机电致发光器件的发光层材料,作为发光材料应用于OLED照明、OLED显示面板,所述发光材料包括黄色发光材料、红色发光材料、绿色发光材料和蓝色发光材料中的一种或几种。
发明的有益效果是:本发明所述的含芴及吲哚类化合物应用于有机电致发光器件中,可以降低OLED器件的驱动电压,提高器件的发光效率和色纯度。在OLED器件的应用上具有很大的应用价值和商业价值,具备良好的产业化前景。
附图说明
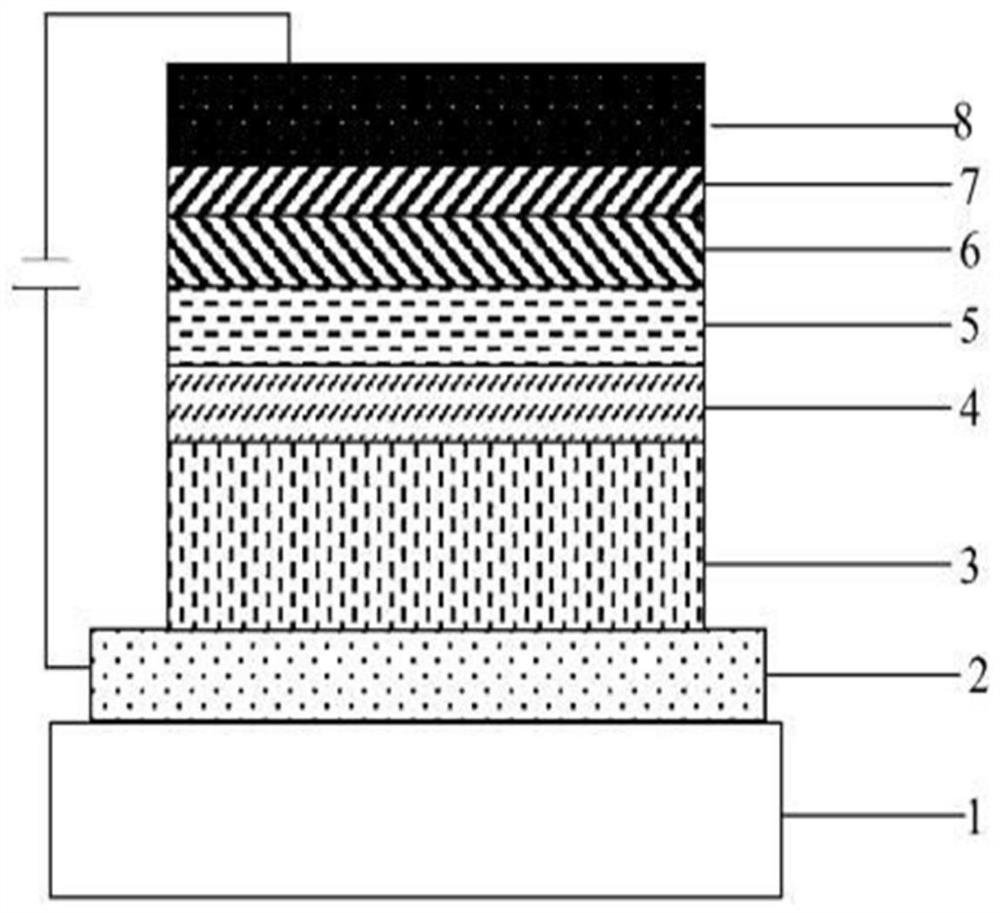
图1为实施例中所述有机电致发光器件的结构示意图;
图中,1玻璃衬底,2阳极,3空穴注入层,4空穴传输层,5发光层,6电子传输层,7电子注入层,8阴极。
具体实施方式
为使本发明的上述目的、特征和优点能够更加明显易懂,下面对本发明的具体实施方式做详细的说明。在下面的描述中阐述了很多具体细节以便于充分理解本发明。但是本发明能够以很多不同于在此描述的其它方式来实施,本领域技术人员可以在不违背本发明内涵的情况下做类似改进,因此本发明不受下面公开的具体实施例的限制。
除非另有定义,本文所使用的所有的技术和科学术语与属于本发明的技术领域的技术人员通常理解的含义相同。本文中在本发明的说明书中所使用的术语只是为了描述具体的实施方式的目的,不是旨在于限制本发明。
合成实施例1
中间体A的合成
在氮气保护下,向500mL的三口烧瓶中加入A-1 25.83g(0.1mol),A-2 32.25g(0.105mol),碳酸钠31.8g(0.3mol),醋酸钯0.4488g(0.002mol),2-双环己基磷-2',6'-二甲氧基联苯1.6421g(0.004mol),甲苯258mL,水95.4mL,混合均匀后,控制温度80~90℃保温,体系逐渐由浑浊变为清亮再变浑浊,保温一段时间后,取样HPLC跟踪至无原料A-1剩余,反应纯度93.2%。
将反应液转移至2000mL圆底烧瓶,向烧瓶中加入700g甲苯、300g水,加热搅拌至体系全溶,分液漏斗分液,用热水将有机相水洗至pH≈7,有机相经干燥后过48.4g硅胶柱,得淡黄色清亮溶液,旋转蒸发仪脱干溶剂,得淡黄色固体45.2g,使用甲苯重结晶3次,重结晶过程滤液浅棕色,固体产品颜色逐渐变浅,最终得到产品为类白色固体,重量为35.1g,产品纯度:99.4%,收率72.44%。
母体C的合成
在氮气保护下,向1000mL的三口烧瓶中加入中间体A48.45g(0.1mol),中间体B23.02g(0.11mol),碳酸铯97.74g(0.3mol),N,N-二甲基乙酰胺500mL,混合均匀后,搅拌升温,控制体系温度在135~140℃,保温回流,跟踪取样至原料中间体A反应完全,反应纯度89.1%。
反应合格后,将反应液转移至2000mL圆底烧瓶,旋转蒸发仪脱干溶剂,再向体系中加入1300mL甲苯,升温至60~70℃搅拌至体系大部分溶解,过滤除去不溶物,将有机相水洗至pH≈7,有机相经干燥后过67.4g硅胶柱,旋转蒸发仪脱干溶剂,得浅棕色固体65.9g,使用甲苯重结晶4次,最终得到产品为类白色固体,重量为59.8g,产品纯度:99.8%,收率88.73%。
化合物1的合成
在氮气保护下,向1000mL的三口烧瓶中加入中间体C 67.38g(0.1mol),中间体E112.49g(0.13mol),碳酸铯97.74g(0.3mol),N,N-二甲基乙酰胺300mL,混合均匀后,搅拌升温,控制体系温度在135~140℃,保温回流,跟踪取样至原料中间体C反应完全,反应纯度73.19%。
反应合格后,将反应液转移至1000mL圆底烧瓶,旋转蒸发仪脱干溶剂,再向体系中加入700mL甲苯,升温至60~70℃搅拌至体系大部分溶解,过滤除去不溶物,将有机相水洗至pH≈7,有机相经干燥后过75.0g硅胶柱,旋转蒸发仪脱干溶剂,得浅黄色固体63.6g,使用甲苯重结晶4次,最终得到产品为浅黄色固体,重量为59.8g,产品纯度:99.9%,收率84.80%。
HPLC-MS:材料理论分子量为749.94,实际检测结果分子量为749.29。
合成实施例2
中间体A的合成
合成方式与实施例1中的中间体A合成方法相同。
母体C的合成
合成方式与实施例1中母体C的合成方法相同。
化合物2的合成
在氮气保护下,向1000mL的三口烧瓶中加入中间体C67.38g(0.1mol),中间体E219.0g(0.13mol),碳酸铯97.74g(0.3mol),N,N-二甲基乙酰胺300mL,混合均匀后,搅拌升温,控制体系温度在135~140℃,保温回流,跟踪取样至原料中间体C反应完全,反应纯度74.31%。
反应合格后,将反应液转移至1000mL圆底烧瓶,旋转蒸发仪脱干溶剂,再向体系中加入700mL甲苯,升温至60~70℃搅拌至体系大部分溶解,过滤除去不溶物,将有机相水洗至pH≈7,有机相经干燥后过80.0g硅胶柱,旋转蒸发仪脱干溶剂,得浅黄色固体82.1g,使用甲苯重结晶4次,最终得到产品为浅黄色固体,重量为71.1g,产品纯度:99.9%,收率88.88%。
HPLC-MS:材料理论分子量为800.00,实际检测结果分子量为799.91。
合成实施例3
中间体A的合成
合成方式与实施例1中中间体A的合成方法相同。
母体C的合成
合成方式与实施例1中母体C的合成方法相同。
化合物3的合成
在氮气保护下,向1000mL的三口烧瓶中加入中间体C 67.38g(0.1mol),中间体E322.39g(0.13mol),碳酸铯97.74g(0.3mol),N,N-二甲基乙酰胺300mL,混合均匀后,搅拌升温,控制体系温度在135~140℃,保温回流,跟踪取样至原料中间体C反应完全,反应纯度71.22%。
反应合格后,将反应液转移至1000mL圆底烧瓶,旋转蒸发仪脱干溶剂,再向体系中加入700mL甲苯,升温至60~70℃搅拌至体系大部分溶解,过滤除去不溶物,将有机相水洗至pH≈7,有机相经干燥后过82.6g硅胶柱,旋转蒸发仪脱干溶剂,得浅黄色固体82.4g,使用甲苯重结晶5次,最终得到产品为浅黄色固体,重量为61.8g,产品纯度:99.9%,收率74.82%。
HPLC-MS:材料理论分子量为826.03,实际检测结果分子量为825.33。
合成实施例4
中间体A的合成
合成方式与实施例1中中间体A的合成方法相同。
母体C的合成
合成方式与实施例1中母体C的合成方法相同。
化合物6的合成
在氮气保护下,向1000mL的三口烧瓶中加入中间体C67.38g(0.1mol),中间体E625.51g(0.13mol),碳酸铯97.74g(0.3mol),N,N-二甲基乙酰胺300mL,混合均匀后,搅拌升温,控制体系温度在135~140℃,保温回流,跟踪取样至原料中间体C反应完全,反应纯度69.97%。
反应合格后,将反应液转移至1000mL圆底烧瓶,旋转蒸发仪脱干溶剂,再向体系中加入700mL甲苯,升温至60~70℃搅拌至体系大部分溶解,过滤除去不溶物,将有机相水洗至pH≈7,有机相经干燥后过85.0g硅胶柱,旋转蒸发仪脱干溶剂,得浅黄色固体88.1g,使用甲苯重结晶5次,最终得到产品为浅黄色固体,重量为59.7g,产品纯度:99.9%,收率70.24%。
HPLC-MS:材料理论分子量为850.06,实际检测结果分子量为849.29。
合成实施例5
中间体A的合成
合成方式与实施例1中中间体A的合成方法相同。
母体C的合成
合成方式与实施例1中母体C的合成方法相同。
化合物7的合成
在氮气保护下,向1000mL的三口烧瓶中加入中间体C67.38g(0.1mol),中间体E728.63g(0.13mol),碳酸铯97.74g(0.3mol),N,N-二甲基乙酰胺300mL,混合均匀后,搅拌升温,控制体系温度在135~140℃,保温回流,跟踪取样至原料中间体C反应完全,反应纯度70.92%。
反应合格后,将反应液转移至1000mL圆底烧瓶,旋转蒸发仪脱干溶剂,再向体系中加入700mL甲苯,升温至60~70℃搅拌至体系大部分溶解,过滤除去不溶物,将有机相水洗至pH≈7,有机相经干燥后过87.4g硅胶柱,旋转蒸发仪脱干溶剂,得浅黄色固体90.3g,使用甲苯重结晶5次,最终得到产品为浅黄色固体,重量为66.9g,产品纯度:99.9%,收率76.54%。
HPLC-MS:材料理论分子量为874.08,实际检测结果分子量为873.32。
合成实施例6
中间体A的合成
合成方式与实施例1中中间体A的合成方法相同。
母体C的合成
合成方式与实施例1中母体C的合成方法相同。
化合物8的合成
在氮气保护下,向1000mL的三口烧瓶中加入中间体C67.38g(0.1mol),中间体E825.51g(0.13mol),碳酸铯97.74g(0.3mol),N,N-二甲基乙酰胺300mL,混合均匀后,搅拌升温,控制体系温度在135~140℃,保温回流,跟踪取样至原料中间体C反应完全,反应纯度71.79%。
反应合格后,将反应液转移至1000mL圆底烧瓶,旋转蒸发仪脱干溶剂,再向体系中加入700mL甲苯,升温至60~70℃搅拌至体系大部分溶解,过滤除去不溶物,将有机相水洗至pH≈7,有机相经干燥后过85.0g硅胶柱,旋转蒸发仪脱干溶剂,得浅黄色固体86.7g,使用甲苯重结晶4次,最终得到产品为浅黄色固体,重量为71.2g,产品纯度:99.9%,收率83.76%。
HPLC-MS:材料理论分子量为850.06,实际检测结果分子量为849.30。
合成实施例7
中间体A的合成
合成方式与实施例1中中间体A的合成方法相同。
母体C的合成
合成方式与实施例1中母体C的合成方法相同。
化合物10的合成
在氮气保护下,向1000mL的三口烧瓶中加入中间体C 67.38g(0.1mol),中间体E1024.2g(0.13mol),碳酸铯97.74g(0.3mol),N,N-二甲基乙酰胺300mL,混合均匀后,搅拌升温,控制体系温度在135~140℃,保温回流,跟踪取样至原料中间体C反应完全,反应纯度72.28%。
反应合格后,将反应液转移至1000mL圆底烧瓶,旋转蒸发仪脱干溶剂,再向体系中加入700mL甲苯,升温至60~70℃搅拌至体系大部分溶解,过滤除去不溶物,将有机相水洗至pH≈7,有机相经干燥后过84.0g硅胶柱,旋转蒸发仪脱干溶剂,得浅黄色固体85.2g,使用甲苯重结晶4次,最终得到产品为浅黄色固体,重量为65.1g,产品纯度:99.9%,收率77.50%。
HPLC-MS:材料理论分子量为840.02,实际检测结果分子量为839.31。
下面通过应用实施例1~7详细说明本发明合成的化合物在OLED器件上的应用效果。
对比例1:
先用去离子水,然后用溶剂如丙酮、甲醇和异丙醇等溶剂对玻璃衬底1上的ITO(氧化铟锡)阳极2进行超声波清洗、再用高纯度酒精冲洗干净,氮气吹干后移至烘箱干燥,再使用等离子清洗机对ITO表面进行等离子处理约5分钟,将所述玻璃衬底1(第一电极,阳极2)装载至真空蒸镀设备中。
将化合物HAT-CN蒸镀到所述玻璃衬底1的ITO电极上,控制蒸镀速度0.03nm/s,真空度约4.7×10-5Pa,形成具有约100nm厚度的HIL(空穴注入层3)。
将化合物TAPC蒸镀到空穴注入层3区域上,控制蒸镀速度0.03nm/s,真空度约4.7×10-5Pa,形成具有约20nm厚度的HTL(空穴传输层4)。
将化合物TPA-2PPI蒸镀到空穴传输层4区域上,控制蒸镀速度0.06nm/s,真空度约4.7×10-5Pa,以形成具有约30nm厚度的EML(发光层5)。
随后,将TPBI蒸镀在所述EML上,控制蒸镀速度0.03nm/s,真空度约4.7×10-5Pa,以形成具有约25nm厚度的ETL(电子传输层6)。
随后,将LiF蒸镀在所述ETL上,控制蒸镀速度0.1nm/s,真空度约4.7×10-5Pa,以形成具有约0.5nm厚度的EIL(电子注入层7)。
最后,将Al蒸镀在所述EIL上,控制蒸镀速度1.0nm/s,真空度约4.7×10-5Pa,以形成具有约100nm厚度的第二电极(阴极8),由此完成有机发光器件的制造。
应用实施例1:
操作与对比例1基本相同,不同点为将发光层材料使用化合物1(蓝色荧光主体)和TPA-2PPI(蓝光掺杂剂)以93:7的质量比蒸镀在空穴传输层上形成约30nm厚的EML。
本发明所述应用实施例2~7的器件制作与实施例1的制作工艺完全相同,并且使用相同的基板材料和电极材料,并且电极材料的膜厚度相同,不同处仅将发光层主体分别换成了化合物2至化合物10,对比例1和实施例1~7所制作的器件各项数据检测结果见表1。
表1
由表1分析可知,选用本发明的化合物作为OLED器件发光主体材料,与现有发光材料TPA-2PPI相比,本发明可以降低OLED器件的驱动电压,提高器件的发光效率和色纯度。在OLED器件的应用上具有很大的应用价值和商业价值,具备良好的产业化前景。
表2
以上所述实施例的各技术特征可以进行任意的组合,为使描述简洁,未对上述实施例中的各个技术特征所有可能的组合都进行描述,然而,只要这些技术特征的组合不存在矛盾,都应当认为是本说明书记载的范围。
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
- 一种含芴及吲哚类化合物及其应用
- 一种含咔唑‑9‑基基团的芴类化合物及其应用
