蛋白质OsMaspardin及其编码基因与应用
文献发布时间:2023-06-19 11:22:42
技术领域
本发明涉及生物技术领域,具体涉及一种蛋白质OsMaspardin及其编码基因与应用。
背景技术
水稻(Oryza sativa L.)是世界主要粮食作物之一,地球上近一半人口都以稻米为食,种植水稻需要消耗大量的淡水资源。水资源短缺是当前制约全球农业生产发展的一个严峻的生态问题。干旱是长期以来影响全世界粮食安全的主要限制因素,随着全球气温升高,干旱和半干旱土地面积正在逐年增加。中国干旱半干旱耕地面积约占总耕地面积的51%,每年有将近2.5×10
Maspardin蛋白属于α/β水解酶超家族成员,含有Maspardin结构域。研究发现,α/β水解酶基因属于是超基因家族,广泛存在于动物、植物和微生物中,所作用的酯键包括羧酸酯键、磷酸酯键和硫酸酯键等。α/β水解酶种类繁多,功能和催化的底物多样,专一性也有很大的差别。主要功能有:(1)参与物质代谢。例如在生物体内糖类合成和分解代谢中涉及多种磷酸酯酶,它们催化糖类物质脱磷酸化;在脂类代谢中,酯酶参与脂类的分解和合成。(2)参与蛋白质的活性调节。蛋白质的磷酸化和去磷酸化是蛋白质的活性调节的重要机制,而磷酸酯酶和蛋白激酶是蛋白质磷酸化和去磷酸化调节系统的主要组成部分,这个调节系统影响酶、细胞膜转运蛋白、信号转录通路蛋白和转录因子的活性,从而参与调节物质代谢、物质转运、信号传递和基因表达。(3)参与细胞内信号物质的合成和转化。例如,磷脂酶催化磷脂分解产生三磷酸肌醇和甘油二酯;磷酸二酯酶9能将环磷酸鸟苷转化为无活性的磷酸鸟苷;环核苷酸磷酸二酯酶水解环磷腺苷使其失去信号功能。(4)参与植物抗逆性调控。α/β水解酶是植物重要的抗逆调节物质,参与许多逆境,包括盐胁迫、干旱、冷害、ABA及生物逆境,特别是磷脂酶参与抗逆性的研究取得了较大进展。
在长期的进化过程中,植物发展出了一系列的耐盐抗旱机制。随着分子生物学的迅速发展,植物耐盐抗旱生理生化机制日益明确,使得克隆与植物耐盐抗旱相关基因成为可能。加强植物耐盐抗旱生理的研究,探明植物在逆境下的生命活动规律并加以人为调控,克隆水稻α/β水解酶相关基因OsMaspardin,利用基因工程技术提高植物耐盐性和抗旱性,培育具有抵抗不良环境性状的优良品种,以提高作物的产量和品质,对于获得农业高产稳产具有重要意义。
发明内容
本发明的目的在于提供一种蛋白质OsMaspardin及其编码基因与应用,可以有效解决背景技术中提出的问题。
为了实现上述发明目的,本发明首先提供了一种蛋白质,名称为 OsMaspardin蛋白或蛋白质OsMaspardin,来源于水稻(Oryza sativa L.),为如下(a1)或(a2)或(a3)任一所示:
(a1)氨基酸序列如SEQ ID NO.1所示的蛋白质;
(a2)SEQ ID NO.1所示的氨基酸序列的N端或/和C端连接蛋白标签得到的融合蛋白;
(a3)将SEQ ID NO.1所示的氨基酸序列经过一个或几个氨基酸残基的取代和/或缺失和/或添加得到的与A1)所示的蛋白质具有90%以上的同一性且功能相同的蛋白质。
其中,SEQ ID NO.1由387个氨基酸残基组成。
上述蛋白质可人工合成,也可先合成其编码基因,再进行生物表达得到。
上述蛋白质中,蛋白标签(protein-tag)是指利用DNA体外重组技术,与目的蛋白一起融合表达的一种多肽或者蛋白,以便于目的蛋白的表达、检测、示踪和/或纯化。所述蛋白标签可为Flag标签、His标签、MBP标签、HA标签、 myc标签、GST标签和/或SUMO标签等。
上述蛋白质中,同一性是指氨基酸序列的同一性。可使用国际互联网上的同源性检索站点测定氨基酸序列的同一性,如NCBI主页网站的BLAST网页。例如,可在高级BLAST2.1中,通过使用blastp作为程序,将Expect值设置为 10,将所有Filter设置为OFF,使用BLOSUM62作为Matrix,将Gap existence cost, Per residue gap cost和Lambdaratio分别设置为11,1和0.85(缺省值)并进行检索一对氨基酸序列的同一性进行计算,然后即可获得同一性的值(%)。
上述蛋白质中,所述90%以上的同一性可为至少91%、92%、95%、96%、 98%、99%或100%的同一性。
本发明还提供蛋白质OsMaspardin的下述任一中的应用:
(b1)提高植物耐盐性;
(b2)制备提高植物耐盐性的产品;
(b3)提高植物抗旱性;
(b4)制备提高植物抗旱性的产品;
(b5)提高干旱和/或盐胁迫条件下植物的生根情况;
(b6)制备提高干旱和/或盐胁迫条件下植物的生根情况的产品;
(b7)提高干旱和/或盐胁迫条件下植物的长势;
(b8)制备干旱和/或盐胁迫条件下植物的长势的产品;
(b9)制备干旱和/或盐胁迫条件下植物的存活率;
(b10)制备提高干旱和/或盐胁迫条件下植物的存活率的产品;
(b11)提高干旱和/或盐胁迫条件下植物脱落酸含量;
(b12)制备提高干旱和/或盐胁迫条件下植物脱落酸含量的产品;
(b13)提高干旱和/或盐胁迫条件下植物脯氨酸含量;
(b14)制备提高干旱和/或盐胁迫条件下植物脯氨酸含量的产品;
(b15)降低干旱和/或盐胁迫条件下植物H
(b16)制备降低干旱和/或盐胁迫条件下植物H
(b17)降低干旱和/或盐胁迫条件下植物丙二醛含量;
(b18)制备降低干旱和/或盐胁迫条件下植物丙二醛含量的产品;
(b19)提高干旱和/或盐胁迫条件下植物SOD活性;
(b20)制备提高干旱和/或盐胁迫条件下植物SOD活性的产品;
(b21)提高干旱和/或盐胁迫条件下植物POD活性;
(b22)制备提高干旱和/或盐胁迫条件下植物POD活性的产品;
上述蛋白质OsMaspardin相关生物材料也属于本发明的保护范围,本发明还提供了蛋白质OsMaspardin相关生物材料的新用途。
本发明蛋白质OsMaspardin相关生物材料的下述任一种中的应用也在本发明的保护范围之内:
(b1)提高植物耐盐性;
(b2)制备提高植物耐盐性的产品;
(b3)提高植物抗旱性;
(b4)制备提高植物抗旱性的产品;
(b5)提高干旱和/或盐胁迫条件下植物的生根情况;
(b6)制备提高干旱和/或盐胁迫条件下植物的生根情况的产品;
(b7)提高干旱和/或盐胁迫条件下植物的长势;
(b8)制备干旱和/或盐胁迫条件下植物的长势的产品;
(b9)制备干旱和/或盐胁迫条件下植物的存活率;
(b10)制备提高干旱和/或盐胁迫条件下植物的存活率的产品;
(b11)提高干旱和/或盐胁迫条件下植物脱落酸含量;
(b12)制备提高干旱和/或盐胁迫条件下植物脱落酸含量的产品;
(b13)提高干旱和/或盐胁迫条件下植物脯氨酸含量;
(b14)制备提高干旱和/或盐胁迫条件下植物脯氨酸含量的产品;
(b15)降低干旱和/或盐胁迫条件下植物H
(b16)制备降低干旱和/或盐胁迫条件下植物H
(b18)制备降低干旱和/或盐胁迫条件下植物丙二醛含量的产品;
(b19)提高干旱和/或盐胁迫条件下植物SOD活性;
(b20)制备提高干旱和/或盐胁迫条件下植物SOD活性的产品;
(b21)提高干旱和/或盐胁迫条件下植物POD活性;
(b22)制备提高干旱和/或盐胁迫条件下植物POD活性的产品;
上述应用中,所述相关生物材料为下述(c1)-(c10)中的任一种:
(c1)编码蛋白质OsMaspardin的核酸分子;
(c2)含有(c1)所述核酸分子的表达盒;
(c3)含有(c1)所述核酸分子的重组载体、或含有(c2)所述表达盒的重组载体;
(c4)含有(c1)所述核酸分子的重组微生物、或含有(c2)所述表达盒的重组微生物、或含有(c3)所述重组载体的重组微生物;
(c5)含有(c1)所述核酸分子的转基因植物细胞系、或含有(c2)所述表达盒的转基因植物细胞系、或含有(c3)所述重组载体的转基因植物细胞系;
(c6)含有(c1)所述核酸分子的转基因植物组织、或含有(c2)所述表达盒的转基因植物组织、或含有(c3)所述重组载体的转基因植物组织;
(c7)含有(c1)所述核酸分子的转基因植物器官、或含有(c2)所述表达盒的转基因植物器官、或含有(c3)所述重组载体的转基因植物器官;
(c8)含有(c1)所述核酸分子的转基因植株、或含有(c2)所述表达盒的转基因植株、或含有(c3)所述重组载体的转基因植株;
(c9)由(c8)所述转基因植株的可再生细胞产生的组织培养物;
(c10)由(c9)所述组织培养物产生的原生质体。
其中,所述核酸分子可以是DNA,如cDNA、基因组DNA或重组DNA;所述核酸分子也可以是RNA,如mRNA或hnRNA等。
上述相关生物材料中,(c1)编码蛋白质OsMaspardin的核酸分子具体可为如下(d1)或(d2)或(d3)中任一所示
(d1)SEQ ID NO.2所示的DNA分子;
(d2)编码序列为SEQ ID NO.2所示的DNA分子;
(d3)在严格条件下与(d1)或(d2)限定的DNA分子杂交,且编码蛋白质OsMaspardin的DNA分子。
其中,SEQ ID NO.2由387个核苷酸组成,其开放阅读框(ORF)为自5′末端起第1位-387位,编码氨基酸序列如SEQ ID NO.1所示的蛋白。
所述严格条件是在2×SSC,0.1%SDS的溶液中,在68℃下杂交并洗膜2次,每次5min,又于0.5×SSC,0.1%SDS的溶液中,在68℃下杂交并洗膜2次,每次15min。
含有所述与植物抗逆性相关蛋白的编码基因的表达盒、重组表达载体、转基因细胞系或重组菌也属于本发明的保护范围。
上述相关生物材料中,(c2)所述的表达盒是指能够在宿主细胞中表达蛋白质OsMaspardin的DNA,该DNA不但可包括启动OsMaspardin基因转录的启动子,还可包括终止OsMaspardin基因转录的终止子。
上述相关生物材料中,(c3)所述重组载体可含有SEQ ID NO.2所示的用于编码蛋白质OsMaspardin的DNA分子。
可用植物表达载体构建含有所述OsMaspardin编码基因表达盒的重组载体。所述植物表达载体可为Gateway系统载体或双元农杆菌载体等,如pGWB411、 pGWB412、pGWB405、pBin438、pCAMBIA1300、pCAMBIA1302、 pCAMBIA2300、pCAMBIA2301、pCAMBIA1301、pBI121、pCAMBIA1391-Xa 或pCAMBIA1391-Xb等。使用OsMaspardin构建重组载体时,在其转录起始核苷酸前可加上任何一种增强型、组成型、组织特异型或诱导型启动子,如花椰菜花叶病毒(CAMV)35S启动子、泛生素基因Ubiqutin启动子(pUbi)等,它们可单独使用或与其它的植物启动子结合使用;此外,使用本发明的基因构建植物表达载体时,还可使用增强子,包括翻译增强子或转录增强子,这些增强子区域可以是ATG起始密码子或邻接区域起始密码子等,但必需与编码序列的阅读框相同,以保证整个序列的正确翻译。所述翻译控制信号和起始密码子的来源是广泛的,可以是天然的,也可以是合成的。翻译起始区域可以来自转录起始区域或结构基因。
在本发明具体的实施方式中,所述重组表达载体是在载体pCBGUS的多克隆位点间插入所述编码基因得到的重组表达载体;
所述载体pCBGUS是通过包括如下步骤的方法得到的:
(1)将pCAMBIA1301载体经过Hind III和EcoR I双酶切,回收载体大片段;
(2)将pBI121载体经过Hind III和EcoR I双酶切,回收包含gusA基因的片段;
(3)将步骤(1)中回收的载体大片段与步骤(2)中回收的包含gusA基因的片段连接,得到重组载体pCBGUS。
所述pCAMBIA1301载体购自CAMBIA公司;所述pBI121载体购自 Clontech公司。
上述相关生物材料中,(c4)所述重组微生物具体可为酵母、细菌、藻和真菌。
上述相关生物材料中,(c7)所述转基因植物器官可为转基因植物的根、茎、叶、花、果实和种子。
上述相关生物材料中,(c9)所述组织培养物可来源于根、茎、叶、花、果实、种子、花粉、胚和花药。
上述相关生物材料中,所述转基因植物细胞系、转基因植物组织和转基因植物器官均不包括繁殖材料。
上述蛋白质OsMaspardin或其相关生物材料在植物育种中的应用也在本发明的保护范围之内。
上述应用中,植物育种中的应用具体可为将含有所述蛋白质OsMaspardin 或所述相关生物材料(如蛋白质OsMaspardin编码基因OsMaspardin)的植物与其它植物进行杂交以进行植物育种。
本发明进一步提供了提供一种培育抗旱性高的转基因植物的方法。
本发明培育抗旱性与耐盐性高的转基因植物的方法,包括提高目的植物中蛋白质OsMaspardin的基因的表达量和/或所述蛋白质OsMaspardin的含量和/或所述蛋白质OsMaspardin的活性,得到转基因植物;所述转基因植物的抗旱性与耐盐性高于所述目的植物。
上述方法中,所述提高目的植物中蛋白质OsMaspardin的基因的表达量和/ 或所述蛋白质OsMaspardin的含量和/或所述蛋白质OsMaspardin的活性的方法为在目的植物中表达或过表达蛋白质OsMaspardin。
上述方法中,所述表达或过表达的方法为将蛋白质OsMaspardin的编码基因导入目的植物。
上述方法中,将蛋白质OsMaspardin的编码基因导入目的植物可通过携带有本发明OsMaspardin基因的植物表达载体导入目的植物中。携带有本发明基因 OsMaspardin的植物表达载体可通过使用Ti质粒、Ri质粒、植物病毒载体、直接DNA转化、微注射、电导、农杆菌介导等常规生物学方法转化植物细胞或组织,并将转化的植物细胞或组织培育成植株。
上述方法中,所述蛋白质OsMaspardin的编码基因的核苷酸序列是SEQ ID NO.2所示的DNA分子。
在本发明具体的实施方式中,所述携带有本发明基因OsMaspardin的植物表达载体可为pCAMBIA1301-OsMaspardin。具体的,pCAMBIA1301-OsMaspardin 利用限制性内切酶Hind III和EcoR I将SEQ ID NO.2所示的DNA分子插入至 pCAMBIA1301载体得到的。
上述方法中,所述抗旱性与耐盐性高主要体现在提高植物的根数、根长、鲜重和存活率、提高ABA含量、提高脯氨酸含量、提高SOD活性、提高POD 活性、降低H
本发明中,所述植物是如下(e1)至(e5)中的任一种:
(e1)双子叶植物;
(e2)单子叶植物;
(e3)禾本科植物;
(e4)稻属植物;
(e5)水稻(Oryza sativa)。
与现有技术相比,本发明的有益效果是:本发明所提供的OsMaspardin基因所编码的蛋白可以提高植物的抗逆性:过表达OsMaspardin基因可提高水稻的抗旱性与耐盐性,干扰表达OsMaspardin基因可降低水稻的抗旱性与耐盐性。从试验结果来看,在NaCl胁迫下,转基因植物表现出很好的生长状态,过表达转基因水稻材料的苗长和鲜重分别比野生型WT材料提高了129~154%和169~ 205%;在甘露醇胁迫下,过表达转基因水稻材料的苗长和鲜重分别比野生型WT 材料提高了128~143%和162~211%;过表达转基因水稻的存活率显著高于野生型植株,较野生型植株相比分别提高了417~513%和230~273%,表达出很强的耐盐性和抗旱性;具体体现在过表达转基因水稻材料增加了ABA含量、脯氨酸含量、SOD活性、POD活性、降低了丙二醛含量和H
附图说明
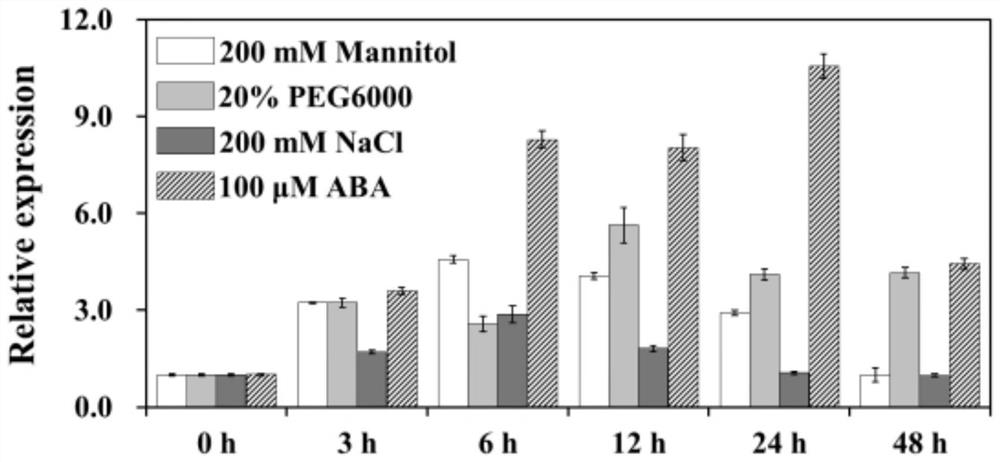
图1本发明OsMaspardin基因在水稻品种扬粳805中的逆境胁迫表达分析。
图2本发明OsMaspardin基因过表达水稻株系的PCR检测结果图。
图3本发明OsMaspardin基因在过表达水稻株系和野生型水稻植株中的表达。
图4本发明OsMaspardin基因干扰水稻株系的PCR检测结果图。
图5本发明OsMaspardin基因在干扰水稻株系和野生型水稻植株中的表达。
图6本发明OsMaspardin基因转基因水稻植株在200mM NaCl、200mM甘露醇的MS培养基上的生长和生根情况,WT为野生型水稻植株,OE2、OE4和 OE7为过表达转基因水稻植株,Ri2和Ri3为干扰表达水稻植株。
图7本发明OsMaspardin基因转基因水稻植株的耐盐性和抗旱性盆栽鉴定, WT为野生型水稻植株,OE2、OE4和OE7为过表达转基因水稻植株,Ri2和 Ri3为干扰表达水稻植株。
图8本发明OsMaspardin基因转基因水稻植株抗逆生理生化指标测定,WT 为野生型水稻植株,OE2、OE4和OE7为过表达转基因水稻植株,Ri2和Ri3 为干扰表达水稻植株。
具体实施方式
下面结合实施例对本发明提供的一种蛋白质OsMaspardin及其编码基因与应用,但是不能把它们理解为对本发明保护范围的限定。
下述实施例中,所用的试验材料及其来源包括:
水稻(Oryza sativa)品种扬粳805和中花11号,由淮阴工学院生命科学与食品工程学院江苏省植物生产与加工实践教育中心实验室保存。
大肠杆菌(Escherichia coli)DH5α由淮阴工学院生命科学与食品工程学院江苏省植物生产与加工实践教育中心实验室保存。克隆载体PMD-18-Simple T、各类限制性内切酶、Taq聚合酶、连接酶、dNTP、10×PCR buffer和DNA marker 购自宝生物工程大连有限公司。所有的化学试剂都从美国西格玛化学公司和上海国药化学试剂公司购买。
本发明中常规的分子生物学操作具体参见《分子克隆》【Molecular Cloning. 2nded.Cold Spring Harbor Laboratory Press,1989】。
下述实施例中常规的基因操作参照分子克隆文献进行【Sambook J,Frets EF,Mannsdes T et al.In:Molecular Cloning.2nd ed.Cold Spring Harbor LaboratoryPress,1989】。
1/2霍格兰营养液记载于如下文献中【Feibing Wang,Weili Kong,Gary Wong,Lifeng Fu,Rihe Peng,Zhenjun Li,Quanhong Yao.AtMYB12 regulates flavonoidsaccumulation and abiotic stress tolerance in transgenic Arabidopsis thaliana.Molecular Genetics and Genomics,2016,291:1545-1559】。
实施例1水稻抗逆性相关的蛋白及其编码基因的获得
1.实验材料
参照Jan等(2013)【Asad Jan,Kyonoshin Maruyama,Daisuke Todaka,SatoshiKidokoro,Mitsuru Abo,Etsuro Yoshimura,Kazuo Shinozaki,Kazuo Nakashima andKazuko Yamaguchi-Shinozaki.OsTZF1,a CCCH-Tandem Zinc Finger Protein, ConfersDelayed Senescence and Stress Tolerance in Rice by Regulating Stress-RelatedGenes.Plant Physiology,2013,161:1202-1216】的方法,将水稻品种‘扬粳805’植物叶片材料取下,液氮速冻,-80℃保存。
2.叶片总RNA提取和纯化
取‘扬粳805’幼苗展开叶片约2.0g,在液氮中研磨成粉状,加入10mL离心管,用Applygen植物RNA提取试剂盒(Applygen Technologies Inc,Beijing) 提取甘薯块根总RNA,试剂盒中包括:Plant RNAReagent,植物组织裂解、分离RNA、去除植物多糖和多酚;Extraction Reagent,有机抽提去除蛋白质、DNA、多糖和多酚;Plant RNA Aid,去除植物多糖多酚和次生代谢产物。利用QIAGEN Oligotex Mini mRNA Kit(QIAGEN,GmbH,Germany)从总RNA中纯化 mRNA。最后,取1μL于1.2%琼脂糖凝胶电泳检测其完整性,另取2μL稀释至500μL,用紫外分光光度计检测其质量(OD
3.OsMaspardin蛋白cDNA的全长克隆
以OsMaspardin基因cDNA序列设计引物进行OsMaspardin蛋白cDNA的全长克隆。
引物序列如下:
OsMaspardin-GC-F:5’-ATGAAGGGCGGCGGGGGCG-3’
OsMaspardin-GC-R:5’-TCATACATCCAATGGCTGTCTCGAC-3’
以‘扬粳805’幼苗展开叶片总RNA经Oligo(dT)反转录为模板,用高保真的FastPfu酶,进行PCR扩增,PCR条件为95℃1min,随后95℃20s,53℃ 20s和72℃1min,进行36个循环,最后72℃延伸5min。琼脂糖凝胶电泳检测PCR扩增产物,获得690bp长度的扩增片段。
综合上述步骤的结果,获得了目的cDNA序列,其核苷酸序列如序列表中序列SEQID NO 1所示。序列表中序列SEQ ID NO 1由1164个碱基组成,自5’端第1位-第1164位碱基为其开放阅读框,编码具有序列表中序列SEQ ID NO 2 所示的氨基酸残基序列的蛋白质。序列表中序列SEQ ID NO 2由387个氨基酸残基组成。将该基因命名为OsMaspardin,将其编码的蛋白命名为OsMaspardin。
实施例2OsMaspardin基因的逆境胁迫表达分析
1.逆境胁迫处理
将‘扬粳805’的饱满种子用1%次氯酸钠表面消毒20min,蒸馏水冲洗6遍,然后用蒸馏水浸泡24-36h,置于湿纱布上,32℃催芽大约2d。将发芽一致的种子播于粘有纱布的泡沫塑料孔板上,进行液体培养,正常生长4w后,开始以下胁迫处理。
甘露醇处理:将水稻幼苗从营养液中转移到含有200mM甘露醇的溶液中,分别在0、3、6、12、24、48h取水稻的根和叶;
PEG处理:处理方法同甘露醇,PEG6000溶液的浓度是20%,分别在0、3、 6、12、24、48h取水稻的根和叶;
NaCl处理:处理方法同甘露醇,NaCl溶液的浓度是200mM,分别在0、3、 6、12、24、48h取水稻的根和叶;
ABA处理:处理方法同甘露醇,ABA溶液的浓度是100μM,分别在0、3、 6、12、24、48h取水稻的根和叶;
对照处理:直接取未经任何处理的幼苗根和叶作为对照(0h)。
所有样品取样后立即经液氮冷冻,-80℃保存。
2.逆境胁迫qRT-PCR分析
分别提取上述步骤中的各处理根和叶总RNA,反转录得到cDNA,进行 qRT-PCR分析,鉴定OsMaspardin基因在水稻不同胁迫处理后的表达特征。 OsActin基因为内参:OsActin-F:5’-TTATGGTTGGGATGGGACA-3’和 OsActin-R:5’-AGCACGGCTTGAATAGCG-3’;OsMaspardin引物序列为: OsMaspardin-F:5’-TGCAAGGCGTGCAGTACTAA-3’和OsMaspardin-R:5’- AGCACTGCCATTACGTGTGA-3’。
结果如图1所示,OsMaspardin基因能被甘露醇、PEG6000、NaCl和ABA 诱导表达,表明OsMaspardin基因与植物耐盐性和抗旱性相关。
实施例3OsMaspardin基因过表达载体的构建及过表达水稻植株的获得
1.OsMaspardin基因过表达载体的构建
将实施例1中测序鉴定正确的含有序列表SEQ ID NO 1所示核苷酸的DNA 片段用BamH I和Sac I进行双酶切,用1%琼脂糖凝胶回收DNA片段,通过T
2.过表达OsMaspardin基因转化水稻
将构建的水稻OsMaspardin基因的过表达载体pCAMBIA1301-OsMaspardin 转化水稻,具体方法如下:
(1)农杆菌的准备
步骤(1)将pCAMBIA1301-OsMaspardin用电击法转化根癌农杆菌EHA105 菌株(Biovector Co.,LTD),得到含有pCAMBIA1301-OsMaspardin的重组农杆菌甲,将重组农杆菌甲命名为EHA105/pCB-OsMaspardin,并涂布于含有卡那霉素抗性的平板筛选转化子。
步骤(2)挑取农杆菌甲单菌接种于5mL LB液体培养基(利福平50μg/mL,氯霉素100μg/mL)中,28℃,250rpm培养20h。
步骤(3)取1mL菌液转接入20-30mL LB液体培养基(利福平50μg/mL,氯霉素100μg/mL)中,28℃,250rpm培养约12h,测OD 600≈1.5。
步骤(4)8000rpm,4℃,10min离心收集菌体,重悬于农杆菌转化渗透液(5%蔗糖,0.05%Silwet L-77)并稀释至OD 600≈0.8。
(1)水稻成熟胚愈伤的获取
步骤(1)将成熟的水稻品种中花11号种子去掉颖壳,用70%酒精消毒1-2 min;
步骤(2)然后用20%的次氯酸钠浸泡30-40min,用无菌蒸馏水冲洗4遍,将种子转移到灭过菌的滤纸上吸干表面水分,然后接种在NB诱导培养基上;
步骤(3)暗培养7-10d后,当盾片膨大,胚乳变软时,去掉胚和芽,把剥下的胚性愈伤转移到NB继代培养基上,大约3w继代一次,继代2-3次后就可以作为受体进行转化。
(3)农秆菌介导转化水稻愈伤组织
步骤(1)选取良好的胚性愈伤组织放于上述侵染液中,浸泡30min;
步骤(2)将愈伤组织取出,用无菌滤纸吸去多余菌液,然后置于NB共培养培养基上培养至刚有菌落出现(大约2-3d);
步骤(3)用无菌水振荡清洗3-4次,直至上清液完全清洁为止,用500mg/L 头孢霉素溶液振荡清洗40min;
步骤(4)取出愈伤组织,放入只带滤纸的无菌培养皿中0.4m/s风干4h,转入NB筛选培养基筛选两轮(每轮3-4w);
步骤(5)将抗性愈伤进行预分化2-3w,然后转移到分化培养基中光照培养2-3w;
步骤(6)待幼芽长至约1cm时转入壮苗培养基培养30d左右;
步骤(7)揭去封口膜炼苗培养1w左右,然后移栽到土中。
3.过表达OsMaspardin基因水稻植株PCR检测
(1)试验方法
用CTAB法提取T
(2)试验结果
电泳检测扩增结果见图2【图2中,泳道M:Maker;泳道W:水;泳道P:阳性对照(重组质粒pCAMBIA1301-OsMaspardin);泳道WT:野生型水稻植株;泳道OE1-OE9:为转化pCAMBIA1301-OsMaspardin的过表达水稻转基因植株】。从图中可见,转化pCAMBIA1301-OsMaspardin的水稻拟转基因植株和阳性对照扩增出591bp的目标条带,表明OsMaspardin基因已经整合到水稻的基因组中,并证明这些再生植株为转基因植株;野生型水稻植株没有扩增出591 bp的目标条带。转基因植株为后续功能分析。
4.过表达OsMaspardin基因水稻植株qRT-PCR检测
(1)试验方法
提取阳性过表达OsMaspardin水稻株系RNA,反转录得到cDNA,进行 qRT-PCR分析,以未转化的烟草野生型为对照。OsActin基因为内参:OsActin-F: 5’-TTATGGTTGGGATGGGACA-3’和OsActin-R: 5’-AGCACGGCTTGAATAGCG-3’;OsMaspardin引物序列为:OsMaspardin-F: 5’-TGCAAGGCGTGCAGTACTAA-3’和OsMaspardin-R:5’-AGCACTGCCATTACGTGTGA-3’。
(2)试验结果
结果如图3所示,WT为野生型水稻植株,OE1-OE9均为阳性转过表达 OsMaspardin水稻植株,表明OsMaspardin在转基因水稻植株中有不同程度的表达,选取表达量最高的过表达株系OE2、OE4和OE7用于后续分析。
实施例4OsMaspardin基因干扰表达载体的构建及干扰水稻植株的获得
1.OsMaspardin基因干扰表达载体的构建
利用Gateway技术构建水稻OsMaspardin基因的RNAi干扰载体,选取 OsMaspardin基因的cDNA序列3’端290bp的特异性区段作为OsMaspardin基因RNA干扰目的片段,采用软件primer5.0设计扩增该RNA干扰目标片段的上游引物OsMaspardin-RNAi-F:5’-TCACACGTAATGGCAGTGCT-3’和下游引物 OsMaspardin-RNAi-R:5’-ATCCAATGGCTGTCTCGACG-3’,并根据Gateway 克隆技术在F引物5’端加上CACC四个碱基,首先把该RNAi干扰目的片段连接pENTR/D Gateway入门载体,然后经过LR反应连接到植物表达载体pANDA 的相应位点,连接产物转化大肠杆菌DH5α,在含有卡那霉素和潮霉素的LB平板上筛选转化子,经酶切和PCR鉴定后,测序确认,RNAi干扰表达载体命名为RNAi-OsMaspardin。
2.干扰表达OsMaspardin基因转化水稻
将构建的水稻OsMaspardin基因的干扰表达载体RNAi-OsMaspardin转化水稻,具体方法如下:
(1)农杆菌的准备
步骤(1)将RNAi-OsMaspardin用电击法转化根癌农杆菌EHA105菌株(BiovectorCo.,LTD),得到含有RNAi-OsMaspardin的重组农杆菌乙,将重组农杆菌甲命名为EHA105/RNAi-OsMaspardin,并涂布于含有卡那霉素抗性的平板筛选转化子。
步骤(2)挑取农杆菌甲单菌接种于5mL LB液体培养基(利福平50μg/mL,氯霉素100μg/mL)中,28℃,250rpm培养20h。
步骤(3)取1mL菌液转接入20-30mL LB液体培养基(利福平50μg/mL,氯霉素100μg/mL)中,28℃,250rpm培养约12h,测OD 600≈1.5。
步骤(4)8000rpm,4℃,10min离心收集菌体,重悬于农杆菌转化渗透液(5%蔗糖,0.05%Silwet L-77)并稀释至OD 600≈0.8。
(1)水稻成熟胚愈伤的获取
步骤(1)将成熟的水稻品种中花11号种子去掉颖壳,用70%酒精消毒1-2 min;
步骤(2)然后用20%的次氯酸钠浸泡30-40min,用无菌蒸馏水冲洗4遍,将种子转移到灭过菌的滤纸上吸干表面水分,然后接种在NB诱导培养基上;
步骤(3)暗培养7-10d后,当盾片膨大,胚乳变软时,去掉胚和芽,把剥下的胚性愈伤转移到NB继代培养基上,大约3w继代一次,继代2-3次后就可以作为受体进行转化。
(3)农秆菌介导转化水稻愈伤组织
步骤(1)选取良好的胚性愈伤组织放于上述侵染液中,浸泡30min;
步骤(2)将愈伤组织取出,用无菌滤纸吸去多余菌液,然后置于NB共培养培养基上培养至刚有菌落出现(大约2-3d);
步骤(3)用无菌水振荡清洗3-4次,直至上清液完全清洁为止,用500mg/L 头孢霉素溶液振荡清洗40min;
步骤(4)取出愈伤组织,放入只带滤纸的无菌培养皿中0.4m/s风干4h,转入NB筛选培养基筛选两轮(每轮3-4w);
步骤(5)将抗性愈伤进行预分化2-3w,然后转移到分化培养基中光照培养2-3w;
步骤(6)待幼芽长至约1cm时转入壮苗培养基培养30d左右;
步骤(7)揭去封口膜炼苗培养1w左右,然后移栽到土中。
3.干扰表达OsMaspardin基因水稻植株PCR检测
(1)试验方法
用CTAB法提取水稻拟RNAi植株和野生型植株的基因组DNA。用常规方法进行PCR检测,所使用的hpt II基因引物为:Primer 1: 5’-ACAGCGTCTCCGACCTGATGCA -3’和Primer2:5’-AGTCAATGACCGCTGTTATGCG-3’。在0.2mL Eppendorf离心管中加入 10×PCR buffer 2μL、4dNTP(10mol/L)1μL、引物(10μmol/L)均为1μL、模板DNA(50ng/uL)2μL、Taq DNA聚合酶0.25μL,加ddH
(2)试验结果
电泳检测扩增结果见图4【图4中,泳道M:Maker;泳道P:阳性对照(重组质粒RNAi-OsMaspardin);泳道WT:野生型水稻植株;泳道Ri1-Ri5:为转化RNAi-OsMaspardin的干扰表达水稻转基因植株】。从图中可见,转化 RNAi-OsMaspardin的水稻拟转基因植株和阳性对照扩增出591bp的目标条带,表明Ri1-Ri5均为水稻RNAi干扰阳性植株。
4.干扰表达OsMaspardin基因水稻植株qRT-PCR检测
(1)试验方法
提取干扰表达水稻株系RNA,反转录得到cDNA,进行qRT-PCR分析,以未转化的水稻野生型为对照。OsActin基因为内参:OsActin-F:5’-TTATGGTTGGGATGGGACA-3’和OsActin-R: 5’-AGCACGGCTTGAATAGCG-3’;OsMaspardin引物序列为:OsMaspardin引物序列为:OsMaspardin-F:5’-TGCAAGGCGTGCAGTACTAA-3’和 OsMaspardin-R:5’-AGCACTGCCATTACGTGTGA-3’。
(2)试验结果
结果如图5所示,WT为野生型水稻植株,Ri1-Ri5均为水稻RNAi植株,表明OsMaspardin基因在RNAi水稻植株中表达量显著降低,选取表达量最低的干扰株系Ri2和Ri3用于后续分析。
实施例5OsMaspardin基因转基因水稻植株抗旱性与耐盐性鉴定
1.转基因水稻植株抗旱性与耐盐性离体鉴定
(1)试验方法
将过表达水稻材料、干扰表达水稻材料和野生型材料的种子消毒,种子播种在MS固体平板上,种子发芽2-3d后,选取发芽状态一致的种子,分别播种在MS、MS+NaCl(200mM)和MS+甘露醇(200mM)的不同中指管培养基上,苗生长7-10d之后,不同处理的苗长势开始出现差异,进行照相和生长势统计,包括苗长和鲜重数据。
(2)试验结果
结果显示,在盐胁迫、甘露醇处理条件下,结果见图6,过表达水稻材料、干扰表达水稻材料和野生型材料均因为盐胁迫、甘露醇胁迫条件的存在,植株变小;但是过表达水稻材料和野生型WT相比,生长状态相对较好,生长势数据统计显示,在盐胁迫下,过表达水稻材料的苗长和鲜重分别比野生型WT材料提高了129~154%和169~205%;在甘露醇胁迫下,过表达水稻材料的苗长和鲜重分别比野生型WT材料提高了128~143%和162~211%;表明过表达OsMaspardin基因显著提高转基因水稻植株的耐盐性和抗旱性。
2.转基因水稻植株抗旱性与耐盐性盆栽鉴定
(1)试验方法
为了验证转基因水稻材料的耐盐性和抗旱性,将纯合的T
(2)试验结果
结果显示,在盐胁迫处理条件4w或干旱胁迫处理6w后,结果见图7,转基因植株的生长状态显著优于野生型植株,转基因植株的存活率显著高于野生型植株,较野生型植株相比分别提高了417~513%和230~273%;表明过表达 OsMaspardin基因显著提高转基因水稻植株的耐盐性和抗旱性。
实施例6OsMaspardin基因转基因水稻植株抗逆生理生化指标的测定
1.脱落酸含量测定
(1)试验方法
脱落酸(ABA)在植物逆境胁迫反应中具有重要作用。ABA可以提高植物的耐盐性,缓解盐分过多造成的渗透胁迫和离子胁迫,维持水分平衡,诱导植物渗透调剂物质脯氨酸大量积累,维持细胞膜结构的稳定性,提高保护性酶的活性。旱害胁迫时,ABA能明显减少叶片水分蒸发,降低叶片细胞膜透性,增加叶片细胞可溶性蛋白质含量,诱导生物膜系统保护酶形成,降低膜脂过氧化程度,增强抗氧化能力,提高植物的抗旱性。因此,ABA可以作为植物抗逆性的一项生化指标。
测定方法参考文献【Shang Gao,Li Yuan,Hong Zhai,Chenglong Liu,ShaozhenHe,Qingchang Liu.Transgenic sweetpotato plants expressing an LOS5 gene aretolerant to salt stress.Plant Cell,Tissue and Organ Culture,2011,107:205-213】,检测水稻植株的ABA含量。水稻植株为空白对照中处理2w的水稻植株、盐胁迫 2w的水稻植株、干旱胁迫4w的水稻植株。实验需重复三次,结果取平均值。
(2)试验结果
水稻植株ABA含量测定实验结果见图8中A(Normal为空白对照,Salt stress 为盐胁迫,Drought stress为干旱胁迫)。结果表明,过表达水稻OE2植株、OE4 植株和OE7植株的ABA含量显著高于野生型水稻植株,干扰水稻Ri2植株和 Ri3植株的ABA含量显著低于野生型水稻植株。
2.脯氨酸含量测定
(1)试验方法
植物在正常条件下,游离脯氨酸含量很低,但遇到干旱、盐等胁迫时,游离的氨基酸便会大量积累,并且积累指数和植物的抗逆性有关。因此,脯氨酸可以作为植物抗逆性的一项生化指标。
测定方法参考文献【Feibing Wang,Weili Kong,Gary Wong,Lifeng Fu,RihePeng,Zhenjun Li,Quanhong Yao.AtMYB12 regulates flavonoids accumulation andabiotic stress tolerance in transgenic Arabidopsis thaliana.MolecularGenetics and Genomics,2016,291:1545-1559】,检测水稻植株的脯氨酸含量。水稻植株为空白对照中处理2w的水稻植株、盐胁迫2w的水稻植株、干旱胁迫4w的水稻植株。实验需重复三次,结果取平均值。
(2)试验结果
水稻植株脯氨酸含量测定实验结果见图8中B(Normal为空白对照,Salt stress为盐胁迫,Drought stress为干旱胁迫)。结果表明,转基因水稻OE2植株、 OE4植株和OE7植株的脯氨酸含量显著高于野生型水稻植株,干扰水稻Ri2植株和Ri3植株的脯氨酸含量显著低于野生型水稻植株。
3.H
(1)试验方法
植物在逆境下或衰老时,由于体内活性氧代谢加强而使H
测定方法参考文献【Feibing Wang,Weili Kong,Gary Wong,Lifeng Fu,RihePeng,Zhenjun Li,Quanhong Yao.AtMYB12 regulates flavonoids accumulation andabiotic stress tolerance in transgenic Arabidopsis thaliana.MolecularGenetics and Genomics,2016,291:1545-1559】,检测水稻植株的H
(2)试验结果
水稻植株H
4.MDA含量测定
(1)试验方法
植物器官衰老或在逆境下遭受伤害,往往发生膜脂过氧化作用,丙二醛 (MDA)是膜脂过氧化的最终分解产物,其含量可以反映植物遭受逆境伤害的程度,即MDA的含量越高,植物遭受逆境伤害的程度越大。
测定方法参考文献【Feibing Wang,Weili Kong,Gary Wong,Lifeng Fu,RihePeng,Zhenjun Li,Quanhong Yao.AtMYB12 regulates flavonoids accumulation andabiotic stress tolerance in transgenic Arabidopsis thaliana.MolecularGenetics and Genomics,2016,291:1545-1559】,检测水稻植株的MDA含量。水稻植株为空白对照中处理2w的水稻植株、盐胁迫2w的水稻植株、干旱胁迫4w的水稻植株。实验需重复三次,结果取平均值。
(2)试验结果
水稻植株MDA含量测定实验结果见图8中D(Normal为空白对照,Salt stress 为盐胁迫,Drought stress为干旱胁迫)。结果表明,转基因水稻OE2植株、OE4 植株和OE7植株的MDA含量显著低于野生型水稻植株,干扰水稻Ri2植株和 Ri3植株的MDA含量显著高于野生型水稻植株。
5.SOD活性测定
(1)试验方法
超氧化物歧化酶(SOD)活性可以作为植物抗逆性的一项生理生化指标。 SOD的活性越低,植物遭受逆境伤害的程度越大。
测定方法参考文献【Feibing Wang,Weili Kong,Gary Wong,Lifeng Fu,RihePeng,Zhenjun Li,Quanhong Yao.AtMYB12 regulates flavonoids accumulation andabiotic stress tolerance in transgenic Arabidopsis thaliana.MolecularGenetics and Genomics,2016,291:1545-1559】,检测水稻植株的SOD活性。水稻植株为空白对照中处理2w的水稻植株、盐胁迫2w的水稻植株、干旱胁迫4w的水稻植株。实验需重复三次,结果取平均值。
(2)试验结果
水稻植株SOD活性测定实验结果见图8中E(Normal为空白对照,Salt stress 为盐胁迫,Drought stress为干旱胁迫)。结果表明,转基因水稻OE2植株、OE4 植株和OE7植株的SOD活性显著高于野生型水稻植株,干扰水稻Ri2植株和 Ri3植株的SOD活性显著低于野生型水稻植株。
6.POD活性测定
(1)试验方法
过氧化物酶(POD)活性可以作为植物抗逆性的一项生理生化指标。POD 的活性越低,植物遭受逆境伤害的程度越大。
测定方法参考文献【Feibing Wang,Weili Kong,Gary Wong,Lifeng Fu,RihePeng,Zhenjun Li,Quanhong Yao.AtMYB12 regulates flavonoids accumulation andabiotic stress tolerance in transgenic Arabidopsis thaliana.MolecularGenetics and Genomics,2016,291:1545-1559】,检测水稻植株的POD活性。水稻植株为空白对照中处理2w的水稻植株、盐胁迫2w的水稻植株、干旱胁迫4w的水稻植株。实验需重复三次,结果取平均值。
(2)试验结果
水稻植株POD活性测定实验结果见图6中F(Normal为空白对照,Salt stress 为盐胁迫,Drought stress为干旱胁迫)。结果表明,转基因水稻OE2植株、OE4 植株和OE7植株的POD活性显著高于野生型水稻植株,干扰水稻Ri2植株和 Ri3植株的POD活性显著低于野生型水稻植株。
生理生化指标的测定结果表明,过表达OsMaspardin基因显著提高转基因水稻植株的耐盐性和抗旱性,干扰表达OsMaspardin基因显著降低转基因水稻植株的耐盐性和抗旱性。
附:本发明所涉及到的核苷酸序列表:
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
序列表
<120> 蛋白质OsMaspardin及其编码基因与应用
<160> 2
<170> SIPOSequenceListing 1.0
<210> 1
<211> 1164
<212> DNA
<213> 序列1(2 Ambystoma laterale x Ambystoma jeffersonianum)
<400> 1
atgaagggcg gcgggggcgc ggcggcggcg tcggcggcgc cgggggacta cgtctacttc 60
aagtccgtcg tcccgctcca caagatctcg attggaccga aattatggag gtactatgat 120
tttggaccaa agactgttcc acctcttgtc tgcatcccag gaattgcagg aacggctgat 180
gtgtactaca aacagatcat gtctctctct atgaagggtt atcgagtgat gtcaattgat 240
gttcctcaag tttggaatca ccaggaatgg attcattcat ttgaaaaatt tttggactcc 300
atgaatatcc atcatgttca tatttatggt acatctcttg gtggatttct tgcacaaata 360
tttgctcaac accgtccaag gagagtaaag tccttggtcc tatcaaatac ttttcttgag 420
acacataagt ttgctgctgc tacgccatgg tctcctgttg ttaattggac cccttctttt 480
ttgctgaagc ggtacctatt gacaggaatc cgagatggcc cccatgaacc gtttattgca 540
gactcagtgg attttgttgt gagtcaggtt gagacgctgt caagagatga tctctcatca 600
aggttgatgt taaatgttaa tgttgcatca gttggatcat taatgctacc tgattcactc 660
atcactataa tggatacaaa cgactattcc gctgttcctc agcagttaaa ggaccaagtg 720
aatgaaaggt acccaggtgc aaggcgtgca gtactaaaga cgggtggtga tttccccttc 780
ctgtcacgtc ctgatgaggt taatttgtac cttcagctac atttgagacg agttggagta 840
gaacctagac cagatctggt ccaaggtttc acacgtaatg gcagtgctgg gagctcaaag 900
gaccaaaaag atggtggaaa caattttgac aatcatcctg gagataatgg tggccctggt 960
tcagggggtc atgatcatga gacacagaat tctggatcag aatcacatga ttctgatgaa 1020
tcaataccaa cgagcacaat gcttgccaat accattctag gtacggttag ctcaaccctg 1080
caagcttcac tatgtgtgct cttgatacat cattactatg agtctgcttt gtatatttcg 1140
tcgagacagc cattggatgt atga 1164
<210> 2
<211> 387
<212> PRT
<213> 序列2(2 Ambystoma laterale x Ambystoma jeffersonianum)
<400> 2
Met Lys Gly Gly Gly Gly Ala Ala Ala Ala Ser Ala Ala Pro Gly Asp
1 5 10 15
Tyr Val Tyr Phe Lys Ser Val Val Pro Leu His Lys Ile Ser Ile Gly
20 25 30
Pro Lys Leu Trp Arg Tyr Tyr Asp Phe Gly Pro Lys Thr Val Pro Pro
35 40 45
Leu Val Cys Ile Pro Gly Ile Ala Gly Thr Ala Asp Val Tyr Tyr Lys
50 55 60
Gln Ile Met Ser Leu Ser Met Lys Gly Tyr Arg Val Met Ser Ile Asp
65 70 75 80
Val Pro Gln Val Trp Asn His Gln Glu Trp Ile His Ser Phe Glu Lys
85 90 95
Phe Leu Asp Ser Met Asn Ile His His Val His Ile Tyr Gly Thr Ser
100 105 110
Leu Gly Gly Phe Leu Ala Gln Ile Phe Ala Gln His Arg Pro Arg Arg
115 120 125
Val Lys Ser Leu Val Leu Ser Asn Thr Phe Leu Glu Thr His Lys Phe
130 135 140
Ala Ala Ala Thr Pro Trp Ser Pro Val Val Asn Trp Thr Pro Ser Phe
145 150 155 160
Leu Leu Lys Arg Tyr Leu Leu Thr Gly Ile Arg Asp Gly Pro His Glu
165 170 175
Pro Phe Ile Ala Asp Ser Val Asp Phe Val Val Ser Gln Val Glu Thr
180 185 190
Leu Ser Arg Asp Asp Leu Ser Ser Arg Leu Met Leu Asn Val Asn Val
195 200 205
Ala Ser Val Gly Ser Leu Met Leu Pro Asp Ser Leu Ile Thr Ile Met
210 215 220
Asp Thr Asn Asp Tyr Ser Ala Val Pro Gln Gln Leu Lys Asp Gln Val
225 230 235 240
Asn Glu Arg Tyr Pro Gly Ala Arg Arg Ala Val Leu Lys Thr Gly Gly
245 250 255
Asp Phe Pro Phe Leu Ser Arg Pro Asp Glu Val Asn Leu Tyr Leu Gln
260 265 270
Leu His Leu Arg Arg Val Gly Val Glu Pro Arg Pro Asp Leu Val Gln
275 280 285
Gly Phe Thr Arg Asn Gly Ser Ala Gly Ser Ser Lys Asp Gln Lys Asp
290 295 300
Gly Gly Asn Asn Phe Asp Asn His Pro Gly Asp Asn Gly Gly Pro Gly
305 310 315 320
Ser Gly Gly His Asp His Glu Thr Gln Asn Ser Gly Ser Glu Ser His
325 330 335
Asp Ser Asp Glu Ser Ile Pro Thr Ser Thr Met Leu Ala Asn Thr Ile
340 345 350
Leu Gly Thr Val Ser Ser Thr Leu Gln Ala Ser Leu Cys Val Leu Leu
355 360 365
Ile His His Tyr Tyr Glu Ser Ala Leu Tyr Ile Ser Ser Arg Gln Pro
370 375 380
Leu Asp Val
385
- 蛋白质OsMaspardin及其编码基因与应用
- 一种蛋白质因子RRF编码基因及其在N-乙酰氨基葡萄糖生产中的应用
