一种黄梁木四倍体诱导方法
文献发布时间:2023-06-19 13:46:35
技术领域
本发明涉及生物技术领域,具体地,涉及一种黄梁木四倍体诱导方法。
背景技术
黄梁木(Neolamarckia cadamba)别名团花,隶属茜草科(Rubiaceae)团花属(Neolamarckia)。黄梁木富含类固醇、生物碱、皂苷、β~谷甾醇、类黄酮、卡丹宾、金鸡宁及其衍生物质等多种活性成分,具有潜在的医学价值(抗炎、抗疟疾寄生虫、治疗糖尿病、降低血糖和血脂等);同时,黄梁木树叶富含粗蛋白、粗脂肪、粗纤维和微量元素,是一种优质的植物饲料原料。黄梁木自然分布于南亚、东南亚热带地区和我国南亚热带。从黄梁木的分布特性可以看出黄梁木喜高温高湿,只能种植于气候温暖,雨量充足,湿度大的地区,对低温的耐受性差。
多倍体育种是一种常见的育种手段。多倍体植物是指体内含有3套或3套以上染色体组的植物,一般来源分为两种,即自然产生和人工诱导。植株染色体经诱导加倍后,由于基因的互作效应和基因的剂量效应,植株细胞生理平衡被打破,与二倍体相比较,多倍体会表现出“巨大性”,根、茎、叶等营养器官的生物量会显著增加;多倍体植物抵抗胁迫能力及活性成分含量都可能会有所提高。因此,如能诱导获得黄梁木多倍体,则可以培育优质黄梁木多倍体品种,改良黄梁木的品质,提高其对环境的适应能力,满足对黄梁木种质资源的需求。
发明内容
为了克服现有技术中存在的缺点和不足,本发明的目的在于提供一种黄梁木四倍体诱导方法。
本发明的目的通过下述技术方案实现:
一种黄梁木四倍体诱导方法,包括如下步骤:
S1.下胚轴外植体预培养:切取无菌黄梁木种子苗下胚轴作为外植体,接种在第一愈伤诱导固体培养基上进行预培养;
S2.四倍体诱导培养:将经预培养后的下胚轴外植体接种到含秋水仙素的愈伤诱导液体培养基中进行暗培养,所述秋水仙素浓度为100mg/L时,暗培养时间为2~4d,所述秋水仙素浓度大于100mg/L且小于等于400mg/L时,暗培养时间为1~4d;
S3.组培幼苗:将步骤S2中经暗培养后的下胚轴外植体接种于第二愈伤诱导固体培养基中进行愈伤组织诱导后,转移至促芽培养基,诱导形成不定芽,待不定芽长至2cm后,切取不定芽接种于第一生根培养基进行生根诱导得到黄梁木再生植株;
S4.倍性鉴定:待步骤S3中的黄梁木再生植株形成的再生根长至0.5~1cm时,取再生根的根尖进行染色体计数,鉴定根尖染色体的倍数;再将鉴定为四倍体的黄梁木再生植株的叶片进行流式细胞仪检测以确定倍性。
优选地,步骤S2中所述秋水仙素浓度为200mg/L、300mg/L、400mg/L,暗培养时间为1~4d。
更为优选地,步骤S2中所述秋水仙素浓度为300mg/L,所述暗培养时间为3d。
优选地,步骤S2中所述的暗培养条件:所述暗培养条件为:在摇床上恒温26℃以转速90~150rpm进行培养。
优选地,在步骤S1中所述预培养时间为3d;在步骤S3中所述培养时间为35d。
优选地,所述第一愈伤诱导固体培养基和第二愈伤诱导固体培养基均为:MS+3.0mg/L TDZ+0.1mg/L 2,4-D+0.05mg/L NAA+30g/L蔗糖+5.0g/L琼脂,pH为5.8~6.0;所述愈伤诱导液体培养基为:MS+3.0mg/L TDZ+0.1mg/L2,4-D+0.05mg/L NAA+30g/L蔗糖,pH为5.8~6.0;所述促芽培养基为:MS+1.5mg/L 6-BA+0.05mg/L NAA+30g/L蔗糖+5.0g/L琼脂,pH为5.8~6.0;所述第一生根培养基为MS+0.1mg/L NAA+30g/L蔗糖+5.0g/L琼脂,pH 5.8~6.0。
优选地,上述黄梁木四倍体诱导方法还包括如下步骤:
S5.黄梁木四倍体扩繁:将步骤S4中确定为四倍体的黄梁木再生植株的茎节接种至增殖培养基中进行黄梁木四倍体扩繁,得到黄梁木四倍体不定芽;
S6.黄梁木四倍体生根及炼苗移栽:将步骤S5中扩繁得到的黄梁木四倍体不定芽接种于第二生根培养基中进行生根诱导,得到组培苗,将所述组培苗连带组培瓶移至室外进行炼苗,炼苗5d后打开组培瓶瓶盖再炼苗5d,然后将组培苗根部上的琼脂洗去,种植到装有以体积比3:1混合的泥炭土和蛭石的苗盆中。
优选地,所述增殖培养基为:MS+1.0mg/L 6-BA+0.05mg/L IBA+30g/L蔗糖+5.0g/L琼脂,pH 5.8~6.0,所述第二生根培养基为:MS+0.1mg/L NAA+30g/L蔗糖+5.0g/L琼脂,pH5.8~6.0。
优选地,步骤S1中所述的预培养条件,步骤S3中所述的愈伤组织诱导、诱导形成不定芽和生根诱导条件,以及步骤S5中所述的扩繁条件均为:温度为26℃,光照强度为2000lx,光照时间为12h/d。
优选地,步骤S1中所述无菌黄梁木种子苗下胚轴外植体的制备方法如下:
在超净工作台内,将提前一天用蒸馏水浸泡过的种子用75%酒精浸泡1min,无菌水振荡清洗3~5次,接着用33.3%次氯酸钠灭菌5min,再用无菌水振荡清洗3~5次,然后用无菌枪头吸取种子播种于不含激素的MS固体培养基中,并用无菌枪头吸水将种子分散均匀,再吸去多余的水,置于培养架,待种子生长出1~2对真叶后切取种子苗下胚轴,得到无菌黄梁木种子苗下胚轴外植体。
优选地,步骤S2中含秋水仙素的愈伤诱导液体培养基的制备方法为:将秋水仙素采用0.25μm滤头抽滤灭菌,再将愈伤诱导液体培养基进行高温高压灭菌,待温度降至50~60℃时,在愈伤诱导液体培养基中加入经过滤灭菌的秋水仙素,得到含秋水仙素的愈伤诱导液体培养基。
本发明所述的MS是指MS标准培养基;TDZ是指N-苯基-N'-(1,2,3-噻二唑-5-基)脲;2,4-D是指2,4-二氯苯氧乙酸;6-BA是指6-苄氨基腺嘌呤;NAA是指奈乙酸;IBA是指吲哚丁酸。
与现有技术相比,本发明的有益效果在于:
1、本发明的黄梁木四倍体诱导方法,以无菌黄梁木种子苗下胚轴作为外植体材料,通过先对下胚轴外植体进行预培养,再用含秋水仙素的愈伤诱导液体培养基处理外植体,再进行外植体进行愈伤诱导、促芽和生根培养等步骤,建立了黄梁木四倍体诱导体系。
2、本发明通过大量的实验发现,当秋水仙素浓度为300mg/L,处理时间为3d时,黄梁木四倍体诱导率高达23.37%,具有显著的优势。
附图说明
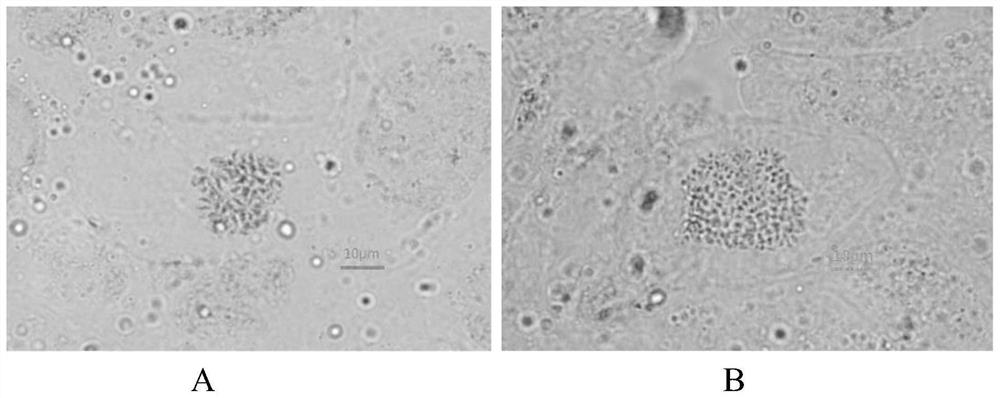
图1是二倍体黄梁木根尖染色体图(A)和四倍体黄梁木根尖染色体图(B);
图2是二倍体黄梁木流式细胞仪检测图(A)和四倍体黄梁木(B)流式细胞仪检测图;
图3是二倍体黄梁木气孔(A)和四倍体(B)黄梁木气孔;
图4是二倍体黄梁木组培苗叶片(A)和四倍体黄梁木组培苗叶片(B);
图5是二倍体黄梁木组培苗(A)和四倍体黄梁木组培苗(B);
图6是二倍体黄梁木移栽苗(A)和四倍体黄梁木移栽苗(B);
图7是二倍体黄梁木移栽苗(A)和四倍体黄梁木移栽苗(B)。
具体实施方式
为了使本技术领域人员更好理解本发明方案,下面对本发明进行更全面的描述。
下面结合实施例对本发明作进一步详细描述,但本发明的实施方式不限于此。除非特别说明,本发明采用的试剂、方法和设备为本技术领域常规试剂、方法和设备。另外,关于本说明书中的“份”、“%”,除非特别说明,分别表示“质量份”、“质量%”。
下述方法中所用种子取自华南农业大学田家炳运动场附近种植多年的单株黄梁木。
实施例1
一种黄梁木四倍体诱导方法,包括如下步骤:
1.无菌黄梁木种子苗下胚轴外植体的制备:
在超净工作台内,将提前一天用蒸馏水浸泡过的种子用75%酒精浸泡约1min,无菌水振荡清洗3~5次,接着用33.3%次氯酸钠灭菌5min(此过程黄梁木种子由红褐色变为淡黄色),再用无菌水振荡清洗3~5次,然后用无菌枪头吸取种子播种于不含激素的MS固体培养基,并用无菌枪头吸水将种子分散均匀,再吸去多余的水,放置于培养架,待种子生长出1~2对真叶(约35d)后切取种子苗下胚轴,得到无菌黄梁木种子苗下胚轴外植体。
2.培养基的制备:
2.1MS固体培养基:将MS培养基用0.50%琼脂固化,然后在121℃,0.1Mpa条件下灭菌20min得到MS固体培养基;
2.2按照如下比例分别配制各培养基:
a.第一愈伤诱导固体培养基和第二愈伤诱导固体培养基:MS固体培养基+3.0mg/LTDZ+0.1mg/L 2,4-D+0.05mg/L NAA+30g/L蔗糖;
b.愈伤诱导液体培养基:MS液体培养基+3.0mg/L TDZ+0.1mg/L 2,4-D+0.05mg/LNAA+30g/L蔗糖;
c.促芽培养基:MS固体培养基+1.5mg/L 6-BA+0.05mg/L NAA+30g/L蔗糖;
d.第一生根培养基和第二生根培养基:MS固体培养基+0.1mg/L NAA+30g/L蔗糖;
e.增殖培养基:MS固体培养基+1.0mg/L 6-BA+0.05mg/L IBA+30g/L蔗糖;
使用1mol/L NaOH或者1mol/L HCl分别将上述培养基的pH调节至5.8~6.0;
2.3含秋水仙素的愈伤诱导液体培养基:将秋水仙素采用0.25μm滤头抽滤灭菌,再将愈伤诱导液体培养基进行高温高压灭菌,待温度降至50~60℃时,在愈伤诱导液体培养基中加入经过滤灭菌的秋水仙素,得到含秋水仙素的愈伤诱导液体培养基;
2.4将上述各培养基分别装入到组培瓶内,所用组培瓶容积为220mL的透明玻璃瓶,每瓶装入30mL的培养基;
3.黄梁木四倍体的诱导:
3.1下胚轴外植体预培养:将切取的无菌黄梁木种子苗下胚轴外植体置于第一愈伤诱导固体培养基上预培养3d;预培养条件为:温度为26℃,光照强度为2000lx,光照时间为12h/d,相对湿度为60%。
3.2四倍体诱导培养:将步骤3.1中预培养后的下胚轴外植体转移至含有浓度为100mg/L秋水仙素的愈伤诱导液体培养基,分别进行暗培养1d、2d、3d和4d,暗培养条件为:在摇床上恒温26℃以转速90~150rpm进行培养。
3.3组培幼苗:将步骤3.2中经暗培养后的下胚轴外植体从含有秋水仙素的愈伤诱导液体培养基中取出,并用无菌水清洗2-3次,清洗后,用无菌滤纸吸干下胚轴外植体表面的水分,接种于第二愈伤诱导固体培养基中培养35d,使愈伤组织长至合适大小,然后转移至促芽培养基,诱导至形成不定芽;待不定芽生长至2cm左右时,将不定芽切下接种于第一生根培养基进行生根诱导得到再生植株。诱导不定芽和生根诱导的条件同预培养。
4.倍性鉴定
4.1染色体观察:待再生植株形成的再生根生长至0.5~1cm左右时,在上午9:30-10:30时取下再生根的根尖,放入到装有蒸馏水并用冰预冷处理过的离心管内,然后置于冰上预处理6~12h。将预处理后的根尖转移至卡诺氏固定液(无水乙醇:冰醋酸=3:1),放入4℃冰箱中固定12~36h。固定好的根尖若不立即使用需依次用90%、80%和70%的乙醇溶液醇洗,最后保存至70%乙醇溶液中,遮光置于4℃冰箱备用。
采用常规染色体压片法进行染色体压片,具体步骤如下:将用卡诺氏固定液固定后的根尖用流水冲洗15~20min,再将根尖转移至l mol/L的HC1中,在60℃下解离6~9min。解离后的根尖用流水冲洗15~20min后,将根尖转移至装有改良卡宝品红染液的离心管中染色15min,然后在载玻片上用刀片切取染色后的根尖顶端,盖上盖玻片,手指轻敲3~5下,置于显微镜下观察根尖染色体形态及数目并拍照。
4.2流式细胞仪检测黄梁木倍性:将经染色体计数鉴定为四倍体的再生植株的叶片进行流式细胞仪检测以确定倍性。
5.再生植株
5.1黄梁木四倍体扩繁:将鉴定为四倍体的黄梁木再生植株的茎节接种至增殖培养基中进行黄梁木四倍体扩繁,得到黄梁木四倍体不定芽,扩繁条件同预培养;
5.2黄梁木四倍体生根及炼苗移栽:将步骤5.1中扩繁得到的黄梁木四倍体不定芽接种于第二生根培养基中进行生根诱导,待形成的再生根生长至须根细长,稍带绿色时得到四倍体组培苗(此过程大约需要35d),将该四倍体组培苗连带组培瓶移至室外进行炼苗,炼苗5d后打开组培瓶瓶盖再炼苗5d,然后洗去四倍体组培苗根部上的琼脂,种植到装有以体积比3:1混合的泥炭土和蛭石的苗盆中,得到四倍体移栽苗。其中,组培瓶为常规组培生产所用玻璃瓶,苗盆为直径约20cm塑料盆。
实施例2
本实施例与实施例1的区别在于:秋水仙素的浓度为200mg/L。
实施例3
本实施例与实施例1的区别在于:秋水仙素的浓度为300mg/L。
实施例4
本实施例与实施例1的区别在于:秋水仙素的浓度为400mg/L。
对照组
以不加秋水仙素得到黄梁木二倍体组培苗和黄梁木二倍体移栽苗作为对照。
实施例5
根据上述实施例1-实施例4的黄梁木四倍体诱导方法进行黄梁木四倍体诱导培养,分别统计外植体再生率、外植体平均产芽量和四倍体诱导率,其结果如表1所示:
表1
说明:1、表1中每一列数值之后相同的字母表示在邓肯多重实验中差异不显著(P<0.05)。
2、表1中各项计算公式为:
外植体再生率=(出芽外植体数/处理的外植体总数)*100%;
外植体平均产芽量=总出芽数/处理的外植体总数;
四倍体诱导率=(四倍体芽数/鉴定的总芽数)*100%。
由表1可以看到,在黄梁木四倍体的诱导过程中,秋水仙素的加入量和诱导时间对外植体再生率、外植体平均产芽量和四倍体诱导率均具有较大的影响。当秋水仙素浓度相同时外植体再生率和外植体平均产芽量与处理时间呈现负相关,秋水仙素对外植体的处理时间越长,对外植体的出芽越不利。当用量在一定范围内,处理时间越长,四倍体诱导率越高,但是超过一定范围后,四倍体诱导率会随着处理时间的延长而降低,这是当浓度较高时,当处理时间加长,对外植体伤害过大,从而影响了四倍体的诱导率。而秋水仙素的浓度在一定范围内,四倍体的诱导率会随着秋水仙素的增加而增加,但是当秋水仙素的浓度超过一定范围,秋水仙素的浓度越高,四倍体的诱导率越低。本发明经过大量的实验,得到了最佳的秋水仙浓度为300mg/L,以及最佳的处理时间为3d,秋水仙浓度为300mg/L,处理时间为3d时,外植体的四倍体诱导率可达23.37%。
实施例6黄梁木四倍体和黄梁木二倍体的特征比较
1、解剖学比较
在上午9:00-10:00,在由实施例1-实施例4的黄梁木四倍体诱导方法得到的黄梁木四倍体组培苗和由对照组得到的同一批次的黄梁木二倍体组培苗中随机选取长势良好苗龄相同的叶片,分别将黄梁木四倍体组培苗叶片和的黄梁木二倍体组培苗叶片的叶背朝上置于干燥滤纸上,用尖头镊子夹住叶片,然后顺时针旋转约45°,快速撕拉叶片,使表皮细胞与叶肉细胞分离,滴一滴蒸馏水于载玻片,将撕下的表皮均匀展开,然后用吸水纸吸干水分盖上盖玻片,使用Nikon DS-Ri2显微镜观察测量及统计,从叶片气孔长度、气孔宽度、气孔密度、保卫细胞本叶绿体含量四个解剖学指标进行比较,其结果如表2所示。
表2
由表2可以看到,与黄梁木二倍体组培苗叶片相比,黄梁木四倍体组培苗叶片气孔密度降低,气孔长度和气孔宽度大幅增加,保卫细胞叶绿体数也大幅增加,说明黄梁木四倍体组培苗光合作用强于黄梁木二倍体组培苗。同时由图3所示,黄梁木四倍体组培苗叶片气孔明显大于黄梁木二倍体组培苗叶片气孔。
2、形态比较
由图4-图7所示,本发明得到的黄梁木四倍体组培苗及其移栽苗生长健壮,与二倍体组培苗及其移栽苗相比,黄梁木四倍体组培苗及其移栽苗茎直径、叶长和叶宽均加大,叶片颜色加深。
3、根尖染色体和DNA含量比较
由图1和图2所示,黄梁木四倍体的根尖染色体数量是黄梁木二倍体的2倍,黄梁木四倍体的DNA相对含量在26000左右,而黄梁木二倍体的DNA含量在13000左右,四倍体的DNA含量为二倍体DNA含量的2倍。
上述实施例为本发明较佳的实现方案,除此之外,本发明还可以其它方式实现,在不脱离本发明构思的前提下任何显而易见的替换均在本发明的保护范围之内。
