一种低酸性组分含量的重组抗EGFR单克隆抗体
文献发布时间:2023-06-19 19:30:30
技术领域
本发明属于医药领域,具体涉及一种低酸性组分含量的重组抗EGFR单克隆抗体。
背景技术
单克隆抗体(monoclonal antibody,mAb)是由单一B细胞克隆产生的具有高度均一、仅针对某一特定抗原表位的抗体,具有特异靶向性,适应症主要集中在肿瘤、自身免疫性疾病、感染性疾病等方面。自1997年全球第一个治疗性单克隆抗体Rituxin由FDA批准上市以来,单克隆抗体迅速在全球的生物医药领域迅猛发展,成为近年来研究热点之一。
表皮生长因子受体(epidermal growth factor receptor,EGFR)是一种跨膜糖蛋白,在实体瘤中呈现高表达。EGFR表达阳性的肿瘤具有恶性度高、侵袭力强的特点,且EGFR表达水平的高低与预后相关,因而成为当前肿瘤分子靶向治疗的一个重要靶点。以EGFR为靶标的单克隆抗体药物,能与内源性配体竞争结合EGFR,通过抑制酪氨酸激酶的激活、促进EGFR内化等作用产生抗肿瘤效应。
目前国内外已有3种抗EGFR单克隆抗体上市,与其他化疗药相比,具有靶点明确、疗效显著、毒副作用低等特点,在临床上取得了较好的疗效。微生物发酵是制备抗EGFR单克隆抗体的主要方法。最早上市的抗EGFR单克隆抗体是2004年被美国FDA批准的西妥昔单抗(Erbitux),它是一种重组的抗EGFR人鼠嵌合单克隆抗体,用于治疗转移性结肠癌。但是,在发酵过程中除了会表达抗EGFR单克隆抗体外,还伴随有大量的杂质产生,包括宿主细胞蛋白质(HCP)、宿主细胞DNA和培养基成分等。HCP可在低的百万分率(parts per million)水平下引起免疫应答,是一种重要的污染物。研究发现,哺乳动物细胞对由剪切应力引起的破坏敏感,这会导致杂质(例如HCP)的释放,影响产品稳定性和纯度。
另外,蛋白具有许多翻译后修饰,如末端的改变、糖基化、脱酰氨基作用、异构化、氧化、分裂、聚合等。几乎所有的这些修饰都会引起蛋白表面电荷的改变,如改变电荷基团数目或引起构象改变,形成电荷异质体。由于电荷异质体会影响药物的疗效和/或导致副作用,故需将其控制在可接受范围内。电荷异质体通常可以通过基于电荷的纯化方法分离成酸性峰,主峰和碱性峰,其中酸性峰的来源可分为以下几个方面:N位糖基化、C末端赖氨酸不均一性、氨基酸氧化、天冬酰胺脱酰胺化及天冬氨酸异构化、共价加合物和N末端谷氨酰胺及谷氨酸环化等。研究发现,酸性异质体对抗体的药效具有更大的不利影响,尤其是对于互补决定区(CDR)的修饰,比如曲妥珠单抗的酸性电荷异质性与HER2的亲和力明显下降,抗增殖作用减弱。单克隆抗体在表达过程中,经过多种翻译修饰之后,也会导致电荷异质性,体现在等电点不同,产生一系列不同等电点的抗体。电荷异质性会影响单克隆抗体的稳定性及生物学活性,因此在生产抗EGFR单克隆抗体时,降低产物中酸性异质体的含量具有重要意义。
申请号为201910035469.1的中国专利申请公开了一种抗EGFR全人源化单克隆抗体的纯化工艺,具体为将vectibix抗体细胞培养液依次进行以下处理:两级深层过滤澄清、亲和层析、低pH孵育病毒灭活、阴离子交换层析、阳离子交换层析、浓缩透析。其阳离子交换层析步骤中,所用填料Poros XS,层析柱2.6×25.4cm,CV 135mL,对层析系统进行消毒和平衡后上样,流速250cm/h,DBC≤65mg/mL填料,保留时间≥5min,淋洗所用平衡液:50mM Na-Acetate,pH值5.0,淋洗后洗脱,洗脱平衡液:50mM Na-Acetate,140mM NaCl,pH值5.0,收集UV280:150-150mAU/mm。该纯化工艺的纯化收率≥70%,纯化后原液纯度≥95%。但是,该纯化工艺无法将酸性峰和主峰及碱性峰分开,无法有效除去产物中的酸性异质体,会影响抗EGFR全人源化单克隆抗体的安全性及生物学活性。
为了克服上述问题,亟需开发出具有低酸性异质体含量的重组抗EGFR单克隆抗体。
发明内容
本发明的目的在于提供一种低酸性组分含量的重组抗EGFR单克隆抗体。
本发明提供了一种重组抗EGFR单克隆抗体,所述重组抗EGFR单克隆抗体中,酸性组分的含量为6%以下。
进一步地,所述重组抗EGFR单克隆抗体中,酸性组分的含量为5.3%-5.7%。
进一步地,所述重组抗EGFR单克隆抗体中,DNA残留水平为0.013pg/mg以下,优选为0.012-0.013pg/mg;
进一步地,所述重组抗EGFR单克隆抗体的纯度为99.6%以上,优选为99.6%-99.8%。
进一步地,所述重组抗EGFR单克隆抗体对结直肠癌细胞的抑制活性为标准品Erbitux的103%以上,优选为标准品Erbitux的103.4%-105.1%。
本发明中,将在HPLC-CEX上的保留时间小于10min的组分定义为酸性组分,保留时间为10min-18min的组分定义为主成分,保留时间大于18min的组分定义为碱性组分。
进一步地,所述重组抗EGFR单克隆抗体的制备方法包括以下步骤:
(1)将表达重组抗EGFR单克隆抗体的细胞发酵培养,收集发酵液,过滤或离心,收集清液;
(2)将步骤(1)所得滤液进行亲和层析,收集洗脱液;
(3)将步骤(2)所得洗脱液进行低pH孵育,过滤,收集滤液;
(4)将步骤(3)所得滤液进行阳离子交换层析,收集洗脱液;所述阳离子交换层析采用的洗脱液为由A相和B相组成的梯度洗脱液,其中B相的体积分数为5%-65%;A相为含10-40mM磷酸盐的溶液,pH值为5.5-6.2;B相为含10-40mM磷酸盐和0.05-0.2M氯化钠的溶液,pH值为5.5-6.2。
进一步地,步骤(1)中,所述细胞为CHO细胞;和/或,所述过滤为深层过滤。
进一步地,步骤(2)中,所述亲和层析中,填料为Protein A、MabSelect、Prosep、POROS或TOSOH,所述Protein A优选为AF-rProtein A,更优选为AF-rProtein A Hc-650F;
所述亲和层析包括以下步骤:
(2.1)淋洗:依次用淋洗液1和淋洗液2淋洗亲和层析柱,淋洗液1为含0.05-0.2M柠檬酸和0.25-1.0M氯化钠的溶液,pH为5.5-6.2;淋洗液2为0.02-0.10M醋酸钠溶液,pH为5.5-6.2;
优选地,淋洗液1为含0.1M柠檬酸和0.5M氯化钠的溶液,pH为6.0;淋洗液2为0.05M醋酸钠溶液,pH为6.0;
(2.2)洗脱:用洗脱液进行洗脱,洗脱液为含0.05-0.2M甘氨酸和0.01-0.04M氯化钠的溶液,pH为2.8-3.2;
优选地,洗脱液为含0.1M甘氨酸和0.02M氯化钠的溶液,pH为3.0±0.1;
(2.3)收集:收集洗脱液。
进一步地,步骤(3)中,所述低pH孵育的温度为20-25℃,时间为1.5h以上,pH值为3.2-3.6。
进一步地,步骤(4)中,所述阳离子交换层析包括以下步骤:
(4.1)前平衡:用平衡液冲洗阳离子交换层析柱;所述平衡液为含10-40mM磷酸盐的溶液,pH值为5.5-6.2;
(4.2)上样:将步骤(3)所得滤液的pH调节至5.5-6.2,上样;
(4.3)后平衡:用平衡液冲洗阳离子交换层析柱;
(4.4)淋洗:用淋洗液淋洗阳离子交换层析柱;淋洗液由A相和B相组成,其中B相的体积分数为4%-6%;
(4.5)洗脱:用洗脱液进行梯度洗脱;
(4.6)收集:收集洗脱液,在UV280值升至0.1AU时开始收集,在UV280值降至0.1AU时结束收集。
进一步地,所述阳离子交换层析中,填料为Nuvia HR-S、Eshmuno CPX、POROS XS或Capto SP ImpRes,优选为Nuvia HR-S;
所述平衡液为含20mM磷酸盐的溶液,pH值为6.0±0.1;所述淋洗液由A相和B相组成,其中B相的体积分数为5%;所述A相为含20mM磷酸盐的溶液,pH值为6.0±0.1;所述B相为含20mM磷酸盐和0.1M氯化钠的溶液,pH值为6.0±0.1;
步骤(4.2)中,所述滤液的pH调节至6.0±0.1;上样的载量小于等于33.8mg/ml;
步骤(4.6)中,收集洗脱液时,在UV280值升至0.1AU之后的第5个柱体积开始收集,在UV280值降至0.1AU时结束收集。
进一步地,所述纯化方法还包括以下步骤:
(5)将步骤(4)所得洗脱液进行阴离子交换层析,收集洗脱液;所述阴离子交换层析采用的填料为GigaCap Q-650M。
进一步地,所述阴离子交换层析包括以下步骤:
(5.1)前平衡:用平衡液冲洗阴离子交换层析柱;所述平衡液为含20mM磷酸盐和48mM氯化钠的溶液,pH值为5.5-6.5;
优选地,所述平衡液为含20mM磷酸盐和48mM氯化钠的溶液,pH值为6.0;
(5.2)上样:将步骤(4)所得洗脱液上样;
(5.3)后平衡:用平衡液冲洗阴离子交换层析柱;
(5.4)洗脱:用洗脱液进行洗脱,洗脱液为含20mM磷酸盐和48mM氯化钠的溶液,pH值为5.5-6.5;
优选地,所述洗脱液为含20mM磷酸盐和48mM氯化钠的溶液,pH值为6.0;
(5.5)收集:收集洗脱液,在UV280值升至0.2AU时开始收集,在UV280值降至0.2AU时结束收集。
进一步地,所述纯化方法还包括以下步骤:
(6)将步骤(5)所得洗脱液进行超滤,除病毒,加入辅料,除菌,得到重组抗EGFR单克隆抗体原液。
进一步地,所述重组抗EGFR单克隆抗体的重链如SEQ ID NO:1所示,轻链如SEQ IDNO:2所示。
关于本发明的使用术语的定义:除非另有定义,否则本文中所用的全部技术术语和科学术语均具有如本发明所属领域普通技术人员通常理解的相同含义。
如本文所用,术语“含有”或“包括(包含)”可以是开放式、半封闭式和封闭式的。换言之,所述术语也包括“基本上由…构成”、或“由…构成”。
如本文所用,术语“室温”或“常温”是指温度为4-40℃,较佳地,25±5℃。如未特别说明,操作温度可以为室温。
如本文所用,术语“重组抗EGFR单克隆抗体”或“重组抗EGFR人鼠嵌合单克隆抗体”可互换使用,指具有重链为SEQ ID NO:1和轻链为SEQ ID NO:2所示氨基酸序列的抗体。
术语“CHO细胞”指中国仓鼠卵巢细胞。
术语“PB”指磷酸盐。
术语“CV”指柱体积。
术语“UV280值”指表示紫外波长为280nm处的吸光度值。
本发明提供的重组抗EGFR单克隆抗体具有以下有益效果:
1、本发明首次发现,通过本发明的阳离子交换层析能够有效去除重组抗EGFR单克隆抗体中生物活性低的酸性组分,使重组抗EGFR单克隆抗体中的HPLC-CEX酸性峰含量小于6%且能保证蛋白收率在87.9%以上,解决了现有技术中酸峰去除效果差的问题。本发明纯化后的重组抗EGFR单克隆抗体中生物活性低的HPLC-CEX酸性峰含量低,不仅有利于提高重组抗EGFR单克隆抗体的纯度,还有利于提高重组抗EGFR单克隆抗体的生物活性,且其安全性优于同类的市售西妥昔单抗。
2、本发明提供的重组抗EGFR单克隆抗体中未检出DNA的残留,远远优于小于0.16pg/mg(100pg/dose)的质量标准。
3、本发明提供的重组抗EGFR单克隆抗体原液的纯度高达99.6%以上。
4、与按照申请号为201910035469.1的中国专利申请记载的纯化方法制得的重组抗EGFR单克隆抗体原液相比,本发明纯化方法所得重组抗EGFR单克隆抗体原液的酸性峰含量明显降低,DNA残留水平明显降低,纯度明显提高,生物学活性和安全性明显提高。
本发明提供了一种从表达重组抗EGFR单克隆抗体的细胞发酵液中纯化重组抗EGFR单克隆抗体的方法,并提供了经该方法纯化后得到的重组抗EGFR单克隆抗体。该重组抗EGFR单克隆抗体中酸性组分含量低,DNA的残留水平低,纯度高,生物活性高,安全性好,应用前景广阔。
显然,根据本发明的上述内容,按照本领域的普通技术知识和惯用手段,在不脱离本发明上述基本技术思想前提下,还可以做出其它多种形式的修改、替换或变更。
以下通过实施例形式的具体实施方式,对本发明的上述内容再作进一步的详细说明。但不应将此理解为本发明上述主题的范围仅限于以下的实例。凡基于本发明上述内容所实现的技术均属于本发明的范围。
附图说明
图1.EGFR单克隆抗体HPLC-CEX检测图谱。
图2.酸性组分、主成分和碱性组分的HPLC-CEX检测图谱,其中A为酸性组分CEX检测图谱,B为主组分CEX检测图谱,C为碱性组分CEX检测图谱。
图3.pH 6.5阳离子交换层析-上样体积为30ml时层析图谱。
图4.pH 6.5阳离子交换层析-上样体积为15ml时层析图谱。
图5.pH 6.0阳离子交换层析图。
图6.pH 7.0阳离子交换层析图。
图7.先25%B等度洗脱后100%B等度洗脱的阳离子交换层析图。
图8.先30%B等度洗脱后100%B等度洗脱的阳离子交换层析图。
图9.以0-100%B梯度洗脱的阳离子交换层析图。
图10.试验组低剂量脾脏病理图。
图11.试验组中剂量脾脏病理图。
图12.试验组高剂量脾脏病理图。
图13.201910035469.1组脾脏病理图。
图14.阳性对照组脾脏病理图。
图15.溶媒对照组脾脏病理图。
具体实施方式
本发明所用原料与设备均为已知产品,通过购买市售产品所得。
以下实施例和实验例采用的发酵液是表达重组抗EGFR人鼠嵌合单克隆抗体的CHO细胞发酵培养得到的发酵液,来源于上海景泽生物技术有限公司的09S220101,09S220302、28R20161014D1、28R20161202等多批次发酵液。发酵液是按照本领域常规的微生物发酵法制备得到的,具体操作如下:
分别设计合成重组抗EGFR人鼠嵌合单克隆抗体的重链和轻链基因序列,并将重链和轻链基因片段克隆至高表达载体(CET1019-AS-puro)上,并转化大肠杆菌DH5,将序列确证的重、轻链目的基因表达载体线性化后共转染CHO细胞。细胞复苏后在摇瓶中细胞扩增,再用WAVE反应器细胞扩增,再按照(4-6)×10
表达的重组抗EGFR人鼠嵌合单克隆抗体又称重组抗EGFR单克隆抗体,具有重链如SEQ ID NO:1和轻链如SEQ ID NO:2所示的氨基酸序列。
重链:
QVQLKQSGPGLVQPSQSLSITCTVSGFSLTNYGVHWVRQSPGKGLEWLGVIWSGGNTDYNTPFTSRLSINKDNSKSQVFFKMNSLQSNDTAIYYCARALTYYDYEFAYWGQGTLVTVSAASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKRVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK(SEQ ID NO:1)。
轻链:
DILLTQSPVILSVSPGERVSFSCRASQSIGTNIHWYQQRTNGSPRLLIKYASESISGIPSRFSGSGSGTDFTLSINSVESEDIADYYCQQNNNWPTTFGAGTKLELKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC(SEQ IDNO:2)
以下实施例和实验例采用离子交换高效液相色谱法(HPLC-CEX)分析单克隆抗体制品的电荷异质性,HPLC-CEX色谱条件如下:
以下实施例和实验例中各步骤液体的收集采用国产一次性储液袋,纯化物料的配置采用国产一次性配液搅拌袋,具体可采用乐纯的储液袋。物料配置时采用烧杯配制后转移至一次性储液袋中。
实施例1:制备重组抗EGFR单克隆抗体
本实施例采用的发酵液源自上海景泽生物技术有限公司生产的09S220101,09S220302两批次发酵液。本实施例具体的纯化步骤如下:
(1)深层过滤
先用注射用水和PBS对PDH4(PALL)过滤器进行预洗,接着将发酵液的经PDH4深层过滤后无菌过滤至储液袋中,PDH4膜包的过滤面积为2m
(2)Protein A亲和层析
所用填料为:AF-rProtein A Hc-650F(东曹),层析柱:D/L 200×500mm(利穗),具体操作为:
亲和柱淋洗:淋洗程序分为淋洗1和淋洗2:
淋洗1:先采用组分为0.1M柠檬酸、0.5M氯化钠,pH为6.0的淋洗液淋洗4个柱体积;
淋洗2:采用组分为0.05M醋酸钠,pH为6.0的淋洗液淋洗4个柱体积。
洗脱:淋洗完成后,用组分为0.1M甘氨酸、0.02M氯化钠,pH3.0±0.1的洗脱液进行洗脱。
收集:收集洗脱液。
以09S220101、09S220302两批次发酵液为纯化前样品,收集的Protein A亲和层析洗脱液的HPLC-CEX酸性峰含量如下表2所示。可以看出,09S220101批Protein A亲和层析洗脱液的酸性峰含量为13.6%,09S220302批Protein A亲和层析洗脱液的酸性峰含量为12.8%。
(3)低pH孵育
将Protein A亲和层析步骤收集的洗脱液调节pH至3.2-3.6,在20-25℃静置1.5h后,用2M Tris调pH到5.8。然后用注射用水和Protein A亲和层析步骤淋洗2的淋洗液对过滤器进行冲洗,用Sartopure GF Plus一次性过滤器过滤,过滤后再用Protein A亲和层析步骤淋洗2的淋洗液对过滤器进行冲洗,收集滤液,2-8℃暂存。
(4)阳离子交换层析
将低pH孵育步骤收集的滤液进行阳离子交换层析,所用填料为Nuvia HR-S(伯乐),层析柱为D/L 200×500mm(博格隆),洗脱液由A相和B相组成。A相:20mM PB,pH 6.0±0.1;B相:20mM PB,0.1M NaCl,pH 6.0±0.1。
具体操作如下:
前平衡:用洗脱液中的A相进行前平衡。
上样:将低pH孵育步骤收集的滤液稀的pH调节至6.0±0.1作为上样样品上样到阳离子交换层析柱,上样载量不超过33.8mg/ml,保留时间为10min。
后平衡:用洗脱液中的A相进行后平衡。
淋洗:用由5%B相和95%A相组成的淋洗液淋洗,保留时间10-12min,淋洗体积1.0个柱体积。
洗脱:以5%-65%B相的洗脱液梯度洗脱150min(梯度起点5%B相、梯度终点65%B相),洗脱时间150min。
收集:洗脱过程中,UV280值升至0.1AU时开始计算,4个CV后开始收集,在UV280值降至0.1AU时收集结束。
表1.阳离子交换层析参数
以09S220101、09S220302两批次发酵液为纯化前样品,收集的阳离子交换层析洗脱液的HPLC-CEX酸性峰含量如下表2所示。可以看出,09S220101批阳离子交换层析洗脱液的酸性峰含量为5.3%,09S220302批阳离子交换层析洗脱液的酸性峰含量为5.7%。
表2:09S220101、09S220302两批次发酵液纯化前后的HPLC-CEX酸性峰含量
/>
另外,计算两批次样品纯化后的蛋白收率分别为09S220101:87.9%,09S220302:88.3%。
蛋白收率计算公式:收集的洗脱液的体积×蛋白的含量/上样样品体积×蛋白含量×100%。
表3.09S220101、09S220302两批次发酵液纯化后的蛋白收率
(5)阴离子交换层析
将阳离子交换层析收集的洗脱液进行阴离子交换层析处理,采用的填料为GigaCap Q-650M,包括前平衡、上样、后平衡、洗脱、收集过程,
具体操作如下:
前平衡:用20mM PB,48mM NaCl,pH 6.0的平衡液进行前平衡;
上样:将阳离子交换层析收集的洗脱液上样;
后平衡:用20mM PB,48mM NaCl,pH 6.0的平衡液进行后平衡;
洗脱:采用20mM PB,48mM NaCl,pH 6.0的洗脱液进行洗脱;
收集:洗脱过程中,UV280值升至0.2AU时开始收集,在UV280值降至0.2AU时收集结束。
以09S220101、09S220302两批次发酵液为纯化前样品,收集的阴离子交换层析洗脱液中的DNA的残留水平低至0.012-0.013pg/mg,远远优于小于0.16pg/mg(100pg/dose)的质量标准。
DNA的残留水平测试方法为:
使用
表4.09S220101、09S220302两批次发酵液纯化后的DNA残留水平
(6)超滤
为生产需求,将阴离子交换层析收集到的洗脱液进行超滤处理,步骤如下:超滤前,先用注射用水冲洗膜包,然后用CIP液(CIP液为:0.5mol氢氧化钠)除热原,接着用注射用水和置换液冲洗膜包,将阴离子交换层析收集到的洗脱液送入膜包进行超滤浓缩至25mg/mL,然后用置换缓冲液进行换液,换液体积超过洗脱液初始体积的5倍时,监测透过液的pH值和电导值,当实测至与TFF置换液偏差不超过±1%时停止换液操作,最后过滤。
将超滤处理后的液体进行除病毒过滤:采用SV4膜包进行除病毒过滤,过滤浓度25mg/mL,pH 5.5,电导10.0ms/cm,过滤压力为3.0bar,室温过滤。
在除病毒过滤后得到的液体中加入聚山梨酯80稀配、除菌过滤处理后得到原液,原液终浓度控制为20mg/mL。
以09S220101、09S220302两批次发酵液为纯化前样品,制得的原液的纯度分别为99.6%、99.8%。
原液纯度测试方法为:
分子排阻色谱法(SEC)基于样品物质的分子大小差异来分析样品物质的分子量大小分布。本抗体理论上有高分子聚合物、单体和低分子量物质三部分,SEC按照分子大小差异依次洗脱和分离这三种物质。高分子聚合物最早洗脱出来,之后依次是单体和低分子量物质。高分子聚合物在报告比例时应将单体峰之前的高分子聚合物峰一起积分并报告比例,此积分方式同样适用于低分子量物质。
1)仪器设备
Agilent 1100、1200、1260或1290HPLC仪器。
2)材料和方法
色谱柱:BioSep-SEC-S3000(300×7.8mm);柱温:室温;流动相:100mmol/L磷酸二氢钠,0.5%氯化钠,pH 6.8;检测波长:280nm。
表5.09S220101、09S220302两批次发酵液经本发明和201910035469.1纯化方法所得原液的质量表征
其中,生物学活性测试方法见下文实验例1。
以下对照重组抗EGFR单克隆抗体的制备方法。
对照例1:
以上海景泽生物技术有限公司生产的09S220101,09S220302两批次发酵液为原料,按照申请号为201910035469.1的中国专利申请记载的纯化方法制备得到对照重组抗EGFR单克隆抗体原液。对照重组抗EGFR单克隆抗体原液的质量表征如表5所示。
可以看出,与按照申请号为201910035469.1的中国专利申请记载的纯化方法制得的重组抗EGFR单克隆抗体原液相比,本发明纯化方法所得重组抗EGFR单克隆抗体原液的酸性峰含量明显降低,DNA残留水平明显降低,纯度明显提高,生物学活性明显提高。
以下通过实验例证明本发明的有益效果。
实验例1:电荷异质体的生物活性测试
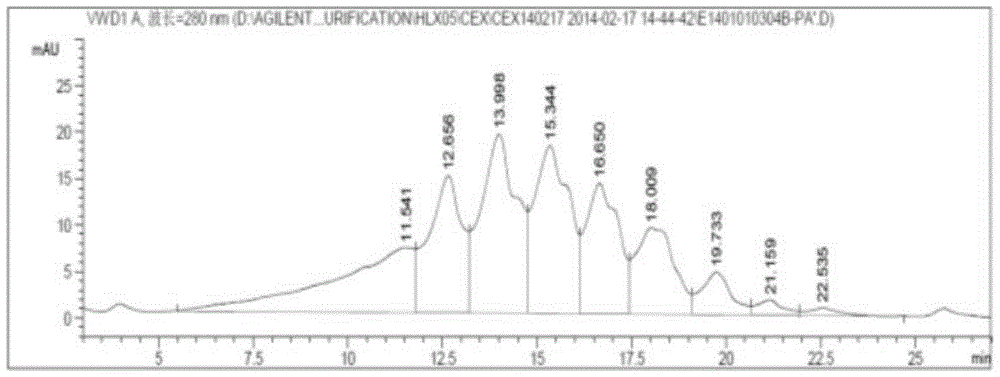
本发明将源自上海景泽生物技术有限公司生产的09S220101、09S220302两批次发酵液按照实施例1的方法经过深层过滤和Protein A亲和层析后,经CEX-HPLC分析,结果如图1所示,发现发酵液中存在部分电荷异质体。分析存在电荷异质体的主要原因为:1)由于目的蛋白(即重组抗EGFR单克隆抗体)存在两个糖链,其糖链上的唾液酸数量分布不一致;2)有脱酰胺化,氨基酸异构作用形成的酸性组分(HPLC-CEX分析图上出峰时间较主峰短);3)C端赖氨酸等修饰形成的碱性组分(HPLC-CEX分析图上出峰时间较主峰长)。
本发明将在HPLC-CEX上的保留时间小于10min的组分定义为酸性组分,保留时间为10min-18min的组分定义为主成分,保留时间大于18min的组分定义为碱性组分。使用制备色谱技术,将酸性组分、主成分和碱性组分分离,分离后三部分的CEX-HPLC色谱图如图2所示。
制备色谱技术的色谱条件如下:
(1)仪器设备
Agilent 1100、1200、1260或1290HPLC仪器
(2)材料和方法
羧肽酶B(CpB)溶液的制备:用超纯水将CpB稀释到80ng/μL。
流动相A:10mmol/L磷酸盐缓冲液,pH 7.0;流动相B:流动相A中加入100mmol/LNaCl,pH 7.0。
无CpB酶解样品溶液的制备:用流动相A将供试品稀释到1mg/mL,将稀释后的供试品溶液移入装有内插管的样品瓶中,放入自动进样器,进样体积50μL,进样量为50μg。各样品溶液分别进样1针。
CpB酶解样品溶液的制备:加入流动相A适量,再按照抗体量:羧肽酶B量=100:1的质量比例加入CpB溶液,混匀,供试品溶液终浓度为1mg/mL,37℃水浴加热30min后,将酶解后的供试品溶液移入装有内插管的样品瓶中,放入自动进样器,进样体积50μL,进样量为50μg。各样品溶液分别进样1针。
表6:制备色谱技术的洗脱条件
本发明通过细胞增殖抑制实验分别检测上述酸性组分、主成分和碱性组分的生物活性,实验方法如下:
EGFR一种分子量约为170kD的跨膜糖蛋白。EGFR与配体结合,促进细胞增殖,抗EGFR单克隆抗体则通过结合EGFR,阻断与其配体结合,从而阻断EGFR信号通路。以EGFR高表达的人结直肠癌细胞株DiFi细胞为靶细胞,EGFR单克隆抗体在不同浓度下对靶细胞的体外增殖过程具有不同的抑制作用。利用CCK-8在电子耦合试剂存在的条件下,可被线粒体脱氢酶还原生成高度水溶性的橙黄色的甲臜,颜色的深浅与细胞的增殖成正比,与细胞的毒性成反比,使用酶标仪在450nm波长处测定OD值,反映活细胞的数量,可得到目的蛋白对DiFi细胞的增殖抑制效应曲线,从而测定目的蛋白的生物学活性。
结果发现,主成分、碱性组分均具有良好的生物活性,明显优于酸性组分的生物活性,但是酸性组分的生物活性不佳,仅为标准品(Erbitux150819,100%对照品)的30%左右。因此,除去发酵液中的酸性组分对提高重组抗EGFR单克隆抗体的生物活性具有重要意义。
实验例2:阳离子交换层析对纯化的影响
在实施例1的基础上,省略阳离子交换层析步骤,测定收集的阴离子交换层析洗脱液的HPLC-CEX酸性峰含量,结果如表7所示。
表7:09S220101、09S220302两批次发酵液纯化后的HPLC-CEX酸性峰含量
可以看出,收集的阴离子交换层析洗脱液的HPLC-CEX酸性峰含量分别为09S220101批次:12.8%,09S220302批次为:12.3%。说明本发明的阳离子交换层析是去除酸性组分的重要步骤,省略阳离子交换层析无法有效去除酸性组分。
实验例3:阳离子交换层析步骤的筛选
一、阳离子交换层析最大载量筛选实验
1.材料和设备
电导仪:FE30K,梅特勒;
pH计:FE20K,梅特勒;
分光光度计:E201,Thermo;
天平:PL2001,梅特勒;
层析系统:AKTA Pure 25M,GE;
层析柱:Nuvia HR-S,Bio-rad,体积4.2ml,柱高10cm;
上样样品:将上海景泽生物技术有限公司生产的28R20161014D16批次发酵液经过离心后进行Protein A亲和层析(Protein A亲和层析方法与实施例1相同),收集Protein A亲和层析洗脱液,经稀释后上样,样品浓度经紫外分光光度计检测为4.74mg/ml。
2.阳离子交换层析最大载量的筛选实验
洗脱液由A相和B相组成。A相:20mM PB,pH 6.5;B相:20mM PB,+0.1M NaCl pH6.5。
阳离子层析操作如表8和表9所示。
表8:pH6.5阳离子层析-操作流程表
表9:pH 6.5阳离子层析-不同上样载量表
结果分析:上样体积为30ml和15ml的阳离子交换层析图分别如图3和图4所示,在高载量33.8mg/ml条件下,淋洗出现高的目标蛋白峰;载量降到原来的50%(16.9mg/ml)进行第二次实验,发现淋洗依然出现出现高的目标蛋白峰,因此,进一步研究阳离子交换层析条件以解决淋洗出现高蛋白峰的问题。
pH作为阳离子交换层析的重要条件,因此,下文进行平衡及洗脱液pH的筛选实验。
二、阳离子交换层析pH筛选实验
参照实验例3步骤一的方法进行实验。上样样品:将上海景泽生物技术有限公司生产的28R20161202批次发酵液经过离心后进行Protein A亲和层析(Protein A亲和层析方法与实施例1相同),收集Protein A亲和层析洗脱液。其酸性峰含量12.2%,样品浓度经紫外分光光度计检测为5.686mg/ml,上样样品分别调节pH至7.0和6.0。
分别将缓冲液和洗脱液的pH设定为6.0、7.0,进行保留时间10min的实验,观察分离效果。
pH为6.0、7.0条件下的阳离子层析图如图5和6所示,从图5和图6可知,在pH6.0条件下,载量33.2mg/ml resin上样时,平衡及淋洗没有出现目的蛋白峰;在pH7.0条件下,载量33.2mg/ml resin上样时,经线性梯度洗脱,无洗脱收集峰。因此,pH7.0不作为缓冲液的pH,选定pH6.0作为平衡及洗脱条件。
平衡液和洗脱液pH为6.0时,考察多组梯度洗脱与等度洗脱方法的洗脱效果,当以5%-65%B的洗脱液梯度洗脱150min(梯度起点5%、梯度终点65%),洗脱过程中,UV280值升至0.1AU时开始计算,4个CV后开始收集,在UV280值降至0.1AU时收集结束。其层析结果如表10所示,计算收集的洗脱液。发现平衡液和洗脱液pH为6.0时经线性梯度洗脱,分段收集可以去除大多数酸性杂峰,收集的洗脱液中酸性峰含量小6%,蛋白收率为87.6%,可作为放大工艺。
表10:pH6.0阳离子层析-80%最大上样量层析结果
根据上述实验,确定本发明阳离子交换层析采用的平衡液和洗脱液pH为6.0,上样载量为小于等于33.8mg/ml。
实验例4:阳离子交换层析步骤中洗脱方式的筛选
1.等度洗脱筛选实验1
在实施例1的基础上,将阳离子交换层析步骤中的洗脱方修改为以25%B等度洗脱后100%B等度洗脱(洗脱过程中洗脱基线平稳后切换洗脱液浓度),洗脱液在100-200cm/h的流速下进行,其它条件与实施例1相同。测试收集的阳离子交换层析洗脱液的HPLC-CEX酸性峰含量和蛋白收率,结果如表11和图7所示。
表11:等度洗脱阳离子交换层析后的HPLC-CEX酸性峰含量和蛋白收率
可以看出,收集的阳离子交换层析洗脱液的HPLC-CEX酸性峰含量为37.1%,蛋白收率为69.5%。说明当以上述等度洗脱洗脱的方式进行阳离子交换层析时无法有效去除酸性组分。
2.等度洗脱筛选实验2
在实施例1的基础上,将阳离子交换层析步骤中的洗脱方式修改为以30%B等度洗脱后100%B等度洗脱(洗脱过程中洗脱基线平稳后切换洗脱液浓度),洗脱液在100-200cm/h的流速下进行,其它条件与实施例1相同。测试收集的阳离子交换层析洗脱液的HPLC-CEX酸性峰含量和蛋白收率,结果如表12和图8所示。
表12:等度洗脱阳离子交换层析后的HPLC-CEX酸性峰含量和蛋白收率
可以看出,收集的阳离子交换层析洗脱液的HPLC-CEX酸性峰含量为19.7%,蛋白收率为63.9%。说明当以上述等度洗脱洗脱的方式进行阳离子交换层析时无法有效去除酸性组分。
3.梯度洗脱筛选实验
在实施例1的基础上,将阳离子交换层析步骤中的洗脱方式修改为以0-100%B梯度洗脱,洗脱液在100-200cm/h的流速下进行,其它条件与实施例1相同。测试收集的阳离子交换层析洗脱液的HPLC-CEX酸性峰含量和蛋白收率,结果如表13和图9所示。
表13:梯度洗脱阳离子交换层析后的HPLC-CEX酸性峰含量和蛋白收率
可以看出,收集的阳离子交换层析洗脱液的HPLC-CEX酸性峰含量合格的为4.7%、5.2%,但是对应的蛋白收率分别为70.1%、75.4%。说明当以0-100%B洗脱的方式进行阳离子交换层析时,可以去除酸性组分,但是蛋白收率较低。说明,当以0-100%B梯度洗脱的方式进行阳离子交换层析时无法同时满足高酸性组分去除率和高蛋白收率。
综上,结合实施例1的洗脱方式发现,本发明以5%-65%B相的洗脱液梯度洗脱是去除酸性组分和保障高蛋白收率的重要条件。
实验例5:阳离子交换层析步骤中填料的筛选
以上海景泽生物技术有限公司生产的09S220101批次发酵液为原料液进行纯化,在实施例1的基础上,将实施例1中阳离子交换层析步骤中采用的填料由Nuvia HR-S(伯乐)替换为POROS XS、Capto SP ImpRes,其它条件与实施例1相同。测试收集的阳离子交换层析洗脱液的蛋白纯度和蛋白收率,结果如表14所示。
表14:不同填料下收集的阳离子交换层析洗脱液的蛋白纯度和蛋白收率
由表14可知,以POROS XS、Capto SP ImpRes、Nuvia HR-S填料进行阳离子交换层析后所得样品的蛋白纯度分别为85.2%、88.6%、99.5%,蛋白收率分别为78.7%、80.9%、87.9%,可以看出,以Nuvia HR-S为填料时的蛋白纯度和蛋白收率均高于以POROS XS、Capto SP ImpRes为填料时的,说明以Nuvia HR-S为填料进行阳离子交换层析是本发明纯化方法的重要条件。
实验例6:免疫毒性试验
1.试验方法及分组:
将60只健康食蟹猴按体重随机分为6组,每组10只,雌雄各半。
分组如下:
试验组:取实施例1纯化后的09S220101批次原液,进行低、中、高剂量组给药,给药量分别为5、50和100mg/kg;
201910035469.1组:取对照例1纯化后的09S220101批次原液,给予50mg/kg剂量;
阳性对照组:给予50mg/kg阳性药物西妥昔单抗注射液(市售);
溶媒对照组:给予重组抗EGFR人鼠嵌合单克隆抗体安慰剂。
各组动物按相应体重慢速静脉注射给药,给药体积为20.0ml/kg,给药速度约为3ml/min。每周给药1次,共5个给药周期,恢复期6周。
2.观察症状和检测指标
组织病理学检查:对剖检动物的脾脏、淋巴结进行组织病理学检查。
3.试验结果:
由图10-15可知,试验组低剂量组、中剂量组及溶媒对照组组脾小体结构正常,红髓白髓规律分布。试验组高剂量组、201910035469.1组和阳性对照组均可见部分动物脾脏淋巴滤泡体积减小,伴随着脾脏内淋巴细胞数目的明显减少,红髓区域扩增,说明试验组高剂量组(100mg/kg)与201910035469.1组(50mg/kg)、阳性对照组(50mg/kg)所观察到的对脾脏的影响类似。
相同的给药剂量(50mg/kg)下,试验组中剂量组的免疫毒性明显低于201910035469.1组和阳性对照组,说明按照本发明纯化方法得到的重组抗EGFR单克隆抗体原液的安全性优于按照申请号为201910035469.1的中国专利申请记载的纯化方法得到的重组抗EGFR单克隆抗体原液和市售西妥昔单抗注射液。
综上,本发明提供了一种低酸性组分含量的重组抗EGFR单克隆抗体,属于医药领域。所述重组抗EGFR单克隆抗体中,酸性组分的含量为6%以下,不仅有利于提高重组抗EGFR单克隆抗体的纯度,还有利于提高重组抗EGFR单克隆抗体的生物活性和安全性。本发明提供了重组抗EGFR单克隆抗体中酸性组分含量低,DNA的残留水平低,纯度高,生物活性高,安全性好,应用前景广阔。
