纳米工程化治疗性隐形细胞
文献发布时间:2023-06-19 11:55:48
相关申请的交叉引用
本申请要求于2018年10月19日提交的美国临时申请第62/747,980号的权益,该临时申请特此通过引用整体并入本文。
背景技术
肿瘤细胞播散是癌症相关死亡的主要驱动因素(>90%)(Gallego-Perez,D.等人,《芯片实验室(Lab Chip)》12:4424-4432(2012);Fidler,I.J.《自然癌症综述(Nat RevCancer)》3:453-458(2003);Gupta,G.P.&Massague,J.《细胞(Cell)》127:679-695(2006))。特别地,多形性成胶质细胞瘤(GBM)是脑癌的致死形式,具有高度侵袭特性(Bellail,A.C.,等人,《国际生物化学与细胞生物学杂志(Int J Biochem Cell Biol)》36:1046-1069(2004))。这种侵袭性肿瘤表现出独特的颅内扩散模式,作为单细胞沿预先对齐的白质束有效地扩散(Gallego-Perez,D.等人,《芯片实验室》12:4424-4432(2012);Bellail,A.C.,等人,《国际生物化学与细胞生物学杂志》36:1046-1069(2004))。越来越多的证据表明GBM的侵袭表型受细胞运动的调节(Giese,A.,等人《临床肿瘤学杂志(J Clin Oncol)》21:1624-1636(2003))。此外,复发似乎主要由高度运动性肿瘤起始细胞的亚群驱动,称为神经胶质瘤干细胞(GSC),其对常规疗法具有抗性(Calabrese,C.等人,《癌细胞(Cancer Cell)》11:69-82(2007);Ghotra,V.P.,等人,《国际辐射生物学杂志(Int J Radiat Biol)》85,955-962(2009))。随着GSC持续在科学和医学领域引起显著的兴趣,需要新的分析和工程化工具以便更好地理解和抵消GSC扩散以在脑中形成新的肿瘤生长病灶的机制。然而,与正在进行的对致癌转化的努力相比,对GSC运动性和治疗抗性的研究受到限制。这部分是由于缺乏有效的工具来鉴定、研究和操作GSC的特定子集或来自GBM生态位的其它目的细胞,以用于研究、诊断和/或治疗目的。通过体内成像在单克隆水平表征肿瘤是极具挑战性的(Irimia,D.&Toner,M.《整合生物学(Integr Biol(Camb))》1:506-512(2009);Condeelis,J.&Segall,J.E.《自然癌症综述》3:921-930(2003))。此外,目前用于离体分析组织外植体的技术往往费力且有限(Johnson,J.等人《组织工程第C部分:方法(Tissue Eng Part CMethods)》15:531-540(2009))。另一方面,常规体外测定(Boyden,S.《实验医学杂志(J ExpMed)》115,453-466(1962);Albini,A.&Benelli,R.《自然方案(Nat Protoc)》2,504-511(2007);Rao,J.S.《自然癌症综述》3,489-501(2003);Yamada,K.M.&Cukierman,E.《细胞》130,601-610(2007);Liang,C.C.,Park,A.Y.&Guan,J.L.《自然方案》2,329-333(2007))不是生理相关的,和/或是仅集中于高度异质性细胞群体的整体行为的终点测试。
发明内容
存在表现出高传播和治疗抗性能力的GSC和MDSC的子集。这些发现表明GSC和MDSC不是单一群体,并且特定克隆子集表现出明显更具“攻击性”的表型,这可能是驱动疾病复发的原因。
本文公开了一种将肿瘤中发现的高度运动性细胞,例如这些高度运动性GSC和/或MDSC克隆“重编程”为“自毁性”细胞“导弹”(本文称为治疗性隐形细胞)的方法,所述“自毁性”细胞“导弹”可寻找并破坏体内复发的新病灶,例如脑。可以从异质群体中分选出运动性增强的细胞,然后通过确定性递送抗癌剂如溶瘤病毒质粒混合物而使其“自毁”。
所公开的方法可涉及分选来自受试者的细胞以产生治疗性隐形细胞。在一些实施例中,细胞是自体的,例如来自待治疗的受试者的血细胞或肿瘤活检。然而,在一些情况下,细胞是同种异体的。
所公开的方法可涉及分选来自受试者的细胞以获得高度运动性亚群,然后对所述亚群重编程以递送抗癌剂。在一些实施例中,可以使用化学引诱物梯度在迁移测定中分选亚群。特别地,化学引诱物梯度可以涉及由待治疗的肿瘤产生的趋化因子。例如,在一些实施例中,化学引诱物包含
在一些实施例中,使用纳米纹理和/或仿生表面在迁移测定中分选亚群。例如,MDSC在没有生化刺激的情况下对预先对齐的结构线索有响应,并且可以沿着该结构线索被引导。因此,在一些实施例中,表面包含微米或纳米级的脊/槽。例如,脊/槽的深度和宽度可以具有100nm至10μm的尺寸,包括100nm至1μm、1μm至10μm、500nm至5μm。脊/槽可以具有各种形状和图案,包括直槽。
在一些实施例中,在跨孔迁移测定或细胞侵袭测定中分选亚群。跨孔迁移测定测量通过多孔膜的细胞数量,而细胞侵袭测定集中于通过细胞外基质的侵袭性细胞迁移。
一旦亚群被分选并任选地扩增,则细胞可被重编程以异源表达编码抗肿瘤蛋白、寡核苷酸或其组合的转基因。
在某些情况下,引入有效的“安全开关”可以用于降低严重的移植物抗宿主病的风险。因此,在一些实施例中,也用杀灭开关系统重编程亚群。迄今为止,研究最广泛的安全开关是HSV I衍生的胸苷激酶(HSV-TK)基因产物。还开发了非免疫原性的安全开关系统,该系统涉及由与经修饰的人FK506结合蛋白(即iCasp9)连接的人促凋亡分子(例如半胱天冬酶-9)组成的融合蛋白。这些安全开关可以通过注入由两种FK506合成变体的二聚体组成的二聚化学诱导剂(CID)来激活。其它诱导型和自毁性杀灭开关正在开发中,并且可用于所公开的治疗性隐形细胞中。
还公开了一种包含通过所公开的方法产生的多个治疗性隐形细胞的组合物。在特定的实施例中,组合物进一步包含药学上可接受的赋形剂。
还公开了一种用于治疗受试者中的肿瘤的方法,其包含向受试者施用有效量的所公开的药物组合物。所公开的方法可以用于治疗任何实体瘤。在特定的实施例中,肿瘤与用于发展治疗性隐形细胞的细胞来源匹配。例如,可以将从乳腺肿瘤活检中获得的高度运动性MDSC重编程以治疗乳腺癌。同样,可以将从多形性成胶质细胞瘤(GBM)活检中获得的高运动性GSC/MDSC重编程以治疗GBM。
在随附的附图和以下描述中阐述了本发明的一个或多个实施例的细节。根据说明书和附图以及权利要求书,本发明的其它特征、目的和优点将是显而易见的。
附图说明
图1A至1E显示基于迁移的分选/“色谱法”的结果。图1A显示纳米纹理表面诱导引导的运动性。具有高运动性的克隆通过化学引诱进入收集室。图1B显示对GSC的研究,其表明高运动性克隆对抗miR363疗法有抗性。图1C显示与大部分MDSC相比,基于迁移的MDSC分选揭示了具有较高运动性的克隆亚群。图1D显示分选表现出具有粒细胞(P4)和单核细胞(P5)亚型的多样化表型。还存在表现出低(P6)或高(P3)Ly6-C/G的未分类亚型。图1E显示具有高运动性的MDSC克隆是P4或P3。*p<0.05。
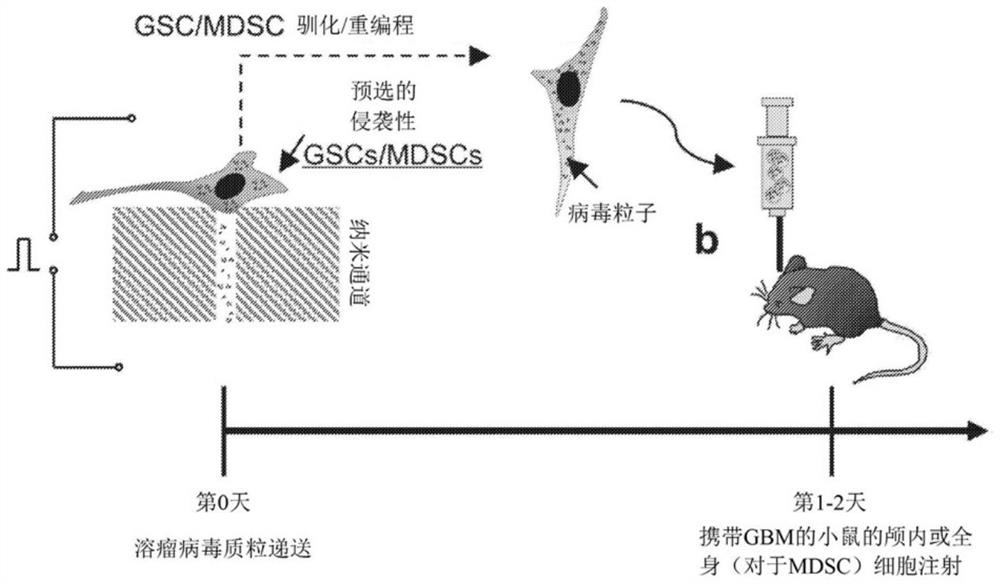
图2描绘了在带有GBM的小鼠中颅内注射重编程/驯化的GSC和/或MDSC,并监测肿瘤进展。
图3显示MDSC在纹理/仿生表面上表现出显著的运动性(即,被引导)。另一方面,在TCP上培养的MDSC表现出有限的运动性。这些结果表明,与肿瘤细胞非常相似,MDSC可对增强体内肿瘤细胞扩散的相同结构线索有反应。*p<0.05。
图4A和4B示出了迁移色谱法设置,其中MDSC被选择性地接种在平台的一侧上,并被诱导经由趋化性以单一方向迁移。表面纳米纹理基于引导的运动性触发克隆分离。图4C显示快速移动与缓慢移动的细胞的速度。图4D和4E含有流式细胞术分析,显示与缓慢移动的克隆(例如大部分MDSC)相比,快速移动的克隆具有独特的表型。*p<0.05。
图5A和5B显示来自黑素瘤患者的循环MDSC的单克隆运动性测定。每个患者的速度差异(图5A)和有效位移差异(图5B)。结果表明,来自某些患者的MDSC表现出增强的速度。但是,当考虑有效位移(即从起点到终点位置的几何距离)时,某些低速MDSC批次显示出明显的位移,这可能反映了更多的方向/持久运动性(无趋化性)。P1:IIIC期,tx纳武单抗(nivolumab)+手术;P2:IV期,tx纳武单抗;P3:IV期V600E/BRAF,tx辐射+派姆单抗(pembrolizumab);P4:IV期,tx纳武单抗+伊匹单抗(ipilumamab);P5:IV期,tx派姆单抗/伊匹单抗/纳武单抗;P6:IV期V600E/BRAF,用INF-α治疗)。
图6A和6B显示可以使用纳米纹理表面来掩盖在标准TCP上未观察到的药物敏感性。图6A显示源自患者的MDSC的单克隆运动性测定,其显示了响应于依鲁替尼(ibrutinib)的特异性克隆亚群的抑制(平均速度>40μm/h)。图6B显示TCP上的单克隆运动性没有显示依鲁替尼对MDSC传播的任何作用。
图7A和7B示出了用于具有集成微流体的迁移色谱法的装置,以使得能够自动分离目标克隆。图7C和7D显示一旦发生基于迁移的分离,则下面的微流体系统可用于使冷却水在给定位置顺序流动,这由于PINIPAM层的热致动而促进了目标MDSC克隆的选择性分离。
图8A显示MDSC和非癌MCF10A的共同培养导致一组MCF10A克隆的运动性增强。图8B显示免疫荧光分析,表明共培养条件触发了某些克隆(例如,波形蛋白)中上皮标志物如钙黏蛋白的表达的减少,以及间充质标志物的增加。图8C显示将MDSC与已经具有攻击性的MDAMB-231细胞共培养并未导致MDA-MB-231群体的运动性发生重大变化。●:单培养,■:50:50共培养▲:90:10共培养(MDSC:乳腺癌/组织细胞)。
图9显示MDSC和乳房组织/癌细胞的共培养导致某些MDSC克隆的速度显著增加,尤其是与MDA-MB-231共培养时。这些结果潜在地表明,在转移细胞的存在下,MDSC运动性受到正向调节,促进了在肿瘤外的共扩散,并在肿瘤细胞的扩散过程中继续了免疫保护作用。
图10A至10E显示MDSC对对齐的结构线索有响应并且表现出引导的传播模式。图10A是肿瘤微环境的示意图,其显示了侵袭性癌细胞和浸润性MDSC,其使用预先对齐的结构线索(例如,重塑的ECM,血管壁)分别逃逸和侵袭肿瘤基质。图10B是基于PDMS的仿生纹理表面的SEM显微照片(具有叠加的MDSC模型),其用于在单克隆水平上评估结构引导的MDSC迁移。图10C显示在纹理与对照/TCP表面上培养的MDSC的肌动蛋白-细胞核染色。与TCP相比,MDSC在纹理表面上具有对齐的/更易迁移的形态。图10D和10E显示在纹理与对照/TCP表面上的单克隆传播轨迹(图10D)和MDSC的量化(图10E),证实了当暴露于预先对齐的结构线索时MDSC的增强的传播能力(即,平均单克隆速度和净轨迹距离)。净轨迹距离是在跟踪期间细胞移动的几何距离的反映。*p<0.01且
图11A至11I显示MDSC亚群表现出独特的传播和基因表达模式。图11A和11B是实验设计的示意图。在这里,通过流式细胞术将MSC-2培养物分为三个不同的亚群,包括粒细胞(CD11b
图12A至12G显示单个MDSC亚群似乎显示出可驱动整个表型范围补充的表型可塑性。图12A是实验设计的示意图。图12B显示单克隆传播(即,平均速度和净轨迹距离)研究没有显示到第7天时所有三个群体之间的显著差异。图12C至12E显示流式细胞术分析,表明尽管到分选后第1天,所有亚群仍保持相对纯净,但到第7天,无论起始细胞群的表型如何,表型的整个范围已得到补充。*p<0.0001,
图13A和13B显示源自黑素瘤患者的循环MDSC在单克隆水平上显示出不同的传播特征。图13A和13B显示某些患者的平均单克隆速度(图13A)和净轨迹距离(图13B)与其余患者群体相比倾向于显著更高,这可能反映了患者的背景。
图14A至14F显示患者来源的MDSC的不同亚群,其显示不同的传播能力。图14A至14C显示通过流式细胞术将黑素瘤患者MDSC分选为粒细胞(CD11b
图15A和15B显示流式细胞术分选亚群的作为时间函数的促炎(图15A)和抗炎(图15B)标志物基因表达的差异。*p<0.0001,
具体实施方式
在更详细地描述本公开之前,应理解,本公开不限于所描述的特定实施例,并且因此当然可以变化。也应当理解,本文中所使用的术语仅为了描述特定实施例,而无意于进行限制,因为本公开的范围将仅受限于所附权利要求。
在提供一系列值的情况下,应当理解,在该范围的上限与下限之间的每个中间值(到下限单位的十分之一,除非上下文另有明确指示)以及在该规定范围中的任何其它规定值或中间值被包含在本公开内。这些更小范围的上限和下限可独立地包括在所述更小的范围内,并且也包括在本公开中,受限于所述范围中具体排除的界限。在规定范围包括所述界限中的一者或两者的情况下,排除那些被包括界限中的任一者或两者的范围也被包括在本公开中。
除非另有定义,否则本文中使用的所有技术和科学术语具有与本公开所属领域的普通技术人员通常所理解的相同含义。尽管类似于或等同于本文描述的那些方法和材料的任何方法和材料也可以用于本公开的实践或测试中,但是现在描述优选的方法和材料。
在本说明书中所引用的所有公开物和专利通过引用并入在本文中,犹如每个单个公开物或专利都具体地且单独地被指示为通过引用并入且通过引用并入在本文中以结合所述公开物所陈述的内容来公开和描述方法和/或材料。任何出版物的引用均是其在申请日之前的公开,并且不应解释为承认本公开由于在先公开而无权早于该出版物。此外,提供的公开日期可能与可能需要独立确认的实际公开日期不同。
如本领域的技术人员在阅读本公开之后将清楚,本文中所描述且所示出的各个实施例中的每一者具有分立部件和特征,在不脱离本公开的范围或精神的情况下,这些分立部件和特征可以很容易与其它多个实施例中的任一者的特征分离或组合。任何记载的方法可以按照所记载事件的顺序或以逻辑上可能的任何其它顺序进行。
除非另有说明,否则本公开的实施例将采用本领域技术范围内的化学、生物学等技术。
提出以下实例以向本领域普通技术人员提供关于如何执行本文公开和要求保护的方法以及如何使用本文公开和要求保护的探针的完整公开和描述。已经尽力确保关于数字(例如,数量、温度等)的准确性,但是应该考虑一些误差和偏差。除非另有说明,否则份数是重量份,温度以℃计,并且压力为大气压或接近大气压。标准温度和压力定义为20℃和1个大气压。
在详细描述本公开的实施例之前,应当理解,除非另外指出,否则本公开不限于特定的材料、试剂、反应材料、制造工艺等,因为它们可以变化。还应理解,本文所使用的术语仅出于描述特定实施例的目的,而无意于进行限制。在本公开中还可能的是,在逻辑上可行的情况下,可以以不同的顺序执行步骤。
必须注意,在说明书和所附权利要求书中使用的单数形式“一个(a)”、“一种(an)”和“所述(the)”包括复数对象,除非上下文另有明确规定。
如本文所用,“自杀基因”是指将导致细胞通过细胞凋亡杀死其自身的基因。这些基因的激活可能是由于许多过程引起的,但是诱导凋亡的主要细胞“开关”是p53蛋白。自杀基因的刺激或引入(通过基因疗法)可通过使癌细胞更易受攻击、对化学疗法更敏感来用于治疗癌症或其它增殖性疾病。癌细胞中表达的基因的一部分与哺乳动物中未发现的酶的其它基因相连,这些酶可以将无害物质转化为对肿瘤有毒的物质。介导这种敏感性的自杀基因可编码病毒或细菌酶,该酶将无活性的药物转化为抑制核酸合成的有毒抗代谢物。
可以通过基于迁移的分选,例如纳米芯片支持的单克隆运动性色谱法,从异质群体中分选出高度运动性的GSC和/或MDSC克隆。基于迁移的细胞分选方法涉及鉴定与其余群体相比表现出增强的传播能力的克隆子集和/或细胞亚群。此类细胞本来就更倾向于归巢/渗入原发性肿瘤和/或转移性生长物,因此可以用作更有效的药物/基因递送媒介物。识别高度传播性克隆子集可以通过许多不同方式来实现。
一种选择是用细线将细胞混合物接种在微纹理或纳米纹理的表面上,这将诱导细胞的接触引导的定向迁移。例如,在没有生化刺激的情况下,MDSC对预先对齐的结构线索有响应并可以沿着预先对齐的结构线索被引导。
可将细胞暴露于化学引诱物梯度下,这将定义细胞迁移的特定方向,并且随着细胞向化学引诱物迁移,“快速移动”克隆可逐步收集在储库中。在没有化学引诱物的情况下进行该分选也可以用作鉴定克隆子集的方法,即使在没有化学引诱物的情况下,克隆子集也更倾向于表现出单向运动性(即朝向收集储库)。即使这些细胞不一定是最快的移动者,但它们在单一方向上表现出持续运动性的能力也可以转化为增强的体内传播的能力(例如,具有高迁移速度但缺乏方向性的细胞不一定是最有效的“浸润物”),这也将使这些克隆对于增强药物/基因向原发性肿瘤和/或转移性生长物的递送是理想的。
选择具有增强的传播能力的细胞的另一种方法可以是通过在transwell系统(例如8微米的孔)上的易位测定。例如,可以将细胞接种在transwell的顶部腔室中,并且具有增强传播能力的细胞将逐渐穿过孔易位到底部腔室,在此处可以收集它们以进行进一步修饰(用于基因/药物递送应用)。
如本文所公开的,所公开的细胞亚群是CD11b
在一些实施例中,细胞源自原发性肿瘤细胞(例如,从常规活检中分离)。在一些实施例中,细胞衍生自髓样来源的抑制细胞(例如,从循环中分离)。然而,所公开的方法可以应用于易于浸润到癌组织中的任何其它细胞类型(例如,其它单核细胞、T细胞等)。
一旦完成高度扩散性克隆的预选,就可以首先扩增这些细胞,然后通过多种途径进行基因工程改造,包括转基因的病毒或非病毒(例如,大容量电穿孔,组织纳米转染)递送,和/或CRISPR/CAS9驱动的转基因插入。此步骤的目的是诱导这些细胞产生抗肿瘤蛋白、寡核苷酸和/或其它实体(例如glut1、mir146、溶瘤病毒等)。一旦完成了这些高度运动性亚群的基因工程化,这些细胞就可以全身性地(例如在血液、淋巴系统中)或局部地(进入原发性肿瘤或转移性肿瘤)被递送回患者体内,旨在消除癌产物。在一些实施例中,转基因编码金属蛋白酶-3组织抑制因子(TIMP-3)。
对于癌症应用,可以对这些细胞进行工程化(通过转染)以表达促炎分子(例如,ccl4、mir146、glut1)来促进T细胞浸润到肿瘤中,或抗转移成分(例如timp3)来预防癌症传播。
在一些实施例中,MDSC用于在其它情况下递送治疗剂,例如阿尔茨海默病或糖尿病,递送抗炎分子或其它形式的脑损伤(例如,缺血性中风),其中MDSC自然归巢,使得一次可以递送治疗物,例如促血管生成和/或促神经元剂或抗炎剂。
这些自体细胞可以用药物诱导的(例如多西环素)“杀灭开关”系统进一步工程化(在将其注射回患者体内之前),以在不再需要其作用时根除治疗细胞。杀灭开关系统在本领域中是已知的,因此,选择和采用合适的杀灭开关系统在本领域技术人员的能力范围内。
已经描述了本发明的多个实施例。然而,将理解的是,在不脱离本发明的精神和范围的情况下,可以进行各种修改。因此,其它实施例在所附权利要求的范围内。
实例
实例1:纳米工程化治疗性隐形细胞
GSC的传播能力,以及它们逃避免疫系统或标准疗法的能力,仍然是致死率的主要驱动物。纳米级工具被用于分离和研究表现出高传播和疗法抗性能力的GSC的特定子集(图1)。
MDSC的初步研究还发现,克隆子集具有出色的传播能力,类似于GSC(图1)。这些发现表明,GSC和MDSC并非单一群体,特定的克隆子集表现出显著更具“攻击性”表型,这可能是驱动疾病复发的原因。在本实例中公开了一种转化性、高风险/高回报方法的开发,该方法通过将高度运动性GSC和/或MDSC克隆“重编程”为“自毁性”细胞“导弹”来最小化GBM复发,所述“自毁性”细胞“导弹可寻找并破坏脑内复发的新病灶。如图1所示,通过纳米芯片支持的单克隆运动性“色谱法”从异质群体中筛选出具有增强运动性的GSC和MDSC。这些细胞随后进行有限的克隆扩增(2-5代),随后通过溶瘤性病毒质粒混合物的确定性、基于纳米通道的递送(Gallego-Perez,D.等人《纳米医学(Nanomedicine)》12:399-409(2016))而被“自毁”。与常规疗法相比,这些病毒可以通过不同的机制杀死癌细胞,因此已被提议作为根除GSC的替代潜在疗法(Cripe,T.P.,等人《分子治疗学(Mol Ther)》17:1677-1682(2009))。
进行了一系列的体外研究,以确定使GSC或MDSC的选定亚组“自毁”的最佳质粒剂量和比例,同时在延长的时间段内保持优异的运动性。然后将这些“驯化的”但高度运动性的GSC/MDSC群体颅内注射(一起或分开)到带有GBM的小鼠中,旨在使它们有效传播,并策略性地在整个患病的大脑中释放治疗性病毒粒子(图2)。
为了验证这些细胞能够归巢于患病的大脑并阻碍肿瘤的进展,还对带有GBM的小鼠进行了重编程/给药MDSC的全身递送的比较实验。先进的成像技术(例如IVIS、PET、MRI)用于监测治疗性GSC/MDSC的命运。尽管与使用溶瘤病毒颗粒直接治疗相比,基于细胞的溶瘤病毒疗法先前已显示出令人鼓舞的结果(Power,A.T.&Bell,J.C.《分子治疗学》15:660-665(2007)),但主要的局限性在于迄今为止已研究的大多数细胞降低了传播能力,尤其是与颅内传播GSC的速度相比。另一方面,驯化/重编程的GSC或MDSC除了具有针对免疫系统的隐形能力外,还具有固有的高颅内运动能力,从而使它们更有效地定植、监视和治疗患病的大脑。
实例2:小鼠MDSC的结构引导性传播
最近的研究表明,在没有生化刺激的情况下,MDSC对预先对齐的结构线索有响应,并可以沿其被引导(图3-4)。相反,在组织培养聚苯乙烯(TCP)上的单克隆运动性测定显示很小的扩散能力(图3),这表明与肿瘤细胞非常相似,MDSC扩散/浸润可能受到结构引导的迁移的支持。芯片支持的迁移色谱法研究表明,与其余群体相比,该克隆子集具有增强的传播能力(图4A-4C),与高度侵袭性癌细胞相当。快速移动的克隆的流式细胞术分析表明,此类群体主要是Ly6-G
实例3:患者MDSC的结构引导性传播
接下来的测试是在没有生化刺激的情况下,患者来源的MDSC是否也表现出结构引导性迁移。在不同的治疗方式下,追踪从不同阶段的黑素瘤患者外周血中分离出的MDSC约24小时。每位患者的MDSC均表现出独特的传播模式/特征,与大部分保持集中低于25μm/h的群体相比,一些患者显示出具有增强运动性的克隆子集(图5)。值得注意的是,有些患者的MDSC的速度完全集中低于25μm/h,这可能表明是明显“静止的”群体,大概反映了恶性肿瘤的类型和/或疗法的方式/阶段。尽管需要更多的研究来确定这些因素与MDSC的单克隆传播能力/特征之间的明确关联,这可以作为其体内活性水平和/或疾病结局的代表,但这些数据进一步支持了以下观点:MDSC并非单一的,探索与运动性相关的机制有可能不仅为改进疗法的开发,而且为新的诊断/预后工具的开发铺平道路。
实例4:结构引导性迁移揭示药物敏感性
损害MDSC迁移/浸润入肿瘤/神经节可能是减少免疫抑制负担的可行策略。Bruton酪氨酸激酶(BTK)抑制剂已普遍用于治疗血液系统癌症。BTK在许多生物过程(包括细胞迁移)中都发挥着作用。尽管MDSC表达BTK,但在存在依鲁替尼(BTK抑制剂)的情况下对TCP的单克隆运动性测定未显示出对迁移的显著影响(图6)。相反,在仿生表面上的运动性测定似乎显示出对MDSC的高度运动子集的选择性靶向(图5)。此类结果表明迁移驱动的变化(例如,细胞骨架排列)可能部分地调节MDSC中的药物敏感性。
实例5:用于迁移色谱法的仿生平台
利用内部纳米制造专业知识(即基于接触/投影的光刻和软光刻)来从聚二甲基硅氧烷(PDMS)制备预先对齐的结构线索(约300nm宽)。然后,在氩等离子体(30瓦,约1000微托)下,将具有热敏性的聚(N-异丙基丙烯酰胺)(PNIPAM)对纹理表面进行官能化。然后,将涂有PINIPAM的基板(约100μm厚)与带有排列的微通道(50μm宽,500μm间距,独立运行,图7)的微流体系统连。这些通道用于使冷却水选择性地流过纹理PDMS下方,并通过PINIPAM的热激活(即从轻度疏水变为高度亲水)促进选择性细胞分离。纳米纹理表面的特征在于扫描电子(SEM)和原子力(AFM)显微镜。PNIPAM涂层将通过在不同温度下的接触角测量、X射线光电子能谱法(XPS)和傅里叶变换红外光谱法(FTIR)进行验证。
实例6:MDSC运动性
使用标准程序,在方案OSU-09142下,从乳腺癌肿瘤患者的新鲜采购组织(即外周血、肿瘤和淋巴组织)中分离MDSC。肿瘤细胞/组织也将使用标准程序36收集。迁移色谱法将使用GM-CSF(200ng/mL)作为化学引诱物在仿生表面上进行(图4、7)。在配备有培养室的共聚焦显微镜中通过时差显微镜记录不同来源MDSC(即循环、肿瘤和淋巴组织驻留)的单克隆迁移。将每10分钟收集一次图像,持续24-72小时,并且使用Fiji的手动跟踪器插件进行后处理/分析。表现出不同程度的运动性的MDSC克隆将通过选择性地“操作”平台的微通道来分离。根据自起始位置的行进距离,将细胞分为高运动性、中运动性和低运动性(图7)。然后通过振荡AFM和如其它地方所述的牵引力显微镜(TFM)分析这些克隆子集的生物力学(即刚度和收缩力),振荡AFM是由Co-I Ghadiali开发的一种用于分析单细胞的粘弹性的技术。此外,对单核细胞(CD15
实例7:BTK抑制
一旦从不同来源的MDSC中鉴定出高度运动性和/或免疫抑制性的克隆,就可以评估BTK抑制剂(即依鲁替尼)阻碍引导性传播的程度。首先,免疫印迹用于评估暴露于0-10μM依鲁替尼的每个克隆子集中BTK和磷酸化BTK(p-BTK)的水平。然后将每个克隆子集铺板在纳米纹理表面(约10
实例8:MDSC/肿瘤细胞传播的相互调节
初步研究表明,MDSC具有专门的流动性得到改善的克隆子集,其可能更倾向于定植肿瘤/淋巴组织,或与高度侵袭性肿瘤细胞共同传播,以在转移早期提供“保护性”免疫抑制。仿生表面的初步研究(图8-9)表明,MDSC的存在触发了非癌性乳腺组织细胞克隆子集中增强的运动性和上皮样至间充质样转变(图8A-8B),表明MDSC可能具有在健康组织中诱导潜在癌性转变的能力。相反,MDSC似乎并未诱导高度侵袭性乳腺癌细胞的总体运动模式发生重大变化(图8C)。有趣的是,最具侵袭性的肿瘤细胞在MDSC中诱导了最强的单克隆运动性变化(图9)。MDSC从聚集在约/低于40μm/h的单克隆速度出发,在某些情况下可以达到约100μm/h的速度,这可能是由于侵袭性肿瘤细胞的细胞因子/趋化因子分泌增加。
实例9:单克隆水平的引导性迁移研究揭示肿瘤相关的髓样来源的抑制细胞群体中可能的目的治疗靶标
纹理化PDMS表面:微纹理PDMS表面通过复制模塑工艺由光刻图案化的硅母模制造。首先使用S1813光刻胶通过标准UV光刻法在硅母模上对脊和槽的平行阵列(宽2μm,高2μm,间隔2μm)进行图案化。然后将PDMS与固化剂的10:1混合物浇铸在母模上,并使其除气并固化数小时。然后将PDMS从母模上脱模,灭菌并置于多孔板上以进行单细胞迁移实验。扫描电子显微镜(SEM)用于表征表面形态。
MDSC培养:小鼠MDSC细胞系(MSC-2)是来自Gregoire Mignot的捐赠。在补充有25mM HEPES、10%热灭活的胎牛血清(FBS)、1%抗生素-抗真菌药和1mM丙酮酸钠的RPMI1640培养基中培养MSC-2细胞。使用RosetteSep HLA髓样细胞富集试剂盒(StemcellTechnologies)从外周血中富集患者来源的MDSC,然后进行Ficoll-Paque离心(GEHealthcare)。通过随后在4℃下使用抗HLA-DR MicroBeads(Miltenyi Biotec)对HLA-DRneg细胞进行阴性选择15分钟来分离MDSC,并使用MS-MACS柱进行分离。在IRB批准的人类受试者研究方案下,在知情同意的情况下采集样本。
单细胞迁移测定:接种约1.5x10
基于流式细胞术的分析和分选:下列抗体用于MSC-2细胞:抗CD11b-FITC、抗Ly6-C-APC和抗Ly6-G-PE,均购自Biolegend。对于患者来源的MDSC,我们使用从BeckmanCoulter购买的抗CD33-APC、抗CD11b-AP和抗HLA-DR-PECy7。使用LSRII流式细胞仪(BDBiosciences)获取数据。针对其各自的同种型对照和没有染色的样本评估所有颜色。
基因表达分析:使用TRizol试剂(ThermoFisher)提取总RNA。使用上标VILO cDNA合成试剂盒(ThermoFisher)在20μl反应中使用500-1000ng RNA进行逆转录反应。cDNA用作模板,使用预先设计的引物通过定量实时PCR来测定促炎和抗炎基因的表达水平。使用QuantStudio 3实时PCR系统和TaqMan快速进样化学试剂(Thermo Scientific)在以下条件下进行实时PCR反应:95℃10分钟,95℃1分钟、60℃1分钟和72℃1分钟的40个循环。针对管家基因GAPDH和ATP-6将基因表达标准化。
原位肿瘤异种移植:首先在6-8周龄的免疫缺陷裸鼠(Jackson Laboratory)的乳腺脂肪垫中注射100万个人类乳腺癌细胞(MDA-MB-231)以产生肿瘤。肿瘤发展4周后,按照制造商建议的说明,使用PKH67绿色荧光细胞接头试剂盒对分选的MDSC亚群进行染色,以进行常规细胞膜标记(Millipore Sigma)。然后通过尾静脉向荷瘤小鼠注射约2.5x10
统计分析:所有统计分析均在Sigma Plot 12或GraphPad Prism 7中进行。我们每个实验使用n=3-6个重复。有关重复次数、统计检验和显著性水平的特定信息可以在图例中找到。
MDSC对地形线索做出响应并表现出结构引导性传播方式。已知结构引导性细胞传播在癌细胞从原发性肿瘤的逃逸以及在周围器官和组织中转移性生长物的建立中起作用。高度侵袭性的癌细胞倾向于表现出独特的扩散模式,优先沿组织内预先对齐的解剖微观结构传播,包括来自细胞外基质(ECM)的径向取向纤维、白质束、血管基底层和软膜下/腹膜下间隙等(图10A)(Gallego-Perez D,等《芯片实验室》2012,12:4424-4432;Bellail AC,等人《国际生物化学与细胞生物学杂志》2004,36:1046-1069;Johnson J等人《组织工程第C部分:方法》2009,15:531-540)。微米和纳米级工具已被用于开发可用于在这些生理相关条件下探测癌细胞运动性的系统(Gallego-Perez D,等人《芯片实验室》2012,12:4424-4432;Bellail AC,等人《国际生物化学与细胞生物学杂志》2004,36:1046-1069;Johnson J,等人《组织工程第C部分:方法》2009,15:531-540;Irimia D,等人《整合生物学》2009,1:506-512;Doyle AD,等人《细胞生物学杂志(J Cell Biol)》2009,184:481-490;Petrie RJ,等人《自然综述分子细胞生物学(Nat Rev Mol Cell Biol)》2009,10:538-549)。尽管地形或细胞限制线索已被用来模拟多种癌细胞中的快速和高度定向运动(Gallego-Perez D,等人《芯片实验室》2012,12:4424-4432;Johnson J,等人《组织工程第C部分:方法》2009,15:531-540;Irimia D,等人《整合生物学》2009,1:506-512;Sidani M,等人《乳腺生物学与肿瘤杂志(JMammary Gland Biol Neoplasia)》2006,11:151-163;Provenzano PP,等人《BMC医学(BMC Med)》2006,4:38;Wong IY,等人《自然物质(Nat Mater)》2014,13:1063-1071),但是尚无研究探讨此类线索对肿瘤相关MDSC传播/浸润能力的影响。接下来测试MDSC是否通过表现出类似于侵袭性癌细胞的结构引导性扩散模式来响应地形线索。鼠MDSC细胞系MSC-2被用作模型(Stiff A,等人《癌症综述(Cancer Res)》2016,76:2125-2136;Trikha P,等人《肿瘤免疫学(Oncoimmunology)》2016,5:e1214787)。这些细胞铺在微纹理化的聚二甲基硅氧烷(PDMS)表面上(图10B),该表面是由光刻制造的硅母模通过复制模塑制造的,并被设计为平行的脊和槽阵列,其尺寸先前已在癌细胞扩散研究中进行了测试(大约2μm x 2μm,间隔2μm)(Gallego-Perez D,等人《纳米快报(Nano Lett)》2016,16:5326-5332;Gallego-Perez D,等人《芯片实验室》2012,12:4424-4432;Kim SH,等人《癌细胞》2016,29:201-213;Gu SQ,等人《核酸综述(Nucleic Acids Res)》2016,44:5811-5819)。通过时差显微镜在单克隆水平上实时监测MDSC运动性。将铺在标准细胞培养表面(即组织培养聚苯乙烯或TCP)上的细胞用于比较。结果表明,MDSC在TCP上在单克隆水平上显示出有限的运动性(图10C-10E),大多数细胞呈现出圆形的形态(图10C)。另一方面,纹理表面清楚地在某些MDSC中诱导了细胞骨架和形态的重排(即对齐)(图10C),这有助于增加运动性(图10D、10E)。与在TCP上约为20μm h
MDSC亚群表现出不同的传播能力。基于明显的克隆间运动性变化,我们根据标准MDSC命名法,通过基于流式细胞术的分选为粒细胞(CD11b
MDSC亚群显示在延长的培养条件下驱动群体稳态的表型可塑性。在基于流速将MSC-2细胞纯化为粒细胞和单核细胞MDSC以及CD11b
微米和纳米级技术已广泛用于探测和/或调节细胞生物学的各个方面,以用于医疗应用(Gallego-Perez D,等人《纳米快报》2016,16:5326-5332;Gallego-Perez D,等人《芯片实验室》2012,12:4424-4432;Kim SH,等人《癌细胞》2016,29:201-213;Gu SQ,等人《核酸综述》2016,44:5811-5819;Minata M,等人《细胞报告(Cell reports)》2019,26:1893-1905;Shukla VC,等人《生物技术趋势(Trends in biotechnology)》2018,36:549-561;Benavente-Babace A,等人《生物传感器与生物电子学(Biosens Bioelectron)》2014,61:298-305;Fei Z,等人《分析化学(Analytical chemistry)》2013,85:1401-1407;ChangL,等人《小型(Small)》2016,12:5971-5980;Chang L,等人《芯片实验室》2015,15:3147-3153;Gallego-Perez D,等人《生物医学微器件(Biomed Microdevices)》2012,14:779-789;Gallego-Perez D,等人《纳米医学(Nanomedicine)》2016,12:399-409;Gallego-PerezD,等人《自然纳米技术(Nature nanotechnology)》2017,12:974;Wu Y,等人《小型》2013,9:2358-2367;Zhao X,等人《尖端科学(Advanced Science)》2015,2;Zhao X,等人《分析化学(Anal Chem)》2015,87:3208-3215)。微米级工程化工具被用来证明与肿瘤相关的MDSC表现出与侵袭性癌细胞相似的结构引导性迁移模式。单克隆运动性分析揭示了MDSC群体内部和整个群体(即,对于患者来源的MDSC)中清晰的异质性,证实了在鼠和患者来源的MDSC中存在具有增强的传播能力的克隆子集。后续运动性研究加上基于流式细胞术的分选、基因表达分析和在裸鼠中的原位肿瘤异种移植实验表明,粒细胞亚群更倾向于表现出增加的传播和肿瘤浸润能力,以及增强的抗炎活动,可能使这一群体成为癌症的诱人治疗靶标。然而,随后的研究强调了此类克隆子集的显著动态和可塑性性质,通过产生完整的MDSC表型谱,纯化的MDSC亚群迅速达到了群体稳态。尽管关于肿瘤驻留的MDSC(即粒细胞与单核细胞)的显性表型存在矛盾的报道(Kumar V,等人《免疫学趋势(Trends in immunology)》2016,37:208-220;Hossain F,等人《癌症免疫学研究(Cancer immunology research)》2015,3:1236-1247;Haverkamp JM,等人《欧洲免疫学杂志(European journal of immunology)》2011,41:749-759;Mairhofer DG,等人《皮肤病研究杂志(Journal of InvestigativeDermatology)》2015,135:2785-2793;Bozkus CC,等人《免疫学杂志(The Journal ofImmunology)》2015,195:5237-5250),我们的单克隆传播和表型可塑性结果指出了潜在的机制,粒细胞MDSC可以通过该机制更好地配备以浸润肿瘤生态位,然后它们可以保留为粒细胞MDSC和/或产生单核细胞MDSC,这取决于多种因素,包括肿瘤类型。有趣的是,对源自癌症患者的循环MDSC进行的单克隆传播研究表明,MDSC运动性可能会受到患者背景(例如,癌症的类型/阶段,治疗方式等)的影响,因此,需要其它研究以确定离体循环MDSC的传播方式是否可用于监测疾病和/或治疗进展。
除非另有定义,否则本文所用的所有技术和科学术语具有与所公开的发明所属领域的技术人员通常所理解的相同含义。本文中所引的公开和所引的材料具体地通过引用并入。
本领域技术人员将认识到或能够仅使用常规实验确定本文所述的本发明的特定实施例的许多等同方案。此类等同方案旨在由所附权利要求书涵盖。
- 纳米工程化治疗性隐形细胞
- 用于阳极活性材料、阴极活性材料和固态电解质的纳米工程涂层及包含纳米工程涂层的电池的制造方法
