一种基于球形核酸信号放大机制的数字式流式微球生化分析方法
文献发布时间:2024-01-17 01:13:28
技术领域
本发明涉及蛋白和外泌体标志物检测技术领域,具体涉及一种基于球形核酸信号放大机制的数字式流式微球生化分析方法。
背景技术
体液中重要蛋白或外泌体标志物的异常表达直接与相关疾病的产生和发展密切关联,而对于极低丰度生物标志物的高灵敏准确分析是目前重大疾病早期液体活检面临的最大挑战,因此实现相关蛋白或外泌体标志物的高灵敏度准确分析对早期疾病的筛查和诊断具有重要意义。
以针对蛋白标志物的免疫分析为例,目前针对蛋白标志物的高灵敏度分析,主要是基于模拟信号读出模式的酶联免疫吸附测定分析方法等,相关方法主要是根据反应体系输出的总体信号来反映靶标蛋白标志物分子的浓度,应用广泛,但是其易受干扰和灵敏度低,无法满足对体液中超低丰度的靶标蛋白分子进行超灵敏准确分析的需求以及无法反映检测个体间的差异。针对目前现有分析方法存在的问题,近年来兴起了一种数字式免疫分析方法,其可在单分子水平检测靶标蛋白分子,因此在超微含量靶标蛋白分子的超灵敏检测方面具有独特优势。目前比较成熟、商品化应用较广的是单分子阵列(Sioma)技术,此方法以微孔作为独立反应单元,利用泊松分布原理,每个磁珠表面负载1或0个靶标蛋白分子,然后将磁珠加载到微孔中,此时表面负载靶标蛋白分子的磁珠触发酶促反应释放荧光从而点亮微孔呈现出阳性荧光信号,通过计数阳性微孔的个数实现靶标蛋白分子的数字式分析。与传统的免疫分析方法相比,此方法具有更低的检出限,但是当磁珠加载到微孔中易造成磁珠的大量损失,导致低采样效率使得其准确度受到一定限制。另外,此方法需要制备大量孔径均一的微孔作为微反应单元来分割靶标蛋白分子和进行信号产生反应以及微孔需要油封,此过程操作繁琐且需要特殊的设备或专有的试剂/耗材。然而,理想的蛋白或外泌体标志物的检测方法应具备类似的数字式分析原理同时摆脱对高端仪器和微室的依赖,且满足稳定、简单、价格低廉、高效灵敏、适用范围广等特点。为此,本发明提供一种基于球形核酸信号放大机制的数字式流式微球生化分析方法。
发明内容
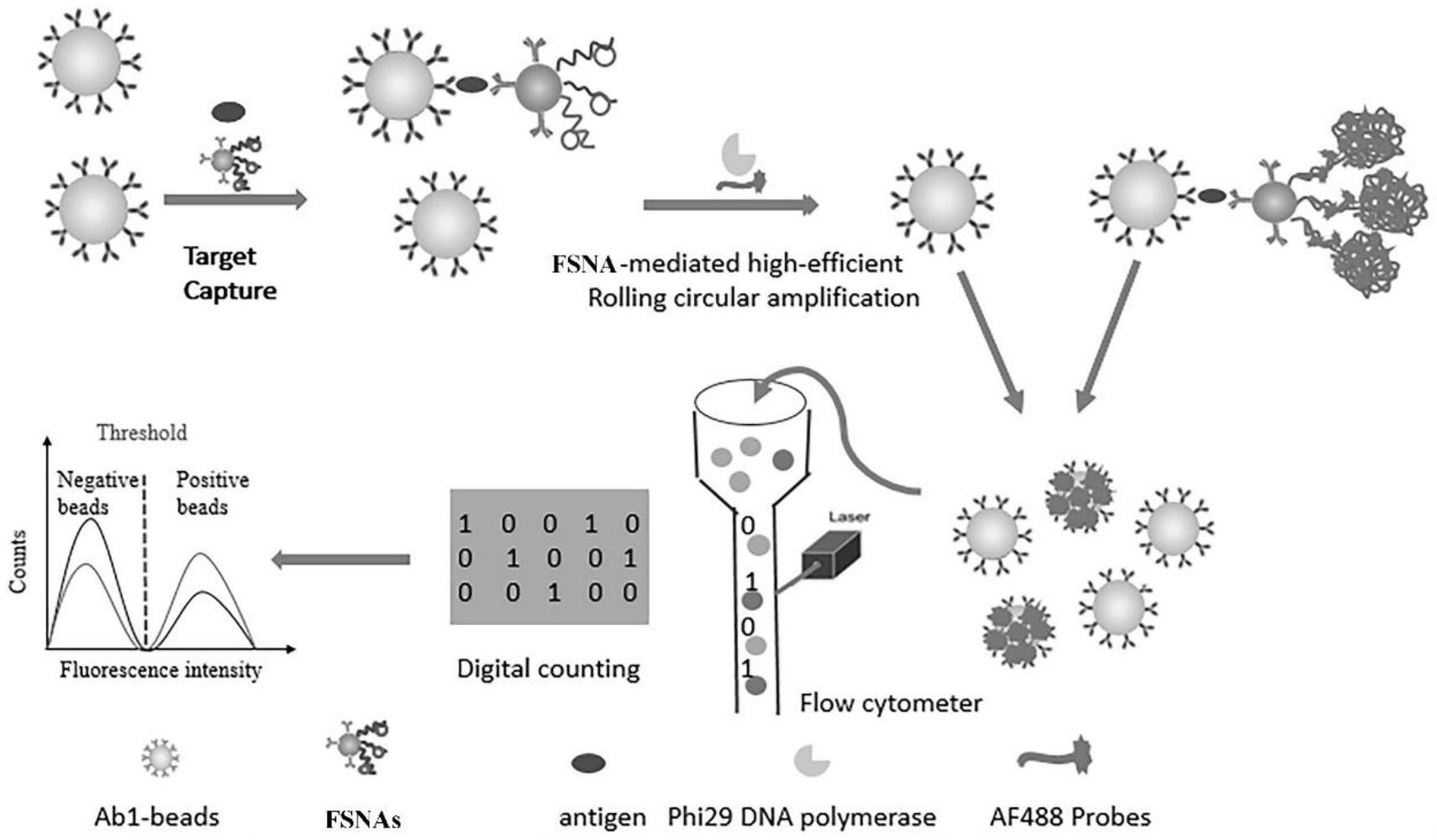
针对上述技术问题,本发明提供了一种基于球形核酸信号放大机制的数字式流式微球生化分析方法,利用非微室依赖的微球作为完全开放的独立反应载体,通过泊松分布,在其表面负载1个或0个靶标蛋白分子或外泌体,利用金纳米颗粒为载体同时负载靶标蛋白或外泌体特异性识别元件和高密度的核酸扩增引物形成的功能化球形核酸作为识别以及蛋白/外泌体-核酸信号转换和放大元件,利用高效的核酸扩增来放大蛋白及外泌体的信号,克服了蛋白和外泌体缺乏类似核酸的信号放大机制的技术难题,以功能化球形核酸作为中间体极大地提高蛋白/外泌体到核酸的转换效率,单靶标分子引发的核酸扩增和荧光信号的富集足够点亮单个微球,利用简单的仪器和操作即可实现靶标蛋白或外泌体的数字式分析。
本发明提供一种基于球形核酸信号放大机制的数字式流式微球生化分析方法,其特征在于,包括以下步骤:
S1,制备同时负载识别元件和核酸探针的功能化球形核酸;将特异性识别靶标标志物分子的捕获抗体或适配体负载于磁性微球上,得到功能化磁性微球;
S2,通过S1功能化磁性微球的捕获抗体或适配体特异性地与靶标标志物分子结合,形成负载1个或0个靶标标志物分子的磁性微球;
S3,通过S2磁性微球上的靶标标志物分子特异性与S1功能化球形核酸的识别元件进行结合,形成磁性微球-单个靶标标志物分子-功能化球形核酸的三明治复合结构;
S4,在S3的三明治复合结构的单个靶标标志物分子上引发滚环扩增反应,并富集荧光团从而点亮对应的磁性微球,即为阳性荧光磁性微球;而S2中负载0个靶标标志物分子的磁性微球不会引发滚环扩增反应和富集荧光团,即为阴性荧光磁性微球;
S5,利用流式细胞仪区分S4中的阳性荧光磁性微球和阴性荧光磁性微球,根据阳性荧光微球的个数或比例实现靶标标志物的数字式分析。
优选的,S1中,所述识别元件为检测抗体或适配体。
优选的,所述检测抗体包括前列腺特异性抗原(PSA)、甲胎蛋白(AFP)、癌胚抗原(CEA)、心肌肌钙蛋白I(cTnI)蛋白的特异性检测抗体,所述适配体包括外泌体膜蛋白CD63适配体、HER2适配体、EpCAM适配体、PSA适配体。
优选的,S1中,所述捕获抗体或适配体通过基团反应或链霉亲和素与生物素之间的结合负载于磁性微球上。
优选的,所述基团反应为氨基与羧基的反应、氨基与环氧基的反应、氨基与醛基的反应、氨基与酯基的反应中的一种。
优选的,所述捕获抗体包括前列腺特异性抗原(PSA)、甲胎蛋白(AFP)、癌胚抗原(CEA)、心肌肌钙蛋白I(cTnI)蛋白的特异性捕获抗体,所述适配体包括外泌体膜蛋白CD63适配体、HER2适配体、EpCAM适配体、PSA适配体。
优选的,S2中,所述靶标标志物分子为蛋白分子或外泌体。
优选的,S2中,当靶标标志物分子的个数低于磁性微球的个数时,根据泊松分布原理,每个磁性微球上负载1个或0个靶标标志物分子。
优选的,S4中,所述功能化球形核酸表面负载的高密度核酸探针引发核酸扩增为滚环扩增反应(RCA)、引物交换反应(PER)等延伸扩增机制中的任意一种或其组合。
与现有技术相比,本发明的有益效果在于:
1、本发明以粒径均一的磁性微球为载体,在磁性微球表面负载抗体或适配体,在超微靶标标志物分子浓度时,基于泊松分布,一个磁性微球表面的抗体或适配体能特异性地结合单个靶标蛋白分子或外泌体,然后通过引入功能化球形核酸进行三明治式夹心反应,将蛋白或外泌体浓度信息转化为核酸定量信息,进而利用高效核酸扩增技术,使得单个靶标蛋白分子或外泌体在磁性微球表面引发大量的核酸扩增和富集足够的荧光信号点亮该单个磁性微球,即为阳性荧光信号(阳性微球)。而没有结合靶标蛋白分子或外泌体的磁性微球,无法结合功能化球形核酸和引发核酸扩增以及富集荧光信号,呈现出阴性荧光信号(阴性微球)。利用流式细胞仪即可对阳性微球和阴性微球进行明显区分,通过计数阳性微球的个数实现靶标蛋白或外泌体的数字式分析,本发明机理如图1所示。
2、本发明以粒径均一的微球作为全开放的独立载体单元,无需任何微孔或微乳等封闭微反应器分配靶标蛋白分子或外泌体以及进行信号产生反应,且各种表面功能化的微球易获取,稳定性高,适用于各种反应介质和核酸扩增方法;此外,本发明无需依赖各种制备微反应器的特殊设备,操作简单且普适高效。
3、本发明通过引入负载高密度核酸扩增引物探针的球形核酸作为信号转换和放大元件,极大地提高靶标到核酸的转换效率,使得单个靶标蛋白分子/外泌体负载的磁性微球表面沉积的荧光信号显著高于阴性微球,利用临床和普通实验室广泛配置的流式细胞仪即可对阳性微球和阴性微球进行显著差异化区分。
附图说明
图1是本发明的机理图;
图2是实施例1中阳性微球随前列腺特异性抗原(PSA)浓度变化的前向散射光(FSC)强度和FL1通道荧光强度关系散点图。
图3是实施例1中阳性微球比例随PSA浓度变化的标准曲线图。
图4是实施例2中阳性微球随外泌体(exosome)浓度变化的前向散射光(FSC)强度和FL1通道荧光强度关系散点图。
图5是实施例2中阳性微球比例随exosome浓度变化的标准曲线图。
具体实施方式
下面结合附图和实施例对本发明进一步详细说明,但本发明的保护范围不仅限于这些实施例。
实施例1
以基于三明治式夹心免疫反应检测PSA分子为例,其数字式分析方法如下:
1、以金纳米颗粒为载体,在其表面负载PSA特异性检测抗体和高密度5’巯基标记的滚环扩增引物探针(核酸序列为:SH-CCCCCCCCCCTAGCTGAGGATAGGACATAATAGCT)制备特异性识别PSA的功能化球形核酸。
2、将biotin(生物素)修饰的PSA特异性捕获抗体与约1.8×10
3、将步骤2反应后的微球进行磁分离,向分离后的微球加入步骤(1)所得的功能化球形核酸,并加入PSA分子和PBST-BSA缓冲溶液(1×PBS,0.1%Tw-20,1%BSA),使体系的终体积为10μL,并控制体系中功能化球形核酸的浓度为60pM,PSA分子的浓度分别为0(Blank)、10fg/mL、50fg/mL、100fg/mL、500fg/mL、1pg/mL、2pg/mL、5pg/mL、10pg/mL,室温下进行免疫反应,反应时间为2h,使每个微球上负载1个或0个PSA分子。
4、将步骤3反应后的微球进行磁分离,向分离后的微球中加入10nM滚环扩增的环形探针模板(核酸序列为:GAACGGTGTCTATTATGTCCTATCCTCAGCTATTATGTCCTATCCTCAGCTATTATGTCCTATCC)和PBST-BSA缓冲溶液,室温下反应1h。
5、将步骤4反应后的微球进行磁分离,向分离后的微球中加入脱氧核糖核苷酸三磷酸(dNTP)、phi29DNAploymerase和phi29缓冲溶液,使体系的终体积为10μL,并控制体系中dNTP的浓度各为0.25mM、phi29DNA ploymerase为5U,在37℃下以环形探针为模板进行核酸延伸扩增反应,反应时间为2h。反应完后磁分离,加入两条3’端标记亮绿色荧光染料(AlexaFluor488,AF488)的核酸探针A和B(核酸序列分别为:TATTATGTCCTATCCTCAGC-AF488,CTGTCCAAGGAACGGTGTCTATT-AF488)、PBST-BSA缓冲溶液,使体系的终体积为10μL,并控制体系中核酸探针A和B的浓度均为500nM,4℃下反应1h,使核酸探针A和B与滚环扩增的延伸产物杂交并富集荧光信号,使负载有1个PSA分子的微球呈现阳性荧光信号,负载0个PSA分子的微球呈现阴性荧光信号。
6、利用流式细胞仪收集不同浓度PSA对应样品中1万个微球的FL1通道的荧光信号,统计出阳性荧光信号微球(简称阳性微球)和阴性荧光信号微球(简称阴性微球)的个数,并绘制阳性微球比例(PercentageofPositiveBeads,PPB)随PSA浓度(C
实施例2
以基于三明治式夹心反应检测HepG2exosome为例,具体数字式分析方法如下:
1、以金纳米颗粒为载体,在其表面同时负载3’巯基标记的外泌体膜蛋白CD63适配体(核酸序列为:CACCCCACCTCGCTCCCGTGACACTAATGCTACTTTTTTTTTT-SH)和高密度5’巯基标记的滚环扩增引物探针(核酸序列为:SH-CCCCCCCCCCTAGCTGAGGATAGGACATAATAGCT)制备特异性识别exosome的功能化球形核酸。
2、将3’端标记biotin(生物素)CD63适配体(核酸序列为:CACCCCACCTCGCTCCCGTGACACTAATGCTACCCCCCCCCC-biotin)与约1.8×10
3、将步骤2反应后的微球进行磁分离,向分离后的微球中加入步骤(1)所得的功能化球形核酸,并加入exosome和PBST-BSA缓冲溶液(1×PBS,0.1%Tw-20,1%BSA),使体系的终体积为10μL,并控制体系中功能化球形核酸的浓度为300pM,exosome的浓度分别为0(Blank)、1.8×10
4、将步骤3反应后的微球进行磁分离,向分离后的微球中加入10nM滚环扩增的环形探针模板(核酸序列为:GAACGGTGTCTATTATGTCCTATCCTCAGCTATTATGTCCTATCCTCAGCTATTATGTCCTATCC)和PBST-BSA缓冲溶液,室温下反应1h。
5、将步骤4反应后的微球进行磁分离,向分离后的微球中加入脱氧核糖核苷酸三磷酸(dNTP)、phi29DNAploymerase和phi29缓冲溶液,使体系的终体积为10μL,并控制体系中dNTP的浓度为0.25mM、phi29DNA ploymerase为5U,在37℃下以环形探针为模板核酸延伸扩增反应,反应时间为2h。反应完后磁分离,加入两条3’端标记亮绿色荧光染料(AlexaFluor488,AF488)的核酸探针A和B(核酸序列分别为:TATTATGTCCTATCCTCAGC-AF488,CTGTCCAAGGAACGGTGTCTATT-AF488)、PBST-BSA缓冲溶液,使体系的终体积为10μL,并控制体系中核酸探针A和B的浓度均为500nM,4℃下反应1h,使核酸探针A和B与滚环扩增的延伸产物杂交并富集荧光信号,使负载有1个exosome的微球呈现阳性荧光信号,负载0个exosome的微球呈现阴性荧光信号。
6、利用流式细胞仪收集不同浓度exosome对应样品中1万个微球的FL1通道的荧光信号,统计出阳性荧光信号微球(简称阳性微球)和阴性荧光信号微球(简称阴性微球)的个数,并绘制阳性微球比例(PercentageofPositive Beads,PPB)随exosome浓度(C
需要指出,对于不同的蛋白或外泌体标志物,针对特定的靶标分子,本发明方法只需选取与之对应的特异性识别探针,其余步骤均完全按照上述相似的检测过程即可实现特定靶标蛋白或外泌体生物标志物的数字式分析。
- 基于球形核酸的级联信号放大高灵敏检测外泌体
- 基于核酸常温等温扩增放大信号系统的均相免疫分析方法
