N-甲基苯胺喹啉类化合物及其合成方法和应用
文献发布时间:2024-04-18 19:52:40
技术领域
本发明属于医药技术领域,具体涉及一种N-甲基苯胺喹啉类化合物及其合成方法和应用。
背景技术
组学的发展极大加快了肿瘤靶向治疗的步伐,帮助科学家发现更多潜在的治疗靶点。研究表明,胆碱代谢异常是胰腺癌代谢重编程的突出特征。胆碱激酶(ChoK)是一种胞质酶,是胆碱代谢通路第一步的反应酶,其通过磷酸化胆碱生成磷酸胆碱并使其进入肯尼迪途径(Kennedy pathway),用于磷脂酰胆碱(PtdCho)的合成,而PtdCho是哺乳动物细胞膜中丰度很高的一类磷脂。在胆碱代谢中,胆碱首先转化成磷酸胆碱(PCho),后者随后与CTP反应形成3-磷酸胆碱。ChoK活性的增加导致PCho水平增高,而PCho在增殖中具有第二信使的作用。PCho可转移到二酰基甘油上生成PtdCho,该途径是PtdCho的主要来源。在哺乳动物中,胆碱激酶家族由两种亚型构成:胆碱激酶α(ChoKα)和胆喊激酶β(ChoKβ)。ChoKα已鉴定为介导人类细胞转化并诱导体内肿瘤发生的原癌基因。
已有多项研究表明,在多种不同类型的肿瘤(包括肺癌、结肠癌、乳腺癌、前列腺癌、膀胱癌、卵巢癌)以及在不同的人癌细胞系中,ChoKα表达增高。另外,ChoKα强制过表达可加重肿瘤的形成及侵袭转移。有研究显示在肝细胞癌中,ChoKα表达水平高的肿瘤具有更强的侵袭性表型,且肿瘤患者术后生存时间更短。与对照组相比,稳定过表达ChoKα的肝癌细胞株具有更高的迁移和侵袭水平,能够在小鼠中形成更大的异种移植瘤并伴有更多的转移。还有研究表明,ChoKα的过表达可增强人乳腺癌细胞的浸润性和对5-氟尿嘧啶的耐药性。在膀胱癌的鼠模型研究中,ChoKα过表达与更大、更易转移的肿瘤相关,并导致更具侵袭性的肿瘤类型。在越来越多的癌症中,ChoKα的表达和活性已被描述为肿瘤侵袭性的强有力生物标志物。此外,ChoKα的高表达也与不良临床结果和较高的肿瘤病理分级有关。
ChoKα作为下游部分受到许多致癌通路的激活与调控,比如ras,src,mos。在肿瘤细胞中,抑制ChoKα可导致PCho水平降低,最终导致PtdCho和鞘磷脂(SM)合成缺陷。PtdCho和SM合成缺陷可这通过降低存活信号及升高细胞内神经酰胺胞水平而导致细胞凋亡的增加;另外,还可以通过下调MAPK和PI3K/AKT信号通路抑制细胞增殖。
为此,已有人提出使用ChoKα作为癌症发展的预后标记物以及开发新型肿瘤治疗药物的靶点。在以往的研究中,ChoKα的小干扰RNA(SiRNA)或小发夹RNA质粒(shRNA)的使用可在体外降低细胞内PCho水平并在体外降低不同癌细胞系的活力,而不影响正常原代细胞。并且,在体内实验中已证实ChoKα缺失可导致肿瘤生长减弱。
RSM-932A(TCD-717)是ChoKα特异性的小分子抑制剂。RSM-932A是针对ChoKα的“人类首创”化合物。RSM-932A具有有效的体外抗肿瘤增殖和体内抗肿瘤活性。临床试验调研发现RSM-932A在实体瘤治疗中完成临床I期,然而未披露结果。ChoKα已被证明通过胆碱代谢进而影响肿瘤的脂质代谢等促进多种肿瘤的进展,针对ChoKα的特异性小分子抑制剂研究甚少,有极大的开发前景。
因此,非常需要开发提供ChoK的高抑制活性的化合物,以允许将其用于上述疾病的治疗。
发明内容
为了解决上述技术问题,本发明提供了一种N-甲基苯胺喹啉类化合物及其合成方法和应用。
本发明是这样实现的,首先提供一种N-甲基苯胺喹啉类化合物,其SMILES结构式为:C1=CC2[N
优选的,所述R
进一步优选,该种化合物中,R
进一步优选,CHKI-03的合成方法,包括如下步骤:
S1-1、将4-氯苯基-甲基-胺(01)和4-溴喹啉(02)溶于冰醋酸中,在Ar保护下,加热条件下反应一定时间后加水淬灭,用乙酸乙酯萃取,萃取后的有机层用饱和氯化钠洗若干次,无水硫酸钠干燥后采用柱层析分离,洗脱剂为石油醚-乙酸乙酯,得淡黄色油状物4-[(4-氯苯基)(甲基)氨基]喹啉(03),上述反应化学方程式如下:
S1-2、向4-(羟基甲基)苯酚(04)中依次加入二乙二醇双对甲苯磺酸酯和碳酸钾,再加入乙腈,Ar保护下,一定温度条件下回流反应一定时间,反应体系至浑浊,冷却至室温后,过滤,滤饼用乙酸乙酯洗若干次,然后合并滤液,用饱和氯化铵溶液和饱和氯化钠溶液各洗若干次,无水硫酸钠干燥后柱层析分离,洗脱剂为二氯甲烷-甲醇,得白色固体粉末[4-({2-[(2-{[4-(羟基甲基)苯基]氧基}乙基)氧基]乙基}氧基)苯基]甲醇(05),上述反应化学方程式如下:
S1-3、向[4-({2-[(2-{[4-(羟基甲基)苯基]氧基}乙基)氧基]乙基}氧基)苯基]甲醇(05)中加入HBr:二氯甲烷体积比为1:3的混合溶液,于室温下反应一定时间,至反应体系逐渐变得澄清后加水,用二氯甲烷萃取,二氯甲烷层用饱和碳酸氢钠水溶液洗若干次,饱和食盐水洗若干次,后除去二氯甲烷,得白色固体(3E)-3-(溴甲基)戊-1,3-二烯2-[(2-{[4-(溴甲基)苯基]氧基}乙基)氧基]乙-1-醇(06),直接用于投下一步,上述反应化学方程式如下:
S1-4、将(3E)-3-(溴甲基)戊-1,3-二烯2-[(2-{[4-(溴甲基)苯基]氧基}乙基)氧基]乙-1-醇(06)和4-[(4-氯苯基)(甲基)氨基]喹啉(03)溶于无水乙腈,于一定温度微波条件下反应一定时间,至反应体系橘黄色澄清透明,冷却至室温后有淡黄色固体析出,减压条件下除去溶剂,再加入乙醚超洗,直接抽滤得黄色固体CHKI-03,上述反应化学方程式如下:
进一步优选,该种化合物中,R
进一步优选,CHKI-05的合成方法,包括如下步骤:
S2-1、向4-(羟基甲基)苯酚(07)中依次加入1,2-双甲苯氧基乙烷和碳酸钾,再加入乙腈,Ar保护下,于一定温度条件下回流反应一定时间,至反应体系浑浊,冷却至室温后,过滤,滤饼用乙酸乙酯洗若干次后合并滤液,用饱和氯化铵溶液和饱和氯化钠溶液各洗若干次,无水硫酸钠干燥后柱层析分离,洗脱剂为二氯甲烷-甲醇,得白色固体粉末{4-[(2-{[4-(羟基甲基)苯基]氧基}乙基)氧基]苯基}甲醇(08),上述反应化学方程式如下:
S2-2、向{4-[(2-{[4-(羟基甲基)苯基]氧基}乙基)氧基]苯基}甲醇(08)中加入HBr:二氯甲烷体积比为1:3的混合溶液,于室温下反应一定时间,至体系逐渐变得澄清后加水,用二氯甲烷萃取,二氯甲烷层后饱和碳酸氢钠水溶液洗若干次,饱和食盐水洗若干次,后除去二氯甲烷,得白色固体4-(溴甲基)-1-[(2-{[4-(溴甲基)苯基]氧基}乙基)氧基]苯(09),直接用于投下一步,上述反应化学方程式如下:
/>
S2-3、将4-(溴甲基)-1-[(2-{[4-(溴甲基)苯基]氧基}乙基)氧基]苯(09)和4-[(4-氯苯基)(甲基)氨基]喹啉(03)溶于无水乙腈,于一定温度微波条件下反应一定时间,至体系橘黄色澄清透明,冷却至室温后有淡黄色固体析出,减压条件下除去溶剂,后加入一定无水乙醚打浆,抽滤得黄色固体,即为CHKI-05,上述反应化学方程式如下:
本发明还提供一种胆碱激酶抑制剂,包括上述的N-甲基苯胺喹啉类化合物或其盐或其衍生物。
本发明还提供一种抗癌药物,其活性成分为上述的N-甲基苯胺喹啉类化合物或其盐或其衍生物。
本发明还提供了上述抗癌药物的应用,用于黑素瘤、骨髓瘤、白血病、淋巴瘤、成神经细胞瘤,或选自结肠、乳腺、胃、卵巢、子宫颈、肺、中枢神经系统、肾、前列腺、膀胱或胰腺的癌症的治疗。
与现有技术相比,本发明的优点在于:
本发明提供的N-甲基苯胺喹啉类化合物中,化合物I(CHKI-03)较化合物RSM-932A具有更强的抑制ChoKα的活性,化合物II(CHKI-05)抑制ChoKα的活性与RSM-932A相当。因此,本发明提供的N-甲基苯胺喹啉类化合物能够作为胆碱激酶抑制剂,用于胆碱激酶的抑制及癌症的治疗。
附图说明
图1为CHKI-03的核磁共振谱图解析;
图2为CHKI-03的液相图谱;
图3为CHKI-03的质谱图谱;
图4为CHKI-05的核磁共振谱图解析;
图5为CHKI-05的液相图谱;
图6为CHKI-05的质谱图谱;
图7为CHKI对细胞活力的影响;
图8为CHKI对细胞中CHoK活力的影响;
图9为CHKI-03对胰腺癌肝转移的影响;
图10为CHKI-03对胰腺肿瘤增殖的影响;
图11为CHKI-03对胰腺肿瘤生长大小的统计;
图12为CHKI-03及药用组合对人胰腺PDX模型小鼠皮下移植瘤大小的影响;
图13为CHKI-03及药用组合对小鼠体内肿瘤大小影响的统计。
具体实施方式
为了使本发明的目的、技术方案及优点更加清楚明白,下面结合附图及实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用于解释本发明,并不用于限定本发明。
实施例1、
本实施例提供一种N-甲基苯胺喹啉类化合物,其SMILES结构式为:C1=CC2[N
本实施例中,x=1,命名为CHKI-03,其化学结构如式(I):
化学名称为:1'-[氧双(乙烷-2,1-二基)双(氧基)双(4,1-亚苯基))双(亚甲基)]双[4-(4-氯-N-甲基苯胺)喹啉]二溴化物。
制备CHKI-03的方法包括如下步骤:
S1-1、将4-氯苯基-甲基-胺(01)(3.46g,24.4mmol)和4-溴喹啉(02)(2.0g,12.2mmol)溶于冰醋酸中,在Ar保护下,130℃条件下反应约3h,然后加20ml水淬灭,用乙酸乙酯萃取,萃取后的有机层用饱和氯化钠洗3次,无水硫酸钠干燥后采用柱层析分离,洗脱剂为石油醚-乙酸乙酯,得淡黄色油状物4-[(4-氯苯基)(甲基)氨基]喹啉(03),上述反应化学方程式如下:
/>
S1-2、向位于圆底烧瓶中的4-(羟基甲基)苯酚(04)(200mg,1.61mmol)中依次加入二乙二醇双对甲苯磺酸酯(331mg,0.80mmol)和碳酸钾(445mg,3.22mmol),再加入乙腈(MeCN),Ar保护下,90℃温度条件下回流反应约4h,反应体系至浑浊,冷却至室温后,过滤,滤饼用5ml乙酸乙酯洗两次,然后合并滤液,用饱和氯化铵溶液和饱和氯化钠溶液各洗两次,无水硫酸钠干燥后柱层析分离,洗脱剂为二氯甲烷-甲醇,得白色固体粉末[4-({2-[(2-{[4-(羟基甲基)苯基]氧基}乙基)氧基]乙基}氧基)苯基]甲醇(05),上述反应化学方程式如下:
S1-3、将[4-({2-[(2-{[4-(羟基甲基)苯基]氧基}乙基)氧基]乙基}氧基)苯基]甲醇(05)(175mg)加入到圆底烧瓶中,再向圆底烧瓶中加入HBr(百分含量47%):二氯甲烷体积比为1:3的混合溶液2ml,于室温下反应1h,至反应体系逐渐变得澄清后加水,用二氯甲烷萃取,二氯甲烷层用饱和碳酸氢钠水溶液洗两次,饱和食盐水洗两次,后除去二氯甲烷,得白色固体(3E)-3-(溴甲基)戊-1,3-二烯2-[(2-{[4-(溴甲基)苯基]氧基}乙基)氧基]乙-1-醇(06),直接用于投下一步(化合物06不稳定,应现用现制,或置于-40℃条件下保存),上述反应化学方程式如下:
S1-4、将(3E)-3-(溴甲基)戊-1,3-二烯2-[(2-{[4-(溴甲基)苯基]氧基}乙基)氧基]乙-1-醇(06)(50mg,0.11mmol)和4-[(4-氯苯基)(甲基)氨基]喹啉(03)(60.3mg,0.22mmol)溶于1ml无水乙腈,于110℃温度微波条件下反应2h,至反应体系橘黄色澄清透明,冷却至室温后有淡黄色固体析出,减压条件下除去溶剂,再加入1ml乙醚超洗1min,直接抽滤得黄色固体CHKI-03,上述反应化学方程式如下:
将实施例1获得的CHKI-03进行核磁共振和HPLC-MS检测,获得核磁共振谱图如图1所示、液相质谱图谱如图2、图3所示。图1用于结构鉴定,图2、图3用于纯度以及结构确认。图1中核磁共振谱图的氢谱和碳谱数据如下:
1
13
由此,CHKI-03的分子式为C
实施例2、
本实施例提供一种N-甲基苯胺喹啉类化合物,其SMILES结构式为:C1=CC2[N
本实施例中,x=0,命名为CHKI-05,其化学结构如式(Ⅱ):
化学名称为:1,1’-[(乙烷-1,2-二基双氧基)双(4,1-亚苯基)双(亚甲基)]双[4-(4-氯-N-甲基苯胺)喹啉]二溴化物。
CHKI-05的合成方法包括如下步骤:
S2-1、向位于圆底烧瓶中的4-(羟基甲基)苯酚(07)(200mg,1.61mmol)中依次加入1,2-双甲苯氧基乙烷(296mg,0.80mmol)和碳酸钾(445mg,3.22mmol),再加入2ml乙腈,Ar保护下,于90℃条件下回流反应约4h,至反应体系浑浊,冷却至室温后,过滤,滤饼用乙酸乙酯洗两次后合并滤液,用饱和氯化铵溶液和饱和氯化钠溶液各洗两次,无水硫酸钠干燥后柱层析分离,洗脱剂为二氯甲烷-甲醇,得白色固体粉末{4-[(2-{[4-(羟基甲基)苯基]氧基}乙基)氧基]苯基}甲醇(08),上述反应化学方程式如下:
S2-2、向{4-[(2-{[4-(羟基甲基)苯基]氧基}乙基)氧基]苯基}甲醇(08)加入到圆底烧瓶中,再加入HBr(47%):二氯甲烷体积比为1:3的混合溶液,于室温下反应1h,至体系逐渐变得澄清后加水,用二氯甲烷萃取,二氯甲烷层后饱和碳酸氢钠水溶液洗两次,饱和食盐水洗两次,后除去二氯甲烷,得白色固体4-(溴甲基)-1-[(2-{[4-(溴甲基)苯基]氧基}乙基)氧基]苯(09),直接用于投下一步(化合物09不稳定,应现用现制,或置于-40℃条件下保存),上述反应化学方程式如下:
S2-3、将4-(溴甲基)-1-[(2-{[4-(溴甲基)苯基]氧基}乙基)氧基]苯(09)(200mg,0.5mmol)和4-[(4-氯苯基)(甲基)氨基]喹啉(03)(268mg,1.0mmol)溶于5ml无水乙腈,于110℃微波条件下反应2h,至体系橘黄色澄清透明,冷却至室温后有淡黄色固体析出,减压条件下除去溶剂,后加入1ml无水乙醚打浆,抽滤得黄色固体,即为CHKI-05,上述反应化学方程式如下:
将实施例2获得的CHKI-05进行检测,检测方法按实施例1进行,获得核磁共振谱图如图4和液相质谱图谱如图5、图6所示。图4用于结构鉴定,图5、图6用于纯度以及结构确认。图4中核磁共振谱图的氢谱和碳谱数据如下:
1
13
HRMS calcd.For C48H42Cl2N4O22+m/z 388.13,found 388.13287.
由此,CHKI-05的分子式为C
实施例3、
采用CCK8法测定实施例1和实施例2获得的化合物处理后细胞的活力:
取生长状态良好的胰腺癌细胞PANC-1和SW1990细胞。消化,收集和计数细胞,并按照6000细胞/孔播种到96孔板,并在37℃条件下孵育过夜。在每个孔中加入不同浓度(100,50,25,12.5,6.25,3.125,1.56,0.78,0.36,0.18μM)的RSM-932A(购自MCE公司)、CHKI-03和CHKI-05,孵育72h。每孔加10μL CCK8溶液。37℃孵育2h后,用酶标仪在450nm处测定吸光度。每次分析包括6个重复孔,至少进行了3次独立实验。用SPSS软件分别计算细胞增殖抑制率和IC50。IC50半数抑制是用来衡量抗体灵敏度的,IC50半数抑制越低,说明抗体的灵敏度越高。
增殖抑制率=[(对照组D450—实验组D450)/对照组D405]×100%。
如图7所示为各组试验细胞增殖抑制率的折线图,从图中可知,在胰腺癌细胞SW1990和PANC-1中比较RSM-932A、CHKI-03、CHKI-05对肿瘤的增殖的抑制作用,PANC-1对CHKI更敏感。在PANC-1细胞中,CHKI-03和CHKI-05作用效果相当,均优于RSM-932A。在SW1990细胞中,CHKI-03抑制细胞活力的能力优于CHKI-05及RSM-932A。根据抑制率曲线,计算出化合物对细胞抑制的IC50,如表1所示。
IC50结果如表1所示。
表1
结果显示,在两种细胞系PANC-1、SW1990中,本发明制备的两种化合物CHKI都具有抑制细胞活力的功能。其中,SW1990细胞对CHKI-03、CHKI-05的敏感性较RSM-932A分别提高了2.3倍和1.06倍,PANC-1中则提高了6.56倍和4.46倍。综上,相较于CHKI-05和RSM-932A,CHKI-03具有更强的抑制细胞活力的作用。
实施例4、
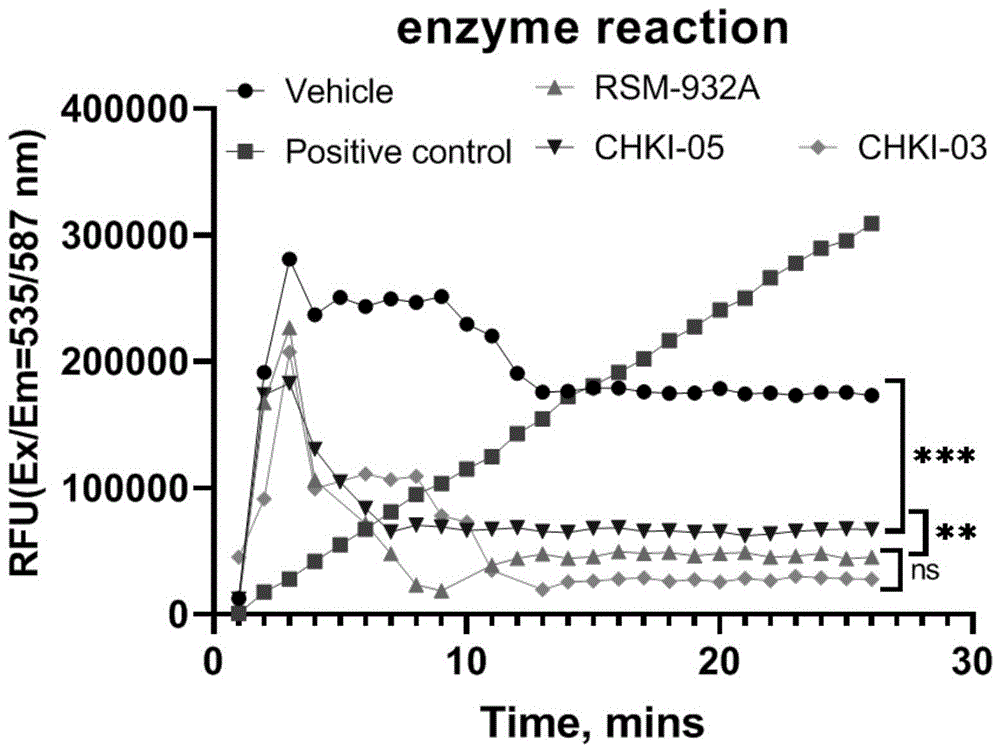
采用胆碱激酶活力测定试剂盒对胆碱激酶活性检测,试剂盒购自Abcam,Cat#AB239729。胆碱被胆碱激酶磷酸化产生一系列中间体,这些中间体与荧光探针反应产生强烈的荧光信号(Ex/Em=535/587nm)。该信号与生物样品中存在的胆碱激酶活性成正比。该测定方法快速、灵敏、重现性好,适用于测定不同细胞和其他生物样品中的胆碱激酶活性,该试剂盒可检测低至0.5μM的胆碱激酶活性。
4.1样本准备:
1)接种胰腺癌细胞PANC-1、SW1990细胞(5*10
2)收获细胞(5×10
3)离心(10,000x g,20min),转移上清至新管,吸取50μL上清于10K离心管中并加450μL Assay Buffer;
4)离心(10,000x g,20min),移去洗脱液,加500μL Assay Buffer于滞留物并再次离心,重复3次,收集沉淀估计体积;
5)使用Assay Buffer溶解20-100倍,取5-10μL稀释的上清于小室;阳性对照:稀释人类胆碱激酶(Human ChoK enzyme)100倍,加5μL于小室,用Assay Buffer调整至50μL;
4.2处理:
为每个孔准备50μL反应样品,加50μL反映样品于标准品、样本和阳性对照中。取50μL Sample Background Mix当作样本背景对照。
注:为了减少背景,先混合除了探针外的所有成分,孵育2分钟后再加入探针。
4.3:在动力学模型Ex/Em=535/587nm下,25°下测量荧光30分钟;
注:孵育时间取决于样品中胆碱激酶的酶活性。
4.4结果:参考图8所示,阳性对照组显示,该方法合理可行,可以根据利用ATP后产生的ADP间接反应CHoK酶活力。溶剂对照组显示,提取的蛋白中CHoK活性较高。CHoK抑制剂组,都对CHoK具有抑制作用。其中,CHKI-03的作用优于RSM-932A,然而优势不显著。通过对PANC-1细胞中CHoK活力的测定,说明CHKI-03、CHKI-05都具有抑制CHoK的活性,CHKI-03的效能要强于CHKI-05。
实施例5、CHKI-03对胰腺癌转移的抑制作用。
通过基础研究发现CHKA可以作为影响胰腺癌转移的重要靶点。因此,本发明还在体内进一步检测了CHKI-03对胰腺癌转移的抑制作用。
本实施例采用CFPAC-1-luc(荧光素酶标记)细胞系进行BALB/C-nu小鼠胰腺原位移植瘤的动物实验,考察CHKI-03对胰腺肿瘤肝转移的影响。实验过程:
(1)取对数生长期的CFPAC-1-luc胰腺癌细胞株,用胰酶消化并收集细胞并计数;
(2)将10只BALB/C-nu小鼠随机分为2组,每组5只:溶剂对照治疗组、CHKI-03治疗组。在裸鼠胰腺按1×10
(3)CHKI-03体内药敏实验:肿瘤细胞接种成功后密切观察小鼠生长情况,在接种第14天给予CHKI-03治疗,每周给药2-3次,连续给药3周(共8次),采用腹腔注射,剂量采用5mg/kg。治疗3周后,采用CO2窒息法处死小鼠,取出肿瘤测量大小和重量。比较各组肿瘤对CHKI-03的化疗敏感性及发生肝转移的情况,通过小动物成像对肝转移进行拍照。
(4)将固定好的胰腺癌肿瘤组织块进行脱水、透明、石蜡包埋、切片及H E染色。
研究表明CHKI-03显著抑制了胰腺肿瘤的肝转移(图9)及肿瘤的大小(图10、图11)。
实施例6、通过PDX模型验证CHKI-03及药物组合对胰腺癌的抑制作用。
利用构建的胰腺癌患者胰腺原位肿瘤、癌周脂肪浸润肿瘤及胰腺癌肝转移肿瘤构建的PDX模型,可以评价CHKI-03对转移型细胞的抑制效果是否强于胰腺原位肿瘤。同时,将CHKI-03与其他药物(雷帕霉素等)进行联用,探究药物组合对胰腺肿瘤的抑制效果。实验过程:
(1)复苏在液氮中保存的胰腺原位肿瘤、癌周脂肪浸润肿瘤及胰腺癌肝转移肿瘤PDX模型组织块,切割成2mm
(2)将75只BALB/C-nu小鼠随机分为3大组,分别是胰腺原位肿瘤组(25只)、癌周脂肪浸润肿瘤组(25只)及胰腺癌肝转移肿瘤组(25只)。每大组进行相应的药物治疗,5个处理,分别是:溶剂对照治疗组、雷帕霉素(Rapamycin)组(2.5mg/kg,隔一天腹腔给药)、吉西他滨(GEM)组(50mg/kg,隔两天腹腔给药)、CHKI-03组(5mg/kg,隔两天腹腔给药)、CHKI-03+Rapamycin组(给药剂量及给药方式同上)。
(3)体内药敏实验:肿瘤组织接种成功后密切观察小鼠生长情况,在接种第14天给予相应治疗,治疗3周后,采用CO2窒息法处死小鼠,取出肿瘤测量大小和重量。比较各组肿瘤对药物及药物组合的化疗敏感性。
(4)将固定好的胰腺癌肿瘤组织块进行脱水、透明、石蜡包埋、切片及H E染色。
通过对CHKI-03、GEM、Rapamycin及CHKI-03+Rapamycin联用抑制体内肿瘤效果的研究,显示CHKI-03对肿瘤的抑制作用明显强于GEM及Rapamycin,单独使用Rapamcin对肿瘤的抑制效果不显著,当联用CHKI-03及Rapamycin对肿瘤的抑制作用效果显著增强(图12、图13)。
从实施例3、实施例4、实施例5及实施例6可知,本发明提供的N-甲基苯胺喹啉类化合物或其盐或其衍生物可以作为胆碱激酶抑制剂;且可以作为抗癌药物的活性成分,具体的,该种抗癌药物可用于黑素瘤、骨髓瘤、白血病、淋巴瘤、成神经细胞瘤,或选自结肠、乳腺、胃、卵巢、子宫颈、肺、中枢神经系统、肾、前列腺、膀胱或胰腺的癌症的治疗。
以上所述,仅是本发明的较佳实施例而已,并非是对本发明做其它形式的限制,任何本领域技术人员可以利用上述公开的技术内容加以变更或改型为等同变化的等效实施例。但是凡是未脱离本发明技术方案内容,依据本发明的技术实质对以上实施例所作的任何简单修改、等同变化与改型,仍属于本发明技术方案的保护范围。
