含氮链状化合物、其制备方法、包含其的组合物和应用
文献发布时间:2024-04-18 19:58:21
技术领域
本发明涉及含氮链状化合物、其制备方法、包含其的组合物和应用。
背景技术
核酸药物为现今基础和应用研究的一个重要方向。核酸药物可用于对病毒及细菌感染性疾病、肿瘤、代谢性疾病等的预防和/或治疗,其生产成本更低且周期更短,有利于快速开发个性化药物。然而,核酸为荷负电的大分子,难以透过细胞膜,同时核酸稳定性不佳,通过开发各种核酸包装和递送系统可一定程度上克服核酸药物的不稳定性,提高其递送效率。
脂质纳米颗粒已被证明可用作递送生物活性物质(如小分子药物、蛋白质和核酸)进入细胞和/或细胞内区室的载体。通过设计及优化脂质纳米颗粒中的各组分的种类和用量,从而优化核酸药物递送系统对于提高核酸药物预防及治疗的功效具重要意义,尤其是可用于递送RNA预防剂和/或治疗剂的脂质化合物以及相关的方法和组合物。
发明内容
本发明旨在提供一种新的可用于递送核酸药物的可电离脂质化合物,增加可电离脂质化合物的种类及核酸预防剂和/或治疗剂递送载体的选择。为解决以上技术问题,本发明提供了一种含氮链状化合物、其制备方法、包含其的组合物和应用。本发明的组合物可用于高效递送核酸药物。
本发明的技术方案如下:
本发明提供了一种如式I所示的含氮链状化合物或其药学上可接受的盐,
X为C
Y为未取代的或被1个、2个或3个Y
各个Y
Z为未取代的或被1个、2个或3个Z
各个Z
A
R
各个R
R
各个R
R
各个R
R
各个R
当X为C
某一优选方案中,如式I所示的含氮链状化合物或其药学上可接受的盐中,某些基团的定义可如下所述,其他基团的定义可如其他任一方案所述(以下简称“某一优选方案中”):X中,所述C
某一优选方案中,X中,所述C
某一优选方案中,Y中,所述C
某一优选方案中,各个Y
某一优选方案中,各个Y
某一优选方案中,Z中,所述C
某一优选方案中,各个Z
某一优选方案中,各个Z
某一优选方案中,R
某一优选方案中,R
某一优选方案中,各个R
某一优选方案中,各个R
某一优选方案中,R
某一优选方案中,R
某一优选方案中,R
某一优选方案中,各个R
某一优选方案中,各个R
某一优选方案中,R
某一优选方案中,R
某一优选方案中,各个R
某一优选方案中,各个R
某一优选方案中,R
某一优选方案中,R
某一优选方案中,R
某一优选方案中,各个R
某一优选方案中,各个R
某一优选方案中,所述如式I所示的含氮链状化合物为如式Ia、Ib、Ic、Id或Ie所示的化合物
某一优选方案中,A
某一优选方案中,A
某一优选方案中,R
某一优选方案中,X为C
Y为C
Z为C
A
R
各个R
各个R
R
各个R
各个R
某一优选方案中,X为C
Y为C
Z为C
A
A
R
各个R
各个R
R
各个R
各个R
当X为C
某一优选方案中,X为C
Y为C
Z为C
A
A
R
R
各个R
某一优选方案中,X为C
Y为C
Z为C
A
A
R
各个R
各个R
R
各个R
各个R
当X为C
某一优选方案中,X为C
Y为C
Z为C
A
A
R
R
各个R
各个R
某一优选方案中,X为C
某一优选方案中,Y为C
某一优选方案中,Z为C
某一优选方案中,R
某一优选方案中,各个R
某一优选方案中,R
某一优选方案中,各个R
某一优选方案中,Y为C
某一优选方案中,Z为C
某一优选方案中,A
某一优选方案中,A
某一优选方案中,各个R
某一优选方案中,各个R
某一优选方案中,当X为C
某一优选方案中,X为
某一优选方案中,Y为
某一优选方案中,Z为
某一优选方案中,R
某一优选方案中,R
某一优选方案中,所述如式I所示的含氮链状化合物为如下任一化合物:
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
本发明还提供一种如式I所示的含氮链状化合物的制备方法,其包括如下步骤:溶剂中,在碱和碘盐存在下,如式I-1所示的化合物与如式I-2所示的化合物进行如下式所示的偶联反应,即可;
M为卤素,X、Y、Z、A
所述偶联反应中,所述卤素可为氟、氯、溴或碘,例如溴。
所述偶联反应中,所述如式I-1所示的化合物与所述如式I-2所示的化合物的摩尔比可为1:(1-2),例1:1.2。
所述偶联反应中,所述碱为本领域常规碱。所述碱可为碱式碳酸盐(盐中阳离子为碱金属离子,阴离子为碳酸根),例如K
所述偶联反应中,所述如式I-1所示的化合物与所述碱的摩尔比可为1:(1-5),例如1:3.5或1:2。
所述偶联反应中,所述碘盐为本领域常规碘盐。所述碘盐可为碱式碘盐,例如KI。
所述偶联反应中,所述如式I-1所示的化合物与所述碘盐的摩尔比可为1:(1-2),例如1:1.2或1:1。
所述偶联反应中,所述溶剂为本领域常规溶剂,所述溶剂可为醚类溶剂或/和腈类溶剂。所述醚类溶剂可为甲基叔丁基醚。所述腈类溶剂可为乙腈。所述腈类溶剂与醚类溶剂的体积比可为1:1。
所述偶联反应中,所述如式I-1所示的化合物与所述溶剂的质量体积比可为10mg/mL-65mg/mL,例如15mg/mL、25mg/mL、40mg/mL、58.5mg/mL、20mg/L、22mg/L或34mg/L。
所述偶联反应中,所述偶联反应的反应温度为本领域常规反应温度,优选为70℃-90℃,例如80℃。
本发明还提供一种脂质载体,其包括物质Z,所述物质Z为如前所述的如式I所示化合物或其药学可接受的盐。
某一优选方案中,所述脂质载体还包括稀释剂。
某一优选方案中,所述稀释剂可为磷酸盐缓冲液或Tris缓冲液等。
某一优选方案中,所述脂质载体还包括磷脂。
某一优选方案中,所述磷脂可为本领域常规磷脂,其为两性辅助性分子,有助于脂质颗粒和细胞膜的融合。所述磷脂可为具有带电极性端和脂肪链非极性端的磷脂类分子,例如二硬脂酰基磷脂酰胆碱(DSPC)、二肉豆蔻酰磷酸胆碱(DMPC)、二油酰磷酸胆碱(DOPC)、棕榈酰磷酸胆碱(DPPC)、1,2-二硬脂酰磷酸胆碱(DSPC)、二十一烷酰磷酸胆碱(DUPC)或棕榈酰磷酸胆碱(POPC)等。
某一优选方案中,所述脂质载体还包括PEG脂质(聚乙二醇修饰的脂质)。
某一优选方案中,所述PEG脂质可为具有聚乙二醇亲水端修饰的脂质分子。所述PEG脂质优选选自PEG修饰的磷脂酰乙醇胺、PEG修饰的磷脂酸、PEG修饰的神经酰胺、PEG修饰的二烷基胺、PEG修饰的二酰基甘油和PEG修饰的二烷基甘油中的一种或多种,例如PEG修饰的二肉豆蔻酰甘油(DMG-PEG2000)等。
某一优选方案中,所述脂质载体还包括甾醇。
某一优选方案中,所述甾醇可为本领域常规甾醇,所述甾醇包括动物性、植物性或菌类甾醇。所述甾醇选自胆固醇、谷甾醇、麦角甾醇、菜油甾醇、豆甾醇、芸苔甾醇、番茄碱、熊果酸和α-生育酚中的一种或多种,例如胆固醇等。
某一优选方案中,所述脂质载体中,所述物质Z与甾醇的摩尔比为0.5~5:1,优选为0.5~3:1,例如0.6~2:1。
某一优选方案中,所述脂质载体中,所述物质Z与磷脂的摩尔比为1~15:1,优选为2~8:1,例如3~6:1。
某一优选方案中,所述脂质载体中,所述物质Z与PEG脂质的摩尔比为20~130:1,优选为20~80:1,例如20~40:1。
某一优选方案中,所述物质Z的摩尔含量约为30mol%至60mol%。
本发明中,摩尔含量的含义为某物质占脂质载体的总物质量的百分比,脂质载体中各组分的摩尔含量之和不超过100mol%。某一优选方案中,所述磷脂的摩尔含量约为0mol%至30mol%。
某一优选方案中,所述甾醇的摩尔含量约为15mol%至55mol%。
某一优选方案中,所述PEG脂质的摩尔含量约为0mol%至10mol%。
某一优选方案中,所述脂质载体由所述物质Z、所述稀释剂、所述磷脂、所述PEG脂质和所述甾醇组成。
本发明还提供一种脂质纳米颗粒,其包括治疗剂和/或预防剂以及前述脂质载体。
某一优选方案中,所述治疗剂和/或预防剂可为一种或两种及以上核酸。所述核酸可为本领域常规核酸。所述治疗剂和/或预防剂可为单链脱氧核糖核酸(DNA)、双链DNA、小干扰RNA(siRNA)、不对称双链小干扰RNA(aiRNA)、微小RNA(miRNA)、小发夹RNA(shRNA)、环状RNA(circRNA)、转运RNA(tRNA)、信使RNA(mRNA)和本领域已知的其他形式的核酸分子,优选为mRNA,例如萤火虫荧光素酶(Fluc)mRNA或SARS-CoV-2刺突蛋白(Spike)mRNA。
某一优选方案中,所述脂质纳米颗粒中氮磷比可为2:1~30:1,所述组合物的氮磷比是指一种或多种可电离脂质化合物中可电离氮原子的摩尔数与RNA中磷酸酯基的摩尔数的比率。优选为2:1~20:1,例如3:1~20:1,还例如3:1~16:1。
某一优选方案中,所述脂质纳米颗粒中,所述脂质载体与治疗剂和/或预防剂的质量比可为3~80:1,优选为6~60:1。
某一方案中,所述脂质纳米颗粒的粒径(平均粒径)可为10~250nm,例如为40~250nm,进一步为50~250nm,或40~150nm,或60~150nm。
某一优选方案中,所述脂质纳米颗粒中,所述脂质载体包裹所述治疗剂和/或预防剂。
本发明还提供一种组合物,其包括物质Z,所述物质Z为如前所述的如式I所示化合物或其药学可接受的盐。
某一优选方案中,所述组合物还包括稀释剂、磷脂、PEG脂质、甾醇和治疗剂和/或预防剂中的一种或多种。
某一优选方案中,所述组合物中,所述稀释剂、磷脂、PEG脂质、甾醇和治疗剂和/或预防剂如前所述。
某一优选方案中,所述组合物中,所述物质Z与所述稀释剂、磷脂、PEG脂质和甾醇中的一种或多种形成如前所述脂质载体。
某一优选方案中,所述组合物中,所述脂质载体与所述治疗剂和/或预防剂形成如前所述的脂质纳米颗粒。某一优选方案中,所述组合物中,所述治疗剂和/或预防剂的包封率为至少50%,优选为至少为70%。
某一优选方案中,所述组合物中,所述组合物的多分散指数不高于0.5,例如不高于0.3。
如无特别说明,本发明所用术语具有如下含义:
术语“卤素”是指氟、氯、溴或碘。
术语“药学上可接受”是指相对无毒、安全、适合于患者使用。
术语“药学上可接受的盐”是指化合物与药学上可接受的酸或碱反应得到的盐。当化合物中含有相对酸性的官能团时,可以通过在合适的惰性溶剂中用足量的药学上可接受的碱与化合物接触的方式获得碱加成盐。药学上可接受的碱加成盐包括但不限于:钠盐、钾盐、钙盐、铝盐、镁盐、铋盐、铵盐等。当化合物中含有相对碱性的官能团时,可以通过在合适的惰性溶剂中用足量的药学上可接受的酸与化合物接触的方式获得酸加成盐。药学上可接受的酸加成盐包括但不限于:盐酸盐、硫酸盐、甲磺酸盐等。具体可参见Handbook ofPharmaceutical Salts:Properties,Selection,and Use(P.Heinrich Stahl,CamilleG.Wermuth,2011,2ndRevisedEdition)。
结构片段中的
基团末端的“-”是指该基团通过该位点与分子其余部分相连。例如,CH
术语“烷基”是指具有指定碳原子数(例如,C
术语“亚烷基”为二价基团,其通过两个单键与分子其余部分相连,其余定义同术语“烷基”。
术语“环烷基”是指具有指定的碳原子数(例如C
术语“烯基”是指包含一个或多个碳-碳双键(例如,1、2或3碳-碳双键)的直链或支链烃基团。
当任意变量(例如基团R
在不违背本领域常识的基础上,上述各优选条件,可任意组合,即得本发明各较佳实例
本发明所用试剂和原料均市售可得。
本发明的积极进步效果在于:本发明提供了一种如式I所示的含氮链状化合物,其结构新颖,其可用做制备脂质纳米颗粒。包含如式I所示的含氮链状化合物的脂质纳米颗粒具有较低的多分散指数,可以高效的转运mRNA。
附图说明
图1为实施23中制备的各Fluc-mRNA LNP凝胶电泳图。
图2为实施例25中293FT细胞与各Fluc-mRNA LNP共培养18-24h后的化学发光强度。
图3为实施例25中293FT细胞与各Spike-mRNA LNP共培养24h后的Spike蛋白表达情况,PBS组作为阴性对照。
图4为实施例26中小鼠静脉注射给药各Fluc-mRNA LNP不同时间后的体内总生物发光量(n=3),PBS组做阴性对照(n=2)。
图5为实施例26中小鼠肌内注射给药各Spike-mRNA LNP后的体内总抗体滴度(末次给药后1周,n=8)。
图6为实施例27中小鼠静脉注射给药各Fluc mRNA LNP不同时间后的体内总生物发光量(n=3)。
具体实施方式
下面通过实施例的方式进一步说明本发明,但并不因此将本发明限制在所述的实施例范围之中。下列实施例中未注明具体条件的实验方法,按照常规方法和条件,或按照商品说明书选择。
本申请实施例的试剂来源如下:
8-溴辛酸:购自江苏艾康,纯度:98%;
十七烷-9-醇:购自北京福源坊科技有限公司,纯度:98%;
DCC:二环己基碳二亚胺,购自阿达玛斯试剂有限公司,货号012041444,纯度:RG,99%;
DMAP:4-二甲氨基吡啶,购自阿达玛斯试剂有限公司,货号:01271081,纯度:RG,99%;
DCM:二氯甲烷,购自上海泰坦科技股份有限公司,货号:01111853,纯度:AR,≥99.5%;
乙醇胺:购自上海易恩化学技术有限公司,货号:R016710,纯度:AR,99%;
乙腈:购自上海泰坦科技股份有限公司,货号:01111797,纯度:AR,≥99.0%;
6-溴己酸:购自阿达玛斯试剂有限公司,货号:01073739,纯度:RG,98%+;
3,7-二甲基-1-辛醇:购自安耐吉化学,货号:A040472,纯度:98%;
K
KI:购自上海易恩化学技术有限公司,货号:RH432132,纯度:AR,99%;
甲基叔丁基醚:购自上海泰坦科技股份有限公司,货号:01030342,纯度:AR,≥99.0%;
2-环己基乙醇:购自上海阿拉丁生化科技股份有限公司,货号:C153306,纯度:GC,>98.0%;
异癸醇:购自上海阿拉丁生化科技股份有限公司,货号:I298943,纯度:98%;
硅藻土:购自上海泰坦科技股份有限公司,货号:01589000,纯度:特优级,≥89.0%,200目;
乙酸乙酯:购自上海泰坦科技股份有限公司,货号:01153552,纯度:AR,≥99.5%;
3,5,5-三甲基-1-己醇:购自上海阿拉丁生化科技股份有限公司,货号:T162750,纯度:GC,>85.0%;
2-乙基己醇:购自上海易恩化学技术有限公司,货号:R016621,纯度:AR,99%;
无水硫酸钠:购自上海泰坦科技股份有限公司,货号:01224581,纯度:AR,≥99.0%;
三氯化铁:购自上海麦克林生化科技股份有限公司,货号:I811935,纯度:AR,99%;
吡啶:购自上海麦克林生化科技股份有限公司,货号:P816288,纯度:AR,99%;
1,2-环氧十二烷:购自上海麦克林生化科技股份有限公司,货号:E808874,纯度:95%;
3-环戊基-1-丙醇:购自上海毕得医药科技股份有限公司,货号:BD86403,纯度:98%;
环己基甲醇:购自上海易恩化学技术有限公司,货号:R014045,纯度:99%;
异壬醇:购自广东翁江化学试剂有限公司;
8-甲基-1-癸醇:购自南京一览生物科技有限公司,纯度:97%;
3-丁基-1-庚醇:购自苏州美诺医药科技有限公司,纯度:95%。
实施例1制备化合物LQ001
步骤1:LQ001-1的制备
物料配比:
操作过程:
反应瓶中加入8-溴辛酸、十七烷-9-醇、DCC、DMAP和DCM,室温下搅拌反应12h,TLC(EA:PE=20:1)显示反应完全。
后处理:
反应液用硅藻土过滤后旋干,柱层析纯化后得40g无色油状物,收率为85%。
1
步骤2:LQ001-2的制备
物料配比:
操作过程:
反应瓶中加入LQ001-1、乙醇胺和乙腈,加热至30℃搅拌反应12h。TLC(EA:PE=20:1)显示反应完全。
后处理:
反应液旋干后用500mL的乙酸乙酯稀释,用500mL水洗2次,取有机相用无水硫酸钠干燥后旋干,柱层析纯化后得到25g无色油状物,收率为87%。
1
步骤3:LQ001-3的制备
物料配比:
操作过程:
反应瓶中加入6-溴己酸、3,7-二甲基-1-辛醇、DCC、DMAP和DCM,室温下搅拌反应12h。TLC(EA:PE=20:1)显示反应完全。
后处理:
反应液用硅藻土过滤后旋干,柱层析纯化后得2.8g无色油状物,收率为83.6%。
1
步骤4:LQ001的制备
物料配比:
/>
操作过程:
反应瓶中加入LQ001-2、LQ001-3、K
后处理:
反应液过滤后旋干,柱层析纯化后得到2g无色油状物,收率为77%。
1
LCMS:Rt:4.991min;MS m/z(ESI):697.1[M+H]
实施例2制备化合物LQ002
步骤1:LQ002-1的制备
物料配比:
操作过程:
反应瓶中加入8-溴辛酸、3,7-二甲基-1-辛醇、DCC、DMAP和DCM,室温下搅拌反应12h,TLC(EA:PE=20:1)显示反应完全。
后处理:
反应液用硅藻土过滤后旋干,柱层析纯化后得2g无色油状物,收率为55%。
1
步骤2:LQ002-2的制备
物料配比:
操作过程:
反应瓶中加入LQ002-1、乙醇胺和乙腈,室温下搅拌反应12h。TLC(EA:PE=20:1)显示反应完全。
后处理:
反应液旋干后用100mL的乙酸乙酯稀释,用100mL水洗2次,取有机相用无水硫酸钠干燥后旋干,柱层析纯化后得到750mg无色油状物,收率为57.8%。
TLC情况:DCM:MeOH=10:1,Rf=0.4。
步骤3:LQ002的制备
物料配比:
操作过程:
反应瓶中加入LQ002-2、LQ001-3、K
后处理:
反应液过滤后旋干,柱层析纯化后得到1g无色油状物,收率为76%。
1
LCMS:Rt:2.429min;MS m/z(ESI):598.9[M+H]
实施例3制备化合物LQ004
步骤1:LQ004-1的制备
物料配比:
操作过程:
反应瓶中加入6-溴己酸、2-环己基乙醇、DCC、DMAP和DCM,室温下搅拌反应12h。TLC(EA:PE=20:1)显示反应完全。
后处理:
反应液用硅藻土过滤后旋干,柱层析纯化后得2g无色油状物。
TLC情况:EA:PE=20:1,Rf=0.6。
步骤2:LQ004的制备
物料配比:
操作过程:
反应瓶中加入LQ001-2、LQ004-1、K
后处理:
反应液过滤后旋干,柱层析纯化后得到2g无色油状物,收率为80%。
1
LCMS:Rt:5.913min;MS m/z(ESI):566.9[M+H]
实施例4制备化合物LQ005
步骤1:LQ005-1的制备
物料配比:
操作过程:
反应瓶中加入8-溴辛酸、2-环己基乙醇、DCC、DMAP和DCM,室温下搅拌反应12h,TLC(EA:PE=20:1)显示反应完全。
后处理:
反应液用硅藻土过滤后旋干,柱层析纯化后得2g无色油状物,收率为55%。
TLC情况:EA:PE=20:1,Rf=0.6。
步骤2:LQ005-2的制备
/>
物料配比:
操作过程:
反应瓶中加入LQ005-1、乙醇胺和乙腈,室温下搅拌反应12h。TLC(EA:PE=20:1)显示反应完全。
后处理:
反应液旋干后用100ml的乙酸乙酯稀释,用100ml水洗2次,取有机相用无水硫酸钠干燥后旋干,柱层析纯化后得到750mg无色油状物,收率为57.8%。
TLC情况:DCM:MeOH=10:1,Rf=0.4。
步骤3:LQ005的制备
物料配比:
操作过程:
反应瓶中加入LQ005-2、LQ004-1、K
后处理:
反应液过滤后旋干,柱层析纯化后得到1g无色油状物,收率为76%。
1
LCMS:Rt:0.086min;MS m/z(ESI):538.7[M+H]
实施例5制备化合物LQ007
步骤1:LQ007-1的制备
物料配比:
操作过程:
反应瓶中加入6-溴己酸、异癸醇、DCC、DMAP和DCM,室温下搅拌反应12h。TLC(EA:PE=20:1)显示反应完全。
后处理:
反应液用硅藻土过滤后旋干,柱层析纯化后得2g无色油状物。
TLC情况:EA:PE=20:1,产物Rf=0.6。
步骤2:LQ007的制备
物料配比:
操作过程:
反应瓶中加入LQ001-2、LQ007-1、K
后处理:
反应液过滤后旋干,柱层析纯化后得到2g无色油状物,收率为80%。
1
LCMS:Rt:3.83min;MS m/z(ESI):696.7[M+H]
实施例6制备化合物LQ008
步骤1:LQ008-1的制备
物料配比:
操作过程:
反应瓶中加入8-溴辛酸、异癸醇、DCC、DMAP和DCM,室温下搅拌反应12h,TLC(EA:PE=20:1)显示反应完全。
后处理:
反应液用硅藻土过滤后旋干,柱层析纯化后得2g无色油状物,收率为55%。
步骤2:LQ008-2的制备
物料配比:
操作过程:
反应瓶中加入LQ008-1、乙醇胺和乙腈,室温下搅拌反应12h。TLC(EA:PE=20:1)显示反应完全。
后处理:
反应液旋干后用100ml的乙酸乙酯稀释,用100ml水洗2次,取有机相用无水硫酸钠干燥后旋干,柱层析纯化后得到750mg无色油状物,收率57.8%。
1
步骤3:LQ008的制备
物料配比:
操作过程:
反应瓶中加入LQ008-2、LQ007-1、K
后处理:
反应液过滤后旋干,柱层析纯化后得到1g无色油状物,收率为76%。
1
LCMS:Rt:4.452min;MS m/z(ESI):598.9[M+H]
实施例7制备化合物LQ010
步骤1:LQ010-1的制备
物料配比:
操作过程:
反应瓶中加入6-溴己酸、3,5,5-三甲基-1-己醇、DCC、DMAP和DCM,室温下搅拌反应12h。TLC(EA:PE=20:1)显示反应完全。
后处理:
反应液用硅藻土过滤后旋干,柱层析纯化后得2g无色油状物。
TLC情况:EA:PE=20:1,Rf=0.6。
步骤2:LQ010的制备
物料配比:
操作过程:
反应瓶中加入LQ001-2、LQ010-1、K
后处理:
反应液过滤后旋干,柱层析纯化后得到2g无色油状物,收率为80%。
1
LCMS:Rt:3.83min;MS m/z(ESI):682.7[M+H]
实施例8制备化合物LQ011
步骤1:LQ011-1的制备
物料配比:
操作过程:
反应瓶中加入8-溴辛酸、3,5,5-三甲基-1-己醇、DCC、DMAP和DCM,室温下搅拌反应12h,TLC(EA:PE=20:1)显示反应完全。
后处理:
反应液用硅藻土过滤后旋干,柱层析纯化后得2g无色油状。
TLC情况:EA:PE=20:1,产物Rf=0.6。
步骤2:LQ011-2的制备
物料配比:
操作过程:
反应瓶中加入LQ011-1、乙醇胺和乙腈,室温下搅拌反应12h。TLC(EA:PE=20:1)显示反应完全。
后处理:
反应液旋干后用100ml的乙酸乙酯稀释,用100ml水洗2次,取有机相用无水硫酸钠干燥后旋干,柱层析纯化后得到750mg无色油状物,收率为57.8%。
1
步骤3:LQ011的制备
物料配比:
操作过程:
反应瓶中加入LQ008-2、LQ007-1、K
后处理:
反应液过滤后旋干,柱层析纯化后得到1g无色油状物,收率为76%。
1
LCMS:Rt:1.609min;MS m/z(ESI):570.5[M]
实施例9制备化合物LQ013
步骤1:LQ013-1的制备
物料配比:
操作过程:
反应瓶中加入6-溴己酸、2-乙基己醇、DCC、DMAP和DCM,室温下搅拌反应12h。TLC(EA:PE=20:1)显示反应完全。
后处理:
反应液用硅藻土过滤后旋干,柱层析纯化后得2g无色油状物。
TLC情况:EA:PE=20:1,产物Rf=0.6。
步骤2:LQ013的制备
物料配比:
操作过程:
反应瓶中加入LQ001-2、LQ013-1、K
后处理:
反应液过滤后旋干,柱层析纯化后得到2g无色油状物,收率为80%。
1
实施例10制备化合物LQ014
步骤1:LQ014-1的制备
物料配比:
操作过程:
反应瓶中加入8-溴辛酸、2-乙基己醇、DCC、DMAP和DCM,室温下搅拌反应12h,TLC(EA:PE=20:1)显示反应完全。
后处理:
反应液用硅藻土过滤后旋干,柱层析纯化后得2g无色油状物,收率为55%。
步骤2:LQ014-2的制备
物料配比:
操作过程:
反应瓶中加入LQ014-1、乙醇胺和乙腈,室温下搅拌反应12h。TLC(EA:PE=20:1)显示反应完全。
后处理:
反应液旋干后用100ml的乙酸乙酯稀释,用100ml水洗2次,取有机相用无水硫酸钠干燥后旋干,柱层析纯化后得到750mg无色油状物,收率为55%。
TLC情况:DCM:MeOH=10:1,产物Rf=0.2。
步骤3:LQ014的制备
物料配比:
操作过程:
反应瓶中加入LQ014-2、LQ013-1、K
后处理:
反应液过滤后旋干,柱层析纯化后得到1g无色油状物,收率为73%。
1
实施例11制备化合物LQ016
步骤1:LQ016-1的制备
物料配比:
操作过程:
反应瓶中加入6-溴己酸、1,2-环氧十二烷、三氯化铁和吡啶,室温下搅拌反应12h。TLC(EA:PE=4:1)显示反应完全。
后处理:
反应液用柱层析纯化后得1.4g产物。
TLC情况:EA:PE=4:1,产物Rf=0.5。
步骤2:LQ016的制备
物料配比:
操作过程:
反应瓶中加入LQ001-2、LQ016-1、K
后处理:
反应液过滤后旋干,柱层析纯化后得到900g无色油状物。
1
LCMS:Rt:3.83min;MS m/z(ESI):740.7[M]
实施例12制备化合物LQ017
步骤1:LQ017-1的制备
物料配比:
操作过程:
反应瓶中加入8-溴辛酸、1,2-环氧十二烷、三氯化铁和吡啶,室温下搅拌反应12h,TLC(EA:PE=4:1)显示反应完全。
后处理:
反应液用硅藻土过滤后旋干,柱层析纯化后得1g无色油状物,收率为25%。
1
步骤2:LQ017-2的制备
物料配比:
操作过程:
反应瓶中加入LQ017-1、乙醇胺和乙腈,室温下搅拌反应2d。TLC(EA:PE=4:1)显示反应完全。
后处理:
反应液旋干后用100mL的乙酸乙酯稀释,用100mL水洗2次,取有机相用无水硫酸钠干燥后旋干,柱层析纯化后得到300mg无色油状物,收率为32.8%。
1
步骤3:LQ017的制备
物料配比:
操作过程:
反应瓶中加入LQ017-2、LQ016-1、K
后处理:
反应液过滤后旋干,柱层析纯化后得到160mg无色油状物,收率为76%。
1
实施例13制备化合物LQ025
步骤1:LQ025-1的制备
物料配比
操作过程:
反应瓶中加入6-溴己酸、3-环戊基-1-丙醇、DCC、DMAP和DCM,室温下搅拌反应12h。TLC(EA:PE=20:1)显示反应完全。
后处理:
反应液用硅藻土过滤后旋干,柱层析纯化后得2.8g无色油状物。
TLC情况:EA:PE=20:1,产物Rf=0.6。
步骤2:LQ025的制备
物料配比:
操作过程:
反应瓶中加入LQ001-2、LQ025-1、K
后处理:
反应液过滤后旋干,柱层析纯化后得到2g无色油状物,收率为80%。
1
LCMS:Rt:3.83min;MS m/z(ESI):666.7[M+H]
实施例14制备化合物LQ026
步骤1:LQ026-1的制备
物料配比:
操作过程:
反应瓶中加入8-溴辛酸、3-环戊基-1-丙醇、DCC、DMAP和DCM,室温下搅拌反应12h,TLC(EA:PE=20:1)显示反应完全。
后处理:
反应液用硅藻土过滤后旋干,柱层析纯化后得1.2g无色油状物,收率为65%。
TLC情况:EA:PE=20:1,产物Rf=0.6。
步骤2:LQ026-2的制备
物料配比:
操作过程:
反应瓶中加入LQ026-1、乙醇胺和乙腈,室温下搅拌反应12h。TLC(EA:PE=20:1)显示反应完全。
后处理:
反应液旋干后用100mL的乙酸乙酯稀释,用100mL水洗2次,取有机相用无水硫酸钠干燥后旋干,柱层析纯化后得到1g无色油状物,收率为87.8%。
TLC情况:DCM:MeOH=10:1,产物Rf=0.2。
步骤3:LQ026的制备
物料配比:
操作过程:
反应瓶中加入LQ026-2、LQ025-1、K
后处理:
反应液过滤后旋干,柱层析纯化后得到1g无色油状物,收率为76%。
1
LCMS:Rt:3.85min;MS m/z(ESI):538.5[M+H]
实施例15制备化合物LQ031
步骤1:LQ031-1的制备
物料配比
操作过程:
反应瓶中加入6-溴己酸、环己基甲醇、DCC、DMAP和DCM,室温下搅拌反应12h,TLC(EA:PE=20:1)显示反应完全(产物Rf值为0.5)。
后处理:
反应液用硅藻土过滤后旋干,柱层析纯化后得8.6g无色油状物,收率69%。
H NMR(600MHz,CHCl
步骤2:LQ031-2的制备
物料配比:
操作过程:
反应瓶中加入LQ031-1、乙醇胺和乙腈,加热至30℃搅拌反应12h。TLC(DCM:MeOH=10:1)显示反应完全(产物Rf值为0.3)。
后处理:
反应液旋干后用500ml的乙酸乙酯稀释,用500ml水洗2次,取有机相用无水硫酸钠干燥后旋干,柱层析纯化后得到5.6g无色油状物。收率69%。
1
步骤3:LQ031的制备
物料配比:
操作过程:
反应瓶中加入LQ031-2、LQ001-1、K
后处理:
反应液过滤后旋干,柱层析纯化后得到1.55g无色油状物。收率64%。
1
实施例16制备化合物LQ032
步骤1:LQ032-1的制备
物料配比:
操作过程:
反应瓶中加入6-溴己酸、环己基甲醇、DCC、DMAP和DCM,室温下搅拌反应12h,TLC(EA:PE=20:1)显示反应完全(产物Rf值为0.5)。
后处理:
反应液用硅藻土过滤后旋干,柱层析纯化后得9g无色油状物,收率70%。
步骤2:LQ032的制备
物料配比:
操作过程:
反应瓶中加入LQ031-2、LQ032-1、K
后处理:
反应液过滤后旋干,柱层析纯化后得到1g无色油状物。收率53%。
1
实施例17制备化合物LQ067
步骤1:LQ067-1的制备
物料配比:
操作过程:
反应瓶中加入6-溴己酸、异壬醇、DCC、DMAP和DCM,室温下搅拌反应12h。TLC(EA:PE=20:1)显示反应完全(产物Rf值为0.6)。
后处理:
反应液用硅藻土过滤后旋干,柱层析纯化后得2.4g无色油状物。
步骤2:LQ067的制备
物料配比:
操作过程:
反应瓶中加入LQ001-2、LQ067-1、K
后处理:
反应液过滤后旋干,柱层析纯化后得到1.5g无色油状物。收率71%。
1
实施例18制备化合物LQ068
步骤1:LQ068-1的制备
物料配比:
操作过程:
反应瓶中加入8-溴辛酸、异壬醇、DCC、DMAP和DCM,室温下搅拌反应12h,TLC(EA:PE=20:1)显示反应完全(产物Rf值为0.6)。
后处理:
反应液用硅藻土过滤后旋干,柱层析纯化后得8.8g无色油状物,收率63%。
步骤2:LQ068-2的制备
物料配比:
操作过程:
反应瓶中加入LQ068-1、乙醇胺和乙腈,加热至30℃搅拌反应12h。TLC(DCM:MeOH=10:1)显示反应完全(产物Rf值为0.3)。
后处理:
反应液旋干后用500mL的乙酸乙酯稀释,用500mL水洗2次,取有机相用无水硫酸钠干燥后旋干,柱层析纯化后得到5.8g无色油状物。收率70%。
步骤3:LQ068的制备
物料配比:
操作过程:
反应瓶中加入LQ068-2、LQ067-1、K
后处理:
反应液过滤后旋干,柱层析纯化后得到1g无色油状物。收率57%。
1
实施例19制备化合物LQ073
步骤1:LQ073-1的制备
物料配比:
操作过程:
反应瓶中加入6-溴己酸、8-甲基-1-癸醇、DCC、DMAP和DCM,室温下搅拌反应12h。TLC(EA:PE=20:1)显示反应完全(产物Rf值为0.6)。
后处理:
反应液用硅藻土过滤后旋干,柱层析纯化后得2.6g无色油状物。
步骤2:LQ073的制备
物料配比:
操作过程:
反应瓶中加入LQ001-2、LQ073-1、K
后处理:
反应液过滤后旋干,柱层析纯化后得到1.2g无色油状物。收率57%。
1
实施例20制备化合物LQ074
步骤1:LQ074-1的制备
物料配比:
操作过程:
反应瓶中加入8-溴辛酸、8-甲基-1-癸醇、DCC、DMAP和DCM,室温下搅拌反应12h,TLC(EA:PE=20:1)显示反应完全(产物Rf值为0.6)。
后处理:
反应液用硅藻土过滤后旋干,柱层析纯化后得9.3g无色油状物,收率62%。
步骤2:LQ074-2的制备
物料配比:
操作过程:
反应瓶中加入LQ074-1、乙醇胺和乙腈,加热至30℃搅拌反应12h。TLC(DCM:MeOH=10:1)显示反应完全(产物Rf值为0.3)。
后处理:
反应液旋干后用500mL的乙酸乙酯稀释,用500mL水洗2次,取有机相用无水硫酸钠干燥后旋干,柱层析纯化后得到5.4g无色油状物。收率60%。
步骤3:LQ074的制备
物料配比:
操作过程:
反应瓶中加入LQ074-2、LQ073-1、K
后处理:
反应液过滤后旋干,柱层析纯化后得到1g无色油状物。收率57%。
1
实施例21制备化合物LQ076
步骤1:LQ076-1的制备
物料配比:
操作过程:
反应瓶中加入6-溴己酸、3-丁基-1-庚醇、DCC、DMAP和DCM,室温下搅拌反应12h。TLC(EA:PE=20:1)显示反应完全(产物Rf值为0.6)。
后处理:
反应液用硅藻土过滤后旋干,柱层析纯化后得2.8g无色油状物。
步骤2:LQ076的制备
物料配比:
操作过程:
反应瓶中加入LQ001-2、LQ076-1、K
后处理:
反应液过滤后旋干,柱层析纯化后得到1.2g无色油状物。收率57%。
1
实施例22制备化合物LQ077
步骤1:LQ077-1的制备
物料配比:
操作过程:
反应瓶中加入8-溴辛酸、3-丁基-1-庚醇、DCC、DMAP和DCM,室温下搅拌反应12h,TLC(EA:PE=20:1)显示反应完全(产物Rf值为0.6)。
后处理:
反应液用硅藻土过滤后旋干,柱层析纯化后得9g无色油状物,收率61%。
步骤2:LQ077-2的制备
物料配比:
操作过程:
反应瓶中加入LQ068-1、乙醇胺和乙腈,加热至30℃搅拌反应12h。TLC(DCM:MeOH=10:1)显示反应完全(产物Rf值为0.3)。
后处理:
反应液旋干后用500mL的乙酸乙酯稀释,用500mL水洗2次,取有机相用无水硫酸钠干燥后旋干,柱层析纯化后得到5g无色油状物。收率57%。
步骤3:LQ077的制备
物料配比:
操作过程:
反应瓶中加入LQ077-2、LQ076-1、K
后处理:
反应液过滤后旋干,柱层析纯化后得到1.1g无色油状物。收率57%。
1
实施例23脂质纳米颗粒(LNP)的制备和检测
将系列可电离脂质化合物、二硬脂酰基磷脂酰胆碱(DSPC,日本精化株式会社,货号:S01005)、胆固醇(日本精化株式会社,货号:O01001)和二肉豆蔻酰甘油-聚乙二醇2000(DMG-PEG2000,国邦药业,货号:O02005)分别溶于乙醇溶液,继而依据一定的摩尔比例混合制得混合脂质的乙醇溶液(脂质总浓度为12.5mM)。将萤火虫荧光素酶(Fluc)mRNA或SARS-CoV-2刺突蛋白(Spike)mRNA(SARS-CoV-2刺突蛋白mRNA参见Tan,S.等人,bioRxiv2022.05.10.491301.)在50mM柠檬酸盐缓冲液(pH 4.0)中稀释得到mRNA溶液。通过使用微流控装置以流速12mL/min、体积比1:3混合脂质的乙醇溶液和mRNA溶液,以可电离脂质与mRNA的氮磷比为6:1制备脂质纳米颗粒。经0.01M的磷酸缓冲液(PBS)透析12-24h除去乙醇。最后,脂质纳米颗粒溶液通过0.22μm无菌过滤器过滤,并经超滤浓缩(Amicon-Ultra,MWCO10KDa)得到使用可电离脂质/DSPC/胆固醇/DMG-PEG2000包封Fluc mRNA或Spike mRNA的LNP制剂。SM102可电离脂质(浙江神洲药业有限公司,批号:W211-YB211202)做阳性对照,其结构如下:
无特殊说明,可电离脂质/DSPC/胆固醇/DMG-PEG2000的摩尔比为50:10:38.5:1.5。使用Malvern Zetasizer Ultra(动态光散射法)测定各LNP的粒径大小及多分散指数(PDI);使用Quant-it Ribogreen RNA定量测定试剂盒(ThermoFisher Scientific,货号:R11490)测定LNP的包封效率;6-(p-Toluidino)-2-naphthalene sulfonic acid sodium salt(TNS,南京熙泽医药科技有限公司,货号:XZ0743)染料结合试验测量LNP的pKa,核酸凝胶电泳考察mRNA完整性,测试结果见表1及图1(各Fluc-mRNA LNP凝胶电泳图)。
表1各LNP的粒径、PDI、包封率及pKa(n=3)。
在本领域中,PDI小于0.3,则说明该LNP制剂中纳米颗粒大小相对均匀;包封率用来说明LNP是否能有效包载mRNA,包封率高于70%,则说明该LNP可有效包载mRNA;琼脂糖凝胶电泳图中条带单一且明亮可说明mRNA结构完整。其中,PDI越趋于0越好,包封率越趋于100%越好。由表1可见,实施例23制备的各LNP粒径在60~150nm之间,PDI均小于0.2,各可电离脂质对应的LNP pKa均大于5.5。由图1可见,SM102、LQ001、LQ007、LQ013、LQ016、LQ025、LQ017对应的各mRNA-LNP电泳后mRNA条带清晰明亮,表明其均可有效包载mRNA并维持mRNA结构完整;LQ109对应的LNP的孔道未见明亮条带,表明该组mRNA完整性欠佳。
实施例24脂质纳米颗粒(LNP)的制备和检测
采用与实施例23相同的制备方式制得8种LNP制剂(包载Fluc mRNA),并测定它们的粒径、PDI及包封率。其中,以可电离脂质与mRNA的氮磷比为6:1制备脂质纳米颗粒,可电离脂质/DSPC/胆固醇/DMG-PEG2000的摩尔比为50:10:38.5:1.5,以四个组分的总摩尔数为100%计,各组制剂摩尔百分含量一致。
表2各LNP的粒径、PDI及包封率
由表2可见,由上述不同可电离脂质制得的各组LNP制剂粒径介于60~250nm之间;PDI均小于0.25,具体介于0.038至0.234;包封率均高于70%。
实施例25LNP制剂的体外细胞实验
以每孔1万个293FT细胞铺种至96孔板,过夜培养至细胞贴壁。将实施例23中制备的Fluc-mRNA LNP制剂(按100ng mRNA/孔计)分别加入96孔板的细胞培养液中(替换为无抗生素、含10%胎牛血清(FBS)的DMEM培养基)(厂家:Gibco,货号:C11995500BT),继续培养18h后弃去细胞上清,100μL细胞裂解液裂解细胞,加D-荧光素钾盐(PerkinElmer,货号:122799,终浓度1mM)和ATP(厂家:ApexBio,货号:C6931,终浓度2mM),酶标仪检测化学发光强度,测试结果见图2(293FT细胞与各Fluc-mRNA LNP共培养18-24h后的化学发光强度。通过ANOVA进行统计学分析。***p<0.001,与PBS组比较)。通过体外细胞实验来验证本申请LNP制剂的体外细胞递送及表达,测试结果见图2。
在图2中,PBS为阴性对照,此组对应的化学发光强度读数可视为背景读值。化学发光强度读数越高,说明表达的越高。由图2可见,LQ001、LQ007、LQ013、LQ016及LQ025对应的Fluc-mRNA LNP均可有效递送Fluc mRNA进入细胞并表达。
以每孔40万个293FT细胞铺种至12孔板,过夜培养至细胞贴壁。将实施例23中制备的Spike-mRNA LNP(按1μg/mL/孔计)分别加入12孔板的细胞培养液中(替换为无抗生素、含10%胎牛血清(FBS)的DMEM培养基)(厂家:Gibco,货号:C11995500BT),继续培养24h。裂解细胞并提取总蛋白,Western blot法测定Spike蛋白的细胞水平表达情况,测试结果见图3(293FT细胞与各Spike-mRNA LNP共培养24h后的Spike蛋白表达情况,PBS组作为阴性对照)。
由图3可见,LQ001、LQ007、LQ013、LQ025对应的Spike-mRNA LNP制剂均可有效递送Spike mRNA进入细胞并表达。
实施例26LNP制剂的动物体内研究
按5μg/只的剂量将实施例23制备的Fluc-mRNA-LNP通过尾静脉注射到6-8周龄雌性Balb/C小鼠(维通利华)中,并在给药后特定的时间节点(本实施例中为6、24、48、72h)腹腔注射D-荧光素钾盐,然后经IVIS Spectrum小动物活体成像仪检测LNP所携带的mRNA在小鼠体内表达的蛋白质的辐射强度(对应于生物发光表达强度),统计小鼠活体肝脏部位总发光强度。测试结果见图4(静脉注射给药各Fluc-mRNA LNP不同时间后的体内总生物发光量(n=3),PBS组做阴性对照(n=2))。规定时间点,腹腔内注射荧光素10min后,通过生物发光成像测量荧光素酶活性,Living Image软件(PerkinElmer)统计肝脏区域的总发光强度。进一步,通过GraphPad软件计算曲线下面积(AUC,单位:p/s*小时),即药后第4小时或第6小时(采用本申请的实验方法,药后3-6小时的峰值相同)至药后第72小时总发光强度测量点连线的曲线下面积,AUC越大,说明表达越好。
如图4所示,LQ001、LQ007、LQ013、LQ016和LQ025对应的Fluc-mRNA LNP制剂在小鼠体内均有较强表达,一直到72h仍能够观察到比本底水平(PBS组)高10倍以上的发光强度。
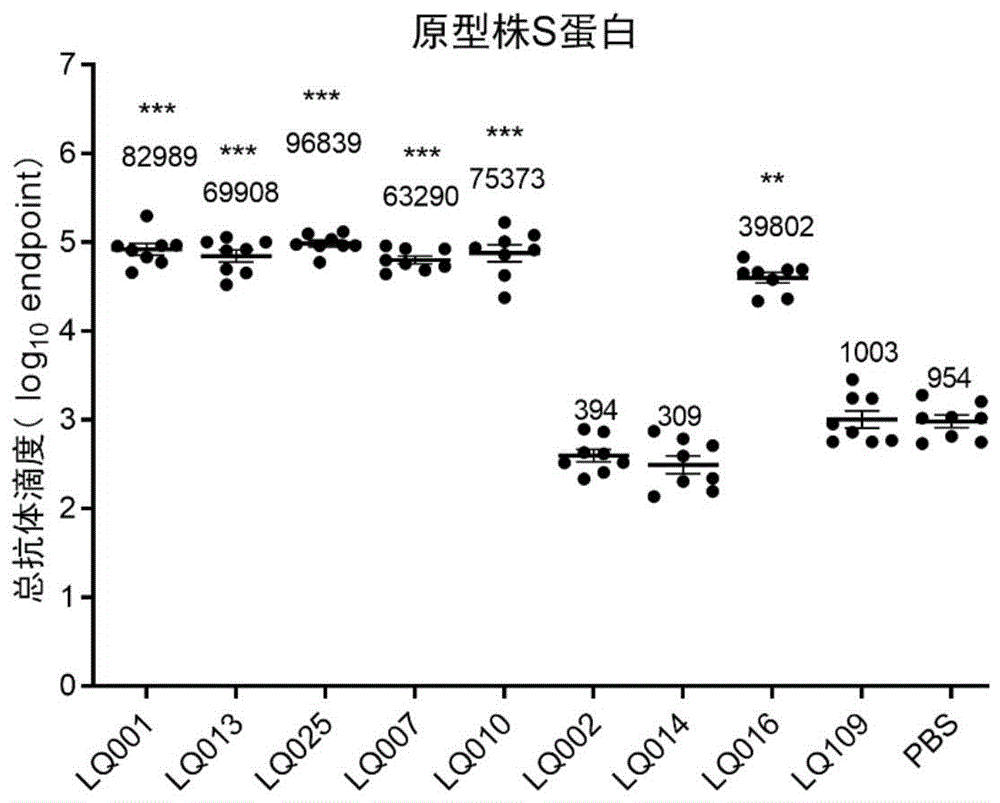
按2μg/只的剂量将实施例23制备的Spike-mRNA-LNP制剂通过肌肉注射到6-8周龄雌性Balb/C小鼠(维通利华)中,在第一次注射后21天重复注射相应的mRNA-LNP制剂。并在2次给药后特定的时间节点(本次实施例中数据为第二次给药后一周)采集小鼠全血。4℃、2000g离心10min从全血中分离出血清,血清在56℃水浴灭活30min,-80℃下保存以用于分析。根据制造商的说明,使用SARS-CoV-2(2019-nCoV))Spike S1+S2 ECD-His RecombinantProtein(义翘神州,货号:40589-V08B1)包被抗原,用SARS-CoV-2(2019-nCoV)SpikeNeutralizing Antibody Mouse Mab(义翘神州,货号:40591-MM43)做对照,2%BSA封闭,Peroxidase AffiniPure Goat Anti-Mouse IgG(H+L)(Jackson ImmunoResearch,货号:115-035-003)二抗孵育,按照说明书,使用TMB(Invitrogen,货号:00-4201-56)显色进行酶联免疫吸附测定(ELISA)分析,测得Spike抗体滴度,测试结果见图5(末次给药后1周小鼠血清中的总抗体滴度(n=8)。通过ANOVA进行统计学分析。**p<0.01,***p<0.001,与PBS组比较)。
与PBS组动物相比,SM102、LQ001、LQ013、LQ025、LQ007、LQ010、LQ016组动物Spike蛋白总抗体滴度有明显的增加,而LQ002、LQ014、LQ109组未见增加。
实施例27LNP制剂的动物体内研究
参考实施例26的小鼠体内试验方法,按5μg/只的剂量将该实施例24制备的所有LNP制剂通过尾静脉注射到6至8周龄的雌性Balb/C小鼠体内,并在给药后特定的时间节点(本实施例中为4、24、48h)腹腔注射D-荧光素钾盐,接下来采用与实施例26相同的方法统计肝脏区域的总发光强度,测试结果见图6。实验结果表明:其中5组(LQ031、LQ067、LQ073、LQ076、LQ077)LNP制剂在小鼠体内有较强表达,表明其体内递送能力较好。
- 配体化合物、包含该配体化合物的烯烃铜配位聚合物及其制备方法和应用
- 含氮五元芳香杂环化合物及其制备方法和应用
- 一种含磷三氮唑化合物制备方法及其在阻燃聚乳酸上应用
- 新晶型的具有降糖作用化合物及制备方法和含其的组合物
- 一种新晶型的抗肿瘤化合物及其制备方法和含其的组合物
- 含烷氧基甲硅烷基的环氧化合物、该化合物的制备方法、包含该化合物的组合物、由该组合物制备的固化产物和该组合物的应用
- 含烷氧基甲硅烷基的环氧化合物、该化合物的制备方法、包含该化合物的组合物、由该组合物制备的固化产物和该组合物的应用
