包含双氟烷基-1,4-苯并二氮杂*酮化合物与免疫治疗剂的组合物和其使用方法
文献发布时间:2023-06-19 09:29:07
技术领域
本发明提供组合物,其包含免疫治疗剂,如嵌合抗原受体T细胞(CAR-T细胞),并且尤其那些靶向通过γ分泌酶裂解的肿瘤抗原的免疫治疗剂,以及双氟烷基-1,4-苯并二氮杂
和其治疗如癌症的疾病和病症的使用方法。
背景技术
B细胞成熟抗原(BCMA)促进浆细胞存活并且在骨髓瘤细胞的生长和存活中起作用。其在发展的稍后阶段中的表达限于B细胞,并且其几乎普遍存在于骨髓瘤细胞上,使其成为抗癌疗法,例如CAR-T细胞疗法的可能标靶。实际上,至少十个靶向BCMA的CAR-T细胞疗法处于用以治疗多发性骨髓瘤的临床研发中。
然而,可能不能完全实现针对BCMA的CAR-T细胞疗法的疗效。BCMA和其它细胞表面肿瘤抗原通过酶(如伽马(γ)分泌酶)从细胞膜裂解和脱落,从而使肿瘤细胞难以由CAR-T细胞鉴别。γ分泌酶是在脂质双层内裂解异位膜蛋白的混杂蛋白酶。γ分泌酶不仅使BCMA引导的CAR-T细胞疗法的BCMA标靶从癌细胞裂解,而且使可溶BCMA(sBCMA)脱落和释放到血流中,在所述血流中,γ分泌酶可充当BCMA引导的CAR-T细胞疗法的诱铒。
在触发器侧,γ分泌酶抑制剂(GSI)可增加通常通过肿瘤上的γ分泌酶裂解的BCMA和其它肿瘤抗原的表面表达。增加的细胞表面BCMA和减少的sBCMA可增加BCMA引导的CAR-T疗法的效能。需要改良的CAR-T细胞组合物和方法来增加CAR-T细胞疗法的效能。
发明内容
本发明提供一种组合物,其包含一种或多种靶向免疫治疗剂的B细胞成熟抗原(BCMA)和一种或多种由式(I)结构表示的化合物:
和/或其至少一种盐,其中:
R
R
R
R
R
R
环A是苯基或吡啶基;
每一R
每一R
y是零、1或2;且
z是1或2。
本发明还提供一种治疗、遏制或抑制个体的B细胞成熟抗原(BCMA)相关病症或与BCMA表达相关的疾病的方法,其包含以下步骤:向所述个体施用包含一种或多种靶向BCMA的免疫治疗剂的第一组合物和包含一种或多种由式(I)结构表示的化合物的第二组合物:
和/或其至少一种盐,其中:
R
R
R
R
R
R
环A是苯基或吡啶基;
每一R
每一R
y是零、1或2;且
z是1或2。
本发明还提供一种治疗、遏制或抑制个体的增生性疾病的方法,其包含以下步骤:向所述个体施用包含一种或多种靶向B细胞成熟抗原(BCMA)的免疫治疗剂的第一组合物和包含一种或多种由式(I)结构表示的化合物的第二组合物:
和/或其至少一种盐,其中:
R
R
R
R
R
R
环A是苯基或吡啶基;
每一R
每一R
y是零、1或2;且
z是1或2。
本发明还提供一种改良个体的抗B细胞成熟抗原(BCMA)疗法的疗效的方法,其包含以下步骤:向所述个体施用包含一种或多种靶向BCMA的免疫治疗剂的第一组合物和包含一种或多种由式(I)结构表示的化合物的第二组合物:
和/或其至少一种盐,其中:
R
R
R
R
R
R
环A是苯基或吡啶基;
每一R
每一R
y是零、1或2;且
z是1或2。
本发明还提供一种减少个体中B细胞成熟抗原(BCMA)从癌细胞脱落的方法,其包含以下步骤:向所述个体施用包含一种或多种由式(I)结构表示的化合物的组合物:
和/或其至少一种盐,其中:
R
R
R
R
R
R
环A是苯基或吡啶基;
每一R
每一R
y是零、1或2;且
z是1或2。
附图说明
在说明书的结论部分特别指出并清楚地要求保护被视为本发明的主题。然而,当结合附图阅读时,通过参考以下详细描述,可以最好地理解本发明的组织和操作方法和其目的、特征和优点,其中:
图1.与
图2A.在多发性骨髓瘤(MM)细胞与化合物22一起培育之后,可溶BCMA在细胞培养基中的含量。U266细胞(MM细胞系)与0.3nM、1nM、3nM和10nM的化合物22一起培育24小时,并且通过ELISA测量可溶BCMA的含量。
图2B.在多发性骨髓瘤(MM)细胞与LY3039478一起培育之后,可溶BCMA在细胞培养基中的含量。U266细胞(MM细胞系)与0.3nM、1nM、3nM和10nM的LY3039478一起培育24小时,并且通过ELISA测量可溶性BCMA的含量。
图2C.在多发性骨髓瘤(MM)细胞与化合物1一起培育之后,可溶BCMA在细胞培养基中的含量。U266细胞(MM细胞系)与0.3nM、1nM、3nM和10nM的化合物1一起培育24小时,并且通过ELISA测量可溶性BCMA的含量。
图2D.在多发性骨髓瘤(MM)细胞与PF3084014一起培育之后,可溶BCMA在细胞培养基中的含量。将U266细胞(MM细胞系)与0.3nM、1nM、3nM和10nM的PF3084014一起培育24小时,并且通过ELISA测量BCMA含量。
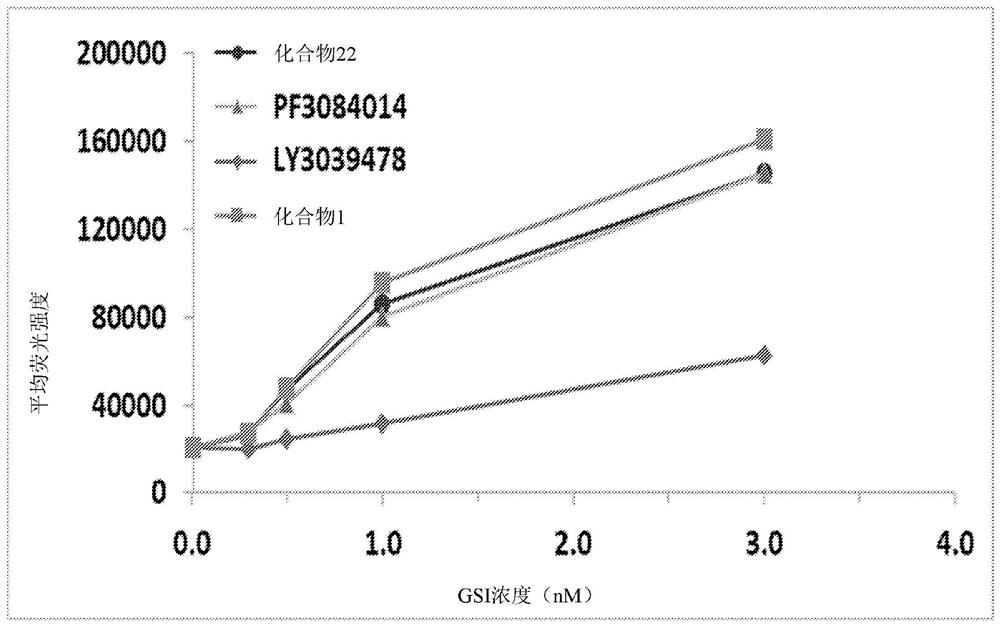
图3.在用γ分泌酶抑制剂(GSI)培育多发性骨髓瘤(MM)细胞之后,可溶BCMA在细胞培养基中的含量。U266细胞(MM细胞系)与0.3nM、1nM、3nM和10nM的GSI(化合物1、化合物22、LY3039478或PF3084014)一起培育24小时,并且通过ELISA测量BCMA含量。
图4A.在用γ分泌酶抑制剂(GSI),化合物1处理之后,BCMA在淋巴瘤细胞系中的含量。用0、1nM、10nM、100nM、500nM、1000nM或10000nM的GSI化合物1处理来自五个不同淋巴瘤细胞系(SP49(具有Notch4 GOF的MCL);Toledo(DLBCL);RC(双重打击DLBCL-MYC,BCL2);SUDHL-4(DLBCL);和SUDHL-6(DLBCL))的细胞24小时。通过流式细胞测量术(FACS分析)观测到细胞表面BCMA含量。*指示遗漏数据点。
图4B.在用γ分泌酶抑制剂(GSI),化合物22处理之后,BCMA在淋巴瘤细胞系中的水平。用0、1nM、10nM、100nM、500nM、1000nM或10000nM的GSI,化合物22处理来自五个不同淋巴瘤细胞系(SP49(具有Notch4 GOF的MCL);Toledo(DLBCL);RC(双重打击DLBCL-MYC,BCL2);SUDHL-4(DLBCL);和SUDHL-6(DLBCL))的细胞24小时。通过流式细胞测量术(FACS分析)观测到细胞表面BCMA含量。
图5A.在用γ分泌酶抑制剂(GSI)处理之后,BCMA在B-ALL细胞系RSV411中的含量。用GSI(化合物1和化合物22)的不同浓度(0-10μM)处理来自急性B细胞淋巴母细胞白血病(B-ALL)细胞系RSV411的细胞24小时。通过流式细胞测量术(FACS分析)观测到细胞表面BCMA含量。
图5B.在用γ分泌酶抑制剂(GSI)处理之后,BCMA在B-ALL细胞系REH中的含量。用GSI(化合物1和化合物22)的不同浓度(0-10μM)处理来自急性B细胞淋巴母细胞白血病(B-ALL)细胞系REH的细胞24小时。通过流式细胞测量术(FACS分析)观测到细胞表面BCMA含量。
图5C.在用γ分泌酶抑制剂(GSI)处理之后,BCMA在B-ALL细胞系O18Z中的含量。用GSI(化合物1和化合物22)的不同浓度(0-10μM)处理来自急性B细胞淋巴母细胞白血病(B-ALL)细胞系018Z的细胞24小时。通过流式细胞测量术(FACS分析)观测到细胞表面BCMA含量。
具体实施方式
在以下详细描述中,阐述了许多具体细节以便提供对本发明的透彻理解。然而,本领域技术人员将理解,可以在没有这些具体细节的情况下实践本发明。在其它情况下,没有详细描述众所周知的方法、程序和组件,以免使本发明含糊不清。
在一个实施例中,本发明的组合物或用于本发明的方法的组合物包含一种或多种γ分泌酶抑制剂。在一个实施例中,γ分泌酶抑制剂包含双氟烷基-1,4-苯并二氮杂
双氟烷基-1,4-苯并二氮杂
在一个实施例中,本发明提供包含由式(I)结构表示的化合物的组合物:
和/或其至少一种盐,其中:
R
R
R
R
R
R
环A是苯基或吡啶基;
每一R
每一R
y是零、1或2;且
z是零、1或2。
在一个实施例中,本发明提供包含如本文所述的化合物的组合物,其以4mg的剂量调配。在一个实施例中,本发明提供包含如本文所述的化合物的组合物,其被调配成用于静脉内施用。
在一个实施例中,本发明提供包含由式(II)结构表示的化合物的组合物:
其中R
在一个实施例中,本发明提供包含式(III)化合物的组合物:
或其前药或盐;其中:
R
R
R
每一R
y为零、1或2。
在一个实施例中,R
在一个实施例中,式(III)化合物包含:(2R,3S)-N-((3S)-1-甲基-2-氧代-5-苯基-2,3-二氢-1H-1,4-苯并二氮杂
在另一实施例中,式(III)化合物包含:(2R,3S)-N-((3S)-2-氧代-5-苯基-2,3-二氢-1H-1,4-苯并二氮杂
在另一实施例中,式(III)化合物包含:(2R,3S)-N-((3S)-1-甲基-2-氧代-5-苯基-2,3-二氢-1H-1,4-苯并二氮杂
在另一实施例中,式(III)化合物包含:(2R,3S)-N-((3S)-1-甲基-2-氧代-5-苯基-2,3-二氢-1H-1,4-苯并二氮杂
在另一实施例中,式(III)化合物包含:(2R,3S)-N-((3S)-1-(
在另一实施例中,式(III)化合物包含式(VI)的化合物:
在一个实施例中,其包含(2R,3S)-N-((3S)-7-氯-1-甲基-2-氧代-5-苯基-2,3-二氢-1H-1,4-苯并二氮杂
在另一实施例中,式(III)化合物包含式(VII)化合物:
在一个实施例中,其包含(2R,3S)-N-((3S)-9-甲氧基-2-氧代-5-苯基-2,3-二氢-1H-1,4-苯并二氮杂
在另一实施例中,式(III)化合物包含:(2R,3S)-N-((3S)-2-氧代-5-苯基-2,3-二氢-1H-1,4-苯并二氮杂
在另一实施例中,式(III)化合物包含:(2R,3S)-N-((3S)-8-甲氧基-2-氧代-5-苯基-2,3-二氢-1H-1,4-苯并二氮杂
在另一实施例中,式(III)化合物包含:(2R,3S)-N-((3S)-9-((2-甲氧基乙基)氨基)-2-氧代-5-苯基-2,3-二氢-1H-1,4-苯并二氮杂
在另一实施例中,本发明提供了包含由式(I)结构表示的化合物的组合物:
和/或其至少一种盐,其中:
R
R
R
R
R
R
环A是苯基或吡啶基;
每一R
每一R
y是零、1或2;且
z是1或2。
在另一实施例中,环A为苯基;且R
在另一实施例中,本发明提供包含由式(IV)结构表示的化合物的组合物:
在另一实施例中,本发明提供包含由式(V)结构表示的化合物的组合物:
其中R
在另一实施例中,本发明提供包含以下的组合物:(2R,3S)-N-((3S)-5-(3-氟苯基)-9-甲基-2-氧代-2,3-二氢-1H-1,4-苯并二氮杂
在另一实施例中,本发明提供了包含由式(I)结构表示的化合物的组合物:
和/或其至少一种盐,其中:
R
R
R
R
R
R
环A是苯基或吡啶基;
每一R
每一R
y是零、1或2;且
z为零、1或2
其限制条件是如果环A为苯基,z为零,且y为1或2,那么至少一个R
C
其限制条件是如果R
其限制条件是如果R
在另一实施例中,如上文所描述的结构包含以下条件中的一条或多条:其限制条件是如果环A为苯基,z为零,且y为1或2,那么至少一个R
在另一实施例中,本发明提供包含由以下结构表示的化合物的组合物:
在另一实施例中,如本文所描述的化合物包含化合物中的一种或多种的前药。
美国专利第9,273,014号(其以全文引用的方式并入本文中)公开各种式(I)化合物:
和/或其至少一种盐,其中:
R
R
R
R
R
R
环A是苯基或吡啶基;
每一R
每一R
y为零、1或2;且
z是1或2。
美国专利第9,273,014号还公开了式(22)化合物:
在一个实施例中,其化学名称为(2R,3S)-N-((3S)-5-(3-氟苯基)-9-甲基-2-氧代-2,3-二氢-1H-1,4-苯并二氮杂
美国专利第8,629,136号(其以全文引用的方式并入本文中)公开了式(III)化合物:
和/或其至少一种盐,其中:
R
每一R
美国专利第8,629,136号还公开了式(1)化合物:
在一个实施例中,其化学名称为(2R,3S)-N-((3S)-1-甲基-2-氧代-5-苯基-2,3-二氢-1H-1,4-苯并二氮杂
在不脱离本发明的精神或基本属性的情况下,可以以其它特定形式实施本发明。本发明涵盖本文中所指出的本发明的方面和/或实施例的所有组合。应理解,本发明的任何和所有实施例可与任何其它一个实施例或多个实施例结合以描述其它实施例。还应理解,实施例的每一个别要素意图与来自任何实施例的任何和所有其它要素组合以描述其它实施例。
在一个实施例中,本发明的组合物或用于本发明方法的组合物包含一种或多种嵌合抗原受体T细胞(CAR-T细胞)。
嵌合抗原受体T细胞(CAR-T细胞)
嵌合抗原受体(CAR)是并入有抗原识别域、共刺激域和T细胞活化域的蛋白质。经遗传修饰以表达CAR的T细胞特异性地识别和消除表达靶抗原的恶性细胞。
CAR-T细胞疗法是第二种美国食品和药品管理局(U.S.Food and DrugAdministration)批准的基因疗法。然而,CAR-T细胞在治疗肿瘤中的疗效不可预测,因为肿瘤产生避开被免疫系统消除的机制,例如经由遏制局部免疫细胞活性。因此,CAR-T细胞作为单独治疗可能有局限性。然而,将CAR-T细胞疗法与其它化合物(如本文所描述的组合)组合可以显著增加CAR-T细胞疗法的疗效。
在一个实施例中,嵌合抗原受体(CAR)是由融合到细胞外肿瘤结合部分的细胞内T细胞信号传导域(最通常为来自单克隆抗体的单链可变片段(scFv))构成的一类靶向抗原的受体。CAR直接识别细胞表面抗原,而与受MHC介导的呈递无关,从而允许在所有患者中使用对任何给定抗原具有特异性的单个受体构建体。最初的CAR将抗原识别域融合到T细胞受体(TCR)复合物的CD3ζ激活链上。虽然这些第一代CAR在活体外诱导T细胞效应功能,但其在很大程度上受到体内不良抗肿瘤疗效的限制。随后的CAR迭代包括与CD3ζ串联的次级共刺激信号,包括来自CD28的细胞内结构域或多种TNF受体家族分子,例如4-1BB(CD137)和OX40(CD134)。此外,第三代受体除CD3ζ外还包括两个共刺激信号,最常见的来自CD28和4-1BB。第二和第三代CAR显著改良抗肿瘤疗效,在某些情况下,诱导某一部分晚期癌症患者完全缓解。在一个实施例中,4-1BB域针对较低的急性毒性和较持久的CAR T细胞存留优化。
在一个实施例中,CAR-T细胞为包含抗原受体的免疫反应性细胞,其在其受体结合到其抗原时活化。
在一个实施例中,如本文所公开的组合物和方法中使用的CAR-T细胞为第一代CAR-T细胞。在另一实施例中,如本文所公开的组合物和方法中使用的CAR-T细胞为第二代CAR-T细胞。在另一实施例中,如本文所公开的组合物和方法中使用的CAR-T细胞为第三代CAR-T细胞。在另一实施例中,如本文所公开的组合物和方法中使用的CAR-T细胞为第四代CAR-T细胞。
在一个实施例中,可以通过引入额外基因(包括编码增殖细胞因子的那些基因(即,IL-12)或共刺激性配体(即,4-1BBL))来进一步增强CAR修饰的T细胞效能,因此产生“装甲(armored)”第四代CAR修饰的T细胞。在一个实施例中,“装甲的CAR-T细胞”是受抑制性肿瘤微环境保护的CAR-T细胞。在另一实施例中,“装甲”CAR技术并入可溶信号传导蛋白的局部分泌,以在肿瘤微环境内放大免疫反应,目标是使全身性副作用降至最小。在一个实施例中,信号传导蛋白信号为IL-12,其可刺激T细胞活化和募集。在一个实施例中,“装甲”CAR技术尤其适用于实体肿瘤适应症,其中微环境和强效免疫抑制机制具有使建立稳固抗肿瘤反应更具挑战性的潜力。
在一个实施例中,CAR T细胞经遗传修饰以编码参与预防细胞凋亡、重构肿瘤微环境、诱导稳态增殖和促进定向的T细胞归巢的趋化因子受体的分子。
在另一实施例中,使用细胞因子转基因的表达、与小分子抑制剂的组合疗法或单克隆抗体来增强如本文所公开的组合物和方法中使用的CAR T细胞疗法。在另一实施例中,旨在改良CART细胞疗法(包括使用双CAR和趋化因子受体以更确切地靶向肿瘤细胞)的其它策略被视为如本文所公开的CAR T细胞和CAR T细胞疗法的一部分。
在一个实施例中,如本文所公开的组合物和方法的CAR T细胞包含可以产生抑制性或放大信号的第二结合域,以便增加CAR T细胞针对癌细胞相对于正常细胞的特异性。举例来说,可以工程改造CAR T细胞使得其将在一种靶蛋白存在下触发,但如果存在第二种蛋白质,那么其将被抑制。替代地,其还可以被工程改造以使得最大活化将需要两种靶蛋白。这些方法可以相对于正常组织增加CAR对肿瘤的特异性。
在另一实施例中,可使用重定向于通用细胞因子杀伤(TRUCK)的T细胞。在一个实施例中,TRUCK为一种通过产生和释放转基因产物(例如IL-12)以活化针对对CAR-T细胞不可见的肿瘤细胞的先天性免疫反应来重定向CAR-T细胞的方式。在另一实施例中,除识别标靶肿瘤细胞和分泌细胞毒性颗粒蛋白质(穿孔素、颗粒酶B)以外,CAR OT-I细胞还诱导连续杀伤。在另一实施例中,CAR-T细胞被工程改造以产生干扰素γ。在另一实施例中,CAR-T细胞功能经由巨噬细胞和NK细胞的共活化改良。
在一个实施例中,如本文所公开的组合物和方法中使用的CAR T细胞编码基于抗体的外部受体结构和编码由基于免疫受体酪氨酸的活化基元构成的信号转导模块的胞质域。
因此,如本文所公开的一个实施例涉及细胞毒性免疫细胞(例如NK细胞或T细胞),其包含嵌合抗原受体(CAR),由此细胞保持其细胞毒性功能。在另一实施例中,嵌合抗原受体对T细胞是外源性的。在另一实施例中,CAR以重组方式表达。在另一实施例中,CAR由载体表达。
在一个实施例中,用于产生CAR T细胞的T细胞为初始CD4
在一个实施例中,本文公开了包含经遗传修饰的免疫细胞的组合物。在另一实施例中,经遗传修饰的免疫细胞为T细胞。在另一实施例中,T细胞为初始T细胞。在另一实施例中,T细胞为初始CD4
在一个实施例中,免疫细胞是细胞毒性的。在另一实施例中,可以从个体的骨髓(自体)或供体(同种异体)获得遗传修饰的细胞毒性细胞。在其它情况下,细胞获自干细胞。举例来说,细胞毒性细胞可以来源于人类多能干细胞,如人类胚胎干细胞或人类诱导多能T细胞。在诱导多能干细胞(IP)的情况下,此类多能干T细胞可以使用来自将对其提供经遗传修饰的细胞毒性细胞的个体的体细胞获得。在一个实施例中,免疫细胞可以通过以下方式从个体或供体获得:通过静脉穿刺、通过单采血液成分术、通过白色细胞移动接着单采血液成分术或静脉穿刺或通过骨髓穿刺来收集细胞。
在一个实施例中,免疫细胞(例如T细胞)通过体内特定因子的存在产生和扩增。在另一实施例中,T细胞产生和维持受体内细胞因子影响。在另一实施例中,体内影响T辅助细胞的产生和维持的细胞因子包含IL-1、IL-2、IL-4、IL-6、IL-12、IL-21、IL-23、IL-25、IL-33和TGFβ。
已经在文献中广泛地描述了CAR T细胞,参见例如Themelli等人(2015)《T细胞工程改造和过继免疫治疗的新细胞来源(New Cell Sources for T Cell Engineering andAdoptive Immunotherapy)》,《细胞干细胞(Cell Stem Cell)》16:357-366;Sharpe和Mount(2015)《癌症疗法中经遗传修饰的T细胞:机会和挑战(Genetically modified T cells incancer therapy:opportunities and challenges)》,疾病模型与机制(Disease Models&Mechanisms)8:337-350;Han等人(2013),《血液学和肿瘤学杂志(Journal of Hematology&Oncology)》6:47-53;Wilkie等人(2010),《生物化学杂志(J Bio Chem)》285(33):25538-25544;和van der Stegen等人(2013),《免疫学杂志(J.Immunol)》191:4589-4598。CAR T细胞可从商业来源(如创意生物实验室(Creative Biolabs)(美国纽约))获得,所述公司提供嵌合抗原受体(CAR)的定制构建和生产服务并且还提供预制的CAR构建体储备体,其可诱导由重组腺病毒疫苗编码的保护性免疫。
T细胞受体(TCR)细胞
在一个实施例中,如本文所公开的组合物和方法除CAR T细胞以外或代替CAR T细胞,还利用设计者T细胞受体(TCR)细胞。TCR为介导T细胞的抗原特异性活化的多亚基跨膜复合物。TCR由两个不同的多肽链构成。TCR通过识别靶细胞(例如肿瘤或癌细胞)上的抗原表位赋予T细胞抗原特异性。在与肿瘤或癌细胞上存在的抗原接触之后,T细胞增殖并且获得允许其消除癌症或肿瘤细胞的表型和功能。
在一个实施例中,TCR T细胞疗法包含将对所关注的蛋白质的表位具有特异性的T细胞受体(TCR)引入到T细胞中。在另一实施例中,所关注的蛋白质为肿瘤相关抗原。在另一实施例中,被基因工程改造的TCR识别肿瘤细胞以及T细胞活化域上的主要组织相容性复合物(MHC)所展现的肿瘤抗原表位。在另一实施例中,T细胞受体识别抗原而无关于其细胞内或膜定位。在另一实施例中,TCR识别细胞内表达肿瘤相关抗原的肿瘤细胞。在一个实施例中,TCR识别内部抗原。在另一实施例中,TCR识别血管生成因子。在另一实施例中,血管生成因子是参与形成新血管的分子。本领域中已知各种经遗传修饰的T细胞受体和其生产方法。
在一个实施例中,TCR T细胞疗法用于治疗、预防、抑制、改善、降低癌症或肿瘤的发病率或缓解癌症或肿瘤。在一个实施例中,TCR T细胞疗法用于治疗、预防、抑制、改善、降低晚期转移性疾病的发病率或缓解晚期转移性疾病,包括具有血液(淋巴瘤和白血病)和实体肿瘤(难治性黑素瘤、肉瘤)的疾病。在一个实施例中,如本文所公开的组合物和方法中使用的TCR T细胞疗法治疗以下中所列出的恶性肿瘤:表1,Sadelain等人《癌症的发现(Cancer Discov.)》2013年4月;3(4):388-398),其以全文引用的方式并入本文中。
在另一实施例中,对T细胞受体进行遗传修饰以结合NY-ESO-1表位,并且TCR工程改造的T细胞是抗NY-ESO-1。在另一实施例中,对T细胞受体进行遗传修饰以结合HPV-16E6表位,并且TCR工程改造的T细胞是抗HPV-16E6。在另一实施例中,对T细胞受体进行遗传修饰以结合HPV-16E7表位,并且TCR工程改造的T细胞是抗HPV-16E7。在另一实施例中,对T细胞受体进行遗传修饰以结合MAGE A3/A6表位,并且TCR工程改造的T细胞是抗MAGE A3/A6。在另一实施例中,对T细胞受体进行遗传修饰以结合MAGE A3表位,并且TCR工程改造的T细胞是抗MAGE A3。在另一实施例中,对T细胞受体进行遗传修饰以结合SSX2表位,并且TCR工程改造的T细胞是抗SSX2。在另一实施例中,对T细胞受体进行遗传修饰以结合本文所公开的靶抗原。使用本领域中熟知的工具,技术人员将了解,可以对T细胞受体进行遗传修饰以结合存在于癌症或肿瘤细胞上的靶抗原,其中TCR工程改造的T细胞包含抗肿瘤或抗癌细胞。
在一个实施例中,如本文所公开的方法包含从个体获得免疫细胞,并且遗传修饰免疫细胞以表达重组T细胞受体(TCR)。在另一实施例中,如本文所公开的方法包含从个体获得免疫细胞、对免疫细胞进行遗传修饰以表达重组TCR且与额外药剂组合,其中所述额外药剂包含凋亡细胞群体、凋亡细胞上清液、CTLA-4阻断剂、α-1抗胰蛋白酶或其片段或其类似物、基于碲的化合物或免疫调节剂或其任何组合。
TCR T细胞已在文献中广泛地描述到,参见例如Sharpe和Mount(2015)同上;Essand M、Loskog ASI(2013),《用于治疗癌症的被基因工程改造的T细胞(综述)(Genetically engineered T cells for the treatment of cancer(Review))》,内科学杂志(J Intern Med)273:166-181;以及Kershaw等人(2014)《经遗传修饰的T细胞在癌症疗法中的临床应用(Clinical application of genetically modified T cells in cancertherapy)》,《临床和转译免疫学(Clinical&Translational Immunology)》3:1-7。
其它免疫治疗剂
在另一实施例中,本发明提供一种组合物,其包含一种或多种由如本文所述的式(I)结构表示的化合物以及癌症疫苗。在另一实施例中,本发明提供一种组合物,其包含一种或多种如本文所描述的由式(I)结构表示的化合物和免疫治疗剂。在一个实施例中,免疫治疗剂包含单克隆抗体。
在另一实施例中,本发明提供一种组合物,其包含一种或多种靶向B细胞成熟抗原(BCMA)的免疫治疗剂、一种或多种免疫治疗性化合物和一种或多种由式(I)结构表示的化合物:
和/或其至少一种盐,其中:
R
R
R
R
R
R
环A是苯基或吡啶基;
每一R
每一R
y是零、1或2;且
z是零、1或2。
在另一实施例中,z是1或2。
在一个实施例中,靶向BCMA的免疫治疗剂包含抗体药物结合物、双特异性抗体、三特异性抗体、三功能抗体、化学连接的Fab或双特异性T细胞接合物(BiTE)。
在另一实施例中,本发明还提供一种如本文所描述的方法,其包含以下步骤:向个体施用包含一种或多种靶向B细胞成熟抗原(BCMA)的免疫治疗剂的第一组合物、包含一种或多种免疫治疗性化合物的第二组合物以及包含一种或多种由式(I)结构表示的化合物的第三组合物:
和/或其至少一种盐,其中:
R
R
R
R
R
R
环A是苯基或吡啶基;
每一R
每一R
y是零、1或2;且
z是零、1或2。
在另一实施例中,z是1或2。
靶向抗原
在一个实施例中,CAR或TCR经由针对抗原的抗体或抗体片段结合到抗原的表位。在另一实施例中,抗体为单克隆抗体。在另一实施例中,抗体为多克隆抗体。在另一实施例中,抗体片段为单链可变片段(scFv)。
用于CAR T细胞疗法的适当靶抗原应均匀地表达于待治疗的恶性肿瘤上,且不应在正常基本细胞上表达。B细胞成熟抗原(BCMA)为此类适当的靶抗原。BCMA为肿瘤坏死因子超家族的成员。在血细胞中,BCMA仅由一些B细胞、正常浆细胞和恶性浆细胞表达;BCMA不由造血干细胞表达。由具有多发性骨髓瘤(MM)的多个案例的恶性浆细胞均匀地表达BCMA,且不由正常基本非造血组织表达BCMA。因此,在一个实施例中,CAR-T靶抗原是BCMA。
可与如本文所描述的由式(I)结构表示的一种或多种化合物组合使用的BCMA靶向方法为本领域中已知的,且包括BCMA引导的CAR-T、抗体药物结合物、双特异性抗体和三特异性抗体。
BCMA CAR-T细胞为本领域中已知的且描述于例如WO2016090320A1中,其以全文引用的方式并入本文中。在另一实施例中,来自以下的BCMA CAR-T细胞或其一组合可以用于本发明中:与宾夕法尼亚大学合作的诺华公司(Novartis)(在一个实施例中CAR-T BCMA细胞,在另一实施例中MTV273,在另一实施例中MCM998),优卡迪疗法生物医学公司(Unicar-Therapy Biomedicine)(在一个实施例中,CD19和BCMA特异性CAR-T细胞),蓝鸟公司和塞尔基因公司(Bluebird&Celgene)(在一个实施例中Bb2121,在另一实施例中Bb21217,在另一实施例中JCARH123),吉利德/凯特(Gilead/Kite)(在一个实施例中,KITE-585),波塞冬治疗公司(Poseida Therapeutics Inc.)(在一个实施例中,P-BCMA-101),CARsgen治疗有限公司(CARsgen therapeutics Co.Ltd)(在一个实施例中,CAR-BCMA),塞尔基因(朱诺(Juno))(在一个实施例中,JCARH125),Cellectis公司、Allogene公司和辉瑞(Pfizer)公司联盟、美国国家卫生研究院(National Institutes of Health)(在一个实施例中,CAR-BCMA),Autolus有限公司(在一个实施例中,APRIL CAR(AUTO02)),Celyad公司。
在一个实施例中,CAR-T细胞具有多于一个标靶。在一个实施例中,CAR-T细胞具有两个标靶。在一个实施例中,两个标靶包含BCMA和跨膜活化子和CAML相互作用子(TACI)。
在一个实施例中,用于如本文所描述的组合物和方法的抗体-药物结合物包含化疗药物。在一个实施例中,抗体-药物结合物是来自蓝鸟公司和塞尔基因公司(苏特罗公司(Sutro))(在一实施例中,BCMA ADC)。
在一个实施例中,抗体-药物结合物中的药物包含抗有丝分裂剂单甲基奥瑞他汀F(Monomethyl auristatin F,MMAF)。在一个实施例中,包含MMAF的抗体-药物结合物包含来自GSK的GSK2857916。
在一个实施例中,抗体-药物结合物中的药物包含鹅膏菌素(Amanitin),在一个实施例中,所述鹅膏菌素杀伤分裂和静止的肿瘤细胞;真核转录的特异性且有效的抑制剂,确切地说,抑制RNA聚合酶II,并且由于低膜渗透率而使游离毒素具有低毒性。在一个实施例中,包含鹅膏菌素的抗体-药物结合物是HDP-101,获自海德堡制药公司(HeidelbergPharma AG)。
在一个实施例中,抗体-药物结合物经由马来酰亚胺己酰基连接子连接。在一个实施例中,包含马来酰亚胺己酰基连接子的抗体-药物结合物包含来自GSK的GSK2857916。
在一个实施例中,用于本发明组合物和方法的靶向BCMA的双特异性抗体包含来自蓝鸟公司和塞尔基因公司的双特异性抗体(在一实施例中,CC93569)。在一个实施例中,双特异性抗体包含T细胞双特异性抗体。在另一实施例中,双特异性抗体包含三功能抗体、以化学方式连接的Fab或双特异性T细胞接合物(BiTE)。在一个实施例中,T细胞接合物靶向CD3 T细胞和BCMA。在一个实施例中,T细胞接合物包含CC-93269。在另一实施例中,T细胞接合物包含安进公司(Amgen)(BI)的AMG 420(BI836909)。在另一实施例中,T细胞接合物包含安进的AMG 701。在另一实施例中,T细胞接合物包含哈泊(Harpoon)的HPN217。在另一实施例中,T细胞接合物包含含三个结合域的单一柔性多肽。
在一个实施例中,靶向BCMA的双特异性抗体针对BCMA和CD16A+。在一个实施例中,CD16A+(Fc受体FcγRIIIa)涉及由NK细胞引发裂解,其在一个实施例中有助于改良治疗的疗效。在一个实施例中,针对BCMA和CD16A+的双特异性抗体是Affimed N.V.公司的AFM26。
在一个实施例中,靶向BCMA的双特异性抗体包含针对两个不同BCMA表位的双特异性抗体。在一个实施例中,激活两个关键BCMA表位有助于改良治疗的疗效。在一个实施例中,针对两个关键BCMA表位的靶向BCMA的双特异性抗体包含南京联想生物科技有限公司(Nanjjing Legend Biotech Co.Ltd.)的LCAR-B38M。
在一个实施例中,靶向BCMA的双特异性抗体包含针对BCMA和CD3的双特异性抗体。在一个实施例中,CD3激活细胞毒性T细胞和T辅助细胞两者,在一个实施例中,其改良治疗的疗效。在一个实施例中,针对于BCMA和CD3的双特异性抗体包含塞尔基因公司的EM801。在另一实施例中,针对BCMA和CD3的双特异性抗体包含辉瑞的PF-06863135。在另一实施例中,针对于BCMA和CD3的双特异性抗体包含Teneobio公司的TNB-381M、TNB-383M或TNB-383B。在另一实施例中,针对于BCMA和CD3的双特异性抗体包含强生公司(Johnson&Johnson)的JNJ-64007957。在另一实施例中,针对于BCMA和CD3的双特异性抗体包含安进(BI)的AMG 420(BI836909)。在一个实施例中,双特异性抗体包含全人类VH域。
在另一实施例中,可以在本发明的组合物和方法中使用靶向BCMA的三特异性抗体。在一个实施例中,三特异性抗体针对人类血清白蛋白(HSA)、CD3和BCMA。在一个实施例中,三特异性抗体包含哈泊的HPN217。
在一个实施例中,BCMA为具有下文阐述的氨基酸序列或其片段的人类BCMA:
MLQMAGQCSQNEYFDSLLHACIPCQLRCSSNTPPLTCQRYCNASVTNSVKGTNAILWTCLGLSLIISLAVFVLMFLLRKINSEPLKDEFKNTGSGLLGMANIDLEKSRTGDEIILPRGLEYTVEECTCEDCIKSKPKVDSDHCFPLPAMEEGATILVTTKTNDYCKSLPAALSATEIEKSISAR(SEQ ID NO:1)。
在另一实施例中,如本文所公开的组合物和方法的CAR T细胞表达肿瘤抗原。在另一实施例中,肿瘤抗原通过γ分泌酶裂解。在一个实施例中,通过γ分泌酶裂解的肿瘤抗原包含BCMA。在另一实施例中,通过γ分泌酶裂解的肿瘤抗原包含血管内皮生长因子受体(VEGFR)。在一个实施例中,VEGFR包含VEGFR-1。在一个实施例中,VEGFR包含VEGFR-2。在另一实施例中,通过γ分泌酶裂解的肿瘤抗原包含CD44或ErbB4。
在另一实施例中,如本文所公开的组合物和方法的CAR T细胞靶向γ分泌酶的底物。在一个实施例中,γ分泌酶底物包含分化簇43(CD43)、CD44、集落刺激因子1受体(CSF1R、CSF-1R)、Delta1、E钙粘蛋白、肝配蛋白B1、肝配蛋白B2、EphB2、ErB4、生长激素受体(GHR)、HLA-A2、胰岛素样生长因子1受体(IGF-1R)、干扰素α和干扰素β受体亚基2(IFNaR2)、介白素1受体类型2(IL1R2)、受体(IR)、Ire1a、Jagged2、脂蛋白受体相关蛋白(LRP)、LRP1B、N钙粘蛋白、Nectin-1α、Notch1、Notch2、Notch3、Notch4或其一组合。
在另一实施例中,γ分泌酶底物包含在结肠直肠癌中缺失的阿尔卡丁(alcadein)-α阿尔卡丁-γ、淀粉样β前驱体样蛋白1(APLP1)、APLP2、载脂蛋白E受体2(ApoER2)、淀粉样前驱体蛋白(APP)、趋化因子(C-X-C基元)配体16(CXCL16)、CX3CL1(在结肠直肠癌中缺失(DCC))、L1、LRP2、LRP6、神经营养素受体类似的死亡域蛋白(NRADD)、p75-神经营养素受体(NTR)、多囊性肾脏和肝病1(PKHD1)、原钙粘蛋白(Pcdh)α4、Pcdhγ-C3、蛋白酪氨酸磷酸酶(PTP)κ、PTPμ、PTP-白血球常见抗原相关蛋白(LAR)、含有Sortilin相关VPS10域的受体1b(SorCS1b)、具有A型重复片段的分选相关受体(SorLA)、Sortilin、多配体蛋白聚糖-3、酪氨酸酶、酪氨酸相关蛋白1(TYRP1)、TYRP2、血管内皮生长因子(VEGF)-1R、VEGF-R1、电压门控钠通道(VGSC)β2、极低密度脂蛋白受体(VLDLR)或其一组合。
在另一实施例中,如本文所公开的组合物的CAR T细胞表达肿瘤相关抗原(TAA)。在一个实施例中,肿瘤相关抗原是:粘蛋白1、细胞表面相关(MUC1)或多态上皮粘蛋白(PEM)、富含精氨酸在早期肿瘤中突变的(Armet)、热冲击蛋白60(HSP60)、钙联蛋白(calnexin)(CANX)、次甲基四氢叶酸脱氢酶(NADP+依赖性)2、次甲基四氢叶酸环水解酶(MTHFD2)、成纤维细胞活化蛋白(FAP)、基质金属肽酶(MMP6)、B黑素瘤抗原-1(BAGE-1)、N-乙酰基葡糖胺基转移酶V的异常转录物(GnTV)、Q5H943、癌胚抗原(CEA)、Pmel、激肽释放酶-4、乳房珠蛋白-1、MART-1、GPR143-OA1、前列腺特异性抗原(PSA)、TRP1、酪氨酸酶、FGP-5、NEU原癌基因、Aft、MMP-2、前列腺特异性膜抗原(PSMA)、端粒酶相关蛋白-2、前列腺酸性磷酸酶(PAP)、尿溶蛋白II或蛋白酶3。
在另一实施例中,如在白血病中想要破坏B细胞的情况下,CAR结合到CD19或CD20以靶向B细胞。CD19为B细胞谱系特异性表面受体,其从祖B细胞到早期浆细胞的广泛表达使得其对于B细胞恶性肿瘤的免疫疗法而言成为引人注目的标靶。在另一实施例中,CAR与CD116结合。在另一实施例中,CAR与ROR1、CD22或GD2结合。在另一实施例中,CAR与NY-ESO-1结合。在另一实施例中,CAR与MAGE家族蛋白结合。在另一实施例中,CAR与间皮素(MSLN)结合。在另一实施例中,CAR与c-erbB2结合。在另一实施例中,CAR结合肿瘤特异性的突变抗原,例如BRAFV600E突变和BCR-ABL易位。在另一实施例中,CAR结合肿瘤特异性的病毒抗原,例如HD中的EBV,宫颈癌中的HPV和默克尔癌(Merkel cancer)中的多瘤病毒。在另一实施例中,CAR T细胞结合到Her2/neu。在另一实施例中,CAR T细胞结合到EGFRvIII。
在一实施例中,嵌合抗原受体(CAR)T细胞结合CD19抗原。在另一实施例中,CAR T细胞结合CD22抗原。在另一实施例中,CAR T细胞结合α叶酸受体。在另一实施例中,CAR T细胞结合至羧基酸酐酶-IX(CAIX)。在另一实施例中,CAR T细胞结合到CD20。在另一实施例中,CAR T细胞结合到CD23。在另一实施例中,CAR T细胞结合到CD24。在另一实施例中,CART细胞结合到CD30。在另一实施例中,CAR T细胞结合到CD33。在另一实施例中,CAR T细胞结合到CD38。在另一实施例中,CAR T细胞结合到CD44v6。在另一实施例中,CAR T细胞结合到CD44v7/8。在另一实施例中,CAR T细胞结合到CD123。在另一实施例中,CAR T细胞结合到CD171。在另一实施例中,CAR T细胞结合到癌胚抗原(CEA)。在另一实施例中,CAR T细胞结合到EGFRvIII。在另一实施例中,CAR T细胞结合到EGP-2。在另一实施例中,CAR T细胞结合到EGP-40。在另一实施例中,CAR T细胞结合到EphA2。在另一实施例中,CAR T细胞结合到Erb-B2。在另一实施例中,CAR T细胞结合到Erb-B 2,3,4。在另一实施例中,CAR T细胞结合到Erb-B3/4。在另一实施例中,CAR T细胞结合到FBP。在另一实施例中,CAR T细胞结合到胎儿乙酰胆碱受体。在另一实施例中,CAR T细胞结合到G
在另一实施例中,嵌合抗原受体(CAR)T细胞靶向CD19抗原,并且对患有B细胞恶性肿瘤、ALL、滤泡性淋巴瘤、CLL和淋巴瘤的个体具有治疗作用。在另一实施例中,CAR T细胞靶向CD22抗原,并且对患有B细胞恶性肿瘤的个体具有治疗作用。在另一实施例中,CAR T细胞靶向α叶酸受体或叶酸受体α(FR-α),并且对患有卵巢癌或上皮癌的个体具有治疗作用。在另一实施例中,CAR T细胞靶向CAIX或G250/CAIX,并且对患有肾细胞癌的个体具有治疗作用。在另一实施例中,CAR T细胞靶向CD20,并且对患有淋巴瘤、B细胞恶性肿瘤、B细胞淋巴瘤、套细胞淋巴瘤和惰性B细胞淋巴瘤的个体具有治疗作用。在另一实施例中,CAR T细胞靶向CD23,并且对患有CLL的个体具有治疗作用。在另一实施例中,CAR T细胞靶向CD24,并且对患有胰腺癌的个体具有治疗作用。在另一实施例中,CAR T细胞靶向CD30,并且对患有淋巴瘤或霍奇金淋巴瘤(Hodgkin lymphoma)的个体具有治疗作用。在另一实施例中,CAR T细胞靶向CD33,并且对患有AML的个体具有治疗作用。在另一实施例中,CAR T细胞靶向CD38,并且对患有非霍奇金淋巴瘤的个体具有治疗作用。在另一实施例中,CAR T细胞靶向CD44v6,并且对患有几种恶性肿瘤的个体具有治疗作用。在另一实施例中,CAR T细胞靶向CD44v7/8,并且对患有宫颈癌的个体具有治疗作用。在另一实施例中,CAR T细胞靶向CD123,并且对患有骨髓恶性肿瘤的个体具有治疗作用。在另一实施例中,CAR T细胞靶向CEA,且对患有结肠直肠癌、结肠直肠瘤、胰脏腺癌、乳腺癌的个体具有治疗作用。在另一实施例中,CAR T细胞靶向EGFRvIII,并且对患有胶质母细胞瘤的个体具有治疗作用。在另一实施例中,CAR T细胞靶向表皮生长因子受体(EGFR),并且对患有NSCLC、上皮癌、神经胶质瘤的个体具有治疗作用。在另一实施例中,CAR T细胞靶向EGP-2,并且对患有多种恶性肿瘤的个体具有治疗作用。在另一实施例中,CAR T细胞靶向EGP-40,并且对患有结肠直肠癌的个体具有治疗作用。在另一实施例中,CAR T细胞靶向EphA2,并且对患有胶质母细胞瘤的个体具有治疗作用。在另一实施例中,CAR T细胞靶向Erb-B2或ErbB3/4,并且对患有乳腺癌和其它相关癌症、前列腺癌、结肠癌、各种肿瘤的个体具有治疗作用。在另一实施例中,CAR T细胞靶向Erb-B 2,3,4,并且对患有乳腺癌和其它相关癌症的个体具有治疗作用。在另一实施例中,CAR T细胞靶向FBP,并且对患有卵巢癌的个体具有治疗作用。在另一实施例中,CART细胞靶向胎儿乙酰胆碱受体,并且对患有横纹肌肉瘤的个体具有治疗作用。在另一实施例中,CAR T细胞靶向G
在另一实施例中,CAR结合到以下中所列出的靶抗原中的一个:表1,Sadelain等人《癌症的发现(Cancer Discov.)》2013年4月;3(4):388-398),其以全文引用的方式并入本文中。在另一实施例中,CAR T细胞表达碳水化合物或糖脂结构。
在一个实施例中,CAR与血管生成因子结合,从而靶向肿瘤脉管系统。在一实施例中,血管生成因子是VEGFR-2。在另一实施例中,血管生成因子是VEGFR-1。在另一实施例中,血管生成因子是内皮糖蛋白。在另一实施例中,本发明的血管生成因子是血管生成素;血管生成素-1;Del-1;成纤维细胞生长因子:酸性(aFGF)和碱性(bFGF);卵泡抑素;粒细胞集落刺激因子(G-CSF);肝细胞生长因子(HGF)/散射因子(SF);白介素8(IL-8);瘦素;中期因子;胎盘生长因子;血小板源性内皮细胞生长因子(PD-ECGF);血小板源性生长因子-BB(PDGF-BB);多效生长因子(Pleiotrophin,PTN);颗粒蛋白前体;增殖蛋白;转型生长因子α(TGF-α);转型生长因子β(TGF-β);肿瘤坏死因子α(TNF-α);血管内皮生长因子(VEGF)/血管通透性因子(VPF)。在另一实施例中,血管生成因子是血管生成蛋白。在一实施例中,生长因子是血管生成蛋白。在一个实施例中,用于本发明的组合物和方法中的一种血管生成蛋白是成纤维细胞生长因子(FGF);VEGF;VEGFR和神经毡蛋白1(NRP-1);血管生成素1(Ang1)和Tie2;血小板源性生长因子(PDGF;BB-均二聚体)和PDGFR;转型生长因子β(TGF-β),内皮糖蛋白和TGF-β受体;单核细胞趋化蛋白1(MCP-1);整合素αVβ3,αVβ5和α5β1;VE-钙粘蛋白和CD31;肝配蛋白;纤溶酶原活化剂;纤溶酶原活化抑制剂1;一氧化氮合成酶(NOS)和COX-2;AC133;或Id1/Id3。在一个实施例中,用于本发明的组合物和方法中的血管生成蛋白是血管生成素,在一个实施例中,其是血管生成素1、血管生成素3、血管生成素4或血管生成素6。在一个实施例中,内皮糖蛋白也称为CD105;EDG;HHT1;ORW;或ORW1。在一个实施例中,内皮糖蛋白是TGFβ共受体。
在另一实施例中,CAR T细胞表达与感染因子相关的抗原。在一实施例中,感染因子是结核分枝杆菌(Mycobacterium tuberculosis)。在一实施例中,所述结核分枝杆菌相关抗原是:抗原85B、脂蛋白IpqH、ATP依赖性解旋酶推定的未表征的蛋白质Rv0476/MTO4941前驱体或未表征的蛋白质Rv1334/MT1376前驱体。
在另一实施例中,CAR与抗体结合。在一个实施例中,CAR T细胞是“抗体偶联的T细胞受体”(ACTR)。根据这个实施例,CAR T细胞是通用CAR T细胞。在另一实施例中,具有抗体受体的CAR T细胞在施用抗体之前、之后或同时施用,且接着结合到抗体,使T细胞极为接近肿瘤或癌症。在另一实施例中,抗体针对肿瘤细胞抗原。在另一实施例中,抗体针对CD20。在另一实施例中,抗体是利妥昔单抗(rituximab)。
在另一实施例中,抗体是曲妥珠单抗(Trastuzumab)(赫赛汀(Herceptin);基因泰克(Genentech)):针对ERBB2的人源化IgG1。在另一实施例中,抗体是贝伐单抗(Bevacizumab)(阿瓦斯汀(Avastin);基因泰克/罗氏(Roche)):针对VEGF的人源化IgG1。在另一实施例中,抗体是西妥昔单抗(Cetuximab)(爱必妥(Erbitux);百时美施贵宝公司(Bristol-Myers Squibb)):针对EGFR的嵌合人-鼠IgG1。在另一实施例中,抗体是帕尼单抗(Panitumumab)(维克替比(Vectibix);安进):针对EGFR的人类IgG2。在另一实施例中,抗体是伊派利单抗(Ipilimumab)(益伏(Yervoy);百时美施贵宝公司):针对CTLA4的IgG1。
在另一实施例中,抗体为阿仑单抗(Alemtuzumab)(坎帕斯(Campath);健赞(Genzyme)):针对CD52的人源化IgG1。在另一实施例中,抗体是奥伐木单抗(Ofatumumab)(阿扎拉(Arzerra);Genmab),针对CD20的人类IgG1:在另一实施例中,抗体是吉妥单抗奥唑米星(Gemtuzumab ozogamicin)(麦罗塔(Mylotarg);惠氏(Wyeth)):针对CD33的人源化IgG4。在另一实施例中,抗体是贝伦妥单抗维多汀(Brentuximab vedotin)(阿德曲斯(Adcetris);西雅图遗传学公司(Seattle Genetics)):针对CD30的嵌合IgG1。在另一实施例中,抗体是90Y-标记的替坦异贝莫单抗(ibritumomab tiuxetan)(Zevalin(泽娃灵);IDEC制药):针对CD20的鼠类IgG1。在另一实施例中,抗体是131II标记的托西莫单抗(tositumomab)((Bexxar);葛兰素史克(GlaxoSmithKline)):针对CD20的鼠类IgG2。
在另一实施例中,抗体是雷莫芦单抗(Ramucirumab),其针对血管内皮生长因子受体2(VEGFR-2)。在另一实施例中,抗体是雷莫芦单抗(雷莫芦注射(Cyramza Injection),礼来公司(Eli Lilly and Company))、布林莫单抗(blinatumomab)(BLINCYTO,安进公司)、帕博利珠单抗(pembrolizumab)(克珠达(KEYTRUDA),默沙东公司(Merck Sharp&DohmeCorp.))、奥必珠单抗(obinutuzumab)(佳仕瓦(GAZYVA),基因泰克公司;此前被称为GA101)、帕妥珠单抗(pertuzumab)注射液(帕杰它(PERJETA),基因泰克公司)或地诺单抗(denosumab)(狄诺塞麦(Xgeva),安进公司)。在另一实施例中,抗体是巴利昔单抗(Basiliximab)(舒莱(Simulect);诺华(Novartis))。在另一实施例中,抗体是达利珠单抗(Daclizumab)(赛尼哌(Zenapax);罗氏)。
在另一实施例中,CAR T细胞所偶联的抗体针对本文所描述和/或本领域中已知的肿瘤或癌症抗原或其一部分。在另一实施例中,CAR T细胞所偶联的抗体针对肿瘤相关抗原。在另一实施例中,CAR T细胞所偶联的抗体针对肿瘤相关抗原或其作为血管生成因子的部分。
本领域的技术人员将了解,经遗传修饰的TCR可以被工程改造以识别上面所描述的CAR结合的任何抗原。在一个实施例中,TCR T细胞结合到上文所述的抗原,作为CAR T细胞结合标靶。在另一实施例中,TCR识别本文所公开的任何抗原。在另一实施例中,TCR识别的抗原为本文所述和/或本领域中已知的肿瘤或癌症抗原或其一部分。在另一实施例中,TCR识别肿瘤相关抗原。在另一实施例中,TCR识别肿瘤相关抗原或其作为血管生成因子的部分。
在一个实施例中,如本文所描述的组合物和方法并有免疫检查点阻断,其在一个实施例中包含PD-1/PD-L1阻断。在一个实施例中,PD-1/PD-L1阻断包含施用抗PD-1、抗PD-L1、抗CTLA-4抗体或其组合。
在另一实施例中,CAR-T细胞被工程改造以产生阻断PD-1/PD-L1的分子。在一个实施例中,CAR-T细胞被工程改造以分泌抗PD-1/PD-L1或抗CTLA-4抗体。在另一实施例中,CAR-T细胞被工程改造以表达PD-1-显性阴性受体(DNR)或PD-1:CD28嵌合开关受体(CSR)。在另一实施例中,CAR-T细胞是PD-1缺陷的。在另一实施例中,PD-1表达通过PD-1shRNA慢病毒盒下调。在另一实施例中,CAR-T细胞用TCR、β2-微球蛋白和/或人类白血球抗原(HLA)的基因敲除来工程改造。在一个实施例中,消融内源性TCR,接着选择性耗尽天然TCR+细胞,此允许产生缺乏任何靶向非CAR抗原的能力的强有力的肿瘤特异性CAR-T细胞。在另一实施例中,CAR-T细胞被工程改造以在TRAC基因启动子下表达,在一个实施例中,其产生均匀的CAR表达量,防止强直性CAR信号传导,在单次或反复暴露于抗原之后建立CAR的有效内化和再表达,且延迟效应T细胞分化和衰竭。
在另一实施例中,免疫检查点阻断包含使用如上文所描述的针对PD-1/PD-L1阻断所描述的技术中的任一种来阻断LAG-3、TIM-3、CTLA-4、SHP-1、腺苷2A受体(A2AR)或其组合。
所有这些均被视为本发明的实施例。
组合治疗
在治疗癌症中,化学治疗剂和/或其它治疗(例如辐射疗法)的组合通常是有利的。额外药剂可以具有与主要治疗剂相同或不同的作用机制。举例来说,可采用药物组合,其中所施用的两种或更多种药物以不同方式或在细胞周期的不同阶段中起作用,和/或其中两种或更多种药物具有不同毒性或副作用,和/或其中所组合的药物各自在治疗患者所呈现的特定疾病病状方面具有所展现的疗效。
在一个实施例中,提供一种治疗癌症的方法,其包含向有需要的哺乳动物施用如本文所述的组合物并且施用一种或多种额外抗癌剂。
在一个实施例中,短语“额外抗癌剂”是指选自以下中的任何一种或多种的药物:烷化剂(包括氮芥、甲磺酸酯、白消安、磺酸烷基酯、亚硝基脲、乙烯亚胺衍生物和三氮烯或其组合);抗血管生成剂(包括基质金属蛋白酶抑制剂);抗代谢物(包括腺苷脱氨酶抑制剂、叶酸拮抗剂、嘌呤类似物和嘧啶类似物);抗生素或抗体(包括单克隆抗体、CTLA-4抗体、蒽环霉素);芳香酶抑制剂;细胞周期反应调节剂;酶类;法呢酶-蛋白质转移酶抑制剂;激素和抗激素剂和类固醇(包括合成类似物、糖皮质激素、雌激素/抗雌激素药[例如SERM]、雄激素/抗雄激素、孕激素、孕酮受体激动剂和促黄体激素释放[LHRH]激动剂和拮抗剂);胰岛素样生长因子(IGF)/胰岛素样生长因子受体(IGFR)系统调节剂(包括IGFR1抑制剂);整合素信号传导抑制剂;激酶抑制剂(包括多激酶抑制剂或Src激酶或Src/ab1抑制剂)、细胞周期素依赖性激酶[CDK]抑制剂、panHer、Her-1和Her-2抗体、VEGF抑制剂(包括抗VEGF抗体)、EGFR抑制剂、PARP(聚ADP核糖聚合酶)抑制剂、丝裂原活化蛋白质[MAP]抑制剂、MET抑制剂、MEK抑制剂、极光激酶抑制剂、PDGF抑制剂和其它酪氨酸激酶抑制剂或丝氨酸/苏氨酸激酶抑制剂;微管干扰剂,如海鞘素(ecteinascidin)或其类似物和衍生物;微管稳定剂,如紫杉烷、基于铂的抗肿瘤药(铂),如顺铂、卡铂、奥沙利铂、奈达铂、特瑞铂四硝酸酯(triplatintetranitrate)、菲铂(phenanthriplatin)、吡铂和赛特铂(satraplatin),和天然存在的埃博霉素和其合成和半合成类似物;微管结合,不稳定剂(包括长春花生物碱);拓扑异构酶抑制剂;异戊二烯基蛋白(prenyl-protein)转移酶抑制剂;铂配位复合物;信号转导抑制剂;和其它用作抗癌和细胞毒性剂的药剂,诸如生物反应调节剂、生长因子和免疫调节剂。
在另一实施例中,本发明提供一种组合物,其包含一种或多种如本文所描述的由式(I)结构表示的化合物以及哺乳动物雷帕霉素靶蛋白(mTOR)抑制剂。在一个实施例中,mTOR抑制剂包含依维莫司(Everolimus)。在另一实施例中,mTOR抑制剂包含西罗莫司(雷帕霉素)。在另一实施例中,mTOR抑制剂包含坦罗莫司(temsirolimus)。
在另一实施例中,mTOR抑制剂包含双重哺乳动物雷帕霉素靶蛋白/磷酰肌醇3-激酶抑制剂,其在一个实施例中包含NVP-BEZ235(达妥昔布(dactolisib))、GSK2126458、XL765或其组合。
在另一实施例中,mTOR抑制剂包含第二代mTOR抑制剂,其在一个实施例中包含AZD8055、INK128/MLN0128、OSI027或其组合。
在另一实施例中,mTOR抑制剂包含第三代mTOR抑制剂,其在一个实施例中包含RapaLink。
在另一实施例中,本发明提供一种组合物,其包含一种或多种如本文所描述的由式(I)结构表示的化合物以及mTOR抑制剂和化学治疗剂。在一个实施例中,mTOR抑制剂包含依维莫司。在一个实施例中,化学治疗药物包含顺铂。
在另一实施例中,本发明提供一种组合物,其包含一种或多种如本文所描述的由式(I)结构表示的化合物以及双膦酸酯。
在另一实施例中,本发明提供一种组合物,其包含一种或多种如本文所描述的由式(I)结构表示的化合物以及癌症生长阻断剂。
在另一实施例中,本发明提供一种组合物,其包含一种或多种由如本文所述的式(I)结构表示的化合物以及蛋白酶体抑制剂。
在另一实施例中,本发明提供一种组合物,其包含一种或多种如本文所描述的由式(I)结构表示的化合物以及一种或多种干扰素。
在另一实施例中,本发明提供一种组合物,其包含一种或多种如本文所描述的由式(I)结构表示的化合物以及一种或多种白介素。
在另一实施例中,本发明提供一种组合物,其包含一种或多种如本文所描述的由式(I)结构表示的化合物以及烷化药物。在一个实施例中,烷化药物包含丙卡巴肼(Procarbazine)(甲苯肼(Matulane))、达卡巴嗪(Dacarbazine)(DTIC)、六甲蜜胺)(Altretamine)(克瘤灵(Hexalen))或其组合。
在另一实施例中,本发明提供一种组合物,其包含一种或多种如本文所描述的由式(I)结构表示的化合物以及抗代谢物。在一个实施例中,抗代谢物包含叶酸化合物(甲氨蝶呤)、氨基酸拮抗剂(氮杂丝氨酸)或其组合。
在另一实施例中,本发明提供一种组合物,其包含一种或多种如本文所述的由式(I)结构表示的化合物以及嘌呤拮抗剂。在一个实施例中,嘌呤拮抗剂包含巯基嘌呤(6-MP)、硫鸟嘌呤(6-TG)、氟达拉宾磷酸盐(Fludarabine Phosphate)、克拉屈滨(Cladribine)(乐司他丁(Leustatin))、喷司他汀(Pentostatin)(尼彭特(Nipent))或其组合。
在另一实施例中,本发明提供一种组合物,其包含一种或多种如本文所描述的由式(I)结构表示的化合物以及嘧啶拮抗剂。在一个实施例中,嘧啶拮抗剂包含氟尿嘧啶(5-FU)、阿糖胞苷(ARA-C)、阿扎胞苷或其组合。
在另一实施例中,本发明提供一种组合物,其包含一种或多种如本文所描述的由式(I)结构表示的化合物以及植物碱。在一个实施例中,嘧啶拮抗剂包含长春碱(Vinblastine)(Velban)、长春新碱(Vincristine)(安可平(Oncovin))、依托泊苷(VP-16、VePe-sid)、替尼泊甙(Teniposide)(Vumon)、拓朴替康(Topotecan)(和美新(Hycamtin))、伊立替康(Irinotecan)(开普拓(Camptosar))、太平洋紫杉醇(Paclitaxel)(紫杉醇(Taxol))、多烯紫杉醇(Docetaxel)(紫杉德(Taxotere))或其组合。
在另一实施例中,本发明提供一种组合物,其包含一种或多种如本文所描述的由式(I)结构表示的化合物以及FOLFIRI,其中在一个实施例中,FOLFIRI包含亚叶酸(甲酰四氢叶酸)、氟尿嘧啶(5-FU)和伊立替康(开普拓)。在另一实施例中,本发明提供一种组合物,其包含一种或多种如本文所描述的由式(I)结构表示的化合物以及亚叶酸(甲酰四氢叶酸)、氟尿嘧啶(5-FU)、伊立替康(开普拓)或其组合。
在另一实施例中,本发明提供一种组合物,其包含一种或多种如本文所描述的由式(I)结构表示的化合物以及抗生素。在一个实施例中,抗生素包含蒽环霉素、阿霉素(Doxorubicin)(亚德里亚霉素(Adriamycin)、Rubex、多希(Doxil))、道诺霉素(Daunorubicin)(柔红霉素(DaunoXome))、放线菌素D(Dactinomycin)(更生霉素(Cosmegen))、伊达比星(Idarubincin)(Idamycin)、普卡霉素(Plicamycin)(光神霉素(Mithramycin))、丝裂霉素(Mitomycin)(Mutamycin)、博莱霉素(Bleomycin)(Blenoxane)或其组合。
在另一实施例中,本发明提供一种组合物,其包含一种或多种如本文所描述的由式(I)结构表示的化合物以及免疫治疗剂。在一个实施例中,免疫治疗剂包含单克隆抗体。在一个实施例中,单克隆抗体包含抗PD-1抗体,其在一个实施例中包含纳武单抗(nivolumab)。
在另一实施例中,单克隆抗体包含阿克妥珠单抗
在另一实施例中,本发明提供一种组合物,其包含一种或多种如本文所描述的由式(I)结构表示的化合物以及激素药剂。在一个实施例中,激素药剂包含他莫昔芬(Tamoxifen)(诺瓦得士(Nolvadex))、氟他胺(Flutamide)(Eulexin)、促性腺激素释放激素激动剂(亮丙立德(Leuprolide)和戈舍瑞林(Goserelin)(诺雷德(Zoladex)))、芳香酶抑制剂、胺鲁米特(Aminoglutethimide)、阿那曲唑(Anastrozole)(阿纳托唑(Arimidex))或其组合。
在另一实施例中,本发明提供一种组合物,其包含一种或多种如本文所描述的由式(I)结构表示的化合物以及安吖啶(Amsacrine)、羟基脲(Hydrea)、天冬酰胺酶(El-spar)、米托蒽醌(Mitoxantrone)(Novantrone)、米托坦(Mitotane)、视黄酸衍生物、骨髓生长因子、阿米福汀(Amifostine)或其组合。
在另一实施例中,本发明提供一种组合物,其包含一种或多种由如本文所述的式(I)结构表示的化合物以及抑制一种或多种癌症干细胞路径的药剂。在一个实施例中,此类药剂包含Hedgehog、WNT、BMP或其组合的抑制剂。
在另一实施例中,本发明提供一种组合物,其包含一种或多种由如本文中所描述的式(I)结构表示的化合物以及以下中的任何一种或多种:雷利米得(Revlimid)、阿瓦斯汀、赫赛汀、美罗华(Rituxan)、欧狄沃(Opdivo)、格列卫(Gleevec)、依鲁维卡(Imbruvica)、万珂(Velcade)、泽替加(Zytiga)、恩杂鲁胺(Xtandi)、力比泰(Alimta)、加德西(Gadasil)、伊布兰西(Ibrance)、帕杰它、塔西纳(Tasigna)、狄诺塞麦、阿飞尼妥(Afinitor)、鲁索替尼(Jakafi)、特罗凯(Tarceva)、克珠达、舒癌特(Sutent)、益伏、多吉美(Nexavar)、诺雷德、爱必妥、Dazalex、希罗达(Xeloda)、佳仕瓦、Venclexta和阿特珠单抗(Tecentriq)。
在另一实施例中,本发明提供一种组合物,其包含一种或多种由如本文中所描述的式(I)结构表示的化合物以及以下中的任何一种或多种:玻玛西林(abemaciclib)、艾卡哚司他(epacadostat)、apalutamide、卡非佐米(Carfilzomib)、克卓替尼(Crizotinib)(PF-02341066)、GDC-0449(维莫德吉(vismodegib))、OncoVex、PLX4032(RG7204)、普纳替尼(Ponatinib)、SGN-35(贝伦妥单抗维多汀)、替沃扎尼(Tivozanib)(AV-951)、T-DM1(曲妥珠单抗-DM1)和XL184(卡博替尼(cabozantinib))。
因此,本发明的组合物可以与适用于治疗癌症或其它增生性疾病的其它抗癌治疗组合施用。本文中本发明进一步包含本发明组合物在制备用于治疗癌症的药剂中的用途,和/或其包含本发明组合物的包装,以及所述组合物与其它抗癌剂或细胞毒性剂组合使用以及用于治疗癌症的治疗的说明书。
在一个实施例中,提供一种治疗癌症的方法,其包含向有需要的哺乳动物施用式(I)化合物与CAR-T疗法的组合;施用达沙替尼(dasatinib);和任选地一种或多种额外抗癌剂。
在一个实施例中,提供一种用于治疗癌症的方法,其包含向有需要的哺乳动物施用式(I)化合物与CAR-T疗法的组合;施用太平洋紫杉醇;和任选地一种或多种额外抗癌剂。
在一个实施例中,提供一种治疗癌症的方法,其包含向有需要的哺乳动物施用式(I)化合物与CAR-T疗法的组合;施用他莫昔芬;和任选地一种或多种额外抗癌剂。
在一个实施例中,提供一种治疗癌症的方法,其包含向有需要的哺乳动物施用式(I)化合物与CAR-T疗法的组合;施用糖皮质激素;和任选地一种或多种额外抗癌剂。适合的糖皮质激素的实例为地塞米松。
在一个实施例中,提供一种治疗癌症的方法,其包含向有需要的哺乳动物施用式(I)化合物与CAR-T治疗的组合;施用卡铂;和任选地一种或多种额外抗癌剂。
本发明化合物可与其它治疗剂调配或共同施用,所述治疗剂针对其在解决与前述病状相关的副作用方面的特定有用性进行选择。举例来说,本发明化合物可以用药剂配制以预防恶心、过敏和胃刺激,如止痛药和H
在一个实施例中,提供药物组合物,其包含式(I)化合物或其前药;一种或多种选自激酶抑制剂(小分子、多肽和抗体)、免疫抑制剂、抗癌剂、抗病毒剂、消炎剂、抗真菌剂、抗生素或血管过度增殖化合物的额外药剂;和任何药学上可接受的载剂、佐剂或媒剂。
可例如以在《医师桌上手册(Physicians'Desk Reference)》中指示或如以另外的方式由一般技术人员确定的那些量来使用以上其它治疗剂(在与本发明的化合物组合采用时)。在本发明的方法中,此类其它治疗剂可以在施用本发明化合物之前、同时或之后施用。
药物组合物
调配物(化合物I)
本发明内还涵盖一类药物组合物,其包含式(I)化合物和一种或多种无毒、药学上可接受的载剂和/或稀释剂和/或佐剂(在本文中统称为“载剂”材料)和(如果需要)其它活性成分。
式(I)化合物可以通过任何适合途径,优选以适合于此类途径的药物组合物的形式,并且以对于所希望的治疗有效的剂量施用。本发明的化合物和组合物可例如以含有常规药学上可接受的载剂、佐剂和媒剂的剂量单位调配物形式施用。举例来说,药物载剂可含有甘露醇或乳糖与微晶纤维素的混合物。混合物可含有额外组分,如润滑剂,例如硬脂酸镁和崩解剂,如交聚维酮。载剂混合物可以填充到明胶胶囊中或以片剂形式压缩。药物组合物可以例如口服剂型或输注形式施用。
对于口服施用,药物组合物可呈例如片剂、胶囊、液体胶囊、悬浮液或液体的形式。药物组合物优选以含有特定量活性成分的剂量单位的形式制备。举例来说,药物组合物可提供为片剂或胶囊,其包含在约1到2000mg、优选约1到500mg并且更优选约5到150mg范围内的量的活性成分。人类或其它哺乳动物适合的日剂量可取决于患者的病状和其它因素而大幅变化,但可使用常规方法确定。
本文中涵盖的任何药物组合物可以例如经由任何可接受和适合的口服制剂口服递送。示范性口服制剂包括但不限于,例如片剂、锭剂、口含锭、水性和油性悬浮液、可分散粉末或颗粒、乳液、硬胶囊和软胶囊、液体胶囊、糖浆和酏剂。旨在用于口服施用的药物组合物可以根据本领域中已知的用于制造旨在用于口服施用的药物组合物的任何方法制备。为了提供药学上适口的制剂,根据本发明的药物组合物可含有至少一种选自甜味剂、调味剂、着色剂、缓和剂、抗氧化剂和防腐剂的药剂。
片剂可以例如通过将至少一种式(I)化合物与至少一种适用于制造片剂的无毒药学上可接受的赋形剂混合来制备。示范性赋形剂包括但不限于惰性稀释剂,例如碳酸钙、碳酸钠、乳糖、磷酸钙和磷酸钠;粒化剂和崩解剂,如微晶纤维素、交联羧甲纤维素钠、玉米淀粉和海藻酸;粘合剂,如淀粉、明胶、聚乙烯吡咯烷酮和阿拉伯胶;以及润滑剂,如硬脂酸镁、硬脂酸和滑石。另外,片剂可以未经涂布,或通过已知技术涂布以掩盖品尝令人不快的药物的不良口味,或延迟在胃肠道中活性成分的崩解和吸收,由此维持活性成分的作用较长时段。示范性水溶性掩味材料包括但不限于羟丙基甲基纤维素和羟丙基纤维素。示范性时间延迟材料包括但不限于乙基纤维素和乙酸丁酸纤维素。
硬明胶胶囊可例如通过混合至少一种式(I)化合物与至少一种惰性固体稀释剂来制备,所述惰性固体稀释剂例如碳酸钙;磷酸钙;以及高岭土。
软明胶胶囊可例如通过将至少一种式(I)化合物与至少一种水溶性载剂(例如聚乙二醇)和至少一种油介质(例如花生油、液体石蜡和橄榄油)混合来制备。
水性悬浮液可以例如通过将至少一种式(I)化合物与至少一种适合于制造水性悬浮液的赋形剂混合来制备。适合于制造水性悬浮液的示范性赋形剂包括但不限于悬浮剂,例如羧甲基纤维素钠、甲基纤维素、羟丙基甲基纤维素、海藻酸钠、海藻酸、聚乙烯吡咯烷酮、黄芪胶和阿拉伯胶;分散剂或湿润剂,例如天然存在的磷脂,例如卵磷脂;环氧烷与脂肪酸的缩合产物,例如聚氧化乙烯硬脂酸酯;环氧乙烷与长链脂肪醇的缩合产物,如十七伸乙基氧鲸蜡醇;环氧乙烷与衍生自脂肪酸和己糖醇的偏酯的缩合产物,如例如聚氧乙烯山梨糖醇单油酸酯;以及环氧乙烷与衍生自脂肪酸和己糖醇酸酐的偏酯的缩合产物,如例如聚乙烯脱水山梨糖醇单油酸酯。水性悬浮液还可含有至少一种防腐剂,例如乙基和正丙基对羟基苯甲酸盐;至少一种着色剂;至少一种调味剂;和/或至少一种甜味剂,包括但不限于蔗糖、糖精和阿斯巴甜糖。
油性悬浮液可例如通过将至少一种式(I)化合物悬浮于植物油(如例如花生油、橄榄油、芝麻油和椰子油)或矿物油(如液体石蜡)中来制备。油性悬浮液还可含有至少一种增稠剂,例如蜂蜡;硬石蜡;和鲸蜡醇。为了提供适口油性悬浮液,上文已经描述的甜味剂中的至少一种和/或至少一种调味剂可以添加到油性悬浮液中。油性悬浮液可进一步含有至少一种防腐剂,包括但不限于抗氧化剂,例如丁基化羟基茴香醚和α-生育酚。
可分散粉末和颗粒可例如通过混合至少一种式(I)化合物与至少一种分散剂和/或湿润剂;至少一种悬浮剂;和/或至少一种防腐剂来制备。适合的分散剂、湿润剂和悬浮剂如上文已描述。示范性防腐剂包括但不限于抗氧化剂,例如抗坏血酸。此外,可分散粉末和颗粒还可含有至少一种赋形剂,包括但不限于甜味剂;调味剂;以及着色剂。
至少一种式(I)化合物的乳液可例如制备为水包油乳液。包含式(I)化合物的乳液的油相可以已知方式由已知成分构成。油相可由(但不限于)例如植物油(例如橄榄油和花生油)、矿物油(例如液体石蜡)和其混合物提供。虽然所述相可仅包含乳化剂,但其可包含至少一种乳化剂与脂肪或油或脂肪与油两者的混合物。适合的乳化剂包括但不限于例如天然存在的磷脂,例如大豆卵磷脂;衍生自脂肪酸和己糖醇酐的酯或偏酯,例如脱水山梨糖醇单油酸酯;和偏酯与环氧乙烷的缩合产物,例如聚氧乙烯脱水山梨糖醇单油酸酯。优选地,亲水性乳化剂连同充当稳定剂的亲脂性乳化剂一起包括在内。还优选包括油和脂肪两者。以及,具有或不具有稳定剂的乳化剂构成所谓的乳化蜡,且蜡与油和脂肪一起构成所谓的乳化软膏基质,其形成乳膏制剂的油性分散相。乳液还可含有甜味剂、调味剂、防腐剂和/或抗氧化剂。适合用于本发明的调配物的乳化剂和乳液稳定剂包括单独的Tween 60、Span80、鲸蜡硬脂醇、肉豆蔻醇、单硬脂酸甘油酯、月桂基硫酸钠、二硬脂酸甘油酯,或与蜡或本领域中众所周知的其它材料一起。
在另一实施例中,式(I)化合物可调配为纳米粒子、脂质纳米粒子、微粒或脂质体。
式(I)化合物还可以例如经由任何药学上可接受和适合的可注射形式静脉内、皮下和/或肌肉内递送。示范性可注射形式包括但不限于无菌水溶液,其包含可接受的载剂和溶剂,例如水、林格氏溶液(Ringer's solution)和等渗氯化钠溶液;无菌水包油微乳液;以及水性或油性悬浮液。
举例来说,可以提供包含约0.2到150mg范围内的活性成分的量的组合物用于静脉内施用。在另一实施例中,活性成分以约0.3到10mg范围存在。在另一实施例中,活性成分以约4到8.4mg范围存在。在一个实施例中,活性成分以约4mg的剂量施用。在另一实施例中,活性成分以约6mg的剂量施用。在另一实施例中,活性成分以约8.4mg的剂量施用。
在另一实施例中,活性成分以约0.3mg的剂量施用。在另一实施例中,活性成分以约0.6mg的剂量施用。在另一实施例中,活性成分以约1.2mg的剂量施用。在另一实施例中,活性成分以约2.4mg的剂量施用。
用于非经肠投药的配制品可以呈水溶液或非水溶液等张无菌注射溶液或悬浮液形式。这些溶液和悬浮液可使用在用于口服施用的调配物的使用时所提及的载剂或稀释剂中的一种或多种,或通过使用其它适合的分散剂或湿润剂和悬浮剂,由无菌粉末或颗粒来制备。化合物可溶于水、聚乙二醇、丙二醇、乙醇、玉米油、棉籽油、花生油、芝麻油、苯甲醇、氯化钠、黄芪胶和/或各种缓冲液中。其它佐剂和施用模式在药学领域中是深入而广泛已知的。活性成分还可以作为与适合载剂的组合物通过注射来施用,所述载剂包括盐水、右旋糖或水,或与环糊精(即,
无菌可注射制剂还可以为在无毒非经肠可接受的稀释剂或溶剂中的无菌可注射溶液或悬浮液,例如呈在1,3-丁二醇中的溶液形式。可采用的可接受媒剂和溶剂中有水、林格氏溶液和等渗氯化钠溶液。另外,无菌不挥发性油通常用作溶剂或悬浮介质。出于此目的,可采用任何温和的不挥发性油,包括合成的单酸甘油酯或二酸甘油酯。另外,在可注射剂制备中使用脂肪酸,如油酸。
无菌可注射水包油微乳液可例如通过以下方式制备:1)将至少一种式(I)化合物溶解于油相中,例如大豆油与卵磷脂的混合物;2)将含有油相的式(I)与水和甘油混合物组合;以及3)处理组合以形成微乳液。
无菌水性或油性悬浮液可根据本领域中已知的方法制备。举例来说,无菌水溶液或悬浮液可以用无毒非经肠的可接受稀释剂或溶剂(例如1,3-丁二醇)制备;并且无菌油性悬浮液可以用无菌无毒的可接受溶剂或悬浮介质(例如无菌不挥发性油,例如合成的单甘油酯或二甘油酯)制备;以及脂肪酸(例如油酸)制备。
可用于本发明药物组合物的药学上可接受的载剂、佐剂和媒剂包括但不限于离子交换剂、氧化铝、硬脂酸铝、卵磷脂、自乳化药物递送系统(SEDDS)(例如d-a-生育酚聚乙二醇1000丁二酸酯)、药物剂型中使用的表面活性剂(例如Tween系列)、聚乙氧基化蓖麻油(例如
本发明的药学上活性化合物可根据药学上可接受的方法处理以生产用于向患者(包括人类和其它哺乳动物)施用的药剂。药物组合物可经历常规药学操作,如灭菌和/或可含有常规佐剂,如防腐剂、稳定剂、湿润剂、乳化剂、缓冲剂等。另外,片剂和丸剂可以用肠溶包衣制备。此类组合物还可包含佐剂,如湿润剂、甜味剂、调味剂和芳香剂。
所施用的化合物的量和用本发明的化合物和/或组合物治疗疾病病状的给药方案取决于多种因素,包括年龄、体重、性别、个体医学病状、疾病类型、疾病严重程度、施用途径和频率以及所采用的具体化合物。因此,给药方案可大幅变化,但可使用标准方法常规地确定。每千克体重约0.001到100mg、优选地在每千克体重约0.005与约50mg之间并且最优选地在每千克体重约0.01到10mg之间的日剂量可为适当的。日剂量可以每天一到四次剂量施用。
在一个实施例中,向个体施用所述化合物一周一次。在另一实施例中,向个体施用所述化合物每两周一次。
出于治疗目的,本发明的活性化合物通常与适合于所指示给药途径的一种或多种佐剂组合。如果口服施用,那么化合物可与乳糖、蔗糖、淀粉粉末、链烷酸的纤维素酯、纤维素烷基酯、滑石、硬脂酸、硬脂酸镁、氧化镁、磷酸和硫酸的钠盐和钙盐、明胶、阿拉伯胶、海藻酸钠、聚乙烯吡咯烷酮和/或聚乙烯醇掺合,且接着压片或囊封以用于方便施用。此类胶囊或片剂可含有控制释放调配物,如可提供于活性化合物于羟丙基甲基纤维素中的分散液中。
本发明的药物组合物包含至少一种式(I)化合物和/或其至少一种盐,和任选地选自任何药学上可接受的载剂、佐剂和媒剂的额外药剂。本发明的替代组合物包含本文所述的式(I)化合物或其前药和药学上可接受的载剂、佐剂或媒剂。
根据式(I)的化合物可以通过适合于待治疗的病状的任何手段施用,其可以取决于对位点特异性治疗的需要或待递送的式(I)化合物的量。本发明的化合物和组合物可例如口服、经粘膜或非经肠施用,包括血管内、腹膜内、皮下、肌肉内和胸骨内。在另一实施例中,本发明的化合物和组合物经静脉内施用。
调配物(CAR-T)
本公开主题的组合物包含含表达BCMA靶向或其它靶向的CAR的免疫反应性细胞的药物组合物和药学上可接受的载剂。施用可以是自体或非自体的。举例来说,表达CAR的免疫反应性细胞和包含其的组合物可从一个个体获得,且向相同个体或不同相容个体施用。本公开主题的外周血衍生T细胞或其后代(例如体内、离体或活体外衍生的)可以经由局部注射施用,包括施用、全身注射、局部注射、静脉内注射或非经肠施用。当施用本公开主题的药物组合物(例如,包含表达靶向BCMA的CAR的免疫反应性细胞的药物组合物)时,其可以单位剂量可注射形式(溶液、悬浮液、乳液)调配。
表达本公开主题的CAR和包含其的组合物的免疫反应性细胞可以无菌液体制剂形式方便地提供,例如等渗水溶液、悬浮液、乳液、分散体或粘性组合物,其可缓冲到所选pH。液体制剂通常比凝胶、其它粘性组合物和固态组合物更容易制备。另外,施用液体组合物,尤其通过注射,稍微更为方便。另一方面,粘性组合物可在适当粘度范围内调配以提供与特定组织的更长接触周期。液体或粘性组合物可包含载剂,其可为含有例如水、盐水、磷酸盐缓冲盐水、多元醇(例如甘油、丙二醇、液体聚乙二醇等)和其适合混合物的溶剂或分散介质。
无菌可注射溶液可以通过将包含表达本公开主题的总体靶向BCMA的CAR的免疫反应性细胞的组合物在所需量的适当溶剂中与各种量的其它成分一起并入来制备。此类组合物可与适合的载剂、稀释剂或赋形剂(如无菌水、生理盐水、葡萄糖、右旋糖等)掺合。也可以将组合物冻干。取决于施用途径和所需制剂,组合物可含有辅助物质,如湿润剂、分散剂或乳化剂(例如甲基纤维素)、pH缓冲剂、胶凝或粘度增强添加剂、防腐剂、调味剂、着色剂等。可以查询标准文本,如以引用的方式并入本文中的《雷明顿的医药科学(REMINGTON'SPHARMACEUTICAL SCIENCE)》,第17版,1985,以制备适合的制剂而不用进行过度实验。
可添加增强组合物的稳定性和无菌性的各种添加剂,包括抗微生物防腐剂、抗氧化剂、螯合剂和缓冲剂。微生物作用的预防可以通过各种抗细菌和抗真菌剂(例如对羟基苯甲酸酯、氯丁醇、苯酚、山梨酸等)来确保。可注射药物形式的延长吸收可以通过使用延迟吸收的药剂来实现,例如,单硬脂酸铝和明胶。然而,根据本发明,所使用的任何载剂、稀释剂或添加剂将必须与表达本公开主题的一般靶向CAR的免疫反应性细胞相容。
组合物可以是等渗的,即,其可以具有与血液和泪液相同的渗透压。本公开主题的组合物所需等渗性可以使用氯化钠或其它药学上可接受的药剂(如右旋糖、硼酸、酒石酸钠、丙二醇或其它无机或有机溶质)来实现。氯化钠对于含有钠离子的缓冲液是优选的。
必要时,组合物的粘度可以使用药学上可接受的增稠剂维持在所选择的水平。可使用甲基纤维素,因为其易于获得且经济适用且容易起作用。其它适合的增稠剂包括例如黄原胶、羧甲基纤维素、羟丙基纤维素、卡波姆(carbomer)等。增稠剂的浓度可以取决于所选择的药剂。重要的是使用会实现所选择粘度的量。显然,适合的载剂和其它添加剂的选择将取决于具体给药途径和具体给药形式的性质,例如液体剂型(例如组合物是否配制成溶液、悬浮液、凝胶或另一液体形式,如时间释放形式或液体填充形式)。
本领域的技术人员将认识到,组合物的组分应选择为化学惰性的,且将不影响如本公开主题中所描述的免疫反应性细胞的活力或疗效。对化学和药物原理的技术人员而言,这将不存在问题,或问题可通过从本公开和本文中引用的文献中参考标准文本或通过简单实验(不涉及过度实验)而轻易避免。
关于本公开主题的免疫反应性细胞的治疗用途的一个考虑因素是实现最优作用所必需的细胞数量。待施用细胞的量将针对所治疗的个体而变化。在某些实施例中,向个体施用本公开主题的约10
本领域技术人员可以容易地确定组合物中的细胞和任选的添加剂、载剂和/或载剂的量并且将按本公开主题的方法施用。通常,任何添加剂(除活性单元和/或药剂以外)以约0.001重量%到约50重量%的量存在于磷酸盐缓冲盐水中,且活性成分以微克到毫克的顺序存在,例如约0.0001重量%到约5重量%、约0.0001重量%到约1重量%、约0.0001重量%到约0.05重量%、约0.001重量%到约20重量%、约0.01重量%到约10重量%或约0.05重量%到约5重量%。对于待施用到动物或人类的任何组合物,并且对于任何特定施用方法,应确定毒性,例如通过测定适合动物模型(例如啮齿动物,如小鼠)中的致死剂量(LD)和LD50;以及测定组合物的剂量、其中组分的浓度和施用引发适合反应的组合物的时序。此类测定不需要根据本领域技术人员的知识、本公开和本文中所引用的文献进行过度实验。并且,可以在无过度实验的情况下确定依序给药的时间。
对于使用抗原特异性T细胞的过继免疫疗法,通常输注约10
使用方法
在一个实施例中,本发明提供所描述的化合物或组合物的用途,所述化合物或组合物用于治疗、遏制或抑制个体中的B细胞成熟抗原(BCMA)相关病症或与BCMA表达相关的疾病。
在另一实施例中,本发明还提供一种在个体中治疗、遏制或抑制B细胞成熟抗原(BCMA)相关病症或与BCMA表达相关的疾病的方法,其包含以下步骤:向所述个体施用包含一种或多种靶向B细胞成熟抗原(BCMA)的免疫治疗剂的第一组合物和包含一种或多种由式(I)结构表示的化合物的第二组合物:
和/或其至少一种盐,其中:
R
R
R
R
R
R
环A是苯基或吡啶基;
每一R
每一R
y是零、1或2;且
z是零、1或2。
在另一实施例中,z是1或2。
在一个实施例中,与BCMA有关的病症包含增生性疾病。在另一实施例中,BCMA相关病症包含多发性骨髓瘤、嗜曙红细胞增多的急性骨髓单核细胞性白血病(AMML)、T细胞淋巴瘤、急性单核细胞性白血病、滤泡性淋巴瘤、弥漫性大B细胞淋巴瘤(DLBCL)、套细胞淋巴瘤(MCL)或其组合。
在另一实施例中,本发明提供所描述的化合物或组合物用于治疗、遏制或抑制个体的增生性疾病的用途。在另一实施例中,本发明提供一种治疗、遏制或抑制个体的增生性疾病的方法,其包含以下步骤:向所述个体施用包含一种或多种表达通过γ分泌酶裂解的肿瘤抗原的嵌合抗原受体T细胞(CAR-T细胞)的第一组合物和包含一种或多种包含式(I)化合物的γ分泌酶抑制剂的第二组合物:
其中:
R
R
R
每一R
z是零、1或2。
在另一实施例中,本发明还提供一种治疗、遏制或抑制个体的增生性疾病的方法,其包含以下步骤:向所述个体施用包含一种或多种靶向B细胞成熟抗原(BCMA)的免疫治疗剂的第一组合物和包含一种或多种由式(I)结构表示的化合物的第二组合物:
和/或其至少一种盐,其中:
R
R
R
R
R
R
环A是苯基或吡啶基;
每一R
每一R
y是零、1或2;且
z是零、1或2。
在另一实施例中,z是1或2。
在一个实施例中,本发明提供所描述的化合物或组合物的用途,所述化合物或组合物用于改良个体中的抗B细胞成熟抗原(BCMA)疗法的疗效。
在另一实施例中,本发明还提供一种改良个体中的抗B细胞成熟抗原(BCMA)疗法的疗效的方法,其包含以下步骤:向所述个体施用包含一种或多种靶向B细胞成熟抗原(BCMA)的免疫疗法的第一组合物和包含一种或多种由式(I)结构表示的化合物的第二组合物:
和/或其至少一种盐,其中:
R
R
R
R
R
R
环A是苯基或吡啶基;
每一R
每一R
y是零、1或2;且
z是零、1或2。
在另一实施例中,z是1或2。
在一个实施例中,抗B细胞成熟抗原(BCMA)疗法包含抗癌疗法。
在一个实施例中,本发明提供所描述的一种或多种组合物用于减少个体中B细胞成熟抗原(BCMA)从癌细胞脱落的用途。
在另一实施例中,本发明还提供一种减少个体中B细胞成熟抗原(BCMA)从癌细胞脱落的方法,其包含以下步骤:向所述个体施用包含一种或多种由式(I)结构表示的化合物的组合物:
和/或其至少一种盐,其中:
R
R
R
R
R
R
环A是苯基或吡啶基;
每一R
每一R
y是零、1或2;且
z是零、1或2。
在另一实施例中,z是1或2。
在另一实施例中,本发明还提供一种减少个体中B细胞成熟抗原(BCMA)从细胞脱落的方法,其包含以下步骤:向所述个体施用包含一种或多种由如本文所述的式(I)结构表示的化合物的组合物。在一个实施例中,所述细胞包含定向到浆细胞(PC)分化或PC的晚期记忆B细胞。在另一实施例中,细胞包含多发性骨髓瘤细胞。
在一个实施例中,本发明提供治疗上可接受量的如本文所描述的一种或多种化合物或组合物用于治疗、遏制或抑制个体的增生性疾病的用途。在另一实施例中,本发明提供治疗有效量的一种或多种如本文所描述的化合物或组合物用于治疗、遏制或抑制个体的增生性疾病的用途。在另一实施例中,本发明提供如本文所述的协同有效量的一种或多种化合物或组合物的用途,其用于治疗、遏制或抑制个体的增生性疾病。在另一实施例中,本发明提供如本文所述的协同治疗有效量的一种或多种化合物或组合物的用途,其用于治疗、遏制或抑制个体的增生性疾病。
在一个实施例中,增生性疾病包含硬纤维肿瘤。
在一个实施例中,增生性疾病包含癌前病状或良性增生性病症。
在一个实施例中,如本文中所使用的术语“癌前”或替代地“变恶性肿瘤前的”可互换地指疾病、综合症或其它病状伴随有癌症风险增加。在本发明的情形下的癌症病状包括但不限于:乳房钙化、阴道上皮内瘤变、巴雷特食道(Barrett's esophagus)、萎缩性支气管炎、先天性角化不良、缺铁性吞咽困难、扁平苔藓、口腔粘膜下纤维化、光化性角化症、日光性弹性组织变性、宫颈非典型增生、粘膜白斑病和红斑。
在一个实施例中,如本文所使用的术语“良性过度增生性病症”是指细胞的异常生长和分化以及由细胞增殖引起的有机组织的量增加的病状。良性过度增生性病症可归因于对调节因素缺乏反应或不当反应,或替代地归因于调节因素功能异常。良性过度增生性病症的非限制性实例为牛皮癣和良性前列腺增生(BPH)。
在另一实施例中,增生性疾病包含癌症。
在一个实施例中,癌症包含实体肿瘤。在另一实施例中,癌症包含血液系统恶性肿瘤。
在一个实施例中,如本文所述的个体患有癌症。在一个实施例中,术语“癌症”在本发明的情形下包括无论是呈实体肿瘤或非实体肿瘤形式的所有类型的赘瘤,并且包括恶性和变恶性肿瘤前的病状以及其转移。
在一个实施例中,癌症为癌瘤、肉瘤、骨髓瘤、白血病或淋巴瘤。在另一实施例中,癌症为混合类型的。
在一个实施例中,混合类型癌症含有若干类型的细胞。所述类型组分可在一个类别内或来自不同类别。一些实例为:腺鳞癌;混合中胚层肿瘤;癌肉瘤;畸胎癌。
在另一实施例中,癌症取决于Notch活化。在另一实施例中,癌症不取决于Notch活化。
在另一实施例中,癌瘤包含腺样囊性癌症(ACC)。在另一实施例中,癌瘤包含胃食管连接癌。
在一个实施例中,所述癌瘤为腺癌。在另一实施例中,癌瘤为鳞状细胞癌。
在一个实施例中,所述肉瘤包含骨肉瘤或成骨肉瘤(骨);软骨肉瘤(软骨);平滑肌肉瘤(平滑肌);横纹肌肉瘤(骨骼肌);间皮肉瘤或间皮瘤(体腔的膜内衬);纤维肉瘤(纤维组织);血管肉瘤或血管内皮瘤(血管);脂肪肉瘤(脂肪组织);神经胶质瘤或星形细胞瘤(脑中发现的神经源性结缔组织);黏液肉瘤(原始胚结缔组织);和间质瘤或混合中胚层肿瘤(混合结缔组织类)。
在一个实施例中,癌症包含骨髓瘤,其在一个实施例中为发源于骨髓浆细胞的癌症。浆细胞产生发现于血液中的一些蛋白质。在一个实施例中,癌症包含多发性骨髓瘤。
在另一实施例中,癌症包含白血病(“非实体肿瘤”或“血癌”),其在一个实施例中为骨髓(血细胞产生部位)的癌症。在一个实施例中,白血病包含骨髓性或粒细胞性白血病(骨髓和粒细胞白细胞组的恶性肿瘤)、淋巴球性或淋巴母细胞性白血病(淋巴和淋巴球性血细胞组的恶性肿瘤)和真性红血球增多症或红细胞增多(各种血细胞产物的恶性肿瘤,但其中有主要是红细胞)。
在另一实施例中,癌症包含T细胞急性淋巴母细胞白血病(T-ALL)。在另一实施例中,癌症包含T-淋巴母细胞白血病/淋巴瘤(TLL)。在另一实施例中,癌症包含慢性淋巴细胞性白血病(CLL)。
在另一实施例中,癌症包含淋巴瘤。在一个实施例中,淋巴瘤包含结外淋巴瘤。在一个实施例中,淋巴瘤包含霍奇金淋巴瘤。在另一实施例中,淋巴瘤包含非霍奇金淋巴瘤。在一个实施例中,淋巴瘤包含边缘区B细胞淋巴瘤、弥漫性大B细胞淋巴瘤或套细胞淋巴瘤。
在另一实施例中,癌症取决于Notch活化。在另一实施例中,癌症包含Notch活化突变。在另一实施例中,癌症不取决于Notch活化。
在一个实施例中,如本文所描述的癌症包含Notch活化基因变异。在另一实施例中,如本文所描述的癌症包含Notch活化改变。在另一实施例中,如本文所描述的癌症包含Notch活化突变。在另一实施例中,如本文所描述的癌症包含Notch活化基因突变。在另一实施例中,如本文所描述的癌症包含Notch突变。在另一实施例中,如本文所描述的癌症包含Notch改变突变。
在一个实施例中,Notch活化基因变异包含一种或多种Notch相关基因中的突变。
在一个实施例中,一种或多种Notch相关基因中的突变诱发Notch活性的功能的增加(GOF)。
在另一实施例中,一种或多种Notch相关基因中的突变包含错义突变。在另一实施例中,一种或多种Notch相关基因中的突变包含无义突变。在另一实施例中,一种或多种Notch相关基因中的突变包含插入突变。在另一实施例中,一个或多个Notch相关基因中的突变包含缺失突变。在另一实施例中,一种或多种Notch相关基因中的突变包含复制突变。在另一实施例中,一个或多个Notch相关基因中的突变包含移码突变。在另一实施例中,一种或多种Notch相关基因中的突变包含重复扩增。在另一实施例中,一种或多种Notch相关基因中的突变包含融合体。
在一个实施例中,B细胞成熟抗原(BCMA)相关病症或与BCMA表达相关的疾病包含具有活化Notch标志的一个或多个细胞。在一个实施例中,活化Notch标志包含上调一个或多个Notch相关基因的表达。在另一实施例中,活化Notch标志包含一个或多个Notch相关基因的表达下调。在另一实施例中,活化Notch标志包含上调一些Notch相关基因的表达和下调一些Notch相关基因的表达。
在另一实施例中,癌症包含星形细胞瘤、膀胱癌、乳腺癌、胆管癌(CCA)、结肠癌、结直肠癌、结肠直肠癌、上皮癌、上皮卵巢癌、纤维肉瘤、胆囊癌、胃癌、神经母细胞瘤、神经胶质瘤、头颈癌、肝细胞癌、肾癌、肝癌、肺癌(包括非小细胞肺癌(NSCLC))、恶性纤维组织细胞瘤(MFH)、恶性胸膜间皮瘤(MPM)、成神经管细胞瘤、黑素瘤、间皮瘤、神经母细胞瘤、骨肉瘤、卵巢腺癌、卵巢癌、胰脏腺癌、胰脏癌、前列腺癌、肾细胞癌(RCC)、横纹肌肉瘤、癌和甲状腺癌。
在一个实施例中,乳腺癌是三阴性乳腺癌。
如本文所使用,术语“癌症”包括癌瘤、肉瘤、骨髓瘤、白血病、淋巴瘤和混合类型肿瘤的以上类别。确切地说,术语“癌症”包括:淋巴增生性病症、乳腺癌、卵巢癌、前列腺癌、子宫颈癌、子宫内膜癌、肺癌、骨癌、肝癌、胃癌、膀胱癌、结肠癌、结肠直肠癌、胰脏癌、甲状腺癌、头颈癌的癌症、中枢神经系统的癌症、脑癌、外周神经系统的癌症、皮肤癌、肾癌以及所有上述的转移瘤。更确切地说,如本文所使用,术语可以指:肝细胞癌、血肿、肝母细胞瘤、横纹肌肉瘤、食道癌瘤、甲状腺癌、神经节胚细胞瘤(ganglioblastoma)、神经胶母细胞瘤、纤维肉瘤、黏液肉瘤、脂肪肉瘤、软骨肉瘤、成骨的肉瘤、脊索瘤、血管肉瘤、内皮肉瘤、尤文氏肿瘤(Ewing's tumor)、平滑肌肉瘤、杆状乳头肉瘤(rhabdotheliosarcoma)、侵袭性乳腺管癌、乳头状腺癌、黑素瘤、鳞状细胞癌、基底细胞癌、腺癌(充分分化、适度分化、不充分分化或未分化)、肾细胞癌、肾上腺样瘤、肾上腺样腺癌、胆管癌、绒膜癌、精原细胞瘤、胚胎癌、维尔姆斯瘤(Wilms'tumor)、睾丸肿瘤、肺癌(包括小细胞、非小细胞肺癌和大细胞肺癌)、膀胱癌、神经胶质瘤、星形胶质细胞瘤、髓母细胞瘤、颅咽管瘤、室管膜瘤、松果体瘤、成视网膜细胞瘤、神经母细胞瘤、结肠癌、经直肠癌瘤、造血性恶性病(包括所有类型白血病以及淋巴瘤,包括:急性骨髓性白血病、急性骨髓细胞性白血病、急性淋巴细胞白血病、慢性骨髓性白血病、慢性淋巴细胞性白血病、肥大细胞白血病、多发性骨髓瘤、骨髓淋巴瘤、霍奇金氏淋巴瘤、非霍奇金淋巴瘤、瓦尔登斯特伦巨球蛋白血症(Waldenstrom's Macroglobulinemia))。
在另一实施例中,与未用组合物处理的实体肿瘤或血液系统恶性肿瘤的细胞的生长相比,施用如本文所描述的任何组合物将实体肿瘤或血液系统恶性肿瘤的细胞的生长减少40%、50%、60%、70%、80%、90%或95%。在组合治疗的情况下,与用组合物中的任一种治疗、经由不同癌症治疗或未经治疗的个体相比较,所描述的组合中的任一种的施用减少实体肿瘤或血液系统恶性肿瘤的细胞的生长。在另一实施例中,本发明提供增加或延长具有瘤变的个体的生存期的方法。如本文所用,术语“瘤变”是指表征为细胞或组织的病理性增殖和其随后转移到或侵入其它组织或器官的疾病。瘤变生长通常不受控且具有渐进性,且在将不会引发或将引起正常细胞倍增停止的条件下发生。瘤变可以影响多种细胞类型、组织或器官,包括但不限于选自由以下组成的组的器官:膀胱、结肠、骨、大脑、乳房、软骨、胶质细胞、食道、输卵管件、胆囊、心、肠、肾脏、肝、肺、淋巴结、紧张组织、卵巢、胸膜、胰、前列腺、骨骼肌、皮肤、脊髓、脾、胃、睪丸、胸腺、甲状腺、气管、泌尿生殖道、输尿管、尿道、子宫和阴道,或其组织或细胞类型。瘤变包括癌症,如肉瘤、癌瘤或浆细胞(浆细胞的恶性肿瘤)。
在另一实施例中,本发明提供一种治疗患有B细胞病状或病症的个体或预防个体中B细胞从BCMA脱落的方法,其包含向个体施用如本文所描述的γ分泌酶抑制剂与如本文所描述的CAR-T细胞的组合。在另一实施例中,本发明提供一种治疗病原性B细胞的方法。
在一个实施例中,如本文所述的个体用辐射疗法、化疗、移植、免疫疗法、激素疗法或光动力疗法治疗或已经先前用其治疗。
定义
除非本文中另外明确陈述,否则以单数形式进行的参考还可包括复数。例如,“一个/种(a/an)”可以指一个/种,或一个或多个/一种或多种。
本文中所阐述的定义优先于以引用的方式并入本文中的任何专利、专利申请案和/或专利申请案公开案中阐述的定义。
下文所列举的是用于描述本发明的各种术语的定义。这些定义适用于术语,因为其在整个说明书中(除非其在特定情况下另外受限制)个别地或作为大组的一部分使用。
如本文所使用,术语“施用”是指与本发明化合物接触。在一个实施例中,局部施用组合物。在另一实施例中,组合物经全身性施用。可以对细胞或组织培养物或对活的生物体(例如人类)实现施用。
如本文所使用,术语“施用(administering)”、“施用(administer)”、“或”“施用(administration)”是指将一种或多种化合物或组合物非经肠、经肠或局部递送到个体。非经肠施用的说明性实例包括但不限于静脉内、肌内、动脉内、鞘内、囊内、眶内的、心内、皮内、腹膜内、经气管、皮下、表皮下的、关节内、囊下、蛛网膜下、脊柱内和胸骨内注射和输注。经肠施用的说明性实例包括但不限于口服、吸入、鼻内、舌下和经直肠施用。局部施用的说明性实例包括但不限于经皮和阴道施用。在特定实施例中,药剂或组合物非经肠施用,任选地通过向个体静脉内施用或口服施用。
在一个实施例中,本发明的组合物包含药学上可接受的组合物。在一实施例中,短语“药学上可接受的”在本文中用以指在合理医学判断范围内,适用于与人类和动物的组织接触而无过量毒性、刺激、过敏反应或其它问题或并发症,与合理效益/风险比相称的那些化合物、物质、组合物和/或剂型。
在一个实施例中,以治疗有效量施用本发明的组合物。在一个实施例中,“治疗有效量”旨在包括本发明化合物单独的量或所要求的化合物的组合的一定量或本发明化合物的一定量以及其它活性成分,以有效充当NOTCH受体的抑制剂,有效抑制γ分泌酶或有效治疗或预防增生性疾病(如癌症)。在一个实施例中,本发明组合物的“治疗有效量”为足以向施用组合物的个体提供有益作用的组合物的量。
如本文所使用,“治疗(treating)”或“治疗(treatment)”涵盖治疗哺乳动物,确切地说人类的疾病状态,并且包括:(a)预防哺乳动物的疾病状态,确切地说,当此类哺乳动物易患疾病状态但尚未诊断为患有其时;(b)抑制疾病状态,即,遏制其发展;和/或(c)引起疾病状态的消退。
在一个实施例中,“治疗”是指治疗性治疗和防治性或预防性措施,其中所述对象是为了预防或减轻如上文所描述的靶向病理性病状或病症。因此,在一个实施例中,治疗可包括直接影响或治愈、遏制、抑制、预防、减轻疾病、病症或病状或其组合的严重程度,延缓其发作,减轻其相关的症状。因此,在一个实施例中,“治疗”尤其指延迟进程、加快缓解、诱导缓解、增加缓解、加快恢复、增加替代治疗剂的疗效或降低对替代治疗剂的抗性或其组合。在一个实施例中,“预防”尤其是指延迟症状的发作、预防疾病复发、减少复发事件的次数或频率、增加有症状的事件之间的时延或其组合。在一个实施例中,“遏制”或“抑制”尤其是指降低症状的严重程度、降低急性事件的严重程度、减少症状次数、减少疾病相关症状的发病率、减少症状的时延、改善症状、减少次级症状、减少次级感染、延长患者生存期或其组合。
在一个实施例中,如本文所使用的术语“减小肿瘤的大小”使用“实体肿瘤反应评估准则”(RECIST)评定。在一个实施例中,RECIST通过测量标靶病变的最长维度来测量肿瘤大小的减小量。在一个实施例中,基于标靶病变大小(具有最长直径的病变)和其对于准确重复测量(通过成像技术或临床方式)的适合性来选择标靶病变。在一个实施例中,所有其它病变(或疾病部位)被鉴别为非标靶病变并且还记录在基线处。不需要对这些病变的测量,但每一病变的存在或不存在始终在下面指出。
在一个实施例中,使用放射学肿瘤反应评估准则评定如本文所使用的术语“减小肿瘤的体积”。由此,根据世界卫生组织(WHO),以其在平移平面中的最大直径(宽度)和其在相同图像上的最大垂直直径(厚度)的两个维度测量肿瘤。
根据本发明的方法中的任一者且在一个实施例中,本文所述的个体为人类。在另一实施例中,个体为哺乳动物。在另一实施例中,个体为灵长类动物,其在一个实施例中为非人类灵长类动物。在另一实施例中,个体为鼠类,其在一个实施例中为小鼠,且在另一实施例中为大鼠。在另一实施例中,个体为犬、猫、牛、马、山羊、绵羊、猪、猴、熊、狐狸或狼。在一个实施例中,个体为鸡或鱼。
在一个实施例中,如本文所描述的组合物包含表达通过γ分泌酶裂解的肿瘤抗原的组合物(即,一种或多种嵌合抗原受体T细胞(CAR-T细胞))和包含如本文所描述的式(I)化合物的一种或多种γ分泌酶抑制剂的组分。在另一实施例中,如本文所描述的组合物由以下组分组成:表达通过γ分泌酶裂解的肿瘤抗原的组合物(即,一种或多种嵌合抗原受体T细胞(CAR-T细胞))和包含如本文所描述的式(I)化合物的一种或多种γ分泌酶抑制剂。在另一实施例中,如本文所描述的组合物主要由以下组分组成:表达通过γ分泌酶裂解的肿瘤抗原的组合物(即,一种或多种嵌合抗原受体T细胞(CAR-T细胞))和包含如本文所描述的式(I)化合物的一种或多种γ分泌酶抑制剂。
应理解,在另一实施例中,包含如本文所描述的要素或步骤的本发明的组合物和方法可由那些要素或步骤组成,或在另一实施例中,主要由那些要素或步骤组成。在一些实施例中,术语“包含”是指纳入所指示的活性剂,如CAR-T细胞和γ分泌酶抑制剂,以及纳入其它活性剂,以及医药行业中已知的药学上或生理学上可接受的载剂、赋形剂、润肤剂、稳定剂等。在一些实施例中,术语“主要由……组成”是指活性成分仅为所指示的活性成分的组合物。然而,可以包括其它化合物,其用于使调配物稳定、保存等,但不直接涉及所指示的活性成分的治疗作用。在一些实施例中,术语“主要由……组成”可指促进活性成分释放的组分。在一些实施例中,术语“由……组成”是指含有活性成分和药学上可接受的载体或赋形剂的组合物。
施用时序和部位
在一个实施例中,CAR T细胞的施用发生在施用式(I)化合物之前、与式(I)化合物同时或在施用式(I)化合物之后。
在一个实施例中,CAR-T细胞的施用发生在与式(I)化合物的施用相同的部位。
在一个实施例中,式(I)化合物在施用CAR-T细胞之前和之后几天施用。在一个实施例中,式(I)化合物在施用CAR-T细胞之前1、2、3、4或5天施用。在另一实施例中,式(I)化合物在施用CAR-T细胞之前6、7、8、9或10天施用。在一个实施例中,式(I)化合物在施用CAR-T细胞之后1、2、3、4或5天施用。在另一实施例中,式(I)化合物在施用CAR-T细胞之后6、7、8、9或10天施用。在另一实施例中,式(I)化合物在施用CAR-T细胞之后1、2、3或4周时施用。
在另一实施例中,式(I)化合物在给药CAR-T细胞前一天和后至多9天施用。在另一实施例中,式(I)化合物在CAR-T细胞施用前一天和后第1天、第8天和第9天施用。在另一实施例中,式(I)化合物在CAR-T细胞施用前一天和后9天施用。在另一实施例中,式(I)化合物在施用CAR-T细胞前一天施用和后9天每天施用。在另一实施例中,式(I)化合物在CAR-T细胞施用前一天和第9天施用。
在一些实施例中,本发明的一种或多种组合物在治疗周期内施用至少一次。在一些实施例中,本发明的组合物在同天向个体施用。在一些实施例中,在不同天内向个体施用本发明的组合物。在一些实施例中,根据治疗时程,将本发明的一种或多种组合物在相同日且在不同日向个体施用。
在具体实施例中,本发明的一种或多种组合物经一种或多种治疗周期向个体施用。治疗周期可以是至少两天、至少三天、至少四天、至少五天、至少六天、至少七天、至少14天、至少21天、至少28天、至少48天或至少96天或更多天。在一个实施例中,治疗周期为28天。在某些实施例中,组合物在相同治疗周期或同时在针对每一组合物分配的不同治疗周期内施用。在各种实施例中,治疗周期由健康护理专业人员基于个体的病状和需求来确定。
在一些实施例中,在28天的治疗周期的至少一天、至少两天、至少三天、至少四天、至少五天、至少六天、至少七天、至少八天、至少九天、至少十天、至少十天、至少十二天、至少13天、至少14天、至少21天或所有28天内施用组合物。在具体实施例中,组合物一天一次向个体施用。在其它特定实施例中,组合物一天两次施用。在某些实施例中,组合物一天施用多于两次。
在一个实施例中,如本文所述的组合物中的一种或多种每天施用一次。在另一实施例中,如本文所述的组合物中的一种或多种每天施用两次。在另一实施例中,如本文所述的组合物中的一种或多种每天施用三次。在另一实施例中,如本文所述的组合物中的一种或多种每天施用四次。在另一实施例中,如本文所述的组合物中的一种或多种每两天施用一次,每三天施用一次,每周两次,每周一次,每2周施用一次,每3周施用一次。
在一个实施例中,施用如本文所述的组合物中的一种或多种7天到28天。在另一实施例中,如本文所述的组合物中的一种或多种施用7天到8周。在另一实施例中,如本文所述的组合物中的一种或多种施用7天到50天。在另一实施例中,如本文所述的组合物中的一种或多种施用7天到六个月。在另一实施例中,如本文所述的组合物中的一种或多种施用7天到一年半。在另一实施例中,如本文所述的组合物中的一种或多种施用14天到12个月。在另一实施例中,如本文所述的组合物中的一种或多种施用14天到3年。在另一实施例中,如本文所述的组合物中的一种或多种施用数年。在另一实施例中,如本文所述的组合物中的一种或多种施用一个月到六个月。
在一个实施例中,如本文所述的组合物中的一种或多种施用7天。在另一实施例中,如本文所述的组合物中的一种或多种施用14天。在另一实施例中,如本文所述的组合物中的一种或多种施用21天。在另一实施例中,如本文所述的组合物中的一种或多种施用28天。在另一实施例中,如本文所述的组合物中的一种或多种施用50天。在另一实施例中,如本文所述的组合物中的一种或多种施用56天。在另一实施例中,如本文所述的组合物中的一种或多种施用84天。在另一实施例中,如本文所述的组合物中的一种或多种施用90天。在另一实施例中,如本文所述的组合物中的一种或多种施用120天。
向有需要的个体施用组合物的次数取决于医学专业人员的判断、病症、病症严重程度和个体对调配物的反应。在一些实施例中,向患有有轻微急性病状的有需要的个体施用本文所公开的组合物一次。在一些实施例中,向患有有中度或重度急性病状的有需要的个体施用本文所公开的组合物多于一次。在其中个体的病状未改善的情况下,在医生判断之后,组合物可以长期施用,也就是说,持续延长的时段,包括在个体生命的持续时间中,以便改善或以其它方式控制或限制个体疾病或病状的症状。
在其中个体的状态确实改良的情况下,在医生判断组合物可以连续施用时;或所施用的药物的剂量可以暂时减少或暂时延迟一定长度的时间(即“休药期”)。休药期的长度在2天到1年之间变化,仅作为举例,包括2天、3天、4天、5天、6天、7天、10天、12天、15天、20天、28天、35天、50天、70天、100天、120天、150天、180天、200天、250天、280天、300天、320天、350天和365天。休药期期间的剂量减少可以是10%-100%,包括仅举例而言10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%和100%。
试剂盒
本发明进一步包含呈试剂盒形式的本发明组合物和任选地一种或多种额外药剂的组合,例如,其包装在一起或放在分开包装中以作为试剂盒出售在一起的情况,或其包装在一起用以调配的情况。
在某些实施例中,所述试剂盒包含治疗性或防治性组合物,所述治疗性或防治性组合物含有有效量的免疫反应性细胞,所述免疫反应性细胞包含单位剂型形式的BCMA或靶向它物的CAR以及有效量的如本文所描述的γ分泌酶抑制剂化合物。在特定实施例中,所述细胞进一步表达至少一种共刺激配体。在某些实施例中,试剂盒包含含有治疗性或防治性疫苗的无菌容器;此类容器可以是本领域中已知的盒、安瓿、瓶子、小瓶、管、包、小包、泡罩包或其它适合容器形式。此类容器可由塑料、玻璃、层压纸、金属箔或适合于容纳药剂的其它材料制成。
必要时,提供免疫反应性细胞以及向患有或处于罹患瘤变(例如多发性骨髓瘤)的风险下的个体施用细胞的说明书。所述说明书将一般包括关于组合物用于治疗或预防瘤变(例如多发性骨髓瘤)的用途的信息。在其它实施例中,所述指令包括以下中的至少一项:对治疗剂的描述;给药时程和施用以用于治疗或预防瘤变(例如多发性骨髓瘤)或其症状;预防措施;警告;适应症;禁忌(counter-indication);剂量过量信息;不利反应;动物药理学;临床研究;和/或文献。指令可直接印刷于容器上(当存在时),或作为标签附到容器上,或作为单独纸张、手册、卡片或文件夹放在容器中或与容器一起提供。
实例
实例1
检查BCMA对MM细胞的基底细胞表面表达和γ分泌酶抑制剂对a)在细胞表面上的BCMA的表达以及b)可溶BCMA的含量的影响。
为了检测可溶和细胞结合型BCMA的含量,将U266细胞(MM细胞系)以250μl总体积下1×10
首先,在未处理细胞中通过荧光活化细胞分选(FACS)测量基础水平BCMA表达。BCMA存在于MM细胞系的细胞表面上(图1.GSI浓度0nM)。
MM细胞与化合物1、化合物22、LY3039478和PF3084014一起培育增加了细胞结合型BCMA含量(图1)。化合物1和22在大于0.3nM的所有剂量下在增加细胞结合型BCMA方面,与LY3039478一样有效且比PF3084014更有效。
用GSI培育MM细胞也减少细胞培养基中的可溶BCMA(图2-3)。在降低细胞培养基中的可溶BCMA方面,化合物22比化合物1更强效(图2A,图2C和图3)。且实际上与LY3039478(图2B)一样强效且比PF3084014(图2D,图3)更强效。
BCMA是在MM细胞上高度表达的蛋白质。BCMA从MM细胞主动脱落,这是通过γ分泌酶介导的过程。本文中证实化合物1和化合物22抑制BCMA脱落(例如,增加标靶MM细胞上的BCMA含量以及降低可溶BCMA的含量)以及或比其它GSI更好。由于可溶BCMA可螯合抗BCMA疗法,如BCMA CAR-T和抗BCMA双特异性单克隆抗体,且阻碍治疗,因此抑制BCMA脱落的GSI(如化合物1和化合物22)为与抗BCMA疗法组合的良好候选物。
实例2-4:材料和方法
产生多个独特的针对BCMA的全人类scFv,且产生基于这些scFv的CAR。通过依序用BCMA-Fc融合蛋白和表达人类BCMA的3T3细胞筛选全人类scFv噬菌体库(>6×10
所产生的scFv用于产生靶向BCMA的CAR。这些靶向BCMA的CAR具有类似结构,例如各自具有包含CD28多肽的跨膜域,和包含CD3ξ多肽的胞内域和包含CD28多肽的共刺激信号传导区。将这些靶向BCMA的CAR中的每一个克隆到逆转录病毒载体中。然后将这些病毒载体转导到HEK 293galv9病毒包装细胞中以产生用于产生CAR+ T细胞的稳定包装线。用逆转录病毒转导人类T细胞(来自健康供体的非所选(CD4和CD8)人类T细胞),以便表达每一靶向BCMA的CAR,使得T细胞表达靶向BCMA的CAR。经由结合A647结合的BCMA-Fc融合蛋白测定人类T细胞上的靶向BCMA的CAR的细胞表面表达。评估靶向BCMA的28z CAR24的细胞表面表达,并且通过流式细胞测量术验证细胞表面检测。
评定二十个人类scFv在人类BCMA与小鼠BCMA之间的交叉反应活性。与小鼠BCMA进行交叉反应的scFv用于同基因型小鼠研究。
实例2
测试BCMA-CAR-T细胞和化合物(1)特异性裂解人类骨髓瘤细胞系(HMCL)的能力。BCMA-CAR-T细胞和/或化合物(1)与表达GFP的肿瘤细胞系SET2(急性骨髓白血病(AML)、CD19-BCMA-);BCWM1(淋巴浆细胞淋巴瘤(LPL)、CD19-BCMA-);L363(多发性骨髓瘤(MM)、CD19-BCMA
药物相互作用分析和协同作用确认通过中位药效法(method of Chou andTalalay)确定。使用计算1.2软件(英国剑桥拜柔公司(Biosoft,Cambridge,UnitedKingdom))进行剂量反应数据的线性回归分析以计算每一个别药物组合的组合指数(CI)。为了确保有效的统计分析,仅包括药剂-效应曲线图的线性相关系数大于0.9的实验数据。CI值定义为:
化合物(1)与BCMA-CAR-T的组合在活体外人类多发性骨髓瘤的模型中引起协同细胞杀伤。具体来说,当以10-80nM之间的浓度(患者中相关的浓度)与10
实例3
靶向BCMA的CAR-T细胞介导抗骨髓瘤免疫反应。在第0天将1×10
实例4
材料和方法
所有患者接受3次300mg/m
根据用于多发性骨髓瘤的国际统一反应准则进行骨髓瘤分级。毒性由前景事件版本4.02的常用术语准则分级。在CAR-BCMA输注后两周、1个月、2个月、3个月和6个月,用标准分级测试评定MM。
用抗CD3单克隆抗体培养自体外周血液单核细胞(PBMC)以诱导T细胞增殖。细胞用γ逆转录病毒载体转导,所述γ逆转录病毒载体编码CAR,且在起始培养物之后9天,输注CAR-BCMA T细胞。
在用藻红蛋白标记的BCMA恒定片段试剂(PE-BCMA-Fc)染色之后通过流式细胞测量术检测CAR-BCMA T细胞。还通过进行定量PCR(qPCR)检测CAR-BCMA T细胞。关于干扰素γ(IFNγ)的酶联免疫吸附分析(ELISA)是在来自CAR-BCMA T细胞样品以及靶细胞的培养物的上清液上进行。在患者血清上进行白细胞介素-6(IL-6)ELISA、可溶BCMA ELISA和多细胞因子分析。
抗BCMA CAR(CAR-BCMA)并入有11D-5-3抗BCMA单链可变片段(scFv)、CD28共刺激域和CD3-ζT细胞活化域。CAR序列由γ逆转录病毒载体主链表达。CAR-BCMA在转导的CD4和CD8 T细胞的表面上一致地表达,并且转导的T细胞在培养物中充分增殖。大多数输注T细胞表达CAR-BCMA。CAR-BCMA T细胞在活体外特异性地识别BCMA。
结果表明,组合治疗与单独的靶向BCMA的CAR-T或化合物(1)治疗相比介导改良的抗肿瘤反应。
实例5
材料和方法
将细胞在250μl的总体积下以1×10
以以下浓度将所测试的化合物(化合物1和化合物22)添加到细胞培养物中:0、10、1、0.5、0.1、0.01、0.001μM(0、1nM、10nM、100nM、500nM、1000nM和10000nM)。在37℃下培育24小时之后,收集细胞并且用抗BCMA抗体染色并且立即通过FACS分析。
结果
使用流式细胞测量术(FACS分析)观测到γ分泌酶抑制剂对淋巴瘤细胞系中的细胞表面BCMA含量的影响(图4)。用不同浓度的化合物1(图4A)或化合物22(图4B)处理来自五个不同淋巴瘤细胞系的细胞24小时。所处理的淋巴瘤细胞系为:SP49(具有Notch4 GOF的MCL);Toledo(DLBCL);RC(二次Hit DLBCL-MYC,BCL2);SUDHL-4(DLBCL);以及SUDHL-6(DLBCL)。GSI浓度为0、1nM、10nM、100nM、500nM、1000nM和10000nM。所有淋巴瘤细胞系在用10nM或更多的化合物1或化合物22处理之后具有较高的BCMA含量。
还使用流式细胞测量术观测到γ分泌酶抑制剂对急性B细胞淋巴母细胞瘤(B-ALL)细胞系中的细胞表面BCMA含量的影响(图5)。用不同浓度(0-10μM)GSI(化合物1和化合物22)处理来自三个不同B-ALL细胞系的细胞24小时。三个B-ALL细胞系RSV411(图5A);REH(图5B);以及O18Z(图5C)并不表达BCMA,并且用至多10μM GSI(例如化合物1或化合物22)处理并不影响BCMA表达(图5A-5C)。在较低剂量GSI(1、0.5、0.1、0.01、0.001M;数据未展示)的情况下证实类似结果。
虽然本文已经说明和描述了本发明的某些特征,但是对于本领域普通技术人员而言将出现许多修改、替换、改变和等效方案。因此,应该理解,所附权利要求旨在覆盖落入本发明真正精神范围内的所有此类修改和变化。
序列表
<110> 艾雅拉制药公司
大卫·西德兰斯基
<120> 包含双氟烷基-1,4-苯并二氮杂䓬酮化合物与免疫治疗剂的组合物和其使用方法
<130> P-579617-PC
<150> 62/675,787
<151> 2018-05-24
<150> 62/667,644
<151> 2018-05-28
<150> 62/715,293
<151> 2018-08-07
<150> 62/787,406
<151> 2019-01-02
<160> 1
<170> PatentIn version 3.5
<210> 1
<211> 184
<212> PRT
<213> 智人
<400> 1
Met Leu Gln Met Ala Gly Gln Cys Ser Gln Asn Glu Tyr Phe Asp Ser
1 5 10 15
Leu Leu His Ala Cys Ile Pro Cys Gln Leu Arg Cys Ser Ser Asn Thr
20 25 30
Pro Pro Leu Thr Cys Gln Arg Tyr Cys Asn Ala Ser Val Thr Asn Ser
35 40 45
Val Lys Gly Thr Asn Ala Ile Leu Trp Thr Cys Leu Gly Leu Ser Leu
50 55 60
Ile Ile Ser Leu Ala Val Phe Val Leu Met Phe Leu Leu Arg Lys Ile
65 70 75 80
Asn Ser Glu Pro Leu Lys Asp Glu Phe Lys Asn Thr Gly Ser Gly Leu
85 90 95
Leu Gly Met Ala Asn Ile Asp Leu Glu Lys Ser Arg Thr Gly Asp Glu
100 105 110
Ile Ile Leu Pro Arg Gly Leu Glu Tyr Thr Val Glu Glu Cys Thr Cys
115 120 125
Glu Asp Cys Ile Lys Ser Lys Pro Lys Val Asp Ser Asp His Cys Phe
130 135 140
Pro Leu Pro Ala Met Glu Glu Gly Ala Thr Ile Leu Val Thr Thr Lys
145 150 155 160
Thr Asn Asp Tyr Cys Lys Ser Leu Pro Ala Ala Leu Ser Ala Thr Glu
165 170 175
Ile Glu Lys Ser Ile Ser Ala Arg
180
