治疗血糖异常(包括2型糖尿病)和/或降低HBA1C水平的治疗性调控以及相关系统和方法
文献发布时间:2023-06-19 09:30:39
相关申请交叉引用
本申请要求于2018年3月29日提交的第62/649,838号未决美国临时专利申请的优先权,该申请通过引用并入本文。
技术领域
本技术一般涉及用于通过对位于患者脊髓内的靶向神经群施加电刺激来治疗患者血糖异常(包括代谢综合征,2型糖尿病(T2D),和/或升高的HbA1c水平)的方法和系统。
背景技术
神经刺激器已被开发用于治疗多种医疗疾病,包括疼痛,动作障碍,功能障碍,痉挛,癌症,和心脏障碍,以及其他医疗疾病。可植入神经刺激系统通常具有可植入信号产生器和一个或多个将电脉冲递送到神经组织或肌肉组织的导线。例如,用于脊髓刺激(SCS)的若干神经刺激系统具有圆柱形导线,该圆柱形导线包括具有圆形横截面形状的导线体和在导线体远端处彼此间隔的一个或多个导电环(即,触点)。导电环作为单独的电极工作,在许多情况下,SCS导线在有或没有通管丝的帮助下通过插入硬膜外腔的针头经皮肤植入。
尽管上述刺激器和治疗方式在许多情况下已被证明是有益的,但医学界仍然非常需要改善的疗法(therapy),以解决代谢性疾病,如糖尿病,尤其是2型糖尿病(T2D)。
附图说明
图1A是根据本技术的代表性系统和方法放置于患者脊柱处以递送治疗性(therapeutic)信号的可植入脊髓调控系统的局部示意图。
图1B是患者脊柱的局部示意性横截面图,示出了根据本技术的代表性系统和方法所植入的导线体的代表性位置。
图2A是大鼠脊髓的局部示意性横截面图,示出了根据本技术的代表性系统和方法可以由疗法信号靶向的板层。
图2B是患者胸椎脊髓的横截面图像,示出了根据本技术的代表性系统和方法可以由疗法信号靶向的结构。
图3是患者的交感神经系统和副交感神经系统及其支配的一些器官的局部示意图,还示出了根据本技术的代表性系统和方法所植入的导线体的代表性位置。
图4A是患者脊髓的局部示意图和患者肝脏的放大图,示出了支配肝脏的交感神经,其可受本技术的代表性系统和方法的影响。
图4B是患者脊髓的局部示意性横截面图和患者肾上腺髓质的放大图,示出了支配肾上腺髓质的交感节前神经元(SPN),其可受本技术的代表性系统和方法的影响。
图5是患者肾系统的一部分的局部示意图,包括肾上腺的放大图,该肾上腺根据本技术的代表性系统和方法可以由疗法信号靶向。
图6是患者脊柱的图像,示出了根据本技术的代表性系统和方法所植入的导线体的代表性位置。
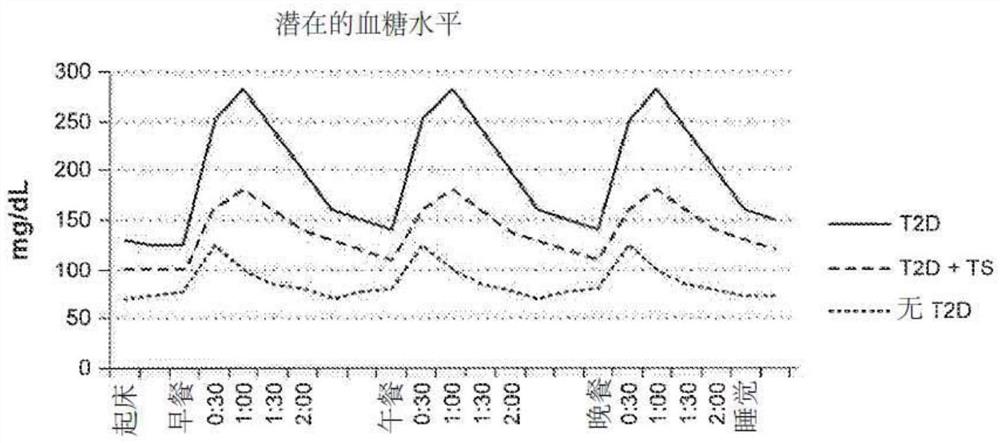
图7是示出了根据本技术的代表性系统和方法的治疗性电疗法对发生在起床和睡觉之间的血糖水平的潜在作用的图表。
图8是示出了根据本技术的系统和方法应用使用反馈回路布置的疗法的代表性过程的流程图。
具体实施方式
标目1.0(“定义”)下提供了所选术语的定义。下文标目2.0(“简介”)下描述了本公开技术操作的解剖和生理环境的一般方面。参考图1A和1B,在标目3.0(“系统特性”)下描述代表性治疗系统及其特性。参考图2A-7,通过代表性系统治疗血糖异常的代表性方法和放置导线的靶向位置描述在标目4.0(“治疗血糖异常的代表性方法”)下。代表性示例(“代表性示例”)描述在标目5.0下。
1.0
如本文所使用的,术语“电信号”通常是可以由一个或多个参数表征的电信号,例如频率,脉冲宽度,和/或幅度。本文公开的代表性电信号可具有(1)频率为从约1.2kHz至约100kHz,或至约50kHz,或至约25kHz,或至约10kHz,或从约1.5kHz至约100kHz,或从约2kHz至约50kHz,或从约3kHz至约20kHz,或从约3kHz至约15kHz,或从约5kHz至约15kHz,或从约3kHz至约10kHz,或1kHz,2kHz,3kHz,4kHz,5kHz,10kHz,15kHz,20kHz,25kHz,50kHz,或100kHz;(2)幅度范围为约0.1mA至约20mA,约0.5mA至约10mA,约0.5mA至约7mA,约0.5mA至约5mA,约0.5mA至约4mA,约0.5mA至约2.5mA;(3)脉冲宽度范围为从约1微秒或更少至约416微秒,从约10微秒至约333微秒,从约10微秒至约166微秒,从约25微秒至约166微秒,从约25微秒至约100微秒,从约30微秒至约100微秒,从约33微秒至约100微秒,从约50微秒至约166微秒;和/或(4)零或非零相间延迟,包括在30微秒阴极脉冲和随后30微秒阳极脉冲之间的20微秒相间延迟,随后是另一个20微秒相间。
如本文所使用的,“程序”通常是可用于表征电信号的一个或多个电信号参数。程序相应地可以包括信号频率,脉冲宽度,幅度,工作周期,信号被引导至的电触点,一天中信号激活的时间,和/或其他适合的参数。给定的装置可以用一个或多个程序来编程,这些程序可以(例如,同时地或顺序地)被激活,或被去激活。
除非另有说明,术语“约”和“大致”是在所声明的值的10%以内的值。
如本文所使用的,术语“血糖异常”通常是患者身体对葡萄糖的处理/反应方式的异常,包括但不限于高于正常HbA1c水平,高于正常空腹血糖水平,高于正常口服葡萄糖耐受试验,和/或持续性高血糖状态,其经常与代谢综合征相关。
如本文所使用的,“II型糖尿病(T2D)”通常是葡萄糖代谢受损和/或胰岛素依赖性葡萄糖水平调整受损的疾病。而T2D是系统性的,它对肝脏,胰腺,肾脏,胃,肾上腺,心脏,血管,神经,眼睛,脚,手,皮肤,和大脑的影响比其他器官更大。本技术的系统和方法被配置为治疗T2D。为了本说明的目的,T2D是一种血糖异常。
术语“代谢综合征”通常是以下五种医疗疾病中至少三种的集合:向心性肥胖,高血压,高血糖,高血清甘油三酸酯,和低血清高密度脂蛋白。代谢综合征增加了发生T2D的风险,这些患者可以是糖尿病前期或有T2D。胰岛素抵抗,代谢综合征,和糖尿病前期是彼此密切相关的。综合征被认为是由能量利用和储存的潜在障碍引起的,针对T2D的疗法通常对代谢综合征患者有效。为了本说明的目的,代谢综合征也被认为是血糖异常。
本文所用的“治疗(treating)”或“治疗(treatment)”通常指预防血糖异常(包括T2D和/或代谢综合征)的持续和/或发作,改善,降低,消除,压制,和/或减轻血糖异常,和/或与血糖异常相关的一个或多个症状,产生血糖异常的完全或部分消退,或其中任何适合的组合。“治疗(treatment)”也指降低患者的HbA1c水平。
如本文所使用的,除非另有说明,术语“调控(modulate)”,“调控(modulation)”,“刺激(stimulate)”和“刺激(stimulation)”通常指具有上述任何作用的信号。因此,脊髓“刺激器”可以对某些神经群产生抑制或兴奋作用。
如本文所使用的,术语“HbA1c”通常是血红蛋白A1c,一种血红蛋白的糖化形式。
以下术语在本公开中可以互换使用:电信号,电刺激,治疗性调控信号,疗法信号,治疗性信号,电脉冲,信号,波形,调控信号,调控,神经调控信号,和治疗性电信号。
下文所述的“代表性系统”和“代表性方法”包括一个或多个特征。代表性系统和方法可以但不必须包括这些特征。
2.0
本技术一般涉及脊髓调控以及相关的系统和方法,其通过治疗性电信号元件或提供治疗性结果的部件的波形来用于治疗血糖异常(包括代谢综合征,2型糖尿病(T2D))和/或降低HbA1c水平。虽然下文在T2D的情境下描述代表性系统和方法,但是这些系统和方法也可以解决总体血糖异常,和/或与血糖异常相关的其他患者指征。本文所述的系统和方法通常可在不产生感觉异常的情况下治疗血糖异常,所述感觉异常基于例如具体患者,可以是也可以不是副作用。额外的副作用可以包括不想要的运动刺激或阻滞,和/或干扰除了靶向的血糖异常以外的感觉功能。代表性系统和方法在调控信号停止后的至少一段时间内继续为血糖异常提供疗法,和/或提供HbA1c水平的降低。尽管下文参考调控背柱,背角,背根,背根进入区,和脊柱的其他特定区域以治疗血糖异常来描述一些代表性系统和方法,但在一些情况下,调控通常可针对患者的脊柱的胸椎区域(例如,T2-T12),和/或其他神经结构和/或其他神经组织,器官,和/或组织的靶向神经群。在至少一些代表性系统和方法中,在上述范围内以胸椎椎体水平递送的疗法信号可以影响在多个椎体水平上从脊髓分支出来的脾神经。
下文参考用于调控患者脊髓和/或患者的其他部位内的一个或多个靶向神经群的方法以及用于提供调控的相关可植入结构来描述本技术的代表性系统和方法的具体细节。一些代表性系统和方法可以具有与本文所描述的代表性系统和方法不同的配置,部件和/或过程,其他系统和方法可以消除特定部件或过程。因此,相关领域的普通技术人员将理解,本公开可以包括具有附加元件的代表性系统和方法,和/或可以包括不具有以下参考图1A-8所示和所述的多个特征的代表性系统和方法。
本文还提供了用于治疗血糖异常(包括T2D)和/或降低HbA1c水平的代表性神经调控系统,方法,和疗法。除非另有说明,否则所讨论的代表性系统和方法不应被解释为对本公开技术范围的限制。对于本领域的技术人员来说,显而易见的是,可以在不偏离本公开技术的范围的情况下进行多种等同,改变,和修改,并且应当理解,本文将包括这样的等同系统和方法。
一般来说,本技术针对于产生包括降低或消除患者体内的血糖异常和/或其一种或多种症状的治疗性作用。可以降低或消除的其他的(例如,与血糖异常相关的)作用包括高血压,腰部脂肪过多,和/或胆固醇或甘油三酯水平异常等症状。治疗性作用可通过抑制,压制,下调,阻断,预防,和/或以其他方式调控受影响的和/或靶向神经群的活动来产生,该靶向神经群例如患者脊柱的胸椎区域中(例如,T2-T12)的靶向神经群。在代表性系统和方法中,受影响的神经群位于患者的交感神经系统内,在其附近,或与其对应,该交感神经系统调控糖原的生成并调整患者胰岛素的生成和/或对胰岛素的反应。不受任何特定理论的约束,抑制患者交感神经系统(例如对应于患者的肝脏,肾上腺,胰腺,肾脏,或胃肠系统(胃,大肠,和/或小肠)中的一个或多个的一个或多个交感神经)的至少一部分,可以通过增加糖原生成量(例如肝脏糖原),增加胰岛素敏感性,增加患者胃肠收缩率而获得治疗性作用,不受任何特定理论的约束,可以诱导胰高血糖素样肽-1(GLP-1)从患者肠道中释放,和/或改变胰岛素的生成和/或葡萄糖的储存(例如,以糖原的形式)。在代表性系统和方法中,可通过抑制对应于T2到T12范围内的一个或多个胸椎的一个或多个交感神经来获得治疗性作用。
下文参考图1A-8所描述的技术可以生成比现有的刺激疗法和/或其他T2D疗法更有效,更稳定,没那么复杂和/或更理想的结果。特别地,这些技术可以生成降低或消除血糖异常和/或在调控信号停止后持续的结果。这些技术可以通过持续或间歇地(例如,按时间表)递送调控信号来执行,以获得关于治疗血糖异常的有益效果。
以下代表性系统和方法中的多个产生包括治疗患者血糖异常的治疗性作用。治疗性作用可通过抑制,压制,下调,阻断,预防,和/或其他调控受影响神经群的活动来生成。
在代表性系统和方法中,治疗性调控信号被引导到通常包括患者脊髓的靶向位置,例如,患者脊髓的背柱。调控信号可被引导到背角,背根,背根神经节,背根进入区,和/或放置于或靠近脊髓自身的其它特定区域。上述区域在此统称为脊髓区。在代表性系统和方法中,治疗性调控信号通常通过(1)患者脑脊液在患者背中沟处的传导,(2)第I-IX板层中的一个或多个,或(3)以上两者,被引导到患者脊髓的第X板层。在更进一步的示例中,调控信号可被引导到其他神经结构和/或靶向神经群。
不受以下理论或任何其他理论的约束,疗法信号可以通过以下两种机制中的一种或两种来治疗血糖异常:(1)通过降低进入交感神经系统的神经递送,和/或(2)通过降低交感神经自身的神经活动。本公开的疗法可治疗血糖异常,在一些情况下伴有感觉异常,而在其他情况下,没有感觉作用(例如,感觉异常)和/或通常与常规SCS疗法相关的其它作用,例如,包括但不限于在1200Hz以下传导的SCS疗法。在通过引用并入本文的专利号为No.8,170,675的美国专利中进一步讨论了包括频率高于1.5kHz的刺激的若干代表性SCS疗法。下文进一步描述与本公开技术相关联的这些和其他优点。
3.0
代表性系统包括可植入的或外部的信号产生器(或脉冲产生器)。信号产生器可耦接到可植入信号递送装置,该可植入信号递送装置将电信号引导到患者的靶向神经群。代表性系统还可以包括其他元件,例如,编程或更新信号递送参数的一个或多个装置,根据该参数,电信号被递送到患者。
代表性系统根据进一步的信号递送参数,将来自(放置于相对于患者解剖结构的选定位置的)电触点的电信号引导到靶向神经群。代表性信号递送参数包括:
例1.刺激位置:T9-T10;频率:10kHz;脉冲宽度:30微秒;幅度:0.5-5mA。
例2.刺激位置:C8-T12;频率:1.2-100kHz;脉冲宽度:1-416微秒;幅度:0.5-15mA。
例3.刺激位置:T2-T12;频率:1.2-50kHz;脉冲宽度:10-416微秒;幅度:0.5-10mA。
例4.刺激位置:T2-T10;频率:1.2-25kHz;脉冲宽度:20-416微秒;幅度:0.5-7.5mA。
例5.刺激位置:T4-T8;频率:5-25kHz;脉冲宽度:20-100微秒;幅度:1-7.5mA。
标目3.0下和本文其他地方所描述的代表性系统可用于实施标目4.0下和本文其他地方所描述的方法。
图1A示意性地示出了相对于患者的脊柱191的总体解剖布置的用于治疗患者血糖异常(例如,T2D或代谢综合征)的代表性患者疗法系统100。系统100可以包括信号产生器101(例如,被植入的或可植入的脉冲产生器或IPG),其可以被皮下地植入患者190体内并且耦接到一个或多个信号递送元件或装置110。系统100还可以包括外部脉冲产生器,之后将进一步详细描述。信号递送元件或装置110可被植入患者190体内,在患者的脊髓中线189处或偏离脊髓中线189。信号递送元件110具有用于在植入后向患者190递送疗法的特征。信号产生器101可以直接连接到信号递送装置110,或者可以通过信号链路(例如导线延伸102和/或无线链路)耦接到信号递送装置110。在代表性系统中,信号递送装置110可包括一根或多根伸长的导线或一根或多根导线体111(分别被标识为第一导线111a和第二导线111b)。如本文所使用的,术语信号递送装置,导线,和/或导线体包括任意的一定数量的适合的承载向患者190提供疗法信号的电极/装置的基板和/或支撑构件。例如,一个或多个导线111可包括一个或多个电极或电触点,其将电信号引导到患者的组织,例如,以提供治疗性缓解。在代表性系统和方法中,信号递送元件110可包括除导线体以外的结构(例如,桨叶,具有面朝靶向组织的盘状电极阵列),该结构也将电信号和/或其他类型的信号引导到患者190,例如,在通过引用整体并入本文的美国专利公开号No.2018/0256892中所公开的。
在代表性系统和方法中,一个信号递送装置可被植入脊髓中线189的一侧,并且第二信号递送装置可被植入脊髓中线189的另一侧。例如,图1A中所示的第一和第二导线111a,111b可以被放置于相对的侧向方向上刚好偏离脊髓中线189(例如,偏移约1mm)的位置,使得两个导线111a,111b彼此间隔约2mm。在代表性方法中,导线111可在例如从约T2到约T12的椎体水平范围内被植入。在代表性方法中,一个或多个信号递送装置可以在其他椎体水平被植入。
信号产生器101可以将信号(例如,电信号)发送到使靶向神经(例如,交感神经)兴奋和/或压制的信号递送元件110。信号产生器101可以包括机器可读(例如,计算机可读)或控制器可读的介质,该介质包含用于产生和发送适合的疗法信号的指令。信号产生器101和/或系统100的其它元件可以包括一个或多个处理器107,存储器单元108,和/或输入/输出装置112。因此,提供调控信号,提供用于放置信号递送装置110的指导信息,建立电池充电和/或放电参数,和/或执行其它相关功能的过程可以由计算机可执行指令来执行,该计算机可执行指令被包含在位于脉冲产生器101和/或其它系统部件的计算机可读介质上或内。此外,脉冲产生器101和/或其它系统部件可包括专用硬件,固件,和/或软件,以执行计算机可执行指令,当该计算机可执行指令被执行时,实施通过引用并入本文的材料中所述的任何一种或多种方法,过程,和/或子过程。专用硬件,固件,和/或软件也用作实施本文所述的方法,过程,和/或子过程的“装置”。信号产生器101还可以包括承载在如图1A所示的单个壳体或多个壳体中的多个部分,元件,和/或子系统(例如,用于根据多个信号递送参数来引导信号)。
信号产生器101还可以接收并响应从一个或多个源接收的输入信号。输入信号可以引导或影响选择,执行,更新,和/或实施的疗法,充电,和/或过程指令的方式。可以从一个或多个传感器(例如,为了说明的目的而在图1A中示意性示出的输入装置112)接收输入信号,该一个或多个传感器由信号产生器101承载和/或分布在信号产生器101外部(例如,在其他患者位置)同时仍与信号产生器101通信。传感器和/或其他输入装置112可以提供依赖或反映患者状态(例如,患者位置,患者姿势,和/或患者活动水平)的输入,和/或不依赖于患者的输入(例如,时间)。更多细节包含在通过引用整体并入本文的专利号为No.8,355,797的美国专利中。下文参考图8描述了检测与2型糖尿病具体相关的特定于患者的化合物水平的传感器的具体细节,以及基于所检测到的水平和/或其他相关生理特性控制所述疗法的反馈技术。
在代表性系统和方法中,信号产生器101和/或信号递送装置110可以从外部电源103获得电力以产生疗法信号。例如,外部电源103可以绕过被植入的信号产生器,并直接在信号递送装置110处(或通过信号继电器部件)产生疗法信号。外部电源103可以使用电磁感应(例如,RF信号)向植入的信号产生器101和/或直接向信号递送装置110发送电力。例如,外部电源103可以包括外部线圈104,该外部线圈104与在可植入信号产生器101,信号递送装置110,和/或电力继电器部件(未示出)内的对应的内部线圈(未示出)通信。为了便于使用,外部电源103可以是便携式的。
在代表性系统和方法中,除了或替代外部电源103,信号产生器101可以从内部电源获得电力以产生疗法信号。例如,被植入的信号产生器101可以包括非充电电池或充电电池以提供这种电力。当内部电源包括充电电池时,外部电源103可用于对电池充电。外部电源103又可以从适合的电源(例如,常规的墙上电力)充电。
在至少一些过程中,在植入信号产生器101之前的初始过程中,外部刺激器或试验调控器(例如,外部脉冲产生器)105可以耦接到信号递送元件110,或者外部脉冲产生器可用于长期疗法。例如,从业者(例如,医生和/或公司代表)可以使用外部刺激器105来实时改变提供给信号递送元件110的调控参数,并且选择最佳或特别有效的参数。这些参数可以包括发射电信号的位置,以及提供给信号递送装置110的电信号的特性。在代表性系统和方法中,通过外部刺激器或试验调控器收集输入,临床医生可以使用该输入来帮助确定要改变的参数。在典型的过程中,从业者使用电缆组件120将试验调控器105临时连接到信号递送装置110。从业者可以在初始位置测试信号递送装置110的功效。然后从业者可以断开电缆组件120(例如,在连接器122处),重新放置信号递送装置110,并重新施加电信号。该过程可以被迭代地执行,直到从业者获得信号递送装置110的所需位置。可选地,从业者可以移动部分被植入的信号递送装置110而无需断开电缆组件120。
在植入信号递送元件110之后,患者190可以(可选地)经历一个试验周期,在此期间,患者通过由试验调控器105产生的信号接收疗法,通常是有限的时间段。在此期间,患者将电缆组件120和试验调控器105佩戴在体外。基于试验结果,从业者可将试验调控器105替换为被植入的信号产生器101,并使用基于试验期间获得的经验而选择的疗法程序来编程信号产生器101。可选地,从业者还可以替换信号递送元件110。一旦可植入信号产生器101被放置于患者190体内,信号产生器101提供的疗法程序仍然可以通过无线的医生编程器117(例如,医生的笔记本电脑,医生的远程或远程装置等)和/或无线的患者编程器106(例如,患者的笔记本电脑,患者的远程或远程装置等)远程更新。通常来说,患者190比从业者控制更少的参数。例如,患者编程器106的能力可以限于启动和/或停止信号产生器101和/或调节信号幅度。患者编程器106可以被配置为接受疼痛缓解输入以及其它变量,例如药物使用。在一些情况下,试验期可以被消除,患者可以直接进行至被植入的脉冲产生器,和完全被植入的信号递送装置。此外,在代表性系统和方法中,外部刺激器可通过无线链路而非电缆组件与一个或多个被植入的信号递送装置链接,以临时(例如,在试验期间)和/或长期地将电力,电信号,和/或数据发送至所述一个或多个信号递送装置。
信号产生器101,导线延伸102,试验调控器105和/或连接器122可各自包括接收元件109。相应地,接收元件109可以是患者可植入元件,或者接收元件109可以与外部患者治疗元件,装置或部件(例如,试验调控器105和/或连接器122)集成在一起。接收元件109可以被配置为便于在信号递送装置110,导线延伸102,脉冲产生器101,试验调控器105和/或连接器122之间的简单耦接和去耦过程。接收元件109在结构和功能上至少总体上与通过引用整体并入本文的美国专利申请公开号No.2011/0071593中描述的类似。
在代表性系统和方法中,本技术包括通过传感器和/或其他输入装置接收的患者反馈,该患者反馈指征或对应于患者对信号的反应。反馈包括但不限于生理反馈(例如,运动和/或感觉反馈,检测到的血液中选定化合物的水平,血压,和/或其他患者状态测量),和口头反馈。响应于患者反馈,可以调节一个或多个信号参数,例如频率,脉冲宽度,幅度或递送位置。后面将参考图8描述更多细节。
图1B是脊髓191和相邻椎体195的横截面图(大体上基于来自Crossman和Neary,“神经解剖学(Neuroanatomy)”,1995年(由丘吉尔·利文斯通(Churchill Livingstone)出版)的信息),其中具有植入在代表性位置的多个导线111(如所示出的导线111a-111e)。为了说明的目的,图1B中示出了植入单个患者中的多根导线111。此外,为了说明的目的,导线111被示出为伸长的,具有相应圆柱形触点的大体上圆柱形的导线,然而,导线111可以是桨叶式导线,例如,具有一个大体上平坦的平面基板,该基板具有面朝靶向组织的盘状电极。在实际使用中,任何给定的患者接收的导线可以少于图1B所示的所有导线111。
脊髓191位于椎孔188内,在腹侧的腹侧躯体196和背侧的横突198和棘突197之间。箭头V和D分别标识腹侧和背侧方向。脊髓191自身位于硬脑膜199内,该硬脑膜199还包围部分从脊髓191出来的神经,包括腹根192,背根193和背根神经节194。背根193在背根进入区187进入脊髓191,并与位于背角186的背角神经元进行连通。在代表性系统和方法中,第一和第二导线111a,111b放置于在相对的侧向方向上刚好偏离脊髓中线189(例如,大约1mm偏移)的位置,使得两根导线111a,111b彼此间隔约2mm,如上所述。在代表性系统和方法中,一根或一对导线可放置于其他位置,例如,如第三根导线111c所示出的,朝向背根进入区187的外边缘,或者如第四根导线111d所示出的,放置于背根神经节194处,或者如第五根导线111e所示出的,大致地放置于脊髓中线189处。导线可放置于硬脑膜外,向包括脊髓自身的脊髓区域中的靶向神经群递送电疗法信号。
代表性系统和方法可以包括其他特征。例如,一根导线111到六根导线111通常可以首尾相连地放置于患者的中线M处或附近,并且跨越从约T2到约T12的椎体水平。在一些情况中,两根,三根,或四根导线111首尾相连(end to end)地放置于患者从T2到T12的中线处或附近。不受任何特定理论的约束,在患者的中线M上放置一根或多根导线111可以模仿接受电疗法信号以解决糖尿病神经病变,慢性腹痛,和其他类型的疼痛和/或与自主神经系统有关的功能紊乱的患者所观察到的疗法的双侧自主神经和疼痛作用。另外,本技术的装置和系统可以包括一个以上的内部刺激器和/或一个以上的外部刺激器,其可以被配置为用于无线刺激,例如通过使用电磁波。
该技术的多个方面体现在计算装置中,例如,已编程/可编程脉冲产生器,控制器和/或其他装置。在其上/其中可以实现所述技术的计算装置可以包括一个或多个中央处理器单元,存储器,输入装置(例如,输入端口),输出装置(例如,显示装置),存储装置,和网络装置(例如,网络接口)。存储器和存储装置是可以存储实现本技术的指令的计算机可读介质。在代表性系统中,计算机可读介质是有形介质。在代表性系统中,数据结构和消息结构可以通过诸如通信链路上的信号之类的无形的数据发送介质来存储或发送。可以使用多种适合的通信链路,包括但不限于局域网和/或广域网。
在代表性系统和方法中,重要的是将信号递送装置110,尤其是装置的疗法或电触点,放置于靶向位置或其附近,该靶向位置(例如,由从业者)被选择以在装置110被激活时在患者体内生成有效结果。第4.0节描述了用于在患者脊柱中放置导线111以递送神经调控信号来治疗患者血糖异常的技术和系统。
4.0
上述标目3.0下和本文其他地方描述的代表性系统可用于实施标目4.0下和本文其他地方所描述的方法。
自主神经系统(ANS)主要负责自动和潜意识调整身体的许多系统,包括心血管,肾脏,胃肠,和体温调整系统。通过调整这些系统,ANS可以使身体适应环境的变化。自主神经纤维支配多种组织,包括心肌,平滑肌,和腺体。这些神经纤维有助于调整与上述组织相关的功能,包括但不限于血压,血流,胃肠功能,体温,支气管扩张,血糖水平和/或储存,血胰岛素水平和/或储存,胰岛素生成和/或代谢,糖原水平和/或储存,糖原生成和/或代谢,HbA1c水平和/或储存,HbA1c生成和/或代谢,代谢,排尿和排便,瞳孔光和适应反射,肾上腺激素,GLP-1,和腺分泌物。自主神经系统包括交感神经系统和副交感神经系统。在许多情况下,这两个系统有相对的作用,因此,每一个系统都可以平衡另一个系统的作用。在通过引用整体并入本文的专利号为No.9,833,614的美国专利中描述了ANS的附加特征和用于调控患者的ANS的治疗性调控信号的应用。
不受任何特定理论的约束,T2D可以至少部分地由患者的交感神经系统的增强的作用所引起。根据本技术的代表性系统和方法,治疗T2D和/或降低HbA1c水平的一种方法是应用治疗性信号来抑制患者交感系统的一个或多个作用。治疗性信号治疗血糖异常的一种可能的作用机制是降低宽动态范围(WDR)神经元的兴奋性。因此,用于治疗血糖异常(包括T2D和/或代谢综合征)的治疗性信号可以相似和/或类似于与疼痛治疗相关的方式来操作,以抑制患者交感系统的至少一部分。治疗性调控信号对WDR神经元的作用在美国专利号NO.9,833,614中描述,其先前通过引用整体并入本文中。
在患者胸椎T2到T12的一个或多个处或附近,特别是在T9和/或T10处或附近,以及T5和/或T6处或附近,进行治疗性调控可以治疗患者的血糖异常,没有感觉异常,没有不良感觉或运动作用,和/或以在调控停止后持续存在的方式。T5/T6通常对应于肝脏,胃,和胰腺,T9/T10通常对应于肾上腺和肠道。在患者胸椎T2到T12的一个或多个处或附近进行治疗性调控可以通过多个不同的机制中的任意个改善葡萄糖不耐受和胰岛素抵抗。
由于不同患者的解剖结构不同,一些患者可能会在T2以上的椎体水平或头侧至T2的椎体水平(例如,C8,C9和/或T1)处接受有效疗法,这仅仅是因为相关神经在不同于大多数患者的位置离开椎管。因此,本技术以及在应用于从T2-T12的椎体水平的电信号情境中描述的任何代表性系统和方法可以应用于C9-T12的椎体水平,以便包括这些患者。
不受任何特定理论的约束,递送治疗性调控信号可通过增加患者肠道内的肠促胰岛素释放(例如,GLP-1和/或GIP释放)来改善血糖异常(例如,T2D和/或代谢综合征)患者的葡萄糖耐量,和/或减少患者部分胃系统中的胃饥饿素的释放。本技术提供用于治疗患者血糖异常(例如,T2D和/或代谢综合征),和/或降低患者的HbA1c水平的方法和装置。通过对胸神经群应用治疗性调控信号来治疗患者血糖异常的方法和系统将在下文讨论。
图2A是患者脊髓191的局部示意性横截面图,显示脊髓内第I-X板层的相对位置。如本文所讨论的,递送治疗性电信号以抑制患者交感神经系统的至少一部分(例如交感神经)可以治疗患者的血糖异常。在代表性系统和方法中,治疗性电信号通过诸如本文所述的被植入的信号递送装置递送到患者的部分交感神经。更具体地说,不受任何特定理论的约束,治疗性电信号的抑制作用可以调控患者的交感神经中间神经元,这些神经元是γ-氨基丁酸能的(GABAergic),在中外侧细胞列内的交感神经节前神经元(SPN)中引起单突触的抑制的突触后电位。交感神经中间神经元通常位于患者脊髓的第V板层,第VII板层,和第X板层,较少出现在第I-IV板层。
不受任何特定理论的约束,较深的板层,例如第V-X板层,尤其是第X板层,可以通过介导治疗性调控信号对患者交感神经的一个或多个的任何抑制作用而与交感神经调控相关。在代表性系统和方法中,治疗性电信号被引导到患者脊髓的第X板层,以抑制患者的交感神经系统,例如通过交感神经中间神经元。治疗性调控信号的这些抑制作用可以促进T2D患者的血糖控制,例如通过促进患者肝脏对葡萄糖的摄取。
图2B是大鼠胸的脊髓的组织学图像。如图2B所示,背侧正中沟250将患者的左背柱255和右背柱257分开。背侧正中沟250含有脑脊液,其传导能力约为患者脊柱自质或灰质的5倍。治疗性电信号通过以下方式可到达患者脊髓的第X板层:(1)通过患者背侧正中沟的脑脊液传导,(2)通过第I-IX板层中的一个或多个,(3)通过另一机制,或(4)通过(1)-(3)中的任意组合。为了定向的目的,示出了背角260和腹角270。
图3是患者的交感神经系统310和副交感神经系统350以及由相应的交感神经315和/或副交感神经355支配的器官的局部示意图。导线体111(如图3所示,植入之前)可放置于患者脊柱330的胸部区域320(例如,T1-T12)处或其附近。将治疗性调控信号施加到患者胸部区域的T2到T12处或之间的靶向位置可以调控患者的交感神经315中的一个或多个,例如腹腔神经节342,肠系膜上神经节344,和肠系膜下神经节348。在代表性系统和方法中,该调控抑制支配患者的肝脏361,胰腺365,肾上腺367,和/或胃363的交感神经315中的一根或多根。通过抑制交感神经315中的一根或多根,可以增加患者的肝脏361对葡萄糖的摄取,从而降低患者的餐后血糖水平,从而治疗患者的T2D。
图4A是患者脊髓191的局部示意图和患者肝脏400的放大示意图,示出了支配肝脏400的交感神经。交感神经链神经节402被示出以供参考。支配肝脏的神经从左胸内脏大神经405,迷走神经前干410,右膈神经420,迷走神经后干430,和右胸内脏大神经440延伸。此外,肝脏前丛460,肝脏后丛465,和膈神经节470也延伸入肝脏400。腹腔神经节450也被示出以供参考。递送本技术的治疗性信号可对肝脏400发挥治疗性益处。在代表性系统和方法中,治疗性信号会降低支配肝脏的交感紧张,从而增加餐后肝脏中葡萄糖的摄取,其作为糖原储存在肝脏中。在代表性系统和方法中,治疗性信号通过影响胰岛素,胰高血糖素,GLP-1,和/或肾上腺激素的代谢来发挥这些益处。在代表性系统和方法中,治疗性信号还可以直接影响患者的肝脏400,例如通过诱导胰岛素,胰高血糖素,GLP-1,和/或肾上腺激素对患者肝脏400的一种或多种作用。治疗性信号可以影响胰岛素和胰高血糖素的比率,这些比率在患有T2D的患者中可以是病理性的。例如,在高胰岛素血症的T2D患者中,胰岛素与胰高血糖素的比率可能是过高的。在代表性系统和方法中,治疗性信号可以降低患者对胰岛素的需求,其可诱导患者肝脏400释放胰高血糖素,例如通过降低胰岛素水平。
图4B是患者脊髓410的局部横截面示意图,以及患者肾上腺髓质420的放大图。肾上腺髓质420由交感节前神经元(SPN)430直接支配。SPN 430通过促进患者肝脏的葡萄糖释放,促进与升高的血糖水平有关的儿茶酚胺(虚线箭头)的释放。将一个或多个治疗性调控信号递送到第X板层患者交感神经中间神经元中的一个或多个可直接和/或间接抑制可间接影响患者肝脏中葡萄糖代谢的SPN活动,如上文参考图4A所述。
图5是患者肾脏系统的局部示意图。具体地,图5示出了患者的肾上腺367a和367b,每个肾上腺包括肾上腺皮质368和肾上腺髓质369。如图5所示,患者的左肾上腺367a近端地位自患者右肾上腺367b。在代表性系统和方法中,可植入刺激装置(例如,导线111)可以被放置于相对于患者脊柱的不同水平,并且在一些情况下,被放置于患者脊柱的另一侧。例如,为了抑制支配左肾上腺367a的交感神经,可以将第一根导线放置于患者T10椎体附近和右侧,而为了抑制支配右肾上腺367b的交感神经,可以将第二根导线放置于患者T9椎体附近和左侧。作为另一示例,第一根导线可放置于患者T10椎体的附近和左侧,而第二根导线可放置于患者T9椎体的附近和右侧。椎体位置不限于T9和T10,还可以包括T2到T12的任何数量的胸椎。
图6是患者脊柱600的图像,以及植入在代表性位置的两个经皮信号递送装置111(示出为信号递送装置111f和111g)。为了说明的目的,图6中示出了两个信号递送装置111,其被植入同一患者中。在实际使用中,任意给定的患者可以接收到多于或少于图6所示的两个信号递送装置111g和111f。
如图6所示,具有第一多个触点C的第一信号递送装置111f放置于患者脊柱600的中线M的第一侧610上,具有第二多个触点C的第二可植入信号递送装置111g放置于中线M的第二侧620上。第一多个触点C是沿着中线M的第一侧610纵向放置,从T8到T10,并且第二多个触点沿着中线M的第二侧620纵向放置,从T9到T11。在代表性系统和方法中,第一可植入信号递送装置111f和第二可植入信号递送装置111g可放置于中线M的同一侧(例如,第一侧610或第二侧620)。在代表性系统和方法中,第一多个触点C可沿中线M的第一侧610纵向放置,从T7到T10,并且第二多个触点沿着中线M的第二侧620纵向放置,从T5到T8。在代表性系统和方法中,第一多个触点C和第二多个触点C的椎体范围可以不同于本文所公开的范围。
如图6所示,第一可植入信号递送装置111f和第二可植入信号递送装置111g被示出为以每个信号递送装置长度的约1/2至约1/3重叠。然而,在代表性系统和方法中,第一可植入信号递送装置111f和第二可植入信号递送装置111g不重叠。例如,第二可植入信号递送装置111g至少可以大体上首尾相连(end to end)地放置,使得第一多个触点C和第二多个触点C大体上沿着中线M纵向延伸。
在代表性系统和方法中,第一可植入信号递送装置111f也可被放置以跨越在中线M的第一侧610上的患者组织的第一部分613和在中线M的第二侧620上的患者组织的第一部分623。第二可植入信号递送装置111g可被放置为跨越在中线的第一侧610上的患者组织的第二部分617和在中线M的第二侧620上的患者组织的第二部分627。当被放置为跨越在中线M的第一侧610和第二侧620时,第一多个触点的至少一个触点C被放置于第一侧610的第一部分613附近,并且第一多个触点的至少一个触点C被放置于第二侧620的第一部分623附近。另外,第二多个触点的至少一个触点C被放置于第一侧610的第二部分617附近,并且所述第二多个触点的至少一个触点C被放置于第二侧620的第二部分627附近。
治疗性电刺激信号可以被递送到靶向位置。在代表性系统和方法中,靶向位置还可以包括第一靶向部分和第二靶向部分。例如,第一被植入的信号递送装置111f可以被放置于第一靶向部分623附近和/或第二被植入的信号递送装置111g可以被放置于第二靶向部分627附近。在代表性系统和方法中,第一靶向部分在第一胸椎附近,第二靶向部分在第二胸椎附近,该第二胸椎可以与第一胸椎相同或不同。
在放置之后,治疗性调控信号可以通过一个或多个可植入治疗性信号递送装置在大体上相同的时间(例如,同时或大致同时)递送到患者的靶向位置。一般而言,抑制交感神经以治疗血糖异常可在将一个或多个具有一个或多个刺激参数的治疗性调控信号递送到T2至T12椎体(例如T9和/或T10)的一个或多个之后实现。例如,刺激参数包括但不限于幅度,频率,脉冲宽度,工作周期,以及刺激是在患者的中线的左侧或其附近还是在患者的中线的右侧或其附近施加的。
在代表性系统和方法中,治疗性调控信号的幅度为患者感觉阈值的约20%至约90%,频率为约10kHz,脉冲宽度为约30微秒,但代表性系统和方法可以具有在本公开中特别是在标目3.0和4.0下公开的其中任意一个幅度,频率和/或脉冲宽度。如本文中别处所述,治疗性调控信号可在餐前,餐中,和/或餐后递送给患者,并且在代表性系统和方法中,治疗性调控信号的一个或多个刺激参数在餐前治疗性调控信号,餐中治疗性调控信号,和/或餐后治疗性调控信号之间可以不同。就本技术而言,餐中是指患者正在消耗卡路里的持续时间,依照代表性系统和方法,餐中时间段可以从大约30分钟到大约120分钟不等。
在代表性系统和方法中,一个或多个治疗性调控信号可被递送到C8-T12,T2-T12,T4-T10,或T4-T6范围内的一个或多个椎体水平的靶向位置处或附近。至少在T4-T6处,治疗性调控信号可抑制与支配患者胃,肝脏,胰腺,和/或肾上腺的交感神经相关联的患者腹腔神经节的至少一部分。通过将一个或多个可植入治疗性信号递送装置放置于T4至T6中的一个或多个处或附近来抑制与T4至T6中的一个或多个处或附近的靶向位置相关的患者的交感神经。抑制患者交感神经的一个或多个可以促进患者肝脏中的葡萄糖摄取和/或降低患者餐后血糖水平。
在代表性系统和方法中,一个或多个治疗性调控信号可被递送到T7至T12中的一个或多个处或附近的靶向位置。这些治疗性调控信号可抑制患者腹腔神经节和/或肠系膜上神经节的至少一部分,该部分与支配患者小肠和大肠以及患者胃,十二指肠,空肠,和回肠的交感神经有关。抑制患者的与T7至T12中的一个或多个相关联的交感神经可以通过将至少一个(例如,在一些情况下至少两个)可植入治疗性信号递送装置放置于T7至T12中的一个或多个处或其附近来实现。不受任何特定理论的约束,抑制患者交感神经的一个或多个可以增加患者肠的肠促胰岛素释放和/或患者胃的胃饥饿素释放。
在代表性系统和方法中,通过改变治疗性调控信号的工作周期,例如通过改变工作周期的开启周期部分和/或工作周期的关闭周期部分中的一个或多个,可以正常化患者感兴趣的胃肠道区域的慢波(例如节律电生理事件)。在代表性示例中:
(1)正常慢波频率约为每分钟3波,电信号的开启周期约为20秒,关闭周期约为20秒,以抑制支配患者胃的交感神经,
(2)正常慢波频率约为每分钟12波,电信号的开启周期约为5秒,关闭周期约为5秒,以抑制支配患者十二指肠的交感神经,
(3)正常慢波频率约为每分钟11波,电信号的开启周期约为5.5秒,关闭周期约为5.5秒,以抑制支配患者空肠的交感神经,
(4)正常慢波频率约为每分钟8波,电信号的开启周期约为7.5秒,关闭周期约为7.5秒,以抑制支配患者回肠的交感神经,以及
(5)正常慢波频率约为每分钟6波,电信号的开启周期约为10秒,关闭周期约为10秒,以抑制支配患者大肠的交感神经。
上述任意工作周期的功效可能经受几天或几个星期的总的“洗入”和/或“洗消”期,正如在频率范围为1.2kHz-100kHz的电信号的其他应用中所观察到的那样。
在代表性系统和方法中,治疗性信号持续或间歇性地递送给患者,例如在一天中的不同时间。当间歇地递送时,治疗性信号可被协调为餐前,餐中,和餐后。例如,治疗性信号可以在患者进餐中被递送,通过这样做,与未接收该治疗性信号的餐中患者相比,增加了患者肝脏对葡萄糖的摄取。餐中时间可以从约30分钟到约120分钟,一天之内可以不同或者大体上相同。在代表性系统和方法中,治疗性信号可以以幅度范围在患者感觉阈值的约20%至约90%之间,频率约为10kHz,和/或脉冲宽度约为30微秒的情况下被递送。
图7示出以下的预期的血糖水平:(1)患有T2D且未接收任何治疗性调控信号的患者,(2)患有T2D且正在接收本文所述的一个或多个治疗性调控信号(例如电刺激疗法)的患者,和(3)没有T2D的患者。如图7所示,每个患者的血糖水平在患者进餐时(例如,吃早餐,午餐,和/或晚餐)从餐前水平升高,而在患者餐后(例如,患者已停止进食后)下降。在代表性系统和方法中,间歇性地递送电刺激疗法来治疗患者的T2D,例如在餐前,餐周(例如在餐中时或附近),餐中,餐后,和睡眠期中的一个或多个期间间歇进行。不受任何特定理论的约束,将本文所述治疗性调控信号的一个或多个递送给T2D患者,与未接受该疗法的T2D患者相比,可以降低T2D患者的餐前,餐中,和餐后血糖水平。
在代表性系统和方法中,电信号在餐周阶段期间被递送,餐中阶段可以与非餐中阶段(例如,餐前,餐后,和/或睡眠期)期间所递送的疗法相同。例如,在餐周阶段和/或餐中阶段期间递送的电信号可以包括2至5个双极,例如3至4个双极,非餐中阶段期间递送的疗法可以包括一个或多个脉冲。不受任何特定理论的约束,同时在多个脊髓水平刺激多个双极,可以对糖尿病所涉及的多种器官(包括肝脏,胃,胰腺,肾上腺,和肠道)提供更广泛的交感神经抑制。此外,间歇性地递送脉冲可以促进患者消化系统内的运动,并保持电池电量。在代表性系统和方法中,睡眠阶段期间递送的电信号也可以与其他阶段期间递送的电信号不同。例如,某些电信号可以避免一些患者的某些现象效应,例如,索马吉(Somogyi)效应和黎明现象效应。这些效应可以涉及到约凌晨1:00至4:00之间(例如约凌晨2:00至约凌晨3:00左右)的低血糖或接近低血糖事件,一旦患者醒来(例如在早晨)会引发高血糖交感反应。在代表性系统和方法中,睡眠阶段期间递送的电信号包括约凌晨1:00至约凌晨4:00之间的关闭期间,以防止发生高血糖交感反应。
在代表性系统和方法中,治疗性调控信号通常可以在患者进餐时同步递送,并且在患者餐后持续一段时间。例如,当T2D患者开始进餐时,他/她可以接收到一个或多个治疗性调控信号,并且,所述一个或多个治疗性调控信号可在进餐阶段和/或延伸至餐后阶段持续或间歇地递送至T2D患者约30分钟至约120分钟。向患有T2D的患者递送本文所述的一个或多个治疗性调控信号可以将T2D患者的血糖水平维持在约75mg/dL和约200mg/dL之间,并且更具体地,在约100mg/dL和约175mg/dL之间。例如,一个或多个治疗性调控信号可使T2D患者的血糖水平在递送治疗性调控信号(例如,电疗法信号)之后降低至少约10%,至少约15%,至少约20%,至少约25%,至少约30%,至少约35%,至少约40%,至少约45%,或至少约50%。
在代表性系统和方法中,T2D患者的HbA1c水平也可以在递送或更多治疗性调控信号后发生改变。例如,T2D患者的HbA1c水平在递送电信号之后降低至少约1%,至少约1.5%,至少约2%,至少约2.5%,至少约3.5%,至少约3.5%,至少约4%,至少约4.5%,至少约5%,至少约6%,至少约7%,至少约8%,至少约9%,或至少约10%。
虽然本技术的代表性系统和方法可能会对正常的运动和/或感觉信号产生一些作用,但是这种作用低于患者能够确实地内在检测到的水平,例如,在没有借助仪器或其他装置的外部帮助的情况下。因此,患者的运动信号和其他感觉信号(与T2D相关的信号除外)的水平可以保持在治疗前的水平。例如,患者的T2D,HbA1c水平,和/或一个或多个相关症状的显著降低,在很大程度上与患者的动作和位置无关。特别是,患者可以采取多种姿势,消耗不同量的食物和液体,和/或进行与日常生活活动和/或其他活动相关的多种动作,而无需调节对患者应用疗法所依据的参数(例如,信号幅度)。这一结果可以大大简化患者的生活,减少患者在进行多种活动的同时进行T2D治疗(或相应症状的治疗)所需的努力。这一结果也可以为那些在睡眠期间经历T2D相关症状的患者提供一种改善的生活方式。
在代表性系统和方法中,患者可以从多个信号递送程序(例如,两个,三个,四个,五个,或六个)中选择以治疗患者的血糖异常,每个信号递送程序具有不同的幅度和/或其他信号递送参数。在代表性系统和方法中,患者可以在睡觉前激活一个程序,在醒来后激活另一个程序,或者患者可以在睡觉前激活一个程序,在醒来后激活第二个程序,以及在进行可以触发,增强,或加重患者的血糖异常的特定活动(如餐前,餐中,和/或餐后活动)之前激活第三个程序。在代表性系统和方法中,患者可以在患者餐前激活第四个程序,当患者在餐中时激活第五个程序,和/或在患者餐后激活第六个程序。在代表性系统和方法中,第四个程序和/或第六个程序可以是相同的,并且也可以与睡觉前和/或醒来后激活的程序大体上相同。这种减少的患者选择可以大大简化患者轻松处理血糖异常的能力,而不会减少(事实上,增加了)该疗法有效解决血糖异常的情况。在包含多个程序的代表性系统和方法中,通过自动检测患者情况的变化,并自动确定和提供适当的疗法方案,可以进一步减少患者的工作量。这些技术和相关系统的附加细节在通过引用并入本文的专利号为No.8,355,797的美国专利中公开。
在代表性系统和方法中,相对于患者激活一个或多个程序,本文所述的系统,装置,和方法自动检测一个或多个餐食事件的开始和/或结束。例如,本文所述的系统,装置,和方法可以通过间歇性或持续地监测患者的血糖水平来自动检测一个或多个餐食事件,并且如果检测到患者的血糖水平发生变化,则本文所述的系统,装置,和方法可以自动递送治疗性电信号。本文所述的代表性系统和方法可包括一个或多个传感器,其被配置成通过检测患者血液中的葡萄糖量来监测患者的血糖水平。
在代表性系统和方法中,电刺激可以按照预先确定的时间表或根据需要进行。可以持续施用一段预先确定的时间,也可以无限期地持续,直到达到特定的治疗性基准,例如直到得到可接受的一个或多个症状的减轻。在代表性系统和方法中,电刺激可每天一次或多次,每周一次或多次,每周一次,每月一次,或每数月一次。由于电刺激被认为可以随着时间的推移通过反复使用治疗性电信号来改善患者的血糖异常(例如,使患者的血糖水平正常化),因此患者可以需要较少频率的电信号疗法。在有代表性的系统和方法中,当患者的血糖异常复发或严重程度增加时,可以递送疗法。施用频率也可以在治疗过程中发生变化。例如,在治疗过程中,当达到某些治疗性基准时,患者可以接受较少频率施用。每次施用的持续时间(例如,受试者接受电刺激期间的实际时间)可以在整个治疗过程中保持不变,也可以根据患者健康,内部病理生理测量,或症状严重程度等因素而变化。在代表性系统和方法中,每次施用的持续时间可为1至4小时,4至12小时,12至24小时,1天至4天,或4天或更长时间。
如上所述,根据代表性系统和方法的治疗性调控信号可以具有在患者感觉阈值的约20%至约90%的幅度范围,在约10kHz的频率,和/或约30微秒的脉冲宽度,并可被应用于与感兴趣器官相关的特定椎体水平,例如胸椎椎体水平(例如,T2-T12),以抑制患者交感神经系统((例如,支配)或与患者的胃,肝脏,胰腺,一个或多个肾上腺,十二指肠,空肠,回肠,和大肠有关的(交感神经))的活动。先前通过引用并入本文的专利号为No.8,170,675的美国专利中描述了特定椎体水平和相关器官的进一步细节。在代表性系统和方法中,额外的模拟参数可应用于这些椎体水平的一个或多个,以治疗血糖异常,例如下文描述的那些。
在代表性系统和方法中,用于治疗患者的血糖异常的治疗性电刺激以至少一部分的疗法信号具有以下频率范围内的频率来实施:约1.2kHz至约100kHz之间;约1.5kHz至约100kHz之间;约1.5kHz至约50kHz之间;在约3kHz至约20kHz之间;在约3kHz至约15kHz之间;或在约5kHz至约15kHz之间;或频率为约5kHz,约6kHz,约7kHz,约8kHz,约9kHz,约10kHz,约11kHz,约12kHz,约10kHz,约25kHz,或约50kHz。
在代表性系统和方法中,用于治疗患者血糖异常的治疗性电刺激以至少一部分的疗法信号具有以下幅度范围内的幅度来实施:约0.1mA至约20mA;约0.5mA至约10mA;约0.5mA至约7mA;约0.5mA至约5mA;约0.5mA至约4mA;和/或约0.5mA至约2.5mA。
在代表性系统和方法中,用于治疗患者血糖异常的治疗性电刺激以至少一部分的疗法信号具有以下脉冲宽度范围内的脉冲宽度来实施:从约1微秒或以下至约416微秒,从约10微秒至约333微秒;从约10微秒至约166微秒;从约25微秒至约166微秒;从约25微秒至约100微秒;从约30微秒至约100微秒;从约33微秒至约100微秒;从约30微秒至约40微秒,和/或从约50微秒至约166微秒。
在代表性系统和方法中,用于治疗患者血糖异常的治疗性电刺激以至少一部分的疗法信号具有以下特性来实施:30微秒的阴极脉冲,接着是20微秒的相间延迟,接着是30微秒的阳极脉冲,然后是另一个20微秒的相间延迟。100微秒的总相位持续时间对应于10kHz的频率。总相位持续时间可在10-833微秒范围内,其对应于1200Hz-100kHz的频率。在代表性系统和方法中,相间延迟可能和20微秒不同,且范围可能从0到相间持续时间与阳极和阴极脉冲(对于两相波形)的组合脉冲宽度之间的最大差值。在代表性的系统和方法中,阴极和/或阳极脉冲可以相差自30微秒,并且可以在1微秒或以下到相间持续时间和相间延迟之间的最大差异(对于两相波形)。给定脉冲对的相对相位可以不是对称的(例如,可以具有不同的宽度和/或幅度),尽管在相反的极性上,但是大体上提供相同的电荷量,以在逐脉冲的基础上提供电荷平衡。
在获得有益结果的同时,向患者提供的疗法的各个方面可以会有所不同。例如,导线体(尤其是导线体电极或触点)的位置可以在整个和/或跨越上述一个或多个靶向位置而变化,例如在T2至T12处或附近的靶向位置,和/或其他器官,组织,和/或神经结构。施加的信号的其他特性也可以变化。在代表性系统和方法中,所施加信号的幅度可以缓升和/或缓降和/或可以增大幅度或将其设在初始水平以建立治疗性作用,然后降低到较低水平以节省电能而不放弃功效,如通过引用并入本文的美国专利公开号No.2009/0204173所公开的。信号幅度可以是指电流水平(例如对于电流控制系统)或者是指电压电平(例如对于电压控制系统)。为上述参数选择的特定值可以因患者到患者和/或指征到指征的不同和/或基于所选的电刺激位置而不同。此外,除了或替代上述参数,本技术可以使用其他参数来监视和/或控制患者疗法。例如,在脉冲产生器包括恒压布置而不是恒流布置的情况下,可以用相应的电压值代替上述电流值。
在代表性系统和方法中,脉冲产生器提供信号所依据的参数可以在疗法方案的部分期间进行调控。例如,频率,幅度,脉冲宽度和/或信号递送位置可根据预设程序,患者和/或医生输入,和/或以随机或伪随机方式进行调控。这种参数变化可用于解决许多潜在的临床情况,包括患者对与正在治疗的疾病相关的一个或多个症状的感知的变化,优选的靶向神经群的变化,和/或患者的适应或习惯化。
在代表性系统和方法中,从业者可以从患者获得反馈,以检测患者的血糖水平和/或治疗性调控信号对患者血糖异常的作用。可使用一个或多个传感元件(在本文中称为“传感元件”)持续地监测患者的血糖水平,以在向患者施加电刺激信号之前,期间和/或之后检测患者的神经信号,神经反应,和/或其他生理参数。在代表性系统和方法中,传感元件可由信号产生器101,信号递送元件110,和/或系统100的其他被植入的部件所携带,如先前参考图1A所述。同样的,传感元件可以被放置于电刺激正在被递送的靶向治疗部位附近的区域。在代表性系统和方法中,传感元件可与信号产生器101和/或信号递送元件104分开放置。例如,传感元件可被植入与电刺激被递送的区域分开的区域中,或以体外方式。当彼此分开时,传感元件和信号产生器101可通过有线链路或无线链路(例如,通过蓝牙链路)彼此耦接。
代表性传感元件可包括阻抗传感器,化学传感器,生物传感器,电化学传感器,血流动力学传感器,光学传感器和/或其他适合的可植入传感装置。在代表性系统和方法中,传感元件可以是袖带电极,并且可以被放置于神经(例如,迷走神经或内脏神经)周围或患者的靶向神经群附近。传感元件可检测来自神经或神经群的一个或多个神经信号和/或神经反应(例如,对应于动作电位的电信号),并且系统(例如,参考图1A的系统100)可以使用检测到的一个或多个神经信号和/或神经反应来确定患者在某个特定的时刻的血糖水平。可以足够频繁地检测神经反应,从而可以确定或至少估计与血糖水平相对应的数据的上升或下降趋势。特别是对于葡萄糖,所检测到的神经反应可与电信号相关,该电信号例如是在神经群的受体与胰高血糖素结合之后产生的。
检测到的一个或多个神经信号和/或反应可包括可测量的特性,并用于确定患者在特定时间点的血糖水平。特性可以包括,例如,信号强度(例如,信号的值是否高于预先确定的阈值),频率(例如,给定时间内激发的动作电位的数目),幅度和/或速度等其他可测量的特性。在代表性系统和方法中,可以以类似的方式使用来自一个或多个先前的神经信号或神经反应的特性的变化,和/或从先前的神经信号或神经反应特性变化的速率。与这些特征相关的测量可以用来确定特定时刻的血糖水平。在代表性系统和方法中,所确定的血糖水平可基于一个或多个神经反应特性与患者或类似位置患者的血糖水平之间的预定相关性来确定或估计。这种相关性可以通过例如控制患者的特定葡萄糖浓度和监测该浓度下患者的神经反应来建立。此过程可在多个浓度下重复,直到在一个浓度范围内建立了相关性。
与常规或传统检测方法/装置相比,本监测技术的代表性系统和方法的一个优点是,它们不依赖于随时间耗尽的消耗性材料。与需要在一次或多次使用后更换的常规装置不同,本技术的可植入传感元件可以基于电信号的特性(即,患者的神经反应)来确定患者的血糖水平,因此不需要移除和更换,或者至少不需要像基于常规技术的装置那样经常这样做。
与常规或传统检测方法/装置相比,本监测技术的代表性系统和方法的另一个优点是,本技术的准确性通常不会随时间而降低。这不同于包含物质的常规的装置,而且可以多次使用。当装置接近使用寿命时,这类装置可能会出现精度问题。
如本文所公开的,监测患者的血糖水平可以与给患者调控电疗法信号同时进行。另外,可以使用本文所述的方法持续(或周期性地)监测患者的血糖水平,并用于确定或调节信号递送参数,以改善调控的电疗法信号的作用。例如,从业者可以(a)持续观察/监测患者的血糖水平以确定基线水平,(b)通过可植入信号递送装置将电疗法信号(例如,频率从1.2kHz至100kHz的信号)引导到患者的神经群体,(c)在引导疗法信号之后监测患者的血糖水平以报告糖尿病反应(例如,血糖水平,所需胰岛素量等)和/或其他功能的变化,(d)如有必要,调节电疗法信号,以获得更想要的血糖水平。调节电疗法信号可以包括调节要应用到靶向位置的后续电信号的一个或多个信号递送参数(例如,频率,幅度,脉冲宽度,工作周期,和正常慢波频率)。步骤(a)-(d)可以迭代地执行,以改善或获得患者想要的结果。监测该系统的适合的方法和产品包括那些可以调节患者对电刺激疗法反应的方法和产品。例如,患者的反应可以包括对患者血清血糖水平的一个或多个测量,例如口服葡萄糖耐量试验,空腹血糖水平,和HbA1c百分比。
本技术的持续监测方法也可用于血糖监测和T2D以外的应用,例如,监测方法可用于基于患者的神经反应监测其他化学物质(例如,多巴胺,血清素等),以及治疗其他障碍性疾病(如,抑郁症,帕金森病等)。此外,本技术的监测方法可作为诊断工具,对疾病进行抢先的监测。例如,可植入传感装置可在任何特定疾病(例如,T2D)发生之前被植入,并且来自该传感装置的数据可用于确定可用于建议疾病发生的趋势。来自传感装置的数据可以被无线传输(例如,到服务器),这样从业者可以远程监测数据并确定趋势。
图8是示出了根据本技术的代表性系统和方法的用于根据来自患者的反馈递送疗法的过程800的框图。该方法可用于本文所述的任何信号递送模式(例如,通过一个或多于一个的信号装置递送的信号,递送到一个或多于一个的靶向神经群的信号)。框802包括建立信号递送参数,包括信号递送时间表。例如,框802可包括建立持续的疗法方案,其中患者每周7天每天24小时接收疗法信号。在其它代表性系统和方法中,疗法信号可根据工作周期来递送。在进一步代表性系统和方法中,疗法信号可以根据与患者饮食行为相关的时间表来递送。例如,患者可以在饭前和饭后以及进食中接受疗法一个小时。患者可以手动激活疗法,或者,例如,如果患者有或多或少的固定时间表,则可以通过计时器自动激活疗法,以便在饭前,进食中和饭后进行递送。根据患者的不同,可以调节上述时间段(例如,调整为之前1小时和/或之后1小时以外的时间段),和/或可以消除其中的一个或两个时间段。
额外的信号递送参数包括信号频率,幅度,脉冲宽度,和其他波形参数,例如脉冲间间隔或相间间隔。信号递送参数还可以包括在任意特定时间在多个可能的电极或触点中的哪些电极或触点被激活。
在框804,根据信号递送时间表和上述其他参数递送疗法。在框806中,检测疗法对患者的作用。例如,框806可以包括在特定时间点检测血清血糖水平。在其他代表性系统和方法中,检测疗法作用可以包括获得更长期的测量。例如,A1C测量通常是较长时间(例如,3到4个月)内A1C蛋白水平的平均值。在代表性应用中,5%的A1C水平被认为是正常的,高于6%的水平会触发评估,如下所述。代表性系统和方法可以包括检测或测量除了或替代血糖的其他参数,例如胰岛素水平和/或血压。
在上述任意示例中,所测量的作用随后可以用来确定:是否继续疗法(框807)和是否可以改善疗法(框808)。如果要停止疗法(例如,如果所测量的作用包括不安全或其他不想要的作用),则在框809停止疗法。如果不是,则如果疗法可以被改善(例如,被优化),则框810包括建立疗法的更新,并且过程返回到框804以根据更新后的参数继续递送疗法。如果在框808,确定疗法是被优化的(或者不被变化),则过程返回到框804,而不建立在框810建立的更新。
上述过程800可以以自动的方式进行,或者由“圈中人”进行。例如,从业者可以在框808确定疗法是否可以被改善,并且如果疗法可以被改善,则可以在框810建立更新。在其他代表性方法中,这个过程可以更加自动化。例如,患者可以使用恒定血糖监测仪,该检测仪持续监测患者血糖水平并将测量结果与内部或外部处理器(例如,被植入的脉冲产生器,基于电话的应用程序或其他外部装置)通信。当将结果递送到外部处理器时,系统可以使用蓝牙或其他适合的无线通信协议。在这些代表性系统和方法中的任意一个中,系统可以在框808自动地确定是否改变信号参数,并且可以在框810自动建立被建议的更新。更新可以基于特定患者的历史数据和/或具有相同或类似指征的较大患者群的历史数据。
至少在一些代表性系统和方法中,信号的频率可以确定信号对患者生理的作用。例如,一些频率可能影响患者胰岛素的生成,而其他频率可能影响患者葡萄糖的储存。一般来说,高频信号(例如,高于约1200Hz)可具有抑制作用,而低频信号可能具有兴奋作用。这种作用可以限制于信号被引导到的特定神经群。因此,如果神经细胞群是抑制性的(例如,抑制性中间神经元),对抑制性神经细胞群的兴奋作用可以对患者产生整体的抑制性生理作用。
通过选择和操纵本文所述的参数,本公开的技术可以影响胰岛素水平和患者的葡萄糖储存率。通过控制这两个变量,这些技术可以更精确地控制患者的血糖水平,从而更精确地控制患者的T2D。这种方法比现有的解决T2D的技术具有显著的优势。例如,目前的技术包括施用胰岛素来降低血糖水平。虽然这种方法对降低血糖水平有很大的益处,但长期来看,它实际上可能会恶化患者的病情。
本申请的受让人对患有疼痛性糖尿病神经病变(PDN)的患者进行了临床研究。研究的主要目的是获得关于电刺激治疗解决PDN患者经受疼痛的能力的数据。然而,该研究的初步结果似乎表明,除了解决PDN外,电刺激疗法对解决T2D也可以是有效的。更具体地说,在三个月的治疗过程中,根据上述参数接受电刺激疗法的20%的患者报告了A1C水平显著降低(例如降低15%-23%)。在研究过程中没有接受电刺激的患者并没有表现出A1C降低。患者接收到10kHz的信号,具有30微秒的阳极/阴极两相脉冲。疗法是从放置于T9-T10椎体水平的电极递送的。
这些初步结果表明,通过具有本文所公开的频率范围的电刺激可实现A1C降低,并且更具体地针对A1C减少(而不是疼痛减轻)来调整疗法递送参数可以进一步改善结果。例如,上述临床研究中的疗法通过大致T9-T10椎体水平的电极来递送,以解决患者的疼痛,而针对这些位置的疗法降低了A1C水平,在更多的头侧椎体水平上(例如,T4-T6)可以实现进一步的降低,为T2D患者提供更好的结果。
更普遍地,电刺激可直接施加到T2-T12区域,器官,和/或另一靶向组织,或可以邻近地施加在T2-T12区域,器官,和/或另一靶向组织(即,足够接近T2-T12区域的神经元,器官,和/或另一靶向组织以接收电信号)。例如,电刺激可被施加在T2-T12区域中的靶向位置处或其附近。作为另一示例,电刺激可被施加到其它神经组织,例如对应于T2-T12区域的周围神经(例如,交感神经)。例如,电刺激可被施加到迷走神经,如迷走神经的肝脏分支。在肝脏分支上的刺激可以增加糖原合酶的活性,糖原合酶是一种涉及葡萄糖代谢的酶,例如将葡萄糖转化为糖原。
对于一些状况,电刺激可被施加到单个靶向组织或器官。对于其他状况,电刺激可被施加到T2-T12区域,多个器官,和/或多个其他靶向组织。例如,当患者状况为血糖异常时,刺激可被施加于T9和/或T10区域,对应于T9和/或T10的神经和/或靶向组织,对应于T9和/或T10的器官,或其组合。根据本技术,可以配置电刺激参数,以使患者不会出现感觉异常。
治疗性调控信号可根据多种机制中的任意作用于靶向器官或器官。例如,治疗性调控信号可以对神经元网络产生作用,而不是对特定神经元产生作用。这种网络作用反过来又可以减少和/或抑制上述交感神经系统的一种或多种作用。上述行为机制可以对其他系统产生级联作用。例如,抑制交感神经系统的作用可以是间接的。由于这种间接作用,对器官的最终作用可以不是瞬间发生的,而是可以需要时间(例如,几天)来建立,以响应在类似时间段(例如,几天)施加给患者的调控信号。
用于向T2-T12区域,器官,和/或另一靶向组织施用电信号的多种适合的装置在上文标目3.0下进行了更详细的描述,并且也可以在通过引用并入本文的参考文献中进行描述。用于施用可治疗T2D,降低HbA1c水平,和/或治疗疼痛的电信号的装置的示例在专利号为No.8,694,108和No.8,355,797的美国专利中公开,这两个专利都通过引用整体并入本文,并作为附录H和D附上。例如,可以使用适合的装置和专门编程的编程模块进行施加电刺激以执行本文所述的任一方法。例如,该装置可以包括导线,其中导线又包括电极。在代表性方法中,施用电刺激包括放置步骤(例如,放置导线以使电极接近骶骨区域,器官,和/或另一靶向组织)和刺激步骤(例如,向电极发送电信号)。在代表性系统和方法中,用于向脊髓施加电信号的装置可在经过或不经修改的情况下改变其用途,以将电信号施用到另一靶向组织或器官,例如,在T2-T12区域,皮质,次皮质,皮质内,或外围的靶。例如,其他靶向组织或器官包括下丘脑,脑干,边缘系统,大脑皮层,迷走神经,和其他直接末端器官。因此,本文所述的系统,子系统,和/或子组件中的任何一个用作执行本文所描述的任一方法的装置。
上述许多代表性系统和方法在治疗血糖异常的情境下进行了描述,其具有被施加到T2-T12椎体水平(例如T9和/或T10)的调控信号。T2D代表一个示例指征,可通过在这个位置施加调控来进行治疗。在代表性系统和方法中,具有与上述参数大致类似的参数(例如,频率,脉冲宽度,幅度,和/或工作周期)的调控信号可施加到其他患者位置,以针对其他指征。
除了制造和使用所公开的装置和系统的方法外,本文所公开的方法还包括和包含指示他人制造和使用所公开的装置和系统的方法。例如,一种代表性方法包括通过将电信号施加到患者的T2-T12区域来治疗患者的血糖异常,该电信号具有在整个本申请中公开的参数,例如,在约1.2kHz到约100kHz的范围内的频率,在1微秒或更小至416微秒的脉冲宽度范围内的脉冲宽度,在0.1mA至20mA的幅度范围内的幅度。工作周期(当小于100%时)可以在5%到75%之间,例如60%-75%,40%-60%(例如50%),25%-50%,或10%-20%。
一种代表性方法包括对装置编程(或指示装置编程),以根据上述任意参数递送电刺激疗法。因此,本文所公开的任意和所有使用和制造方法也充分公开和使能指示这种使用和制造方法的相应的方法。
根据上述内容,将理解,为了说明的目的,本文描述了本技术的代表性系统和方法,但是可以在不偏离本技术的情况下进行多种修改。如上所述,当在T9和/或T10处施加刺激时,具有上述特性的信号可以为T2D患者提供治疗性益处。在其他靶向位置,电信号可具有更显著和/或靶向作用,例如,当电信号被引导到与特定器官相关联的特定神经元或神经群时,这些特定器官被约T2到约T12椎体水平出来的神经所削弱,如上所述。在代表性系统和方法中,除了T2D和/或T2D之外,本技术可用于解决一个或多个疼痛指征,例如通过引用并入的参考文献中描述的那些。
除了治疗血糖异常外,上述方法,系统,和装置还可用于为经历疼痛和/血糖异常以外的疾病或状况(例如恶心,运动,和/或霍纳(Horner)综合征等)的患者递送许多适合的疗法,例如基于感觉异常的疗法和/或无感觉异常的疗法。此类疗法和相关方法,系统,和装置的示例在美国专利公开号No.2009/0204173和No.2010/0274314中进行了描述,其各自的公开通过引用整体并入本文中,并作为附录G和I附上。
在特定代表性系统和方法的情境下描述的本技术的某些方面可以在其他代表性系统和方法中组合或消除。例如,上述的许多具有代表性的系统和方法是指使用两个或多个导线来递送电疗法信号。在代表性系统和方法中,本文所述的电疗法信号可以用一根导线或一根以上导线递送,并且包括本文所述的导线和并入本文的参考文献中所述的那些。此外,虽然已经在代表性系统和方法的上下文中描述了与本技术的代表性系统和方法相关联的优点,但是其他系统和方法也可以展现出这种优点,且并非所有系统和方法都必需向本技术范围内的所有系统和方法展示这种优点。因此,本公开和相关技术可以包括本文未明确示出或描述的其他实施例。
如果通过引用并入本文中的任何内容与本公开相冲突,则以本公开为准。
5.0
提供以下示例是为了进一步说明本技术的代表性系统和方法,不应被解释为限制本技术的范围。就提及的某些代表性系统和方法或其特征来说,它仅仅是为了说明的目的,并且除非另有规定,并不意欲限制本技术。本领域技术人员可以在不行使创造性能力和不偏离本技术范围的情况下开发出等同的装置。应当理解,在仍然保持在本技术的范围内的同时,可以对本文所述的过程进行许多变化。这些变化意在包括在本公开技术的范围内。同样的,在以下条款中描述本公开技术的代表性系统和方法。
1.一种用于治疗具有血糖异常的患者的方法,包括:
至少部分地基于患者血糖异常的指征,将可植入信号递送装置放置于患者脊髓处在约C8到约T12的椎体范围内的靶向位置附近;以及
通过所述可植入信号递送装置将电信号引导至所述靶向位置,其中所述电信号的频率范围为1.2kHz至100kHz。
2.根据条款1所述的方法,其中所述血糖异常包括2型糖尿病(T2D)和/或代谢综合征。
3.根据上述任一项条款所述的方法,其中靶向位置沿着患者脊髓的纵向中线。
4.根据上述任一项条款所述的方法,其中所述至少一个可植入信号递送装置是桨叶式导线。
5.根据上述任一项条款所述的方法,其中所述电信号的频率约为10kHz。
6.根据条款5所述的方法,其中所述电信号的脉冲宽度约为30微秒。
7.根据条款6所述的方法,其中所述电信号的幅度为患者感觉阈值的约20%到患者感觉阈值的约90%。
8.根据条款7所述的方法,其中所述靶向位置是从T4到T6。
9.根据条款8所述的方法,其中所述电信号抑制与器官相关联的患者交感神经的一个或多个,该器官选自患者的胃,肝脏,胰腺,和一个或多个肾上腺。
10.根据条款9所述的方法,其中所述一个或多个交感神经通过患者的腹腔神经节提供。
11.根据条款7所述的方法,其中所述靶向位置是从T7至T12。
12.根据条款11所述的方法,其中所述电信号抑制与器官相关联的患者交感神经的一个或多个,该器官选自患者的胃,十二指肠,空肠,回肠,和大肠。
13.根据条款12所述的方法,其中一个或多个交感神经通过患者的腹腔神经节和/或肠系膜上神经节提供。
14.根据条款12所述的方法,其中所述电信号还包括具有开启周期和关闭周期的工作周期。
15.根据条款14所述的方法,其中所述器官是患者的胃,其中所述开启周期约为20秒,所述关闭周期约为20秒。
16.根据条款14所述的方法,其中所述器官是患者的十二指肠,其中所述开启周期约为5秒,所述关闭周期约为5秒。
17.根据条款14所述的方法,其中所述器官是患者的空肠,其中所述开启周期约为5.5秒,所述关闭周期约为5.5秒。
18.根据条款14所述的方法,其中所述器官是患者的回肠,其中所述开启周期约为7.5秒,所述关闭周期约为7.5秒。
19.根据条款14所述的方法,其中所述器官是患者的大肠,其中所述开启周期约为10秒,所述关闭周期约为10秒。
20.根据上述任一项条款所述的方法,其中,当患者在餐中时,电信号被递送到所述靶向位置。
21.根据条款20所述的方法,其中所述电信号在约30分钟及约120分钟的期间内递送一段时间。
22.根据上述任一项条款所述的方法,其中所述患者的血糖水平在电信号递送后降低至少约10%,至少约15%,至少约20%,至少约25%,至少约30%,至少约35%,至少约40%,至少约45%,或至少约50%。
23.根据上述任一项条款所述的方法,其中引导所述电信号降低患者的HbA1c水平。
24.根据条款23所述的方法,其中所述患者的HbA1c水平在所述电信号递送之后降低至少约1%,至少约1.5%,至少约2%,至少约2.5%,至少约3%,至少约3.5%,至少约4%,至少约4.5%,至少约5%,至少约6%,至少约7%,至少约8%,至少约9%,或至少约10%。
25.根据上述任一项条款所述的方法,其中,引导所述电信号包括将所述电信号引导到患者脊髓的第X板层。
26.根据条款25所述的方法,其中通过在患者背部正中沟处的患者脑脊液的传导或通过第I-IX板层中的一个或多个将所述电信号引导至患者脊髓的第X板层。
27.根据上述任一项条款所述的方法,其中所述电信号抑制患者交感神经的一个或多个,以促进患者肝脏中的葡萄糖摄取和/或降低患者餐后血糖水平。
28.根据上述任一项条款所述的方法,还包括:
通过测量患者的血糖水平来监测患者的血糖异常;以及
响应于从监测患者血糖异常所获得的结果,至少执行以下过程之一:
(a)调节至少一个信号递送参数,根据该参数,所述电信号被引导到所述靶向位置,其中所述信号递送参数是频率,幅度,脉冲宽度,或工作周期中的至少一个,
(b)在不调节至少一个信号递送参数的情况下继续发送所述电信号,
(c)终止所述电信号的递送。
29.一种治疗患者的方法,包括:
至少部分基于患者T2D的指征,将可植入信号递送装置放置于患者脊髓处在约C8到约T12的椎体范围内的靶向位置附近;以及
通过具有多个触点的可植入信号递送装置将电信号引导至靶向位置,其中所述电信号具有10kHz的频率,30微秒的脉冲宽度,以及从约20%的患者感觉阈值到约90%的患者感觉阈值的幅度。
30.根据条款29所述的方法,其中所述靶向位置沿着患者脊髓的纵向中线。
31.根据条款30所述的方法,其中所述可植入信号递送装置被放置成跨越在所述患者的脊髓中线的第一侧上所述患者的组织的第一部分和在所述患者的脊髓中线的第二侧上所述患者的组织的第二部分。
32.根据条款31所述的方法,其中所述植入信号递送装置的至少一个触点放置于所述第一部分附近,并且至少一个触点放置于所述第二部分附近。
33.根据条款29所述的方法,其中所述靶向位置是从T4到T6。
34.根据条款33所述的方法,其中所述电信号抑制与器官相关联的一个或多个交感神经,该器官选自患者的胃,肝脏,胰腺,和一个或多个肾上腺。
35.根据条款34所述的方法,其中一个或多个交感神通过患者的腹腔神经节提供。
36.根据条款29所述的方法,其中所述靶向位置是从T7到T12。
37.根据条款36所述的方法,其中所述电信号抑制与器官相关联的交感神经的一个或多个,该器官选自患者的胃,十二指肠,空肠,回肠,和大肠。
38.根据条款37所述的方法,其中所述一个或多个交感神经通过患者的腹腔神经节和/或肠系膜上神经节提供。
39.根据条款37所述的方法,其中所述电信号具有工作周期,该工作周期具有开启周期和关闭周期。
40.根据条款39所述的方法,其中所述器官是患者的胃,其中所述开启周期约为20秒,所述关闭周期约为20秒,例如,以靶向支配患者的胃的交感神经。
41.根据条款39所述的方法,其中所述器官是患者的十二指肠,其中所述开启周期约为5秒,所述关闭周期约为5秒,例如,以靶向支配患者的十二指肠的交感神经。
42.根据条款39所述的方法,其中所述器官是患者的空肠,其中所述开启周期约为5.5秒,所述关闭周期约为5.5秒,例如,以靶向支配患者的空肠的交感神经。
43.根据条款39所述的方法,其中所述器官是患者的回肠,其中所述开启周期约为7.5秒,所述关闭周期约为7.5秒,例如,以靶向支配患者的回肠的交感神经。
44.根据条款39所述的方法,其中所述器官是患者的大肠,其中所述开启周期约为10秒,所述关闭周期约为10秒,例如,以靶向支配患者的大肠的交感神经。
45.根据条款30所述的方法,其中所述电信号通过患者脊髓中线两侧的触点同时被递送到所述靶向位置。
46.根据条款29-45中任一项所述的方法,其中当患者在餐中时,所述电信号被递送到所述靶向位置。
47.根据条款46所述的方法,其中所述电信号被递送达约30分钟到约120分钟。
48.根据条款29-47中任一项所述的方法,其中所述患者的血糖水平在所述电信号递送后降低至少约10%,至少约15%,至少约20%,至少约25%,至少约30%,至少约35%,至少约40%,至少约45%,或至少约50%。
49.根据条款29-48中任一项所述的方法,其中引导所述电信号降低患者的HbA1c水平。
50.根据条款49所述的方法,其中所述患者的HbA1c水平在所述电信号递送之后降低至少约1%,至少约1.5%,至少约2%,至少约2.5%,至少约3%,至少约3.5%,至少约4%,至少约4.5%,至少约5%,至少约6%,至少约7%,至少约8%,至少约9%,或至少约10%。
51.根据条款29-50中任一项所述的方法,其中引导所述电信号包括将所述电信号引导到患者脊髓的第X板层。
52.根据条款51所述的方法,其中通过在患者背部正中沟处的患者脑脊液的传导或通过第I-IX板层中的一个或多个将所述电信号传导至患者脊髓的第X板层。
53.根据条款29-52中任一项所述的方法,其中所述电信号抑制患者的一个或多个交感神经,以促进患者肝脏中的葡萄糖摄取和/或降低患者餐后血糖水平。
54.根据条款29-53中任一项所述的方法,还包括:
通过测量患者的血糖水平来监测患者的T2D;以及
响应于从监测患者的T2D所获得的结果,调节至少一个信号递送参数,根据该参数,所述电信号被施加到所述靶向位置,其中所述信号递送参数选自频率,幅度,脉冲宽度,和工作周期。
55.一种治疗患者的方法,包括:
至少部分基于患者T2D的指征,将至少一个可植入信号递送装置放置于患者脊髓处在约C8到约T12的椎体范围内的靶向位置附近;
通过所述至少一个可植入信号递送装置将电信号引导至所述靶向位置以修改患者的(a)血糖水平或(b)胰岛素水平,或(c)(a)和(b)两者,其中所述电信号的频率范围为1.2kHz至100kHz。
56.根据条款55所述的方法,其中所述至少一个可植入信号递送装置包括第一组触点和第二组触点。
57.根据条款56所述的方法,其中所述第一组触点放置于患者脊髓中线的第一侧,所述第二组触点放置于患者脊髓中线的第二侧。
58.根据条款57所述的方法,其中所述至少一个可植入信号递送装置为桨叶式导线。
59.根据条款58所述的方法,其中所述第一组触点放置于所述桨叶式导线的第一侧,所述第二组触点放置于所述桨叶式导线的第二侧。
60.一种治疗患者的方法,包括:
至少部分地基于患者T2D的指征,将至少一个第一触点放置于患者脊髓处在约T2到约T12的椎体范围内的第一靶向位置附近,并且将至少一个第二触点放置于患者脊髓处在约T2到约T12的椎体范围内的第二靶向位置附近;以及
通过所述至少一个第一触点将第一电信号引导到所述第一靶向位置,并且通过所述至少一个第二触点将第二电信号引导到所述第二靶向位置,其中所述第一电信号和第二电信号各自具有从1.2kHz至100kHz的频率范围内的频率。
61.根据条款60所述的方法,其中所述至少一个第一触点由第一可植入信号递送装置承载,并且其中所述至少一个第二触点由第二可植入信号递送装置承载。
62.根据条款60-61中任一项所述的方法,其中所述至少一个第一触点和所述至少一个第二触点由单个可植入信号递送装置承载,并且其中所述单个信号递送装置包括桨叶。
63.根据条款60-62中任一项所述的方法,其中所述至少一个第一触点放置于患者脊髓中线的第一侧,所述至少一个第二触点放置于患者脊髓中线的第二侧。
64.根据条款63所述的方法,其中所述至少一个第一触点包括沿着所述中线的第一侧纵向放置的多个第一触点,并且其中所述至少一个第二触点包括沿着所述中线的第二侧纵向放置的多个第二触点。
65.根据条款60-64中任一项所述的方法,其中所述第一靶向位置放置于第一胸椎附近,并且所述第二靶向位置放置于与所述第一胸椎不同的第二胸椎附近。
66.一种治疗血糖异常患者的系统,包括:
可植入患者脊髓区域的硬膜外腔的信号递送装置;
电耦接到所述信号递送装置的脉冲产生器;
患者传感器;以及
机器可读介质,可操作地耦接到所述患者传感器和所述脉冲产生器,所述机器可读介质具有机器可读指令,当该指令被执行时:
从所述患者传感器接收与患者血糖水平或患者胰岛素水平中的至少一个的指征相对应的输入;以及
响应于该输入,改变至少一个参数,所述脉冲产生器根据该参数将电信号引导到可植入信号递送装置,其中所述电信号的频率范围为1.2kHz至100kHz。
67.根据条款66所述的系统,其中所述患者传感器是胰岛素传感器。
68.根据条款66所述的系统,其中所述患者传感器是血糖传感器。
69.根据条款66所述的系统,其中所述患者传感器为HbA1C传感器。
70.根据条款66-69中任一项所述的系统,其中所述电信号具有工作周期,该工作周期具有开启周期和关闭周期,其中所述开启周期和所述关闭周期与患者的正常慢波频率相关。
71.根据条款70所述的系统,其中所述开启周期约为20秒,所述关闭周期约为20秒,所述正常慢波频率约为每分钟3波,例如,以靶向支配患者的胃的交感神经。
72.根据条款70所述的系统,其中所述开启周期约为5秒,所述关闭周期约为5秒,所述正常慢波频率约为每分钟12波,例如,以靶向支配患者的十二指肠的交感神经。
73.根据条款70所述的系统,其中所述开启周期约为5.5秒,所述关闭周期约为5.5秒,所述正常慢波频率约为每分钟11波,例如,以靶向支配患者的空肠的交感神经。
74.根据条款70所述的系统,其中所述开启周期约为7.5秒,所述关闭周期约为7.5秒,所述正常慢波频率约为每分钟8波,例如,以靶向支配患者的回肠的交感神经。
75.根据条款70所述的系统,其中所述开启周期约为10秒,所述关闭周期约为10秒,所述正常慢波频率约为每分钟6波,例如,以靶向支配患者的大肠的交感神经。
76.根据条款66-75中任一项所述的系统,其中当患者在餐中时,所述电信号被递送到所述靶向位置。
77.根据条款66-76中任一项所述的系统,其中所述至少一个参数包括频率,幅度,脉冲宽度,或工作周期中的至少一个。
78.根据条款66-77中任一项所述的系统,其中所述机器可读指令在执行时响应于所述输入终止所述电信号的递送。
79.根据条款66-78中任一项所述的系统,其中所述电信号的幅度范围为0.1mA至20mA。
80.根据条款66-78中任一项所述的系统,其中所述电信号的幅度范围为0.5mA至10mA。
81.一种用于治疗2型糖尿病(T2D)的频率范围为1.2kHz至100kHz的电信号,其中所述电信号由脉冲产生器产生并被引导至可植入信号递送装置。
82.根据条款81所述的电信号,其中所述频率范围为2kHz至50kHz。
83.根据条款81所述的电信号,其中所述频率范围为3kHz至20kHz。
84.根据条款81所述的电信号,其中所述频率范围为3kHz至10kHz。
85.根据条款81所述的电信号,其中所述频率为10kHz。
86.根据条款81-85中任一项所述的电信号,其中所述信号的脉冲宽度范围为1微秒至416微秒。
87.根据条款81-85中任一项所述的电信号,其中所述信号的脉冲宽度为5微秒或更小。
88.根据条款81-85中任一项所述的电信号,其中所述信号的脉冲宽度为30微秒。
89.根据条款81-88中任一项所述的电信号,其中所述信号的幅度范围为0.1mA至20mA。
90.根据条款81-88中任一项所述的电信号,其中所述信号的幅度范围为0.5mA至10mA。
91.根据条款81-88中任一项所述的电信号,其中所述信号的幅度范围为0.5mA至5mA。
92.根据条款81-91中任一项所述的电信号,其中所述可植入信号递送装置承载有触点,所述触点被放置成将所述电信号引导到患者脊髓处的靶向位置。
93.根据条款81所述的电信号,其中所述频率范围为1.2kHz至100kHz,其中所述电信号的脉冲宽度范围为1微秒至416微秒,幅度范围为0.5mA至15mA。
94.根据条款81所述的电信号,其中所述频率范围为1.2kHz至50kHz,其中所述电信号的脉冲宽度范围为10微秒至416微秒,幅度范围为0.5mA至10mA。
95.根据条款81所述的电信号,其中所述频率范围为1.2kHz至25kHz,其中所述电信号的脉冲宽度为20微秒至416微秒,幅度范围为0.5mA至7.5mA。
96.根据条款81所述的电信号,其中所述频率范围为5kHz至25kHz,其中所述电信号的脉冲宽度范围为20微秒至100微秒,幅度范围为1mA至7.5mA。
97.根据条款81所述的电信号,其中所述频率为10kHz,并且其中所述电信号的脉冲宽度为30微秒,幅度范围为0.5mA至5mA。
98.一种治疗患有血糖异常的患者的方法,包括:
将至少一个可植入信号递送装置放置于患者的脊髓处在约C8至约T12的椎体水平范围内的靶向位置附近;以及
通过可植入信号递送装置将电信号引导至所述靶向位置,其中所述电信号的频率范围为1.2kHz至100kHz。
- 治疗血糖异常(包括2型糖尿病)和/或降低HBA1C水平的治疗性调控以及相关系统和方法
- 降低系统性调节性T细胞水平或活性来治疗CNS疾病和损伤
