一种培育黑猪新品种的毛色性状快速精准固定方法及应用
文献发布时间:2023-06-19 09:32:16
技术领域
本发明涉及动物数量遗传学与分子生物学技术领域,尤其涉及一种培育黑猪新品种的毛色性状快速精准固定方法及应用。
背景技术
当今猪新品种的培育主要利用杂交优势来融合各品种猪的优良特性,实现多性状的平衡选择。我国猪新品种的培育保留我国地方品种猪母性强、发情明显、繁殖力高、肉质好、适应及抗逆性强等优点,改进其增重慢、体型结构不良、屠宰率低、瘦肉率低等缺点,综合了不同品种的优点,改善了生长发育、胴体和猪肉的品质。在新品种的培育中,培育出的品种要求遗传背景相同、性状及适应性相似,且遗传稳定,具有一定的种用价值,并有一定的结构和足够的数量。
利用杂交育种理论培育新品种的技术路线主要包括三个阶段:第一阶段是杂交创新,即根据育种目标,选择所要使用的杂交品种,并通过杂交结合各品种的优良特征,同时进行适当的培育,获得符合育种目标的理想型杂交基础群。第二阶段是自繁定型阶段,是对已达到理想型标准的个体停止杂交,转入自群繁育,从血统上封闭畜群。第三阶段是扩群提高阶段,主要是大量繁殖已固定的理想型个体,迅速增加数量,建立新品种(系),完成一个品种应该具备的条件,使之成为合格的新品种。
在新品种培育的杂交F2代往往会出现性状分离,且这一情况是不可避免的。对猪而言,其中最明显的性状分离是毛色性状的分离。但因为毛色遗传可能由多基因同时控制,会导致不同品种猪杂交后代的毛色分离情况各有不同。其中最理想的毛色分离是遵循孟德尔一对性状的分离规律,即在子一代全为杂合子,表现为显性;子二代出现毛色分离,且显性和隐性的分离比接近3:1;之后随着后代不断闭锁繁育,毛色逐渐固定,最后达到稳定遗传,形成一个毛色性状一致的种群。但由于毛色基因遗传的多样性和复杂性,后代仔猪毛色分离类型和比例会有所不同。故在进行毛色选育的时候要弄清其遗传规律,这样才能更快速高效地将其固定下来。
猪只毛色的稳定代表着遗传的稳定,是新品种培育的重要育种目标之一。而且,猪只毛色作为遗传标志,在品种识别等各方面有着重要意义。在生猪市场对高品质猪肉的需求逐渐增加的社会背景下,毛色作为品种鉴别的标志,其稳定遗传能给高品质黑猪养殖行业带来巨大的经济效益。
现有最普遍的猪只黑毛性状固定方法是通过表型逐代选育,在杂交后代中选留全黑个体,剔除如花猪等分离个体,一代一代选育,直至黑毛性状基本稳定遗传,降低出现黑白花猪比例来实现的。然而,这种传统的育种方法耗时长,且不能完全纯合黑毛性状个体。
发明内容
有鉴于此,本发明的目的在于提出一种黑猪新品种的毛色固定方法及快速培育方法,以解决现有的毛色固定及育种存在的时效长且纯度低的问题。
基于上述目的,本发明提供了一种黑猪新品种的毛色固定方法,包括:对培育黑猪品种的父本、母本、F1代和F2代毛色表型进行毛色表型统计;根据毛色表型的统计结果,确定F2代的毛色分离规律为孟德尔一对性状的分离规律,筛选MC1R基因为控制猪黑毛性状的预设主效基因;采集黑猪品种父本、母本、F1代和F2代毛囊并提取基因组DNA;采用PCR扩增基因组中的MC1R基因,并进行回收和纯化处理,得到纯化PCR产物;对纯化PCR产物进行测序,得到MC1R基因的SNP突变位点,并进行基因分型。分析基因分型中黑白花猪的基因型,确定黑猪的毛色遗传为单基因控制的显性遗传;选用F2中的黑色纯合子基因型的黑猪进行配种,使黑猪新品种的毛色在F3代得以固定。
在其中一个实施例中,所述基因分型包括成华母猪和F2代纯合E
所述E
所述E
所述黑白花色基因型为E
在其中一个实施例中,扩增基因组中的MC1R基因的引物对包括第一引物对和第二引物对,其中,所述第一引物对和所述第二引物对的预期产物长度以及第一引物对和第二引物对所针对的MC1R基因区域均不相同。
在其中一个实施例中,所述第一引物对的预期产物长度为884bp,上游引物在5’端,下游引物在外显子区域;所述第二引物对的预期产物长度为903bp,上游引物在外显子区域,下游引物在3’端。
在其中一个实施例中,第一引物对包括第一上游引物MC1RF1:GCTGAGCACAGGCGAGGTT,其为SEQ ID NO.3所示;以及第一下游引物MC1RR1:GGAAGCAGAGGCTGGACACC,其为SEQ ID NO.4所示;
第二引物对包括第二上游引物MC1RF2:CATCGCCAAGAACCGCAACC,其为SEQ ID NO.5所示;第二下游引物MC1RR2:GGTCCAGCGTCCATACCTTCA,其为SEQ ID NO.6所示。
在其中一个实施例中,所述黑猪为嘉林黑猪,所述嘉林黑猪为巴克夏公猪与成华母猪杂交的F1代和F2代。
在其中一个实施例中,所述PCR扩增体系为22μl 2×TsingKE Master Mix、1μlcDNA、μl上游引物以及1μl下游引物;反应条件为98℃预变性2min、98℃变性10sec、61℃退火10sec、72℃退火10sec以及72℃延伸5min,其中,98℃变性10sec到61℃退火10sec至72℃退火10sec循环数为34个;所述基因组DNA的吸光度OD值为1.8-2.0,浓度为100-200ng/μl。
在其中一个实施例中,所述对纯化PCR产物进行测序,得到MC1R基因的SNP突变位点,并进行基因分型,具体包括:对测序结果进行序列拼接,并将拼接后的序列与黑色原生型猪的基因序列进行比对,确定SNP突变位点,并基于SNP位点确定黑色纯合子的基因型。
本发明实施例还提供一种培育黑猪新品种的快速培育方法,应用上述的方法所得的黑色纯合子基因型的黑猪进行选育。
从上面所述可以看出,本发明提供的黑猪新品种的毛色固定方法及快速培育方法是通过MC1R基因黑色性状分子标记筛选黑色性状,同时结合表型判断,保留黑色纯合子基因型的黑猪,突破了常规表型选育耗时长、纯度低的缺点。本发明可应用于纯化黑色黑猪品系的快速简捷培育,以及相关配套系的性能研究与生产。本方法具有黑色主效基因的确定有效性高,选育进程快、选育准确性高等优点,能够节省因公猪导致的饲料消耗成本,同时节省猪舍空间等优点。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍。
图1为本发明实施例的培育黑猪新品种的毛色性状快速精准固定方法的流程示意图;
图2是本发明实施例的毛色MC1R基因5’端突变位点;
图3是本发明实施例的毛色MC1R基因外显子突变位点;
图4是本发明实施例的MC1R基因氨基酸突变位点;
图5为本发明实施例的培育黑猪新品种的毛色性状快速精准固定方法的又一流程示意图。
具体实施方式
为使本发明的目的、技术方案和优点更加清楚明白,以下结合具体实施例,并参照附图,对本发明进一步详细说明。
本发明的发明人在长期的黑猪新品种的选育工作中注意到,猪不同毛色的形成主要是由于色素的沉积和分布不同而导致的,其中与毛色有关的主要是络氨酸源性色素,主要代表是黑色素及其衍生物。黑色素分为真黑色素和褐黑色素,起源于胚胎躯干神经嵴细胞,主要通过黑素母细胞迁移出去聚集在表皮的基底层,然后移入发育中的毛囊形成黑色素。黑色素的形成有特定的通路,涉及很多基因,不同基因的突变,会导致不同的毛色表型。而有关猪毛色的控制基因座至少有8个,且每个基因座有多个等位基因,不同的等位基因又控制着不同的毛色。因此,发明人发现,由于猪毛色的基因位点多而杂,且存在一定的上位效应和连锁遗传,在毛色由多位点同时控制的情况下,毛色的固定就变得举步维艰。
发明人提出一种黑猪新品种的毛色固定方法及培育方法,通过基因工程进行毛色选育,去除杂合子,保留黑色基因型的纯合子进行扩繁。通过本发明提供的方法,对主效基因的确定,能更有效的完成对毛色的选育,同时还能够达到短时间内将黑猪猪只毛色固定,且使所培育猪只品种的种群毛色稳定遗传,解决了常规选育纯度低,猪舍不足等问题。
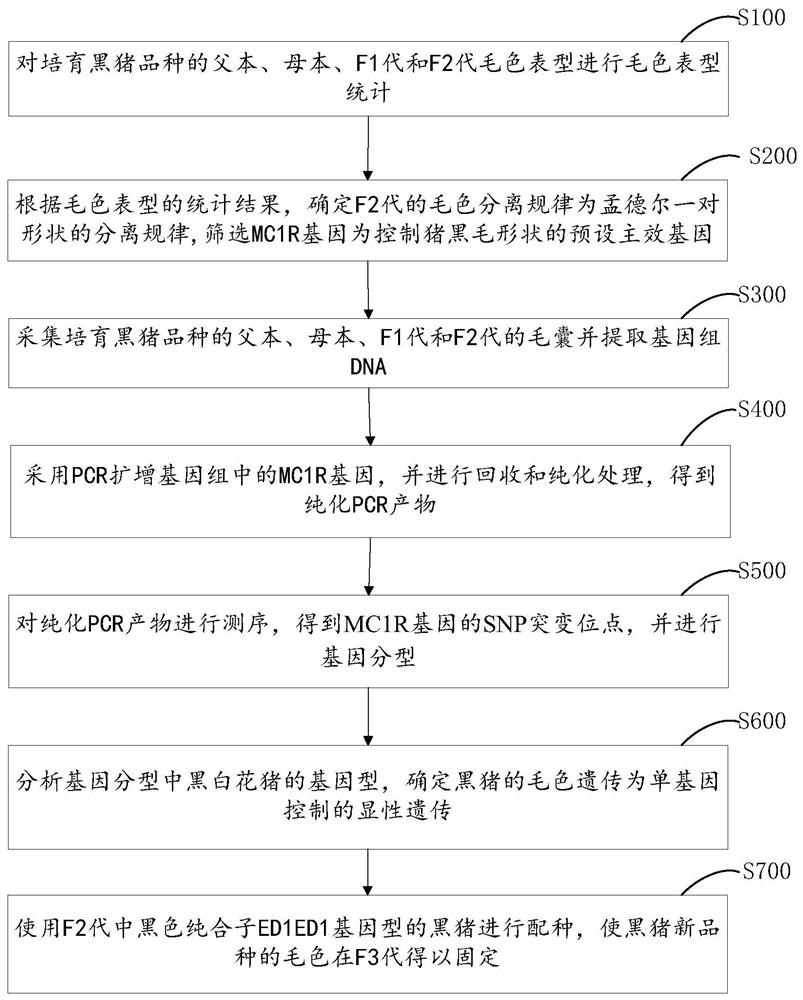
请参阅图1,为本发明实施例提供的培育黑猪新品种的毛色固定方法,包括:
S100,对培育黑猪新品种的父本、母本、F1代和F2代毛色表型进行毛色表型统计;
S200,根据毛色表型的统计结果,确定F2代的毛色分离规律为孟德尔一对性状的分离规律,筛选MC1R基因为控制猪黑毛性状的预设主效基因;
S300,采集培育黑猪品种的父本、母本、F1代和F2代的毛囊并提取基因组DNA;
S400,采用PCR扩增基因组中的MC1R基因,并进行回收和纯化处理,得到纯化PCR产物;
S500,对纯化PCR产物进行测序,得到MC1R基因的SNP突变位点,并进行基因分型;
S600,分析基因分型中黑白花猪的基因型,确定黑猪的毛色遗传为单基因控制的显性遗传;
S700,使用F2代中黑色纯合子基因型的黑猪进行配种,使黑猪新品种的毛色在F3代得以固定。
上述方法步骤中所述培育黑猪为嘉林黑猪,是以巴克夏猪为父本,以成华猪为母本进行杂交所得的F1代和F2代。其中,F1代毛色性状为全黑,F2代开始出现毛色分离,表现为黑白花色和全黑色两种毛色表型。
在步骤S100中,本发明实施例为了发现杂交巴成猪黑毛性状的遗传规律,首先观察了各杂交世代中毛色的表型变化,统计结果如表1所示。
在步骤S200中,统计发现,利用10头巴克夏公猪(多米诺黑斑型)和320头成华母猪(黑毛型)杂交所得的F1杂交品种(3140头)毛色均为黑色。而使用30头F1代黑毛公猪和588头F1代黑毛母猪所繁育的5906头F2杂交猪的黑猪和花猪比例约为3:1。结果表明,培育的嘉林黑猪在毛色表型上的分离遵循孟德尔的分离定律,初步推测毛色遗传是由单基因控制的显性遗传。
表1嘉林黑猪各世代毛色比例
本发明根据统计结果筛选控制黑毛性状的基因。就目前研究发现的控制毛色的基因座至少有9个,分别是白色(I)基因座、毛色扩展基因(E)、白肩带(Be)基因座、白头或海福特(He)基因座、鼠灰色(A)基因座、褐色(B)基因座、白化(C)基因座、淡化(D)基因座和S基因座。其中研究最清楚的是白色I和毛色扩增基因E基因座。本发明根据以往研究发现,黑毛性状主要受毛色扩展基因(E)控制,而毛色扩展基因E位点编码黑色素皮质激素受体(MC1R)基因。该基因位于6号染色体上,控制着真黑色素和褐黑色素的相对伸展范围,决定着黑毛的形成。故本发明确定MC1R基因为黑毛性状的预设主效基因,在后续选育过程中,以该基因为预设主效基因进行毛色的选育。
在步骤S300中,对父本巴克夏、母本成华猪、嘉林黑猪F1代、F2代黑猪和黑白花猪的毛囊进行了采集,并提取了基因组DNA。具体方法如下:1.毛囊的采集
(1)材料
75%酒精棉球、手套、止血钳、1×PBS溶液、已编号的采样袋和冰袋。
(2)方法
1)带上手套,先使用75%的酒精棉在巴成猪背部擦拭毛发,然后使用PBS溶液浸泡后的棉花擦拭整根毛发,保证样品不被污染;
2)用止血钳夹住毛发根部,用力拔下30根毛发(毛发末端可看到清晰的毛囊,即毛发根部白色或黑色物质);
3)拔下的毛发在室温条件下干燥几分钟(刚采下的毛囊粘性较大)。
4)将干燥后的毛发样品装入已编号的采样袋中,放入装有冰袋的泡沫盒。
(3)注意事项
1)采样过程中毛发需一根一根地拔取,不要触及毛发的毛囊部位,就是毛发根部的黑色物质,以防污染样品;
2)选取猪毛发质量好的猪进行采样,发质不好的猪不宜使用;
3)为保证检测效果,勿采集自然脱落下来的毛发,且不要装入落在地上的样本。
4)样品采集好后,放进装有冰袋的盒子,立即运送回实验室,放入-20℃的冰箱保存备用或者直接进行DNA的提取。黑猪的毛囊采集为使用酒精棉消毒后拔出,并干燥数秒所得。其中,采集数量为至少20根,优选为40根。
2.基因组DNA的提取
1)取20根毛发的毛囊组织,放入1.5ml离心管中,用眼科剪将其尽量剪碎,并分别加入组织裂解液和蛋白酶,涡旋震荡使其充分混匀。
2)将步骤1)所得裂解物放置在水浴锅中。水浴温度为56℃,水浴时间可以为24小时,以使毛囊组织充分裂解从而提高产量。
3)分别向步骤2)处理后的各个离心管中加入等体积的结合液GB,剧烈颠倒混匀后,金属浴10min,并冷却;
4)分别向经过步骤3)所得的离心管内加入无水乙醇,颠倒混匀;
5)分别转移步骤4)处理后的离心管中溶液和沉淀于吸附柱内,并将吸附柱放入收集管中,离心弃掉收集管中的液体,将吸附柱放入收集管中;
6)向步骤5)所得吸附柱中加入抑制物去除液GD,离心弃废液;
7)分两次加漂洗液PW至吸附柱中清洗DNA沉淀,以洗去沉淀所含盐分,每次离心并弃掉收集管中的废液。
其中,步骤5)~7)中离心转速可以均为12000r/min,离心时间可以均为30sec。
8)将吸附柱放回空收集管中,离心。其中,离心转速可以均为12000r/min,离心时间可以为2min,以尽量除去漂洗液,避免漂洗液中残留乙醇影响后续PCR反应。
9)取出吸附柱,并放入干净的离心管中,第一次室温放置,并向吸附膜中间加入洗脱缓冲液,再次室温放置并离心。第一次室温放置的时间需适宜,以尽可能去除吸附柱中残留乙醇,但不使吸附柱干燥为宜。
在步骤S400中,包括了MC1R基因的PCR扩增以及PCR产物的回收和纯化。具体操作为:
1.PCR扩增
采用PCR扩增基因组中的MC1R基因具体包括,使用MC1R基因的引物,以提取到的黑猪基因组DNA为模板,进行PCR扩增。其中,基因组DNA的最后吸光度OD值在1.8-2.0之间,浓度为100-200ng/μl。
(1)引物的设计
MC1R基因的引物对包括第一引物对和第二引物对。所述第一引物对和所述第二引物对的预期产物长度以及第一引物对和第二引物对所针对的MC1R基因区域均不相同。
所述第一引物对的预期产物长度为884bp,上游引物在5’端,下游引物在外显子区域;所述第二引物对的预期产物长度为903bp,上游引物在外显子区域,下游引物在3’端。
请参阅表2,第一引物对包括第一上游引物MC1RF1和第一下游引物MC1RR1。其中,MC1RF1:GCTGAGCACAGGCGAGGTT,其为SEQ ID NO.3所示;MC1RR1:GGAAGCAGAGGCTGGACACC,其为SEQ ID NO.4所示。
第二引物对包括第二上游引物MC1RF2和第二下游引物MC1RR2。其中,MC1RF2:CATCGCCAAGAACCGCAACC,为SEQ ID NO.5所示;MC1RR2:GGTCCAGCGTCCATACCTTCA,为SEQ IDNO.6所示。
表2引物基本信息
本发明引物的特异性和灵敏度结果见表3。通过将引物分段设计为两种不同长度的引物对,能够相较于整体引物对(即一种引物对),完整的扩增出MC1R基因的外显子区域,且具更高的灵敏度和特异性。
表3引物的特异性和灵敏度结果
(2)PCR扩增
①PCR扩增体系为:
22μl 2×TsingKE Master Mix、1μl cDNA、1μl上游引物以及1μl下游引物。
②PCR扩增条件如表4所示。
表4 PCR条件
2.PCR产物的回收和纯化处理
①制胶:将琼脂糖加入TBE缓冲液,水合数分钟后,置微波炉中将琼脂糖融化均匀。较佳地,在加热过程中不时摇动,使附于瓶壁上的琼脂糖颗粒进入溶液,且加热时应盖上封口膜,减少水份蒸发。
②胶板制备:将胶槽置于制胶板上,插样品梳,待胶液冷却至一定程度后加入EB溶液浸泡染色。凝胶冷却凝固后,拔出样品梳,并加入电泳缓冲液。其中,样品梳下缘应与胶槽底面保持1mm左右的间隙,且加入EB溶液后去除气泡,以提高胶板的制备品质。
③点样:点样板或薄膜上混合DNA样品和上样缓冲液,并分别用移液枪加入样品槽中。其中,上样缓冲液的最终稀释倍数应不小于1×。每加完一个样品,应更换一个加样头,以防污染,加样时勿碰坏样品孔周围的凝胶面。
④电泳:加样后的凝胶板立即通电进行电泳。其中,使用电压220V电流120A,电泳20min或溴酚蓝移动到距离胶板下沿约1cm处时,停止电泳。以避免电压升高,导致琼脂糖凝胶的有效分离范围降低。
⑤观察和拍照:电泳完毕,取出凝胶,在紫外灯下观察加有EB的电泳胶板。DNA存在处显示出肉眼可辨的桔红色荧光条带。于凝胶成像系统中拍照并保存。其中,紫外灯的波长为254nm。
⑥切下显色条带,加入Buffer溶液混合均匀,加热至凝胶完全熔化。再次加入Buffer溶液混合均匀,将混合液转移至离心管中多次离心,弃滤液,得到纯化PCR产物。
步骤S500中,对纯化PCR产物进行测序指的是对纯化PCR产物进行Sanger测序。并根据测序结果进行基因分型,包括对测序结果进行序列拼接,并将拼接后的纯合序列与杂合序列进行比对,确定SNP突变位点,并基于SNP位点确定突黑色纯合子的基因型,以及氨基酸突变。同时,还将成华母猪以及巴克夏公猪的序列与黑猪的基因序列进行比对,观察其MC1R基因的基因型是否与预期的结果一致,验证嘉林黑猪新品种的毛色遗传是否符合孟德尔一对性状分离规律。
其中,利用Chromas和CExpress进行序列的拼接和导出,并利用NCBI进行序列的比对。MC1R基因的突变位点及突变位点峰如表5和图2-3所示,氨基酸的突变如表6和图4所示。成华母猪和F2代纯合嘉林黑猪均为纯合E
表5MC1R基因的突变位点
表6MC1R基因的氨基酸突变
黑色纯合子基因型的黑猪为E
所述E
所述黑白花色基因型为E
在步骤S600中,由步骤S500的测序结果可得嘉林黑猪母本成华猪的基因型为E
步骤S700中,选择F2代中的纯合子E
本发明实施例还提供一种培育黑猪新品种的快速培育方法,应用上述的方法所得的F3代的黑色纯合子基因型的黑猪进行快速繁育。
本发明提供的黑猪新品种的毛色固定方法及快速培育黑猪新品种的方法,通过分段设计的预期长度分别为884bp和903bp的第一引物对和第二引物,能够以高度的灵敏度和特异度,完整的扩增出MC1R基因的外显子区域,从而提高了对于测序结果进行基因分型的可靠性和准确性,进而提高对于所得黑色纯合子基因型的黑猪的基因型的有效性。能够快速有效固定猪毛色,达到短时间内将猪只毛色固定,且利用基因的筛选,能完全纯合猪种群中的黑毛基因,再利用纯合子基因型的黑猪进行繁育能够使猪种群毛色稳定遗传,极大地加速了育种进程。
实施例
请参阅图5,在猪场通过对比杜洛克猪和巴克夏猪作为公猪的优势,最终选择巴克夏公猪与成华母猪来培育新品种。在培育过程中筛选毛色基因后,选择通过辨别MC1R基因的基因型来进行毛色的固定。其中涉及了DNA的提取,PCR扩增,凝胶电泳,测序以及序列的分析等步骤,具体步骤如下。
步骤一:毛色分离比统计
通过对新品种的亲本及各世代毛色表型进行统计,得到各世代毛色分离比。统计发现,利用10头巴克夏公猪(多米诺黑斑型)和320头成华母猪(黑毛型)杂交所得的F1杂交品种(3140头)毛色均为黑色。而使用30头F1代黑毛公猪和588头F1代黑毛母猪所繁育的5906头F2杂交猪的黑猪和花猪比例约为3:1。结果表明,培育的嘉林黑猪在毛色表型上的分离遵循孟德尔的分离定律,初步推测毛色遗传是由单基因控制的显性遗传。
步骤二:新品种培育中影响毛色主效基因的筛选
在黑猪新品种培育过程中F2世代出现了毛色分离(黑白花猪),巴克夏和成华猪毛色都是黑色占主导,黑毛又由毛色扩展基因E基因座控制,而E位点编码的黑色素皮质激素受体(MC1R)基因,控制真黑色素和褐黑色素的相对伸展范围,控制着黑毛的形成,故初步确定MC1R基因作为主效基因,并设计实验进行验证。
步骤三:毛色MC1R基因的实验部分
(1)DNA提取
采集猪只毛发,使用DNA提取试剂盒提取毛囊中DNA,具体操作步骤如下:
Ⅰ.剪20根猪毛发的毛囊组织,放入1.5ml离心管中,用眼科剪将其尽量剪碎,以提高提取产量;
Ⅱ.向每个离心管中分别加入200μl组织裂解液AE和蛋白酶K(20mg/ml)20μl,颠倒混匀;
Ⅲ.将裂解物放置在56℃水浴锅中,消化过夜,使组织充分裂解以提高产量;
Ⅳ.向各个离心管中加入等体积的200μl结合液GB,剧烈颠倒混匀后,70℃金属浴放置10min;
Ⅴ.室温冷却后,向离心管内加入200μl无水乙醇,颠倒混匀;
Ⅵ.转移离心管中溶液和沉淀于吸附柱内,并将吸附柱放入收集管中,12 000r/min离心30s,弃掉收集管中的液体后,将吸附柱放入收集管中;
Ⅶ.向吸附柱中加入500μl抑制物去除液GD,12 000r/min离心30sec,弃废液;
Ⅷ.分两次加入700μl漂洗液PW清洗,除去DNA沉淀中所含盐分,每次需12 000r/min离心30sec,并弃掉收集管中的废液;
Ⅸ.最后将吸附柱放回空收集管中,12 000r/min离心2min,尽量除去漂洗液,避免漂洗液中残留乙醇影响后续PCR反应;
Ⅹ.取出吸附柱,放入一个干净的离心管中,室温放置5min,去除吸附柱中残留乙醇,但不易放置时间过长以免吸附柱干燥造成得率降低,小心向吸附膜中间加入30μl洗脱缓冲液EB,室温放置3min,12000r/min离心2min,检测浓度,并将得到的DNA放置-20℃冰箱保存备用。
本发明所提取DNA最后吸光度OD值在1.8-2.0之间,浓度稀释到100-200ng/μl用于PCR扩增。
(2)PCR扩增
根据Genebank已发表的MC1R基因序列(登录号FJ665467.1)使用primer3.0和primer5.0设计引物。分两段设计,扩增完整的序列。
正向引物:
884bP:GCTGAGCACAGGCGAGGTT,其核苷酸序列如SEQ ID NO 3所示;
903bp:CATCGCCAAGAACCGCAACC,其核苷酸序列如SEQ ID NO 5所示;
反向引物:
884bP:GGAAGCAGAGGCTGGACACC,其核苷酸序列如SEQ ID NO 4所示;
903bp:GGTCCAGCGTCCATACCTTCA,其核苷酸序列如SEQ ID NO 6所示。
引物合成后,进行PCR扩增,扩增所用酶由擎科生物科技公司提供,扩增体系和条件如下。
1)PCR体系
2×TsingKE Master Mix 22μl
cDNA 1μl
上、下游引物 1μl
2)PCR条件
(3)凝胶电泳
Ⅰ.制胶(1.5%):称取1.5g琼脂糖,加入100mlTBE缓冲液,待水合数分钟后,置微波炉中将琼脂糖融化均匀。在加热过程中要不时摇动,使附于瓶壁上的琼脂糖颗粒进入溶液,加热时应盖上封口膜,以减少水份蒸发。
Ⅱ.胶板制备:将胶槽置于制胶板上,插上样品梳子,注意观察梳子齿下缘应与胶槽底面保持1mm左右的间隙,待胶溶液冷却至50℃左右时,加入最终浓度为0.5微克/毫升的EB(也可不把EB加入凝胶中,而是电汰后再用0.5μg/ml的EB溶液浸泡染色15分钟),摇匀,轻轻倒入电泳制胶板上,除掉气泡,待凝胶冷却凝固后,垂直轻拔梳子,将凝胶放入电泳槽内,加入1×电泳缓冲液,使电泳缓冲液液面刚高出琼脂糖凝胶面。
Ⅲ.点样:点样板或薄膜上混合DNA样品和上样缓冲液,上样缓冲液的最终稀释倍数应不小于1×。用10μL微量移液器分别将5μL样品加入胶板的样品小槽内,每加完一个样品,应更换一个加样头,以防污染,加样时勿碰坏样品孔周围的凝胶面。(注:加样前要先记下加样的顺序和点样量)
Ⅳ.电泳:加样后的凝胶板立即通电进行电泳,DNA的迁移速度与电压成正比,使用电压220V电流120A,电泳20min。也可根据溴酚蓝移动到距离胶板下沿约1cm处时,停止电泳。
Ⅴ.观察和拍照:电泳完毕,取出凝胶。在波长为254nm的紫外灯下观察加有EB的电泳胶板。DNA存在处显示出肉眼可辨的荧光条带。于凝胶成像系统中拍照并保存。
(4)PCR产物的纯化及sanger测序
将经电泳检测合格的样品进行纯化和Sanger测序。
1)PCR产物纯化
①将PCR样品配平离心至4000rpm,检查各样品的体积,补水至50μl。
②按照样品:6×Loading buffer=5:1加入10μl6×Loading buffer,若样品体积在50-70μl补加6×Loading buffer 5μl,离心至4000rpm混匀。
③将样品点入事先准备好的1.2%纯化胶中,点样顺序为:纯化胶第一行1-8孔点入样品第一列,第9孔为marker,10-17孔点入样品第二列。以此类推点完96孔,最后在纯化胶每行第9孔中分别点入2μl DL2000,电泳仪电压设定160V接上接头正负极恒压电泳40-60min,开始电泳后要观察纯化胶槽正负极有气泡冒出。
④将胶块放入凝胶成像仪器中采集图像,图像必须保证marker条带清晰。
⑤在紫外透射仪下,用手术刀切下目的条带,切取的胶块质量应小于3g,将其放入对应的板孔号中,4000rpm离心1min,加入500μl Buffer GL,盖上封口膜,65℃水浴12min。
⑥检查每孔胶块是否完全溶解,若没有完全溶解再次65℃水浴3min,揭开封口膜,用连续加液器每孔加入100μl混匀的磁珠,对于预检标记为红色的在补入100μl磁珠,盖上硅胶垫,漩涡震荡30s,转入水平震荡仪600-800rpm震荡5min。
⑦将96孔板卡入磁力架中,磁吸30s,将磁力架和样品正反轻微颠倒3次,再次静置磁吸1min。
⑧弃废液,吸水纸上轻磕,用50-1200μl 8道电动移液器向每孔移取500μlBufferW1,盖上硅胶垫漩涡震荡30s,将96孔板卡入磁力架中,磁吸30s,将磁力架和样品正反轻微颠倒3次,再次静置磁吸1min。
⑨弃废液,吸水纸上轻磕,用50-1200μl 8道电动移液器向每孔移取500μl BufferW2盖上硅胶垫漩涡震荡30s,将96孔板卡入磁力架中,磁吸30s,将磁力架和样品正反轻微颠倒3次,再次静置磁吸1min。
⑩弃废液,吸水纸上轻磕,离心至600rpm。
取下磁力架,加入35μl的Eluent(已65℃水浴加热),盖上封口膜,65℃水浴5min。之后离心至1000rpm,将96孔板卡入磁力架中,磁吸1min。
2μl样品+5μl 1.4×溴酚蓝混合后点入0.8%的鉴定胶中,按照A01-H01的竖向顺序横向点入,中间空出2孔,分别加入1μl、2μl量的DL2000,300V电泳11min。
将鉴定胶放入凝胶成像仪中采集图像,图像必须保证marker条带清晰。对照纯化前后胶图,根据PCR定量标准在PCR记录表上标注每孔模板浓度并稀释至指定浓度,对回收后电泳无条带的样品按照4μl样品+5μl 1.4×溴酚蓝再次电泳鉴定。
将稀释后模板水浴5min,离心至4000rpm,标记Lims系统模板状态。
2)测序
①反应体系:
②测序反应循环条件:
③测序反应纯化:
Ⅰ.用8道移液器往样品板加入38μl,盖硅胶垫震荡10s,静置1min,再次震荡10s,离心至1000rpm;
Ⅱ.将样品板放入磁力架中,卡好,静置2min;
Ⅲ.取下硅胶垫,倒置样板甩弃废液,吸水纸上轻磕;
Ⅳ.加入100μl Magical Buffer,静置30秒,倒置样板甩弃废液,吸水纸上轻磕,550rpm离心10s,换上新的吸水纸,再次离心10s;
Ⅴ.将样品板从磁力架上取出,放在96孔板板托上,自然晾干2min,加入20μl灭菌高纯水。盖上干净的硅胶垫震荡30s,4000rpm离心1min;
Ⅵ.从LIMS管理系统导出上机表,上3730测序仪;
Ⅶ.使用3730xl对数据进行收集。
步骤四:MC1R基因序列分析及基因型分析
对测序数据利用Chromas和CExpress进行序列的拼接和导出,并利用NCBI进行序列的比对,找出MC1R基因的突变位点及突变位点峰图。其中成华猪和纯合嘉林黑猪为E
步骤五:选育
MC1R基因在机体黑色素的沉积中起着重要的作用,是一个潜在的黑色杂种猪黑毛性状的候选基因。因此,通过对巴克夏、成华猪、F1巴成杂交猪、F2巴成杂交猪(称为纯合子或杂合子)的MC1R基因完整DNA进行测序,获得了1501bp的MC1R DNA序列(GenBank登录号AY960624),并从这些样本中筛选出了MC1R基因完整DNA序列中的12个突变位点(表5)。根据MC1R基因的突变SNP位点,确定成华猪和F2黑猪(称为纯合子)具有典型的E
本发明提供了一种基于地方猪杂交培育新品种的黑毛性状快速精准固定方法,此方法详细介绍了在新品种培育过程中如何弄清所培育品种的毛色遗传规律并将其快速精准地固定。此方法在极大程度上缩短了毛色选育所需的时间,并增加了猪种群毛色基因的纯度,快速而精准地控制了毛色的遗传,能够为其他猪只新品种培育中毛色的固定提供参考。
本发明的实施例旨在涵盖落入所附权利要求的宽泛范围之内的所有这样的替换、修改和变型。因此,凡在本发明的精神和原则之内,所做的任何省略、修改、等同替换、改进等,均应包含在本发明的保护范围之内。
SEQUENCE LISTING
<110> 四川农业大学
<120> 培育黑猪新品种的毛色性状快速精准固定方法及应用
<130> FI200303
<160> 8
<170> PatentIn version 3.3
<210> 1
<211> 1501
<212> DNA
<223> 猪MC1R基因
<400> 1
gctctgcgct ccaaggagcc aggaccaact gggtgcccct tgcgcctccc ggcaccaggc 60
ggagtgccgg ggctcccacg gtgcgtcccg ggcccacgcc cgtcacgtgg ccgccctcgg 120
gaggaggggc tcaggcagga ctttaaagat gcccagaaag cctccgttct cctgggacct 180
cagtccccca ccccggcctg cggcgaggca ggaggctcaa aatgtccgga cctgagcgac 240
tgcctctcca gggaagactt ggtggggagg tgggctgagc acagagggtc ctggccggga 300
accgcctggg cctctctggc cgggccatgc ccgggcccac gttcggccag ccagggcgag 360
tgtgggggca cctctgggag ccatgagctg agcaggaccc ccgagagcga cgtgccctcc 420
ctgctccctg gcgggacgat gcctgtgctt ggcccggaga ggaggctgct ggcttccctc 480
agctccgcac ccccagccgc cccccgcctc gggctggccg ccaaccagac caaccagacg 540
ggcccccagt gcctggaggt gtccattccc gacgggctct tcctcagcct ggggctggtg 600
agcctcgtgg agaacgtgct ggtggtggcc gccatcgcca agaaccgcaa cctgcactcg 660
cccatgtact acttcgtctg ctgcctggcc gtgtcggacc tgctggtgag cgtgagcaac 720
atgctggaga cggccgtgct gccgctgctg gaggcgggcg ccctggccgc ccaggccgcc 780
gtggtgcagc agctggacaa cgtcatggac gtgctcatct gcggctccat ggtgtccagc 840
ctctgcttcc tgggcgccat cgccgtggac cgctacgtgt ccatcttcta cgcgctgcgc 900
taccacagca tcgtgacgct gccccgcgcg gggcgggcca tcgcggccat ctgggcgggc 960
agcgtgctct ccagcaccct cttcatcgcc tactaccacc acacggccgt cctgctgggc 1020
ctcgtcagct tcttcgtggc catgctggcg ctcatggcgg tactgtacgt ccacatgctg 1080
gcccgggcct gccagcacgg ccggcacatc gcccggctcc acaagacgca gcaccccacc 1140
cgccagggct gcggcctcaa gggcgcagcc accctcacca tcctgctggg cgtcttcctc 1200
ctctgctggg cacccttctt cctgcacctc tccctcgtcg tcctctgccc ccagcacccc 1260
acctgcggct gcgtcttcaa gaacgtcaac ctctttctgg ccctcgtcat ctgcaactcc 1320
atcgtggacc ccctcatcta cgccttccgc agccaggagc tccgcaagac cctccaggag 1380
gtgctgcagt gctcctggtg aggggggcgg gcgctggagc caggctgcgg ggctgagggc 1440
agtggtgccg tcctgcggcc cggttcctac gtggctgggc agccccttgg cagagaggac 1500
g 1501
<210> 2
<211> 963
<212> DNA
<223> 猪氨基酸部分对应的MC1R基因
<400> 2
atgcctgtgc ttggcccgga gaggaggctg ctggcttccc tcagctccgc acccccagcc 60
gccccccgcc tcgggctggc cgccaaccag accaaccaga cgggccccca gtgcctggag 120
gtgtccattc ccgacgggct cttcctcagc ctggggctgg tgagcctcgt ggagaacgtg 180
ctggtggtgg ccgccatcgc caagaaccgc aacctgcact cgcccatgta ctacttcgtc 240
tgctgcctgg ccgtgtcgga cctgctggtg agcgtgagca acatgctgga gacggccgtg 300
ctgccgctgc tggaggcggg cgccctggcc gcccaggccg ccgtggtgca gcagctggac 360
aacgtcatgg acgtgctcat ctgcggctcc atggtgtcca gcctctgctt cctgggcgcc 420
atcgccgtgg accgctacgt gtccatcttc tacgcgctgc gctaccacag catcgtgacg 480
ctgccccgcg cggggcgggc catcgcggcc atctgggcgg gcagcgtgct ctccagcacc 540
ctcttcatcg cctactacca ccacacggcc gtcctgctgg gcctcgtcag cttcttcgtg 600
gccatgctgg cgctcatggc ggtactgtac gtccacatgc tggcccgggc ctgccagcac 660
ggccggcaca tcgcccggct ccacaagacg cagcacccca cccgccaggg ctgcggcctc 720
aagggcgcag ccaccctcac catcctgctg ggcgtcttcc tcctctgctg ggcacccttc 780
ttcctgcacc tctccctcgt cgtcctctgc ccccagcacc ccacctgcgg ctgcgtcttc 840
aagaacgtca acctctttct ggccctcgtc atctgcaact ccatcgtgga ccccctcatc 900
tacgccttcc gcagccagga gctccgcaag accctccagg aggtgctgca gtgctcctgg 960
tga 963
<210> 3
<211> 320
<212> PRT
<223> 猪MC1R氨基酸序列
<400> 3
Met Pro Val Leu Gly Pro Glu Arg Arg Leu Leu Ala Ser Leu Ser Ser
1 5 10 15
Ala Pro Pro Ala Ala Pro Arg Leu Gly Leu Ala Ala Asn Gln Thr Asn
20 25 30
Gln Thr Gly Pro Gln Cys Leu Glu Val Ser Ile Pro Asp Gly Leu Phe
35 40 45
Leu Ser Leu Gly Leu Val Ser Leu Val Glu Asn Val Leu Val Val Ala
50 55 60
Ala Ile Ala Lys Asn Arg Asn Leu His Ser Pro Met Tyr Tyr Phe Val
65 70 75 80
Cys Cys Leu Ala Val Ser Asp Leu Leu Val Ser Val Ser Asn Met Leu
85 90 95
Glu Thr Ala Val Leu Pro Leu Leu Glu Ala Gly Ala Leu Ala Ala Gln
100 105 110
Ala Ala Val Val Gln Gln Leu Asp Asn Val Met Asp Val Leu Ile Cys
115 120 125
Gly Ser Met Val Ser Ser Leu Cys Phe Leu Gly Ala Ile Ala Val Asp
130 135 140
Arg Tyr Val Ser Ile Phe Tyr Ala Leu Arg Tyr His Ser Ile Val Thr
145 150 155 160
Leu Pro Arg Ala Gly Arg Ala Ile Ala Ala Ile Trp Ala Gly Ser Val
165 170 175
Leu Ser Ser Thr Leu Phe Ile Ala Tyr Tyr His His Thr Ala Val Leu
180 185 190
Leu Gly Leu Val Ser Phe Phe Val Ala Met Leu Ala Leu Met Ala Val
195 200 205
Leu Tyr Val His Met Leu Ala Arg Ala Cys Gln His Gly Arg His Ile
210 215 220
Ala Arg Leu His Lys Thr Gln His Pro Thr Arg Gln Gly Cys Gly Leu
225 230 235 240
Lys Gly Ala Ala Thr Leu Thr Ile Leu Leu Gly Val Phe Leu Leu Cys
245 250 255
Trp Ala Pro Phe Phe Leu His Leu Ser Leu Val Val Leu Cys Pro Gln
260 265 270
His Pro Thr Cys Gly Cys Val Phe Lys Asn Val Asn Leu Phe Leu Ala
275 280 285
Leu Val Ile Cys Asn Ser Ile Val Asp Pro Leu Ile Tyr Ala Phe Arg
290 295 300
Ser Gln Glu Leu Arg Lys Thr Leu Gln Glu Val Leu Gln Cys Ser Trp
305 310 315 320
<210> 4
<211> 19
<212> 人工序列
<223> F1引物
<400> 3
gctgagcaca ggcgaggtt 19
<210> 5
<211> 20
<212> 人工序列
<223> R1引物
<400> 4
ggaagcagag gctggacacc 20
<210> 6
<211> 20
<212> 人工序列
<223> F2引物
<400> 5
catcgccaag aaccgcaacc 20
<210> 7
<211> 21
<212> 人工序列
<223> R2引物
<400> 6
ggtccagcgt ccataccttca 21
<210> 8
<211> 20
<212> 人工序列
<223> F3引物
<400> 7
aagatgccca gaaagcctcc 20
<210> 9
<211> 16
<212> 人工序列
<223> R3引物
<400> 8
cactgccc tcagcccc 16
- 一种培育黑猪新品种的毛色性状快速精准固定方法及应用
- 一种黑猪新品种的培育方法
