一种替格瑞洛手性中间体的制备方法
文献发布时间:2023-06-19 11:22:42
技术领域
本发明涉及基因工程与酶工程技术领域,特别是涉及生物催化不对称合成手性中间体的技术领域,更为具体的说是涉及一种替格瑞洛手性中间体的制备方法。
背景技术
替格瑞洛化学名称为(1S,2S,3R,5S)-3-[7-[[(1R,2S)-2-(3,4-二氟苯基)环丙基]氨基]-5-丙硫基三唑并[4,5-d]嘧啶-3-基]-5-(2-羟乙氧基)-1,2-环戊二醇。该药物是由阿斯利康公司研发的一种新型的具有选择性的小分子抗凝血药。该药物作为一种选择性二磷酸腺苷受体拮抗剂,可以作用于P2Y12ADP受体,从而抑制ADP介导的血小板活化和聚集。替格瑞洛于2011年7月被美国FDA批准上市,2012年11月获准在中国上市。
(S)-2-氯-1-(3,4-二氟苯基)乙醇作为替格瑞洛合成过程中的关键手性中间体,如何高效合成该S构型化合物一直是本领域技术人员研究的热点。同时,这也是替格瑞洛合成领域的难点。
采用生物合成法制备手性中间体具有反应条件温和、环境友好等特点。目前在替格瑞洛手性中间体(S)-2-氯-1-(3,4-二氟苯基)乙醇的合成研究领域中,主要存在以下问题:
在CN107686447A中公开的关于替格瑞洛中间体(S)-2-氯-1-(3,4-二氟苯基)乙醇的酶催化反应中需要添加葡糖,不仅增加了废水处理量,而且真菌发酵产酶的生产成本要高于常规的E.coli菌株,该方法的生产成本较高;
在CN106906249A中所公开的方法中,由于所使用的酶活性较低,因此需要消耗大量的酶,生产成本相对较高。
发明内容
本发明所要解决的技术问题是提供一种新的替格瑞洛手性中间体的生物催化制备方法,从而可以高效制备获得替格瑞洛合成中的关键手性中间体(S)-2-氯-1-(3,4-二氟苯基)乙醇。
为了解决上述技术问题,本发明公开了一种替格瑞洛手性中间体的制备方法,所述制备方法以2-氯-1-(3,4-二氟苯基)乙酮(式II)为底物,以携带有重组Alcoholdehydrogenase酶AT6702基因的重组菌经发酵培养获得的湿菌体为酶源,在pH5.0-8.0的缓冲液为反应介质,助溶剂与辅酶参与的反应体系下,进行反应,反应结束后,经分离纯化获得(S)-2-氯-1-(3,4-二氟苯基)乙醇(式I),所述重组Alcohol dehydrogenase酶AT6702基因如SEQ ID:1所示;
作为一种优选的技术方案,所述催化还原反应的反应条件为:30~40℃,200~280rpm。
作为一种进一步优选的技术方案,所述助溶剂采用分步加入的方式,首先加入2/3量的助溶剂反应一小时,然后再加入剩余量的助溶剂继续反应四小时后,得到含有(S)-2-氯-1-(3,4-二氟苯基)乙醇的分离产物。
优选地,酶源的添加量为底物质量的0.1-10倍。
优选地,辅酶为NADP+或NADPH。进一步优选地,所述NADP+或NADPH的添加量为底物质量的0.001-0.1倍。
优选地,所述缓冲液为磷酸盐缓冲液(PB缓冲液)。进一步优选地,所述磷酸盐缓冲液的浓度为0.2mol/L缓冲液。更为优选的是,所述磷酸盐缓冲液的添加量以底物的添加量计算为1g底物添加缓冲液10-100mL。
进一步优选地,所述助溶剂为异丙醇。在本发明中还进一步公开了所述的酶源的制备方法是,将携带有重组Alcohol dehydrogenase酶AT6702基因的重组菌接种至LB培养基中,37±2℃培养10-24小时,然后按照2%的接种量转接于LB培养基中,37±2℃培养至OD600=0.6时,加入IPTG,20℃诱导16h,发酵结束后,离心收集湿菌体,用pH7.0磷酸盐缓冲液洗涤,破碎,得到酶源,所述LB培养基的组成为胰蛋白胨10g/L、酵母粉5g/L、NaCl 10g/L,pH 7.0。
作为一种优选的技术方案,所述重组菌是以pET-28a(+)为表达载体,通过将如SEQID NO:1所示的核苷酸序列载入大肠杆菌BL21(DE3),培养得到。
进一步优选的,所述重组菌的构建方法是,合成如SEQ ID:1所示的重组Alcoholdehydrogenase酶AT6702的基因序列,以pET-28a为表达载体,选择EcoR I和Hind III酶切位点接入外源基因,然后将构建好的载体载入E.coli BL21(DE3)中,涂布在含卡那霉素的培养基平板上,放入37℃培养箱中培养10-24小时,得到含有该重组基因得到重组菌,所述LB培养基的组成为胰蛋白胨10g/L、酵母粉5g/L、NaCl 10g/L,pH 7.0。
本发明利用基因工程技术,成功构建能够表达Alcohol dehydrogenase酶AT6702的重组菌,并利用该重组菌制备手性中间体(S)-2-氯-1-(3,4-二氟苯基)乙醇,手性选择ee值可以达到100%。并且本发明不需要额外添加辅酶循环酶,且酶催化活性高达2.5,化学纯度>99%,手性纯度100%。是一种具有高催化效率和高手性选择的合成方法。
附图说明
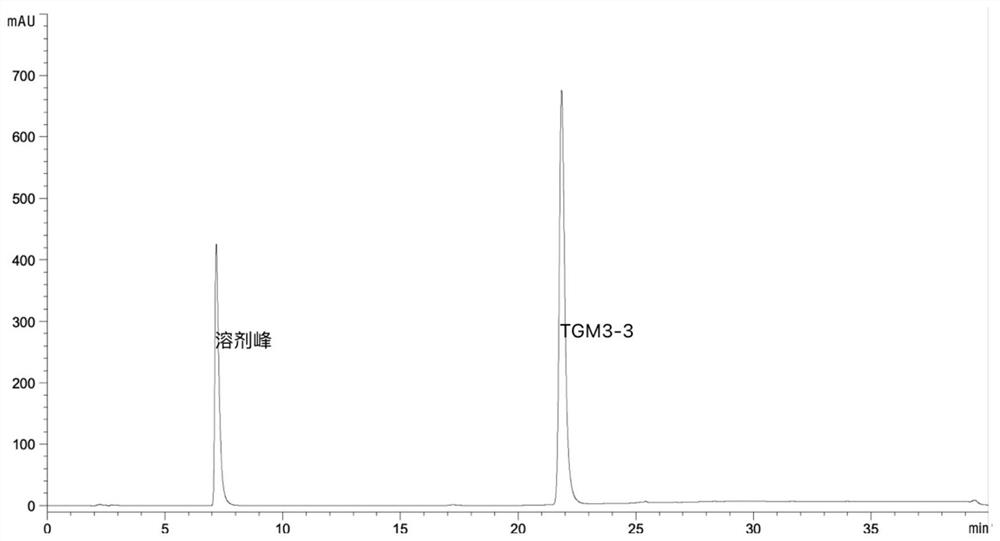
图1为(S)-2-氯-1-(3,4-二氟苯基)乙醇(图中编号TGM3-3)制备的反相检测图谱。
图2为(S)-2-氯-1-(3,4-二氟苯基)乙醇(图中编号TGM3-3)制备的正相手性图谱。
具体实施方式
为了更好地理解本发明,下面我们结合具体的实施例对本发明进行进一步的阐述。
除非有特殊说明,在本发明实施例中所用试剂均为普通市售产品。
实施例1 AT6702表达菌株的构建
将Alcohol dehydrogenase酶的基因送检基因合成公司合成后,选择表达载体为pET-28a,选择EcoR I和Hind III酶切位点接入外源基因,将构建好的载体载入E.coliBL21(DE3)中,涂布在含卡那霉素的LB平板上,放入37℃培养箱中过夜,将长出来的单菌落进行质粒提取和测序验证,最终确认获得含该酯酶基因的重组工程菌。其中,AT6702的核苷酸序列如SEQ ID NO:1所示。其中LB培养基:胰蛋白胨10g/L、酵母粉5g/L、NaCl 10g/L,pH7.0。
实施例2重组菌发酵产酶制备(S)-2-氯-1-(3,4-二氟苯基)乙醇
(1)制备2-氯-1-(3,4-二氟苯基)乙酮还原酶发酵液
将实施例1构建的重组菌接种于10mL的LB培养基中,37℃震荡培养过夜,按照2%的接种量转接于LB培养基中,37℃培养至OD600=0.6时,加入50μl 0.5mol/L的IPTG,20℃诱导16h,离心收集湿菌体,0.2M pH7.0磷酸盐缓冲液洗涤两次后超声波破碎后获得稀释的粗酶液。
(2)酶催化制备(S)-2-氯-1-(3,4-二氟苯基)乙醇
在250mL的锥形瓶中分别加入9mL 0.2M pH7.0PB buffer,10mg的NADP+,10mL稀释粗酶液(约含1g湿菌体),2.5g底物,2mL的异丙醇,反应温度为40℃,220rpm,摇床催化反应。反应1h后,补充1mL异丙醇,反应4h后,底物完全转化加入等体积乙酸乙酯萃取2次,取上层乙酸乙酯相。结合图1看到所制备得到的目标产物化学纯度约为99.04%(图一中编号TGM3-3为化合物I),图1中各数据见表1(由于其他峰的峰值较低,在图1中未能体现出来,具体保留时间和峰高等信息参考表1中所列),结合图2看到所制备得到的目标产物手性纯度100%(图2中编号TGM3-3为化合物I)催化效率为2.5,图2中各数据见表2。
表1:
信号1:VWD1 A,Wavelength=210nm
表2:
Detector A Chl 210nm
。
实施例3
在250mL的锥形瓶中分别加入9mL 0.2M pH7.0 PB buffer,10mg的NADP+,10mL稀释粗酶液(约含1g湿菌体),2.5g底物,3mL的异丙醇,反应温度为40℃,220rpm,摇床催化反应。反应4h后,底物完全转化加入等体积乙酸乙酯萃取2次,取上层乙酸乙酯相。制备得到的目标产物化学纯度约为92.79%,反应未完全,底物残留>5%,ee值100%。
实施例4
在250mL的锥形瓶中分别加入9mL 0.2M pH8.0,10mg的NADP+,10mL稀释粗酶液(约含1g湿菌体),2.5g底物,2mL的异丙醇,反应温度为40℃,220rpm,摇床催化反应。反应1h后,补充1mL异丙醇,反应4h后,底物完全转化加入等体积乙酸乙酯萃取2次,取上层乙酸乙酯相。制备得到的目标产物化学纯度约为96.99%,反应基本完全,底物残留<5%,ee值100%。
实施例5
在250mL的锥形瓶中分别加入9mL pH7.0 PB buffer,10mg的NADP+,10mL稀释粗酶液(约含1g湿菌体),2.5g底物,2mL的异丙醇,反应温度为35℃,220rpm,摇床催化反应。反应1h后,补充1mL异丙醇,反应4h后,底物完全转化加入等体积乙酸乙酯萃取2次,取上层乙酸乙酯相。所制备得到的目标产物化学纯度约为97.46%,反应基本完全,ee值100%。
实施例6
在250mL的锥形瓶中分别加入9mL pH7.0 PB buffer,10mg的NADP+,10mL稀释粗酶液(约含1g湿菌体),2.5g底物,2mL的异丙醇,反应温度为45℃,220rpm,摇床催化反应。反应1h后,补充1mL异丙醇,反应4h后,底物完全转化加入等体积乙酸乙酯萃取2次,取上层乙酸乙酯相。所制备得到的目标产物化学纯度约为83.70%,反应未完全,底物残留>5%,ee值100%。
以上所述是本发明的具体实施方式。应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也视为本发明的保护范围。
序列表
<110> 宿迁盛基医药科技有限公司
<120> 一种替格瑞洛手性中间体的制备方法
<130> 202110013
<160> 1
<170> SIPOSequenceListing 1.0
<210> 1
<211> 759
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 1
atgactgatc gtttaaaagg caaagtagca attgtaactg gcggtacctt gggaattggc 60
ttggcaatcg ctgataagtt tgttgaagaa ggcgcaaagg ttgttattac cggccgtcac 120
gctgatgtag gtgaaaaagc tgccaaatca atcggcggca cagacgttat ccgttttgtc 180
caacacgatg cttctgatga agccggctgg actaagttgt ttgatacgac tgaagaagca 240
tttggcccag ttaccacggt tgtcaacaat gccggaattg cggtcagcaa gagtgttgaa 300
gataccacaa ctgaagaatg gcgcaagctg ctctcagtta acttggatgg tgtcttcttc 360
ggtacccgtc ttggaatcca acgtatgaag aataaaggac tcggagcatc aatcatcaat 420
atgtcatcta tcgaaggttt tgttggtgat ccaactctgg gtgcatacaa cgcttcaaaa 480
ggtgctgtca gaattatgtc taaatcagct gccttggatt gcgctttgaa ggactacgat 540
gttcgggtta acactgttca tccaggttat atcaagacac cattggttga cgatcttgaa 600
ggggcagaag aaatgatgtc acagcggacc aagacaccaa tgggtcatat cggtgaacct 660
aacgatatcg cttggatctg tgtttacctg gcatctgacg aatctaaatt tgccactggt 720
gcagaattcg ttgtcgatgg tggatacact gctcaataa 759
- 替格瑞洛的中间体及其制备方法和替格瑞洛的制备方法
- 替格瑞洛的中间体及其制备方法和替格瑞洛的制备方法
