作为Advillin功能促进剂的环状胺衍生物以及新型环状胺衍生物和其药物用途
文献发布时间:2023-06-19 12:02:28
技术领域
本发明涉及作为Advillin功能促进剂的环状胺衍生物以及新型环状胺衍生物和其药物用途。
背景技术
Advillin主要在末梢神经中表达,在神经轴索伸展中承担重要的功能(非专利文献1和非专利文献2)。在Advillin缺损的小鼠中,在神经回路的再生时确认神经轴索伸展的功能障碍,神经轴索的长度也短(非专利文献2)。此外,如果在Advillin缺损的小鼠中通过神经结扎或抗癌处置等诱发神经轴索损伤,则与正常小鼠相比确认到与神经轴索损伤相关的症状的恶化(非专利文献2和非专利文献3)。另一方面,在使Advillin过表达的神经细胞中,包含神经轴索的神经突起的数量和长度增加(非专利文献3)。即,Advillin已知具有神经再生时的神经轴索伸展促进作用。
神经轴索为了伸展,在神经轴索前端的生长锥中,需要将单体肌动蛋白的聚合和肌动蛋白丝脱聚合(以下称为肌动蛋白丝代谢转换)调节正常(非专利文献4)。已知上述Advillin存在于神经轴索前端的生长锥中(非专利文献3)。此外,Advillin作为肌动蛋白结合蛋白质,已知具有调节肌动蛋白丝代谢转换的功能(非专利文献5)。
末梢神经的轴索损伤也被称为末梢神经损伤,由外科手术、毒物、血液循环障碍、因交通事故等引起的外伤或放射线治疗等而引起,引起运动麻痹、知觉麻痹或自主神经等的障碍。末梢神经的轴索损伤后已知发生神经轴索再生,但包含异常的功能恢复不良的情况较多。实际的神经轴索再生需要时间,在该过程中神经轴索周边的组织、与神经轴索末端接合的靶标组织发生变性,由此神经轴索末端与靶标组织或靶标细胞的再接合无法正确进行,无法进行有效且正常的神经再支配,据称这是其原因之一。再接合的不正确性不仅发生在神经与肌肉组织等靶标组织之间,而且还发生在感觉神经间和运动神经间,在感觉神经间确认到异常知觉,在运动神经间确认到不自主的异常运动(非专利文献6)。此外,特别是在神经轴索和神经鞘断裂的神经断裂中,无法期待自然治愈,也没有有效的治疗药,因此进行神经修复术、功能重建手术等外科的疗法,但存在的问题在于患者的负担大(非专利文献7)。因此,迫切期望用于治疗和预防末梢神经的轴索损伤后的包含异常的功能恢复不良的促进神经轴索伸展的有效的治疗药。
专利文献1和2中,公开了环状胺衍生物具有镇痛作用和能够治疗或预防末梢神经障碍,但针对促进Advillin功能的效果和治疗神经轴索损伤的效果没有公开。此外,促进Advillin功能的化合物也是未知的。
现有技术文献
专利文献
专利文献1:国际公开第2016/136944号
专利文献2:国际公开第2018/181860号
非专利文献
非专利文献1:Ravenall等人,European Journal of Neuroscience,2002年,第15卷,p.281-290
非专利文献2:Hasegawa等人,The Journal of Neuroscience,2007年,第27卷,p.14404-14414
非专利文献3:Chuang等人,Proceedings of the National Academy ofSciences of the United States of America,2018年,第115卷,p.E8557-E8566
非专利文献4:Blanquie等人,Current Opinion in Neurobiology,2018年,第51卷,p.60-69
非专利文献5:Rao等人,The Journal of Clinical Investigation,2017年,第127卷,p.4257-4269
非专利文献6:西胁等人,リハビリテーション医学,2002年,第39巻,p.257-266
非专利文献7:金谷,The Japanese Journal of Rehabilitation Medicine,2014年,第51卷,p52-60。
发明内容
发明要解决的课题
为此,本发明的目的在于,提供包含低分子化合物且对神经轴索损伤的治疗有用的Advillin功能促进剂。
用于解决课题的手段
本发明人等为了解决上述课题而反复深入研究的结果发现,环状胺衍生物或其药理学上可允许的盐具有促进Advillin功能的作用。
即,本发明提供Advillin功能促进剂,其含有下述通式(I)所示的环状胺衍生物或其药理学上可允许的盐作为有效成分。
[化1]
[式中,标记*的碳是手性碳,A表示下述通式(IIa)或(IIb)所示的基团,
[化2]
R
上述的环状胺衍生物中,A优选为通式(IIa)所示的基团,此时,R
上述的环状胺衍生物中,A优选为通式(IIb)所示的基团,此时,X更优选为-N(R
此外,上述的环状胺衍生物中,R
进一步,上述的环状胺衍生物中,标记*的手性碳的立体化学更优选为S构型。
通过限定于这些,能够进一步提高Advillin功能促进作用。
本发明提供Advillin功能促进剂,其用于通过与Advillin和/或Advillin复合体结合而促进Advillin的功能,含有上述通式(I)所示的环状胺衍生物或其药理学上可允许的盐作为有效成分。
此外,本发明提供Advillin功能促进剂,其用于改善肌动蛋白丝代谢转换调节异常,含有上述通式(I)所示的环状胺衍生物或其药理学上可允许的盐作为有效成分。
此外,本发明提供Advillin功能促进剂,其用于促进神经轴索伸展,含有上述通式(I)所示的环状胺衍生物或其药理学上可允许的盐作为有效成分。
进一步,本发明提供Advillin功能促进剂,其用于与Advillin和/或Advillin复合体结合而改善肌动蛋白丝代谢转换调节异常、促进神经轴索伸展,含有上述通式(I)所示的环状胺衍生物或其药理学上可允许的盐作为有效成分。
此外,本发明提供Advillin功能促进剂,其为神经轴索损伤治疗剂,含有上述通式(I)所示的环状胺衍生物或其药理学上可允许的盐作为有效成分。
此外,本发明提供环状胺衍生物或其药理学上可允许的盐,所述环状胺衍生物是选自3-羟基-3-(1-甲基-1H-咪唑-2-基)-1-(4-吗啉代哌啶-1-基)丙-1-酮、1-(4-(二甲基氨基)哌啶-1-基)-3-(1-丙基-1H-咪唑-2-基)-3-羟基丙-1-酮、1-(4-(二甲基氨基)哌啶-1-基)-3-(1-异丙基-1H-咪唑-2-基)-3-羟基丙-1-酮、3-(5-氯-1-甲基-1H-咪唑-2-基)-1-(4-(二甲基氨基)哌啶-1-基)-3-羟基丙-1-酮、1-(4-(二甲基氨基)哌啶-1-基)-3-(1-(2-甲氧基乙基)-1H-咪唑-2-基)-3-羟基丙-1-酮和1-(4-(二甲基氨基)哌啶-1-基)-3-(1-(3,3,3-三氟丙基)-1H-咪唑-2-基)-3-羟基丙-1-酮中的一种化合物。
此外,本发明提供药物,其包含环状胺衍生物或其药理学上可允许的盐作为有效成分,所述环状胺衍生物是选自3-羟基-3-(1-甲基-1H-咪唑-2-基)-1-(4-吗啉代哌啶-1-基)丙-1-酮、1-(4-(二甲基氨基)哌啶-1-基)-3-(1-丙基-1H-咪唑-2-基)-3-羟基丙-1-酮、1-(4-(二甲基氨基)哌啶-1-基)-3-(1-异丙基-1H-咪唑-2-基)-3-羟基丙-1-酮、3-(5-氯-1-甲基-1H-咪唑-2-基)-1-(4-(二甲基氨基)哌啶-1-基)-3-羟基丙-1-酮、1-(4-(二甲基氨基)哌啶-1-基)-3-(1-(2-甲氧基乙基)-1H-咪唑-2-基)-3-羟基丙-1-酮和1-(4-(二甲基氨基)哌啶-1-基)-3-(1-(3,3,3-三氟丙基)-1H-咪唑-2-基)-3-羟基丙-1-酮中的一种化合物。
此外,本发明提供用于治疗神经轴索损伤的药物组合物,其含有上述的通式(I)所示的环状胺衍生物或其药理学上可允许的盐、和药理学上可允许的赋形剂等。
此外,本发明提供上述的通式(I)所示的环状胺衍生物或其药理学上可允许的盐,其用于治疗神经轴索损伤。
此外,本发明提供上述的通式(I)所示的环状胺衍生物或其药理学上可允许的盐用于治疗神经轴索损伤的用途。
此外,本发明提供上述的通式(I)所示的环状胺衍生物或其药理学上可允许的盐在制造用于治疗神经轴索损伤的药物中的用途。
此外,本发明提供治疗神经轴索损伤的方法,其包括向需要治疗的患者施与治疗有效量的上述的通式(I)所示的环状胺衍生物或其药理学上可允许的盐。
此外,本发明提供治疗神经轴索损伤的方法,其包括使有效量的上述的通式(I)所示的环状胺衍生物或其药理学上可允许的盐与神经细胞接触。
此外,本发明提供治疗神经轴索损伤的方法,其包括将有效量的上述的通式(I)所示的环状胺衍生物或其药理学上可允许的盐施与需要其的对象。
此外,上述的神经轴索损伤的原因不仅限于此,可以举出外科手术、毒物、血液循环障碍、因交通事故等引起的外伤或放射线治疗等。
此外,本发明提供用于治疗与神经轴索损伤相关的疾病的药物组合物,其含有上述的通式(I)所示的环状胺衍生物或其药理学上可允许的盐、和药理学上可允许的赋形剂等。
此外,本发明提供上述的通式(I)所示的环状胺衍生物或其药理学上可允许的盐,其用于治疗与神经轴索损伤相关的疾病。
此外,本发明提供上述的通式(I)所示的环状胺衍生物或其药理学上可允许的盐用于治疗与神经轴索损伤相关的疾病的用途。
此外,本发明提供上述的通式(I)所示的环状胺衍生物或其药理学上可允许的盐在制造用于治疗与神经轴索损伤相关的疾病的药物中的用途。
此外,本发明提供治疗与神经轴索损伤相关的疾病的方法,其包括向需要治疗的患者施与治疗有效量的上述的通式(I)所示的环状胺衍生物或其药理学上可允许的盐。
此外,本发明提供治疗与神经轴索损伤相关的疾病的方法,其包括使有效量的上述的通式(I)所示的环状胺衍生物或其药理学上可允许的盐与神经细胞接触。
此外,本发明提供治疗与神经轴索损伤相关的疾病的方法,其包括将有效量的上述的通式(I)所示的环状胺衍生物或其药理学上可允许的盐向需要其的对象施与。
此外,本发明提供用于促进Advillin功能、改善肌动蛋白丝代谢转换调节异常、或促进神经轴索伸展的药物组合物,其含有上述的通式(I)所示的环状胺衍生物或其药理学上可允许的盐、和药理学上可允许的赋形剂等。
此外,本发明提供上述的通式(I)所示的环状胺衍生物或其药理学上可允许的盐,其用于促进Advillin功能、改善肌动蛋白丝代谢转换调节异常、或促进神经轴索伸展。
此外,本发明提供上述的通式(I)所示的环状胺衍生物或其药理学上可允许的盐用于促进Advillin功能、改善肌动蛋白丝代谢转换调节异常、或促进神经轴索伸展的用途。
此外,本发明提供上述的通式(I)所示的环状胺衍生物或其药理学上可允许的盐在制造用于促进Advillin功能、改善肌动蛋白丝代谢转换调节异常、或促进神经轴索伸展的药物中的用途。
此外,本发明提供促进Advillin功能、改善肌动蛋白丝代谢转换调节异常、或促进神经轴索伸展的方法,其包括向需要其的患者施与治疗有效量的上述的通式(I)所示的环状胺衍生物或其药理学上可允许的盐。
此外,本发明提供促进Advillin功能、改善肌动蛋白丝代谢转换调节异常、或促进神经轴索伸展的方法,其包括使有效量的上述的通式(I)所示的环状胺衍生物或其药理学上可允许的盐与神经细胞接触。
此外,本发明提供促进Advillin功能、改善肌动蛋白丝代谢转换调节异常、或促进神经轴索伸展的方法,其包括将有效量的上述的通式(I)所示的环状胺衍生物或其药理学上可允许的盐向需要其的对象施与。
发明的效果
根据本发明的环状胺衍生物或其药理学上可允许的盐,能够促进作为肌动蛋白丝代谢转换调节分子之一的Advillin的功能,能够用作针对与神经轴索损伤相关的疾病的药物。
本说明书包括作为本申请优先权基础的日本特许出愿第2018-243042号的说明书和/或附图中记载的内容。
附图说明
图1是示出Advillin对肌动蛋白丝的功能的图。
图2是示出实施例7的化合物对由大鼠的各组织制备得到的膜级分的特异性结合的图。
图3是示出大鼠脊神经结扎模型中的实施例7的化合物的肌动蛋白丝代谢转换调节异常的改善作用的图。
图4是以细胞形态变化形式示出诱导了神经轴索损伤的大鼠背根神经节原代培养细胞中的实施例7的化合物的神经轴索伸展作用的图像。
图5是示出诱导了神经轴索损伤的大鼠背根神经节原代培养细胞中的实施例7的化合物的神经轴索伸展促进作用的图。
具体实施方式
本说明书中使用的下述术语在没有特别说明的情况下,如下述定义所述。
本发明的一个实施方式所涉及的环状胺衍生物的特征在于,为下述的通式(I)所示。
[化3]
[式中,标记*的碳是手性碳,A表示下述通式(IIa)或(IIb)所示的基团,
[化4]
R
上述的环状胺衍生物中,A优选为通式(IIa)所示的基团,此时,R
上述的环状胺衍生物中,A优选为通式(IIb)所示的基团,此时,X优选为-N(R
上述的环状胺衍生物中,R
上述的环状胺衍生物中,标记*的手性碳的立体化学优选为S构型。
本发明的上述的环状胺衍生物所涉及的一个实施方式中,A为通式(IIa)所示的基团,R
本发明的上述的环状胺衍生物所涉及的一个实施方式中,A为通式(IIb)所示的基团,X为-N(R
本发明的上述的环状胺衍生物所涉及的一个实施方式中,A为通式(IIb)所示的基团,X为-O-,R
本发明的上述的环状胺衍生物所涉及的一个实施方式中,是选自3-羟基-3-(1-甲基-1H-咪唑-2-基)-1-(4-吗啉代哌啶-1-基)丙-1-酮、1-(4-(二甲基氨基)哌啶-1-基)-3-(1-丙基-1H-咪唑-2-基)-3-羟基丙-1-酮、1-(4-(二甲基氨基)哌啶-1-基)-3-(1-异丙基-1H-咪唑-2-基)-3-羟基丙-1-酮、3-(5-氯-1-甲基-1H-咪唑-2-基)-1-(4-(二甲基氨基)哌啶-1-基)-3-羟基丙-1-酮、1-(4-(二甲基氨基)哌啶-1-基)-3-(1-(2-甲氧基乙基)-1H-咪唑-2-基)-3-羟基丙-1-酮和1-(4-(二甲基氨基)哌啶-1-基)-3-(1-(3,3,3-三氟丙基)-1H-咪唑-2-基)-3-羟基丙-1-酮中的一种化合物。
上述的通式(I)所示的环状胺衍生物(以下称为环状胺衍生物(I))的优选的具体例示于表1和表2,但本发明不限于此。
应予说明,环状胺衍生物(I)中,存在对映异构体、立体异构体等异构体的情况下,任一种异构体和它们的混合物包括在环状胺衍生物(I)中。此外,环状胺衍生物(I)中,存在对映异构体、立体异构体等异构体的情况下,环状胺衍生物(I)可以是任一种异构体或包含它们的混合物的混合物。此外,环状胺衍生物(I)中,存在因构象而导致的异构体的情况下,任一种异构体和它们的混合物包括在环状胺衍生物(I)中。目标异构体可以通过公知的方法或以其为准的方法得到。例如,环状胺衍生物(I)中存在对映异构体的情况下,由环状胺衍生物(I)拆分的一个对映异构体也包括在环状胺衍生物(I)中。
目标对映异构体可通过公知的手段(例如使用光学活性的合成中间体、或对最终物的外消旋混合物使用公知的方法或以其为准的方法(例如光学拆分))得到。
此外,环状胺衍生物(I)中,包括环状胺衍生物(I)的前药或其药理学上可允许的盐。环状胺衍生物(I)的前药是指在生物体内以酶或化学的方式转变为环状胺衍生物(I)的化合物。环状胺衍生物(I)的前药的活性本体是环状胺衍生物(I),但环状胺衍生物(I)的前药本身也可以具有活性。
作为环状胺衍生物(I)的前药,可以举出例如环状胺衍生物(I)的羟基被烷基化、磷酸化或硼酸化而得到的化合物。这些化合物可以按照公知的方法,由环状胺衍生物(I)合成。
此外,环状胺衍生物(I)的前药可以在公知文献(“医薬品の開発(医药品的开发)”、广川书店、1990年、第7卷,p.163~198和Progress in Medicine、第5卷,1985年、p.2157~2161)中记载的生理条件下变化为环状胺衍生物(I)。
环状胺衍生物(I)可以被同位素标记,作为标记的同位素,可以举出例如
作为环状胺衍生物(I)的药理学上可允许的盐,可以举出例如盐酸盐、硫酸盐、磷酸盐或氢溴酸盐等无机酸盐或草酸盐、丙二酸盐、柠檬酸盐、富马酸盐、乳酸盐、苹果酸盐、琥珀酸盐、酒石酸盐、乙酸盐、三氟乙酸盐、马来酸盐、葡糖酸盐、苯甲酸盐、水杨酸盐、昔萘酸盐、帕莫酸盐、抗坏血酸盐、己二酸盐、甲磺酸盐、对甲苯磺酸盐或肉桂酸盐等有机酸盐。
环状胺衍生物(I)或其药理学上可允许的盐中,包括其水合物和溶剂化物。
环状胺衍生物(I)或其药理学上可允许的盐中存在多晶型的情况下,所有多晶型和它们的混合物包括在环状胺衍生物(I)或其药理学上可允许的盐中。
环状胺衍生物(I)或其药理学上可允许的盐可以按照例如公知文献(国际公开第2016/136944号)中记载的方法合成。
“Advillin”包括同工型、类似物、变体、片段或功能衍生物。Advillin是advillin基因的转录产物,有时也表示为别名p92或AVIL,是凝溶胶蛋白家族的成员之一。此外,在人中,Advillin存在两种同工型,是包含819个氨基酸或821个氨基酸的蛋白质。
“Advillin”是指如图1所示那样,作用于肌动蛋白丝,具有切断双螺旋结构的肌动蛋白丝的功能的分子。
“Advillin功能促进”是指Advillin所具有的生物学功能的维持、持续、增强和/或将降低的状态正常化。此外,Advillin功能促进中,可以举出将肌动蛋白丝代谢转换调节的异常改善和/或正常化。因此,因末梢神经的轴索损伤而导致肌动蛋白丝增加的情况下,通过Advillin功能促进,肌动蛋白丝减少,相对而言单体肌动蛋白量增加。进一步,Advillin功能促进中,还包括促进神经轴索伸展。
“Advillin复合体”是指与Advillin发生相互作用和/或结合的蛋白质等分子和Advillin形成的集合体。
环状胺衍生物(I)与Advillin和/或Advillin复合体结合可以通过例如公知文献(Aono等人,2018年、Biochemical and Biophysical Research Communications、第505卷,p.1203-1210)中记载的使用磁性微粒、即FG beads(注册商标)的亲和纯化而评价。此外,除了使用识别Advillin和/或Advillin复合体的抗体的免疫沉降法、亲和纯化之外,还可以通过利用表面等离子体共振(SPR)来分析分子的相互作用进行评价。
“肌动蛋白丝代谢转换”是指经过单体肌动蛋白的聚合与肌动蛋白丝的脱聚合的过程的双方向性的代谢转换。
“肌动蛋白丝代谢转换调节异常”是指上述的“肌动蛋白丝代谢转换”中的肌动蛋白聚合、肌动蛋白丝脱聚合的平衡崩溃,一方向性的过程变得优先。
“肌动蛋白丝代谢转换调节异常的改善”是指使上述的“肌动蛋白丝代谢转换调节异常”中的一方向性的过程优先的状态正常化或趋近正常。即,是指使肌动蛋白丝量、和肌动蛋白丝量与单体肌动蛋白量之比正常化或趋近正常。
环状胺衍生物(I)或其药理学上可允许的盐具有改善肌动蛋白丝代谢转换调节异常的作用可以通过使用细胞(例如人原代培养背根神经节神经细胞、源自大鼠和小鼠等哺乳动物的原代培养背根神经节神经细胞、源自大鼠肾上腺褐色细胞的PC12细胞或源自大鼠背根神经节神经的F11细胞等),测定细胞内的肌动蛋白丝量来进行评价。作为细胞内的肌动蛋白丝量的测定方法,例如可以通过采用与肌动蛋白丝结合的经荧光标记的鬼笔环肽的荧光染色来进行测定(Carlson等人,NeuroToxicology、2001年、第22卷,p.819-827)。
此外,“细胞内肌动蛋白丝减少作用”是指与不实施使细胞内的肌动蛋白丝量减少的措施的情况相比,使细胞内的肌动蛋白丝量减少的作用,优选为减少不实施使细胞内的肌动蛋白丝量减少的措施的情况的细胞内的肌动蛋白丝量之中的5%以上、10%以上、20%以上、30%以上、40%以上、50%以上、60%以上、70%以上、80%以上、90%以上或100%的作用。
进一步,环状胺衍生物(I)或其药理学上可允许的盐具有改善肌动蛋白丝代谢转换调节的异常的作用可以通过使用与肌动蛋白丝代谢转换调节异常相关的疾病的样品、例如神经轴索损伤患者或神经轴索损伤动物模型等的组织等,测定肌动蛋白丝量与单体肌动蛋白量之比来进行评价。作为神经轴索损伤动物模型,可以举出例如大鼠脊神经结扎模型(Kim等人,Pain、1992年、第50卷,p.355-363)。肌动蛋白丝量与单体肌动蛋白量之比可以在通过组织或细胞裂解液的超离心而将肌动蛋白丝与单体肌动蛋白分离后,对各肌动蛋白通过蛋白质印迹法进行定量而算出(Kim等人,The Journal of Physiology、2015年、第593卷,p.1873-1886)。
“神经轴索”是指从神经细胞体延伸的长突起,也被称为神经突起。神经轴索形成神经纤维。神经轴索的末端分枝而与下面的神经细胞、靶标组织接合,传导神经的兴奋。
“神经轴索损伤”是指神经轴索部分或完全破坏或断裂,从损伤部位起组织侧的轴索改性、脱落的状态。
“神经轴索伸展”是指神经细胞的轴索伸展。通过促进神经轴索伸展,能够期待神经轴索损伤后的靶标组织与神经轴索的再接合和/或将神经回路重构。
此外,作为神经轴索损伤的原因,不限于以下,可以举出例如外科手术、毒物、血液循环障碍、因交通事故等引起的外伤或放射线治疗等。
作为上述的毒物,可以举出外因性和内因性的神经毒。例如,作为外因性的毒素,可以举出河豚毒素、箭毒蛙毒素、maurotoxin、agitoxin、charybdotoxin、Margatoxin、slotoxin、scyllatoxin、hefutoxin、calciseptine、taicatoxin或calcicludine等。作为内因性的毒素,可以举出谷氨酸、N-甲基-D-天冬氨酸(NMDA)或红藻氨酸等。此外,可以举出气体(例如一氧化碳)、金属(例如汞)、甲醇或乙醇等。此外,还可以举出除草剂、杀虫剂等农药(例如鱼藤酮或百草枯等)作为毒物。进一步,在日本毒物和剧毒物取缔法中,作为对人体有害的毒物,公开了毒物和剧毒物的列表,还可以举出这些中记载的毒物。
作为与神经轴索损伤相关的疾病(包括成为原因的疾病),不限于以下,可以举出例如腕管综合征、旋前圆肌综合症、前骨间神经麻痹、尺骨神经管综合征(Guyon管综合征)、肘管综合征、后骨间神经麻痹、桡骨神经麻痹、胸腔出口综合征、腋窝神经麻痹、肩胛上神经麻痹、梨状肌综合征、腰神经丛麻痹、跗管综合征、大腿神经麻痹、坐骨神经麻痹、胫骨神经麻痹、总腓骨神经麻痹、深腓骨神经麻痹(前跗管综合征)、隐神经麻痹(Hunter氏管综合征)、颈椎管狭窄症、腰椎管狭窄症、面神经麻痹、动眼神经麻痹、滑车神经麻痹、外展神经麻痹、巨细胞血管炎、高安动脉炎、结节性多发动脉炎、川崎病、肉芽肿性多血管炎(Wegener肉芽肿症)、显微镜下多血管炎、嗜酸性肉芽肿性多血管炎(过敏性肉芽肿性血管炎、Churg‐Strauss综合征)、冷球蛋白血症、IgA血管炎(Henoch-Schönlein紫癜)、皮肤白细胞破碎性血管炎、全身性红斑狼疮、干燥综合征、类风湿性关节炎、混合性结缔组织病、多发性肌炎、皮肌炎、硬皮病、Behcet病、贝尔氏面瘫、亨特式综合征、细菌・病毒感染症(莱姆病、HIV感染症或麻风病等)、结节病、恶性肿瘤等。
环状胺衍生物(I)或其药理学上可允许的盐具有神经轴索伸展促进作用可通过使用人神经细胞的轴索受损伤的组织、神经轴索损伤动物模型或神经细胞(例如源自大脑皮质的神经细胞或源自背根神经节的细胞等),测定伸展的神经突起的长度或密度等来进行评价(Yang等人,Free Radical Biology and Medicine,2018年,第120卷,p.13-24)。
环状胺衍生物(I)或其药理学上可允许的盐可以被用作治疗或预防哺乳动物(例如小鼠、大鼠、仓鼠、兔、猫、狗、牛、山羊、猴或人)、特别是人的神经轴索损伤的药物。
在将环状胺衍生物(I)或其药理学上可允许的盐用作药物的情况下,可以将环状胺衍生物(I)或其药理学上可允许的盐直接或配合作为药物可允许的载体,经口或非经口地施与。
作为将含有环状胺衍生物(I)或其药理学上可允许的盐作为有效成分的药物经口施与的情况的剂型,可以举出例如片剂(包括糖衣片和膜包衣片)、丸剂、颗粒剂、散剂、胶囊剂(包括软胶囊剂和微胶囊剂)、糖浆剂、乳剂或混悬剂。此外,作为将含有环状胺衍生物(I)或其药理学上可允许的盐作为有效成分的药物非经口施与的情况的剂型,可以举出例如注射剂、注入剂、点滴剂、栓剂、涂布剂或贴剂。进一步,将环状胺衍生物(I)或其药理学上可允许的盐与适当的基剂(例如丁酸的聚合物、乙醇酸的聚合物、丁酸-乙醇酸的共聚物、丁酸的聚合物与乙醇酸的聚合物的混合物或聚甘油脂肪酸酯)组合,制成缓释性制剂也是有效的。
上述的剂型的制剂的制备可以按照在制剂领域中一般使用的公知的制造方法来进行。在该情况下,根据需要,可以含有制剂领域中一般使用的赋形剂、粘合剂、润滑剂、崩解剂、甜味剂、表面活性剂、悬浮剂或乳化剂等而制造。
片剂的制备可以例如含有赋形剂、粘合剂、崩解剂或润滑剂而进行。丸剂和颗粒剂的制备可以例如含有赋形剂、粘合剂或崩解剂而进行。此外,散剂和胶囊剂的制备可以例如含有赋形剂而进行。糖浆剂的制备可以例如含有甜味剂而进行。乳剂或混悬剂的制备可以例如含有表面活性剂、悬浮剂或乳化剂而进行。
作为赋形剂,可以举出例如乳糖、葡萄糖、淀粉、蔗糖、微晶纤维素、甘草末、甘露醇、碳酸氢钠、磷酸钙或硫酸钙。
作为粘合剂,可以举出例如淀粉糊液、阿拉伯胶液、明胶液、黄蓍胶液、羧基甲基纤维素液、藻酸钠液或丙三醇。
作为崩解剂,可以举出例如淀粉或碳酸钙。
作为润滑剂,可以举出例如硬脂酸镁、硬脂酸、硬脂酸钙或精制滑石。
作为甜味剂,可以举出例如葡萄糖、果糖、转化糖、山梨糖醇、木糖醇、丙三醇或单糖浆。
作为表面活性剂,可以举出例如月桂基硫酸钠、聚山梨酯80、脱水山梨糖醇单脂肪酸酯或聚乙二醇40硬脂酸酯。
作为悬浮剂,可以举出例如阿拉伯胶、藻酸钠、羧基甲基纤维素钠、甲基纤维素或膨润土。
作为乳化剂,可以举出例如阿拉伯胶、黄蓍胶、明胶或聚山梨酯80。
进一步,将含有环状胺衍生物(I)或其药理学上可允许的盐作为有效成分的药物制备为上述的剂型的情况下,可以添加在制剂领域中一般使用的着色剂、保存剂、芳香剂、矫味剂、稳定剂或增稠剂等。
含有环状胺衍生物(I)或其药理学上可允许的盐作为有效成分的药物的平均1日的施与量根据患者的状态或体重、化合物的种类或施与途径等而不同,例如在向成人(体重约60kg)经口施与的情况下,优选将环状胺衍生物(I)或其药理学上可允许的盐以有效成分量计在1~1000mg的范围内分为1~3次施与,向成人(体重约60kg)非经口给与的情况下,如果是注射剂,则优选将环状胺衍生物(I)或其药理学上可允许的盐以有效成分量计在平均1kg体重0.01~100mg的范围内通过静脉注射施与。
环状胺衍生物(I)或其药理学上可允许的盐为了补充或增强治疗或预防效果、或者减少施与量,也可以与其它药剂适量配合或并用。环状胺衍生物(I)或其药理学上可允许的盐可以与其它药剂同时施与,也可以按照任意顺序连续施与。作为其它药剂,不仅限于此,也可以与治疗神经轴索损伤的药剂并用。
实施例
以下,使用实施例、比较例和参考例详细说明本发明,但本发明不限于这些。
以下的记载中,NMR数据中所示的溶剂名示出测定中使用的溶剂。此外,400 MHzNMR谱使用JNM-AL400型核磁共振装置(日本电子公司制)而测定。化学位移以四甲基硅烷作为基准,用δ(单位:ppm)表示,信号各自用s(单峰)、d(二重峰)、t(三重峰)、q(四重峰)、quint(五重峰)、sept(七重峰)、m(多重峰)、br(宽峰)、dd(双二重峰)、dt(双三重峰)、ddd(三二重峰)、dq(双四重峰)、td(三双重峰)、tt(三重三重峰)表示。ESI-MS谱使用AgilentTechnologies 1200 Series、G6130A(AgilentTechnology公司制)测定。溶剂全部使用市售的物质。快速柱色谱使用YFLC W-prep2XY(山善公司制)。
环状胺衍生物(I)的原料和中间体通过以下的参考例中记载的方法合成。应予说明,针对参考例化合物的合成中使用的化合物中未记载合成法的物质,使用市售的化合物。
(参考例1)(S)-2-(3-(4-(二甲基氨基)哌啶-1-基)-1-(1-甲基-1H-咪唑-2-基)-3-氧代丙氧基)乙酸苯甲酯的合成:
[化5]
向(S)-1-(4-(二甲基氨基)哌啶-1-基)-3-羟基-3-(1-甲基-1H-咪唑-2-基)丙-1-酮(0.100g、0.357mmol)的四氢呋喃(0.800mL)溶液中在0℃下添加氢化钠(55%、0.0202mg、0.464mmol)。在该温度下搅拌10分钟后,向反应液中添加溴乙酸苯甲酯(0.0620mL、0.390mmol),在室温下进一步搅拌15小时。向反应液中添加氯化铵水溶液,用氯仿萃取。将有机层用10%氯化钠水溶液洗涤后,用无水硫酸钠干燥,过滤,将滤液减压浓缩。将残渣用快速柱色谱(NH硅胶、氯仿/甲醇)纯化,得到(S)-2-(3-(4-(二甲基氨基)哌啶-1-基)-1-(1-甲基-1H-咪唑-2-基)-3-氧代丙氧基)乙酸苯甲酯(0.568g、0.133mmol、37%),为无色油状物。
(参考例2)1-甲基-1H-咪唑-2-甲酸乙酯的合成:
[化6]
向1-甲基-1H-咪唑(1.00g、12.2mmol)的乙腈(4.0mL)溶液中,在0℃下添加三乙基胺(3.40mL、24.4mmol)、氯甲酸乙酯(2.34mL、24.4mmol),将反应液在室温下进行16小时搅拌。将反应液进行硅藻土过滤,将滤液减压浓缩。将残渣用快速色谱(硅胶、己烷/乙酸乙酯)纯化,得到1-甲基-1H-咪唑-2-甲酸乙酯(1.50g、9.73mmol、80%),为白色固体。
(参考例3) 3-(1-甲基-1H-咪唑-2-基)-3-氧代丙酸乙酯的合成:
[化7]
向1-甲基-1H-咪唑-2-甲酸乙酯(1.50g、9.73mmol)的甲醇(15.0mL)溶液中,在室温下添加氢氧化钠水溶液(1.0N、14.6mL、14.6mmol),将反应液在相同温度下搅拌3小时。将反应液冷却至0℃。向反应液中添加盐酸(1.0N)而中和后,减压浓缩。用甲苯共沸,添加乙醇。将析出物进行硅藻土过滤,将滤液减压浓缩。向所得粗产物中在室温下添加乙腈(7.0mL)、羰基二咪唑(1.54g、9.52mmol),将反应液在相同温度下搅拌2.5小时(反应液A)。另外,将氯化镁(0.997g、10.5mmol)溶解在乙腈(7.0mL)中,在室温下添加丙二酸乙酯钾盐(1.70g、9.99mmol)、三乙基胺(2.98mL、21.4mmol),将反应液在相同温度下搅拌2.5小时(反应液B)。将反应液A在室温下添加到反应液B中,将反应液在80℃下搅拌2小时。将反应液冷却至室温。向反应液中添加盐酸(1.0N)后,用乙酸乙酯萃取。将有机层用10%氯化钠水溶液洗涤后、用无水硫酸钠干燥,过滤,将滤液减压浓缩。将残渣用快速色谱(硅胶、己烷/乙酸乙酯)纯化,得到3-(1-甲基-1H-咪唑-2-基)-3-氧代丙酸乙酯(0.721g、3.67mmol、38%),为白色固体。
(参考例4) 4-(吗啉-4-基)哌啶的合成:
[化8]
向1-叔丁氧基羰基-4-哌啶酮(1.51g、7.58mmol)的二氯甲烷(25.0mL)溶液中,在0℃下添加吗啉(0.792g、9.09mmol)、三乙酰氧基硼氢化钠(1.93g、9.09mmol)和乙酸(0.0460g、0.758mmol),在室温下进行16小时搅拌。将反应液冷却至0℃。向反应液中添加饱和碳酸氢钠水溶液,用二氯甲烷萃取。将有机层用无水硫酸钠干燥,过滤,将滤液减压浓缩。将残渣溶解在盐酸(1.0N)中,用乙酸乙酯萃取。向水层中添加48%氢氧化钠水溶液,制成碱性后,用二氯甲烷萃取。将有机层用无水硫酸钠干燥,过滤,将滤液减压浓缩。将残渣溶解在甲醇(25.0mL)中,添加浓盐酸(5.0mL)后,在40℃下搅拌12小时。将反应液进行浓缩干固后,溶解在蒸馏水中。添加48%氢氧化钠水溶液,制成碱性后,用二氯甲烷萃取。将有机层用无水硫酸钠干燥,过滤,将滤液减压浓缩。得到4-(吗啉-4-基)哌啶(1.52g、5.63mmol、74%),为黄色固体。
(参考例5)1-(1-甲基-1H-咪唑-2-基)-3-(4-吗啉代哌啶-1-基)丙-1,3-二酮的合成:
[化9]
向3-(1-甲基-1H-咪唑-2-基)-3-氧代丙酸乙酯(0.200g、1.02mmol)的甲苯(0.460mL)溶液中,在室温下添加4-(吗啉-4-基)哌啶(0.158g、0.928mmol),将反应液在110℃下进行16小时搅拌。将反应液进行减压浓缩。将残渣用快速色谱(硅胶、氯仿/甲醇)纯化,得到1-(1-甲基-1H-咪唑-2-基)-3-(4-吗啉代哌啶-1-基)丙-1,3-二酮(0.285g、0.890mmol、96%),为无色油状物。
(参考例6)1-丙基-1H-咪唑-2-甲醛的合成:
[化10]
向1H-咪唑-2-甲醛(1.00g、10.4mmol)的N,N-二甲基甲酰胺(10.0mL)溶液中,添加1-碘丙烷(1.22mL、12.5mmol)和碳酸钾(2.16g、15.6mmol),在60℃下搅拌3小时。向反应液中添加水,用乙酸乙酯萃取。将有机层用10%氯化钠水溶液洗涤后,用无水硫酸钠干燥,过滤,将滤液减压浓缩。将残渣用快速柱色谱(硅胶、己烷/乙酸乙酯)纯化,得到1-丙基-1H-咪唑-2-甲醛(0.786g、5.69mmol、55%),为黄色油状物。
(参考例7)1-异丙基-1H-咪唑-2-甲醛的合成:
[化11]
向1H-咪唑-2-甲醛(1.00g、10.4mmol)的N,N-二甲基甲酰胺(10mL)溶液中,添加2-碘丙烷(1.26mL、12.5mmol)和碳酸钾(2.16g、15.6mmol),在60℃下搅拌3小时。向反应液中添加水,用乙酸乙酯萃取。将有机层用10%氯化钠水溶液洗涤后,用无水硫酸钠干燥,过滤,将滤液减压浓缩。将残渣用快速柱色谱(硅胶、己烷/乙酸乙酯)纯化,得到1-异丙基-1H-咪唑-2-甲醛(0.703g、5.09mmol、49%),为黄色油状物。
(参考例8)5-氯-1-甲基-1H-咪唑-2-甲醛的合成:
[化12]
向(5-氯-1-甲基-1H-咪唑-2-基)甲醇(0.300g、2.05mmol)的二氯甲烷(20.0mL)溶液中,在0℃下添加Dess-Martin试剂(1.04g、2.46mmol),在该温度下搅拌3小时。向反应液中添加10%硫代硫酸钠水溶液和饱和碳酸氢钠水溶液,用氯仿萃取。将有机层用10%氯化钠水溶液洗涤后,用无水硫酸钠干燥,过滤,将滤液减压浓缩。将残渣用快速柱色谱(硅胶、己烷/乙酸乙酯)纯化,得到5-氯-1-甲基-1H-咪唑-2-甲醛(0.235g、1.62mmol、79%),为白色固体。
(参考例9)1-(2-甲氧基乙基)-1H-咪唑-2-甲醛的合成:
[化13]
向1H-咪唑-2-甲醛(1.00g、10.4mmol)的N,N-二甲基甲酰胺(10.0mL)溶液中,添加2-溴乙基甲基醚(1.20mL、12.5mmol)和碳酸钾(2.16g、15.6mmol)、碘化钠(0.468g、3.12mmol),在60℃下搅拌3小时。向反应液中添加水,用乙酸乙酯萃取。将有机层用10%氯化钠水溶液洗涤后,用无水硫酸钠干燥,过滤,将滤液减压浓缩。将残渣用快速柱色谱(硅胶、己烷/乙酸乙酯)纯化,得到1-(2-甲氧基乙基)-1H-咪唑-2-甲醛(0.535g、3.47mmol、33%),为白色固体。
(参考例10)1-(3,3,3-三氟丙基)-1H-咪唑-2-甲醛的合成:
[化14]
向1H-咪唑-2-甲醛(0.500g、5.20mmol)的N,N-二甲基甲酰胺(5.20mL)溶液中,添加1,1,1-三氟-3-碘丙烷(0.710mL、6.24mmol)和碳酸钾(1.08g、7.81mmol),在60℃下搅拌5小时。向反应液中添加水,用乙酸乙酯萃取。将有机层用10%氯化钠水溶液洗涤后,用无水硫酸钠干燥,过滤,将滤液减压浓缩。将残渣用快速柱色谱(硅胶、己烷/乙酸乙酯)纯化,得到1-(3,3,3-三氟丙基)-1H-咪唑-2-甲醛(0.0863g、0.449mmol、8.6%),为无色油状物。
(参考例11)1-(4-(二甲基氨基)哌啶-1-基)乙酮的合成:
[化15]
向4-二甲基氨基哌啶(1.00g、7.79mmol)的二氯甲烷(7.8mL)溶液中,在0℃下添加吡啶(0.922mL、9.75mmol)和乙酸酐(0.946mL、11.7mmol),将反应液在室温下搅拌16小时。向反应液中添加饱和碳酸氢钠水溶液,用氯仿萃取。将有机层用10%氯化钠水溶液洗涤后,用无水硫酸钠干燥,过滤,将滤液减压浓缩。将残渣用快速柱色谱(NH硅胶、氯仿/甲醇)纯化,得到1-(4-(二甲基氨基)哌啶-1-基)乙酮(0.869g、6.78mmol、87%),为无色油状物。
(参考例12)4-(1-甲基哌嗪-4-基)哌啶的合成:
[化16]
向1-叔丁氧基羰基-4-哌啶酮(1.50g、7.53mmol)的二氯甲烷(25.0mL)溶液中,在0℃下添加1-甲基哌嗪(0.905g、9.03mmol)、乙酸(0.497g、8.28mmol)和三乙酰氧基硼氢化钠(1.92g、9.03mmol),将反应液在室温下搅拌16小时。将反应液冷却至0℃。向反应液中添加饱和碳酸氢钠水溶液,用二氯甲烷萃取。将有机层用用无水硫酸钠干燥,过滤,将滤液减压浓缩。将残渣溶解在盐酸(1.0N)中,用乙酸乙酯萃取。向水层中添加48%氢氧化钠水溶液,制成碱性后,用二氯甲烷萃取。将有机层用用无水硫酸钠干燥,过滤,将滤液减压浓缩。将残渣溶解在甲醇(25.0mL)中,添加浓盐酸(5.0mL)后,在40℃下搅拌12小时。将反应液进行减压浓缩后,溶解在蒸馏水中。添加48%氢氧化钠水溶液,制成碱性后,用二氯甲烷萃取。将有机层用无水硫酸钠干燥,过滤,将滤液减压浓缩,得到4-(1-甲基哌嗪-4-基)哌啶(0.826g、4.51mmol、60%),为白色固体。
(参考例13)粗4-二乙基氨基哌啶的合成:
[化17]
向4-氧代哌啶-1-甲酸苯甲酯(0.500g、2.14mmol)的二氯甲烷(12.0mL)溶液中,在0℃下添加二乙基胺(0.276mL、2.68mmol)、乙酸(0.0120mL、0.214mmol)和三乙酰氧基硼氢化钠(0.681g、3.22mmol),将反应液在室温下进行16小时搅拌。将反应液冷却至0℃。向反应液中添加饱和碳酸氢钠水溶液,用氯仿萃取。将有机层用无水硫酸钠干燥,过滤,将滤液减压浓缩。将残渣用快速柱色谱(NH硅胶、氯仿/甲醇)纯化。将所得粗纯化物溶解于甲醇(8.0mL)中,在室温下添加钯/碳(10%wet、0.180g、0.169mmol),在氢气氛围下搅拌16小时。将反应液进行硅藻土过滤,将滤液减压浓缩,得到4-二乙基氨基哌啶的粗产物。
(参考例14)1-(4-(二甲基氨基)哌啶-1-基)-3-(1-甲基-1H-咪唑-2-基)丙-1,3-二酮的合成:
[化18]
向1-(4-(二甲基氨基)哌啶-1-基)乙酮(1.00g、5.87mmol)的四氢呋喃(20mL)溶液中,在-78℃下滴加二异丙基氨基锂的四氢呋喃溶液(2.0M、7.05mL、14.1mmol),在相同温度下搅拌1小时。向反应液中在相同温度下添加1-甲基-1H-咪唑-2-甲酸乙酯(1.09g、7.05mmol)的四氢呋喃溶液(9.0mL),搅拌1小时后,在0℃下进一步搅拌1小时。向反应液中按顺序添加饱和氯化铵水溶液、碳酸钾水溶液,用氯仿萃取。将有机层用10%氯化钠水溶液洗涤后,用无水硫酸钠干燥,过滤,将滤液减压浓缩。将残渣用快速柱色谱(NH硅胶、己烷/乙酸乙酯)纯化,得到1-(4-(二甲基氨基)哌啶-1-基)-3-(1-甲基-1H-咪唑-2-基)丙-1,3-二酮(0.990g、3.56mmol、61%),为无色油状物。
(参考例15)1-(1-甲基-1H-咪唑-2-基)-3-(4-(4-甲基哌嗪-1-基)哌啶-1-基)丙-1,3-二酮的合成:
[化19]
向3-(1-甲基-1H-咪唑-2-基)-3-氧代丙酸乙酯(0.200g、1.02mmol)的甲苯(0.46mL)溶液中,在室温下添加4-(1-甲基哌嗪-4-基)哌啶(0.170g、0.927mmol),将反应液在110℃下搅拌16小时。将反应液进行减压浓缩。将残渣用快速柱色谱(NH硅胶、氯仿/甲醇)纯化,得到1-(1-甲基-1H-咪唑-2-基)-3-(4-(4-甲基哌嗪-1-基)哌啶-1-基)丙-1,3-二酮(0.290g、0.870mmol、94%),为无色油状物。
(参考例16)1-(4-(二乙基氨基)哌啶-1-基)-3-(1-甲基-1H-咪唑-2-基)丙-1,3-二酮的合成:
[化20]
向3-(1-甲基-1H-咪唑-2-基)-3-氧代丙酸乙酯(0.150g、0.765mmol)的甲苯(0.38mL)溶液中,在室温下添加粗4-二乙基氨基哌啶(0.143g、0.917mmol),将反应液在110℃下搅拌10小时。将反应液减压浓缩。将残渣用快速柱色谱(NH硅胶、氯仿/甲醇)纯化,得到1-(4-(二乙基氨基)哌啶-1-基)-3-(1-甲基-1H-咪唑-2-基)丙-1,3-二酮(0.0750g、0.245mmol、32%),为无色油状物。
(参考例17)1-(4-(二甲基氨基)哌啶-1-基)-3-羟基-3-(1-甲基-1H-咪唑-2-基)丙-1-酮的合成:
[化21]
向1-(4-(二甲基氨基)哌啶-1-基)乙酮(0.0500g、0.294mmol)的四氢呋喃(0.8mL)溶液中,在-78℃下滴加二异丙基氨基锂的四氢呋喃溶液(2.0M、0.162mL、0.323mmol),在相同温度下搅拌1小时。向反应液中在相同温度下添加1-甲基-1H-咪唑-2-甲醛(0.0390g、0.352mmol)的四氢呋喃溶液(0.4mL),搅拌1小时后,在0℃下进一步搅拌1小时。向反应液中按顺序添加饱和氯化铵水溶液、碳酸钾水溶液,用氯仿萃取。将有机层用10%氯化钠水溶液洗涤后,用无水硫酸钠干燥,过滤,将滤液减压浓缩。将残渣用快速柱色谱(硅胶、氯仿/甲醇)纯化,得到1-(4-(二甲基氨基)哌啶-1-基)-3-羟基-3-(1-甲基-1H-咪唑-2-基)丙-1-酮(0.0220g、0.0785mmol、27%),为无色油状物。
(实施例1)3-羟基-3-(1-甲基-1H-咪唑-2-基)-1-(4-吗啉代哌啶-1-基)丙-1-酮的合成:
[化22]
向1-(1-甲基-1H-咪唑-2-基)-3-(4-吗啉代哌啶-1-基)丙-1,3-二酮(0.285g、0.890mmol)的甲醇(4.50mL)溶液中,在室温下添加硼氢化钠(0.0370g、0.979mmol),将反应液在相同温度下搅拌3小时。向反应液中添加饱和碳酸氢钠水溶液,减压浓缩。向残渣中添加蒸馏水,用氯仿萃取。将有机层用10%氯化钠水溶液洗涤后、用无水硫酸钠干燥,过滤,将滤液减压浓缩。将残渣用快速色谱(硅胶、氯仿/甲醇)纯化,得到3-羟基-3-(1-甲基-1H-咪唑-2-基)-1-(4-吗啉代哌啶-1-基)丙-1-酮(0.0711g、0.221mmol、25%)(以下称为实施例1的化合物),为无色油状物。
(实施例2)1-(4-(二甲基氨基)哌啶-1-基)-3-(1-丙基-1H-咪唑-2-基)-3-羟基丙-1-酮的合成:
[化23]
向1-(4-二甲基氨基哌啶-1-基)乙酮(0.300g、1.76mmol)的四氢呋喃(6.00mL)溶液中,在-78℃下滴加二异丙基氨基锂的四氢呋喃溶液(2.0M、0.969mL、1.94mmol),在相同温度下搅拌1小时。向反应液中在相同温度下添加1-丙基-1H-咪唑-2-甲醛(0.292g、2.12mmol)的四氢呋喃溶液(2.8mL),搅拌1小时后,在0℃下进一步搅拌1小时。向反应液中按顺序添加饱和氯化铵水溶液、碳酸钾水溶液,用氯仿萃取。将有机层用10%氯化钠水溶液洗涤后,用无水硫酸钠干燥,过滤,将滤液减压浓缩。将残渣用快速柱色谱(NH硅胶、氯仿/甲醇)纯化,得到1-(4-(二甲基氨基)哌啶-1-基)-3-(1-丙基-1H-咪唑-2-基)-3-羟基丙-1-酮(0.296g、0.960mmol、55%)(以下称为实施例2的化合物),为无色油状物。
(实施例3)1-(4-(二甲基氨基)哌啶-1-基)-3-(1-异丙基-1H-咪唑-2-基)-3-羟基丙-1-酮的合成:
[化24]
向1-(4-二甲基氨基哌啶-1-基)乙酮(0.300g、1.76mmol)的四氢呋喃(6.00mL)溶液中,在-78℃下滴加二异丙基氨基锂的四氢呋喃溶液(2.0M、0.969mL、1.94mmol),在相同温度下搅拌1小时。向反应液中在相同温度下添加1-异丙基-1H-咪唑-2-甲醛(0.292g、2.12mmol)的四氢呋喃溶液(2.8mL),搅拌1小时后,在0℃下进一步搅拌1小时。向反应液中按顺序添加饱和氯化铵水溶液、碳酸钾水溶液,用氯仿萃取。将有机层用10%氯化钠水溶液洗涤后,用无水硫酸钠干燥,过滤,将滤液减压浓缩。将残渣用快速柱色谱(NH硅胶、氯仿/甲醇)纯化,得到1-(4-(二甲基氨基)哌啶-1-基)-3-(1-异丙基-1H-咪唑-2-基)-3-羟基丙-1-酮(0.302g、0.979mmol、56%)(以下称为实施例3的化合物),为无色油状物。
(实施例4)3-(5-氯-1-甲基-1H-咪唑-2-基)-1-(4-(二甲基氨基)哌啶-1-基)-3-羟基丙-1-酮的合成:
[化25]
向1-(4-二甲基氨基哌啶-1-基)乙酮(0.231g、1.36mmol)的四氢呋喃(5.10mL)溶液中,在-78℃下滴加二异丙基氨基锂的四氢呋喃溶液(2.0M、0.745mL、1.49mmol),在相同温度下搅拌1小时。向反应液中在相同温度下添加5-氯-1-甲基-1H-咪唑-2-甲醛(0.235g、1.63mmol)的四氢呋喃溶液(1.70mL),搅拌1小时后,在0℃下进一步搅拌1小时。向反应液中按顺序添加饱和氯化铵水溶液、碳酸钾水溶液,用氯仿萃取。将有机层用10%氯化钠水溶液洗涤后,用无水硫酸钠干燥,过滤,将滤液减压浓缩。将残渣用快速柱色谱(NH硅胶、氯仿/甲醇)纯化,得到3-(5-氯-1-甲基-1H-咪唑-2-基)-1-(4-(二甲基氨基)哌啶-1-基)-3-羟基丙-1-酮(0.159g、0.505mmol、37%)(以下称为实施例4的化合物),为无色油状物。
(实施例5)1-(4-(二甲基氨基)哌啶-1-基)-3-(1-(2-甲氧基乙基)-1H-咪唑-2-基)-3-羟基丙-1-酮的合成:
[化26]
向1-(4-二甲基氨基哌啶-1-基)乙酮(0.300g、1.76mmol)的四氢呋喃(6.00mL)溶液中,在-78℃下滴加二异丙基氨基锂的四氢呋喃溶液(2.0M、0.969mL、1.94mmol),在相同温度下搅拌1小时。向反应液中在相同温度下添加1-(2-甲氧基乙基)-1H-咪唑-2-甲醛(0.292g、2.12mmol)的四氢呋喃溶液(2.80mL),搅拌1小时后,在0℃下进一步搅拌1小时。向反应液中按顺序添加饱和氯化铵水溶液、碳酸钾水溶液,用氯仿萃取。将有机层用10%氯化钠水溶液洗涤后,用无水硫酸钠干燥,过滤,将滤液减压浓缩。将残渣用快速柱色谱(NH硅胶、氯仿/甲醇)纯化,得到1-(4-(二甲基氨基)哌啶-1-基)-3-(1-(2-甲氧基乙基)-1H-咪唑-2-基)-3-羟基丙-1-酮(0.193g、0.594mmol、34%)(以下称为实施例5的化合物),为无色油状物。
(实施例6)1-(4-(二甲基氨基)哌啶-1-基)-3-(1-(3,3,3-三氟丙基)-1H-咪唑-2-基)-3-羟基丙-1-酮的合成:
[化27]
向1-(4-二甲基氨基哌啶-1-基)乙酮(0.0760g、0.448mmol)的四氢呋喃(1.80mL)溶液中,在-78℃下滴加二异丙基氨基锂的四氢呋喃溶液(2.0M、0.246mL、0.492mmol),在相同温度下搅拌1小时。向反应液中在相同温度下添加1-(3,3,3-三氟丙基)-1H-咪唑-2-甲醛(0.0860g、0.448mmol)的四氢呋喃溶液(0.70mL),搅拌1小时后,在0℃下进一步搅拌1小时。向反应液中按顺序添加饱和氯化铵水溶液、碳酸钾水溶液,用氯仿萃取。将有机层用10%氯化钠水溶液洗涤后,用无水硫酸钠干燥,过滤,将滤液减压浓缩。将残渣用快速柱色谱(NH硅胶、氯仿/甲醇)纯化,得到1-(4-(二甲基氨基)哌啶-1-基)-3-(1-(3,3,3-三氟丙基)-1H-咪唑-2-基)-3-羟基丙-1-酮(0.0845g、0.233mmol、52%)(以下称为实施例6的化合物),为无色油状物。
(实施例7)(S)-1-(4-(二甲基氨基)哌啶-1-基)-3-羟基-3-(1-甲基-1H-咪唑-2-基)丙-1-酮的合成:
[化28]
将1-(4-(二甲基氨基)哌啶-1-基)-3-羟基-3-(1-甲基-1H-咪唑-2-基)丙-1-酮(3.32g)用HPLC纯化光学拆分,将洗脱液减压浓缩。将残渣用快速柱色谱(NH硅胶、氯仿/甲醇)纯化,得到(S)-1-(4-(二甲基氨基)哌啶-1-基)-3-羟基-3-(1-甲基-1H-咪唑-2-基)丙-1-酮(0.467g、>99%ee)(以下称为实施例7的化合物),为白色固体。
HPLC保持时间:8.4min,机器:株式会社岛津制作所制LC-10ADvp系统,柱:CHIRALCEL OZ-H、4.6×250mm(株式会社Daicel制),溶剂:含0.01%乙二胺的甲醇(v/v),流量:0.5mL/min,检测法:UV220nm,柱温度:40℃.
(实施例8)3-羟基-3-(1-甲基-1H-咪唑-2-基)-1-(4-(4-甲基哌嗪-1-基)哌啶-1-基)丙-1-酮的合成:
[化29]
向1-(1-甲基-1H-咪唑-2-基)-3-(4-(4-甲基哌嗪-1-基)哌啶-1-基)丙-1,3-二酮(0.290g、0.870mmol)的甲醇(4.4mL)溶液中,在室温下添加硼氢化钠(0.0360g、0.957mmol),将反应液在相同温度下搅拌3小时。向反应液中添加饱和碳酸氢钠水溶液,减压浓缩。向残渣中添加蒸馏水,用氯仿萃取。将有机层用10%氯化钠水溶液洗涤后、用无水硫酸钠干燥,过滤,将滤液减压浓缩。将残渣用快速柱色谱(NH硅胶、氯仿/甲醇)纯化,得到3-羟基-3-(1-甲基-1H-咪唑-2-基)-1-(4-(4-甲基哌嗪-1-基)哌啶-1-基)丙-1-酮(0.140g、0.417mmol、48%)(以下称为实施例8的化合物),为无色油状物。
(实施例9)1-(4-(二乙基氨基)哌啶-1-基)-3-羟基-3-(1-甲基-1H-咪唑-2-基)丙-1-酮的合成:
[化30]
向1-(4-(二乙基氨基)哌啶-1-基)-3-(1-甲基-1H-咪唑-2-基)丙-1,3-二酮(0.0800g、0.261mmol)的甲醇(1.3mL)溶液中,在室温下添加硼氢化钠(0.0109g、0.287mmol),将反应液在相同温度下搅拌3小时。向反应液中添加饱和碳酸氢钠水溶液,减压浓缩。向残渣中添加蒸馏水,用氯仿萃取。将有机层用10%氯化钠水溶液洗涤后、用无水硫酸钠干燥,过滤,将滤液减压浓缩。将残渣用快速柱色谱(NH硅胶、氯仿/甲醇)纯化,得到1-(4-(二乙基氨基)哌啶-1-基)-3-羟基-3-(1-甲基-1H-咪唑-2-基)丙-1-酮(0.0561g、0.182mmol、70%)(以下称为实施例9的化合物),为无色油状物。
(实施例10)环状胺衍生物(I)对由大鼠的各组织制备得到的膜级分的结合评价:
通过评价被
作为环状胺衍生物(I),使用实施例7的化合物。
使用7周龄雄性SD大鼠(日本Charles river株式会社制)。将大鼠用异氟烷麻醉,使用内壁用肝素钠注射液(エイワイファーマ株式会社制)处理了的注射器,由腹主动脉放血致死。放血致死后60分钟以内,摘除大脑、小脑、脑干、脑干、脊髄、背根神经节、坐骨神经、皮肤、心脏、肌肉、肝脏、肾脏和小肠。大脑采集两侧的大脑半球。小脑由全脑采集。脑干采集从全脑中去除大脑和小脑得到的部分。脊髄摘除胸髄和腰髄的一部分,剥离硬膜,去除残余的神经根而采集。背根神经节采集两侧的腰部神经節(L3~L6)。坐骨神经摘出两侧的坐骨神经,去除脂肪等附着组织而采集。皮肤采集前后肢足跖部的皮肤的一部分。心脏采集摘除的全量。肌肉采集大腿四头肌的一部分。肝脏采集外侧左叶。肾脏采集摘除的全量。小肠将内容物洗涤,采集十二指肠和空肠周边部约5cm。采集的组织立刻用干冰冷冻,在-80℃下保存。背根神经节、坐骨神经、肌肉和皮肤将由10只个体采集的组织混合,当作1个样品处理。其它的组织将由3只采集的组织混合,当作1个样品处理。
向采集的组织中,添加匀浆缓冲液(蔗糖(1M)、Tris-HCl(0.5M)和1×蛋白酶抑制剂混合液( Sigma Aldrich公司制)、pH7.6),使用匀浆器,制备各组织的匀浆试样。将各匀浆试样在1000×g、4℃下离心10分钟,去除未裂解组织。将上清液在10万×g、4℃下超离心60分钟,将所得沉淀用Krebs-Ringer碳酸氢盐缓冲液( Sigma Aldrich公司制)悬浮,用BCA蛋白质测定试剂盒(Thermo Fisher Scientific公司制)对蛋白质量进行定量。
膜级分与被
对上述的样品A组和B组,添加包含辛基-β-D-硫代吡喃葡萄糖苷(0.4%(w/v))的被
由大鼠的各组织制备得到的膜级分与被
其结果是,实施例7的化合物对由各组织制备得到的膜级分的特异性结合在由背根神经节制备得到的膜级分中是显著的。接着,由坐骨神经制备得到的膜级分的特异性结合是由背根神经节制备得到的膜级分的特异性结合的42%。由脊髄制备得到的膜级分的特异性结合是由背根神经节制备得到的膜级分的特异性结合的23%。由脑干制备得到的膜级分的特异性结合是由背根神经节制备得到的膜级分的特异性结合的4.2%,由包含脑的其它组织制备得到的膜级分的特异性结合是由背根神经节制备得到的膜级分的特异性结合的低于1%。实施例7的化合物对由背根神经节、坐骨神经之类的末梢神经或脊髄制备得到的膜级分特异性结合,因此发现实施例7的化合物的分子靶标存在于末梢神经或脊髄中,环状胺衍生物(I)与存在于末梢神经或脊髄中的膜结合而发挥作用。
(实施例11) 环状胺衍生物(I)或其药理学上可允许的盐的结合分子的鉴定:
为了鉴定环状胺衍生物(I)或其药理学上可允许的盐的结合分子,使用将环状胺衍生物(I)固定化的FG beads进行亲和纯化和综合性鉴定。
环状胺衍生物(I)与具有氨基连接基团的FG beads通过酰胺键而固定化,因此合成具有羧基的环状胺衍生物。
作为上述的具有羧基的环状胺衍生物,使用下述的化学式所示的(S)-2-(3-(4-(二甲基氨基)哌啶-1-基)-1-(1-甲基-1H-咪唑-2-基)-3-氧代丙氧基)乙酸(以下称为微珠固定化用化合物),通过以下的方法合成。
微珠固定化用化合物的合成:
[化31]
向(S)-2-(3-(4-(二甲基氨基)哌啶-1-基)-1-(1-甲基-1H-咪唑-2-基)-3-氧代丙氧基)乙酸苯甲酯(0.0550g、0.128mmol)的乙醇(2.50mL)溶液中,在室温下添加钯-碳(10%wet、14.0mg),在氢气氛围下搅拌6小时。将反应液进行硅藻土过滤,将滤液减压浓缩,得到(S)-2-(3-(4-(二甲基氨基)哌啶-1-基)-1-(1-甲基-1H-咪唑-2-基)-3-氧代丙氧基)乙酸(0.0404g、0.119mmol、93%),为无色油状物。
在NH
与上述的环状胺衍生物固定化微珠反应的蛋白质溶液由大鼠背根神经节制备。大鼠背根神经节从6周龄的雄性SD大鼠(日本Charles River株式会社制)分离。将大鼠用氨基甲酸酯麻醉,切开腹主动脉,通过放血安乐死。切开后背部后,摘除脊柱,冰冷。切取脊柱背侧,从脊柱腹侧去除脊髄后,用精密镊子摘除带有神经纤维束的背根神经节(T11至13和L3至6、两侧)。将摘除的背根神经节浸渍在冰冷的Leibovitz's L-15培养基(Thermo FisherScientific公司制)中,在实体显微镜下去除神经纤维束,分离背根神经节。分离的背根神经节用液氮冷冻,保存在-80℃下。背根神经节将由21只个体采集的组织混合,当作1个样品处理。
将背根神经节在分析缓冲液(NaCl(140mM)、KCl(5mM)、CaCl
将环状胺衍生物固定化微珠与上述蛋白质溶液混合,在4℃下反应一夜。将微珠用分析缓冲液洗涤3次后,用PBS(-)洗涤1次后,悬浮于PBS(-)中。将与微珠结合的蛋白质用鸟枪(Shotgun)法分析(LC-MS/MS)进行综合性鉴定。
未固定化合物的微珠中不结合,与环状胺衍生物固定化微珠结合的蛋白质示于表3。Entry ID(大鼠)和蛋白质名由蛋白质数据库Uniprot(http://www.uniprot.org/)引用。但是,表3中,针对Entry ID F1LTJ5的蛋白质名,Uniprot中是Uncharacterized Protein,但在PANTHER Classification System中,是基底膜型硫酸乙酰肝素蛋白多糖核心蛋白质的直系同源物,因此蛋白质名记作基底膜型硫酸乙酰肝素蛋白多糖核心蛋白质。
所鉴定的分子8种之中,Advillin被报告与其它组织相比在末梢神经组织更高地表达(Ravenall等,European Journal of Neuroscience、2002年、第27卷,p.14404-14414)。实施例10中,示出实施例7的化合物的分子靶标是在末梢神经中大量存在的分子,因此示出环状胺衍生物(I)的分子靶标是Advillin的可能性。
此外,Advillin被报告与本实施例中鉴定的肌球蛋白等形成复合体(Chuang等,Proceedings of theNational Academy of Sciences of the United States ofAmerica、2018年、第115卷,p.E8557-E8566)。因此,示出环状胺衍生物(I)或其药理学上可允许的盐与Advillin和/或由本实施例中鉴定的蛋白质等构成的Advillin复合体结合,调节Advillin的功能的可能性。
(实施例12)大鼠背根神经节神经细胞株中的细胞内肌动蛋白丝减少作用:
研究了环状胺衍生物(I)或其药理学上可允许的盐对F11细胞(大鼠背根神经节神经株化细胞)中的细胞内肌动蛋白丝量的作用。
作为受试物质,使用实施例1、2、3、4、5、6、7、8和9的化合物。
作为比较例的化合物,使用表4所示的1-(4-(二甲基氨基)哌啶-1-基)-3-(1-乙基-1H-咪唑-2-基)-3-羟基丙-1-酮(以下称为比较例1的化合物)、1-(4-(二甲基氨基)哌啶-1-基)-3-羟基-3-(1-(2,2,2-三氟乙基)-1H-咪唑-2-基)丙-1-酮(以下称为比较例2的化合物)、1-((R)-3-(二甲基氨基)吡咯烷-1-基)-3-羟基-3-(1-甲基-1H-咪唑-2-基)丙-1-酮(以下称为比较例3的化合物)和1-((R)-3-(3-(二甲基氨基)哌啶-1-基)-3-羟基-3-(1-甲基-1H-咪唑-2-基)丙-1-酮(以下称为比较例4的化合物)。比较例1、2、3和4的化合物按照公知文献(国际公开第2016/136944号)中记载的方法合成。
为了将F11细胞从培养烧瓶中剥离,向细胞添加0.25%Trypsin/EDTA(ThermoFisher Scientific公司制),在室温下孵育数分钟。然后,添加含10%胎牛血清的DMEM培养基(Thermo Fisher Scientific公司制)而悬浮,以1,500rpm离心1分钟。去除离心上清液后,添加含0.5%胎牛血清的DMEM培养基,将细胞悬浮,在层连蛋白包被(2μg/cm
培养开始7天后,交换为包含奥沙利铂(最终浓度15μM)的含有0.5%胎牛血清的DMEM培养基,培养5天,由此诱导了神经轴索损伤。实施例或比较例的各化合物与奥沙利铂同样,包含在培养基中进行处置(最终浓度10μM)。
奥沙利铂和各化合物处置5天后,将细胞用PBS(-)洗涤3次,添加4%多聚甲醛・磷酸缓冲液(和光纯药公司制),在室温下静置10分钟,将细胞固定。添加Acti-stain 670 鬼笔环肽(Cytoskeleton公司制),在室温下孵育30分钟,将肌动蛋白丝染色。使用IN CellAnalyzer 2200(GE Healthcare公司制)获取细胞的图像,使用IN Cell InvestigatorDeveloper Toolbox进行图像分析。细胞内肌动蛋白丝量用与肌动蛋白丝结合的经荧光标记的鬼笔环肽的荧光量(Density)表示。
奥沙利铂单独处置的组(以下称为奥沙利铂单独处置组)与不处置奥沙利铂的组相比,细胞内肌动蛋白丝量增加5%,示出统计学上显著的增加,因此确认到诱发肌动蛋白丝代谢转换调节异常(p<0.05、Student的t检验)。相对于该奥沙利铂单独处置组的细胞内肌动蛋白丝量,算出因各化合物而导致的细胞内肌动蛋白丝减少率。
F11细胞中的各化合物的细胞内肌动蛋白丝减少效果示于表5。表中的“细胞内肌动蛋白丝减少率”示出相对于奥沙利铂单独处置组的细胞内肌动蛋白丝量,通过各化合物处置而减少的细胞内的肌动蛋白丝量的比率(%)(平均值,各组的例数设为1例(1孔),为5例)。表中的“受试化合物”示出利用各化合物的化合物处置组。
与溶剂处置组相比,实施例1、2、3、4、5、6、7、8和9的化合物使细胞内的肌动蛋白丝量减少5%以上。另一方面,比较例1、2、3和4的化合物的细胞内的肌动蛋白丝量的减少率为5%以下。
(实施例13)大鼠脊神经结扎模型中的肌动蛋白丝代谢转换调节异常改善作用:
研究环状胺衍生物(I)或其药理学上可允许的盐对大鼠脊神经结扎模型的坐骨神经中的肌动蛋白丝量与单体肌动蛋白量之比的作用。
使用6周龄雄性SD大鼠(日本Charles river株式会社制)。大鼠脊神经结扎模型通过在异氟烷吸入麻醉下将大鼠的右侧腰背部切开,切除脊髄椎弓,将脊神经的L5和L6的神经根完全结扎后,将肌层和皮肤缝合,从而制作。阴性对照(假手术组)中,露出右侧的L5和L6的神经,不进行结扎,同样将肌层和皮肤缝合。神经结扎后经过1周的大鼠用于以下的实验。
向大鼠脊神经结扎模型,以6、20或60mg/kg的3个用量1天1次、2天经口施与实施例7的化合物,在最终施与3小时后,在异氟烷麻醉下采集坐骨神经,安乐死。采集的坐骨神经在-80℃下冷冻保存。作为对照,设置施与作为溶剂的蒸馏水的假手术组和脊神经结扎模型的蒸馏水施与组(蒸馏水施与组),各自通过上述相同的处置,采集坐骨神经后,安乐死。
肌动蛋白丝和单体肌动蛋白的定量中,使用G-肌动蛋白/F-肌动蛋白体内测定试剂盒(Cytoskeleton公司制)。冷冻组织添加含蛋白酶抑制剂和ATP(1mM)的裂解液和F-肌动蛋白稳定缓冲液(Cytoskeleton公司制),匀浆。将匀浆液在37℃下孵育10分钟,以350×g离心5分钟。将其上清液在100,000×g、37℃下离心1小时。离心后得到的上清液作为单体肌动蛋白样品,沉淀物作为肌动蛋白丝样品。肌动蛋白丝样品在冰上孵育1小时,15分钟进行1次滴管吸取。单体肌动蛋白样品和肌动蛋白丝样品中的肌动蛋白量通过蛋白质印迹法来测定。向单体肌动蛋白样品和肌动蛋白丝样品中添加SDS样品缓冲液,进行热变性处置后,施用于SDS-PAGE预制凝胶(Bio-Rad公司制)进行电泳,分离蛋白质。将凝胶中的蛋白质电气地在PVDF膜上移动・固定化,制作印迹(印迹膜)(トランスブロット Turbo 印迹系统、Bio-Rad公司制)。将印迹膜封膜(Block One、ナカライテスク公司制)后,添加肌动蛋白的抗体(抗肌动蛋白兔多克隆抗体),在室温下孵育1小时。洗涤印迹膜后,添加抗兔HRP标记二次抗体(GEHealthcare公司制),在室温下孵育30分钟。洗涤印迹膜后,添加检测试剂(ECL Prime、GEHealthcare公司制),使用CCD成像器(Bio-Rad公司制),检测化学发光。使用Image Lab软件(Bio-Rad公司制),对肌动蛋白的带的发光强度进行定量。
实施例7的化合物的大鼠脊神经结扎模型的坐骨神经中的肌动蛋白丝/单体肌动蛋白比的评价结果示于图3。图3a中,示出通过蛋白质印迹法检测从坐骨神经分离的肌动蛋白丝样品(上部分)和单体肌动蛋白样品(下部分)中存在的肌动蛋白蛋白质得到的图像。对各肌动蛋白蛋白质的带的发光强度进行定量,算出肌动蛋白丝相对于单体肌动蛋白之比(以下称为肌动蛋白丝/单体肌动蛋白比),示于图3b。图3b的纵轴示出肌动蛋白丝/单体肌动蛋白比(平均值±标准误差)。横轴的“蒸馏水假手术”表示假手术组(6例),“蒸馏水”表示脊神经结扎模型的蒸馏水施与组(7例),“实施例7的化合物”表示脊神经结扎模型的实施例7的化合物的施与组,“6”表示脊神经结扎模型的实施例7的化合物的6mg/kg施与组(6例),“20”表示脊神经结扎模型的实施例7的化合物的20mg/kg施与组(6例),“60”表示脊神经结扎模型的实施例7的化合物的60mg/kg施与组(7例)。图中的“#”与假手术组相比,示出统计学上显著(#:p<0.05、Student的t检验)的差异,图中的“*”与脊神经结扎模型的蒸馏水施与组相比,示出统计学上显著(*:p<0.025、Williams的多重比较,单侧)的差异。
施与蒸馏水的大鼠脊神经结扎模型组(蒸馏水施与组)中,与假手术组相比,肌动蛋白丝/单体肌动蛋白比显著地上升。实施例7的化合物的施与组中,肌动蛋白丝/单体肌动蛋白比伴随实施例7的化合物的施与用量的增加而降低,60mg/kg施与组中,与蒸馏水施与组相比确认到显著的减少。即,可知实施例7的化合物具有改善因脊神经结扎而导致的坐骨神经的肌动蛋白丝代谢转换调节的异常的作用。
作为实施例11所示的环状胺衍生物(I)或其药理学上可允许的盐的分子靶标之一、即Advillin的功能,报告了介由对肌动蛋白的结合而调节肌动蛋白丝代谢转换的功能(Hasegawa等,The Journal of Neuroscience、2007年、第27卷,p.14404-14414)。因此,根据实施例11、12和13可知,环状胺衍生物(I)或其药理学上可允许的盐在与Advillin和/或Advillin复合体结合的作用的同时,促进Advillin和/或Advillin复合体的功能,示出肌动蛋白丝代谢转换调节异常的改善作用。
(实施例14)大鼠背根神经节原代培养细胞中的神经轴索伸展促进作用的评价:
研究环状胺衍生物(I)或其药理学上可允许的盐对大鼠背根神经节原代培养细胞中的神经突起伸展的作用。
使用4~7周龄雄性SD大鼠(日本Charles river株式会社制)。将大鼠通过氨基甲酸酯的腹腔内施与进行麻醉。确认施加了麻醉后,迅速切开腹主动脉,通过放血而安乐死。切开后背部后,摘除脊柱,冰冷。切取脊柱背侧,从脊柱腹侧中去除脊髄,使脊柱腹侧的背根神经节露出。用镊子摘除背根神经节(L3至6、两侧),浸渍在冰冷的Leibovitz'sL-15(ThermoFisher Scientific公司制)培养基中,在实体显微镜下去除神经纤维束。去除了神经纤维束的背根神经节用眼科剪刀引入细微切口,制成背根神经节片。
将背根神经节片浸渍在约3mL的胶原酶A(ロシュモレキュラーシステム公司制)溶液中,在37℃下孵育20分钟。孵育后,在200×g、25℃下离心分离5分钟,去除上清液的胶原酶A溶液,添加约1mL胰蛋白酶溶液,在37℃下孵育5分钟。接着,添加包含10%胎牛血清的DMEM(Thermo Fisher Scientific公司制)约3mL,在200×g、室温下离心分离5分钟后,去除上清液。去除上清液后,向沉淀中添加含有2%B27添加剂的Neurobasal-A Medium(以下称为培养培养基、Thermo Fisher Scientific公司制)约5mL,用微量吸管分散后,用70μm细胞滤网(BDファルコン公司制)回收去除了残渣的细胞,进一步用5mL的培养培养基将细胞滤网上的残渣洗涤,回收细胞。回收的细胞在200×g、室温下离心分离5分钟,去除上清液。
上清液去除后,添加培养培养基5mL,将细胞团块悬浮。将该细胞悬浮液在经层连蛋白包被(6μg/cm
培养2小时后,交换为包含奥沙利铂(最终浓度3μM)的培养培养基,通过7天培养,诱导了神经轴索损伤。实施例7的化合物在奥沙利铂处置的同时,包含在培养培养基中进行处置(最终浓度10、30或100μM)。
培养开始1周后,将细胞用PBS(-)洗涤3次,用4%多聚甲醛・磷酸缓冲液处理10分钟。用PBS(-)洗涤3次后,用20%Blocking One(ナカライテスク公司制)、0.1%Triton X-100/PBS(-)处理1小时。用PBS(-)洗涤1次后,将抗βIII微管蛋白小鼠单克隆抗体抗体(Promega公司制)用包含5%Blocking One的0.1%Triton X-100/PBS(-)稀释500倍,在4℃下处理一夜。处理一夜后,用PBS(-)洗涤3次,将二次抗体(CF488A抗小鼠IgG驴抗体、Biotium公司制)用包含5%Blocking One的0.1%Triton X-100/PBS(-)稀释,在室温下处理1小时。接着,用PBS(-)洗涤3次后,用PBS(-)对稀释1000倍的DAPI(同仁化学研究所公司制)进行5分钟处理,用PBS(-)洗涤3次。
使用IN Cell Analyzer 2200(GE Healthcare公司制)获取细胞的图像,使用INCell Investigator Developer Toolbox进行图像分析。分析结果中,将识别为神经突起的区域的长度(Fiber length)除以神经细胞数而得到的数值表示为每1个细胞的神经突起的长度,将使神经突起的长度增加的作用作为神经轴索伸展作用而进行评价。
图4示出无处置组(蒸馏水处置)、奥沙利铂单独处置组、和奥沙利铂和实施例7的化合物的100μM处置组的各条件的平均的细胞例的图像。如图4所示,通过奥沙利铂的单独处置,观察到神经突起的长度缩短的图像,通过实施例7的化合物(100μM)处置,确认到与奥沙利铂单独处置组相比神经突起的长度增加。
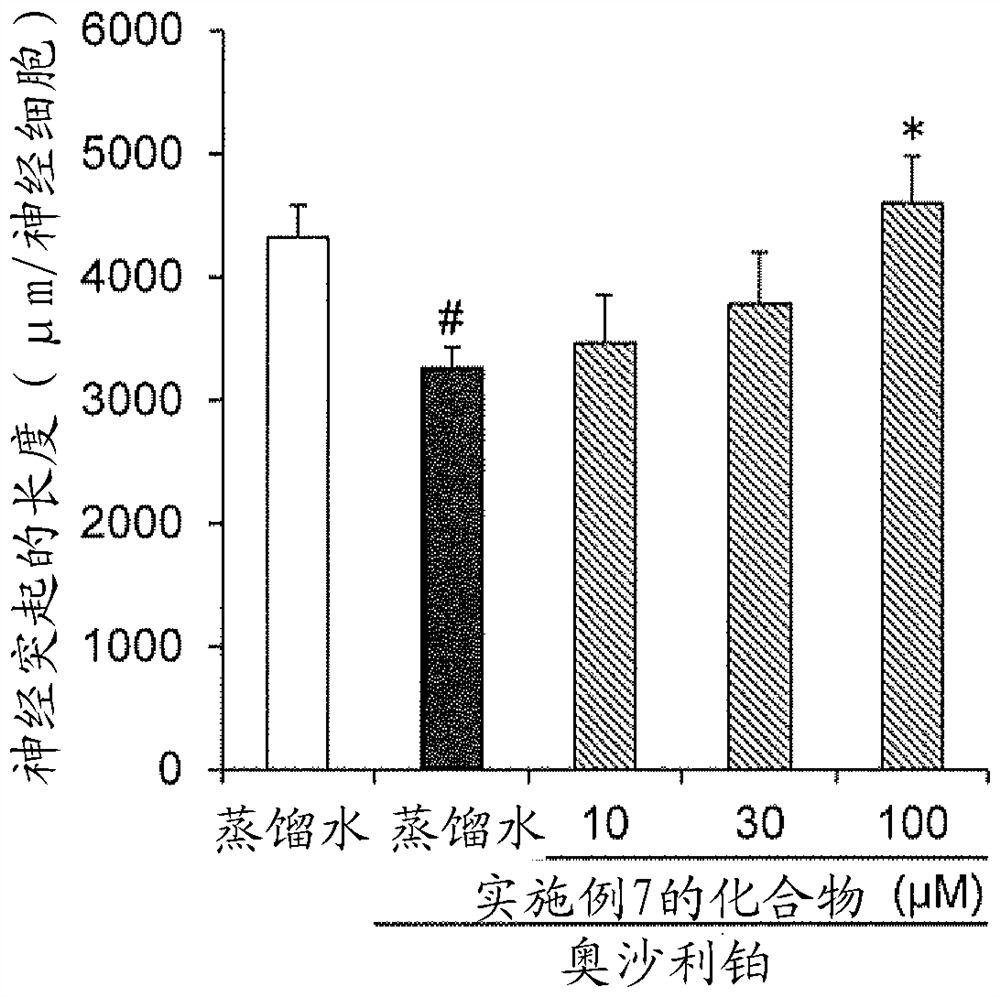
各图像的神经突起的长度的分析结果示于图5。图5的纵轴示出神经突起的长度(μm/神经细胞)(平均值±标准误差,各组5例)。横轴的“蒸馏水”示出无处置组,“奥沙利铂+蒸馏水”示出奥沙利铂单独处置组,“奥沙利铂+实施例7的化合物”示出奥沙利铂和实施例7的化合物的施与组,“10”示出奥沙利铂和实施例7的化合物的10μM处置组,“30”示出奥沙利铂和实施例7的化合物的30μM处置组,“100”示出奥沙利铂和实施例7的化合物的100μM处置组。图中的“#”与无处置组相比,示出统计学上显著(#:p<0.05、Student的t检验)的差异,图中的“*”与奥沙利铂单独处置组相比,示出统计学上显著(*:p<0.025、Williams的多重比较,单侧)的差异。
如图5所示,通过奥沙利铂的单独处置,神经突起的长度显著缩短,但通过实施例7的化合物(10、30和100μM)处置,与奥沙利铂单独处置组相比,确认到与实施例7的化合物的用量的增加相伴随的神经突起的长度的增加。实施例7的化合物的100μM处置组中,与奥沙利铂单独处置组相比确认到显著的增加。即,可知实施例7的化合物在用奥沙利铂诱发了神经轴索损伤的大鼠背根神经节原代培养细胞中,具有神经轴索伸展促进作用。
作为实施例11所示的环状胺衍生物(I)的分子靶标、即Advillin的功能,报告了伸展神经轴索的功能(Hasegawa等人,The Journal of Neuroscience、2007年、第27卷,p.14404-14414)。因此,通过实施例11和实施例14,示出环状胺衍生物(I)或其药理学上可允许的盐在具有与Advillin和/或Advillin复合体结合的作用的同时,具有神经轴索伸展促进作用。
根据以上的结果可知,本发明的权利要求书的环状胺衍生物(I)具有Advillin功能促进作用。
工业实用性
本发明的环状胺衍生物或其药理学上可允许的盐具有Advillin功能促进作用,因此能够用作针对与神经轴索损伤相关的疾病的药物。
本说明书中引用的所有出版物、专利和专利申请通过直接引用而并入本说明书中。
- 作为Advillin功能促进剂的环状胺衍生物以及新型环状胺衍生物和其药物用途
- 带有环状偕胺肟或环状脒腙的噁唑烷酮衍生物及其药物组合物
