一种抑制PCSK9基因表达的RNA抑制剂及其应用
文献发布时间:2023-06-19 12:11:54
技术领域
本发明属于生物化学领域,具体涉及一种抑制肝细胞中前蛋白转化酶枯草杆菌蛋白酶Kexin9(PCSK9)基因表达的RNA抑制剂及其应用,所述的RNA抑制剂由正义链和反义链通过碱基配对形成,正义链和反义链彼此之间至少85%碱基互补,且部分或全部核苷酸糖基2’位的-OH被氟或甲氧基取代,末端至少有连续3个核苷酸之间的磷酸酯被硫代。本发明提供的RNA抑制剂的结构中还含有使所述RNA抑制剂具有肝靶向特异性的结构5’MVIP和3'MVIP,其中5’MVIP偶联在所述RNA抑制剂正义链和/或反义链5’末端,3’MVIP偶联在所述RNA抑制剂反义链和/或正义链3’末端,5’MVIP和3’MVIP都包含有肝靶向特异性配体X、支链L、接头B和连接链D,5’MVIP还包含与所述RNA抑制剂正义链或反义链5’末端连接的转接点R
背景技术
RNAi
RNAi(RNA干扰)于1998年,由安德鲁·法厄(Andrew Z.Fire)等在秀丽隐杆线虫中进行反义RNA抑制实验时发现,并将这一过程称为RNAi。这一发现被《Science》杂志评为2001年的十大科学进展之一,并名列2002年十大科学进展之首。自此以后,以RNAi为作用机理的siRNA作为潜在的基因治疗药物得到人们广泛的关注,2006年,安德鲁·法厄与克雷格·梅洛(Craig C.Mello)由于在RNAi机制研究中的贡献获得诺贝尔生理或医学奖。RNAi是在许多生物中,包括动物、植物和真菌,都可由双链RNA(dsRNA)触发的,在RNAi过程中,一种称为“Dicer”的核酸内切酶将长链dsRNA切割或“切丁”成21~25个核苷酸长的小片段。这些小片段,被称为小干扰RNA(siRNA),其中的反义链(Guide strand)被加载到Argonaute蛋白(AGO2)上。AGO2加载发生在RISC-loading复合物中,这是一个三元复合物,由Argonaute蛋白、Dicer和dsRNA结合蛋白(简称为TRBP)组成。在装载过程中,正义链(Passengerstrand)链被AGO2裂解并排出。然后,AGO2使用反义链与包含完全互补序列的mRNA结合,然后催化这些mRNA的切割,致使mRNA分裂丧失翻译模板的作用,进而阻止相关蛋白质的合成。切割后,被切割的mRNA被释放,加载着反义链的RISC-loading复合物被循环用于另一轮的切割。
据统计,在人体内的疾病相关蛋白中,大约超过80%的蛋白质不能被目前常规的小分子药物以及生物大分子制剂所靶向,属于不可成药蛋白。旨在通过基因的表达、沉默等功能治疗疾病的基因治疗被业界认为是继化学小分子药物、生物大分子药物之后的第三代治疗药物,这种疗法在基因水平上实现对疾病的治疗,不受不可成药蛋白的制约。作为基因治疗中RNAi技术最主流的类型,RNAi技术是从mRNA的水平对疾病进行治疗,相比化学小分子药物及生物大分子药物在蛋白质水平的治疗具有更高的效率。利用RNAi技术,可以根据特定基因序列,设计出特异性高、抑制效果好的siRNA的正义链和反义链序列,通过固相合成这些单链序列,然后正义链与反义链在特定的退火缓冲液中按照碱基配对原则配对成siRNA,最后通过载体系统输送到体内相应靶点,降解目标mRNA,破坏目标mRNA作为翻译模板的功能,从而阻止相关蛋白的合成。
siRNA的递送系统
siRNA在血液和组织中不稳定,容易被核酸酶降解,为了提高siRNA的稳定性,可以通过对siRNA的正义链和反义链修饰,但这些化学修饰只提供有限的免受核酸酶降解的保护作用并且可能最终影响siRNA的活性。因此,还需要相应的传递系统来保障siRNA安全高效的穿过细胞膜。由于siRNA分子质量较大,且带有大量负电荷,而且具有高水溶解性,所以自身无法顺利穿越细胞膜到达细胞内。
脂质体基本结构是由亲水核和磷脂双分子层构成,具备类似生物膜的磷脂双分子层,拥有很高的生物相容性,所以脂质体一度成为最受欢迎、应用最广泛的siRNA载体。脂质体介导的siRNA递送主要将siRNA包裹到脂质体内,保护siRNA不被核酸酶降解,提高siRNA的通过细胞膜障碍的效率,从而促进细胞的吸收。例如阴离子脂质体、pH敏感性脂质体、免疫脂质体、膜融合脂质体(fusogenic liposome)和阳离子脂质等等,尽管取得了一定的进展,但脂质体本身容易引发炎症反应,给药前必须使用多种抗组胺和激素类如西利替嗪和地塞米松类等药物,以减少可能发生的急性炎症反应,因此在实际临床应用中并不适合所有治疗领域,尤其像慢性乙肝这一类治疗周期长的疾病,长期使用可能产生的积蓄毒性是潜在的安全隐患,因此需要一种更安全有效的载体系统来递送siRNA。
肝脏中去唾液酸糖蛋白受体(ASGPR),是肝细胞特异性表达的受体,是一种高效的内吞型受体。由于体内生理情况下各种糖蛋白在酶或酸水解唾液酸后,暴露出的次末端是半乳糖残基,所以ASGPR特异性结合的糖为半乳糖基,故又称半乳糖特异性受体。半乳糖、半乳糖胺、N-乙酰半乳糖胺等单糖和多糖分子都对ASGPR有高亲和性。ASGPR主要生理功能是介导血液中去唾液酸糖蛋白、脂蛋白等物质的清除,且与病毒性肝炎、肝硬化、肝癌等肝脏疾病的发生发展有着密切联系。ASGPR这一特性的发现,对肝源性疾病的诊断及治疗起着重要作用(Ashwell G、Harford J,Carbohydrate specific Receptors of the Liver,AnnRev Biochem 1982 51:531-554)。结构中含有半乳糖或半乳糖胺及其衍生物的肝源性疾病治疗药物可以特异性地与ASGPR亲和,从而具有主动肝靶向性,不需要其它的载体系统来输送。
前蛋白转化酶枯草杆菌蛋白酶Kexin9(PCSK9)
2003年,研究人员在法国的一个家系中发现了编码前白蛋白转化酶枯草菌素9(Proprotein Convertase Subtilisin/Kexin type 9,PCSK9)的基因突变可能与家族性高胆固醇血症(familial hypercholesterolemia,FH)相关。PCSK9是前蛋白转化酶家族中的第9个蛋白酶K亚家族,PCSK9是一种主要由肝细胞产生的蛋白酶。血浆中的PCSK9与肝细胞表面的低密度脂蛋白受体(low density lipoprotein receptor,LDLR)结合,PCSK9-LDLR结合体经内吞作用进入肝脏细胞内并在溶酶体上被降解,使肝细胞表面LDLR减少。LDLR的减少导致血浆中的LDL-C不能进入肝脏代谢,进而导致血浆LDL-C的水平增高。
动脉粥样硬化是冠心病发生发展中关键病变,是血管的慢性炎性疾病,主要是由于血管中脂质过度积聚,巨噬细胞吞噬受损内皮上的脂质,形成泡沫细胞,诱发炎症反应,进而形成一组由脂质斑块引起的疾病。同时,血液循环中低密度脂蛋白胆固醇(lowdensity lipoprotein cholesterol,LDL-C)的含量与心血管疾病死亡呈正相关。LDL-C升高,身体在短期内是无症状的,但是长期的升高可导致动脉粥样硬化。经过几十年,慢性升高的胆固醇促成动脉中动脉粥样硬化斑块形成,动脉粥样硬化可导致涉及动脉的进行性狭窄或甚至完全闭塞。另外,更小的斑块可能破裂并引起凝块形成和血流阻断,从而导致例如心肌梗死和/或中风。如果狭窄或闭塞的形成是逐渐的,那么到组织和器官的血液供应缓慢地减少,一直到器官功能变得受损。因此,LDL-C增高可以视为冠状动脉粥样硬化发生发展的独立危险因素,而降低LDL-C有益于预防心血管疾病。
研究人员发现,两个常见的PCSK9失功能型突变(PCSK9-679X和PCSK9-142X)与血中低LDL-C水平相关。该发现表明,PCSK9失功能型突变会促进肝对脂质的代谢,降低血中LDL-C水平。这提示PCSK9可以成为调节体内低密度脂蛋白代谢、降低心血管病发病率的重要药物靶点PCSK9的抑制剂可用于治疗或/和预防由PCSK9基因介导的,包括但不限于高脂血症、动脉粥样硬化或与PCSK9基因介导有关的其它疾病。目前他汀类药物仍是治疗动脉粥样硬化性心血管疾病首选药物,但仍有部分他汀药物不耐受患者或最大耐受剂量仍达不到LDL-C治疗靶点(<1.8mmol/L(70mg/dL)或是<1.4mmol/L(55mg/dL))。中国仅有在31.4%的高危/极高危患者接受他汀治疗后达到的LDL-C目标。
因此,本领域急需开发出一种具有新的作用机理,并能够更有效降低血液中LDL-C水平的药物来治疗或预防动脉粥样硬化性心血管疾病。本发明提供的PCSK9 RNA抑制剂通过干扰PCSK9 mRNA,破坏其作为翻译模板的功能,阻止PCSK9蛋白的合成,减少PCSK9与肝细胞表面LDLR结合的机会,使LDL-C进到肝细胞被代谢掉,从而提供了一种全新的治疗模式来有效降低LDL-C的水平,也使那些他汀类不耐受和家族遗传性高胆固醇血症患者有药可用。
发明内容
本发明涉及一种抑制肝细胞中前蛋白转化酶枯草杆菌蛋白酶Kexin9(PCSK9)基因表达的RNA抑制剂及其应用,所述的RNA抑制剂由正义链和反义链通过碱基配对形成,正义链和反义链彼此之间至少85%碱基互补,且部分或全部核苷酸糖基2’位的-OH被氟或甲氧基取代,末端至少有连续3个核苷酸之间的磷酸酯被硫代,以增强其在体内的稳定性。本发明所述的RNA抑制剂的结构中还含有的5’MVIP和3'MVIP,使所述RNA抑制剂具有肝靶向特异性的结构,其中5’MVIP偶联在所述RNA抑制剂正义链和/或反义链5’末端,3’MVIP偶联在所述RNA抑制剂反义链和/或正义链3’末端,5’MVIP和3’MVIP都包含有肝靶向特异性配体X、支链L、接头B和连接链D,5’MVIP还包含与所述RNA抑制剂正义链或反义链5’末端连接的转接点R
一方面,本发明提供了一种抑制PCSK9基因表达的RNA抑制剂或其药学上可接受的盐,其中,
所述RNA抑制剂由链长为15-30的正义链和反义链通过碱基配对形成,其中链长优选为19-23。
在上述技术方案中,优选地,所述正义链和反义链之间至少有85%的碱基互补;
所述正义链或反义链的部分或全部核苷酸糖基2’位的-OH可以被取代,其中,所述取代基团为氟或甲氧基,优选从所述正义链5’末端开始的第5、7、8、9位核苷酸糖基2’位的-OH被氟代且从所述反义链的5'末端开始的第7、12、14位核苷酸糖基2’位的-OH被氟代,其余的核苷酸糖基2’位的-OH被甲氧基取代;且所述正义链或反义链的末端至少有3个相邻核苷酸之间的磷酸酯键可以硫代。
更优选地,所述正义链为如下所示的SEQ ID NO.351或与其相差一个、两个或三个核苷酸的序列,所述反义链为如下所示的SEQ ID NO.366或与其相差一个、两个或三个核苷酸的序列:
正义链:5'ccaaagaugucaucaaugagg 3' SEQ ID NO.:351
反义链:5'ucauugaugacaucuuuggca 3' SEQ ID NO.:366
其中,g=鸟苷酸,a=腺苷酸,u=尿苷酸,c=胞苷酸。
为了增强上述RNA抑制剂在体内的稳定性,在不影响其活性甚至增强其活性的情况下,可以对上述RNA抑制剂的正义链和反义链进行修饰,其中的核苷酸可以有修饰基团,可以整条链或者部分修饰。更优选地,其中,所述正义链为SEQ ID NO.534或与其相差一个、两个或三个核苷酸的序列;所述反义链为SEQ ID NO.435或与其相差一个、两个或三个核苷酸的序列:
正义链:5'Cs Cs A A fA G fA fU fG U C A U C A A Us Gs A 3' SEQ ID NO.:534
反义链:5'Us Cs A U U G fA U G A C fA U fC U U U G Gs Cs A 3' SEQ IDNO.:435
其中,G=2'-O-甲基鸟苷酸,A=2'-O-甲基腺苷酸,U=2'-O-甲基尿苷酸,C=2'-O-甲基胞苷酸;Gs=2'-O-甲基-3’-硫代鸟苷酸,As=2'-O-甲基-3'-硫代腺苷酸,Us=2'-O-甲基-3'-硫代尿苷酸,Cs=2'-O-甲基-3'-硫代胞苷酸;fG=2'-氟鸟苷酸,fA=2'-氟腺苷酸,fU=2'-氟尿苷酸,fC=2'-氟胞苷酸;fGs=2'-氟-3'-硫代鸟苷酸,fAs=2'-氟-3'-硫代腺苷酸,fUs=2'-氟-3'-硫代尿苷酸,fCs=2'-氟-3'-硫代胞苷酸。
在上述技术方案中,优选地,所述RNA抑制剂或其药学上可接受的盐还含有5’MVIP和3’MVIP的组合,其中,
所述5’MVIP和3’MVIP为带有肝靶向特异性配体X的配体结构,其还包含支链L、接头B和连接链D;
所述5’MVIP偶联在所述正义链和/或反义链5’末端,其还包含与所述正义链或反义链5’末端连接的转接点R
所述3’MVIP偶联在所述反义链和/或正义链3’末端,其包含与所述正义链或反义链3’末端连接的转接点R
所述5’MVIP的结构如通式I所示,所述3’MVIP的结构如通式II所示,
其中,
n和m分别为0-4的整数,优选为1-3的整数,且n+m=2-6的整数,优选n+m=2、3或4;
所述转接点R
R
R
所述肝靶向特异性配体X,选自半乳糖、半乳糖胺、N-乙酰半乳糖胺及其衍生物,优先选自N-乙酰半乳糖胺及其衍生物,并且所述肝靶向特异性配体X在5’MVIP与3’MVIP各自的内部或5’MVIP与3’MVIP之间可以相同,也可以不同;
所述支链L是含有-NH-、C=O、O、S、酰胺基、磷酰基、硫代磷酰基、C4-C10脂肪族碳环基、苯基或者这些基团的组合的C4-C18直链,所述直链可以带有乙基醇或羧酸类的侧链,所述支链L优选为含酰胺基或六元脂肪族碳环基的C7-C18直链,并且所述支链L在5’MVIP与3’MVIP各自的内部或5’MVIP与3’MVIP之间可以相同,也可以不同;
所述接头B选自以下结构:
其中,A
所述连接链D是含有-NH-、C=O、O、S、酰胺基、磷酰基、硫代磷酰基、芳香烃基、C4-C10脂肪族碳环基、含1-3个氮的五元或六元杂环基或者这些基团的组合的C3-C18直链,所述C3-C18直链也可以带有甲基醇、甲基叔丁基、甲基苯酚基、C5-C6脂肪环基的侧链,所述连接链D优选为含两个C=O、六元脂肪族碳环基或苯基的C3-C10直链。
具体地,在一些实施方案中,当n=0(即不存在5’MVIP)时,所述MVIP的结构可以为:
在一些实施方案中,当n=1时,所述MVIP的结构可以为:
在一些实施方案中,当n=2时,所述MVIP的结构可以为:
在一些实施方案中,当n=3时,所述MVIP的结构可以为:
在一些实施方案中,当n=4时,所述MVIP的结构可以为:
在一些实施方案中,所述的n是指同时放在所述RNA抑制剂的正义链和反义链5’末端5'MVIP中n之和,所述的m是指同时放在所述RNA抑制剂的正义链和反义链3’末端3'MVIP中m之和。
所述肝靶向特异性配体X选自用于增强肝细胞对RNA抑制剂的摄取的结构,可以是脂质、类固醇、维生素、糖、蛋白质、肽、多胺及肽模拟结构。在本发明提供的RNA抑制剂中,引入所述RNA抑制剂中的正义链或反义链末端的肝靶向特异性配体X可以相同,也可以不同,例如在特性上,有些可以是增强肝靶向性,有些可以是所述RNA抑制剂在体内药代动力学的调节结构,有些可以是具有体内溶解活性的结构。在一些实施方案中,所述肝靶向特异性配体X选自以下结构中的一种或多种单糖及其衍生物。
所述单糖选自以下结构中的一种或多种:甘露糖、半乳糖、D-阿拉伯糖、葡萄糖、果糖、木糖、葡糖胺、核糖。甘露糖选自以下结构中的一种或多种:D-吡喃甘露糖、L-吡喃甘露糖、α-D-呋喃甘露糖、β-D-呋喃甘露糖、α-D-吡喃甘露糖、β-D-吡喃甘露糖。半乳糖选自以下结构中的一种或多种:L-半乳糖、D-半乳糖、α-D-吡喃半乳糖、β-D-吡喃半乳糖、α-D-呋喃半乳糖、β-D-呋喃半乳糖。葡萄糖选自以下结构中的一种或多种:D-葡萄糖、L-葡萄糖、α-D-吡喃葡萄糖、β-D-吡喃葡萄糖、α-D-呋喃葡萄糖、β-D-呋喃葡萄糖。果糖选自以下结构中的一种或多种:α-D-呋喃果糖、α-D-吡喃果糖。木糖选自以下结构中的一种或多种:D-呋喃木糖、L-呋喃木糖。核糖选自以下结构中的一种或多种:核糖、D-核糖、L-核糖。单糖衍生物选自甘露糖衍生物、半乳糖衍生物、葡萄糖衍生物、核糖衍生物以及其他衍生物。半乳糖衍生物选自α-D-半乳糖胺、N-乙酰基半乳糖胺、4-硫代-β-D-吡喃半乳糖。葡萄糖衍生物可以选自2-氨基-3-O-[(R)-1-羧乙基]-2-脱氧-β-D-吡喃葡萄糖、2-脱氧-2-甲基氨基-L-吡喃葡萄糖、2-脱氧-2-磺氨基-D-吡喃葡萄糖、5-硫代-β-D-吡喃葡萄糖、2,3,4-三-O-乙酰基-1-硫代-6-O-三苯甲基-α-D-吡喃葡萄糖苷甲酯。核糖衍生物选自D-4-硫代核糖、L-4-硫代核糖的一种或多种。
在一些优选实施方案中,所述肝靶向特异性配体X选自半乳糖、半乳糖胺、N-乙酰半乳糖胺及其衍生物,其结构通式如下:
其中,W
在一些实施方案中,所述肝靶向特异性配体X优先选自以下结构中的一种或多种:
其中,W选自-OH、-NHCOOH或-NHCO(CH
在一些实施方案中,所述肝靶向特异性配体X在同一个5'MVIP或3'MVIP结构中可以相同,也可以不同。
在一些实施方案中,5'MVIP与3'MVIP彼此之间的X可以相同,也可以不同。
所述支链L是含有-NH-、C=O、O、S、酰胺基、磷酰基、硫代磷酰基、C4-C10脂肪族碳环基、苯基或者这些基团的组合的C4-C18的直链,所述直链可以带有乙基醇或羧酸类的侧链,所述支链L优选为含酰胺基或六元脂肪族碳环基的C7-C18直链,其长短或结构会影响到本发明所述的RNA抑制剂的活性。
在一些实施方案中,所述支链L在同一个5'MVIP或3'MVIP结构中可以相同,也可以不同。
在一些实施方案中,5'MVIP与3'MVIP彼此之间的支链L可以相同,也可以不同。
在一些实施方案中,所述支链L可以选自如下结构中的一种或多种:
其中,r1是1-12的正整数,r2为0-20的整数,Z为H或烷基或酰胺基,如C1-C5烷基、C1-C5的酰胺基,如甲酰胺等。
所述接头B的结构与能引入的特异性配体X的数量有关,接头B中含-NH-、C、O、S、酰胺基、磷酰基、硫代磷酰基,当n或m为1时,其为一条直链,当n或m为2、3或4时,其分叉的次数分别为2、3或4。所述接头B可以选自以下结构式:
其中,A
在一些实施方案中,当n或m为1、2、3或4时,所述接头B选自以下结构式:
其中,r为0-4的整数。
在一些实施方案中,当n或m为1、2、3或4时,所述接头B选自以下结构式:
在一些实施例中,所述接头B优先选自以下结构中的一种或几种:
所述连接链D是含有-NH-、C=O、O、S、酰胺基、磷酰基、硫代磷酰基、芳香烃基、C4-C10脂肪族碳环基、含1-3个氮的五元或六元杂环基或者这些基团的组合的C3-C18直链,所述C3-C18直链也可以带有甲基醇、甲基叔丁基、甲基苯酚基、C5-C6脂肪环基的侧链,所述连接链D优选为含两个C=O、六元脂肪族碳环基或苯基的C3-C10直链。
在一些实施方案中,所述连接链D选自以下结构中的一种或几种:
其中,每个n为1-20的正整数,且每个n为相同或不同的整数;s为2-13的整数;Z
在一些实施方案中,所述连接链D优先选自以下结构中的一种:
在一些实施方案中,所述连接链D优先选自以下结构中的一种或几种:
在一些最优选实施方案中,所述连接链D为含两个C=O的C3-C10直链烷基。
在一些实施方案中,所述5’MVIP结构中的(X-L)
在一些优选实施方案中,所述5’MVIP结构中的(X-L)
表1:5’MVIP的(X-L)
在一些实施方案中,5’MVIP也可以不存在,这时候m可以为2-4的整数。
在一些优选实施方案中,所述3’MVIP结构中的(X-L)
表2:3’MVIP的(X-L)
在本发明提供的RNA抑制剂中,所述5’MVIP还包含与所述正义链或反义链5’末端连接或偶联的转接点R
在一些实施方案中,R
在一些实施方案中,R
在一些优选的实施方案中,R
i.其中的一个氧原子或硫原子用于R
在一些实施方案中,优选以下结构:
ii.R
在一些实施方案中,R
在一些优选实施方案中,正义链或反义链5’MVIP亚磷酰胺单体优选以下结构:
当通式中n为1-4时,上述的单体中接头B部分分别支化1至4次,以获得对应的单体化合物,借助上述的单体化合物,肝靶向特异性配体X通过固相合成被引入到正义链或反义链5’末端。
在一些优选实施方案中,转接点R
在本发明提供的RNA抑制剂中,所述3’MVIP还包含与所述正义链或反义链3’末端连接或偶联的转接点R
在一些实施方案中,含杂环结构如哌啶基、吡咯基、噻唑基或者苯环的转接点R
本发明所述的R
在一些实施方案中,R
当通式中m为1-4时,上述的单体中接头B部分分别支化1至4次,以获得对应的Solid Support。
在一些实施方案中,R
当通式中m为1-4时,上述的单体中接头B部分分别支化1至4次,以获得对应的Solid Support。
在一些优选实施方案中,R
当通式中m为1-4时,上述的单体中接头B部分分别支化1至4次,以获得对应的Solid Support。
在一些实施方案中,3’MVIP solid support结构如下:
在一些优选实施方案中,5’MVIP配体结构中的(X-L)
表3:5’MVIP中(X-L)
在一些实施方案中,3’MVIP可以不存在,这时候n可以是2-4。
在一些实施方案中,3’MVIP配体结构中的(X-L)
表4:3’MVIP的(X-L)
本发明提供的RNA抑制剂结构中的正义链和反义链链长为15-30,优选19-23,彼此之间至少85%碱基互补。为了增强正义链和反义链在体内的稳定性,RNA抑制剂的正义链和反义链可以在没有影响活性甚至增强活性的情况下进行修饰,其中的核苷酸可以有修饰基团,可以整条链或者部分修饰,优选全部修饰。所述修饰为本领域的研究者易于理解的技术,可以在糖基部分,选至如下任一种或多种:脱氧核糖核苷酸、核苷酸模拟物、脱碱基核苷酸、2’-修饰核苷酸、3’至3’连接(倒置)核苷酸、含非天然碱基的核苷酸、桥接核苷酸、肽核酸(PNA)、解锁的核碱基类似物、锁定核苷酸、3’-O-甲氧基(2’核苷间连接)核苷酸、2’-F-阿拉伯糖核苷酸、5’-Me/2’-氟带核苷酸、吗啉代核苷酸、乙烯基膦酸酯脱氧核糖核苷酸、含乙烯基膦酸酯的核苷酸和含环丙基膦酸酯的核苷酸。其中,2’-修饰核苷酸包括但不限于:2’-O-甲基核苷酸、2’-脱氧-2’-氟核苷酸、2’-脱氧核苷酸、2’-甲氧基乙基核苷酸、2’-氨基核苷酸和2’-烷基核苷酸。在本发明提供的RNA抑制剂中,所述RNA抑制剂的正义链和反义链均不需要均匀修饰,可在其单个核苷酸中掺入一种以上的修饰。所述的修饰也可在碱基部分发生,经修饰的核碱基包括合成和天然的核碱基,诸如5-取代嘧啶,6-氮杂嘧啶和N-2/N-6和O-6取代嘌呤,5-甲基胞嘧啶,5-羟甲基胞嘧啶,黄嘌呤,次黄嘌呤,2-氨基腺嘌呤,腺嘌呤和鸟嘌呤的6-烷基,腺嘌呤和鸟嘌呤的2-烷基和其他烷基衍生物,2-硫代尿嘧啶,2-硫代胸腺嘧啶,2-硫代胞嘧啶,5-卤代尿嘧啶,胞嘧啶,5-丙炔基尿嘧啶,5-丙炔基胞嘧啶,6-偶氮尿嘧啶,6-偶氮胞嘧啶,6-偶氮胸腺嘧啶,5-尿嘧啶,4-硫尿嘧啶,8-卤素、8-氨基、8-巯基、8-硫代烷基、8-羟基和其他8-取代的腺嘌呤和鸟嘌呤,5-卤、5-三氟甲基和其他5-取代的尿嘧啶和胞嘧啶,7-甲基鸟嘌呤和7-甲基腺嘌呤,8-氮鸟嘌呤和8-氮杂腺嘌呤,7-脱氮鸟嘌呤,7-脱氮腺嘌呤,3-脱氮鸟嘌呤和3-脱氮腺嘌呤。
本发明所述的RNA抑制剂的正义链和反义链的部分或全部是2’-O-甲基核苷酸和/或2’-脱氧-2’-氟核苷酸,且至少连续两个硫代磷酸酯键存在其正义链5’端和反义链3’端的核苷酸之间,优选末端3个连续的核苷酸之间磷酸酯键被硫代。
在本发明提供的RNA抑制剂中,当其一条单链上有3’MVIP时,与这条单链相互补的另外一条单链相应的有5’MVIP或3’MVIP或者没有;当所述RNA抑制剂的一条单链上有5’MVIP时,与其相互补的另外一条单链相应的有3’MVIP或5’MVIP或者没有。5’MVIP和3’MVIP也可以同时连接在正义链或反义链的对应末端,即正义链的5’末端有5’MVIP时,其3'末端也可以有3'MVIP;反义链的5’末端有5’MVIP时,其3'末端也可以有3'MVIP。或者,5’MVIP同时放在正义链和反义链的5’末端。或者,3’MVIP同时放在正义链和反义链的3’末端。
在一些实施方案中,优选下表5中不同5'MVIP和3'MVIP组合接入RNA抑制剂的正义链和或反义链的不同位置,考察对PCSK9基因表达水平的影响。
表5:5'MVIP与3'MVIP的组合
在一些实施方案中,本发明所述的RNA抑制剂或其药学上可接受的盐优选以羧酸盐、钠盐、三乙胺盐或其它可药用盐的形式制备或合成。
在一些实施方案中,所述RNA抑制剂或其药学上可接受的盐更优选为其钠盐或三乙胺盐。
在一些实施方案中,所述RNA抑制剂中的正义链选自下列表6中的序列。
表6:RNA抑制剂的正义链序列
在一些实施方案中,本发明所述的RNA抑制剂的正义链与表6中的各序列相差一个、两个或三个核苷酸。
在一些实施方案中,所述RNA抑制剂的反义链选自下表7中的序列。
表7:RNA抑制剂的反义链序列
在一些实施方案中,本发明所述的RNA抑制剂的反义链与表7中的各序列相差一个、两个或三个核苷酸。
在一些筛选实施方案中,所述的RNA抑制剂的正义链和反义链选自表8中的序列。
表8:筛选RNA抑制剂的序列
在一些实施方案中,本发明所述的RNA抑制剂的正义链和反义链与表8中的各序列相差一个、两个或三个核苷酸。
在一些优选的细胞筛选方案中的RNA抑制剂选自表9。
表9:筛选RNA抑制剂
在一些实施方案中,本发明所述的RNA抑制剂的正义链和反义链与表9中的各序列相差一个、两个或三个核苷酸。
在一些实施方案中,所述RNA抑制剂的正义链选自下列表10中的序列。
表10:RNA抑制剂的正义链序列
在一些实施方案中,本发明所述的RNA抑制剂的正义链与表10中的各序列相差一个、两个或三个核苷酸。
在一些实施方案中,所述RNA抑制剂的反义链选自下列表11中的序列。
表11:RNA抑制剂的反义链序列
在一些实施方案中,本发明所述的RNA抑制剂的反义链与表11中的各序列相差一个、两个或三个核苷酸。
在一些实施方案中,所述RNA抑制剂的正义链选自下列表12中的序列。
表12:RNA抑制剂的正义链序列
在一些实施方案中,本发明所述的RNA抑制剂的正义链与表12中的各序列相差一个、两个或三个核苷酸。
在一些实施方案中,所述RNA抑制剂的反义链选自下列表13中的序列。
表13:RNA抑制剂的反义链序列
在一些实施方案中,本发明所述的RNA抑制剂的反义链与表13中的各序列相差一个、两个或三个核苷酸。
在一些优选动物实验方案中,所述的RNA抑制剂选自表14中的序列。
表14:优选RNA抑制剂
在一些实施方案中,本发明所述的RNA抑制剂的正义链和反义链与表14中的各序列相差一个、两个或三个核苷酸。
在一些实施方案中,所述RNA抑制剂的正义链SEQ ID NO.411:Cs Cs A A fA G fAfU fG U C A U C A A U G As Gs G的5'末端和/或3'端与不同结构的5'MVIP和/或3'MVIP连接,所述正义链选自下表15。
表15:正义链的5'末端和/或3'端与不同结构的5'MVIP和/或3'MVIP连接
在一些实施方案中,本发明所述的RNA抑制剂的正义链与表15中的各序列相差一个、两个或三个核苷酸。
在一些实施方案中,所述RNA抑制剂的反义链SEQ ID NO.435:Us Cs A U U G fAU G A C fA U fC U U U G Gs Cs A的5'末端和/或3'端与不同结构的5'MVIP和/或3'MVIP连接,所述正义链选自下表16。
表16:反义链的5'末端和/或3'端与不同结构的5'MVIP和/或3'MVIP连接
在一些实施方案中,本发明所述的RNA抑制剂的反义链与表16中的各序列相差一个、两个或三个核苷酸。
在一些实施方案中,本发明所述的RNA抑制剂是由表15的正义链或与这些正义链相差一个、两个或三个核苷酸的序列和表16中的反义链或与这些反义链相差一个、两个或三个核苷酸的序列随机配对形成的。
在一些实施方案中,评估将不同组合的5'MVIP和3'MVIP放在正义链(SEQ ID NO.:534)和/或反义链(SEQ ID NO.:435)对应末端,考察所得RNA抑制剂对LDL-C降低效果影响。同时也考察了正义链mer数的不同所得RNA抑制剂对对LDL-C降低效果影响。RNA抑制剂代码、所含的单链及SEQ ID NO.如下表17。
表17:RNA抑制剂代码、所含的单链及SEQ ID NO.
优选出正义链5’MVIP和反义链3’MVIP的组合为5’MVIP01/3’MVIP01、5’MVIP01/3’MVIP17或5’MVIP09/3’MVIP09及正义链上的5’MVIP和3’MVIP的组合为5’MVIP01/3'MVIP09或5’MVIP09/3'MVIP01,所得的PCSK9 RNA抑制剂对血清中LDL-C水平都具有显著的降低作用。
另一方面,本发明还提供了一种上述RNA抑制剂或其药学上可接受的盐在制备用于治疗或/和预防脂质失调方面的疾病的药物中的应用,其中,所述脂质失调方面的疾病是由PCSK9基因介导的,包括但不限于高脂血症、动脉粥样硬化、与PCSK9基因介导有关的其它疾病。
再一方面,本发明提供了一种药物组合物,该药物组合物包括上述RNA抑制剂或其药学上可接受的盐和药学上可接受的辅料,其剂型为口服剂、静脉注射剂或者皮下或肌内注射剂,优选为皮下注射剂。
又一方面,本发明提供了一种药物组合物,该药物组合物包含上述RNA抑制剂或其药学上可接受的盐和其他治疗高脂血症的药物,其中,所述其他治疗高脂血症的药物包括但不限于已在临床上使用的贝特类、他汀类、胆汁酸隔离剂、烟酸类。
在一些实施方案中,使用细胞株Hep3B考察了当5'MVIP和/或3'MVIP结构中X、L、B、D、R
在一些实施方案中,使用细胞株Hep3B考察了不同肝靶向特异性配体X对所述的RNA抑制剂降低PCSK9基因表达水平效果的影响:
表18:不同肝靶向特异性配体X的RNA抑制剂
在一些实施方案中,使用细胞株Hep3B考察了不同支链L对所述的RNA抑制剂作用效果的影响:
表19:不同支链L的RNA抑制剂
备注:标有*的RNA抑制剂,表示在同一个5'MVIP或3'MVIP结构中或5'MVIP与3'MVIP彼此L结构不同。
在一些实施方案中,使用细胞株Hep3B考察了接头B对所述的RNA抑制剂降低PCSK9基因表达水平效果的影响:
表20:不同接头B的RNA抑制剂
备注:标有*的RNA抑制剂,表示5'MVIP与3'MVIP彼此之间的接头B结构不同。
在一些实施方案中,使用细胞株Hep3B考察了连接链D对所述的RNA抑制剂降低PCSK9基因表达水平效果的影响:
表21:不同连接链D的RNA抑制剂
备注:标有*的RNA抑制剂,表示5'MVIP与3'MVIP彼此之间的连接链D结构不同。
在一些实施方案中,使用细胞株Hep3B考察了不同转接点R
表22:不同转接点R
在一些实施方案中,使用细胞株Hep3B考察了不同转接点R
表23:不同转接点R
在一些实施方案结果显示中,本发明所述的RNA抑制剂对食蟹猴血液中LDL-C水平降低有显著效果,且持续性好。
附图说明
为了使本发明的目的、技术方案和有益效果更加清楚,本发明提供如下附图:
图1为实施例1中1.1.5中合成的ERCd-01-c2的高分辨质谱图;
图2为实施例1中1.2.6中合成的3’MVIP17-c1的高分辨质谱图;
图3为实施例1中2.1.2中合成的5’MVIP09-ERCd-PFP-c2的高分辨质谱图;
图4为实施例2中的RNA抑制剂对细胞株Hep3B中PCKS9基因表达水平抑制效果图;
图5为实施例2中的RNA抑制剂对细胞株Hela中PCKS9基因表达水平抑制效果图;
图6为实施例3中的RNA抑制剂干预后小鼠血液中LDL-C水平变化率图;
图7为实施例4中的RNA抑制剂干预后小鼠血液中LDL-C水平变化率图;
图8为实施例5中的RNA抑制剂干预后小鼠血液中LDL-C水平变化率图;
图9为实施例6、7和9中不同X/L/D对RNA抑制剂降低PCSK9的基因表达水平效果的影响图;
图10为实施例8中不同接头B对RNA抑制剂降低PCSK9的基因表达水平效果的影响图;
图11为实施例10和11中不同转接点R1/R2对RNA抑制剂降低PCSK9的基因表达水平效果的影响图;
图12为实施例12中的RNA抑制剂干预后食蟹猴血液中PCSK9蛋白水平变化率图;
图13为实施例12中的RNA抑制剂干预后食蟹猴血液中LDL-C水平变化率图。
具体实施方式
以下实施例说明了本发明公开的一些实施方案,但并不局限于这些。此外,在提供具体实施方案时,本发明人预期了那些具体实施方案的应用。例如具有具体同类或类似化学结构的RNA抑制剂,用于不同的肝源性疾病的治疗。
说明:
DMSO的中文名称为二甲基亚砜;
DMF的中文名称为N,N-二甲基甲酰胺;
HOBt的中文名称为1-羟基苯并三氮唑;
HBTU的中文名称为O-苯并三氮唑-四甲基脲六氟磷酸酯;
DIPEA(DIEA)的中文名称为N,N-二异丙基乙胺;
DCM的中文名称为二氯甲烷;
DMAP的中文名称为4-二甲氨基吡啶;
DMT-CL的中文名称为4,4'-二甲氧基三苯基氯甲烷;
MEOH的中文名称为甲醇;
TBTU的中文名称为O-苯并三氮唑-N,N,N',N'-四甲基脲四氟硼酸;
实施例1、RNA抑制剂的固相亚磷酰胺法合成
本发明所述的RNA抑制剂包括但不限于Ky08-DS0103、Ky08-DS0105、Ky08-DS0107、Ky08-DS0109和Ky08-DS0111和Ky08-DS0113是通过固相亚磷酰胺法得到各自的正义链和反义链,正义链与对应的反义链互补退火得到终产品。固相亚磷酰胺法基本步骤包括:1)脱保护:脱掉起始单体Solid Support羟基保护基(DMTr);2)偶联:加上第一个亚磷酰胺单体,通过3’至5’方向发生偶联反应;3)氧化:将所得的核苷亚磷酸酯氧化成更稳定的核苷磷酸酯(即三价磷氧化成五价磷);4)封闭:将没有反应的前一步核苷酸单体5’-OH加冒封死,使其不再进一步参与反应;重复上述步骤,直至最后一个亚磷酰胺单体的接入。然后用甲胺水溶液和氨水裂解Solid Support与起始单体之间酯键,并将所得寡聚核苷酸上的各个碱基与磷酸上的保护基氰乙基(P)、苯甲酰基(mA、fA)、乙酰基(mC)等脱掉。经HPLC分离纯化后,过滤除菌,冻干得到相应的正义链或反义链。
退火精确测定正义链和反义链复溶溶液的浓度,按等摩尔浓度进行混合后,加入该体积1/20体积的1M PBS溶液再次混匀,将混合体系加热至95℃,持续5min,然后自然降温3h至40℃或者室温时,进行HPLC检测,若单链残余<5%即可认为反应完成。
当本发明的RNA抑制剂的正义链或反义链的3'端有3'MVIP时,3'MVIP的solidsupport作为固相合成的起始单体,3’MVIP的solid spport通式如下:
m为1-4时,通式中接头B部分分别支化1至4次,以获得对应的3’MVIP的SolidSupport。
当m为1时,所得的Solid Support作为RNA抑制剂Ky08-DS0105的正义链和Ky08-0111反义链固相合成的起始单体;当m为2时,所得的Solid Support作为RNA抑制剂Ky08-DS0107、Ky08-DS0109的正义链和Ky08-DS0103的反义链的固相合成起始单体;
当m为3时,所得的Solid Support作为RNA抑制剂Ky08-DS0113的反义链的固相合成起始单体。
当本发明的RNA抑制剂的正义链或反义链的5'端有5’MVIP时,5’MVIP亚磷酰胺单体是作为正义链或反义链固相合成的最后一个亚磷酰胺单体。5’MVIP亚磷酰胺单体通式如下:
n为1-4时,通式中接头B部分分别支化1至4次,以获得对应的5’MVIP亚磷酰胺单体。
当n为1时,所得的5’MVIP亚磷酰胺单体作为RNA抑制剂Ky08-DS0107、Ky08-DS0111和Ky08-DS0113的正义链固相合成的最后一个单体;当n等于2时,所得的5’MVIP亚磷酰胺单体作为Ky08-DS0103、Ky08-DS0105和Ky08-DS0109的正义链固相合成的最后一个单体。
当n等于3时,所得的带3个配体X的5’MVIP亚磷酰胺单体可作为正义链或反义链固相合成的最后一个单体。本发明所述的这些RNA抑制剂的正义链和反义链在进行亚磷酰胺固相合成之前,需要先化学合成相应的3’MVIPSolid Support和5’MVIP亚磷酰胺单体。化学合成过程叙述如下:
1. 3’MVIP Solid Support的合成
1.1 RNA抑制剂Ky08-DS0103的反义链和Ky08-DS0107、Ky08-DS0109正义链的3'MVIP09的Solid Support的合成
合成过程描述:
1.1.1.ERC-01-c1的合成
称取2-氨基-1,3-丙二醇(5.0g,54.9mmol)加入DMSO 50mL,氢氧化钠溶液(1g/mL)5mL,降温到0℃,滴加丙烯酸叔丁酯(20mL,137.8mol)2小时加完,室温反应48h,加石油醚(100mL),饱和食盐水洗2次,有机层干燥。过层析柱(洗脱液:乙酸乙酯:石油醚=25%-75%),上柱加0.05%的三乙胺,得无色油状物6.2g。
1.1.2.ERC-01-c2的合成
称取ERC-01-c1(6.2g,17.9mmol),加二氯甲烷50mL,碳酸钠溶液(25%)23mL,室温滴加氯甲酸苄酯(8.2mL,57.4mmol),2小时滴加完,室温反应过夜,饱和食盐水洗涤3次,无水硫酸钠干燥,蒸干溶剂,过层析柱(乙酸乙酯:石油醚=5%-30%)得油状物4.0g。
1.1.3.ERC-01-c3的合成
取ERC-01-c2(4.0g,8.3mmol)加甲酸12mL,室温反应过夜,减压蒸干溶剂,得产品2.8g。
1.1.4.ERCd-01-c1的合成
将化合物ERC-01-c3(1.11g,3.0mmol)和dlSANC-c4(3.6g,8.04mmol)加到DMF(60mL)中,然后加入HOBt(2.24g)和HBTU(3.36g),然后缓慢加入DIEA(4.16mL)。反应液室温下搅拌反应3小时。然后加入水,水层用二氯甲烷萃取(2x10mL)。合并有机层,然后依次用饱和碳酸氢钠(80mL)、水(2x60 mL)、饱和食盐水(60mL)洗。用无水硫酸钠干燥,减压蒸干,用硅胶柱层析纯化(洗脱液:3-15%MeOH in DCM)。得淡黄色固体3.24g。
1.1.5.ERCd-01-c2的合成
ERCd-01-c1(3.24g,2.6mmol)用甲醇(60mL)溶解,加入10%钯碳(0.3g),乙酸(2.0mL)。然后常压下加氢,反应过夜。反应液用硅藻土过滤,滤液减压蒸干,得油状物ERCd-01-c22.9g,其高分辨质谱图见图1。
1.1.6. 3’MVIP09-c1的合成
向反应瓶内依次加入SANCd-01-c0(0.824g,1.5mmol)和ERCd-01-c2(1.09g,1.0mmol),再加入10mL的DCM,搅拌溶解,再依次加入TBTU(0.963g)和DIPEA(0.517g),反应过夜,加水,用DCM萃取,有机相再用饱和食盐水洗涤,干燥、过滤、浓缩,最后过硅胶柱进行纯化,得产品1.3g。
1.1.7. 3’MVIP09-c2的合成
向反应瓶内依次加入3’MVIP09-c1(1.62g,1mmol)和10mL的DCM,室温搅拌溶解,再依次加入DMAP(0.366g)和丁二酸酐(0.3g,3mmol),室温搅拌反应,TLC分析,反应合格浓缩掉DCM,加水,用DCM萃取,有机相再用饱和食盐水洗涤,有机相经无水硫酸钠干燥、过滤、浓缩,最后过硅胶柱进行纯化,得到产品为1.55g。
1.1.8. 3’MVIP09 Solid Support合成
向反应瓶内依次加入3’MVIP09-c2(0.86g,0.5mmol)和10mL DMF,溶解,再依次加入HBTU(0.19g)、DIPEA(0.194g)和大孔氨甲基树脂(2.0g),摇床24h,过滤,所得产品用10%甲醇/DCM洗涤,再用25%醋酸/吡啶进行封端,取代度150μmol/g。
1.2 RNA抑制剂Ky08-DS0113的反义链的3'MVIP17的Solid Support的合成
1.2.1.SANC-01-c1的合成
合成步骤参照实施例1中1.1.1.ERC-01-c1的合成。1.2.2.SANC-01-c2的合成
合成步骤参照实施例1中1.1.2.ERC-01-c2的合成。
1.2.3.SANC-01-c3的合成
合成步骤参照实施例1中1.1.3.ERC-01-c3的合成。
1.2.4.SANCd-01-c1的合成
合成步骤参照实施例1中1.1.4.ERCd-01-c1的合成。
1.2.5.SANCd-01-c2的合成
合成步骤参照实施例1中1.1.5.ERCd-01-c2的合成。
1.2.6. 3’MVIP17-c1的合成
合成步骤参照实施例1中1.1.6.3’MVIP09-c1的合成,合成所得3’MVIP17-c1的高分辨质谱图见图2。
1.2.7. 3’MVIP17-c2的合成
合成步骤参照实施例1中1.1.7.3’MVIP09-c2的合成。
1.2.8. 3’MVIP17的Solid Support合成
合成步骤参照实施例1中1.1.8 3’MVIP09的Solid Support合成。
1.3 RNA抑制剂Ky08-DS0105正义链和Ky08-DS0111反义链的3'MVIP01的SolidSupport的合成:
合成过程描述:
1.3.1. 3’MVIP01-c1的合成
合成步骤参照实施例1中1.1.6.3’MVIP09-c1的合成。
1.3.2. 3’MVIP01-c2的合成
合成步骤参照实施例1中1.1.7.3’MVIP09-c2的合成。
1.3.3. 3’MVIP01 Solid Support合成
合成步骤参照实施例1中1.1.8.3’MVIP09 Solid Support合成。
2. 5’MVIP亚磷酰胺单体的合成
2.1当n为2时,所得的5’MVIP亚磷酰胺单体作为Ky08-DS0103、Ky08-DS0105和Ky08-DS0109正义链固相合成的最后一个单体5’MVIP09亚磷酰胺单体的合成:
2.1.1. 5’MVIP09-ERCd-PFP-c1的合成
称量ERCd-01-c2(2.18g,2.0mmol)溶于DMF(50mL),加戊二酸单苄酯(0.53g,2.4mmol)、DIPEA(0.78g)与TBTU(0.84g),室温搅拌过夜,加水淬灭(50mL),DCM(30mL*3)萃取,10%柠檬酸(50mL*3)、饱和碳酸氢钠50mL和吡啶100mL洗涤,无水硫酸钠干燥,过滤,旋蒸,过柱纯化得产品5’MVIP09-ERCd-PFP-c1(2.15g)。
2.1.2. 5’MVIP09-ERCd-PFP-c2的合成
称量5’MVIP09-ERCd-PFP-c1(2.15g,1.66mmol)和10%钯碳(0.21g),加甲醇(50mL),室温搅拌加氢过夜,反应结束后硅藻土过滤钯碳,旋蒸得5’MVIP09-ERCd-PFP-c2粗品(1.9g),其高分辨率质谱图如图3所示。
2.1.3. 5’MVIP09-ERCd-PFP的合成
称量5’MVIP09-ERCd-PFP-c2粗品(1.9g,1.58mmol)溶于DCM(60mL),加DIPEA(1.33g),冷却,加三氟乙酸五氟苯酚酯(2.21g,7.9mmol),室温搅拌反应2h后旋蒸,再溶于DCM(60mL),饱和碳酸氢钠(30mL*3)、10%柠檬酸(30mL*1)、饱和食盐水(50mL*1)洗涤,无水硫酸钠干燥,过滤,旋蒸得5’MVIP09-ERCd-PFP粗品(2.35g),抽干后无纯化直接用于下一步反应。
2.1.4. 5’MVIP09亚磷酰胺单体-c1的合成
5’MVIP09-ERCd-PFP粗品(2.35g,1.58mmol)溶于DCM(60mL),加DIPEA(0.82g,6.32mmol)、6-氨基-1-己醇(0.37g,3.16mmol),室温搅拌反应过夜。加10%柠檬酸(30mL),DCM(30mL*3)萃取,饱和食盐水(50mL)洗涤,无水硫酸钠干燥,过滤、旋蒸,过柱纯化得产品5’MVIP09单体-c1(1.73g)。
2.1.5. 5’MVIP09亚磷酰胺单体
称量5’MVIP09亚磷酰胺单体-c1(1.3g、1.0mmol)溶于乙腈(30mL),加入二异丙胺三氮唑(0.111102g),冰浴下滴加双-(二异丙基氨基)(2-氰基乙氧基)膦(0.36g,1.2mmol),室温反应4h,HPLC中控,反应合格后,浓缩过柱纯化得到产品5’MVIP09单体(1.2g)。
2.2当n为1时,所得的5’MVIP亚磷酰胺单体作为Ky08-DS0107、Ky08-DS0111和Ky08-DS0113的正义链固相合成的最后一个单体5'MVIP01亚磷酰胺单体的合成:
5'MVIP01的亚磷酰胺单体称量YICd-01-c2(1.12g,2.0mmol),剩余操作参照2.1.1.~2.1.5.。
实施例2:使用Hep3B和Hela细胞株筛选RNA抑制剂的序列
试验过程描述:
使用本领域公开成熟的亚磷酰胺固相合成方法制备相应的RNA抑制剂Ky08-DS01~Ky08-DS15。配制含10%胎牛血清的DMEM培养基。细胞(Hep3B和Hela细胞)分别在10cm培养皿中培养至80-90%融合时,接种6孔板。倾去培养液,用2mL PBS洗涤细胞两次。加入2mLTrypsin-EDTA溶液,混匀后,37℃放置3-5分钟。小心吸去胰酶溶液,加入2mL含10%FBS的DMEM培养液,吹打使细胞形成单细胞悬液。血球计数板计数,将细胞稀释至1.5×10
试验结果:所得试验数据见图4和图5。如图4和图5所示,在加药量为0.5nM和10nM时,其中Ky08-DS01、Ky08-DS04、Ky08-DS06、Ky08-DS07、Ky08-DS08、Ky08-DS10对Hep3B和Hela细胞株中PCSK9基因表达水平的抑制有显著效果。
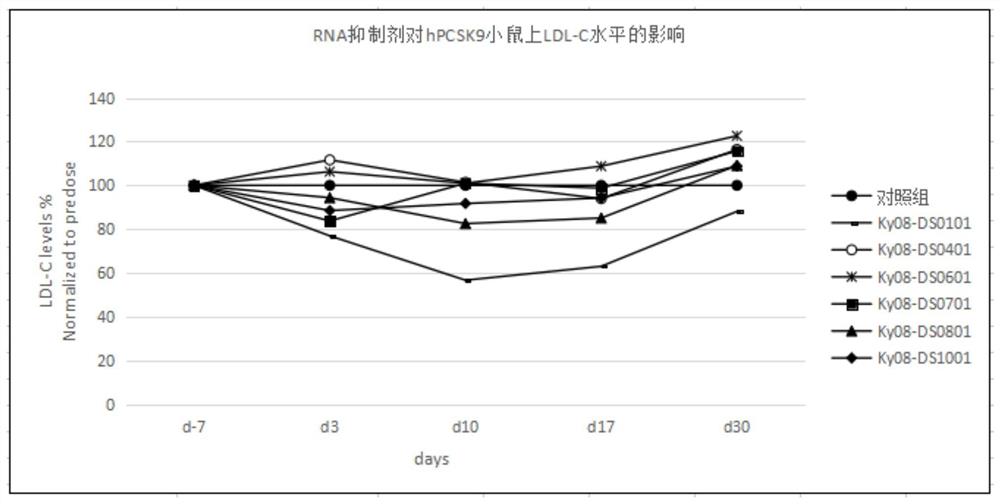
实施例3:RNA抑制剂在B6-hPCSK9小鼠高血脂模型中的体内药效探索研究1
试验过程描述:按实施例1所述的方法制备相应的RNA抑制剂Ky08-DS0101、Ky08-DS0401、Ky08-DS0601、Ky08-DS0701、Ky08-DS0801、Ky08-DS1001。
B6-hPCSK9小鼠35只,适应性饲养结束后根据体重随机分为对照组以及给药组,每组5只。喂养5周后,对小鼠进行4~5h禁食,随后眼眶采血(≤75μL),分离血浆后检测低密度脂蛋白胆固醇(LDL-C)的水平。当WD喂养组小鼠LDL-C水平均值达1.2mmol/L则判定模型构建成功。所有小鼠自采血后恢复一周,根据LDL-C水平随机分为15组,每组5只。分组给药当天定义为Day0,给药时间为当天上午。将每个RNA抑制剂加生理盐水配制成0.6mg/mL的溶液。在首次给药后7天、10天、17天和30天对所有小鼠禁食4-5h,随后眼眶采集血液,分离血浆后,检测LDL-C水平。
试验结果:RNA抑制剂干预后小鼠血液中LDL-C水平变化率见图6。B6-hPCSK9小鼠在给予5周西方饮食饲料喂养后,其LDL-C水平较对照饲料喂养的B6-hPCSK9小鼠提高4倍以上,差异显著(p<0.0001),表明高脂血症模型构建成功。在给药后3、10、17和30天后,Ky08-DS0101处理组小鼠血浆LDL-C水平表现出显著的下降趋势,在给药10天后LDL-C水平达最低值,随后逐渐回升。其中在给药10天和17天后Ky08-DS0101处理组小鼠血浆LDL-C水平与对照组相比差异具有显著性(Day10,1.16±0.21mmol/L Vs2.03±0.21mmol/L,p<0.001;Day17,1.32±0.12mmol/L Vs 2.12±0.44mmol/L,p<0.01)。在给药后,Ky08-DS0101处理组小鼠血浆LDL-C水平与本组给药前(Day-7)相比,在给药后第10天呈现出良好的降脂效果,并且单次给药药效维持至17天。在给药后3、10、17和30天后,Ky08-DS0401和Ky08-DS0601处理组小鼠血浆LDL-C水平与对照组相比无明显下降趋势,且差异无显著性(p>0.05)。Ky08-DS0701处理组小鼠在给药3天后出现LDL-C水平降低,但与对照组以及本组小鼠给药前相比差异无显著性(p>0.05),并且该组小鼠血浆LDL-C水平在给药10天后恢复至对照组以及本组给药前水平。Ky08-0801处理组小鼠在给药3、10以及17天后出现LDL-C水平降低,但与模型对照以及本组小鼠给药前相比差异无显著性(p>0.05),在给药30天后该组小鼠血浆LDL-C水平恢复至对照组以及本组给药前水平。Ky08-DS1001处理组小鼠在给药3和10天后出现LDL-C水平降低,但与对照组以及本组小鼠给药前相比差异无显著性(p>0.05),在给药17天后该组小鼠血浆LDL-C水平恢复至对照组以及本组给药前水平。优选出Ky08-DS0101作进一步序列优化修饰。
实施例4:RNA抑制剂在B6-hPCSK9小鼠高血脂模型中的体内药效探索研究2
按实施例1所述的方法制备相应的RNA抑制剂Ky08-DS0102、Ky08-DS0402、Ky08-DS0403、Ky08-DS0602、Ky08-DS0603、Ky08-DS0702、Ky08-DS0802、Ky08-DS1002。
B6-hPCSK9小鼠45只,适应性饲养结束后根据体重随机分为对照组(n=1)以及给药组(n=8)。喂养5周后,对小鼠进行4~5h禁食,随后眼眶采血(≤75μL),分离血浆后检测低密度脂蛋白胆固醇(LDL-C)的水平。当WD喂养组小鼠LDL-C水平均值达1.2mmol/L则判定模型构建成功。所有小鼠自采血后恢复一周,根据LDL-C水平随机分为7组,每组5只。分组给药当天定义为Day0,给药时间为当天上午。将每个RNA抑制剂加生理盐水配制成0.6mg/mL的溶液。在首次给药后7天、10天、17天、30天、39天、46天对所有小鼠禁食4-5h,随后眼眶采集血液,分离血浆后,检测LDL-C水平。
试验结果:RNA抑制剂干预后小鼠血液中LDL-C水平变化率见图7。B6-hPCSK9小鼠在给予5周西方饮食饲料喂养后,其血液中LDL-C水平的均值已达1.8mmol/L以上,而在过往试验中B6-hPCSK9小鼠在普通饲料喂养下血液中LDL-C水平在0.4mmol/L左右,表明高胆固醇血症模型构建成功。与溶剂对照组相比,Ky08-DS0102可显著降低高胆固醇血症B6-hPCSK9小鼠血液中LDL-C水平,在Day21时LDL-C水平达最低值,随后逐渐回升。其中在Day7、Day14、Day21、Day32以及Day39时,Ky08-DS0102处理组小鼠血液LDL-C水平与溶剂对照相比差异具有显著性(Day7,p<0.001;Day14,p<0.01;Day21,p<0.0001;Day32,p<0.01;Day 39,p<0.05)。在药物干预后,Ky08-DS0102处理组小鼠血液中LDL-C水平与本组给药前(Day-7)相比,在前三周表现出良好的降脂效果,分别降低了46.71%、43.11%和54.34%。与对照组相比,Ky08-DS0402、Ky08-DS0403、Ky08-DS0602、Ky08-DS0603、Ky08-DS0702、Ky08-DS0802和Ky08-DS1002的干预均可使高胆固醇血症B6-hPCSK9小鼠血液中LDL-C水平Day7时下降,但仅Ky08-DS0603和Ky08-DS0702干预组与溶剂对照组相比差异具有显著性(Ky08-DS0603,p<0.01;Ky08-DS0702,p<0.05);并且在Day14和Day21时,Ky08-DS0402、Ky08-DS0403、Ky08-DS0602、Ky08-DS0603、Ky08-DS0702、Ky08-DS0802和Ky08-DS1002处理组小鼠血液中LDL-C水平明显回升,在Day32时抑制效果小于20%。Day39时,Ky08-DS0102处理组小鼠血液中LDL-C的水平与对照组相比显著降低(p<0.001)。药效测试过程中,各药物干预组无小鼠出现体重剧烈下降等异常状态,无小鼠意外死亡,试验动物对药物的耐受性良好。优选出Ky08-DS0102作为进一步优选RNA抑制剂。
实施例5:不同的5'MVIP/3'MVIP组合形成的RNA抑制剂RNA抑制剂在B6-hPCSK9小鼠高血脂模型中的体内药效探索研究
评估将不同组合的5'MVIP和3'MVIP放在优选出来的RNA抑制剂Ky08-DS0102的正义链(SEQ ID NO.:411)从21mer缩减至19mer所得正义链(SEQ ID NO.:534)和/或反义链(SEQ ID NO.:435)对应末端,考察所得RNA抑制剂对LDL-C降低效果影响。试验过程描述:
按实施例1所述的方法制备得到相应的RNA抑制剂Ky08-DS0102、Ky08-DS0103、Ky08-DS0105、Ky08-DS0107、Ky08-DS0109、Ky08-DS0111、Ky08-DS0113。
B6-hPCSK9小鼠40只,适应性饲养结束后根据体重随机分为对照组以及给药组,每组5只。喂养5周后,对小鼠进行4~5h禁食,随后眼眶采血(≤75μL),分离血浆后检测低密度脂蛋白胆固醇(LDL-C)的水平。当WD喂养组小鼠LDL-C水平均值达1.2mmol/L则判定模型构建成功。所有小鼠自采血后恢复一周,根据LDL-C水平随机分为13组,每组5只。分组给药当天定义为Day0,给药时间为当天上午。将每个RNA抑制剂加生理盐水配制成0.6mg/mL的溶液。在首次给药后7天、14天、21天、28天以及35天对所有小鼠禁食4-5h,随后眼眶采集血液,分离血浆后检测LDL-C水平。
试验结果:RNA抑制剂干预后小鼠血液中LDL-C水平变化率见图8。结果显示RNA抑制剂Kylo-DS0102、Ky08-DS0103、Kylo-DS0105、Kylo-DS0107、Kylo-DS0109、Kylo-DS0111和Kylo-DS0113对小鼠模型血液中LDL-C水平都具有显著的降低效果,各组单次给药都可以连续3周使LDL-C水平降低不低于40%左右。其中Ky08-DS0103给药组在给药后d14天个体出现55%降低的最佳效果,组平均降低达到49%。
实施例6使用细胞株Hep3B评估不同肝靶向特异性配体X对RNA抑制剂降低PCSK9的基因表达水平效果的影响
考察不同肝靶向特异性配体X对RNA抑制剂降低PCSK9基因表达水平效果的影响,所得的RNA抑制剂中Ky08-DS0103、Ky08-DS0103-X2~Ky08-DS0103-X6除X结构改变外,L、B、D及R
试验所涉及的RNA抑制剂中的正义链为SEQ ID NO:534,反义链为SEQ ID NO:435,正义链5'末端偶联5'MVIP,反义链3'末端偶联3'MVIP。
试验过程描述:按实施例1所述的方法制备相应的RNA抑制剂,配制含10%胎牛血清的DMEM培养基。用培养液配制含10nM RNA抑制剂样品的培养基。以10
所得试验数据见图9。结果表明,当X分别为半乳糖、半乳糖胺、N-乙酰半乳糖胺及其衍生物时,所得RNA抑制剂优选N-乙酰半乳糖胺及其衍生物作为配体。
实施例7使用细胞株Hep3B评估不同支链L对RNA抑制剂降低PCSK9基因表达水平效果的影响
考察不同支链L对RNA抑制剂降低PCKS9基因表达水平效果的影响,所得RNA抑制剂中Ky08-DS0103、Ky08-DS0103-L2~Ky08-DS0103-L14除L结构改变外,X、B、D及R
试验所涉及的RNA抑制剂中的正义链为SEQ ID NO:534,反义链为SEQ ID NO:435,正义链5'末端偶联5'MVIP,反义链3'末端偶联3'MVIP。
试验过程描述:按实施例1所述的方法制备相应的RNA抑制剂,配制含10%胎牛血清的DMEM培养基。Hep3B在10cm培养皿中培养至80-90%融合时,接种6孔板。倾去培养液,用2mL PBS洗涤细胞两次。加入2mL Trypsin-EDTA溶液,混匀后,37℃放置3-5分钟。小心吸去胰酶溶液,加入2mL含10%FBS的DMEM培养液,吹打使细胞形成单细胞悬液。血球计数板计数,将细胞稀释至1.5×10
所得试验数据见图9。结果表明,L直链所含碳数对RNA抑制剂的作用效果影响较大,链长为C7-C18这个范围内作用效果较好;当含有-NH-、C=O、O、S、酰胺基、磷酰基、硫代磷酰基、脂肪族碳环基如环己烷或者这些基团的组合时,在5’MVIP与3’MVIP各自的内部或5’MVIP与3’MVIP之间可以相同,也可以不同,所得RNA抑制剂对PCSK9基因表达水平抑制效果无显著影响。
实施例8使用细胞株Hep3B评估接头B对RNA抑制剂降低PCSK9基因表达水平效果的影响
考察不同接头B对RNA抑制剂降低PCSK9的基因表达水平效果的影响,所得RNA抑制剂Ky08-DS0103、Ky08-DS0103-B2~Ky08-DS0103-B7、Ky08-DS0113、Ky08-DS0113-B2~Ky08-DS0113-B12、Ky08-DS0111、Ky08-DS0111-B2~Ky08-DS0111-B7、Ky08-DS0107、Ky08-DS0107-B2~Ky08-DS0107-B6、Ky08-DS0105、Ky08-DS0105-B2~Ky08-DS0105-B6,除B结构改变外,X、L、D及R
试验所涉及的RNA抑制剂中的正义链为SEQ ID NO:534,反义链为SEQ ID NO:435,正义链5'末端偶联5'MVIP,反义链3'末端偶联3'MVIP。
试验过程描述:按实施例1所述的方法制备相应的RNA抑制剂,配制含10%胎牛血清的DMEM培养基。Hep3B在10cm培养皿中培养至80-90%融合时,接种6孔板。倾去培养液,用2mL PBS洗涤细胞两次。加入2mL Trypsin-EDTA溶液,混匀后,37℃放置3-5分钟。小心吸去胰酶溶液,加入2mL含10%FBS的DMEM培养液,吹打使细胞形成单细胞悬液。血球计数板计数,将细胞稀释至1.5×10
所得试验数据见图10。结果表明,除接头B结构改变外,而X、L、D及R
实施例9使用细胞株Hep3B评估连接链D对RNA抑制剂降低PCSK9基因表达水平效果的影响
考察不同连接链D对RNA抑制剂降低PCSK9基因表达水平效果的影响,所得RNA抑制剂Ky08-DS0103、Ky08-DS0103-D2~Ky08-DS0103-D5除D结构改变外,X、L、B及R
试验所涉及的RNA抑制剂中的正义链为SEQ ID NO:534,反义链为SEQ ID NO:435,正义链5'末端偶联5'MVIP,反义链3'末端偶联3'MVIP。
试验过程描述:按实施例1所述的方法制备相应的RNA抑制剂,配制含10%胎牛血清的DMEM培养基。Hep3B在10cm培养皿中培养至80-90%融合时,接种6孔板。倾去培养液,用2mL PBS洗涤细胞两次。加入2mL Trypsin-EDTA溶液,混匀后,37℃放置3-5分钟。小心吸去胰酶溶液,加入2mL含10%FBS的DMEM培养液,吹打使细胞形成单细胞悬液。血球计数板计数,将细胞稀释至1.5×10
所得试验数据见图9。结果表明,除连接链D结构改变外,而X、L、B及R
实施例10:使用细胞株Hep3B评估不同R
考察不同转接点R
试验所涉及的RNA抑制剂中的正义链为SEQ ID NO:534,反义链为SEQ ID NO:435,正义链5'末端偶联5'MVIP,反义链3'末端偶联3'MVIP。
试验过程描述:按实施例1所述的方法制备相应的RNA抑制剂,配制含10%胎牛血清的DMEM培养基。Hep3B在10cm培养皿中培养至80-90%融合时,接种6孔板。倾去培养液,用2mL PBS洗涤细胞两次。加入2mL Trypsin-EDTA溶液,混匀后,37℃放置3-5分钟。小心吸去胰酶溶液,加入2mL含10%FBS的DMEM培养液,吹打使细胞形成单细胞悬液。血球计数板计数,将细胞稀释至1.5×10
所得试验数据见图11。结果表明,不同的转接点R1会对RNA抑制剂抑制PCKS9基因表达水平的效果有影响,其中R1-1作为转接点的降低PCKS9基因表达水平效果优于其他转接点。
实施例11:使用细胞株Hep3B评估不同R
考察不同转接点R
试验所涉及的RNA抑制剂中的正义链为SEQ ID NO:534,反义链为SEQ ID NO:435,正义链5'末端偶联5'MVIP,反义链3'末端偶联3'MVIP。
试验过程描述:按实施例1所述的方法制备相应的RNA抑制剂,配制含10%胎牛血清的DMEM培养基。Hep3B在10cm培养皿中培养至80-90%融合时,接种6孔板。倾去培养液,用2mL PBS洗涤细胞两次。加入2mL Trypsin-EDTA溶液,混匀后,37℃放置3-5分钟。小心吸去胰酶溶液,加入2mL含10%FBS的DMEM培养液,吹打使细胞形成单细胞悬液。血球计数板计数,将细胞稀释至1.5×10
所得试验数据见图11。结果表明,不同的转接点R
实施例12:RNA抑制剂在食蟹猴的体内药效探索研究
试验过程描述:按实施例1所述的方法制备相应的RNA抑制剂Ky08-DS0103、Ky08-DS0105、Ky08-DS0107、Ky08-DS0109、Ky08-DS0111和Ky08-DS0113。
选取14只4~7岁雌性食蟹猴适应性饲养结束后根据体重随机分为对照组以及给药组,每组2只。给药剂量为6mg/kg。分组给药当天定义为Day0,给药时间为当天上午。在首次给药后7天、14天、21天、28天、35天、42天和60天采集血液,分离血浆后,检测LDL-C和PCSK9蛋白水平。
试验结果:RNA抑制剂干预后小鼠血液中PCSK9蛋白和LDL-C水平和水平变化率见图12和图13。图12结果显示,RNA抑制剂Ky08-DS0103、Ky08-DS0105、Ky08-DS0107、Ky08-DS0111和Ky08-DS0113对食蟹猴血液中PCSK9水平都呈现出显著降低的效果,各组连续60天都可以使血液中的PCSK9水平降低率维持在至少70%左右。其中Ky08-DS0103在给药第14天,最高可以使血液中PCSK9水平下降83%,可以连续60天左右维持在80%左右的降低率。图13结果显示,给药后第7天,各给药组都可以使血液中LDL-C水平降低50%左右,且这样显著的降低率可持续至42天。其中Ky08-DS0103效果呈现最佳,在给药后第7天可以使LDL-C降低60%以上,且这样的降低率可以持续至第42天左右,至第60天仍具有高于40%的降低效果。
序列表
<110> 厦门甘宝利生物医药有限公司
<120> 一种抑制PCSK9基因表达的RNA抑制剂及其应用
<160> 2
<170> SIPOSequenceListing 1.0
<210> 1
<211> 21
<212> RNA
<213> 人工序列(Artificial Sequence)
<400> 1
ccaaagaugu caucaaugag g 21
<210> 2
<211> 21
<212> RNA
<213> 人工序列(Artificial Sequence)
<400> 2
ucauugauga caucuuuggc a 21
- 一种抑制PCSK9基因表达的RNA抑制剂及其应用
- 一种抑制PCSK9基因表达的siRNA分子及其应用
