HAP1在制备诊断、预防和/或治疗胃癌的产品中的应用
文献发布时间:2023-06-19 19:28:50
技术领域
本发明涉及医药生物技术领域,尤其涉及HAP1在制备诊断、预防和/或治疗胃癌的产品中的应用。
背景技术
胃癌是一种全世界范围内常见的多因素、复杂的恶性肿瘤,胃癌的发病率在所有恶性肿瘤中排名前五,同时也是造成死亡的第四大原因,我国是胃癌的高发高死亡地区,占全球发病人数的47%,且无论是发病率还是死亡率均占所有癌种的第二位,严重威胁人民的健康与生命。胃癌的发病机制涉及环境和遗传等多种因素,其中有些基因起着关键作用,对这些基因的生物学功能的研究和探讨有助于为临床提供有效精准的诊断方法、治疗靶点等,从而提高胃癌的早诊早治,延长患者的生存。
肿瘤抑制基因(Tumor suppressor genes),是指一类可抑制细胞生长、增殖,诱导细胞凋亡,并有抑制癌变潜能的基因。当它失活时,协同癌基因导致细胞恶性转化。目前常见的已分离的肿瘤抑制基因及其功能:①细胞信号转导和表观遗传学调控,如APC参与信号转导,NFl催化RNAs失活等。②细胞周期负调控,如Rb、p53、CDKN2A基因参与细胞周期调节。③负调控转录因子,如WT、DCC等基因。④与发育和干细胞增生相关调控,如APC、Axin、VHL、WTl等基因。⑤DNA错配修复,如MSH、MLH等基因。
亨廷顿蛋白相关蛋白1(huntingtin-associated protein 1,HAP1)是一种神经元蛋白,主要表达于神经系统,HAP1对于维持神经元存活以及调节动物的食物摄入量和体重至关重要。除了HAP1在中枢神经系统中的关键作用外,在内分泌系统和消化系统中也发现有HAP1的表达。HAP1与癌症之间的研究日益增多,主要涉及乳腺癌、胰腺癌、急性淋巴细胞白血病等。
免疫组化结果显示,HAP1在胃肠道的不同类型的内分泌器官和黏膜中存在差异性表达。HAP1表达主要集中在胃幽门部,特别是胃幽门腺的腺体底部。胃体部表达较少,贲门部几乎不含HAP1阳性细胞。HAP1基因在胃癌组织中低表达,在癌旁胃粘膜组织中高表达。HAP1在胃中的特异性表达差异提示HAP1与胃的生物学性状和功能存在相关性。
目前,HAP1基因在胃癌中的分子机制尚不完全清楚,其功能和表达变化的临床意义尚未有报道。因此,分析HAP1基因与胃癌发生发展的关系,探索针对HAP1基因途径的胃癌诊断和靶向治疗策略至关重要。
发明内容
本发明提供了HAP1在制备诊断、预防和/或治疗胃癌的产品中的应用,通过检测HAP1的表达水平,可以在早期诊断胃癌,及早进行有效的治疗手段,减低患者的死亡率;提供了以HAP1为靶点和核心的预防和/或治疗胃癌的药物,有望成为肿瘤靶向治疗的一种新手段,解决了现有技术中存在的问题。
本发明所采用的技术方案之一是:
HAP1作为生物标志物在制备早期诊断胃癌或胃癌预后预测的产品中的应用。
进一步的,所述产品是以HAP1为靶点的检测试剂或诊断药物。
进一步的,所述检测试剂或诊断药物包括特异性扩增HAP1的引物;所述引物包括上游引物如SEQ ID NO.1所示,以及下游引物如SEQ ID NO.2所示。
进一步的,所述检测试剂或诊断药物通过HAP1表达的变化水平进行早期诊断胃癌或胃癌预后。
进一步的,所述HAP1表达水平所对应的检测样本为胃癌组织或癌旁组织。
进一步的,所述检测试剂或诊断药物包括探针、抗体或核酸芯片。
进一步的,所述检测试剂或诊断药物以HAP1为基础进行RT-PCR或实时定量PCR检测。
进一步的,检测方法为:用β-actin作为对照,先提取RNA,通过逆转录准备cDNA。利用实时荧光定量PCR仪(Applied BiosystemS,USA)进行实时定量PCR检测。反应总体积10微升:1微升cDNA模板;1微升引物;5微升2×qPCR Master Mix;3微升无菌无酶水。反应参数如下:95℃预热5分钟;40个循环设置如下,95℃,15秒;60℃,1分钟;最后进行溶解曲线分析和表达分析。
本发明所采用的技术方案之二是:
HAP1在制备预防和/或治疗胃癌的产品中的应用。
进一步的,所述产品是以HAP1为靶点得到的药学上可接受的任意一种剂型的药物。
进一步的,所述药物的剂型为粉剂、注射剂、胶囊、片剂或口服液。
进一步的,所述药物包括表达载体,所述表达载体由抑癌基因HAP1和pLVX-Puro载体构建而成。
进一步的,所述的表达载体的制备方法,包括如下操作步骤:
(1)获得cDNA:全长HAP1基因的开放阅读框采用RT-PCR法从正常胃组织的总RNA中获得,然后进行扩增,扩增所用正向引物HAP1-cF如SEQ ID NO.3所示,扩增所用反向引物HAP1-cR如SEQ ID NO.4所示;
(2)将上述cDNA连接到pLVX-Puro载体,转化感受态细菌,在含氨苄青霉素培养LB板中培养,挑取阳性克隆培养,经测序选择正确克隆;
(3)抑癌基因HAP1表达载体的构建
抽提正确克隆的质粒,用限制性内切酶XhoI和EcoRI酶切后,经1%琼脂糖凝胶电泳分离后回收目的片段,连入线性化的pLVX-Puro载体,转化感受态细菌,在含氨苄青霉素培养LB板中培养,挑取阳性克隆培养,经酶切和测序双鉴定后,保存正确克隆,抽提质粒,即得。
本发明所采用的技术方案之三是:
一种预防或治疗胃癌的表达载体,由上述抑癌基因HAP1和pLVX-Puro载体构建而成。
本发明的有益效果:
本发明通过对HAP1蛋白及HAP1基因在胃癌组织及癌旁组织中的表达情况进行研究,在筛选HAP1基因低表达的肿瘤基础上,特异性恢复该抑癌基因在胃癌组织细胞中的表达,提供了胃癌靶向治疗的新手段和方法。本发明特异扩增HAP1的引物作为试剂及诊断药物,在胃癌靶向治疗中提供了诊断依据和有效治疗手段,为减低胃癌患者死亡率提供更及时的临床策略。
附图说明
图1为检测HAP1在正常胃粘膜组织和胃癌组织中表达水平;
图2为HAP1在胃粘膜上皮细胞GES-1和多种胃癌细胞系中表达水平;
图3为HAP1对胃癌细胞的增殖功能的影响;
图4为HAP1对胃癌细胞迁移和侵袭功能的影响;
图5为HAP1对胃癌细胞凋亡的影响;
其中,图1中a为免疫组化检测临床胃癌患者的胃癌组织和正常癌旁组织中的HAP1表达水平;图1中b为Western blot检测正常胃粘膜组织和胃癌组织中HAP1蛋白表达水平;图1中c为RT-qPCR检测正常胃粘膜组织和胃癌组织中HAP1的mRNA表达水平;
图2中a为Western blot检测GES-1和多种胃癌细胞系中的HAP1的蛋白表达水平;图2中b为RT-qPCR检测GES-1和多种胃癌细胞系中的HAP1的mRNA表达水平;图2中c为Western Blot检测过表达HAP1的胃癌细胞系MKN-28和AGS中HAP1的蛋白水平;图2中d为RT-qPCR检测过表达HAP1的胃癌细胞系MKN-28和AGS中HAP1的mRNA表达水平;
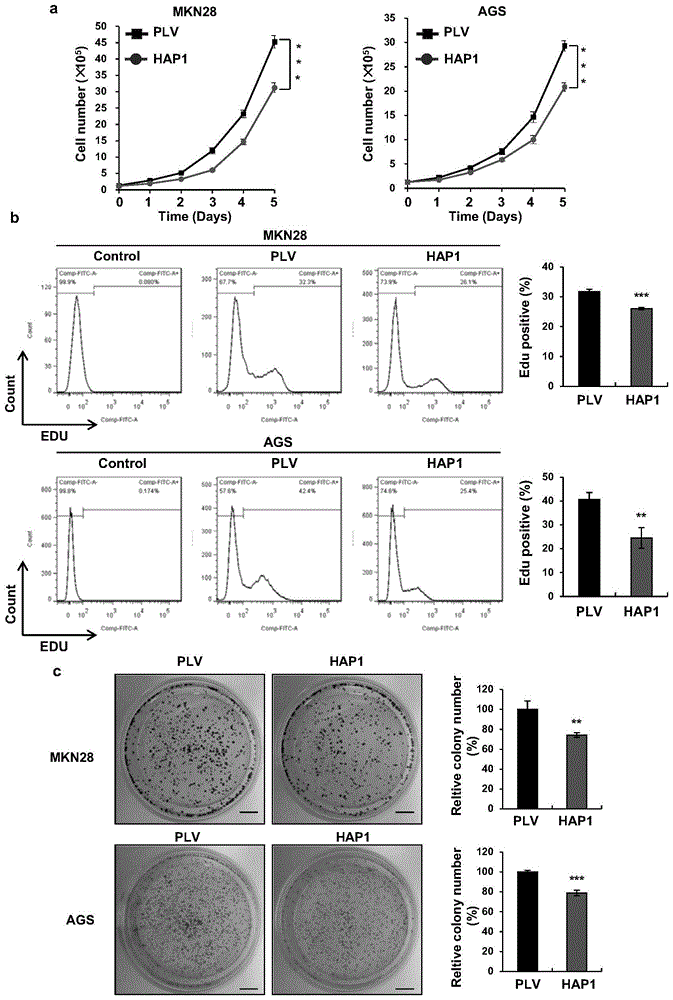
图3中a为细胞计数实验检测过表达HAP1对MKN28和AGS胃癌细胞系增殖功能的影响;图3中b为EdU实验检测过表达HAP1对MKN28和AGS胃癌细胞系增殖功能的影响;图3中c为集落形成实验检测过表达HAP1对MKN28和AGS胃癌细胞系的致瘤能力的影响;
图4中a为划痕实验检测过表达HAP1对MKN28和AGS胃癌细胞系的细胞迁移的影响;图4中b为Transwell实验检测过表达HAP1对MKN28和AGS胃癌细胞系的侵袭能力的影响;图4中c为Western blot检测上皮-间充质转化(Epithelial-Mesenchymal Transition,EMT)相关标记蛋白的表达水平;
图5中a为显微镜观察葡萄糖饥饿时过表达HAP1的胃癌细胞MKN28凋亡的差异;图5中b为Annexin V-FITC/PI染色流式细胞术检测葡萄糖饥饿时过表达HAP1对胃癌细胞系MKN28和AGS的细胞凋亡的影响;图5中c为Western blot检测葡萄糖饥饿时过表达HAP1对胃癌细胞MKN28和AGS中凋亡相关的信号通路蛋白的表达水平的影响。
具体实施方式
为能清楚说明本方案的技术特点,下面通过具体实施方式,结合附图,对本发明进行详细阐述。
发明人研究发现,HAP1蛋白和HAP1基因在胃癌组织中低表达,在癌旁胃粘膜组织中高表达,并且具有抑制胃癌细胞生长和延长患者生存时间的作用,因此在筛选HAP1基因低表达的肿瘤基础上,特异性恢复该抑癌基因在胃癌组织细胞中的表达,有望成为胃癌靶向治疗的一种新方法和手段。
HAP1蛋白序列如下:
Met Arg Pro Lys Arg Leu Gly Arg CysCys Ala Gly Ser Arg Leu Gly ProGly Asp Pro Ala Ala Leu ThrCys Ala Pro Ser Pro Ser Ala Ser Pro Ala Pro GluPro Ser Ala Gln Pro Gln Ala Arg GlyThrGly Gln Arg Val Gly Ser Arg Ala Thr SerGly Ser Gln Phe Leu Ser Glu Ala Arg ThrGly Ala Arg Pro Ala Ser Glu Ala GlyAla Lys Ala Gly Ala Arg Arg Pro Ser Ala Phe Ser Ala Ile Gln Gly Asp Val ArgSer Met Pro Asp Asn Ser Asp Ala Pro TrpThr Arg Phe Val Phe Gln Gly Pro PheGlySer Arg Ala ThrGly Arg GlyThrGly Lys Ala AlaGly Ile Trp Lys Thr Pro Ala AlaTyr Val Gly Arg Arg Pro Gly Val Ser Gly Pro Glu Arg Ala AlaPhe Ile Arg GluLeu Glu Glu Ala Leu Cys Pro Asn Leu Pro ProPro Val Lys Lys Ile Thr Gln GluAsp Val Lys Val Met Leu Tyr Leu Leu Glu Glu Leu Leu Pro Pro Val Trp Glu SerVal Thr Tyr GlyMet Val Leu Gln Arg Glu Arg Asp Leu AsnThr Ala Ala Arg Ile GlyGln Ser Leu Val Lys Gln Asn Ser Val Leu Met Glu GluAsn Ser Lys Leu Glu AlaLeu LeuGly Ser Ala Lys Glu Glu Ile Leu Tyr Leu Arg His Gln Val Asn Leu ArgAsp Glu Leu Leu Gln Leu Tyr Ser Asp Ser Asp Glu Glu Asp Glu Asp GluGluGluGluGluGluGlu Lys Glu Ala Glu GluGlu Gln Glu Glu GluGlu Ala Glu Glu AspLeu Gln Cys Ala His Pro Cys Asp Ala Pro Lys Leu Ile Ser Gln Glu Ala Leu LeuHis Gln His HisCys Pro Gln Leu Glu Ala Leu Gln Glu Lys Leu Arg Leu Leu GluGluGluAsn His Gln Leu Arg Glu Glu Ala Ser Gln Leu Asp Thr Leu Glu Asp Glu GluGln Met Leu Ile Leu Glu Cys Val Glu Gln Phe Ser Glu Ala Ser Gln GlnMet AlaGlu Leu Ser Glu Val Leu Val Leu Arg Leu Glu Asn Tyr Glu Arg Gln Gln Gln GluVal Ala Arg Leu Gln Ala Gln Val Leu Lys Leu Gln Gln Arg Cys Arg Met Tyr GlyAla Glu Thr Glu Lys Leu Gln Lys Gln Leu Ala Ser Glu Lys Glu Ile Gln Met GlnLeu Gln Glu GluGluThr Leu Pro GlyPhe Gln Glu Thr Leu Ala Glu Glu Leu Arg ThrSer Leu Arg ArgMet Ile Ser Asp Pro Val Tyr PheMet Glu Arg Asn Tyr Glu Met ProArg Gly Asp Thr Ser Ser Leu Arg Tyr Asp Phe Arg Tyr Ser Glu Asp Arg Glu GlnVal Arg GlyPhe Glu Ala Glu GluGly Leu Met Leu Ala Ala Asp Ile Met Arg Gly GluAsp PheThr Pro Ala Glu GluPhe Val Pro Gln Glu Glu Leu Gly Ala Ala Lys Lys ValPro Ala Glu GluGly Val Met Glu Glu Ala Glu Leu Val Ser Glu GluThr Glu GlyTrpGlu Glu Val Glu Leu Glu Leu Asp Glu Ala Thr Arg MetAsn Val ValThr Ser Ala LeuGlu Ala Ser Gly Leu Gly Pro Ser His Leu Asp MetAsn Tyr Val Leu Gln Gln LeuAla AsnTrp Gln Asp Ala His Tyr Arg Arg Gln Leu Arg Trp Lys Met Leu Gln LysGly Glu Cys Pro His Gly Ala Leu Pro Ala Ala Ser Arg Thr Ser Cys Arg SerSerCys Arg
HAP1基因序列如下:
ATGCGCCCGA AGAGGTTGGG CCGGTGCTGC GCGGGGAGCC GGCTCGGACC CGGGGACCCAGCAGCACTCA CCTGTGCACC TTCGCCCTCA GCCAGTCCCG CTCCGGAGCC CTCTGCGCAG CCGCAGGCACGGGGCACTGG ACAGAGAGTA GGATCCCGAG CCACCTCTGG ATCCCAGTTC CTCTCGGAAG CCCGCACCGGAGCTCGCCCG GCCTCGGAGG CTGGAGCCAA GGCAGGAGCC CGGCGCCCGT CCGCATTCTC GGCCATCCAAGGGGATGTCC GGTCTATGCC CGACAATTCG GACGCGCCGT GGACCCGCTT CGTATTCCAA GGGCCGTTTGGTTCCCGGGC CACTGGCCGG GGGACTGGAA AGGCAGCGGG CATCTGGAAG ACGCCAGCCG CCTACGTTGGCCGGCGACCC GGGGTGTCCG GCCCTGAGCG CGCCGCCTTT ATTCGGGAGC TGGAGGAAGC ACTGTGTCCTAACCTACCTC CGCCAGTCAA AAAGATCACC CAGGAAGACG TCAAAGTGAT GTTATATTTG CTGGAGGAGCTTCTCCCACC TGTCTGGGAG AGCGTTACCT ATGGGATGGT CCTGCAGAGA GAGAGGGACC TGAACACTGCAGCTCGCATC GGCCAGTCCC TGGTGAAACA GAACAGTGTT TTGATGGAGG AGAACAGCAA GCTGGAAGCCCTGCTGGGCT CAGCCAAGGA GGAGATTTTA TACCTCAGAC ACCAGGTGAA CTTGCGGGAT GAGCTCCTCCAGCTCTACTC AGATTCTGAT GAGGAGGATG AGGATGAAGA AGAGGAGGAG GAAGAAAAGG AGGCAGAAGAGGAACAGGAA GAAGAAGAAG CAGAGGAAGA CCTGCAGTGT GCTCATCCCT GTGATGCCCC TAAGCTGATTTCGCAGGAGG CATTGCTGCA CCAGCACCAC TGCCCACAGC TGGAAGCCTT GCAGGAGAAG CTGAGGCTGCTGGAGGAGGA GAATCATCAG CTGAGAGAAG A
实施例1HAP1在正常胃粘膜组织和胃癌组织中表达水平的分析
1.实验方法
1.1免疫组化检测临床胃癌患者的胃癌组织和正常癌旁组织中HAP1表达水平(1)标本固定:选择4%多聚甲醛作为固定剂,均匀覆盖于载玻片上,待干;
(2)脱水、石蜡包埋和制片:用梯度乙醇(由低到高50%,70%,80%,100%)充分脱水,然后对组织进行完全浸蜡处理,制备石蜡切片;
(3)石蜡切片脱蜡和水化:60℃、20分钟脱蜡,然后立即用二甲苯Ⅰ、Ⅱ、Ⅲ分别处理10分钟,水化用梯度乙醇(由高到低100%,80%,70%,50%)进行;
(4)抗原修复:将切片浸入柠檬酸钠抗原修复液中,完全浸湿后,微波炉中火加热6分钟,重复4次,修复后自然冷却30分钟左右,使温度将至室温;(5)通透:滴加200μL 0.3%Triton-X-100,室温静置10分钟,然后甩干通透液,滴加200μL PBS洗涤3分钟,重复洗涤3次;
(6)封闭:滴加200μL 5%BSA,室温静置30分钟;
(7)一抗孵育:将封闭液甩干,用PBS溶液按照1:250配制HAP1一抗工作液,滴加200μL,将玻片置于冰箱孵育过夜,温度一般设置为4℃;
(8)一抗洗涤:将玻片取出后室温平衡10分钟,放入盛有PBS的染色架中,100rpm摇床洗5分钟,重复洗涤5次;
(9)二抗孵育:用PBS溶液按照1:1000配制二抗工作液,滴加200μL,室温孵育30分钟;
(10)二抗洗涤:将玻片取出后室温平衡10分钟,放入盛有PBS的染色架中,100rpm摇床洗5分钟,重复洗涤5次;
(11)DAB显色;
(12)PBS漂洗后,苏木精染色10分钟;盐酸分化5秒,氨水返蓝5秒;伊红染色10秒,这几个步骤间均需蒸馏水冲洗;
(13)脱水:重复2次,由低到高梯度50%,70%,80%,100%的乙醇处理5分钟,二甲苯处理10分钟;
(14)封片,拍照。
1.2Western blot检测原发性胃癌标本及其邻近正常组织标本中HAP1蛋白表达水平
1.2.1提取细胞蛋白
(1)将人原发性胃癌标本及其邻近正常组织标本进行研磨裂解后收集细胞然后放至冰上;
(2)超声破碎细胞,一般选用30%超声强度、25kHz频率,超声10次,每次1秒;
(3)13,500rpm,4℃离心10分钟,将离心得到的上清转移至新EP管并置于冰上;
(4)G250法测定蛋白浓度:
利用BSA(牛血清白蛋白,0.5μg/μL)制作蛋白标准曲线。取5个EP管分别加入下表所示的体积,配制成0、0.05、0.1、0.15、0.2μg/μL五个蛋白浓度(见下表1)。
表1
加入1mL G250染液,颠倒混匀,按每孔200μL加入96孔板中,设置4个重复;在595nm吸收波长处测量样本吸光度值;待测样本稀释50倍后加入1mL G250染液,颠倒混匀,按每孔200μL加入96孔板中,同样设置4个重复,依据标曲公式计算样本浓度;
(5)用新鲜的细胞裂解液将所有的样本稀释成相同的蛋白浓度,根据样本总体积加入相应体积的5×SDS蛋白上样缓冲液,使其最终稀释成1×SDS;
(6)金属浴100℃煮蛋白,10分钟;-20℃保存备用。
1.2.2蛋白质印迹
(1)配制SDS-PAGE胶(上层胶浓度为4%,下层胶浓度为10%);
(2)每孔上样30-40μg提取的蛋白,电泳后将胶上的蛋白转至经甲醇活化过的PVDF膜上(Roche,3010040001);
(3)5%脱脂牛奶封闭1小时,TBST缓冲液稀释1次;
(4)将PVDF膜与一抗在4℃摇床上孵育过夜;
(5)使用TBST缓冲液漂洗,每次5分钟漂洗3次;
(6)加入合适比例的辣根过氧化合物酶标二抗(Beyotime),在摇床上孵育1小时;
(7)使用TBST缓冲液漂洗,每次5分钟漂洗3次;
(8)使用ECL增强化学发光试剂(Bio-rad,1705061)曝光。
1.3RT-qPCR检测临床胃癌组织和邻近正常组织标本中HAP1的mRNA表达水平
1.3.1RNA抽提以及RNA浓度及纯度的检测
(1)应用RNAiso Plus(Takara,9109)提取胃癌标本及其邻近正常组织标本总RNA;
(2)使用NanoDrop超微量分光光度计(Thermo Scientific,ND-1000)测定提取的RNA的质量和浓度;
1.3.2mRNA逆转录和实时荧光定量PCR
(1)逆转录PCR(10μL体系)
第①步(60℃、5分钟):
表2逆转录PCR第①步反应
第②步(42℃、60分钟;70℃、10分钟):
表3逆转录PCR第②步反应
(2)实时荧光定量PCR(10μL体系):
预变性:95℃、10分钟;变性:95℃、15秒;退火/延伸:60℃、60秒(40cycles)表4实时荧光定量PCR反应
引物序列:
发明人设计并合成了3对扩增HAP1的RT-qPCR引物,通过实验验证了3对引物的特异性。通过普通PCR扩增后进行DNA凝胶电泳,检测PCR产物条带是否单一,大小是否正确;通过RT-qPCR实验扩增,分别观察扩增曲线和溶解曲线,检测扩增效率。最终,通过对比筛选出最优的特异性扩增HAP1的RT-qPCR引物,即如下示出的上游引物SEQ ID NO.1和下游引物SEQ ID NO.2。
HAP1:
Forward:GGCCTCTCAACTCGACACTC(SEQ ID NO.1)
Reverse:GCTGCCGTTCATAGTTTTCCAG(SEQ ID NO.2)
β-actin:
Forward:CTGGAACGGTGAAGGTGACA(SEQ ID NO.5)
Reverse:AAGGGACTTCCTGTAACAATGCA(SEQ ID NO.6)
2.结果分析
如图1中a结果显示,与正常癌旁组织相比,胃癌组织的HAP1表达量明显降低,且差异有统计学意义;如图1中b结果显示,胃癌组织中HAP1蛋白水平较临近正常胃组织明显下降;如图1中c结果显示,胃癌组织中HAP1的mRNA表达水平也下调。
实施例2HAP1在胃粘膜上皮细胞GES-1和多种胃癌细胞中表达水平的分析
1.实验方法
1.1采用Western blot检测胃粘膜上皮细胞GES-1和多种胃癌细胞中HAP1蛋白表达水平
具体操作步骤参见实施例1中1.2-1.3部分的内容。
2、结果分析
进一步验证上述实施例2的结果,发明人利用一系列胃癌细胞系和胃黏膜上皮细胞GES-1,体外评估HAP1的表达。与GES-1相比,western blot结果如图2中a显示,与胃黏膜上皮细胞GES-1相比,HAP1的蛋白表达水平在所有胃癌细胞系中均下调,如图2中b显示,这些胃癌细胞系中HAP1的mRNA表达水平也呈现下调。
实施例3HAP1基因的克隆和表达载体的构建
1.实验方法
1.1HAP1过表达序列扩增
HAP1扩增引物序列:
HAP1-F:CCGCTCGAGCGGAGATGCGCCCGAAGAGGTT(SEQ ID NO.3)
HAP1-R:CCGGAATTCCGGTCATCGGCACGACGATCTG(SEQ ID NO.4)PCR扩增体系如表5(总体积:50μL):
表5 PCR扩增体系
1.2.慢病毒基因过表达载体pLV-Puro的酶切
慢病毒基因过表达载体pLV-Puro酶切反应体系如表6(37℃水浴;3小时):
表6表达载体pLV-Puro的酶切反应
1.3核酸电泳及酶切片段回收
(1)配制1%(M/V)的琼脂糖凝胶,电泳过程中需使用新配制的TAE电泳缓冲液,以保证电泳和回收的效果。将第2步中得到的PCR产物或双酶切产物进行电泳,电泳结束后在紫外线切胶仪下切取所需的DNA片段凝胶,收集并转移至1.5mL EP管中;
(2)使用琼脂糖凝胶DNA回收试剂盒进行回收。向含胶块的EP管中加入等量PN溶液,50℃水浴,水浴时需要温和多次地翻转EP管,使胶块达到充分溶解状态(注:若胶块过大,可提前将胶块处理为碎块);
(3)取一个新的吸附柱CA2放入对应收集管中,将第②步得到的溶液加入这一吸附柱中,室温放置2分钟,12,000rpm离心1分钟,倒废液(注:吸附柱CA2需预先进行柱平衡步骤);
(4)向吸附柱中央加600μL漂洗液(已添加无水乙醇),12,000rpm离心1分钟;
(5)重复步骤(4);
(6)将吸附柱放回空转,12,000rpm离心2分钟,使漂洗液去除彻底,再开盖放置几分钟,晾干;
(7)在吸附柱下方放置一个新的EP管中,向吸附柱中央加入洗脱缓冲液,室温放置2-3分钟;12,000rpm离心得到DNA溶液;
(8)回收得到的DNA片段用紫外分光光度计检测其浓度与纯度。
1.4HAP1表达载体的构建
将经1%琼脂糖凝胶电泳分离后回收目的片段DNA连入线性化的pLV-Puro,连接反应体系如表7,室温过夜。
表7重组质粒的连接
1.5 DNA的转化与质粒构建
(1)从超低温冰箱内取出分装的感受态细胞(100μL/每EP管),置于冰上溶解;
(2)将感受态细胞悬液与20μL DNA连接产物于EP管中混合,轻柔充分使体系均匀,在冰上静置30分钟;
(3)将该EP管放入42℃水浴条件下,热激45秒,取出冰上冷却2-3分钟;
(4)取上述菌液均匀涂布于含氨苄青霉素的LB固体培养基上,待菌液完全吸收后,倒置放入细菌培养箱,室温培养14-16小时,即得单克隆菌落;
(5)挑取上述单克隆菌培养,并使用试剂盒抽提质粒,通过PCR的方法扩增目的片段,经DNA凝胶电泳鉴定。
2.结果分析
如图3电泳结果显示,扩增片段为1860bp左右,为HAP1阳性克隆,HAP1基因的表达载体构建成功。
实施例4建立HAP1过表达的稳转胃癌细胞株
1.实验方法
1.1慢病毒包装
在HEK-293T细胞(要求细胞密度90%左右)中进行慢病毒包装。
(1)在150μL无血清培养液中加入Lipofectamine-2000转染试剂,静置5分钟;
(2)将包装质粒pAX
(3)将转染混合液加入35mm的细胞培养皿的细胞培养液中,混匀。待6-8小时后,换成2mL新鲜DMEM完全培养基(10%FBS);
(4)36-48小时后收集病毒,8000g离心5分钟,收集全部的上清液,经0.45μm滤膜过滤后将病毒上清液转移至新的收集管中,-20℃保存。
1.2细胞转染
用慢病毒包装得到的病毒上清感染胃癌细胞系MKN28和AGS(细胞接种密度一般控制在50%左右)。根据病毒滴度确定需要加入病毒的量,同时加10μg/L的polybrene(1:1000稀释),通过电荷作用加快病毒进入细胞。12小时后可进行换液处理,24-48小时之后病毒即可在细胞中表达。
1.3嘌呤霉素筛选稳定细胞株
细胞在含有嘌呤霉素的细胞培养基中增殖,以筛选出稳定过表达质粒的细胞系。
(1)慢病毒感染细胞的48小时后,依据细胞的实际状态以换液或消化重新铺板的方式将细胞培养基替换为含有嘌呤霉素(1g/mL)的新鲜培养基;
(2)每隔2-3天,细胞传代或换液,仍需继续补充添加了合适浓度嘌呤霉素的新鲜培养基;
(3)筛选7天后通过Western Blot和RT-qPCR验证HAP1基因过表达情况。
2.结果分析
如图2中c显示,Western Blot检测胃癌细胞系MKN28和AGS中过表达HAP1的实验组与空载PLV的阴性对照组相比,HAP1的蛋白水平明显上调;如图2中d显示,实时荧光定量PCR检测HAP1的mRNA表达水平,胃癌细胞系MKN28和AGS中过表达HAP1的实验组与空载PLV的阴性对照组相比,HAP1的mRNA表达水平明显上调,差异有统计学意义。
实施例5HAP1抑制胃癌细胞的增殖功能
1.实验方法
1.1细胞计数测定
(1)利用
(2)将1×10
(3)在设计的时间内使用
1.2EdU实验检测过表达HAP1的胃癌细胞的增殖情况
(1)为了达到进一步实验所需的浓度,将EdU(Beyotime,C0071S)溶解在二甲亚砜(DMSO,Sigma)中,储备浓度为50mg/mL,然后在PBS中稀释;
(2)EdU在收获前12小时加入细胞培养皿中;
(3)12小时后,在胃癌细胞中加入4%的甲醛100μL,待其固定15分钟后用PBS冲洗两次。然后用含Tris缓冲盐水和0.1%Triton X-100的PBS处理15分钟,然后用PBS洗涤两次;
(4)加入200μL RiboBio染色液完成EdU-click反应(室温避光30分钟),然后用PBS漂洗细胞,500μL PBS重悬细胞;
(5)采用流式细胞术检测EdU阳性的细胞的检测,用FlowJo软件进行分析。
2.结果分析
如图3中a结果显示,在不同时间对MKN28和AGS细胞系进行细胞计数实验,发现过表达HAP1显著延缓了细胞增殖速度;如图3中b EdU实验检测结果显示,MKN28和AGS细胞系过表达HAP1后显著延缓了细胞增殖。
实施例6HAP1抑制胃癌细胞的克隆形成能力
1.实验方法
1.1集落形成实验测定过表达HAP1的胃癌细胞的致瘤能力
(1)将2×10
(2)将60mm细胞培养皿置于含5%CO
(3)细胞生长1-2周后,在室温下用PBS洗涤2次;
(4)将细胞固定在4%多聚甲醛中,0.01%结晶紫溶液染色15分钟。采用Image J软件计算胃癌细胞集落数,统计分析存活频率。每组设3个重复。
2.结果分析
如图3中c显示,在MKN28和AGS细胞中,过表达HAP1后肿瘤细胞克隆形成能力显著降低,表明HAP1具有抑制胃癌细胞的克隆形成能力。
实施例7HAP1抑制胃癌细胞迁移和侵袭功能
1.实验方法
1.1划痕实验检测HAP1对胃癌细胞的迁移功能的影响
(1)将细胞种到60mm的细胞培养皿中,培养细胞密度达到90%左右时;
(2)用200μL的枪头在皿中轻轻划一直线;
(3)PBS洗去悬浮细胞三次后,置于含10%FBS的完整RPMI 1640培养基中孵育;
(4)分别于0和48小时对划伤创面进行拍照。
1.2 Transwell实验检测HAP1对胃癌细胞的侵袭功能的影响
(1)transwell实验在transwell室(8μm孔径)中进行,胃癌细胞进行血清饥饿24小时;
(2)将细胞悬浮于不含血清的培养基中,200μL置于细胞室上层(每孔约2×10
(3)在细胞培养箱中孵育48小时后,用棉签从transwell小室上表面清除非侵入性细胞;
(4)用4%的甲醛固定侵袭细胞约10分钟后,在室温下用0.05%的结晶紫染色5-10分钟;
(5)在5个随机显微镜视野中计数阳性胃癌细胞,每组设3个重复。
1.3Western blot检测胃过表达HAP1后MKN28和AGS胃癌细胞中上皮-间充质转化(Epithelial-Mesenchymal Transition,EMT)标记蛋白表达水平
具体试验操作步骤参见实施例1中1.2.1-1.2.2部分的内容。
2.结果分析
如图4中a结果显示,MKN28和AGS细胞的划痕实验表明,过表达HAP1可抑制细胞迁移;如图4中b显示,经transwell实验表明,当HAP1过表达时,MKN28和AGS细胞的侵袭能力显著下调;如图4中c显示,western blot检测上皮-间充质转化(Epithelial-MesenchymalTransition,EMT)标记蛋白,发现HAP1过表达强烈上调了E-cadherin的蛋白水平,而E-cadherin在胃癌细胞中通常是下调的,N-cadherin表达无明显变化。同时,EMT标记物之一Vimentin在HAP1过表达的MKN28和AGS细胞中表达下调。综上所述,HAP1抑制了胃癌细胞的迁移和侵袭能力。
实施例8HAP1促进胃癌细胞的凋亡
1.实验方法
1.1显微镜观察过表达HAP1对细胞凋亡的影响
(1)以过表达空载PLV的胃癌细胞系MKN28作为阴性对照组,稳定过表达HAP1的胃癌细胞系MKN28作为实验组;
(2)对细胞计数后按4×10
(3)分别在饥饿0、24小时后观察细胞状态,通过显微镜拍照记录细胞凋亡的状态。
1.2流式细胞术检测细胞凋亡
(1)将过表达空载PLV和过表达HAP1的MKN28在无糖培养基中培养24小时后,收集细胞培养上清加入12×75mm规格的流式细胞管中;
(2)用不含EDTA的胰酶消化细胞,完全培养基终止消化后,将所有细胞和液体加入上述流式管中;
(3)用预冷的PBS再次漂洗细胞培养皿底部,将其加入上述流式管中,2000rpm离心5分钟,保留沉淀;
(4)每个样本中加入1mL预冷的PBS重悬,洗涤2次,离心得到细胞;
(5)向细胞沉淀中加入1×凋亡缓冲液重悬细胞,每个样本加100μL;
(6)再加入5μL PI染液,混匀后避光孵育15分钟;
(7)孵育完毕后补加400μL 1×凋亡缓冲液,轻轻吹吸几次后经300目尼龙网过滤至新的流式管;
(8)选择合适的通道使用BD FACS Aria II流式细胞仪检测细胞凋亡。
1.3 Western blot检测了凋亡相关的信号通路蛋白表达情况
具体试验操作步骤参见实施例1中1.2.1-1.2.2部分的内容。
2.结果分析
如图5中a显示,葡萄糖饥饿24小时后过表达HAP1促进了胃癌细胞MKN28和AGS的死亡进程,细胞凋亡更加明显;如图5中b显示,Annexin V-FITC/PI染色流式细胞术检测发现,过表达HAP1导致MKN28和AGS胃癌细胞死亡比例增加,HAP1促进细胞凋亡;为了探究能量缺陷条件下HAP1调控细胞死亡的分子机制,检测了凋亡相关的信号通路蛋白,如图5中c所示,促凋亡因子Bcl-2下调,Bax和Bcl-xl的表达没有明显变化,Cleaved Caspase-3和Caspase-12表达水平均上调。综上所述,HAP1参与了细胞凋亡过程,并通过调控凋亡相关蛋白的表达来促进细胞凋亡。
结论:基因HAP1在胃癌组织中表达下降,且其表达水平与胃癌患者的预后生存时间及转移几率密切相关;通过克隆HAP1的cDNA,构建HAP1基因的表达载体,发现基因HAP1在胃癌细胞中过表达后,可以抑制胃癌细胞生长,促进其凋亡,降低其迁移和侵袭的能力。
以上结果表明:HAP1基因在胃癌具有抑癌功能。检测HAP1基因的表达可以用于胃癌的诊断。而恢复HAP1基因的抑癌功能则可以达到治疗肿瘤的目的。因此,新的潜在抑癌基因HAP1在胃癌的诊断、预防及治疗中均有一定的应用价值。
上述具体实施方式不能作为对本发明保护范围的限制,对于本技术领域的技术人员来说,对本发明实施方式所做出的任何替代改进或变换均落在本发明的保护范围内。
本发明未详述之处,均为本技术领域技术人员的公知技术。
