地夫可特中间体的制备方法
文献发布时间:2023-06-19 19:04:00
技术领域
本发明涉及药物合成技术领域,具体而言,涉及一种地夫可特中间体的制备方法。
背景技术
地夫可特(Deflazacort),是一种用于治疗过敏性哮喘、类风湿性关节炎、皮肤过敏的口服药物,也可用于治疗杜氏肌营养不良症的皮质固醇类激素药物,通过减少炎症和降低免疫系统的活性。其化学名为21-乙酰氧基-11β-羟基-2'-甲基-5'H-娠烷-1,4-二烯并[17,16-D]噁唑-3,20二酮,结构式如下:
地夫可特的主要生产方法为:黄姜提取物皂素为起始原料,经过开环水解而得到双烯,双烯经过环氧水解、沃氏氧化而得到沃氏氧化物,再经过生物发酵法而得到霉菌脱氢物,霉菌脱氢物再经过氧化反应、保护、氨化、环合、还原、水解、碘化、置换而得到地夫可特。路线如下:
其中式(1)(16α)-16,17-环氧孕甾-1,4-二烯-3,11,20-三酮)为关键中间体,其之后的反应步骤较为理想,但是关键中间体的制备过程存在如技术问题:
原料黄姜资源较少,种植年限长,黄姜中的薯蓣皂苷元,含量较低,且提取过程消耗大量的高浓度酸碱,环境不友好;在薯蓣皂苷元后续反应过程中,步骤繁琐且需要生物发酵,耗时耗力,成本高。
发明内容
基于此,本发明基于本申请人在先专利CN114317662A中的制备方法,以11α,17α-双羟黄体酮为原料制备获得17α-羟基孕甾-1,4-二烯-3,11,20-三酮(具体结构如式Ⅰ),先进行17位羟基消除,再进行16(17)-烯环氧化获得地夫可特关键中间体化合物Ⅲ。
本发明提供了一种地夫可特中间体的制备方法,具体包括:
(a)将化合物Ⅰ进行羟基消除反应获得化合物Ⅱ;
(b)将所述化合物Ⅱ溶于极性溶剂中,并与氧化剂和相转移催化剂混合进行环氧化反应获得地夫可特中间体化合物Ⅲ;
在其中一个实施例中,所述羟基消除反应具体为:
将所述化合物Ⅰ与消除溶剂/SO
在其中一个实施例中,所述步骤(b)中极性溶剂为四氢呋喃、二氧六环、丙酮。
在其中一个实施例中,所述氧化剂为过酸;所述过酸具体包括:过氧乙酸,叔丁基过氧化氢、间氯过氧苯甲酸、过氧苯甲酸。
在其中一个实施例中,所述的相转移催化剂为四丁基溴化铵或苄基三甲基氢氧化铵。
在其中一个实施例中,所述环氧化反应的反应温度为0~40℃。
在其中一个实施例中,所述环氧化反应后还包括纯化过程,包括:
将所述环氧反应后获得的混合物进行浓缩,加水搅拌获得沉淀过滤取滤饼,干燥后采用乙酸乙酯进行重结晶,获得地夫可特中间体化合物Ⅲ。
本发明的有益效果:
本发明采用羟基消除和环氧化过程制备获得了地夫可特的关键中间体,通过环氧化过程的条件优化,以特定的溶剂、氧化剂和相转移催化剂相互配合,提高环氧化过程的选择性,转化率高,减少了副产物,且反应条件温和,后处理过程简单,使得生产更加经济、安全。适合于工业化推广。
附图说明
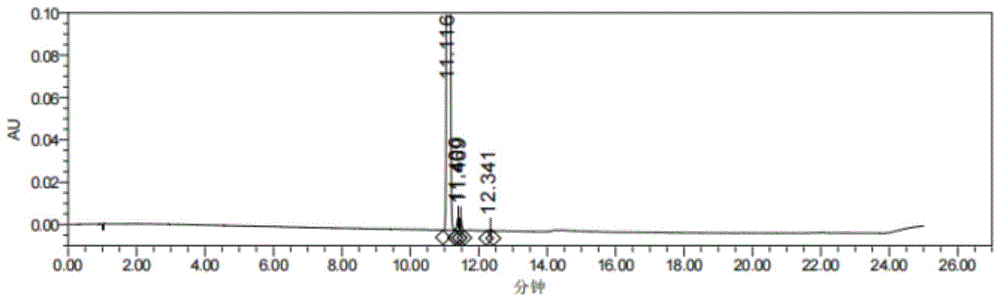
图1为本发明实施例2获得的化合物Ⅲ的HPLC谱图;
图2为本发明实施例2获得的化合物Ⅲ的
图3为本发明实施例2获得的化合物Ⅳ的
具体实施方式
为使本发明的上述目的、特征和优点能够更加明显易懂,下面结合附图对本发明的具体实施方式做详细的说明。在下面的描述中阐述了很多具体细节以便于充分理解本发明。但是本发明能够以很多不同于在此描述的其它方式来实施,本领域技术人员可以在不违背本发明内涵的情况下做类似改进,因此本发明不受下面公开的具体实施例的限制。
此外,术语“第一”、“第二”仅用于描述目的,而不能理解为指示或暗示相对重要性或者隐含指明所指示的技术特征的数量。由此,限定有“第一”、“第二”的特征可以明示或者隐含地包括至少一个该特征。在本发明的描述中,“多个”的含义是至少两个,例如两个,三个等,除非另有明确具体的限定。
除非另有定义,本文所使用的所有的技术和科学术语与属于本发明的技术领域的技术人员通常理解的含义相同。本文中在本发明的说明书中所使用的术语只是为了描述具体的实施例的目的,不是旨在于限制本发明。本文所使用的术语“和/或”包括一个或多个相关的所列项目的任意的和所有的组合。
本发明提供了一种地夫可特中间体的制备方法,具体包括:
(a)将化合物Ⅰ进行羟基消除反应获得化合物Ⅱ;
(b)将所述化合物Ⅱ溶于极性溶剂中,并与氧化剂和相转移催化剂混合进行环氧化反应获得地夫可特中间体化合物Ⅲ;
在具体地示例中,所述羟基消除反应过程具体为:
将所述化合物Ⅰ与消除溶剂/SO
在其中一个实施例中,所述步骤(b)中极性溶剂为四氢呋喃、丙酮。
在其中一个实施例中,所述氧化剂为过酸;所述过酸具体包括:过氧乙酸,叔丁基过氧化氢,间氯过氧苯甲酸,过氧苯甲酸,优选叔丁基过氧化氢。
在其中一个实施例中,所述的相转移催化剂为四丁基溴化铵或苄基三甲基氢氧化铵或苄基三乙基氯化铵。
优选组合包括:极性溶剂为四氢呋喃,氧化剂为叔丁基过氧乙酸和相转移催化剂苄基三甲基氢氧化铵。
在其中一个实施例中,所述环氧化反应的反应温度为0~40℃。优选的环氧化反应的温度为0~5℃。
化合物II具有3个双健,过氧酸是亲电试剂,双键碳原子连有供电基时,连接的供电基越多反应越容易进行。如果两个不同的烯键存在于同一分子中,电子云密度较高的烯键容易氧化;当烯键与羰基共轭时,它的活性会降低。基于结构分析,通过选择较弱的过氧试剂,极性溶剂,添加合适的相转移催化剂来提高选择性。
实验室中常用有机过氧酸(简称过酸)作环氧化试剂,烯烃反应生成1,2-环氧化物。常用的过氧酸有过氧甲酸、过氧乙酸、过氧苯甲酸、过氧间氯苯甲酸、过氧三氟乙酸等。过氧酸分子中含有吸电子取代基时,它的反应活性则远比烷基过氧酸活泼。过氧酸的氧化性顺序为:过氧三氟乙酸>过氧间氯苯甲酸>过氧苯甲酸>过氧乙酸>叔丁基过氧化氢。较弱的过酸能够明显提高环氧的选择性。
烯烃的环氧化反应通常在惰性溶剂(如氯仿、二氯甲烷、乙醚、甲苯)中进行,但化合物II在这些溶剂中由于溶解度和极性等原因,反应效果较差;优选四氢呋喃和丙酮作为溶剂,能够兼顾上述优缺点。
相转移催化剂在反应中起到重要作用,能够加快反应速度,进而提高反应选择性。如果反应时间长,过渡环氧的产物会增加。
在其中一个实施例中,所述环氧化反应后还包括纯化过程,包括:
将所述环氧反应后获得的混合物进行浓缩,加水搅拌获得沉淀过滤取滤饼,干燥后采用乙酸乙酯进行重结晶,获得地夫可特中间体化合物Ⅲ。
在上述羟基消除和环氧化反应过程中,采用TLC检测,跟踪反应至反应完全。
以下结合具体实施例详细描述本发明,这些实施例用于理解而不是限定本发明。
在本发明实施例中,起始原料化合物Ⅰ:17α-羟基孕甾-1,4-二烯-3,11,20-三酮为自制,其他试剂均为市售。
起始原料化合物Ⅰ:17α-羟基孕甾-1,4-二烯-3,11,20-三酮参考专利CN114317662A自制,其氢谱,碳谱数据如下:
实施例1
化合物Ⅱ:孕甾-1,4,16-三烯-3,11,20-三酮的制备。
反应式为:
制备过程:250mL三口瓶中,一次加入化合物Ⅰ10.0g,氯代丁二酸亚胺10.0g,吡啶50mL,氮气保护下降温至-20~-30℃,缓慢滴加30%SO
实施例2
化合物Ⅲ的制备
反应式为:
制备过程:在洁净干燥的250mL三口瓶中依次加入四氢呋喃(100.0mL),实施例获得的化合物Ⅱ(10.0g)和四丁基溴化铵(0.5g),降温至0-5℃,缓慢滴加过氧化氢叔丁醇(5.0g,70%的水溶液),加完后,搅拌反应,TLC检测反应至完全(应该理解的是,该反应至完全指的是反应产物不再增加,并不是所有化合物Ⅱ全部反应)。将体系加入至亚硫酸钠水溶液(50mL,5%),碘化钾淀粉试纸检测无氧化性,将体系减压浓缩,用水(50mL)置换1次,过滤,水(50mL)淋洗,滤饼干燥,得到9.2g目标化合物Ⅲ以及少量副产物Ⅳ,HPLC纯度96.8%(有少量过氧化物存在),收率92.0%;粗品用乙酸乙酯重结晶,纯度为99%;其中HPLC图谱如图1所示。
其中峰结果如表1所示:
化合物Ⅲ氢谱(图谱如图2所示),碳谱鉴别如下:
化合物Ⅳ的氢谱(图谱如图3所示)、碳谱鉴别如下:
实施例3-12
按照实施例2的方法制备地夫可特关键中间体化合物Ⅲ,各试剂的选择、比例以及反应温度如表1所示;以及其收率和分离产品纯度如表2所示。
表1 实施例3-12制备条件
其中,THF:四氢呋喃;TBHP:叔丁基过氧化氢;TRITON B:苄基三甲基氢氧化铵;TBAB:四丁基溴化铵。
表2 实施例3-12结果统计表
对比例1
二氯甲烷(1mL)和甲醇(6mL)中加入化合物II(1g),降温0℃左右依次滴加叔丁基过氧化氢(0.45g)和四丁基溴化铵溶液(0.03g),TLC跟踪检测,反应完全后加醋酸(2.5mL)淬灭,浓缩,加入10mL水置换,抽滤,烘干得粗品0.85g,分离产品纯度:化合物Ⅲ为83.6%,双环氧产物(化合物IV)为12.1%。
对比例2
四氢呋喃(10mL)中加入化合物II(2.0g),降温0℃左右加入叔丁基过氧化氢(0.9g),反应2h左右,TLC检测,有20%的原料剩余,继续延长反应时间至6小时,至反应产物不再增加,淬灭后,浓缩,水置换,抽滤,烘干得粗品1.63g,HPLC检测纯度化合物Ⅲ为85.3%,双环氧产物(化合物IV)比例为6.3%,原料剩余4.5%。
根据上述实施例11和对比例1、2,其中对比例1、2与实施例11相比,反应物的比例是相同的,但是对比例1中将溶剂变更为二氯甲烷和甲醇的混合溶液,对比例2未添加相转移催化剂。对比实施例11和对比例1和2的获得的产物中各物质的纯度,可以知道,溶剂的类型和相转移催化剂会较大程度影响反应的选择性和反应转化率。根据实施例2-12,当有机过酸的种类和相转移催化剂不同时,反应选择性和反应转化率均具有较大的差别,因此,本发明中反应为一个有机整体,反应过程中的原料、反应环境以及各参数之间相互影响,通过本发明对相关条件的限定,获得了一种产率高、反应选择性好的地夫可特中间体的制备方法。
以上所述实施例的各技术特征可以进行任意的组合,为使描述简洁,未对上述实施例中的各个技术特征所有可能的组合都进行描述,然而,只要这些技术特征的组合不存在矛盾,都应当认为是本说明书记载的范围。
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准,说明书及附图可以用于解释权利要求的内容。
- 一种橙皮素的制备方法、橙皮素中间体的制备方法和用于制备橙皮素的生物酶
- 1,7-二甲基黄嘌呤及其中间体的制备方法、中间体
- 一种用于合成抗肿瘤药物niraparib的中间体的制备方法及中间体
- 钆特醇中间体及其合成方法和利用该钆特醇中间体制备钆特醇的方法
- 钆特醇中间体及其合成方法和利用该钆特醇中间体制备钆特醇的方法
