一种基于人Dll4抗体设计的多肽及其应用
文献发布时间:2023-06-19 19:05:50
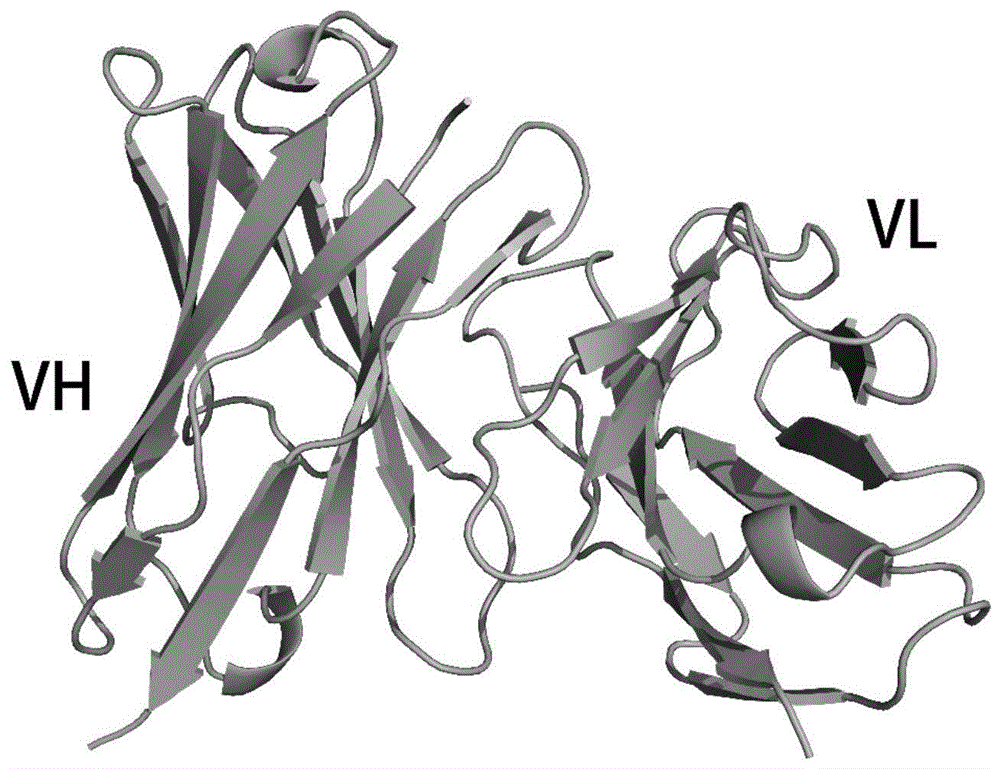
技术领域
本发明属于生物技术领域,具体涉及一种基于人Dll4抗体设计的多肽及其应用。
背景技术
单克隆抗体因其靶向性,用于治疗时毒副作用大幅降低,是靶向药物开发的上佳之选。然而,单克隆抗体的应用还存在一些限制,例如其较大的尺寸导致组织穿透性差从而难以到达靶点、不算理想的药代动力学性质以及最重要的,较大的花费与制备难度。因此,有必要开发更小尺寸、更易制备的替代品。
药物发现的研究长久以来集中在两个部分:小分子药物(<500Da)、生物大分子(>5000Da)。根据FDA定义,多肽是一类由40个或更少氨基酸组成的组合物,分子量为500-5000Da,而各制药公司目前在这一分子量范围内的产品占比并不高。近年来,研究人员逐渐意识到多肽的诸多优势,包括设计简单、合成难度较小、较低的免疫原性与毒性以及更好的组织穿透性。目前,在欧洲、美国和日本市场,有超过100种多肽药物被用于治疗各类疾病。从财务上来说,多肽市场也有很大潜力。据估计,到2019年,该市场每年价值110-160亿英镑。
多肽可通过筛选或基于结构设计来获得。前者主要为噬菌体展示、RNA展示等技术,这种方法的不需要配体或受体的结构信息,本质为随机搜索,时间消耗较大且靶点未知,结果难以保证。例如,Diehnelt等人开发了一种基于多肽的合成抗体(Synbody),其靶点并未在研究伊始确定,而是后续通过一个含有8000个人类蛋白的阵列筛选得到的。相反,基于结构设计的方法使用了蛋白交互界面的结构信息来指导多肽设计。这些结构信息通常来自实验测得的晶体结构。例如Boohaker等人基于PD-1/PD-L1复合物的晶体结构,分析其结合区域并设计出了模仿PD-L1的多肽,该肽能与PD-L1竞争结合到PD-1,从而发挥阻断作用。同理,抗原-抗体复合物也能指导多肽开发。例如Nakajima等人模仿帕妥珠单抗(Pertuzumab)开发了一种HER2拮抗多肽(HRAP)。该肽来自帕妥珠单抗可变区与HER2结合的关键氨基酸残基。
本发明采用AlphaFold2预测本课题组已获授权的抗体H3L2(授权号:CN105384819B)可变区结构并将其与人Dll4进行通过Rosetta进行分子对接,得分最佳的结果用于分子动力学模拟与MM/PBSA结合自由能计算,根据计算结果选出对结合贡献高的氨基酸残基组成多肽并验证该肽有与人Dll4的结合能力及其体外活性。
发明内容
发明目的
本发明提供两种Dll4靶向肽。
技术方案
一种Dll4靶向肽,其特征在于所述Dll4靶向肽为多肽SH2或多肽SL1,其中多肽SH2具有SEQ ID NO.1所示的氨基酸序列;多肽SL1具有SEQ ID NO.2所示的氨基酸序列。
所述的Dll4靶向肽在制备治疗肿瘤转移药物中的应用。
具体而言:
两种基于人源抗Dll4抗体可变区的计算机辅助设计的多肽SH2与SL1,首先使用AlphaFold2web server(https://colab.research.google.com/github/sokrypton/ColabFold/blob/main/AlphaFold2.ipynb#)预测抗体可变区结构,通过RosettaDock将其与人Dll4对接并选择得分最佳的复合物通过Gromacs进行分子动力学模拟,将模拟所得轨迹通过gmx_MM/PBSA脚本计算结合自由能,选择贡献较多的氨基酸残基组成多肽。最后得到的多肽分别来自抗体可变区重链与轻链的CDR区氨基酸序列分别为:SH2:AlaIleTyrProGlyGly ThrArgTyrThrGlnLysPheLysGly(AIYPGGTRYTQKFKG);SL1:SerValSerSerIleSerTyrGlnHis(SVSSISYQH)。
但需要注意的是不是所有经过分子对接获得化合物就一定具有相应的效果,原因在于,模型构建过程中对靶点认知不够,特别是空间结构,另外蛋白与蛋白相互结合是非刚性的,其空间结构存在变化的结构,导致大多数筛选出化合物作用效果弱,或没有起作用。因此还需要经过实验加以确认。此外,由于晶体结构测定需要大量时间与资源,故并非所有蛋白质或复合物都有相应的晶体结构数据,如上限制了计算机辅助设计药物的研发,即计算机辅助设计是一种辅助手段,但并不是决定性,需要进一步科学试验加以验证。
使用gmxrms命令分别计算受体、配体以及复合物的RMSD,如图2所示。RMSD值表示目标分子中的原子在模拟过程中偏离初始位置的距离,一定程度上可反映结构的稳定性。若分子本身柔性较大则需要更长时间的模拟才有可能达到稳定状态。在此选取相对稳定的14-21ns(波动在0.1nm范围内),通过gmx_MM/PBSA计算结合自由能,选择CDR区氨基酸进行结合自由能分解,结果如图3所示。对于目标多肽而言,其序列长度不宜过短,故选择重链CDR2、轻链CDR1进行下一步优化。根据图3所示结果,将结合自由能>5KJ/mol的氨基酸残基删去,随后输入至ProtParam(https://web.expasy.org/protparam/)预测多肽的物理化学性质,其中主要关注预测的稳定性与亲水性。重链CDR2在上一步的删减后已经具有相对理想的稳定性与亲水性,故不再优化。轻链CDR1由于存在连续的丝氨酸残基,稳定性预测结果较差,故酌情删减至结果为稳定;同时第34位亮氨酸对亲水性影响较大,故替换为谷氨酰胺以增加亲水性。最终获得多肽序列为SEQ ID NO.1和SEQ ID NO.2,命名为多肽SH2和SL1。
就本发明而言,获得的多肽SH2与SL1,如图3所示,选取相对稳定的时间段通过MM/PBSA计算结合自由能,选择CDR区氨基酸进行结合自由能分解,获得多肽SH2与SL1;如图4所示,表明人Dll4可溶蛋白量随温度升高而减少,但经多肽处理后并未明显减少,说明两种肽提高了人Dll4的热稳定性,二者均能够与人Dll4结合。结果如图5所示,SL1具有促进HUVEC细胞迁移的作用,SH2几乎无作用。再次说明计算机辅助设计只是初步结果,尽管设计出的多肽有相似的与人Dll4结合能力,但其药效结果相差巨大,SL1具有结果,而SH2几乎无作用。
有益效果
本发明提供两种基于人源化Dll4抗体H3L2设计的多肽SH2与SL1,均未见文献报道。与抗体相比,本发明的多肽尺寸小、制备难度与花费都相对较低。经过基于纯蛋白的蛋白质热迁移实验验证,两种多肽均可与人Dll4结合,但只有SL1可促进HUVEC细胞迁移,具有构建多肽偶联药物的潜力。
附图说明
图1为使用AlphaFold2webserver预测的H3L2可变区结构。
图2为分子动力学模拟的RMSD折线图。
图3为结合自由能分解图。A:VH;B:VL。
图4为蛋白质热迁移的WesternBlot图。A:SH2;B:SL1。
图5为划痕损伤修复图。A:细胞随时间迁移;B:迁移距离。
具体实施方案
实施例1多肽设计
1.H3L2可变区结构预测
进入AlphaFold2webserver(https://colab.research.google.com/github/sokrypton/ColabFold/blob/main/Al phaFold2.ipynb#),输入H3L2可变区的轻链与重链序列,通过“:”分隔,运行程序进行结构预测,选择评分最高的结果用于分子对接,结构如图1所示。
2.分子对接
由于RosettaDock需要初始构象,故先进入ZDock(https://zdock.umassmed.edu/)网站,将上述结构以及人Dll4晶体结构(PDBID:5MVX)分别作为“LigandInput”与“ReceptorInput”进行上传,对接结果的得分为负数,打分越低越好,选择得分最低的结果作为初始构象。
首先使用Rosetta的PrePackApp对结构进行预处理,使非结合部位的氨基酸残基都处于能量最低态,避免对后续打分产生影响。随后调用RosettaDock进行对接并选择合适的结果进行下一步的分子动力学模拟。
3.分子动力学模拟
使用Gromacs 2020.6进行分子动力学模拟,选择CHARMM36作为分子动力学模拟的力场。首先用gmx pdb2gmx命令产生复合物拓扑文件,再用gmx editconf设置边界,将复合物放置在正立方体盒子中,边界设置为1.1nm。随后使用gmx solvate命令向体系中添加水分子,水模型为TIP3P,然后通过gmx genion向体系中添加Na
使用gmx rms命令分别计算受体、配体以及复合物的RMSD,如图2所示。RMSD值表示目标分子中的原子在模拟过程中偏离初始位置的距离,一定程度上可反映结构的稳定性。若分子本身柔性较大则需要更长时间的模拟才有可能达到稳定状态。在此选取相对稳定的14-21ns(波动在0.1nm范围内),通过gmx_MM/PBSA计算结合自由能,选择CDR区氨基酸进行结合自由能分解,结果如图3所示。对于目标多肽而言,其序列长度不宜过短,故选择重链CDR2、轻链CDR1进行下一步优化。根据图3所示结果,将结合自由能>5KJ/mol的氨基酸残基删去,随后输入至ProtParam(https://web.expasy.org/protparam/)预测多肽的物理化学性质,其中主要关注预测的稳定性与亲水性。重链CDR2在上一步的删减后已经具有相对理想的稳定性与亲水性,故不再优化。轻链CDR1由于存在连续的丝氨酸残基,稳定性预测结果较差,故酌情删减至结果为稳定;同时第34位亮氨酸对亲水性影响较大,故替换为谷氨酰胺以增加亲水性。最终获得多肽序列为SEQ ID NO.1和SEQ ID NO.2,命名为多肽SH2和SL1。
实施例2蛋白质热迁移
蛋白质热迁移实验是检测配体(如小分子或多肽)与蛋白结合的一种方法,原理是在一定温度范围内,蛋白空间结构随温度升高而变化,由可溶形式变为不可溶形式。当配体与蛋白结合后,蛋白热稳定性变高,在同一温度下结合了配体的蛋白可溶形式含量高于未结合的蛋白,可通过Western Blot检测,步骤如下。
1.将多肽粉末溶于PBS配制成1mg/ml的多肽溶液,分装至EP管并保存在-80℃冰箱。取PCR管若干,每管加入10μg/ml人Dll4蛋白20μl并放入PCR热循环仪加热3min,温度范围设置为40-70℃,加热后拿出并室温放置3min。将PCR管中的液体转移至1.5ml EP管,13000g 4℃离心30min,小心吸出上清到新的EP管备用
2.按比例加入5x Loading Buffer混匀,沸水浴加热10min后放至室温,通过Western Blot检测:经SDS-PAGE电泳后转移至PVDF膜,用5%脱脂奶粉37℃孵育1h进行封闭;随后用TBST漂洗10min,再加入脱脂奶稀释的一抗(H3L2,1:100),4℃孵育过夜;次日取出膜漂洗6次,每次10min,加入脱脂奶稀释的HRP标记羊抗人IgG抗体(上海翌圣,1:10000)为二抗,37℃孵育1.5h;再取出膜漂洗6次,每次10min,将ECL显影液(上海翌圣,1:1混匀)均匀滴加在膜上并置于曝光仪中曝光,根据条带变化得到蛋白相应温度范围。
3.取两组PCR管,首先每管加入上述等量的人Dll4蛋白溶液,再分为两组,一组加入相对蛋白过量的多肽,一组加入等体积PBS,混匀后室温孵育30min。按上述操作离心并进行WesternBlot检测,结果如图4所示,表明人Dll4可溶蛋白量随温度升高而减少,但经多肽处理后并未明显减少,说明两种肽提高了人Dll4的热稳定性,二者均能够与人Dll4结合。
实施例3划痕损伤修复实验
1.当HUVEC细胞汇合度达80-90%时,用0.25%胰酶消化3min,加入含10%FBS的DMEM培养基将细胞吹下并转移至10mlEP管中,1200rpm离心3min,再用前述培养基重悬为单细胞悬液。
2.调整细胞浓度为2×10
3.待孔中细胞汇合度达85%时,更换无血清的DMEM培养基饥饿处理12h,随后吸去培养基,使用200ul枪头在孔中划线,用PBS洗去漂浮细胞,再加入用无血清DMEM培养基稀释的多肽,立即拍照,记为0h,继续培养。
4.加药后在相应时间点分别拍照,使用Image-Pro-Plus软件计算划痕宽度,迁移距离=(L0-Ln)/2,L0表示0h时的宽度,Ln表示其他时间点的宽度。结果如图5所示,SL1具有促进HUVEC细胞迁移的作用,SH2几乎无作用。
- 一种基于外膜蛋白生成机制的抗菌多肽及其应用
- 一种抗人DLL4和抗人VEGF双特异性抗体及其制备与应用
- 一种抗人DLL4和抗人VEGF双特异性抗体及其制备与应用
