川芎活性部位在制备抗痛风药物中的应用
文献发布时间:2024-01-17 01:26:37
技术领域
本发明属于药物技术领域,涉及中药活性部位及其用途,具体涉及川芎活性部位在制备抗痛风药物中的应用。
背景技术
中药川芎为伞形科植物川芎(Ligusticum chuanxiong Hort)的干燥根茎。《中国药典》收载其具有“活血行气,祛风止痛”之功效,中医临床主要用于治疗胸胁刺痛,跌扑肿痛,经闭痛经,症瘕腹痛,头痛,风湿痹痛等症。现代药理学研究川芎具有扩血管、抗血小板聚集和血栓形成、抗氧化、神经保护、抗炎、抗菌、保肝护肾、镇静、平喘、抗增殖和促凋亡等作用。
痛风(gout)是长期嘌呤代谢紊乱,体内血尿酸增高,并沉积在骨关节等部位引起的疾病。人体内黄嘌呤氧化酶(xanthine oxidase,XOD)能使次黄嘌呤转为黄嘌呤,再使黄嘌呤转变成尿酸,因此,黄嘌呤氧化酶是现代医学治疗痛风最常用靶点。黄嘌呤氧化酶抑制剂可使尿酸生成减少,从而具有抗痛风效果。截止目前,全世界仅有2个此类药物上市,即别嘌呤醇(allopurinol)和非布司他(febuxostat)。
根据中医对痛风的认识,中医将痛风归属于“痹证”范畴,在治疗时结合病情进展特点,采用祛风、止痛、活血类中药,因此,中医临床也常在治疗痛风的复方中配伍使用川芎,如桑当汤、通痹汤等。
但迄今,国内外尚未对川芎抗痛风的活性物质进行系统研究,川芎抗痛风的活性部位、可能的主要成分及如何发挥抗痛风作用等研究均属空白。1998年,韩国学者对川芎80%甲醇提取物在体外抑制黄嘌呤氧化酶的作用进行了研究,发现其抑制作用较弱。2017年,本申请发明人发现川芎经甲醇提取后所得的提取物在体外具有明显的黄嘌呤氧化酶抑制作用,其抑制XOD的IC
综上所述,本申请发明人首次明确了川芎抗痛风的活性部位,初步揭示其可能是通过抑制黄嘌呤氧化酶而发挥抗痛风作用的作用机理,该部位能够作为制备防治痛风的药物或保健品的备选材料。
发明内容
本发明的目的是提供川芎活性部位在制备抗痛风药物中的应用。
为达到上述目的,本发明公开了该活性部位的制备方法、主要成分及其体内外药理作用。
一方面,本发明涉及川芎活性部位在制备抗痛风药物中的应用,公开了川芎活性部位为乙酸乙酯部位,该部位抑制XOD的IC
具体地,川芎活性部位,即川芎乙酸乙酯部位获得方式为利用乙酸乙酯提取或萃取川芎溶液;该川芎溶液为川芎水溶液或川芎醇溶液。
具体地,本发明明确了川芎活性部位,即川芎乙酸乙酯部位主要包含中小极性亲脂类成分,主要为苯酞类化合物。
另一方面,本发明涉及一种抗痛风药物或保健品,其包含川芎的乙酸乙酯部位。
本发明所述川芎活性部位可制成任何一种药物或保健品适用的剂型,包括但不限于片剂、滴丸剂、膏剂、喷雾剂、胶囊剂等;进一步地,为了充分发挥本发明所提供药物的药效,在制备其便于使用的制剂剂型时,除需加入所必须的活性组分川芎活性部位外,还需加入辅助其有效组分发挥药效的助剂或载体,包括矫味剂、崩解剂、助溶剂、缓冲剂中的一种或几种组合,均为现有常用的药物或保健品助剂,本发明并不做特别限定,可根据实际应用需要作出选择或调整。
本发明与现有技术相比具有以下有益效果或者优点:
(1)川芎活性部位作为一种源于中草药的天然化合物,具有环境友好、耐药性低、环境残留少、生物毒性低、天然易降解等优点,可以有效缓解化药及抗生素带来的药物残留、环境污染和耐药性问题,符合目前绿色无公害水产品的要求。
(2)本发明人明确了川芎抑制黄嘌呤氧化酶的关键物质基础为乙酸乙酯部位,该部位抑制XOD的IC
附图说明
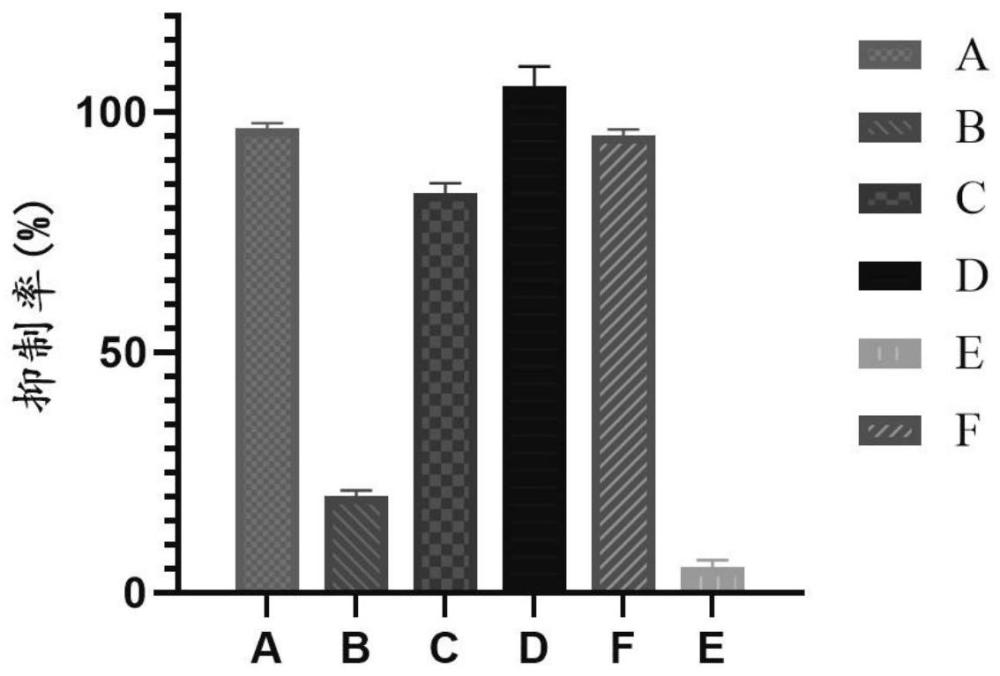
图1为川芎提取物/萃取物对XOD的抑制率;其中,A~F分别表示别嘌呤醇、川芎的水提取物、川芎的甲醇提取物、川芎的乙酸乙酯提取物、川芎的乙酸乙酯萃取剩余物、川芎的乙酸乙酯萃取物对XOD的抑制结果。
图2为川芎乙酸乙酯提取物对XOD的抑制作用曲线。
图3为川芎乙酸乙酯部位对小鼠血清XOD活力的影响;其中,与空白组相比,
图4为川芎乙酸乙酯部位对小鼠肝脏XOD活力的影响;其中,与空白组相比,
图5为川芎乙酸乙酯部位对小鼠血清尿酸含量的影响;其中,与空白组相比,
图6为川芎乙酸乙酯部位对小鼠足肿胀度的影响;其中,与空白组相比,
图7为川芎乙酸乙酯部位对小鼠体重的影响。
图8为川芎乙酸乙酯部位UPLC图谱(上)与总离子流图(下)。
图9为川芎乙酸乙酯部位主要成分结构。
具体实施例
下面,结合实施例对本发明的技术方案进行说明,但是,本发明并不限于下述的实施例。
下述各实施例中实验方法和检测方法,如无特殊说明,均为常规方法;所述药剂和材料,如无特殊说明,均可在市场上购买得到;所述指标数据,如无特殊说明,均为常规测量方法。
实施例1
本实施例提供了川芎抗痛风活性部位的确认
以临床防治痛风的主要靶标黄嘌呤氧化酶为切入点,基于前期研究基础,即本申请发明人发现川芎甲醇提取物在体外具有显著的黄嘌呤氧化酶抑制作用,为进一步明确川芎抑制黄嘌呤氧化酶的活性部位,本申请发明人设计了如下试验:
1川芎提取物/萃取物的制备
称取川芎饮片4份,每份50g,分别进行如下处理:
第一份样品,加水200mL,超声提取两次,每次1h,合并提取液后浓缩至干,得川芎水提取物(B)。
第二份样品,加甲醇200mL,超声提取两次,每次1h,合并提取液后浓缩至干,得川芎甲醇提取物(C)。
第三份样品,加乙酸乙酯200mL,超声提取两次,每次1h,合并提取液后浓缩至干,得川芎乙酸乙酯提取物(D)。
第四份样品,加甲醇200mL,超声提取两次,每次1h,合并提取液后浓缩至干,分散于150mL水中,用等量乙酸乙酯萃取三次(合并萃取液),再将水溶液和乙酸乙酯萃取液分别浓缩至干,得到萃取剩余物(E)和乙酸乙酯萃取物(F)。
2川芎提取物/萃取物体外抑制黄嘌呤氧化酶活性测试
2.1缓冲液的配制:精密称取0.4780gKH
2.2底物的配制:精密称取3.65mg黄嘌呤,加入缓冲液定容至50mL,超声溶解。
2.3酶液的配制:取XOD(5U)用50mL缓冲液稀释后分装于样品瓶中,-70℃保存备用。
2.4阳性对照样品的配置:称取别嘌呤醇2mg,加1mLDMSO和8mLPBS缓冲液,超声促溶。
2.5待测样品的制备:分别称取B、C、D、E、F样品各1.0mg,用DMSO10μL超声溶解,加缓冲液至1mL,即得1mg/mL的溶液,微孔滤膜过滤后备用。
2.6活性测试:取96孔板,分别吸取各样品及阳性对照各100μL,空白组吸取10μLDMSO和90μL缓冲液,每孔各加入酶溶液40μL,在酶标仪内37℃孵育3min后,加入底物60μL(总体积共200μL),立即在295nm处测定吸光度值(每隔30s一次),共计15min。
2.7XOD抑制率(%)的计算公式:抑制率(%)=[1-(ΔA样品/ΔA空白)]×100%,其中ΔA为一定时间吸光度的差值。
2.8IC
3结果与分析
3.1川芎抑制XOD活性部位的确认
阳性对照别嘌呤醇(A)及川芎提取物/萃取物(B~F)对XOD的抑制结果如图1所示:川芎的甲醇提取物和乙酸乙酯提取物均有较好的活性(分别为83.14%和105.38%),其中乙酸乙酯活性更强,表现出和阳性药别嘌呤醇(96.78%)相似的完全抑制的趋势。考虑到分别使用水、甲醇和乙酸乙酯作为溶剂对川芎进行提取,所得的提取物存在成分交叉现象,特别是其甲醇提取物中含有大量与乙酸乙酯提取物相同的成分。本申请发明人将川芎的甲醇提取物分成乙酸乙酯萃取物(F)和萃取剩余物(E)两个部分,分别测定其活性。结果表明,E对XOD的抑制作用几乎完全消失,仅5.31%的抑制率。与此同时,F则表现出了较强的抑制活性(抑制率为95.25%),并与D大致等同。综合以上结果,可以得出:川芎乙酸乙酯提取物/萃取物为川芎体外抑制XOD的活性部位。
3.2川芎乙酸乙酯部位抑制XOD的IC
按照抑制XOD活性测定的方法对川芎乙酸乙酯提取物系列浓度对XOD抑制率进行测定,绘制出活性曲线,如图2所示,并计算得出IC
实施例2
本实施例提供了川芎乙酸乙酯部位抗痛风作用的体内验证
1实验材料
1.1实验动物
雄性昆明小鼠,18~20g,由成都达硕实验动物有限公司提供,许可证号[SCXK(川)2020-030]。
1.2实验试剂
氧嗪酸钾(PO)、尿酸盐钠(MSU),sigma;0.9%生理盐水,西安京西双鹤药业;羧甲基纤维素钠、秋水仙碱片,广东彼迪药业有限公司;碘酒、乙醇、戊巴比妥钠、尿酸测定试剂盒、XO测试盒,南京建成科技有限公司。
1.3实验仪器
Multiskan全波长酶标仪,赛默飞公司;UV-2600紫外可见分光光度计,Shimadzu,Kyoto,Japan;涡旋混匀仪(型号:VORTEX-6),杭州旭清科技有限公司;制冰机(型号:AC-270),北京康建美博科技发展有限公司;十万分之一电子天平(型号:CPA225D),赛多利斯科学仪器有限公司;足容积测量仪(型号:YSL-7C),山东省医学科学院济南益延科技发展有限公司。
2实验方法
2.1羧甲基纤维素钠混悬液的制备:将800mL超纯水加热至70℃,置于磁力搅拌器上,将4g羧甲基纤维素钠缓慢倒入超纯水中,持续搅拌2小时,得澄清胶装液体,无肉眼可见团块,于4℃冰箱过夜,即得0.5%羧甲基纤维素钠混悬液。
2.2测试样品(川芎乙酸乙酯提取物)的制备:将1g川芎乙酸乙酯提取物溶于20mL0.5%羧甲基纤维素钠混悬液中,超声促溶,即得50mg/mL川芎乙酸乙酯提取物的混悬液。
2.3阳性对照(别嘌呤醇)的制备:将0.04g别嘌呤醇溶于10mL的0.5%羧甲基纤维素钠中。
2.4阳性对照(秋水仙碱)的制备:将0.5mg秋水仙碱溶于5mL0.5%羧甲基纤维素钠混悬液中,即得0.1mg/mL的秋水仙碱混悬液。
2.5氧嗪酸钾(PO)的制备:将4g氧嗪酸钾盐研磨后缓慢加入0.5%羧甲基纤维素钠中,反复吹打,无肉眼可见颗粒,得白色混悬液。
2.6MSU晶体的制备:将400mg尿酸钠加至77mL的超纯水中,再加入2.5mL浓度为1mol/L的NaOH共同加热至95℃,使其完全溶解,待冷却后,使用HCL调整pH至7.0,放入4℃冰箱,24h后待晶体析出,3000r/min离心2分钟,共离心3次,至不再有晶体析出,得到的晶体在100℃下烘干2小时备用。使用时加PBS缓冲液制成浓度为20mg/mL的MSU晶体溶液。
2.7实验动物分组及给药
将雄性昆明小鼠适应性喂养后,随机分为高尿酸血症正常对照组、高尿酸血症模型组、高尿酸血症别嘌呤醇药物组、高尿酸血症川芎乙酸乙酯提取物组、急性痛风性关节炎正常对照组、急性痛风性关节炎模型组、急性痛风性关节炎秋水仙碱药物组和急性痛风性关节炎川芎乙酸乙酯提取物组,每组8只。高尿酸血症别嘌呤醇药物组每日灌胃给予别嘌呤醇混悬液,急性痛风性关节炎秋水仙碱药物组每日灌胃给予秋水仙碱混悬液,高尿酸血症川芎乙酸乙酯提取物组和急性痛风性关节炎川芎乙酸乙酯提取物组每日灌胃给予川芎混悬液,高尿酸血症正常对照组、急性痛风性关节炎正常对照组、高尿酸血症模型组和急性痛风性关节炎模型组每日灌胃给予0.5%羧甲基纤维素钠混悬液,给药体积均为10mL/kg,连续给予7天。
在最后一次给药前1h高尿酸血症模型组,高尿酸血症别嘌呤醇药物组及高尿酸血症川芎乙酸乙酯提取物组均腹腔注射PO混悬液给药体积均为280mg/kg,给药后1h将所有动物通过眼球后静脉丛取血,室温静置30min,3000r/min离心取上清,重复两次,收集小鼠血清。小鼠肝脏采集-80℃保存备用。急性痛风性关节炎正常对照组在第7天灌胃1h后,在右脚垫上注射0.1mL生理盐水;急性痛风性关节炎模型组、急性痛风性关节炎秋水仙碱药物组和急性痛风性关节炎川芎乙酸乙酯提取物组右脚垫上注射0.1mLMSU晶体悬浮液。
3指标检测
3.1小鼠肝脏XOD活性检测
按照1:9的比例在小鼠肝脏组织中加入0.9%生理盐水,利用机械匀浆的方法制备小鼠肝脏匀浆液。匀浆液在6000r/min条件下分离上清备用。通过酶活性比色测定法,评价高尿酸模型小鼠血液和肝脏中XOD活性及川芎乙酸乙酯部位对其XOD活力的影响。
3.2血清中尿酸含量的测量
利用比色法对小鼠血清中尿酸的含量进行测定,评价高尿酸血症模型建立效果及川芎乙酸乙酯部位对高尿酸模型小鼠尿酸的影响。
3.3小鼠足肿胀度测量
在MSU溶液注射后的0h、4h、8h、12h和24h,分别用足容积测量仪测量小鼠的足容积,并计算小鼠足肿胀度,计算公式如下:
肿胀度(%)=(C
其中,C
3.4统计学方法
采用GraphPadPrism8软件进行数据处理。数据均采用均值±标准误
4结果与分析
4.1川芎乙酸乙酯部位对小鼠血清XOD活力的影响
如图3所示,在尿酸酶抑制剂氧嗪酸钾构建的高尿酸小鼠体系中,建模小鼠血清XOD活力为28.19U/L,较正常组小鼠(20.53U/L)升高了37.32%,有统计学差异(P<0.01),提示该模型构建成功。与高尿酸血症小鼠相比,别嘌呤醇组小鼠血清XOD活力为11.99U/L,降低了57.45%(P<0.0001)。与别嘌呤醇效果相似,川芎乙酸乙酯部位组小鼠血清XOD活力为18.32U/L,降低了34.99%(P<0.001),表明川芎乙酸乙酯部位对高尿酸血症小鼠血清中XOD活力有显著抑制作用。
4.2川芎乙酸乙酯部位对小鼠肝脏XOD活力的影响
如图4所示,经尿酸酶抑制剂氧嗪酸钾构建的高尿酸小鼠体系中,建模小鼠肝脏XOD活力为32.62U/gprot,较正常对照组小鼠(23.85U/L)升高了36.83%(P<0.01),表明该模型构建成功。与高尿酸血症小鼠相比,别嘌呤醇组小鼠肝脏XOD活力为18.95U/gprot,降低了41.92%(P<0.001)。与别嘌呤醇组小鼠相似,川芎乙酸乙酯部位组小鼠肝脏XOD活力为20.74U/gprot,降低了36.44%(P<0.05),表明川芎乙酸乙酯部位对高尿酸血症小鼠肝脏中XOD活力有显著抑制作用。
4.3川芎乙酸乙酯部位对小鼠血清中尿酸含量的影响
如图5所示,腹腔注射氧嗪酸钾1h后,模型组小鼠血清中尿酸含量为286.82μmol/L,与正常组小鼠相比,升高了75.16%,有统计学差异(P<0.001),提示该模型构建成功。与高尿酸血症小鼠相比,别嘌呤醇组小鼠血清尿酸含量为68.72μmol/L,降低了75.16%(P<0.001)。与别嘌呤醇组小鼠相似,川芎乙酸乙酯部位组小鼠血清尿酸含量为108.14μmol/L,降低了60.92%(P<0.001),表明川芎乙酸乙酯部位可显著降低高尿酸血症小鼠血清中尿酸的含量。
4.4川芎乙酸乙酯部位对痛风模型小鼠足肿胀度的影响
如图6所示,在给予小鼠足垫注射MSU晶体0h、4h、8h、12h和24h后,与正常组(注射生理盐水)小鼠相比,模型组小鼠足肿胀度均增加了19%以上(P<0.0001),表明成功建立了小鼠痛风性关节炎模型,且模型在整个研究过程中较为稳定。
在建模4h、8h、12h和24h,秋水仙碱均表现出了较强的抑制作用,其在不同时间时,足肿胀度均比模型组减少了9%以上(P<0.001),并在第24h达到最高(15.32%)。同时,川芎乙酸乙酯部位在相应的时间也对模型小鼠的足肿胀度表现出相似的抑制作用,其在4h、8h、12h和24h对小鼠足肿胀度的抑制作用较模型组分别减少了10.51%,16.68%,18.78%和17.09%,效果甚至优于秋水仙碱的作用。
4.5川芎乙酸乙酯部位对小鼠体重的影响
如图7所示,与正常组相比,别嘌呤醇组和秋水仙碱组的体重变化量明显较低,提示别嘌呤醇(40mg/kg·d)和秋水仙碱(1mg/kg·d)对小鼠的体重增长可能产生一定影响。而川芎乙酸乙酯部位组(500mg/kg·d)在治疗前后的体重变化与正常组相似,提示其对小鼠体重增长无明显影响。
实施例3
本实施例提供了基于UPLC-Q-TOFMS/MS技术的川芎乙酸乙酯部位成分表征
1实验方法
1.1供试品的准备
取川芎乙酸乙酯部位适量,精密称定,加甲醇配制为50mg/mL的供试品溶液,经0.22μm微孔滤膜滤过,备用。
1.2色谱条件
流动相:0.1%甲酸水(A)-乙腈(B);梯度洗脱程序:0~25min,10%~35%B,25~32min,35%~36%B,32~40min,36%~40%B,40~45min,40%~55%B,51~60min,65%~80%B;流速0.3mL/min;样品进样量3μL;检测波长:254nm;柱温:30℃。
1.3质谱分析条件
Waters质谱仪(SYNAPTG2-SiQ-TOF);电喷雾正离子模式;毛细管电压,3.0kV;源温度:100℃;脱溶剂温度:350℃;去溶剂化气体流量,800L/h;锥形气流为50L/h。
2结果与分析
按照如上条件,得到UPLC色谱图和正离子模式的TIC图,如图8所示。通过梳理文献,建立川芎化学成分数据库,并结合常见中药化学成分数据库,与川芎质谱信息进行比对,对该部位成分进行表征,各成分的保留时间、分子式和碎片离子等信息见表1,推测的结构见图9。
表1川芎乙酸乙酯部位主要成分的色谱与质谱数据
如上所述,即可较好地实现本发明,上述的实施例仅仅是对本发明的优选实施方式进行描述,并非对本发明的范围进行限定,在不脱离本发明设计精神的前提下,本领域普通技术人员对本发明的技术方案做出的各种改变和改进,均应落入本发明确定的保护范围内。
