用于转导的方法、反应剂盒、反应剂和设备
文献发布时间:2024-04-18 19:44:28
相关申请的交叉引用
本申请要求于2015年10月22日提交的美国临时专利申请62/245,265,题为“用于转导一群细胞的方法、反应剂盒和设备”,于2016年3月9日提交的美国临时专利申请62/305,989,题为“用于转导一群细胞的方法、反应剂盒和设备”,和于2016年7月29日提交的美国临时申请62/369,020,题为“用于促进转导的方法和反应剂”的优先权,其内容完整纳入本文以供参考。
通过引用纳入序列表
本申请与电子格式的序列表一同提交。所提供的序列表名称为735042001840SeqList.txt,创建于17.10.16,其文件大小为39,953字节。该序列表的电子格式的信息通过引用其全文纳入本文。
技术领域
本公开内容在一些方面涉及细胞组合物,例如一群淋巴细胞。方法涉及使用反应剂(reagent),例如促进转导的寡聚蛋白反应剂,以及某些情形中可包括可逆结合于其上的结合剂,该结合一般能通过添加物质逆转。在一些方面,本公开内容提供了转导细胞群的方法和反应剂,其涉及使作用剂(agent)结合到细胞表面分子,从而提供含有转导的细胞的经孵育的组合物。某些情形中,反应剂是多聚化反应剂,一种或多种作用剂能够通过与反应剂可逆结合而多聚化。在一些方面,多聚的作用剂能供细胞群转导之用,随后此类作用剂可通过破坏所述可逆键来去除。在一些实施方式中,所提供的方法能用于转导细胞,在另一些情况下还能用于富集、激活、刺激和/或扩增转导的细胞。还提供了其使用方法、组合物和设备。
背景
体外转导T细胞群已有各种策略,包括体外转导抗原特异性T细胞用于过继性细胞免疫治疗和癌症治疗。在一些方面,T细胞疗法的汇集,例如用重组受体如嵌合抗原受体工程改造或转导的T细胞已经显示出在携瘤宿主中的抗肿瘤反应性,或用于治疗病毒感染。需要用于例如研究、诊断和治疗目的的体外转导细胞群的改进策略。提供满足此类需求的作用剂、方法、制品和反应剂盒。
发明内容
本文在一些实施方式中提供了转导细胞的方法,包括将含靶细胞的多个细胞与寡聚蛋白反应剂和病毒颗粒一同孵育,该方法产生含有被病毒颗粒转导的一个或多个细胞的输出组合物。
在这样的一些实施方式中,寡聚反应剂包含多个多肽单体单元,其中每个单元的长度至少是或至少约10、20、30或40个氨基酸,和/或分子量至少是或至少约20、30、40或50kDA;和/或寡聚反应剂的分子量至少或约100,和/或约150kDa至约2000kDa之间,和/或约150kDa至约1500kDa之间,和/或约150kDa至约1250kDa之间,和/或约150kDa至约1000kDa之间,和/或约150kDa至约500kDa之间,和/或约150kDa至约300kDa之间,约300kDa至约2000kDa之间,约300kDa至约1500kDa之间,约300kDa至约1250kDa之间,约300kDa至1000kDa之间,约300kDa至约500kDa之间,约500kDa至约2000kDa之间,约500kDa至约1500kDa之间,约500kDa至约1250kDa之间,约500kDa至1000kDa之间,约1000kDa至约2000kDa之间,约1000kDa至约1500kDa之间,约1000kDa至约1250kDa之间,约1250kDa至约2000kDa或约1500kDa至约2000kDa之间。
在一些此类实施例中,反应剂包含多种多聚体亚基,其各自包含多个单体单元。某些方面,多聚体亚基是四聚体。
在一些此处的实施方式中,寡聚蛋白反应剂包含链霉亲和素、亲和素、链霉亲和素类似物或突变蛋白或亲和素类似物,或前述任一的突变蛋白或生物活性片段,和/或前述之任选的多个亚基。
本文还在一些实施方式中提供了转导细胞的方法,包括将包含靶细胞的多细胞与蛋白反应剂以及病毒颗粒一同孵育,所述蛋白反应剂包含链霉亲和素、亲和素、链霉亲和素类似物或突变蛋白,亲和素类似物、前述任一的突变蛋白或生物活性片段,和/或前述之任选的多个亚基,该方法产生包含由病毒颗粒转导的一个或多个细胞的输出组合物。
在一些此处的实施方式中,孵育包括将细胞与反应剂和病毒颗粒同时或依次(任意顺序)混合。在一些实施方式中,在至少部分孵育期间,反应剂和病毒颗粒同时与细胞共在或同时与细胞接触。
本文还在一些实施方式中提供了一种转导细胞的方法,该方法包括使病毒颗粒与寡聚蛋白反应剂接触,从而产生一种包含与反应剂关联的病毒颗粒的混合物;以及将该混合物与含有靶细胞的多个细胞孵育,该方法产生含有被病毒颗粒转导的一个或多个细胞的输出组合物。
在一些实施方式中,该方法包括将病毒颗粒与蛋白反应剂一同孵育,所述蛋白反应剂包含链霉亲和素、亲和素、链霉亲和素类似物或突变蛋白、亲和素类似物、前述任一的突变蛋白或生物活性片段,和/或任何之任选的多个亚基,从而产生包含与反应剂关联的病毒颗粒的混合物;并且将该混合物与多个细胞一同孵育,该方法产生包含由病毒颗粒转导的一个或多个细胞的输出组合物。
在一些此处的实施方式中,反应剂具有净正电荷或总正电荷。某些情形中,所述反应剂是裸露的。
在一些此处的实施方式中,反应剂不含和/或不偶联或不可逆性结合于结合剂;作用剂不含和/或不偶联或不结合于具有对细胞表面标志物特异性的结合域的分子;反应剂不含和/或不偶联或不结合于胞外基质元件,粘性分子、整合素、凝集素、整合素-结合蛋白、趋化因子、细胞因子、生长因子、胞外基质结合分子、ECM元件、病毒蛋白、促进病毒进入的细胞表面受体、肝素、乙酰肝素、聚糖;和/或反应剂不含肝素结合域和/或不含整合素结合域和/或不含VLA4结合域和/或不含VLA5-结合域;和/或反应剂不含和/或不偶联或偶合或结合于病毒结合剂或细胞选择剂。
在一些此处的实施方式中,反应剂还含有和/或可逆性结合于多个一种或多种结合剂,所述结合剂各自能特异性结合病毒颗粒表面和/或靶细胞表面的分子。
本文在一些实施方式中提供了转导细胞的方法,其包括将多个靶细胞与寡聚蛋白反应剂以及病毒颗粒一同孵育,其中:寡聚蛋白反应剂包括多个多肽单体单元,其中每个单元的长度至少是或至少约10、20、30或40个氨基酸且/或分子量至少是或至少约20、30、40或50kDA;和/或寡聚蛋白反应剂的分子量或平均分子量至少是或至少约100kDa,该方法产生包括被病毒颗粒转导的一个或多个细胞的输出组合物。
在一些方法实施方式中,寡聚蛋白反应剂包括多个多肽单元,各自包含链霉亲和素、亲和素、生物素结合多肽、链霉标签-结合多肽、链霉亲和素突变蛋白、链霉亲和素类似物、亲和素突变蛋白、亲和素类似物、和/或前述任一的生物活性片段。
在一些方法实施方式中,寡聚蛋白反应剂包括一或多个多聚体亚基,所述多聚体亚基各自包含两个或更多多肽单元。
本文还在一些实施方式中提供了转导细胞的方法,包括将包含靶细胞的多细胞与(1)蛋白反应剂,所述蛋白反应剂包括链霉亲和素、亲和素、链霉亲和素类似物或突变蛋白、亲和素类似物、前述任一的突变蛋白或生物活性片段,和/或任何之任选的多个亚基,和(2)病毒颗粒一同孵育,该方法产生包含由病毒颗粒转导的一个或多个细胞的输出组合物。
一些此处的实施方式中,(i)孵育包括将靶细胞和反应剂混合和/或将靶细胞与病毒颗粒依次混合(任何顺序),可任选地,其中(a)中的混合和(b)中的混合在不超过1小时、2小时、3小时、4小时、5小时、6小时、7小时、8小时、9小时、10小时、11小时、12小时、18小时、24小时、36小时、48小时、或72小时的时间内进行,和/或(a)中的混合与(b)中的混合相隔不超过1小时、2小时、3小时、4小时、5小时、6小时、7小时、8小时、9小时、10小时、11小时、12小时、18小时、24小时、36小时、或48小时;(ii)孵育包括混合靶细胞、反应剂和病毒颗粒,所述混合同时或几乎同时进行;(iii)孵育包括将含有靶细胞与病毒颗粒而不含反应剂的组合物混合,可任选地,其中:包含靶细胞和反应剂的组合物中的靶细胞不超过5%、10%、20%、30%或40%是活化细胞并表达选自下组的表面标志物:HLA-DR、CD25、CD69、CD71、CD40L和4-1BB;具有选自下组的细胞因子的胞内表达:IL-2,IFNγ、TNF-α,且/或能够增殖;和/或混合在组合物中的靶细胞和病毒颗粒混合后不超过1小时、2小时、3小时、4小时、5小时、6小时、7小时、8小时、9小时、10小时、11小时、12小时、18小时、24小时、36小时、或48小时内进行;(iv)孵育包括将包含靶细胞和反应剂但不含病毒颗粒的组合物与病毒颗粒混合,可任选地,其中:包含靶细胞和反应剂的组合物中的靶细胞不超过5%、10%、20%、30%或40%是活细胞并表达选自下组的表面标志:HLA-DR、CD25、CD69、CD71、CD40L和4-1BB;具有选自下组的细胞因子的胞内表达:IL-2,IFNγ、TNF-α,且/或能够增殖;和/或混合在组合物中靶细胞和病毒颗粒混合后不超过1小时、2小时、3小时、4小时、5小时、6小时、7小时、8小时、9小时、10小时、11小时、12小时、18小时、24小时、36小时、或48小时内进行;(v)孵育包括将包含病毒颗粒和反应剂的组合物与包含靶细胞但不包含病毒颗粒和/或不含反应剂的组合物混合,可任选地,其中:包含靶细胞和反应剂的组合物中的靶细胞不超过5%、10%、20%、30%或40%是活化的细胞表达选自下组的表面标志:HLA-DR、CD25、CD69、CD71、CD40L和4-1BB;具有选自下组的细胞因子的胞内表达:IL-2,IFNγ、TNF-α,且/或能够增殖。在一些实施方式中,寡聚蛋白反应剂包括多个单一单元,所述单元包括以下所述之一或多种:生物素结合多肽、链霉亲和素、亲和素、链霉亲和素类似物、链霉亲和素突变蛋白、亲和素类似物、亲和素突变蛋白和生物活性片段。
在一些实施方式中,反应剂包括多种或多个多聚体亚基单元,各自包括两个或更多单体单元。在一些实施方式中,多聚体亚基是四聚体和/或各自包括四个单体单元。
在一些实施方式中,孵育包括同时或依次(任意序列)将细胞与反应剂混合和与病毒颗粒混合。在一些实施方式中,在至少一部分孵育期间,反应剂和病毒与细胞同时与细胞共在或同时与细胞接触。
本文在一些实施方式中提供了转导细胞的方法,其包括:(a)使病毒颗粒与寡聚蛋白反应剂接触,从而产生包括病毒颗粒和反应剂的组合物,其中病毒颗粒任选地与反应剂关联;和(b)将(a)中的组合物与包含靶细胞的多个细胞孵育,该方法产生包括被病毒颗粒转导的一个或多个细胞的输出组合物。
本文在一些实施方式中提供了转导细胞的方法,其包括将含有病毒颗粒与寡聚蛋白反应剂的组合物和包含靶细胞的多细胞混合,该方法产生含有被病毒颗粒转导的一个或多个细胞的输出组合物。
本文还在一些实施方式中提供了转导细胞的方法,其包括(a)将病毒颗粒与蛋白反应剂接触,所述蛋白反应剂包括链霉亲和素、亲和素、链霉亲和素类似物或突变蛋白,亲和素类似物、前述任意的突变蛋白或生物活性片段,和/或前述之任选的多个亚基,从而产生包括病毒颗粒和反应剂的组合物,其中病毒颗粒可任选地与反应剂关联;和(b)将(a)中的组合物与多个细胞一同孵育,该方法产生包含由病毒颗粒转导的一个或多个细胞的输出组合物。
本文在一些实施方式中提供了转导细胞的方法,其包括将含有病毒颗粒和蛋白反应剂的组合物与含有靶细胞的多个细胞混合,其中:蛋白反应剂包括链霉亲和素、亲和素、链霉亲和素类似物或突变蛋白、亲和素类似物、前述任一的突变蛋白或生物活性片段,和/或前述之任选的多个亚基;并且,该方法产生包括被病毒颗粒转导的一个或多个细胞的输出组合物。在一些实施方式中,反应剂和/或每一单体单元和/或每一多聚体单元具有净正电荷或总正电荷。
在一些实施方式中,反应剂不含和/或不偶联或不可逆性结合于结合剂,该结合剂包括抗体或其片段;反应剂不包括包含人细胞表面分子或其结合片段的结合剂;反应剂不包含或不偶联或结合于具有对人细胞表面标志,可任选的T细胞标志物特异性的结合域的分子;反应剂不含和/或不偶联或不结合于胞外基质元件,粘性分子、整合素、凝集素、整合素-结合蛋白、趋化因子、细胞因子、生长因子、胞外基质结合分子、ECM元件、病毒蛋白、促进病毒进入的细胞表面受体、肝素、乙酰肝素、聚糖;和/或反应剂不含肝素结合域和/或不含整合素结合域和/或不含VLA4结合域和/或不含VLA5-结合域。
在一些实施方式中,反应剂还含有和/或可逆性结合于多个一种或多种结合剂,所述结合剂各自能特异性结合病毒颗粒表面和/或靶细胞表面的分子。
本文在一些实施方式中提供了转导细胞的方法,包括将包含靶细胞的多细胞与1)包含多个能可逆结合结合剂的结合位点的寡聚蛋白反应剂,其中一个或多个结合位点与结合剂可逆性结合;和2)病毒颗粒一同孵育,其中1)中的孵育的至少一部分与2)同时发生,该方法产生含有被病毒颗粒转导的一个或多个细胞的输出组合物。某些情形中,反应剂包含多个结合位点,其能可逆地与各所述结合剂结合,多个结合位点包括一个或多个结合位点Z,其能与结合伴侣C结合;结合剂还含有一个或多个结合伴侣C。
在一些实施方式中,结合剂是或包含受体结合剂。某些情形中,反应剂还包含另一种结合剂,其是与靶细胞表面表达的一种分子特异性结合的选择剂。在一些方面,结合剂是与一个或多个靶细胞表面表达的分子特异性结合的选择剂。某些情形中,结合剂是特异性结合病毒颗粒表面分子的病毒结合剂。
在一些实施方式中,提供了转导细胞的方法,该方法包括使含包含靶细胞的多个细胞的组合物与结合剂接触,所述结合剂是能够与一个或多个靶细胞表达的分子特异性结合的选择剂,且与包含能与所述选择剂可逆结合的多个结合位点的反应剂可逆结合;和在一个或多个病毒颗粒的存在下孵育至少多个细胞,其中所述接触和孵育同时或以任意顺序依次进行,该方法产生包含被病毒颗粒转导的细胞的输出组合物。
某些情形中,病毒颗粒与反应剂可逆结合,所述反应剂含有能直接或间接与病毒颗粒表面的分子可逆结合的多个结合位点。在一些方面,病毒颗粒与反应剂通过病毒颗粒结合剂可逆结合,该病毒颗粒结合剂与病毒颗粒表面的分子特异性结合,所述反应剂含有可逆结合病毒结合剂的多个结合位点。
在一些实施方式中,反应剂包括多个结合位点Z1,其能与选择剂可逆结合,和/或反应剂含有多个结合位点Z2,其能与一个或多个病毒颗粒通过病毒结合剂可逆结合。
在一些实施方式中,提供了转导细胞的方法,该方法包括使含有一个或多个病毒颗粒的组合物与结合剂接触,所述结合剂是能与病毒颗粒表面的分子特异性结合的病毒结合剂,且与包含多个结合位点的反应剂可逆结合,所述结合位点与病毒结合剂可逆结合;和在一个或多个病毒颗粒存在下孵育至少含靶细胞的多个细胞,其中所述接触和孵育同时或以任意顺序依次进行,该方法产生包含被病毒颗粒转导的多个细胞的输出组合物。
一些此处的实施方式中,(1)中的接触和(2)中的孵育在不超过1小时、2小时、3小时、4小时、5小时、6小时、7小时、8小时、9小时、10小时、11小时、12小时、18小时、24小时、36小时、48小时、或72小时内进行,和/或(a)中的混合与(b)中的孵育相隔不超过1小时、2小时、3小时、4小时、5小时、6小时、7小时、8小时、9小时、10小时、11小时、12小时、18小时、24小时、36小时、或48小时进行。
在一些此处的实施方式中,结合剂是或包含抗体、抗体片段、单价抗体片段、具有抗体样结合性质的蛋白结合分子、含有Ig结构域的分子、细胞因子、趋化因子、适体、MHC分子,或它们的结合片段。某些此类实施方式中,抗体片段含有选自以下所述的片段:Fab片段、Fv片段、(Fab’)
某些此类实施方式中,反应剂是或含寡聚蛋白反应剂。某些情形中,寡聚蛋白反应剂包含链霉亲和素、亲和素、链霉亲和素类似物或突变蛋白或亲和素类似物,前述任一的突变蛋白或生物活性片段,和/或前述之任选的多个亚基。在某些此类实施方式中,反应剂是可溶性的。
在一些此处的实施方式中,在孵育期间,反应剂不是且不结合于或关联于(associated with)固体支持物、固定相、珠、微粒、磁性颗粒和/或基质;并且/或者,反应剂是柔性的,不含金属或磁性核心,完全或主要由有机多聚体组成,不为球形,基本上不为球形或形状不均一,且/或非刚性。
某些此类实施方式中,反应剂被直接或间接固定化在或者能够直接或间接固定化在支持物上;且至少一部分孵育发生在所述支持物上。某些方面,反应剂是直接或间接固定化在或者能够直接或间接固定化在支持物上,由此,选择剂直接或间接固定化在或者能够直接或间接固定化在支持物上;随着进一步合并支持物,至少一群中的一个或多个靶细胞在至少部分孵育期间通过选择剂固定到支持物上。
本文某些实施方式中还提供转导细胞的方法,所述方法令以下物质接触:含有含靶细胞的细胞群和选择剂的组合物,所述选择剂能够特异性结合一种或多种靶细胞表达的选择标志物并且直接或间接固定于或能够直接或间接固定于支持物上;和支持物,由此所述至少一群中的一个或多个靶细胞通过所述选择剂固定到所述支持物上;和在含有多个病毒颗粒的组合物存在下孵育至少一群细胞,其中所述多个表达颗粒中一个或多个能够直接或间接固定于所述支持物。某些情形中,所述接触和孵育同时或依次(任一顺序)进行;所述一个或多个靶细胞和所述一个或多个病毒颗粒在至少部分孵育期间固定到所述支持物上;并且,所述方法产生含被所述病毒颗粒转导的多个细胞的输出组合物。
在一些实施方式中,支持物为固定相或包含固定相;和/或支持物是固体支持物或包含固体支持物。在反应剂固定于或能够固定于支持物的某些情形,反应剂具有多个结合位点Z1,它们能够可逆结合选择剂,还有多个结合位点Z2,它们能够通过病毒结合剂可逆结合一个或多个病毒颗粒。某些情形中,接触步骤还包括合并反应剂,所述反应剂固定在支持物上。某些情形中,在与选择剂和/或含多个细胞的组合物接触之前将反应剂和支持物合并。
在一些实施方式中,选择剂是第一选择剂,分子是第一分子,并且还在第二选择剂存在下进行孵育,所述第二选择剂能够特异性结合一个或多个靶细胞表面表达的第二分子。某些情形中,第二选择剂可逆结合于反应剂或第二反应剂,反应剂或第二反应剂具有多个结合位点,它们能够可逆结合第二选择剂,第二选择剂由此与之可逆结合。
一些实施方式中,靶细胞包含血细胞;靶细胞包含白细胞;靶细胞包含淋巴细胞;靶细胞包含B细胞;靶细胞包含B细胞群;靶细胞包括T细胞;靶细胞包含T细胞群;和/或靶细胞包含自然杀伤(NK)细胞;所述靶细胞包含树突细胞;所述靶细胞包含巨噬细胞。
某些情形中,靶细胞包含抗原特异性T细胞或细胞群、辅助T细胞或细胞群、细胞毒性T细胞或细胞群、记忆性T细胞或细胞群、调节性T细胞或细胞群、NK细胞或细胞群、抗原特异性B细胞或细胞群、记忆性B细胞或细胞群、调节性B细胞或细胞群。
在一些此处的实施方式中,靶细胞含T细胞。某些情形中,T细胞包含CD4+和/或CD8+T细胞和/或其亚群或亚组,并且/或者是针对以上所述任一细胞群进行了富集的。
某些此类实施方式中,所述分子是B细胞或T细胞共同受体;所述分子是或含T细胞或B细胞抗原受体复合物;所述分子是或含CD3链;所述分子是或含CD3ζ(zeta)链;所述分子是或含CD8;所述分子是或含CD4。在一些实施方式中,被选择剂特异性结合的分子是或含CD25、CD28、CD62L、CCR7、CD27、CD127、CD3、CD4、CD8、CD45RA和/或CD45RO。
某些此类实施方式中,选择剂与所述分子之间的特异性结合不诱导给向靶细胞的信号,或者不包括向靶细胞传递刺激或活化或增殖信号。某些实施方式中,至少部分孵育期间,选择剂结合靶细胞表面表达的分子,由此促进反应剂与靶细胞关联。某些情形中,相比不表达所述分子或不被选择剂特异性结合的非靶细胞的转导,反应剂与靶细胞之间的关联增强靶细胞的转导。
某些此类实施方式中,所述多个细胞包含静息T细胞或初始T细胞。某些此类实施方式中,至少40%、至少50%、至少60%、至少70%、至少80%或至少90%的T细胞对于选自以下所述T细胞活化标志物呈阴性:HLA-DR、CD25、CD69、CD71、CD40L和4-1BB;并且或则缺少选自以下所述细胞因子的胞内表达:IL-2、IFNγ、TNF-α;且/或能够增殖。某些实施方式中,不超过10%的T细胞具有选自以下所述的T细胞活化标志物:HLA-DR、CD25、CD69、CD71、CD40L和4-1BB;和/或缺少选自以下所述细胞因子的胞内表达:IL-2、IFNγ、TNF-α;且/或能够增殖。
某些此类实施方式中,孵育之前,所述方法不包括在促T细胞活化的条件下刺激所述多个细胞中的细胞。
某些此类实施方式中,孵育前,细胞不曾接受离体刺激,所述刺激包括约37℃孵育和/或选自以下所述一种或多种作用剂存在下孵育:能够激活、诱导T细胞、CD4+T细胞和/或CD8+T细胞内通过TCR复合物的信号的作用剂;能够诱导T细胞、CD4+T细胞和/或CD8+T细胞增殖的作用剂;CD3-结合分子;CD28-结合分子。某些实施方式中,所述多个细胞包含活化的细胞。
某些此类实施方式中,与反应剂孵育前或期间,所述方法包括在刺激剂存在下、在一个或多个靶细胞被所述刺激剂刺激或活化的条件下激活细胞。某些情形中,靶细胞包含T细胞,所述刺激条件包括存在能够激活TCR复合物组分之一或多个之胞内信号转导结构域的物质。某些方面,作用剂包含主作用剂(primary agent)和次作用剂(secondary agent),主作用剂特异性结合TCR复合物,次作用剂特异性结合T细胞共刺激分子。
某些实施例中,主作用剂特异性结合CD3;和/或共刺激分子选自:CD28、CD137(4-1-BB)、OX40或ICOS。某些方面,所述主作用剂和次作用剂包含抗体和/或存在于固体支持物的表面之上。
某些实施方式中,所述方法还包括在受体结合剂存在下培养至少多个细胞,所述受体结合剂特异性结合一个或多个靶细胞表面表达受体从而传递刺激信号并且可逆结合于反应剂或第二反应剂,所述反应剂或第二反应剂含各自能够可逆结合所述受体结合剂的多个结合位点,由此诱导或调节细胞内信号。某些情形中,所述培养在所述孵育之前进行和/或开始。
在一些实施方式中,在孵育期间,反应剂是第二反应剂(second reagent),所述第二反应剂未结合于或未关联固体支持物、固定相、珠、微粒、磁性颗粒和/或基质,且/或,所述第二反应剂是柔性的,不含金属或磁性核心,完全或主要由有机多聚体组成,不为球形,基本上不为球形或形状不均一,且/或非刚性。某些情形中,反应剂是第二反应剂且该第二反应剂固定在支持物上。
某些实施方式中,刺激剂含MHC-I:肽复合物或其功能性分部、MHC-II:肽复合物或其功能性分部,且/或能够通过T细胞的TCR/CD3复合物、T细胞的含CD3复合物和/或T细胞的含ITAM分子传递刺激信号。
一些此处的实施方式中,受体结合剂特异性结合TCR/CD3复合物的成员或特异性结合CD3。某些情形中,受体结合剂是第一受体结合剂,并且,还在第二受体结合剂存在下进行培养,所述第二受体结合剂是辅结合剂(accessory binding agent),能够特异性结合一个或多个T细胞表面的第二受体,由此在细胞内诱导第二信号从而增强、减弱或改变第一受体传递的信号。
某些实施例中,第二受体结合剂可逆结合于反应剂、第二反应剂或第三反应剂;所述反应剂、第二反应剂或第三反应剂具有多个能够可逆结合第二受体结合剂的结合位点,第二受体结合剂由此与之可逆结合。某些情形中,第二受体是共刺激分子、辅助分子、细胞因子受体、趋化因子受体、免疫哨点分子,或是TNF家族或TNF受体家族成员。
某些此类实施方式中,第一和第二受体结合剂分别结合细胞表面表达的含有CD3和/或CD28的分子,或则,所述分子就是CD3和/或CD28的分子。某些方面,第一和第二受体结合剂分别包含抗CD3抗体或其片段和/或抗CD28抗体或其片段。
某些此类实施方式中,孵育和培养分开在分开的但彼此操作性连接例如管道连接的容器中进行。某些实施方式中,孵育和培养在封闭系统中进行。
某些实施方式中,所述方法包括收获可逆结合于且受受体结合剂(可以是第一和/或第二受体结合剂)刺激的细胞,由此产生经培养的细胞,所述经培养的细胞是或包含靶细胞所在的多个细胞。
某些此类实施方式中,所述方法在所述接触之后还包括分离和/或去除多个细胞中固定化靶细胞之外的其他细胞。某些情形中,所述分离和/或去除通过洗涤步骤进行。某些情形中,所述分离和/或去除在孵育开始之前进行。
某些此类实施方式中,孵育在所述接触之前进行和/或开始;或则,孵育在所述接触之后进行和/或开始。某些此类实施方式中,所述接触发生于所述孵育的至少部分期间。
某些实施方式中,病毒结合剂结合病毒颗粒表面分子,所述分子选自包膜糖蛋白、包膜糖蛋白变体、嵌合包膜糖蛋白、病毒衣壳蛋白,病毒衣壳蛋白变体、病毒基质蛋白、病毒基质蛋白变体、合成部分(synthetic moiety)、肽或标签。某些情形中,包膜糖蛋白选自VSV糖蛋白(VSV-G)、辛德比斯糖蛋白(例如SIN)、MMLV糖蛋白、HSV糖蛋白、MMTV糖蛋白、麻疹病毒糖蛋白、HTLV糖蛋白、SIV糖蛋白、GALV糖蛋白、HIV糖蛋白(例如gp160、gp120或gp41)和RSV糖蛋白(例如gp85或gp37),或是它们足以使之被病毒颗粒结合剂结合的组成部分、变体,或嵌合分子。某些方面,病毒结合剂结合的病毒颗粒表面分子是与该病毒异源的非病毒重组分子。
某些实施方式中,所述分子是合成部分、肽或标签,选自:谷胱甘肽-S-转移酶(GST)、甲壳素结合蛋白(CBP)、钙调蛋白结合肽(CBP)、FLAG-肽、血细胞凝集素肽、VSV-G-标签、HSV-标签、T7表位、麦芽糖结合蛋白(MBP)、HSV表位、myc表位、V5-标签和链霉亲和素结合肽。某些情形中,所述分子是链霉亲和素结合肽。某些方面,所述分子是合成部分、肽或标签,所述病毒颗粒经工程改造而在其表面表达所述合成部分、肽或标签。
在一些实施方式中,所述链霉亲和素结合肽包含SEQ ID NO:7、8、13、14和15-19中任一项所示的氨基酸序列。某些情形中,所述分子是或含配体结合域。某些实施例中,所述分子是或含抗原受体。某些情形中,所述抗原受体是嵌合抗原受体(CAR)。某些方面,病毒结合剂是抗体或抗原结合片段,它们特异性结合CAR胞外区。某些情形中,所述胞外区是抗原结合域或铰链区。
某些此类实施方式中,病毒颗粒结合剂选自鱼精蛋白、
某些此类实施方式中,病毒颗粒与反应剂关联或结合。某些实施方式中,病毒载体的基因组含有编码重组蛋白的异源核酸分子。某些情形中,所述重组蛋白是抗原受体。某些实施例中,所述重组蛋白是嵌合抗原受体。
某些此类实施方式中,病毒颗粒是逆转录病毒载体颗粒。某些方面,病毒颗粒是慢病毒颗粒。某些情形中,慢病毒载体颗粒含有衍生自HIV-1的基因组。某些此类实施方式中,逆转录病毒载体颗粒是γ逆转录病毒颗粒。某些实施例中,γ逆转录病毒颗粒是鼠白血病病毒(MLV)颗粒。某些实施方式中,病毒载体颗粒是具有病毒包膜糖蛋白的假型化病毒颗粒。某些情形中,病毒包膜糖蛋白是VSV-G。
某些此类实施方式中,嵌合抗原受体CAR包含特异性结合靶抗原的胞外抗原识别结构域和含ITAM的胞内信号转导结构域。某些情形中,胞内细胞信号转导结构域包含CD3ζ链的胞内结构域。某些方面,还包括将胞外域与胞内细胞信号转导结构域相连的跨膜结构结构域。某些情形中,所述跨膜结构域包含CD28的跨膜部分。在一些实施方式中,胞内信号转导结构域还包含T细胞共刺激分子的胞内结构域。某些实施例中,T细胞共刺激分子选自CD28和41BB。
某些此类实施方式中,核酸还包含与重组抗原受体编码核酸操作性相连的启动子。
某些此类实施方式中,所述多个细胞包含外周血单核细胞(PBMC)或者其经富集或分离的细胞亚群。某些实施方式中,所述多个细胞包含血细胞、白细胞、淋巴细胞、B细胞、T细胞或NK细胞。
在一些实施方式中,多个细胞包含抗原特异性T细胞或细胞群、辅助T细胞或细胞群、细胞毒性细胞或细胞群、记忆性T细胞或细胞群、调节性T细胞或细胞群、NK细胞或细胞群、抗原特异性B细胞或细胞群、记忆性B细胞或细胞群、调节性B细胞或细胞群。某些实施方式中,多个细胞是原代细胞(primary cell)。某些实施方式中,多个细胞包含T细胞。某些方面,T细胞为未分级分离的T细胞、富集或分离的CD3+T细胞、富集或分离的CD4+T细胞、或富集或分离的CD8+T细胞。
某些此类实施方式中,反应剂对细胞无毒,或者,孵育或培养后细胞中至少或至少约75%、85%、90%、95%或更多细胞是活的。某些此类实施方式中,接触和/或孵育后细胞所受细胞毒性与相同条件下与聚阳离子转导佐剂孵育的细胞所受细胞毒性相比低或低约1.2倍、1.5倍、2.0倍、3.0倍、4.0倍、5.0倍或10倍;接触和/或孵育后细胞的活力与相同条件下与聚阳离子转导佐剂孵育的细胞相比高1.2倍、1.5倍、2.0倍、3.0倍、4.0倍、5.0倍或10倍。某些情形中,聚阳离子转导佐剂是硫酸鱼精蛋白、纤连蛋白衍生的转导佐剂或RetroNectin。
某些此类实施方式中,反应剂是或含:可逆结合生物素、生物素类似物或其生物活性片段的链霉亲和素、亲和素、链霉亲和素类似物或突变蛋白;可逆结合链霉亲和素结合肽的亲和素或链霉亲和素类似物或突变蛋白;包含至少两个螯合基团K的反应剂,其中所述至少两个螯合基团能够结合过渡金属离子;能够结合寡聚组氨酸亲和标签的物质;能够结合谷胱甘肽-S转移酶的物质;钙调蛋白或其类似物;能够结合钙调蛋白结合肽(CBP)的物质;能够结合FLAG肽的物质;能够结合HA标签的物质;能够结合麦芽糖结合蛋白(MBP)的物质;能够结合HSV表位的物质;能够结合myc表位的物质;或能够结合生物素化载体蛋白的物质。
在某些此类实施方式中,反应剂是:可逆结合生物素或其生物活性片段的链霉亲和素类似物或突变蛋白、亲和素、链霉亲和素的寡聚体或多聚体;可逆结合链霉亲和素结合肽的链霉亲和素或亲和素类似物或突变蛋白;包含至少两个螯合基团K的作用剂,其中所述至少两个螯合基团能够结合过渡金属离子;能够结合寡聚组氨酸亲和标签的物质;能够结合谷胱甘肽-S-转移酶的物质;钙调蛋白或其类似物;能够结合钙调蛋白结合肽(CBP)的物质;能够结合FLAG肽的物质;能够结合HA标签的物质;能够结合麦芽糖结合蛋白(MBP)的物质;能够结合HSV表位的物质;能够结合myc表位的物质;或能够结合生物素化载体蛋白的物质。
某些此类实施方式中,反应剂包括:链霉亲和素类似物或突变蛋白、或和亲和素类似物或突变蛋白、亲和素、链霉亲和素的寡聚体或多聚体。某些方面,寡聚体或多聚体中的个体分子通过多糖或双官能性接头交联。某些此类实施方式中,反应剂是或含可逆结合生物素或其生物活性片段的链霉亲和素类似物或突变蛋白或亲和素类似物或突变蛋白;反应剂是或含可逆结合生物素类似物或其生物活性片段的链霉亲和素类似物或突变蛋白或亲和素类似物或突变蛋白;和/或,反应剂是或含可逆结合链霉亲和素结合肽的链霉亲和素类似物或突变蛋白或亲和素类似物或突变蛋白。
某些方面,链霉亲和素结合肽选自:Trp-Ser-His-Pro-Gln-Phe-Glu-Lys(SEQ IDNO:8)、Trp-Ser-His-Pro-Gln-Phe-Glu-Lys-(GlyGlyGlySer)
某些此类实施方式中,反应剂具有SEQ ID NO:1或SEQ ID NO:2或与SEQ ID NO:1或SEQ ID NO:2至少85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%相同的氨基酸序列。某些此类实施方式中,反应剂含有链霉亲和素类似物或突变蛋白,所述类似物或突变蛋白含有氨基酸序列Va1
在一些实施方式中,所述链霉亲和素类似物或突变蛋白含有:a)SEQ ID NOS:3-6、27和28任一中所示氨基酸序列;b)如下氨基酸序列:与SEQ ID NOS:3-6、27和28之任一具有至少85%、86%、87%、88%、89%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更高序列相同性并且含有对应于Va1
在一些实施方式中,链霉亲和素类似物或突变蛋白还含有一处或多处氨基酸置换(replacement),位置对应于SEQ ID NO:1所示氨基酸序列内链霉亲和素内第117、120和121位。某些实施例中,一处或多处氨基酸置换选自Glu117、Asp117、Arg117、Ser120、Ala120、Gly120、Trp121、Tyr121或Phe121;或者,一处或多处氨基酸置换选自以下所述之一或多项:Glu117、Gly120或Tyr121;或者多处氨基酸置换选自Glu117、Gly120或Tyr121。
某些此类实施方式中,所述链霉亲和素类似物或突变蛋白含有:a)SEQ ID NOS:27或28任一中所示氨基酸序列;b)如下氨基酸序列:与SEQ ID NOS:28具有至少85%、86%、87%、88%、89%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更高序列相同性并且含有对应于Va1
某些此类实施方式中,结合剂含有结合伴侣C,它是链霉亲和素结合肽。某些实施例中,结合伴侣C含有选自以下所述的链霉亲和素结合肽:Trp-Ser-His-Pro-Gln-Phe-Glu-Lys(SEQ ID NO:8)、Trp-Ser-His-Pro-Gln-Phe-Glu-Lys-(GlyGlyGlySer)
某些此类实施方式中,所述方法包括破坏所述一个或多个结合剂与所述反应剂之间的可逆结合。某些情形中,所述破坏包括向细胞中引入能够逆转所述一个或多个结合剂与所述反应剂之间可逆结合的物质。某些方面,所述物质是游离结合伴侣和/或是竞争剂。某些情形中,所述物质在组合物中对T细胞或对靶细胞无害,且/或与在可比或相同条件下不含该物质分别孵育T细胞或靶细胞相比,加入该物质不会令存活靶细胞百分比降至低于90%、80%、70%、60%或50%。
某些此类实施方式中,反应剂是或含链霉亲和素、亲和素、链霉亲和素类似物或突变蛋白或或/和亲和素类似物或突变蛋白或其生物活性片段;包含链霉亲和素-结合肽、生物素或其生物活性片段(例如D-生物素)或生物素类似物或其生物活性片段的物质。某些实施例中,所述物质是链霉亲和素结合肽,选自:Trp-Ser-His-Pro-Gln-Phe-Glu-Lys(SEQ IDNO:8)、Trp-Ser-His-Pro-Gln-Phe-Glu-Lys-(GlyGlyGlySer)
某些此类实施方式中,所述方法包括所述破坏后收获细胞。某些此类实施方式中,所述方法还包括再孵育细胞。某些情形中,以上进一步孵育在细胞扩增条件下进行。某些方面,孵育和再孵育在同一容器中进行;和/或,再孵育在所述物质的存在下进行;和/或,所述方法在再孵育之前,不包括从孵育组合物中去除所述物质、选择剂、刺激剂、病毒颗粒结合剂和/或反应剂。某些实施方式中,再孵育之前反应剂不从组合物中去除,进一步孵育期间反应剂不从组合物中去除,或者,进一步孵育至少半程期间反应剂不从组合物中去除。
某些实施方式中,再孵育在37℃±2℃下进行或在约37℃±2℃下进行;和/或,所述孵育和/或再孵育的至少部分期间,再孵育在能够将信号递送到T细胞的其他作用剂的存在下进行。某些情形中,所述其他反应剂能够增强或诱导T细胞、CD4+T细胞和/或CD8+T细胞的增殖。在一些实施方式中,所述其他反应剂是选自IL-2、IL-15和IL-7的细胞因子。在一些实施方式中,再孵育的进行时间不超过14天、不超过12天、不超过10天、不超过8天或不超过6天。
某些此类实施方式中,支持物含有树脂或基质;支持物含有凝聚过滤基质;支持物含有色谱基质;且/或,支持物含有基于纤维素或基于有机聚合物的膜。某些此类实施方式中,支持物包含微粒、刚性颗粒、磁性颗粒或珠。某些情形中,色谱基质位于柱中,且/或所述色谱是柱色谱或平面色谱。某些实施方式中,支持物是固定相,孵育和/或接触全程或部分期间包含于容器中。
某些此类实施方式中,所述容器选自:柱、适合双向流动的容器、移液管、管、适合样品流动通过的柱。
某些此类实施方式中,输出组合物中的一个或多个转导细胞表达由病毒颗粒所含异源核酸编码的重组蛋白。某些此类实施方式中,与没有反应剂存在下的病毒颗粒转导相比,细胞转导率提高超过或超过约或约1.2倍、1.5倍、2倍、3倍、4倍、5倍、10倍或更多。
某些此类实施方式中,所述方法实现表达选择剂所结合分子的靶细胞的选择性转导。某些情形中,与不表达所述分子的非靶细胞相比,表达所述分子的细胞中转导率高至少2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍或更高。
某些此类实施方式中,所述多个细胞中至少2.5%、至少5%、至少6%、至少8%、至少10%、至少20%、至少25%、至少30%、至少40%、至少50%或至少75%的细胞经所述方法被所述病毒载体转导;和/或至少2.5%、至少5%、至少6%、至少8%、至少10%、至少20%、至少25%、至少30%、至少40%、至少50%或至少75%所述进一步孵育组合物中的细胞被所述病毒载体转导;和/或至少2.5%、至少5%、至少6%、至少8%、至少10%、至少20%、至少25%、至少30%、至少40%、至少50%或至少75%所述孵育组合物和/或所述再孵育组合物中的细胞表达病毒载体所含异源核酸的产物。
某些此类实施方式中,所述方法离体进行。某些此类实施方式中,所述方法还包括收获或分离所述方法所得被转导的细胞。
本文还提供,以上所述方法之任一产生的转导细胞。某些情形中,还提供含有转导细胞的组合物。
本文还提供如下组合物,其含有可逆结合于反应剂的病毒载体颗粒结合剂的组合物,所述病毒颗粒结合剂能够特异性结合病毒颗粒表面分子;或可逆结合于反应剂的病毒载体颗粒。某些方面,反应剂含有多个结合位点,各自能够可逆结合病毒颗粒结合剂。某些情形中,组合物还含有选择剂,其能够可逆结合剂并能够特异性结合靶细胞表面分子。某些实施例中,反应剂是或含链霉亲和素、亲和素、链霉亲和素类似物或突变蛋白或亲和素类似物或突变蛋白,前述任一的突变蛋白或生物活性片段,和/或前述之任选的多个亚基。
某些实施方式中,病毒结合剂结合病毒颗粒表面分子,所述分子是相对于所述病毒分子的异源非病毒重组分子;或结合病毒颗粒表面分子,所述分子选自包膜糖蛋白、包膜糖蛋白变体、嵌合包膜糖蛋白、病毒衣壳蛋白,病毒衣壳蛋白变体、病毒基质蛋白、病毒基质蛋白变体、合成部分(synthetic moiety)、肽或标签。
某些情形中,包膜糖蛋白选自:VSV糖蛋白(VSV-G)、辛德毕斯糖蛋白(如SIN)、MMLV糖蛋白、HSV糖蛋白、MMTV糖蛋白、麻疹病毒糖蛋白、HTLV糖蛋白、SIV糖蛋白、GALV糖蛋白、HIV糖蛋白(如gp160、gp120或gp41)和RSV糖蛋白(如gp85或gp37),或是它们足以令病毒颗粒结合剂与之结合的组成部分、变体,或嵌合分子;或者,所述分子是合成部分、肽或标签,选自谷胱甘肽-S-转移酶(GST)、甲壳素结合蛋白(CBP)、钙调蛋白结合肽(CBP)、FLAG-肽、血细胞凝集素肽、VSV-G-标签、HSV-标签、T7表位、麦芽糖结合蛋白(MBP)、HSV表位、myc表位、V5-标签和链霉亲和素结合肽。
某些实施例中,非病毒重组分子是或含配体结合域。某些期限中,所述分子是或含抗原受体。某些方面,所述抗原受体是嵌合抗原受体(CAR)。某些情形中,病毒结合剂是抗体或抗原结合片段,它们特异性结合CAR胞外区。某些实施方式中,所述胞外区是抗原结合域或铰链区。
本文还提供一种制品,包含本文所述组合物和支持物,其中,反应剂固定在支持物上。某些情形中,支持物是或含固定相和/或固体支持物。某些实施例中,支持物是固定相,所述固定相是或含色谱基质,所述制品还包括容纳了全部或部分色谱基质的容器。某些情形中,容器是柱。
本文还提供一种设备,其含有容纳有一种或多种组分的一个或多个容器,所述组分选自一个或多个蛋白质反应剂、含靶细胞和病毒颗粒的多个细胞和支持物,所述支持物含有至少一个固定相,所述固定相是或含色谱基质。某些情形中,至少一个寡聚蛋白反应剂可逆结合于病毒颗粒结合剂、选择剂和/或受体结合剂。某些方面,一个或多个容器液体连通,一种或多种组分由此可以在设备内在容器间流通。
某些此类实施方式中,本文所述制品或设备还具有样品出口,液体连通所述至少一个色谱固定相之一。某些实施方式中,制品或设备是功能性密闭或无菌的系统。
某些此类实施方式中,制品或设备还具有一项或多项控制机制,能够调节或调整一个或多个容器或部分或组分或至少所述至少一个色谱固定相之一的pH、pO
本文还提供含有链霉亲和素结合肽的病毒载体颗粒。某些情形中,链霉亲和素结合肽是含包膜糖蛋白的融合蛋白。某些实施例中,包膜糖蛋白是VSV-G。
某些此类实施方式中,病毒载体是逆转录载体,例如慢病毒。某些方面,链霉亲和素结合肽选自:Trp-Ser-His-Pro-Gln-Phe-Glu-Lys(SEQ ID NO:8)、Trp-Ser-His-Pro-Gln-Phe-Glu-Lys-(GlyGlyGlySer)
本文某些实施方式中提供一种试剂盒(反应剂盒),具有本文所述病毒载体颗粒、具有一个或多个能够可逆结合病毒载体颗粒的结合位点的反应剂;可选地,还有使用说明书。某些情形中,试剂盒还含有选择剂,能够结合靶细胞表面的选择标志物,其中的反应剂具有一个或多个能够可逆结合选择剂的结合位点。
本文还提供含有与病毒颗粒关联的寡聚蛋白反应剂的组合物。某些实施例中,寡聚反应剂包含多个多肽单体单元,各自的长度至少是或约10、20、30或40个氨基酸,且/或分子量至少是或约20、30、40或50kDA;且/或寡聚反应剂的分子量至少是或约100,且/或约150kDa至2000kDa之间,且/或约150kDa至1500kDa之间,且/或约150kDa至1250kDa之间,且/或约150kDa至1000kDa之间,且/或约150kDa至500kDa之间,且/或约150kDa至300kDa之间,约300kDa至2000kDa之间,约300kDa至1500kDa之间,约300kDa至1250kDa之间,约300kDa至1000kDa之间,约300kDa至500kDa之间,约500kDa至2000kDa之间,约500kDa至1500kDa之间,约500kDa至1250kDa之间,约500kDa至1000kDa之间,约1000kDa至2000kDa之间,约1000kDa至1500kDa之间,约1000kDa至1250kDa之间,约1250kDa至2000kDa或约1500kDa至2000kDa之间。
某些实施方式中,寡聚蛋白反应剂含有寡聚物,所述寡聚物含多个多聚体亚基。某些实施例中,多聚体亚基是四聚体,多单元且各含单体单元。某些方面,寡聚蛋白反应剂包含或可选性地包含以下物质的多个单元:链霉亲和素、亲和素、链霉亲和素类似物或突变蛋白或亲和素类似物或突变蛋白,前述任一的突变蛋白或生物活性片段,和/或前述之任选的多聚体。
某些实施方式中,病毒颗粒含有编码异源核酸的核苷酸序列。
某些此类实施方式中,反应剂是裸露的;反应剂不含和/或不偶联、不可逆结合于结合剂;反应剂不含和/或不偶联、不可逆结合于具有细胞表面标志碳源结合域的分子,所述分子可以是选自:粘附分子、整联蛋白、趋化因子、细胞因子、生长因子、胞外基质结合分子、病毒蛋白、促进病毒进入的细胞表面受体、肝素(heparin)、乙酰肝素(heparan)、聚糖、T细胞表面标志、CD3、CD28、CD4和/或CD8;反应剂不含和/或不偶联、不可逆结合于哺乳动物细胞表面标志、胞外基质组分、粘附分子、整联蛋白、凝集素、整联蛋白结合蛋白、趋化因子、细胞因子、生长因子、胞外基质结合分子、ECM组分、病毒蛋白、促进病毒进入的细胞表面受体、肝素(heparin)、乙酰肝素(heparan)、聚糖;和/或反应剂不含肝素集合结构域且/或不含整联蛋白结合域且/或不含VLA4-结合域且/或不含VLA5-结合域;且/或反应剂不含和/或不偶联、不可逆结合于病毒结合剂或细胞选择剂。
某些实施方式中,反应剂还含有或可逆结合于多个一种或多种结合剂。某些实施例中,结合剂是特异性结合病毒颗粒表面分子的病毒颗粒结合剂,特异性结合靶细胞表面分子的选择剂,或是特异性结合受体从而向靶细胞内传递刺激信号的受体结合剂。
某些此类实施方式中,结合剂是或含抗体、抗体片段、单价抗体片段、具有抗体样结合性质的蛋白结合分子、含有Ig结构域的分子、细胞因子、趋化因子、适体、MHC分子,或它们的结合片段。某些情形中,抗体片段含有选自以下所述的片段:Fab片段、Fv片段、(Fab’)
某些此类实施方式中,反应剂具有SEQ ID NO:1或SEQ ID NO:2或与SEQ ID NO:1或SEQ ID NO:2至少85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%相同的氨基酸序列。某些此类实施方式中,反应剂含有链霉亲和素类似物或突变蛋白,所述类似物或突变蛋白具有氨基酸序列Va1
某些此类实施方式中,反应剂含有链霉亲和素类似物或突变蛋白,其含有:a)SEQID NOS:3-6、27和28任一中所示氨基酸序列;b)如下氨基酸序列:与SEQ ID NOS:3-6、27和28之任一具有至少85%、86%、87%、88%、89%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更高序列相同性并且含有对应于Va1
某些实施方式中,链霉亲和素类似物或突变蛋白具有一处或多处氨基酸置换,位置对应于SEQ ID NO:1所示氨基酸序列中链霉亲和素内第117、120和/或121位。某些实施例中,一处或多处氨基酸置换选自Glu117、Asp117、Arg117、Ser120、Ala120、Gly120、Trp121、Tyr121或Phe121;或者,一处或多处氨基酸置换选自以下所述之一或多项:Glu117、Gly120或Tyr121;或者多处氨基酸置换选自Glu117、Gly120或Tyr121。
某些此类实施方式中,反应剂含有链霉亲和素类似物或突变蛋白,其含有:a)SEQID NOS:27或28任一中所示氨基酸序列;b)如下氨基酸序列:与SEQ ID NOS:28具有至少85%、86%、87%、88%、89%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更高序列相同性并且含有对应于Va1
某些此类实施方式中,病毒载体的基因组含有编码重组蛋白的异源核酸分子。某些情形中,所述重组蛋白是抗原受体。某些实施方式中,病毒颗粒是逆转录病毒。某些情形中,逆转录病毒是慢病毒。某些情形中,逆转录病毒是γ逆转录病毒。某些实施方式中,病毒颗粒呈逆转录缺陷。
某些此类实施方式中,反应剂是可溶性的。
本文某些实施方式中提供转导细胞的方法。本文提供一种转导细胞的方法,包括将含一个或多个靶细胞的多个细胞(例如输入组合物中包含这多个细胞)与(1)寡聚反应剂和(2)病毒颗粒一同孵育(例如接触),可选地,所述方法产生含有一个或多个转导细胞的输出组合物。
并未提供转导细胞的方法,所述方法包括:(a)病毒颗粒与寡聚反应剂接触,由此产生包含与反应剂关联的病毒颗粒的混合物;和(b)该混合物与含有多细胞的输入组合物接触,可选地,所述方法产生含有一个或多个转导细胞的输出组合物。在一些实施方式中,作用剂是或含寡聚体。在一些实施方式中,接触包括将细胞与反应剂和与病毒颗粒同时或依次(任意顺序)混合。在一些实施方式中,在至少一部分接触期间,反应剂和病毒颗粒同时与细胞共在或同时与细胞接触。
某些实施方式中,寡聚反应剂是寡聚蛋白反应剂;且/或所述寡聚蛋白反应剂含多个多肽单体单元,各单元各自可选性地具有至少或至少约10、20、30或40氨基酸的长度,或者至少或至少约50、60、65、70、80、90、100、125或150氨基酸的长度,且/或分子量至少是或约20、30、40或50kDa,可选性地,反应剂包含寡聚物,所述寡聚物包含多个多聚体亚基,所述多聚体亚基可以是四聚体、多单元且各自含有单体单元;且/或寡聚反应剂的分子量至少是或约100,且/或约150kDa至2000kDa之间,且/或约150kDa至1500kDa之间,且/或约150kDa至1250kDa之间,且/或约150kDa至1000kDa之间,且/或约150kDa至500kDa之间,且/或约150kDa至300kDa之间,约300kDa至2000kDa之间,约300kDa至1500kDa之间,约300kDa至1250kDa之间,约300kDa至1000kDa之间,约300kDa至500kDa之间,约500kDa至2000kDa之间,约500kDa至1500kDa之间,约500kDa至1250kDa之间,约500kDa至1000kDa之间,约1000kDa至2000kDa之间,约1000kDa至1500kDa之间,约1000kDa至1250kDa之间,约1250kDa至2000kDa或约1500kDa至2000kDa之间。
某些实施方式中,反应剂例如寡聚蛋白反应剂包含或可选性地包含以下物质的多个单元:链霉亲和素、亲和素、链霉亲和素类似物或突变蛋白或亲和素类似物或突变蛋白,前述任一的生物活性片段,和/或前述之任选的多聚体。
在一些实施方式中,接触包括将细胞与反应剂和病毒颗粒同时或依次(任意顺序)混合。在一些实施方式中,在至少一部分孵育期间,反应剂和病毒颗粒同时与细胞共在或同时与细胞接触。
某些实施方式中,输出组合物中的一个或多个转导细胞表达由病毒颗粒所含异源核酸编码的重组蛋白。某些实施方式中,病毒颗粒是逆转录病毒,例如慢病毒或γ逆转录病毒。
某些实施方式中,本文方法相比无反应剂转导或佐剂(例如纤连蛋白片段(Retronectin)或硫酸鱼精蛋白)转导提高了转导效率。某些实施方式中,转导效率提高超过或超过约1.2倍、2倍、3倍、4倍、5倍、10倍或多个。
某些实施方式中,反应剂可逆结合于结合剂。某些实施方式中,细胞上的结合剂可促进以下一项或多项:细胞或细胞亚群的选择、分离、活化、刺激和/或扩增。某些实施方式中,所述结合是本文所述任一结合剂。
本文还提供含反应剂例如寡聚反应剂如本文所述病毒颗粒的组合物。某些实施方式中,病毒颗粒是逆转录病毒,例如慢病毒或γ逆转录病毒。
本文还提供含反应剂例如寡聚反应剂如本文所述病毒颗粒的试剂盒。某些实施方式中,病毒颗粒是逆转录病毒,例如慢病毒或γ逆转录病毒。
附图说明
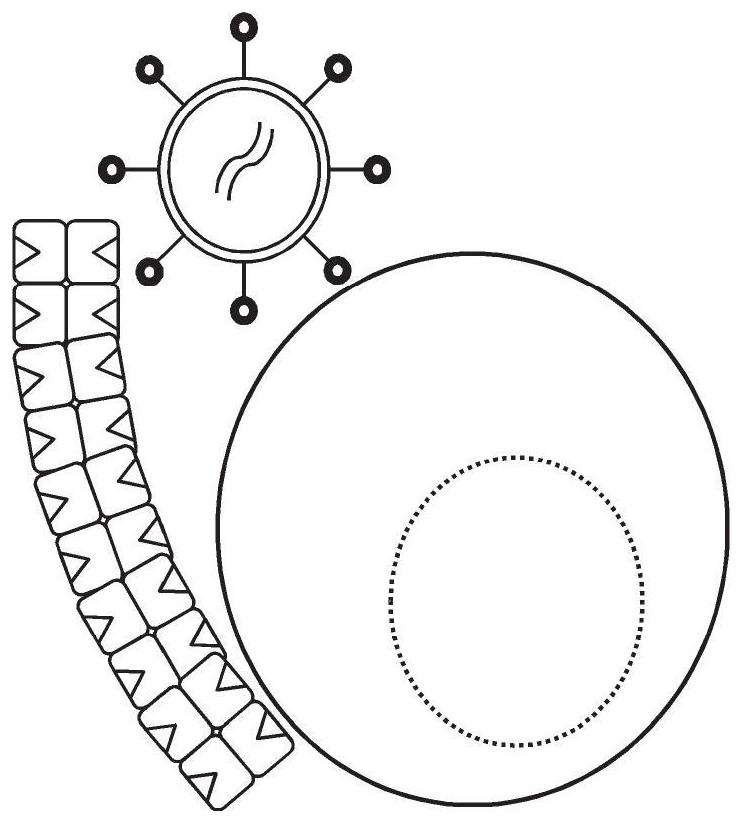
图1呈现本文所述方法的图示,所述方法包括含靶细胞的多细胞与寡聚蛋白(如链霉亲和素突变蛋白寡聚物)反应剂和病毒颗粒一同孵育或接触。
图2显示本文所述方法的示例性实施方式,均为采用可逆系统的病毒转导方法。
图2A:反应剂可逆结合于第一和第一作用剂。第一作用剂能够特异性结合病毒颗粒上的分子。第二作用剂能够特异性结合细胞上的分子。反应剂具有多个结合位点Z1和Z2,它们相同或不同,它们各自能够可逆结合作用剂。第一作用剂含有至少一个结合伴侣C1,它能够结合剂的至少一个结合位点Z1,第二作用剂含有至少一个结合伴侣C2,它能够结合剂的至少一个结合位点Z2。某些情形中,C1和C2不同。某些情形中,C1和C2相同或基本上相同。第一作用剂含有至少一个结合位点V1,它能够特异性结合病毒颗粒表面分子。第二作用剂含有至少一个结合位点B2,它能够特异性结合细胞表面分子。在一些实施方式中,第一试剂和/或第二试剂可为选择剂。在此,第一作用剂结合于病毒颗粒表面分子,第二作用剂结合细胞表面分子。
图2B:反应剂可逆结合于病毒颗粒和作用剂。作用剂能够特异性结合细胞上的分子。反应剂具有多个结合位点Z1和Z2,它们相同或不同,它们各自能够可逆结合。病毒颗粒含有至少一个结合伴侣C1,它能够特异性结合剂的至少一个结合位点Z1。作用剂含有至少一个结合伴侣C2,它能够特异性结合剂的至少一个结合位点Z2。某些情形中,C1和C2不同。某些情形中,C1和C2相同或基本上相同。作用剂含有至少一个结合位点B2,它能够特异性结合细胞表面分子。某些实施方式中,作用剂可以是选择剂。图2B显示一病毒颗粒,其病毒颗粒表面的病毒包膜蛋白内含有结合伴侣,图中还显示与细胞表面分子结合的作用剂。
图2C显示结合于支持物例如固体支持物和/或固定相,且可逆结合第一和第二作用剂的反应剂。第一作用剂能够特异性结合病毒颗粒上的分子。第二作用剂能够特异性结合细胞上的分子。反应剂具有多个结合位点Z1和Z2,其可相同或不同,它们各自能够可逆结合于作用剂。第一作用剂含有至少一个结合伴侣C1,它能够结合剂的至少一个结合位点Z1,第二作用剂含有至少一个结合伴侣C2,它能够结合剂的至少一个结合位点Z2。某些情形中,C1和C2不同。某些情形中,C1和C2相同或基本上相同。第一作用剂含有至少一个结合位点V1,它能够特异性结合病毒颗粒表面分子。第二作用剂含有至少一个结合位点B2,它能够特异性结合细胞表面分子。在一些实施方式中,第一试剂和/或第二作用剂可为选择剂。在此,第一作用剂结合于病毒颗粒表面分子,第二作用剂结合于细胞表面分子。
图2D显示结合于支持物例如固体支持物和/或固定相,且可逆结合病毒颗粒和作用剂的反应剂。作用剂能够特异性结合细胞上的分子。反应剂具有多个结合位点Z1和Z2,它们相同或不同,它们各自能够可逆结合。病毒颗粒含有至少一个结合伴侣C1,它能够特异性结合剂的至少一个结合位点Z1。作用剂含有至少一个结合伴侣C2,它能够特异性结合剂的至少一个结合位点Z2。某些情形中,C1和C2不同。某些情形中,C1和C2相同或基本上相同。作用剂含有至少一个结合位点B2,它能够特异性结合细胞表面分子。在一些实施方式中,作用剂可以是选择剂。图2D中,病毒颗粒在其表面包膜蛋白内含有结合伴侣,作用剂结合于细胞表面分子。
图3提供了示例性实施方式的示意图。
图3A显示含有用于可逆结合于反应剂的多个结合位点的反应剂(或其代表性部分)。此图中,反应剂表现为能够可逆结合两个作用剂,这两个作用剂各自能够特异性结合细胞上的分子。该反应剂具有多个结合位点(包括多个结合位点Z1),它们各自能够可逆结合于作用剂。第一和第二作用剂,在有些情况下可相同,在示意图中显示为各自包含至少一个结合伴侣C1。结合伴侣C1可逆结合结合位点Z1。第一和第二作用剂各自还含有结合位点B2,B2能特异性结合细胞表面上的分子,在有些情况下,所述分子可在同一细胞上。在此,第一和第二作用剂示为特异性结合于同一细胞上的分子。
图3B显示含有能够可逆结合于第一和第二作用剂的多个结合位点的反应剂的示意图,其中第一和第二作用剂各自能够分别特异性结合第一和第二细胞上的分子。反应剂具有多个结合位点Z1,其各自能够可逆结合剂。第一和第二作用剂(在有些情况下可相同)各自包含结合伴侣C1,其可逆结合结合位点Z1。第一和第二作用剂各自含有结合位点B2,B2能特异性结合细胞表面上的分子,在有些情况下,所述分子可在同一细胞上或在不同细胞上。在此,第一作用剂结合第一细胞表面上的分子,第二作用剂结合第二细胞表面上的分子。
图3C显示能够可逆结合第一和第二作用剂的反应剂,所述作用剂各自能够分别特异性结合第一和第二细胞上的分子。反应剂含有多个结合位点Z1和Z2,其可相同或不同,它们各自能够可逆结合所述作用剂中的一种或两种。第一作用剂包含可逆结合Z1的结合伴侣C1;第二作用剂包含能可逆结合Z2的结合伴侣C2。某些情形中,C1和C2不同。某些情形中,C1和C2相同或基本上相同。第一作用剂包含结合位点B1,B1能特异性结合细胞表面上的分子,第二作用剂包含至少一个结合位点B3,B3能特异性结合细胞表面上的分子。某些情形中,结合位点B1和B3结合两种不同细胞表面分子、或同一分子上的不同表位、或不同细胞表面上的相同或不同分子。在此,第一作用剂显示为通过B1结合第一细胞表面上的分子,第二作用剂通过B3结合第二细胞表面上的分子。
图3D显示能够可逆结合第一和第二作用剂(例如选择剂)的反应剂,所述作用剂各自能够特异性结合细胞上的分子。反应剂具有多个结合位点(包括Z1和Z2),其可相同或不同,它们各自能够可逆结合于作用剂。第一作用剂包含能特异性结合于结合位点Z1的结合伴侣C1,第二作用剂包含能特异性结合于结合位点Z2的结合伴侣C2。某些情形中,C1和C2不同。某些情形中,C1和C2相同或基本上相同。第一作用剂包含能特异性结合细胞表面上分子的结合位点B1,第二作用剂包含能特异性结合细胞表面上分子的结合位点B3。在一些实施方式中,第一作用剂和第二作用剂可为选择剂。结合位点B1和B3能结合细胞表面上的相同或不同分子(例如受体)、同一分子上的相同或不同表位、或不同细胞表面上的相同或不同分子在此,第一作用剂结合细胞表面上的第一分子,第二作用剂结合同一细胞表面上的第二分子。
图3E显示可逆结合第一和第二作用剂的反应剂,所述作用剂各自能够特异性结合细胞上的分子。反应剂具有多个结合位点(包括Z1和Z2),其可相同或不同,它们各自能够可逆结合于作用剂。第一作用剂包含能够可逆结合所述反应剂的Z1的结合伴侣C1,第二作用剂包含能够可逆结合Z2的结合伴侣C2。某些情形中,C1和C2不同。某些情形中,C1和C2相同或基本上相同。第一作用剂包含能特异性结合细胞表面上分子的至少一个结合位点B2,第二作用剂包含能特异性结合细胞表面上分子的至少一个结合位点B4。在一些实施方式中,第一作用剂和第二作用剂可为刺激剂。结合位点B2和B4能结合细胞表面上的相同或不同分子、分子上的相同或不同表位、或不同细胞表面上的相同或不同分子。在此,第一作用剂结合细胞表面上的第一分子,第二作用剂结合同一细胞表面上的第二分子。
图4(A-E)包括图4A~图4E,分别提供了图3A-3E中所示示例性实施方式的示意图,区别在于反应剂显示为固定在支持物(例如固相)上。
图5提供了示例性实施方式的示意图,其中将寡聚反应剂用于使刺激剂多聚化,将所得复合物与细胞一同孵育以将信号递送给细胞,然后逆转结合。分图A显示寡聚反应剂1,其示为未结合于任何支持物且为柔性。此处显示为Fab片段且能够特异性结合细胞表面上分子的刺激剂2结合剂。该作用剂包含能够可逆结合于反应剂上结合位点(例如结合位点Z)的结合伴侣(例如结合伴侣C),使得作用剂多聚化。分图B描绘了结合伴侣可逆结合剂上的结合位点。将细胞3加入系统中。分图C描绘了多聚化的作用剂(Fab片段)特异性结合细胞3上的分子4。在分图C中,所绘作用剂是刺激性受体结合剂(例如第一受体结合剂和/或第二受体结合剂),当作用剂结合细胞上的分子时,它们能诱导或调节细胞中的信号。如分图D所示,将物质5(例如竞争性反应剂,如生物素)加入组合物,其可为对反应剂上的结合位点比所述作用剂上的结合伴侣具有更高结合亲和力的物质,由此破坏反应剂1和作用剂2之间的可逆结合。某些情形中,所述作用剂(例如Fab片段)还能从其与细胞3上分子4的相互作用中解离。某些情形中,这能破坏、减弱和/或终止细胞中的信号转导。
图6提供了可逆系统连接于支持物(例如固体支持物或表面,包括固相)的示例性实施方式的示意图。分图A显示了包含反应剂1的支持物6。将能够特异性结合细胞表面上分子的作用剂2(例如Fab片段)加入该系统。作用剂2(例如Fab片段)包含能够可逆结合于反应剂上结合位点(例如结合位点Z)的结合伴侣(例如结合伴侣C)。分图B描绘了结合伴侣可逆结合剂上的结合位点。将细胞3加入系统中。分图C描绘了作用剂2(例如,Fab片段)结合细胞3表面上的分子4。在一些实施方式中,scFv包括受体结合剂或选择剂。在一些实施方式中,所述作用剂(例如Fab片段)可为受体结合剂或选择剂。在分图C描绘了示例性一种或多种受体结合剂(例如第一受体结合剂和/或第二受体结合剂),当作用剂(例如Fab片段)结合细胞上的分子时,它们能诱导或调节细胞中的信号。加入物质5(例如竞争性反应剂,如生物素),其可为对反应剂上的结合位点比对所述作用剂(例如Fab片段)上的结合伴侣具有更高结合亲和力的物质,由此破坏反应剂和作用剂之间的可逆结合。分图D描绘了作用剂2(例如Fab片段)和反应剂之间结合的破坏,由此使得反应剂与所述作用剂解离,从而从细胞解离。某些情形中,所述作用剂(例如Fab片段)还能从其与细胞3上分子4的相互作用中解离。某些情形中,这能破坏、减弱和/或终止细胞中的信号转导。
图7A-7C显示如下试验的结果:在该试验中,CD3+T应答细胞在体外用可逆αCD3/αCD28 Fab片段刺激后增殖,所述片段可逆固定于包被有链霉亲和素突变蛋白
图8A-8E显示如下试验的结果:在该试验中,CD3+T应答细胞在体外用可逆αCD3/αCD28 Fab片段刺激后增殖,所述片段可逆固定于用作可溶性反应剂的可溶性寡聚链霉亲和素突变蛋白。实验结果如图8A-8E所示,300,000个CD3+应答T细胞(T
图9A和9B显示经纯化的CD4+和CD8+T应答细胞(T
图10A和10B显示经纯化的CD4+和CD8+T应答细胞(T
图11A和11B显示获自图9A-B和图10A-B中关于纯化的CD4+和CD8+T应答细胞增殖的扩增动力学结果的组合数据,图11A描绘了CD4+T细胞的结合,图11B描绘了CD8+T细胞的结果。直线用于表示在第3天更换培养基的培养,虚线表示在第3天不更换培养基获得的扩增程度值。图11A和11B中所示数据基于投入细胞数标准化。仅显示了用寡聚链霉亲和素突变蛋白(n≥3)刺激的T
图12A和12C显示在体外用αCD3/αCD28 Fab片段多克隆刺激的CD3+中心记忆T细胞(T
图13A和13B显示在体外用αCD3/αCD28 Fab片段刺激的经纯化CD8+T应答细胞的扩增表型和产率,所述片段可逆固定于作为可溶性反应剂作用的两类可溶性寡聚链霉亲和素突变蛋白。第一类寡聚链霉亲和素突变蛋白是寡聚链霉亲和素突变蛋白部分在实施例3中获得(常规骨架);用作可溶性反应剂的第二类该寡聚链霉亲和素突变蛋白为如前所述的可溶性寡聚物,在本文中称为“大”骨架。在这些试验中,寡聚常规链霉亲和素突变蛋白部分(n≥3)也用作以单个Fab片段(图13A和13B中的第三柱)官能化或以αCD3 Fab和αCD28 Fab组合官能化的反应剂。继αCD3/αCD28Fab片段组合刺激,将另一αCD8 Fab片段(购自IBA股份有限公司(德国哥廷根
图14A和14B显示在体外用αCD3/αCD28 Fab片段刺激的经纯化CD8+T应答细胞的扩增表型和产率,所述片段可逆固定于作为可溶性反应剂作用的可溶性寡聚链霉亲和素突变蛋白,该可溶性反应剂以单个Fab片段官能化或以Fab片段的组合官能化(如前所述)。在这些试验中,CD8+T应答细胞用可溶性反应剂(实施例3的可溶性寡聚链霉亲和素突变蛋白(1mg/ml))刺激,该可溶性反应剂以不同量的αCD3Fab和αCD28 Fab片段(可选联同αCD8Fab)官能化。术语“1×”对应于:1.5μg寡聚链霉亲和素突变蛋白,其以单独的0.5μgαCD3Fab片段官能化,以及1.5μg寡聚链霉亲和素突变蛋白,其以单独的0.5μgαCD28 Fab官能化),或者3μl寡聚链霉亲和素突变蛋白制剂,其负载有0.5μgαCD3 Fab片段和0.5μgαCD28Fab,或者4.5μl寡聚链霉亲和素突变蛋白制备物,其负载有0.5μg strep加标的αCD3 Fab、0.5μg strep加标的αCD8 Fab和0.5μg strep加标的αCD28 Fab。相应的,术语“2×”对应于:3.0μg寡聚链霉亲和素突变蛋白,其以单独的1μgαCD3 Fab片段官能化,以及3.0μg寡聚链霉亲和素突变蛋白,其以单独的1μgαCD28 Fab官能化,意味着用了两倍量的固定化αCD3 Fab片段。无处理应答T细胞作为阴性对照,经市售抗CD3/抗CD28微珠(微珠上不可逆固定有αCD3和αCD28的单克隆抗体)刺激纯化CD8+T应答细胞作为阳性对照。图14A的柱状图显示扩增程度,依据的是第5天收获的细胞数,与阴性对照比较并相对于阳性对照标准化。图14B显示细胞培养后CD8和CD45RO表面表达的FACS分析。
图15A和15B显示在体外用αCD3/αCD28 Fab片段刺激的经纯化CD3+T应答细胞的扩增,所述片段可逆固定于作为可溶性反应剂的实施例3的可溶性寡聚链霉亲和素突变蛋白。在一个试验中,除了αCD3/αCD28 Fab片段,还将αCD8 Fab片段(市售获自IBA股份有限公司(德国哥廷根),产品目录号6-8000-203)固定于可溶性寡聚链霉亲和素突变蛋白上,以测试是否可能采用其上还可逆固定有αCD8 Fab片段的反应剂在大量CD3+培养物中优先刺激CD8+T细胞亚群。更具体而言,将500,000个纯化的CD3+应答T细胞(T
图16A和16B显示Jurkat细胞中差示胞内钙移动,所述细胞用αCD3抗体OKT3标记或用以
图17显示细胞用抗CD3 OKT3 Fab多聚体可逆染色的结果。将刚分离的PBMC用单克隆抗体(左侧点图,Fab多聚体的亲本克隆)或同源PE标记Fab多聚物染色,在用D-生物素处理之前(左起第二点图)或处理之后(中部点图)进行分析。然后在后续用新鲜PE标记
图18显示通过可逆结合抗CD28 Fab片段分离的细胞,所述片段用以藻红蛋白荧光标记的
图19A和19B显示在体外用αCD3/αCD28 Fab片段刺激的经纯化CD4+和CD8+T应答细胞活化后的T细胞早期集落形成,所述片段可逆固定于实施例3中所述的可溶性寡聚链霉亲和素突变蛋白(n≥3)。图19A描绘了关于CD4+T细胞的结果,图19B描绘了关于CD8+T细胞的结果。显示了用可溶性多聚化反应剂(寡聚链霉亲和素突变蛋白)刺激的T
图20A-F显示了在体外用两种肽刺激的出自纯化CD3+CD62L+CD45RA-T
图21显示出自纯化的CD3+CD62L+CD45RA-T
图22A和22B显示经转导Jurket细胞胞内信号转导级联活化,所述细胞经修饰以表达αCD19嵌合抗原受体(CAR),并用作为可溶性多聚化反应剂的实施例3的寡聚
图23是转导T(CD3+门控)CAR(x轴)和CD4+(y轴)表面标志表达的点阵图,转导在以下物质存在下进行:(1)抗CD3/抗CD28磁珠和硫酸鱼精蛋白佐剂,(2)抗CD3/抗CD28磁珠和可逆结合抗CD8 Fab的寡聚蛋白反应剂或(3)仅可逆结合了抗CD3/抗CD28 Fab的寡聚蛋白反应剂。
具体实施方式
在此提供的是一种转导细胞的方法,通过靶细胞例如细胞组合物与寡聚蛋白反应剂和病毒载体颗粒接触,所述接例如培养或孵育进行。某些实施方式中,寡聚蛋白反应剂是其上结合有多个或多种结合剂(如病毒结合剂)或选择剂的多聚化反应剂。某些实施方式中,所述方法涉及可逆反应剂系统,其中,多聚化反应剂在靶细胞和病毒颗粒存在下进行孵育,期间,多聚化反应剂与病毒颗粒和/或靶细胞表面上一个或多个分子结合,由此产生包含病毒载体转导多细胞的组合物。本文还提供组合物和制品,例如含有病毒载体和寡聚反应剂的试剂盒,还提供与所述方法联用的器械和系统。某些实施方式中,所述组合物和试剂盒可用于本文所述的方法和用途。
本申请援引的所有公开文献,包括专利文献、科技文献和数据库,均全面引用参考并纳入用于全部目的,视同对每篇出版物进行了独立引用。如果本文中有定义与本文采纳的专利、专利申请、出版物及其他公开文献有冲突或不一致,本文定义优先。例如,本文引用并全面纳入PCT国际申请PCT/EP2015/058339的全部内容。
本文所用章节标题仅用于组织目的,而不应理解为限制所述客体。
I.细胞转导方法概览
在此提供的是一种转导细胞的方法,通过细胞组合物与寡聚蛋白反应剂和病毒载体颗粒接触例如培养或孵育进行。某些实施方式中,细胞同时或分开与寡聚蛋白反应剂和病毒颗粒接触或孵育。某些实施方式中,病毒颗粒和寡聚反应剂混合,该混合物与细胞接触或孵育。某些实施方式中,本文所述方法的细胞转导效率高于采用传统转导佐剂(
某些实施方式中,本文方法是基于以下发现:链霉亲和素的突变蛋白例如链霉亲和素突变蛋白的寡聚形式促进病毒转导。某些方面,结果显示,采用寡聚链霉亲和素突变蛋白的转导效率一致高于采用其他活化剂的方法和采用其他佐剂的转导。某些实施方式中,寡聚蛋白(如链霉亲和素)能够关联病毒颗粒,所述关联例如结合或相互作用。某些实施方式中,寡聚蛋白反应剂(如寡聚链霉亲和素突变蛋白)具有净正电荷。
某些方面,转导效率提高是用裸寡聚蛋白(如链霉亲和素突变蛋白)反应剂实现的,所述寡聚蛋白反应剂没有或不需要偶联或关联其他结合部分或作用剂来结合细胞或病毒上的分子。某些实施方式中,寡聚蛋白(如链霉亲和素突变蛋白)反应剂不含或没有偶联病毒结合剂。某些实施方式中,寡聚蛋白(如链霉亲和素突变蛋白)反应剂不含或没有偶联细胞(如免疫细胞)表面分子特异性结合剂,如选择剂或刺激剂。据信,虽然结合剂未必是提高转导效率所必需的,但在某些方面,寡聚蛋白(如链霉亲和素突变蛋白)反应剂可以包含例如偶联(如可逆偶联)结合剂,例如病毒结合剂,选择剂或刺激剂。某些实施方式中,加入结合于寡聚蛋白反应剂的结合剂例如病毒结合剂或选择剂能够对细胞转导具有增强、调节和/或选择性靶向作用。
某些实施方式中,本文方法采用反应剂,所述反应剂可以其上结合有一种或多种作用剂(例如第一作用剂、第二作用剂等)的多聚化反应剂,所述作用剂能够特异性结合病毒颗粒和/或细胞表面的分子。某些实施方式中,多聚化反应剂上结合有病毒结合剂,后者结合病毒颗粒表面的分子例如病毒包膜上或包膜内的分子。某些实施方式中,反应剂例如多聚化反应剂因此可以结合有一个或多个通过病毒颗粒结合剂结合的病毒颗粒。某些实施方式中,多聚化反应剂就会有选择剂,选择剂结合至少多个细胞中一个或多个细胞表达的细胞表面分子例如选择标志物。某些方面,作用剂,例如第一、第二作用剂等,既可以可逆也可以不可逆地结合于多聚化反应剂。
因此,多聚化反应剂通常提供多于一个结合位点(例如Z1),某些情形中,多个反应剂能可逆结合这些结合位点从而将第一反应剂、第二反应剂和/或其他反应剂以足够的封闭递呈给细胞群。在一些实施方式中,多聚化反应剂包含至少一个结合位点Z(例如Z1)以可逆结合第一作用剂,第一作用剂还包含至少一个结合伴侣C(例如C1),其中结合伴侣C(例如C1)能够可逆结合多聚化反应剂的结合位点Z(例如Z1)。在此方面中,应注意到多聚化试剂可具有多个结合位点(例如Z1),例如链霉亲和素突变蛋白(且为同四聚体)在其天然状态下具有4个该结合位点(例如Z1),且能进一步被寡聚化。某些情形中,反应剂可仅具有一个结合位点(例如Z1)以可逆结合结合伴侣(例如C1)。此类例子为多聚钙调蛋白。钙调蛋白仅具有针对钙调结合肽的一个结合位点。然而,钙调蛋白能被生物素化,进而与链霉亲和素寡聚体(还可参见下文)反应,由此提供在“骨架”上递呈高封闭的多个钙调蛋白分子的多聚化反应剂,从而提供多聚钙调蛋白。
因此,第一作用剂在与多聚化反应剂接触或一同孵育时,能通过结合伴侣C(例如C1)和结合位点Z(例如Z1)之间形成的可逆键与多聚化反应剂可逆结合。此外,第二反应剂可包括结合伴侣C(例如C2),结合伴侣C2对应地可逆结合多聚化反应剂的结合位点Z(例如Z2)。优选实施方式,第二作用剂在与多聚化试剂接触或一同孵育时,通过结合伴侣C(例如C1)和结合位点Z(例如Z2)之间形成的可逆键与多聚化反应剂可逆结合。某些情形中,C1和C2可相同或基本相同、和/或包含相同或基本相同的部分。某些情形中,Z1和Z2可相同或基本相同、和/或包含相同或基本相同的部分。
某些实施方式中,多聚化反应剂与作用剂(例如病毒结合剂、选择剂或其他作用剂)之间结合的解离和破坏可通过竞争剂或竞争性物质存在下的孵育来逆转或破坏。在一些实施方式中,采用结合多聚作用剂上相同结合位点的结合伴侣C1和C2部分具有如下优点:可采用同样的竞争性反应剂(既针对第一结合伴侣C1,也针对第二结合伴侣C2)或其类似物破坏(在一些情况下,终止)结合从而令靶细胞(例如T细胞)群从多聚化试剂上解离,并且,寡聚不同的结合剂,由此终止靶细胞(例如T细胞)群的转导、选择、刺激或激活和/或扩增。
某些方面,结合剂例如病毒结合剂、选择剂或本文其他所述其他作用剂是抗体或抗原结合片段。某些实施方式中,抗体分子与其抗原(包括例如细胞表面受体分子)的结合亲和力一般为10
某些情形中,为生产包含结合伴侣C的结合剂(例如第一作用剂、第二作用剂等,例如病毒结合剂、选择剂或受体结合剂如刺激性剂),可采用用于重组生产相应作用剂(例如抗体片段)的表达载体来提供结合伴侣C(例如C1或C2),从而使得结合伴侣C(例如C1或C2)成为与相应反应剂的融合蛋白的一部分位于N末端或C末端。在一些实施方式中,在反应剂为抗体或抗原结合片段的情况下,结合伴侣C(例如C1或C2)可位于轻链或重链的C末端。同时,克隆重组蛋白(例如抗体分子可变结构域)和重组生产相应蛋白质(例如抗体片段)的方法是本领域技术人员熟知的(参见例如Skerra,A.(1994))。在一些实施方式中,抗体分子制造为具有针对给定目标(例如所述CD3或CD28或其他辅助或刺激性作用分子)的抗体样特性的人工结合分子的,例如可通过熟知的进化法如噬菌体展示(例如在如下文献中综述:Kay,B.K.等(1996)Phage Display of Peptides and Proteins–A Laboratory Manual(“肽和蛋白质的噬菌体展示——实验室指南”),第一版,学术出版社,纽约,NY;Lowman,H.B.(1997)Annu.Rev.Biophys.Biomol.Struct.26,401–424,或Rodi,D.J.,和Makowski,L.(1999)Curr.Opin.Biotechnol.10,87–93)、核糖体展示(在如下文献中综述:Amstutz,P.等,(2001)Curr.Opin.Biotechnol.12,400-405)、或mRNA展示(如下文献中所报导:Wilson,D.S.等,(2001)Proc.Natl.Acad.Sci.USA 98,3750-3755)。
某些实施方式中,反应剂和采用反应剂的方法具有产生以下效果的特征:提高免疫细胞和/或特定免疫细胞群和/或亚群的转导效率,包括用于过继免疫治疗的免疫细胞。某些实施方式中,本文方法能够与现有方法相当或更高的效率转导细胞,先现有方法例如用传统佐剂(如
相反,本文所述寡聚反应剂可长时间地维持细胞培养物且没有毒性,所述反应剂例如含有链霉亲和素突变蛋白的反应剂,包括多聚化反应剂。某些实施方式中,本文所述转导方法在接触病毒颗粒和细胞之前或期间可以不从细胞中去除寡聚反应剂例如多聚化反应剂。某些实施方式中,不必在进一步分行例如为转导细胞扩增而进行的进一步分行的至少部分期间去除寡聚反应剂例如多聚化反应剂。
在一些实施方式中,所述细胞包括通过遗传工程改造导入的一种或多种核酸,并,由此表达所述核酸的重组或经遗传工程改造的产物。在一些实施方式中,核酸是异源性的,即,通常不存在于细胞或从该细胞获得的样品中,如从另一个生物体或细胞获得的样品,其例如通常不在工程改造中的细胞和/或这类细胞来源的生物体中发现。在一些实施方式中,核酸不是天然存在的,如核酸不是自然中发现的,包括包含编码来自多种不同细胞类型的各种结构域的核酸的嵌合组合。
某些实施方式中,相比传统佐剂如
某些方面,反应剂例如寡聚蛋白反应剂是与选择剂可逆结合或关联的多聚化反应剂,所述选择剂能够特异性结合细胞表面分子从而优先定向转化表达相应标志的细胞。某些实施方式中,大群中的特定细胞亚群相比其他细胞被选择性地转导。某些情形中,特定相比以前的转导效率比混合细胞群中其他细胞可以高达或高达约1.2倍、1.5倍、2.0倍、3.0倍、4.0倍、5.0倍、6.0倍、7.0倍、8.0倍、9.0倍、10倍或更高。某些实施方式中,混合培养物中的亚群定向可提供实质性的益处。某些实施方式中,这可以简化制造流程,降低必需事先纯化细胞群所需的消耗。某些实施方式中,本文所述用于遗传改造细胞的方法不包括细胞与寡聚蛋白(链霉亲和素突变蛋白)反应剂接触以利病毒颗粒转导前选择细胞的步骤,所述寡聚蛋白反应剂可逆结合于选择剂,所述选择剂将转导定向于特定细胞群。
某些实施方式中,本文所述反应剂和方法还有其他益处。通常,可用基于逆转录病毒的载体将目标基因稳定整合到细胞中。通常,采用现有逆转录病毒载体进行的T细胞转导要求通过T细胞受体(TCR)接合或通过细胞因子刺激活化T细胞。某些情形中,制备遗传改造T细胞用于过继免疫治疗的现有方法需要依次离体选择、激活、转导和扩增。然而,对于某些用于过继免疫治疗的细胞制备并非总是需要或希望包括这些步骤,例如出于多步骤的复制性、成本、再现性等考虑。某些方面,本文方法允许这些步骤中的一步或多步同时(非依序)进行。
某些实施方式中,本文方法包括其他步骤,包括一步或多步细胞选择、分离、刺激、激活和/或扩增。某些实施方式中,可将调控转导所用相同寡聚反应剂如多聚化反应剂用于以上其他步骤之一或多步,例如用于选择细胞和/或激活细胞和/或调控细胞转导。某些实施方式中,寡聚反应剂可以是多聚化反应剂并结合有细胞表面分子特异性结合剂,该结合剂促进细胞选择、激活、刺激和/或扩增。某些实施方式中,细胞选择、激活、转导调控和/或扩增之一或多步可在相同寡聚反应剂例如多聚体反应剂存在下进行,某些情形中,这可以是连续或半连续流程(例如密闭系统中)的一部分。某些实施方式中,本文方法可用于细胞处理相关方法,包括制备治疗用例如过继细胞治疗用细胞。尤其,本文涉及的方法优于现有方法例如现有大规模处理方法。相比之下的优点包括例如降低成本、优化流程、提高效率、提高安全性和提高不同对象、不同条件下的再现性。
通常,可用基于逆转录病毒的载体将目标基因稳定整合到细胞中。用现有逆转录病毒载体或许并不总能有效且稳定地遗传改造静息和/或非周期(non-cycling)细胞供细胞治疗之用。例如,现有方法可能无法用逆转录病毒载体有效转导非扩增免疫细胞如非扩增骨髓细胞或静息T细胞。某些情形中,为了在T细胞中诱发转导,可能需要通过T细胞受体(TCR)接合或通过细胞因子刺激活化T细胞。某些情形中,制备遗传改造T细胞用于过继免疫治疗的现有方法需要依次离体选择、激活、转导和扩增。
例如,在过继细胞治疗用细胞的制备中纳入活化和/或刺激步骤(例如在细胞选择之后)会增加时间、成本、反应剂消耗和/或增加处理难度。这些结果会增加不同处理流程之间和/或不同对象来源细胞之间的差异分析。因此,某些实施方式中,本文方法的优点在于不同于其他方法同时选择或富集细胞群,将其暴露于逆转录病毒主体颗粒和/或活化或刺激所述细胞。
某些方面,反应剂如寡聚蛋白反应剂可以与刺激剂(如抗CD3和/或抗CD28)可逆结合或关联,从而同时调控转导和激活细胞。某些情形中可以在接触或孵育的至少部分期间进行上述反应。本文转导方法的某些实施方式中,接受转导的群中的细胞如T细胞在与反应剂和病毒颗粒接触或孵育前未经或不必刺激和/或激活。某些实施方式中,本发明方法采用与刺激剂(如抗CD3和/或抗CD28)可逆结合或关联的寡聚反应剂如寡聚蛋白反应剂令转导效率相比先用活化剂(如抗CD3和/或抗CD28包被的磁性颗粒)活化然后传统致动件转导的方法提高至少1.2倍、1.5倍、2.0倍、3倍、4倍、5倍或更多。某些方面,这相比其他系统或方法是一个优势,其他系统或方法中不存在能够另外传递特定激活信号的转导反应剂。同样,尚未有另外能起转导佐剂作用的激活反应剂。
某些实施方式中,刺激剂如第一或第二刺激剂能够结合靶细胞表面分子,由此向细胞提供信号,有时这可以是主活化信号和/或次信号或共刺激信号。在一些实施方式中,主活化信号可足以活化细胞以扩增/增殖。多聚化反应剂还可具有结合于其上的第二作用剂,该第二作用剂刺激细胞表面上的辅助分子。第二作用剂结合于细胞表面上的辅助分子时,可由此刺激活化的细胞扩增。同样,该第二作用剂能可逆结合或不可逆结合多聚化反应剂。
在一个方面,本文所公开的方法是细胞群的系列扩增,其中全淋巴细胞群被刺激/扩增,然后通过在适合固相上的层析去除扩增所必需的反应剂。在一些实施方式中,经扩增/刺激的细胞(其为培养的细胞)可按照本文所述方法、可用例如T细胞受体或嵌合抗原受体(CAR)转染,某些方面,可用结合导入的T细胞受体或嵌合抗原受体的另外的刺激性分子对细胞进行第二刺激扩增。
某些实施方式中,因为过继细胞治疗中细胞剂量是由表达重组受体的细胞数量决定的,提高转导效率可缩短达到产品剂量所需的时间。因此,某些情形中,扩增转导细胞群的一个或多个流程(例如用在转导之后用刺激剂再孵育细胞)的进行时间因本发明方法而缩短至少或至少约20%、30%、40%、50%、60%、70%或更多。某些实施方式中,扩增细胞群以达到转导细胞治疗有效剂量的一个或多个流程的进行时间缩短至少或至少约2小时、6小时、12小时、24小时、48小时、72小时或96小时。某些实施方式中,制造用于过继细胞治疗的治疗有效量的遗传改造的细胞所需总时间降低至少或至少约20%、30%、40%、50%、60%、70%或更多。
某些实施方式中,本文方法可在密闭系统中例如以自动化方式进行。寡聚蛋白反应剂如多聚化反应剂既可以固定于固体支持物也可以是可溶形式的。某些实施方式中,细胞和/或病毒颗粒与寡聚蛋白(如链霉亲和素突变蛋白)反应剂如多聚化反应剂的接触或孵育在存在支持物如固定相或固体相的条件下进行,所述固定相或固体相述支持物有时结合有选择剂。某些实施方式中,待转导的细胞和/或病毒颗粒,或者是经选择、刺激和/或活化的细胞,与固定相中的反应剂关联,某些情形中,反应剂固定于(一般为间接固定)固定相。
本文还提供组合物、试剂盒和器械,用于实施本文所述方法,例如用于遗传改造细胞以用于过继细胞治疗。某些方面,细胞从对象中分离,如变为事实发生改造,载给予同一对象。其他方面中,它们从对象分离,经工程改造,但给予另一个对象。
II.用于细胞转导的反应剂系统
在此提供的是使用反应剂如寡聚反应剂如转导佐剂的方法。某些实施方式中,相同的寡聚反应剂有时是不同的寡聚反应剂可以是多聚化反应剂,其上结合有一个或多个结合剂用于在转导增强活化或刺激细胞、用于选择或优先定向特定的细胞亚组接受转导和/或用于刺激或扩增细胞。
在一些实施方案中,反应剂是寡聚蛋白反应剂。某些实施方式中,反应剂包含一个或多个多肽序列,序列长至少或至少约10、20、30、40个氨基酸,例如至少或至少约50、60、65、70、80、90、125、150、200、250、300个氨基酸或更长。某些实施方式中,寡聚反应剂包含多个多肽单体单元,单体单元各自含多肽序列,序列长至少或至少约10、20、30、40个氨基酸,例如至少或至少约50、60、65、70、80、90、125、150、200、250、300个氨基酸或更长。某些实施方式中,寡聚蛋白是二聚体、三聚体、四聚体或高阶寡聚体。在一些实施方式中,寡聚蛋白反应剂含有至少2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、35、40、45、50、60或更多单体单元。在一些实施方式中,各单体单元相同。某些实施方式中,寡聚反应剂含有多达2、3、4或更多不同单体单元。某些实施方式中,反应剂具有净正电荷或总正电荷。
某些实施方式中,本文方法包括孵育多个靶细胞与寡聚蛋白反应剂和病毒颗粒,其中,寡聚蛋白反应剂具有多个多肽单体单元,各单元长度至少或至少约10、20、30或40个氨基酸,且/或分子量至少或至少约20、30、40、50kDa;且/或寡聚蛋白反应剂的分子量或平均分子量至少或至少约100kDa,所述方法产生一输出组合物,其中包含被病毒颗粒转导的一个或多个细胞。
某些实施方式中,寡聚反应剂的分子量或是组合物中反应剂的平均分子量至少或至少约50kDa、至少或至少约100kDa、至少或至少约300kDa、至少或至少约500kDa、至少或至少约1000kDa、至少或至少约1250kDa、至少或至少约1500kDa、至少或至少约2000kDa,
某些实施方式中,寡聚反应剂的分子量或是组合物中反应剂的平均分子量至少或至少约50kDa至约2000kDa、约50kDa至约1000kDa、约50kDa至约500kDa、约100kDa至2000kDa、约100kDa至约1000kDa、约100kDa至约500kDa、约150kDa至约2000kDa、约150kDa至约1500kDa、约150kDa至约1250kDa、约150kDa至1000kDa、约150kDa至约500kDa或约150kDa至约300kDa、约300kDa至约2000kDa、约300kDa至约1500kDa、约300kDa至约1250kDa、约300kDa至1000kDa、约300kDa至约500kDa、约500kDa至约2000kDa、约500kDa至约1500kDa、约500kDa至约1250kDa、约500kDa至1000kDa、约1000kDa至约2000kDa、约1000kDa至约1500kDa、约1000kDa至约1250kDa、约1250kDa至约2000kDa、约1500kDa至约2000kDa、约50kDa至100kDa,50kDa至500kDa或100kDa至500kDa。
某些实施方式中,反应剂是或含链霉亲和素或亲和素或其突变蛋白。在一些实施方式中,链霉亲和素可为野生型链霉亲和素、链霉亲和素突变蛋白或类似物,例如链霉亲和素样多肽。类似地,某些方面,亲和素可包括野生型亲和素、或亲和素突变蛋白或类似物,例如中性亲和素,一种具有修饰的精氨酸的去糖基化生物素,其通常具有更高的中性pi且可用作天然生物素的替代品。通常,生物素的去糖基化中性形式包括市售那些形式,例如“Extravidin”可获自Sigma Aldrich公司,或例如“NeutrAvidin”可获自ThermoScientific公司或Invitrogen公司。
某些实施方式中,反应剂包含SEQ ID NO:1、2、3、4、5、6、27或28所示氨基酸序列,或与SEQ ID NO:1、2、3、4、5、6、27或28具有至少85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更高序列相同性的氨基酸序列。
A.可逆反应剂系统
在一些实施方式中,所述方法采用可逆系统,其中能够结合生物颗粒如细胞、微生物或病毒颗粒表面分子的至少一种反应剂(例如受体结合剂或选择剂或打不开了结合剂)与反应剂可逆关联。某些情形中,反应剂包含能够可逆结合作用剂的多个结合位点。一些情况中,反应剂是多聚化反应剂。在一些实施方式中,至少一种反应剂(例如受体结合剂、选择剂或病毒颗粒结合剂)包含能特异性结合于分子的表位或区域的至少一个结合位点(B或V)且还包含特异性结合反应剂至少一个结合位点Z的结合伴侣C。某些情形中,结合伴侣C和至少一个结合位点Z之间的结合相互作用是非共价相互作用。在一些实施方式中,结合伴侣C和至少一个结合位点Z之间的结合相互作用(例如非共价相互作用)是可逆的。
某些实施方式中,可以在例如竞争剂(又称洗脱剂)之类物质存在下介导可逆关联,所示竞争剂是或含结合位点,也能结合至少一个结合位点Z。通常,所述物质(如竞争剂)的作用是竞争者,因其对反应剂结合位点Z的结合亲和力高于结合伴侣C且/或因其存在浓度高于结合伴侣C而结合伴侣C从反应剂脱落和/或解离。某些实施方式中,所述物质(如竞争性反应剂)对至少一个结合位点Z的亲和力高于作用剂(如受体结合剂、选择剂或病毒颗粒结合剂)结合伴侣C对至少一个结合位点Z的亲和力。因此,有时,反应剂结合位点Z与作用剂(如受体结合剂、选择剂或病毒颗粒结合剂)结合伴侣C之间的连键会因加入所述物质(如竞争性反应剂)而被破坏,由此使得作用剂(如受体结合剂、选择剂或病毒颗粒结合剂)与反应剂之间的关联成为可逆。
可用于该可逆系统的反应剂在本领域中已有记载且已知,参见例如:美国专利号5,168,049;5,506,121;6,103,493;7,776,562;7,981,632;8,298,782;8,735,540;9,023,604;和国际公开PCT申请号WO2013/124474和WO2014/076277。以下描述了能够形成可逆相互作用的反应剂和结合伴侣、以及能够逆转该结合的物质(例如竞争性反应剂)的非限制性例子。
1.反应剂
在一些实施方式中,反应剂包含一个或多个结合位点Z,所述Z能够可逆结合作用剂(例如受体结合剂、选择剂或病毒颗粒结合剂)所包含的结合伴侣C。在一些实施方式中,反应剂包含多个结合位点Z,它们各自能够特异性结合包含在作用剂(例如受体结合剂、选择剂和/或病毒颗粒结合剂)中的结合伴侣C,从而使得反应剂能够可逆结合多个作用剂(例如受体结合剂、选择剂和/或病毒颗粒结合剂),例如为多聚化反应剂。某些实施方式中,反应剂是单个分子(如单体)的寡聚物或聚合物或是单个分子组成的亚基的复合物(例如四聚体)的寡聚物或聚合物,此类寡聚物或聚合物具有至少一个结合位点Z。某些实施方式中,反应剂具有至少两个结合位点Z、至少三个结合位点Z、至少四个结合位点Z,例如至少5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、24、28、32、36、40、44、48、52、56、60、64、68、72或更多结合位点Z。这些结合位点可以相同或含有一种或多种不同结合位点(如Z1、Z2、Z3等)。
某些实施方式中,一个或多个如两个或更多作用剂(例如受体结合剂、选择剂和/或病毒颗粒结合剂)与反应剂关联(如可逆结合),例如通过一个或多个反应剂上的结合位点Z。在一些情况下,这使得多个作用剂(例如受体结合剂、选择剂和/或病毒颗粒结合剂)彼此紧密排列,由此,当具有(至少两拷贝)某分子(如细胞表面分子)的生物颗粒(如靶细胞)被带至与具有一个或多个能够结合该特定分子的结合位点(B或V)的作用剂接触时产生亲合力(avidity)。
在一些实施方式中,具有相同结合位点(B或V)的两种或更多种不同作用剂(如受体结合剂、选择剂或病毒载体颗粒结合剂)能可逆结合该反应剂。在一些实施方式中,可以采用至少两种(类)作用剂,有时是三种(类)或四种(类)不同的作用剂,例如两种或更多种不同的受体结合剂、选择剂和/或病毒载体颗粒结合剂。例如,在一些实施方式中,反应剂能可逆包含结合位点B1、B2、B3或B4等的第一作用剂(例如受体结合或选择剂)和包含其他结合位点(例如结合位点B1、B2、B3、B4中的另一种)的第二作用剂(例如受体结合剂或选择剂)。某些情形中,第一作用剂和第二作用剂的结合位点可相同。例如,某些方面,至少两种作用剂(如受体结合剂或选择剂)各自均能结合相同分子。某些情形中,第一作用剂和第二作用剂的结合位点可不同。某些方面,至少两种作用剂(例如受体结合剂、选择剂)各自能结合不同的分子,例如第一分子、第二分子等。某些情形中,不同分子(例如细胞表面分子)可存在于相同靶细胞上。在其他情况下,不同分子(例如细胞表面分子)可存在于同一细胞群中的不同靶细胞上。某些情形中,第三、第四等反应剂(例如受体结合剂或选择剂)可与相同反应剂关联,各作用剂各自含有其他不同的结合位点。某些实施方式中,反应剂可以可逆结合于至少一个作用剂(如受体结合剂或选择剂)和病毒载体颗粒结合剂,所述作用剂含一个或多个结合位点B(如B1、B2、B3),所述病毒载体颗粒结合剂含一个或多个结合位点V(如V1、V2、V3)。
某些实施方式中,一个或多个作用剂如两个或更多不同作用剂(如受体结合剂、选择剂和/或病毒载体颗粒结合剂)含有相同的结合伴侣C。某些实施方式中,这两个或更多不同作用剂(如受体结合剂或选择剂)含有不同的结合伴侣。某些方面,第一作用剂(例如受体结合剂、选择剂或病毒颗粒结合剂)可具有能特异性结合反应剂上结合位点Z1的结合伴侣C1,第二作用剂(例如受体结合剂、选择剂或病毒颗粒结合剂)可具有能特异性结合反应剂上结合位点Z1或结合位点Z2的结合伴侣C2。因此,某些情形中,反应剂所包含的多个结合位点Z包括结合位点Z1和Z2,它们能够分别可逆结合作用剂(如受体结合剂、选择剂或病毒颗粒结合剂)所包含的结合伴侣C1和C2。在一些实施方式中,C1和C2相同,和/或Z1和Z2相同。在其他方面中,多个结合位点Z中的一个或多个可不同。在其他情况中,多个结合伴侣C中的一个或多个可不同。选择能与含有结合位点Z的反应剂相容的结合伴侣C的任何组合在本领域技术人员的能力范围内,只要各结合伴侣C能够与结合位点Z之一相互作用(例如特异性结合)。
一些方法实施方式中,寡聚蛋白反应剂包括多个多肽单元,它们各自包括链霉亲和素、亲和素、生物素结合多肽、strep标签结合多肽、链霉亲和素突变蛋白、链霉亲和素类似物、亲和素突变蛋白、亲和素类似物、和/或前述任一的生物活性片段。例如,某些实施方式中,本文方法包括将包含靶细胞的多细胞以下物质孵育:(1)蛋白反应剂,所述蛋白反应剂包含链霉亲和素、亲和素、链霉亲和素类似物或突变蛋白,亲和素类似物、前述任一之突变蛋白或生物活性片段,和/或前述任一的多个亚基,和(2)病毒颗粒,该方法产生包含由病毒颗粒转导的一个或多个细胞的输出组合物。
某些实施方式中,反应剂是链霉亲和素、链霉亲和素突变蛋白或类似物、亲和素、亲和素突变蛋白或类似物(如中性亲和素)或它们的混合物,反应剂含有一个或多个结合位点Z与结合伴侣C可逆结合。某些实施方式中,结合伴侣C可以是生物素、生物素衍生物或类似物、或链霉亲和素结合肽或其他能够特异性结合链霉亲和素、链霉亲和素突变蛋白或类似物、亲和素、亲和素突变蛋白或类似物的分子。在一些实施方式中,反应剂为或包含链霉亲和素、亲和素、链霉亲和素类似物或突变蛋白、或亲和素类似物或突变蛋白,其可逆结合生物素、生物素类似物或其生物活性片段。在一些实施方式中,反应剂为或包含链霉亲和素突变蛋白或类似物、或亲和素突变蛋白或类似物,其可逆结合链霉亲和素结合肽。在一些实施方式中,所述物质(例如竞争性反应剂)可为生物素、生物素衍生物或类似物、或链霉亲和素结合肽,其能够与结合伴侣C竞争结合一个或多个结合位点Z。在一些实施方式中,结合伴侣C和该物质(例如竞争性反应剂)是不同的,该物质(例如竞争性反应剂)对一个或多个结合位点Z的亲和力高于对结合伴侣的亲和力。
在一些实施方式中,链霉亲和素可为野生型链霉亲和素、链霉亲和素突变蛋白或类似物,例如链霉亲和素样多肽。类似地,某些方面,亲和素可包括野生型亲和素、或亲和素突变蛋白或类似物,例如中性亲和素,一种具有修饰的精氨酸的去糖基化生物素,其通常具有更高的中性pi且可用作天然生物素的替代品。通常,生物素的去糖基化中性形式包括市售那些形式,例如“Extravidin”可获自Sigma Aldrich公司,或例如“NeutrAvidin”可获自Thermo Scientific公司或Invitrogen公司。
在一些实施方式中,反应剂为链霉亲和素或链霉亲和素突变蛋白或类似物。在一些实施方式中,野生型链霉亲和素(wt-链霉亲和素)的氨基酸序列如Argarana等,NucleicAcids Res.14(1986)1871-1882所公开(SEQ ID NO:1)。一般说来,链霉亲和素天然存在为四个相同亚基的四聚体,即其为同四聚体,其中各亚基包含针对生物素、生物衍生物或类似物或生物素模拟物的单个结合位点.示例性的链霉亲和素亚基是SEQ ID NO:1所示的氨基酸序列,但该序列还可包含与其同源的来自其他链霉菌(Streptomyces)种系的序列。就具体情况而言,链霉亲和素的各亚基对生物素有高亲和力,平衡常数(K
在一些实施方式中,链霉亲和素可为任何形式,例如野生型或未修饰的链霉亲和素,例如来自链霉菌种系的链霉亲和素或其功能活性片段,其包含针对生物素、生物素衍生物或类似物或生物素模拟物的结合位点的至少一个功能性亚基,例如通常包含SEQ ID NO:1所示的来自亲和素链霉菌(Streptomyces avidinii)的野生型链霉亲和素的至少一个功能性亚基或其功能活性片段。例如,在一些实施方式中,链霉亲和素可包含野生型链霉亲和素的片段,其在N-末端和/或C-末端截短。此类最小的链霉亲和素包括如下任何形式:N末端起始于SEQ ID NO:1的氨基酸位置10-16的区域中,C末端终止于SEQ ID NO:1的氨基酸位置133-142的区域中。在一些实施方式中,链霉亲和素功能活性片段包含SEQ ID NO:2所示的氨基酸序列。在一些实施方式中,所述未修饰的链霉亲和素,例如SEQ ID NO:2所示的,还可包含位于对应于Ala13(按照SEQ ID NO:1所示编号)的位置处的N末端甲硫氨酸。本文提供的链霉亲和素或链霉亲和素突变蛋白中的残基位置编号参照SEQ ID NO:1中残基的编号。
某些方面,链霉亲和素突变蛋白包括与未修饰或野生型链霉亲和素序列相比存在一个或多个氨基酸取代、缺失或添加的多肽,但所述多肽包含至少一个功能性亚基,所述功能性亚基包含针对生物素、生物素衍生物或类似物或链霉亲和素结合肽的结合位点。某些方面,链霉亲和素样多肽和链霉亲和素突变蛋白可为本质上是野生型链霉亲和素免疫等价物的多肽,且尤其是能够以与野生型链霉亲和素相同或不同亲和力结合生物素、生物素衍生物或生物素类似物的多肽。在一些情况中,链霉亲和素样多肽或链霉亲和素突变蛋白可包含非野生型链霉亲和素的一部分的氨基酸,或它们可仅包含野生型链霉亲和素的一部分。在一些实施方式中,链霉亲和素样多肽是与野生型链霉亲和素不同的多肽,这是由于宿主不含将宿主产生的多肽转化为野生型链霉亲和素结构所需的酶。在一些实施方式中,链霉亲和素还可作为链霉亲和素四聚体和链霉亲和素二聚体存在,尤其是链霉亲和素同四聚体、链霉亲和素同二聚体、链霉亲和素异四聚体和链霉亲和素异二聚体。通常,各亚基一般具有针对生物素或生物素类似物或针对链霉亲和素结合肽的结合位点。链霉亲和素或链霉亲和素突变蛋白的例子在例如WO 86/02077、DE 19641876 Al、US 6,022,951、WO 98/40396或WO 96/24606中提及。
在一些实施方式中,链霉亲和素突变蛋白可包含一些氨基酸它们不是未修饰或野生型链霉亲和素的一部分,或可仅包含野生型或非修饰链霉亲和素的一部分。在一些实施方式中,与未修饰或野生型链霉亲和素亚基(例如SEQ ID NO:1所示的野生型链霉亲和素亚基或其功能活性片段,例如SEQ ID NO:2所示)相比,链霉亲和素突变蛋白包含可具有一个或多个氨基酸取代(置换)的至少一个亚基。在一些实施方式中,与野生型或未修饰链霉亲和素相比,链霉亲和素突变蛋白的至少一个亚基可具有至少1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20个不同氨基酸,和/或包含至少一个亚基,其所含氨基酸序列与SEQ ID NO:1或2所示氨基酸序列具有至少85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更高的序列相同性,其中,此链霉亲和素突变蛋白具有结合生物素、生物素衍生物或类似物或生物素模拟物的功能活性。在一些实施方式中,所述氨基酸置换(取代)是保守或非保守性突变。链霉亲和素突变蛋白的例子在本领域中已知,参见例如美国专利号5,168,049;5,506,121;6,022,951;6,156,493;6,165,750;6,103,493;或6,368,813;或国际公开PCT申请号WO2014/076277。
在一些实施方式中,链霉亲和素或链霉亲和素突变蛋白包括:含一个或多于一个功能性亚基的蛋白质,所述亚基包含针对生物素、生物素衍生物或类似物或链霉亲和素结合肽的一个或多个结合位点Z,例如含两个或更多个、三个或更多个、四个或更多个,在一些情况中,5、6、7、8、9、10、11、12或更多个功能性亚基的蛋白质。在一些实施方式中,链霉亲和素或链霉亲和素突变蛋白可包括:单体;二聚体,包括异二聚体或同二聚体;四聚体,包括同四聚体、异四聚体、单价四聚体或二价四聚体;或可包括其更高级别的多聚体或寡聚体。
在一些实施方式中,链霉亲和素或链霉亲和素突变蛋白对肽配体结合伴侣的结合亲和力小于1×10
在一些实施方式中,反应剂(例如链霉亲和素或链霉亲和素突变蛋白)对肽配体结合伴侣具有结合亲和力,该肽配体结合伴侣可为存在于反应剂(例如受体结合剂或选择剂)中的结合伴侣C。在一些实施方式中,肽序列包含具有SEQ ID NO:9所示通式的序列,例如包含SEQ ID NO:10所示序列。在一些实施方式中,肽序列具有SEQ ID NO:11所示的通式,例如如SEQ ID NO:12所示。在一个实施例中,肽序列为Trp-Arg-His-Pro-Gln-Phe-Gly-Gly(也称
在一些实施方式中,反应剂为或包含链霉亲和素突变蛋白。在一些实施方式中,与SEQ ID NO:1所示的野生型链霉亲和素或其生物活性部分相比,链霉亲和素突变蛋白包含一个或多个突变(例如氨基酸置换)。例如,链霉亲和素的生物活性部分包括N末端和/或C末端截短的链霉亲和素变体,其在一些情况中被称为最小链霉亲和素。在一些实施方式中,与SEQ ID NO:1的序列相比,N末端截短的最小链霉亲和素(可对其进行任何突变)在N末端起始于氨基酸位置10~16区域,在C末端终止于氨基酸位置133~142区域。在一些实施方式中,可使N末端截短的链霉亲和素(可对其进行任何突变)包含SEQ ID NO:2所示的序列。在一些实施方式中,最小链霉亲和素包含从位置Ala13~Ser139的氨基酸序列,且可选地具有替代Ala13的N末端甲硫氨酸残基。为了本文的目的,氨基酸位置的编号全部参考SEQ IDNO:1所示野生型链霉亲和素的编号(例如Argarana等,Nucleic Acids Res.14(1986),1871-1882,也可参见图3)。
在一些实施方式中,链霉亲和素突变蛋白是美国专利号6,103,493所述的突变体。在一些实施方式中,链霉亲和素突变蛋白在氨基酸位置44~53区域内包含至少一个突变,基于野生型链霉亲和素的氨基酸序列,例如如SEQ ID NO:1所示。在一些实施方式中,所述链霉亲和素突变蛋白在44、45、46和/或47中的一个或多个残基处包含突变。在一些实施方式中,链霉亲和素突变蛋白在野生型链霉亲和素第44位处疏水脂族氨基酸(例如Val、Ala、Ile或Leu)替代Glu,在第45位用任何氨基酸替代,在第46位用脂族氨基酸(例如疏水脂族氨基酸)替代,和/或在第47位用碱性氨基酸(例如Arg或Lys,如通常为Arg)替代Val。在一些实施方式中,在第46位为Ala和/或在第47位为Arg和/或在第44位为Val或Ile。在一些实施方式中,链霉亲和素突变体包含残基Val
在一些实施方式中,链霉亲和素突变蛋白是描述于国际公开的PCT申请号WO2014/076277的突变体。在一些实施方式中,参照SEQ ID NO:1所示的氨基酸位置,链霉亲和素突变蛋白在氨基酸位置44~53的区域中包含至少两个半胱氨酸残基。1.在一些实施方式中,所述半胱氨酸残基位于位置45和52处以产生连接这些氨基酸的二硫桥。在此处的实施方式中,氨基酸44通常是甘氨酸或丙氨酸,且氨基酸46通常是丙氨酸或甘氨酸,且氨基酸47通常是精氨酸。在一些实施方式中,参照SEQ ID NO:1所示的氨基酸位置,链霉亲和素突变蛋白在氨基酸残基115~121的区域中包含至少一个突变或氨基酸差异。1.在一些实施方式中,链霉亲和素突变蛋白在氨基酸位置117、120和121处含有至少一个突变,和/或,氨基酸118和119缺失,且至少氨基酸位置121处有取代。
在一些实施方式中,链霉亲和素突变蛋白在对应于117位的位置包含突变,该突变可为:大的疏水性残基(如Try、Tyr或Phe)或带电荷残基(如Glu、Asp或Arg)或疏水残基(如Asn或Gin),或者,在一些情况中,疏水残基Leu、Met或Ala,或极性残基Thr、Ser或His。在一些实施方式中,117位的突变与如下突变组合:对应于120位的位置的突变,该突变可为小残基(如Ser或Ala或Gly);对应于121位的位置的突变,该突变可为疏水性残基(例如大的疏水性残基,如Trp、Tyr或Phe)。在一些实施方式中,117位处的突变与以下突变组合:对应于SEQID NO:1所示野生型链霉亲和素或其生物活性片段第120位的位置处的突变,该突变可为疏水性残基(例如Leu、Ile、Met或Val,或通常Tyr或Phe;以及,对应于SEQ ID NO:1所示野生型链霉亲和素或其生物活性片段第121位的位置处的突变,该突变可为小残基(如Gly、Ala或Ser)或Gln或疏水性残基(如Leu、Val、Ile、Trp、Tyr、Phe或Met)。在一些实施方式中,此类突变蛋白还能包含残基Val44-Thr45-Ala46-Arg47或残基Ile44-Gly45-Ala46-Arg47。在一些实施方式中,链霉亲和素突变蛋白包含残基Val44、Thr45、Ala46、Arg47、Glu117、Gly120和Tyr121。在一些实施方式中,链霉亲和素突变蛋白包含SEQ ID NO:27或28所示的氨基酸序列,或显示出与SEQ ID NO:27或28所示氨基酸序列至少85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更高序列相同性的氨基酸序列,其包含残基Val44、Thr45、Ala46、Arg47、Glu117、Gly120和Tyr121,且显示结合生物素、生物素类似物或链霉亲和素结合肽的功能活性。
在一些实施方式中,链霉亲和素突变蛋白可包含任何组合形式的任何上述突变,且所得的链霉亲和素突变蛋白可显示对肽配体(Trp Arg His Pro Gln Phe Gly Gly;也称
在一些实施方式中,链霉亲和素突变蛋白具有SEQ ID NO:3~6、27或28所示的氨基酸序列,或与SEQ ID NO:3~6、27或28任一所示的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更高的序列相同性,且对肽配体(Trp-Arg-His-Pro-Gln-Phe-Gly-Gly;也称
在一些实施方式中,链霉亲和素突变体还可结合至其它链霉亲和素配体,例如但不限于,生物素、亚氨基生物素、硫辛酸、脱硫生物素、二氨基生物素、HABA(羟基偶氮苯-苯甲酸)或/和二甲基-HABA。在以下实施方式中,链霉亲和素突变蛋白对其他链霉亲和素配体(例如生物素或脱硫生物素)的结合亲和力大于该链霉亲和素突变蛋白对生物素模拟肽配体(例如SEQ ID NO:7-19任一所示)的结合亲和力。因此,在一些实施方式中,生物素或生物素类似物或衍生物(例如脱硫生物素)在本文所提供的方法中可用作竞争性反应剂。例如,与生物素-链霉亲和素相互作用约10
在一些情况中,反应剂包含例如能够结合过渡金属离子的至少两个螯合基团K。在一些实施方式中,反应剂能够结合寡聚组氨酸亲和标签、谷胱甘肽-S-转移酶、钙调蛋白或其类似物、钙调蛋白结合肽(CBP)、FLAG-肽、HA-标签、麦芽糖结合肽(MBP)、HSV表位、myc表位、和/或生物素化载体蛋白。
某些实施方式中,蛋白反应剂是寡聚蛋白反应剂,可具有一个或多个多聚体亚基,各亚基各自具有两个或更多多肽单元。在一些实施方式中,寡聚蛋白反应剂包括多个单一单位,其包括一种或多种生物素结合多肽、链霉亲和素、亲和素、链霉亲和素类似物、链霉亲和素突变蛋白、亲和素类似物、亲和素突变蛋白和生物活性片段。
在一些实施方式中,反应剂是寡聚体或多聚体。在一些实施方式中,寡聚体或多聚体可通过如下方式产生:直接或间接连接天然存在状态的蛋白质个体分子,这可以通过者直接或间接连单独的单体分子或作为个体分子的亚基的复合物(例如,直接或间接连接天然存在状态的蛋白质的二聚体、三聚体、四聚体等)。例如,链霉亲和素或亲和素的四聚化同二聚体或异二聚体可被视为相应寡聚体或多聚体的最小构建区块或个体分子。在一些实施方式中,寡聚体或多聚体可包含至少2个蛋白质个体分子连接(例如,为2聚体),或可为蛋白质个体分子(例如单体、四聚体)的至少3聚体、4聚体、5聚体、6聚体、7聚体、8聚体、9聚体、10聚体、11聚体、12聚体、13聚体、14聚体、15聚体、16聚体、17聚体、18聚体、19聚体、20聚体、25聚体、30聚体、35聚体、40聚体、45聚体或50聚体。
寡聚体可采用本领域已知的任何方法产生,例如描述于公开的美国专利申请公开号US2004/0082012中的任何方法。在一些实施方式中,寡聚体或多聚体包含两个或更多个个体分子,它们可以是交联的,例如通过多聚糖或双功能接头交联。
在一些实施方式中,寡聚体或多聚糖通过在多糖的存在下交联个体分子或作为个体分子的亚基的复合物而获得。在一些实施方式中,可通过在多糖(例如葡聚糖)中引入羧基残基来制备寡聚体或多聚体。某些方面,反应剂的个体分子(例如单体或四聚体)可通过内部赖氨酸残基的伯胺基团偶联,和/或通过葡聚糖骨架中游离N末端与羧基偶联,所采用的是本领域常规的碳二亚胺化学法。在一些实施方式中,偶联反应进行的摩尔比为约60摩尔反应剂个体分子(例如单体或四聚体)/摩尔葡聚糖。
在一些实施方式中,反应剂是一个或多个链霉亲和素、或亲和素、或链霉亲和素类似物或突变蛋白(如
在一些实施方式中,通过采用二官能接头或其他化学接头(例如戊二醛)或其他本领域已知的方法交联个体分子或组成个体分子的单体复合物来获得寡聚体或多聚体。某些方面,可通过采用用作接头的二官能分子(例如戊二醛)或通过本领域所描述的其他方法交联个体链霉亲和素或亲和素分子来获得链霉亲和素、或亲和素、或链霉亲和素或亲和素的任何突变蛋白或类似物的交联寡聚体或多聚体。例如,可以如下产生链霉亲和素突变蛋白的寡聚体:将巯基引入链霉亲和素突变蛋白(该步骤可例如通过使链霉亲和素突变蛋白与2-亚氨氢氯化硫醇(Traut反应剂)反应来实现),以及活化(例如在另一独立的反应中)链霉亲和素突变蛋白中可及的氨基基团。在一些实施方式中,氨基基团的该活化可通过使链霉亲和素突变蛋白与市售异二官能交联剂(例如磺基琥珀酰亚胺基-4-(N-马来酰亚胺甲基)环己烷-1-羧酸酯(磺基-SMCC)或琥珀酰亚胺基-6-[(β-马来酰亚胺丙酰胺基)己酸酯(SMPH))反应来实现。某些此类实施方式中,将如此获得的两反应的产物混合在一起,通常会导致修饰链霉亲和素突变蛋白产物所含巯基与另一修饰链霉亲和素突变蛋白产物所含活化(例如通过马来酰亚胺官能化)氨基酸反应。某些情形中,通过该反应形成链霉亲和素突变蛋白的多聚体/寡聚体。这些寡聚体可具有适当数量的个体分子,例如至少2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、40、45、50个或更多个个体分子,寡聚化程度可根据反应条件而不同。
在一些实施方式中,寡聚或多聚反应剂可通过尺寸排阻层析分离,且任何所需级份(fraction)可用作反应剂。例如,在一些实施方式中,在2-亚氨氢氯化硫醇和异二官能交联剂(例如磺基SMCC)的存在下使修饰的链霉亲和素突变蛋白反应后,可通过尺寸排阻层析分离寡聚反应剂或多聚反应剂,且任何所需级份可用于反应剂。在一些实施方式中,寡聚物不具有(且不必具有)单一分子量,但它们可具有统计学重量分布,例如高斯分布。某些情形中,具有多于三个链霉亲和素或突变蛋白四聚体(例如同四聚体或异四聚体)的任何寡聚体可用作可溶性反应剂,例如通常为3~50个四聚体(例如同四聚体或异四聚体)、10~40个四聚体(例如同四聚体或异四聚体)、或25~35个四聚体(例如同四聚体或异四聚体)。该寡聚体可具有(例如)3~25个链霉亲和素突变蛋白四聚体(例如同四聚体或异四聚体)。某些方面,链霉亲和素突变蛋白的分子量约为50kDa,可溶性寡聚体的分子量可为约150kDa~约2000kDa、约150kDa~约1500kDa、约150kDa~约1250kDa、约150kDa~1000kDa、约150kDa~约500kDa or约150kDa~约300kDa、约300kDa~约2000kDa、约300kDa~约1500kDa、约300kDa~约1250kDa、约300kDa~1000kDa、约300kDa~约500kDa、约500kDa~约2000kDa、约500kDa~约1500kDa、约500kDa~约1250kDa、约500kDa~1000kDa、约1000kDa~约2000kDa、约1000kDa~约1500kDa、约1000kDa~约1250kDa、约1250kDa~约2000kDa或约1500kDa~约2000kDa。通常,由于各链霉亲和素分子/突变蛋白具有四个生物素结合位点,该反应剂可提供12~160个结合位点Z,例如12~100个结合位点Z。
在一些实施方式中,反应剂不含和/或不偶联或不可逆性结合于结合剂(包括抗体或其片段)或不包括含人细胞表面分子或其结合片段的结合剂;反应剂不包含或不偶联或结合于具有对人细胞表面标志例如T细胞标志特异性的结合域的分子;反应剂不含和/或不偶联或不结合于胞外基质元件,粘性分子、整合素、凝集素、整合素-结合蛋白、趋化因子、细胞因子、生长因子、胞外基质结合分子、ECM元件、病毒蛋白、促进病毒进入的细胞表面受体、肝素、乙酰肝素、聚糖;和/或反应剂不含肝素结合域和/或不含整合素结合域和/或不含VLA4结合域和/或不含VLA5-结合域。
在一些实施方式中,反应剂还含有和/或可逆性结合于多个一种或多种结合剂,所述结合剂各自能够特异性结合病毒颗粒表面和/或靶细胞表面的分子。
2.反应剂形式
a.支持物
某些实施方式中,转导和/或一个或多个其他处理步骤(如选择、活化或扩增)可在固体支持物上如采用基质进行,例如磁珠、琼脂糖颗粒、细胞培养皿或其他固体表面基质,支持物上已固定、偶联或结合有寡聚蛋白反应或多聚化反应剂。在一些实施方式中,反应剂包含在支持物上,所述支持物为例如固体支持物或表面(例如珠)或固定相(色谱基质)。在一些此处的实施方式中,反应剂可逆固定在支持物上。某些情形中,反应剂通过共价键固定于支持物。某些情形中,反应剂通过非共价键可逆固定于支持物。某些方面,靶细胞和/或病毒颗粒依次或同时暴露于或接触固体支持物(如固定相(如色谱基质))上的反应剂。
在一些实施方式中,支持物是固体支持物。可将任何固体支持物(表面)用于可逆固定反应剂。其上可固定反应剂的示例性固体支持物包括磁珠、多聚珠、细胞培养板、微量滴定板、膜或中空纤维。某些方面,可在
在一些实施方式中,反应剂可为例如可逆结合链霉亲和素结合肽的链霉亲和素或亲和素突变蛋白。此类链霉亲和素突变蛋白可共价连接任何表面,例如用于色谱纯化的树脂(珠),它们以该形式市售获自IBA有限公司(哥廷根),例如作为
其他可方便购得的示例性例子是固定化的金属亲和色谱(IMAC),例如可用于寡聚组氨酸标签(his-标签)蛋白的可逆固定
在一些实施方式中,用于本文方法中的色谱基质还可包括磁力可吸引物质,例如一种或多种磁力可吸引颗粒或铁磁流体。各磁力可吸引颗粒可包括具有能结合靶细胞或表达颗粒的结合位点的反应剂。在一些情况中,磁力可吸引颗粒可包含抗磁性、铁磁性、顺磁性或超顺磁性材料。通常,超顺磁性材料以诱导磁场响应磁场而不会导致永久磁化。基于铁氧化物的磁性颗粒为例如市售:Dyn珠(Dynal Biotech公司)、磁性MicroBeads(MiltenyiBiotec公司)、磁性多孔玻璃珠(CPG有限公司)、以及获自各自其他来源,例如RocheApplied Science公司、BIOCLON公司、BioSource国际有限公司、micromod公司,AMBION公司、Merck公司、Bangs Laboratories公司、Polysciences公司或Novagen有限公司,以上并非穷举。基于超顺磁Co和FeCo的磁性纳米颗粒以及铁磁性Co纳米晶体已有描述,例如Hutten,A等(J.Biotech.(2004),112,47-63)。在一些实施方式中,所述细胞和细胞群采用免疫磁性(或亲和性磁性)分离技术分开(separated)或分离(isolated)(综述参见《分子医学方法》(Methods in Molecular Medicine),第58卷:代谢研究方法(MetastasisResearch Protocols),第2卷:细胞体外和体内性能(Cell Behavior In Vitro and InVivo),第17-25页,S.A.Brooks和U.Schumacher编
在一些实施方式中,支持物包含固定相。因此,在一些实施方式中,反应剂包含于固定相(也称为色谱基质)上。在一些此处的实施方式中,反应剂可逆固定在固定相上。某些情形中,反应剂通过共价键可逆固定于固定相。某些方面,反应剂通过非共价键可逆固定于固定相。
可将任何材料用作色谱基质。通常,适合的色谱材料本质上无害,即对细胞活力无不利影响,例如按所需条件用于装填色谱柱时。在一些实施方式中,固定相保持在预定的定位(例如预定位置),而样品的定位可改变。因此,在一些实施方式中,固定相是色谱系统的一部分,流动相流过该部分(连续流或批次形式),液相中所含的组分(溶解或分散)发生相间分布。
在一些实施方式中,色谱基质具有固相或半固相形式,而含有待分离/分隔靶细胞的样品则是液相。色谱基质可为颗粒材料(具有任何适宜的尺寸和形状)或整体色谱材料,包括纸基质或膜。因此,某些方面,色谱法既可以是柱色谱法,也可以是平面色谱法。在一些实施方式中,除了标准色谱柱,还可将允许双向流的柱(例如
在一些实施方式中,适于本文方法的非磁性或不可磁化色谱固定相包括衍生化二氧化硅或交联凝胶。某些方面,交联凝胶可基于天然聚合物,例如基于自然界存在的聚合物类。例如,可作为色谱固定相基础的天然聚合物为多糖。某些情形中,所用多糖大体交联的。多糖基质的例子包括但不限于:琼脂糖凝胶(例如,Superflow
在一些实施方式中,交联凝胶可基于合成的聚合物,例如基于自然界中不存在的聚合物类。某些方面,色谱固定相所基于的此类合成的聚合物具有极性单体单元,因此其本身具有极性。因此,在一些情况中,该极性聚合物是亲水性的。某些方面,亲水性分子(也称疏油性)包含能与水分子形成偶极-偶极相互作用的部分。通常,疏水性分子(也称亲脂性)具有与水分离的趋势。
适合的合成聚合物的示例性例子是:聚丙烯酰胺类、苯乙烯-二乙烯基苯凝胶和丙烯酸酯和二醇的共聚物或丙烯酰胺与二醇的共聚物。示例性的例子是聚甲基丙烯酸凝胶(作为
在一些实施方式中,用于本文方法中的色谱基质还可包括磁力可吸引物质,例如一种或多种磁力可吸引颗粒或铁磁流体。各磁力可吸引颗粒可包括具有能结合靶细胞的结合位点的反应剂。在一些情况中,磁力可吸引颗粒可包含抗磁性、铁磁性、顺磁性或超顺磁性材料。通常,超顺磁性材料以诱导磁场响应磁场而不会导致永久磁化。基于铁氧化物的磁性颗粒为例如市售:Dyn珠(Dynal Biotech公司)、磁性MicroBeads(Miltenyi Biotec公司)、磁性多孔玻璃珠(CPG有限公司)、以及获自各自其他来源,例如Roche AppliedScience公司、BIOCLON公司、BioSource国际有限公司、micromod公司,AMBION公司、Merck公司、Bangs Laboratories公司、Polysciences公司或Novagen有限公司,以上并非穷举。基于超顺磁Co和FeCo的磁性纳米颗粒以及铁磁性Co纳米晶体已有描述,例如Hutten,A等(J.Biotech.(2004),112,47-63)。在其他实施方式中,用于本文方法的色谱基质没有任何磁力可吸引物质。
b.可溶性
在一些实施方式中,反应剂不结合于固体支持物,即其以可溶形式存在或是可溶的。原则上,该反应剂同样可用作固定于支持物(例如固体支持物或固定相)的反应剂。例如,任何全文所述示例性反应剂均可不固定或附着于支持物(如不附着于固体支持物或固定相)来使用。某些实施方式中,反应剂具有多个结合位点Z用于经结合伴侣相互作用而可逆结合结合剂。有时,反应剂是个体分子的寡聚体或多聚体或是作为个体分子的亚基复合物的寡聚体或多聚体(如二聚体、三聚体或四聚体蛋白的寡聚体或多聚体)。在一些实施方式中,反应剂可为例如链霉亲和素突变蛋白寡聚体、钙调蛋白寡聚体、提供至少两个螯合基团K的化合物(寡聚体),其中所述至少两个螯合基团能够结合过渡金属离子,由此使得反应剂能够结合寡组氨酸亲和标签、多聚谷胱甘肽-S-转移酶或生物素化载体蛋白。
在一些实施方式中,反应剂的特征是不含附着于该反应剂的固体支持物(表面)。例如,在一些实施方式中,反应剂不含或不附着于(直接或间接)颗粒、珠、纳米颗粒、微球或其他固体支持物。在一些实施方式中,反应剂不是刚性、非柔性或硬性的,或不含或不附着于刚性、非柔性或硬表面。在一些实施方式中,反应剂是柔性的或基本上柔性。在一些情况中,反应剂能够调节或匹配以适应细胞表面的形式。在一些实施方式中,反应剂的形状不是球形或基本球形,或不包含球形或基本球形的形状。
在一些实施方式中,基本全部,即超过80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更多的反应剂为有机材料、由有机材料组成或包含有机材料。例如,在一些实施方式中,超过80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更多的反应剂为脂质、碳水化合物、蛋白质、肽或它们的混合物,由脂质、碳水化合物、蛋白质、肽或它们的混合物组成,或包含脂质、碳水化合物、蛋白质、肽或它们的混合物。在一些实施方式中,反应剂基本上缺少如下物质、基本不由如下物质组成或基本不含如下物质:无机材料、无机核心(例如金属,如铁)、核磁或无机聚合物(例如苯乙烯聚合物,如聚苯乙烯)、乳剂、二氧化硅或磁性核心。例如,在一些实施方式中,反应剂的无机材料或组成反应剂一部分的无机材料的相对百分比少于20%、5%、10%、5%或更少。
在一些实施方式中,水性溶液中反应剂的总体积的大部分(即多于50%,例如多于60%、70%、80%、90%、95%、99%或更多)含有形成反应剂的个体蛋白分子,例如个体分子或作为个体分子的亚基复合物(例如四聚体分子)的寡聚体或多聚体。在一些实施方式中,可溶性反应剂的总封闭小于1.2g/cm
在一些实施方式中,可溶性反应剂(例如不附着于支持物或固体支持物,如不附着于珠)具有相对小的尺寸,例如尺寸通常小于或约小于20nm,例如小于或约小于15nm,小于或约小于10nm,小于或约小于5nm或更小。
在一些实施方式中,可溶性反应剂(例如不附着于支持物或固体支持物,如不附着于珠)是生物惰性的,即其对活细胞无毒性。在一些实施方式中,反应剂可生物降解,例如,其可通过酶活性降解或被吞噬细胞清除。
在一些实施方式中,可使反应剂(例如链霉亲和素或突变蛋白,如四聚化链霉亲和素突变蛋白)与载体(例如有机载体)反应。某些方面,除了与多糖的反应以外,还可将生理学或药学上可接受的蛋白质例如血清白蛋白(如人血清白蛋白(HSA)或牛血清白蛋白(BSA))用作载体蛋白。在此情况中,反应剂(例如链霉亲和素或链霉亲和素突变蛋白,个体四聚体或寡聚体形式)可通过非共价相互作用与载体蛋白偶联。在一些此处的实施方式中,生物素化BSA(可通过不同供应商市售获得,例如ThermoFisher Scientific公司、SigmaAldrich公司或Vectorlabs公司,以上非穷举)可与反应剂(例如链霉亲和素突变蛋白)反应。某些方面,部分反应剂寡聚体(例如链霉亲和素寡聚体)可通过一个或多个结合位点Z非共价结合生物素化载体蛋白,留出寡聚体的大部分结合位点Z用于结合反应剂(例如受体结合剂或选择剂)以及本文所述的任何其他作用剂。因此,可由此制备具有多个结合位点Z的可溶性反应剂。
在其他实施方式中,反应剂(例如链霉亲和素突变蛋白,个体四聚体或寡聚体形式)可共价偶联合成的载体,例如聚乙二醇(PEG)分子。例如,可将任何合适的PEG分子用于该目的,PEG分子和相应的反应剂可以是可溶性。通常,分子量最高达1000Da的PEG分子在水或可用于本文所述方法的培养基中可溶。在一些情况中,此类基于PEG的反应剂可采用市售活化PEG分子(例如,PEG-NHS衍生物,可获自NOF North America公司,美国加利福尼亚州爱尔文;或活化的PEG衍生物,可获自Creative PEGWorks公司,美国北卡罗来纳州教堂山)与链霉亲和素突变蛋白的氨基基团制备。
3.组分去除与破坏
在一些实施方式中,孵育后或在需要中断刺激的其他适宜时间,可逆结合剂的结合伴侣C(例如C1)与多聚化反应剂的结合位点Z(例如Z1)之间的结合通过破坏相应的可逆键而被破坏。某些情形中,破坏可通过在含有结合于多聚化反应剂的细胞群的孵育/反应混合物中加入竞争物来实现。对于可逆结合剂的结合伴侣C(例如C1)与多聚化反应剂的结合位点Z(例如Z1)之间可逆键的竞争性破坏(其可理解为是竞争性洗脱),可使细胞群/孵育混合物与能够破坏第一结合伴侣和结合位点Z(例如Z1)之间连键的游离第一结合伴侣C(例如C1)或所述第一结合伴侣C的类似物接触。以结合伴侣C(例如C1)为链霉亲和素结合肽(其结合链霉亲和素的生物素结合位点)为例,第一游离伴侣可为相应的游离链霉亲和素结合肽或竞争性结合的类似物。此类类似物可为例如生物素或生物素衍生物,例如脱硫生物素。
某些方面,成为可逆可以是因为链霉亲和素结合肽(如Strep-标签)与链霉亲和素突变蛋白结合性反应剂之间连键的亲和力虽高但是低于链霉亲和素结合性反应剂与生物素或生物素类似物的亲和力。因此,某些实施方式中,可加入生物素(维生素H)或生物素类似物用于破坏链霉亲和素突变蛋白结合性反应剂(如固体支持物(如珠或色谱基质)上)与链霉亲和素结合肽(如Strep-标签)之间的结合反应。在一些实施方式中,在低浓度的生物素或类似物的存在下,例如在0.1mM-10mM,0.5mM-5mM或1mM-3mM,例如一般至少或约至少1mM或至少2mM,例如是或约是2.5mM的生物素或类似物的存在下,所述相互作用是可逆的。在一些实施方式中,竞争剂如生物素或生物素类似物存在下进行孵育使得选定细胞从固体支持物(如色谱柱或珠)上释放。
在一些实施方式中,由于一种或多种可逆结合的作用剂从细胞表面分子解离,本文方法的优点还包括:在刺激过程结束时,受刺激细胞群不含结合剂(如变得结合剂、选择剂或刺激剂)。并且,在一些实施方式中,方法所用全部其他反应剂,即作用剂(例如第一或第二作用剂、受体结合剂、例如刺激剂、或选择剂)以及结合伴侣C(例如C1)的竞争性反应剂或其类似物可从经刺激的细胞群轻易去除。
某些实施方式中,分离/去除组分(如竞争性反应剂)可用第二固定相进行。为此,对包含靶细胞(例如T细胞)和/或病毒颗粒和一种或多种其他组分的基质进行第二固定相上的色谱,这可以是例如在如前所述上样到第一固定相之前或之后。该第二固定相可为凝胶过滤基质和/或亲和色谱基质,其中该凝胶过滤和/或亲和色谱基质包含亲和反应剂。包含在色谱树脂上的亲和反应剂包括(特异性)结合反应剂(如链霉亲和素突变蛋白如Strep-Tactin)结合位点Z的结合伴侣D,从而令结合性分子反应剂固定到固定相上。在一些实施方式中,亲和反应剂可为例如链霉亲和素、链霉亲和素突变蛋白、亲和素、亲和素突变蛋白或其混合物。在一些实施方式中,作用剂(例如第一或第二作用剂、受体结合剂,如刺激剂或选择剂)和/或竞争性反应剂结合亲和反应剂从而固定到色谱基质上。某些方面,如果采用基于链霉亲和素的分子反应剂(如Strep-Tactin)且与之结合的作用剂含链霉亲和素结合肽(如Strep-标签),则第二固定相上亲和反应剂所含结合伴侣D可以是生物素。然后,组合物中其余链霉亲和素或链霉亲和素突变蛋白结合生物素,生物素通常共价偶联于色谱基质(如市售biotin-sepharose
某些此类实施方式中,可将靶细胞(如基因改造(如转导)的T细胞)与反应剂分离收获。
于是,含培养细胞(如经分离、选择、转导、活化和/或扩增的细胞群)的样品不含作用剂(如第一第二作用剂等,如病毒结合剂、选择剂或受体结合剂,如刺激剂,或选择性)且/或不含竞争性物质。在一些实施方式中,培养物组合物不含任何反应性物质,这有时就与某些应用例如细胞治疗类应用的联用而言是有利的。
某些实施方式中,用于破坏或逆转作用剂与反应剂之间结合的竞争性物质可方便地用“去除盒(removal cartridge)”(见WO2013/124474)从刺激细胞群中去除。某些情形中,例如在多聚化反应剂固定于固体支持物(例如生物反应器表面或磁珠)上的情况下,反应剂被牵制(held back)。因此,使用去除盒来去除游离作用剂和竞争性反应剂可包括:将洗脱样品(例如破坏可逆结合后获得的样品)加载到第二色谱柱上。在一些实施方式中,该色谱柱具有合适的固相,该固相既是亲和色谱基质,同时也能用作凝胶渗透基质。某些方面,该亲和色谱基质具有固定于其上的亲和反应剂。在一些实施方式中,亲和反应剂可为例如链霉亲和素、链霉亲和素突变蛋白、亲和素、亲和素突变蛋白或其混合物。
在一些实施方式中,色谱基质是凝胶过滤基质,例如当如本文所述用于去除盒中时。通常,凝胶过滤的特征在于其设计目的。因此,凝胶过滤基质在某些方面主要基于细胞或其他生物实体的尺寸实现对它们的分离。这些方面中,相应色谱基质通常是如上所述的微粒状多孔材料。色谱基质可具有一定的排除极限,通常用分子量定义,即大于该极限的分子绝对不进入孔中。在一些实施方式中,界定尺寸排阻极限的相应分子量可选择为小于相应的靶细胞。此类该实施方式中,靶细胞被阻止进入尺寸排阻色谱基质的孔中。类似地,固定相可具有尺寸小于所选靶细胞的孔。在示例性实施方式中,色谱基质的平均孔径为0~约500nm。
在一些实施方式中,样品中存在的组分如作用剂(如病毒结合剂、受体结合剂或选择剂)或竞争性反应剂小于孔的排阻极限,因此能够进入色谱基质的孔中。某些方面,能够部分或全部进入孔容的此类组分中,分子越大进孔越少于是先洗脱,而最小的分子通常最后被洗脱。在一些实施方式中,色谱基质的排阻极限可选为低于靶细胞的最大宽度。因此,某些方面,进入孔容的组分比靶细胞在色谱基质中/上滞留更久。因此,在一些情况中,可从色谱柱的洗脱物中收集与样品中其他物质/组分分离的靶细胞。因此,某些方面,组分如作用剂(如受体结合剂或选择剂)或适当加入的竞争性反应剂从凝胶过滤基质中洗脱的时间点可迟于靶细胞。在一些实施方式中,该效果可被进一步增强,例如凝胶渗透基质包含反应剂(例如共价结合于其上)且该反应剂具有能结合作用剂(例如受体结合剂或选择剂)和/或样品中的竞争性反应剂的结合位点Z的情形。在一些情况中,作用剂(例如受体结合剂或选择剂)和/或竞争性反应剂可通过与反应剂的结合位点Z结合固定到基质上。某些方面,该方法在去除盒中进行。
在一些实施方式中,提供了一种设备,其包含至少一个第一固定相和第二固定相的组合,例如用于选择细胞的色谱柱(选择盒)和用于去除反应剂的第二色谱柱(去除盒)。该设备可包括串联流体相连的多个第一和第二固定相(色谱柱)组合。该设备可包括样品入口,该入口与第一和第二固定相的第一组合中的第一固定相流体连通。某些实施方式中,该设备还可包含细胞的样品出口,该样品出口与至少一个第一第二色谱固定相组合中最后一个组合中的第二固定相流体连通。某些方面,该设备还可包括竞争性反应剂容器,其与第一第二固体相组合中的至少一个第一固体相流体连通。
在一些实施方式中,从组合物中去除反应剂和其他组分的能力还具有能够避免任何固体支持物(例如磁珠)的优点。在一些实施方式中,这意味着消除或尽可能降低靶细胞(例如基因改造(如转导)T细胞)被磁珠污染的风险。在一些实施方式中,这也意味着与其他方法相比,例如与采用Dyna珠而需采取额外措施来确保最终的扩增T细胞群不含磁珠相比,更易于建立符合GMP标准的工艺。
B.结合剂
某些实施方式中,作用剂(如受体结合剂、选择剂、病毒载体颗粒结合剂)具有一个或多个结合位点用于结合生物颗粒(如细胞、微生物或变得)上的分子。在一些实施方式中,作用剂(例如受体结合剂或选择剂)具有用于结合细胞表面上的分子(例如细胞表面分子)的一个或结合位点B。某些实施方式中,作用剂(如病毒载体颗粒结合剂)有一个或多个结合位点V用于结合病毒颗粒表面分子。因此,某些情形中,作用剂(如总体结合剂或选择剂)具有一个结合位点(如B或V)或多个结合位点(如多个结合位点B或V),其中,作用剂与生物颗粒表面分子之间的特异性结合包括一个或多个结合位点(如B或V)与所述分子间的相互作用。
在一些实施方式中,作用剂仅有单个结合位点,即为单价。某些实施方式中,作用剂有至少两个如多个能够结合所述分子的结合位点,包括三个、四个或五个。某些情形中,结合位点是B,作用剂(如受体结合剂或选择剂)具有多个能够结合所述分子的结合位点B,包括两个、三个、四个或五个,例如B1、B2、B3等。在一些此类方面中,所述至少两个或更多结合位点B可相同。在一些实施方式中,一个或多个所述至少两个或更多结合位点B可不同(例如B1和B2)。某些实施方式中,结合位点是V,作用剂(如病毒颗粒结合剂)具有多个能够结合病毒载体颗粒表面分子的结合位点V,包括两个、三个、四个或五个,例如V1、V2、V3等。有时所述至少两个或更多结合位点V可相同。在一些实施方式中,至少两个或更多结合位点V中的一个或多个可不同(例如V1和V2)。某些实施方式中,结合位点(如B或V)具有一个抗体结合位点(如一个或多个互补决定区(CDR))或至少两个所述抗体结合位点。
在一些实施方式中,一种或多种不同作用剂(例如一种或多种不同受体结合剂、选择剂或结合细胞上分子的其他作用剂与反应剂可逆结合。在一些实施方式中,至少2、3、4或更多种不同作用剂与相同的反应剂可逆结合。在一些实施方式中,至少两种不同作用剂与相同的反应剂可逆结合,由此各反应剂包含一个结合位点B或多个结合位点B用于所述作用剂和所述分子之间的特异性结合。在一些实施方式中,所述至少两种或更多种作用剂包含相同的结合位点B,例如用于结合相同或基本相同的分子。在一些实施方式中,所述至少两种或更多种作用剂包含不同结合位点B,例如用于结合不同的分子。在一些实施方式中,第一作用剂(例如第一受体结合剂或第一选择剂)包含结合位点B1、B2、B3、B4等,第二作用剂(例如第二受体结合剂或第二选择剂)包含其他结合位点B1、B2、B3、B4等。在一些实施方式中,第一作用剂(例如第一选择剂)包含结合位点B1,第二作用剂(例如第二选择剂)包含结合位点B3。在一些实施方式中,第一作用剂(例如第一受体结合剂)包含结合位点B2,第二作用剂(例如第二受体结合剂)包含结合位点B4。在任何此类实施方式中,第一作用剂和第二作用剂可包含结合伴侣,C1或C2。在一些实施方式中,C1和C2可相同。在一些实施方式中,C1和C2不同。在一些实施方式中,第一作用剂和第二作用剂包含相同的结合伴侣C1。
某些情形中,之间的解离常数(K
在一些实施方式中,作用剂通过结合位点B或V与分子结合的解离发生得足够迅速从而使得生物颗粒(如靶细胞或病毒颗粒)在反应剂和作用剂之间的可逆连键被破坏后仅被瞬时染色或与反应剂关联。在一些情况中,当用k
在一些实施方式中,该键的K
某些方面,作用剂(例如受体结合剂或选择试剂)所针对的分子可以是细胞表面分子。在一些实施方式中,细胞表面分子是肽或蛋白质,例如受体,如膜受体蛋白。在一些实施方式中,受体为脂质、多糖或核酸。在一些实施方式中,细胞表面分子为蛋白质,其可为外周膜蛋白或整合膜蛋白。在一些实施方式中,细胞表面分子可具有一个或多个跨膜结构域。作为一些示例性例子,具有跨膜结构域的膜蛋白可为:G蛋白偶联受体,例如气味受体,视紫红质受体、视紫红质信息素受体,肽激素受体、味觉受体、GABA受体、鸦片受体,血清素受体,Ca
在一些实施方式中,细胞表面分子可为定义所需细胞群或亚群的抗原,所述细胞群或亚群例如血细胞如淋巴细胞(例如T细胞、辅助T细胞,如CD4+辅助T细胞,B细胞或自然杀伤细胞)、单核细胞或干细胞,例如CD34+外周干细胞或表达Nanog或Oct-4的干细胞群或亚群。T细胞的例子包括如下细胞:例如CMV特异性CD8+T淋巴细胞、细胞毒性T细胞、记忆T细胞和调节T细胞(Treg)。Treg的示例性例子为CD4 CD25 CD45RA Treg细胞,记忆T细胞的示例性例子是CD62L CD8+特异性中心记忆T细胞。细胞表面分子可为肿瘤细胞标志物。
某些实施方式中,作用剂(如病毒颗粒载体结合剂)所针对的分子可以是细胞病毒表面分子。例如以下所述。
如前所述,某些实施方式中,结合位点B或V之外,作用剂(如受体结合剂、选择剂或病毒载体颗粒结合剂)具有结合伴侣C。某些方面,结合伴侣C能够结合反应剂的结合位点Z,其中,反应剂具有针对结合伴侣C的一个或多个结合位点。在一些实施方式中,作用剂(例如受体结合剂或选择试剂)中的结合伴侣C与一个或多个结合位点Z之间可形成非共价键,该共价键可为任何强度和亲和力,且可在实施该方法的条件下被破坏或逆转。作用剂(例如受体结合剂、选择剂和/或病毒载体颗粒结合)可包括至少1个、至少2个、3个或更多个其他结合伴侣C,反应剂可包括至少2个,例如3、4、5、6、7、8或更多个针对作用剂(例如受体结合剂或选择剂)所含结合伴侣C的结合位点Z。如美国专利7,776,562、美国专利8,298,782或国际专利申请公开号号WO 2002/054065中所述,可选择结合伴侣和具有一个或多个相应结合位点Z的反应剂的任何组合,例如使得结合伴侣C和结合位点Z能够在复合物中可逆结合,以例如产生亲合力(avidity)效果。
中译文(例如受体结合剂、选择剂或病毒载体颗粒结合剂)所含结合伴侣C可例如基于烃的(包括聚合的),且包括氮-、磷-、硫-、碳-、卤素-或拟卤素基团。某些方面,其可为醇、有机酸、无机酸、胺、膦、硫醇、二硫化物、烷烃、氨基酸、肽、寡肽、多肽、蛋白质、核酸、脂质、糖、寡糖或多糖。作为进一步的例子,其还可为阳离子、阴离子、聚阳离子、聚阴离子、聚合阳离子、电解质、聚电解质、碳纳米管或碳纳米泡沫。通常,该结合伴侣C对反应剂结合位点的亲和力高于对其他物质的亲和力。相应结合伴侣C的例子包括但不限于冠醚、免疫球蛋白、其片段和具有抗体样功能的蛋白质类结合分子。
在一些实施方式中,作用剂(如受体结合剂、选择剂或病毒载体颗粒结合剂)中所含结合伴侣C包括生物素,反应剂包括可逆结合生物素的链霉亲和素类似物或亲和素类似物。在一些实施方式中,作用剂所含结合伴侣C包括可逆结合链霉亲和素或亲和素的生物素类似物,反应剂包括可逆结合相应生物素类似物的链霉亲和素、亲和素、链霉亲和素类似物或亲和素类似物。在一些实施方式中,作用剂所含结合伴侣C包括链霉亲和素或亲和素结合肽,反应剂包括可逆结合相应链霉亲和素或亲和素结合肽的链霉亲和素、亲和素、链霉亲和素类似物或亲和素类似物。
在一些实施方式中,反应剂是链霉亲和素,例如前文所述链霉亲和素突变蛋白(如SEQ ID NO:3-6所示),作用剂(例如受体结合剂或选择剂)所含结合伴侣C可包括链霉亲和素结合肽。在一些实施方式中,链霉亲和素结合肽可包含SEQ ID NO:9所示通式的序列,例如包含SEQ ID NO:10所示序列。在一些实施方式中,肽序列具有SEQ ID NO:11所示的通式,例如SEQ ID NO:12所示。在一个实施例中,肽序列为Trp-Arg-His-Pro-Gln-Phe-Gly-Gly(也称
在一些实施方式中,链霉亲和素结合肽可被进一步修饰。在一些实施方式中,链霉亲和素结合肽可包括肽序列Trp-Ser-His-Pro-Gln-Phe-Glu-Lys(也称
在一些实施方式中,作用剂(如受体结合剂、选择剂和/或病毒载体颗粒结合剂)的结合伴侣C包括本领域技术人员已知作为亲和标签的部分。此类实施方式中,反应剂可包括已知结合该亲和标签的相应结合伴侣,例如抗体或抗体片段。作为已知亲和标签的一些示例性例子,作用剂(例如受体结合剂或选择试剂)所含结合伴侣C可包括:二硝基苯酚或地高辛、寡聚组氨酸、多聚组氨酸、免疫球蛋白结构域、麦芽糖结合蛋白、谷胱甘肽-S-转移酶(GST)、甲壳素结合蛋白(CBP)或硫氧还蛋白、钙调蛋白结合肽(CBP)、FLAG-肽、HA-标签(序列:Tyr-Pro-Tyr-Asp-Val-Pro-Asp-Tyr-Ala)(SEQ ID NO:20)、VSV-G-标签(序列:Tyr-Thr-Asp-Ile-Glu-Met-Asn-Arg-Leu-Gly-Lys)(SEQ ID NO:21)、HSV-标签(序列:Gln-Pro-Glu-Leu-Ala-Pro-Glu-Asp-Pro-Glu-Asp)(SEQ ID NO:22)、T7表位(Ala-Ser-Met-Thr-Gly-Gly-Gln-Gln-Met-Gly)(SEQ ID NO:23)、麦芽糖结合蛋白(MBP)、单纯疱疹病毒糖蛋白D的序列Gln-Pro-Glu-Leu-Ala-Pro-Glu-Asp-Pro-Glu-Asp(SEQ ID NO:24)的HSV表位、序列为Glu-Gln-Lys-Leu-Ile-Ser-Glu-Glu-Asp-Leu(SEQ ID NO:25)的转录因子c-myc的“myc”表位、V5-标签(序列:Gly-Lys-Pro-Ile-Pro-Asn-Pro-Leu-Leu-Gly-Leu-Asp-Ser-Thr)(SEQ ID NO:26)、或谷胱甘肽-S-转移酶(GST)。在此类实施方式中,反应剂(可为抗体或抗体片段)的一个或多个结合位点Z和抗原之间形成的复合物能通过加入游离抗原(即游离肽(表位标签))或游离蛋白质(例如MBP或CBP)被竞争性破坏。在一些实施方式中,亲和标签还可为寡核苷酸标签。在一些情况中,该寡核苷酸标签可例如用于杂交反应剂中所连接或包含的具有互补序列的寡核苷酸。
适合的结合伴侣C的其他例子包括但不限于:凝集素、蛋白A、蛋白G、金属、金属离子、次氮基三乙酸衍生物(NTA)、RGD-基序、葡聚糖、聚乙烯亚胺(PEI)、氧化还原聚合物、糖蛋白、适体、染料、直链淀粉、麦芽糖、纤维素、甲壳素、谷胱甘肽、钙调蛋白、明胶、多粘菌素、肝素、NAD、NADP、赖氨酸、精氨酸、苄脒、多聚U、或寡聚-dT.凝集素(例如伴刀豆蛋白A)已知可结合多糖或糖基化蛋白。染料的示例性例子是三嗪染料染料,例如Cibacron蓝F3G-A(CB)或Red HE-3B,其特异性结合NADH依赖性酶类。通常,Green A结合Co A蛋白、人血清白蛋白以及脱氢酶。在一些情况中,染料7-氨基放线菌素D和4’,6-二脒基-2苯基吲哚结合DNA。通常,金属(例如Ni、Cd、Zn、Co或Cu)的阳离子常被用于结合亲和标签,例如包含寡聚组氨酸的序列,包括六组氨酸或His-Asn-His-Arg-His-Lys-His-Gly-Gly-Gly-Cys标签(MAT标签)(SEQ ID NO:35)和N-甲基丙烯酰基-(L)-半胱氨酸甲酯。
在一些实施方式中,作用剂(如受体结合剂、选择剂或病毒载体颗粒结合剂)所含结合伴侣C与反应剂的一个或多个结合位点Z之间的结合在二价、三价或四价阳离子的存在下发生。就此而言,在一些实施方式中,反应剂包括二价、三价或四价阳离子,通常由合适的螯合剂保持(例如络合)。在一些实施方式中,作用剂(例如受体结合剂或选择剂)所含结合伴侣C可包括含(例如络合有)二价、三价或四价阳离子的部分。相应金属螯合剂的例子包括但不限于:乙二胺、乙二胺四乙酸盐(EDTA)、乙二醇四乙酸(ETGA)、二亚乙基三胺五乙酸(DTPA)、N,N-双(羧甲基)甘氨酸(也称次氮基三乙酸,NTA)、l,2-双(邻氨基苯氧基)乙烷-N,N,N’,N’-四乙酸(BAPTA)、2,3-二巯基-1-丙醇(二巯基丙醇)、卟吩和亚铁血红素。作为例子,EDTA形成包含大部分单价、二价、三价和四价金属离子(例如银(Ag
在一些实施方式中,反应剂(例如受体结合剂、选择剂和/或病毒载体颗粒结合剂)所含结合伴侣C包括钙调蛋白结合肽,反应剂包括多聚化钙调蛋白,例如美国专利5,985,65中所描述。在一些实施方式中,作用剂(如受体结合剂、选择剂和/或病毒载体颗粒结合剂)所含结合伴侣C包括FLAG肽,反应剂包括结合FLAG肽的抗体,例如结合单克隆抗体4E11的FLAG肽,如美国专利4,851,341中所述。在一个实施方式中,作用剂(如受体结合剂、选择剂和/或病毒载体颗粒结合剂)所含结合伴侣C包括寡聚组氨酸标签,反应剂包括结合该寡聚组氨酸标签的抗体或过渡金属离子。在一些情况中,对所有这些结合复合物的破坏可通过金属离子螯合(例如钙螯合,如通过加入EDTA或EGTA)完成在一些实施方式中,钙调蛋白、抗体(例如4E11)或螯合的金属离子或游离螯合剂可通过常规方法多聚化,例如在第一步中基本如Noguchi,A等,Bioconjugate Chemistry(1992)3,132-137所述,通过生物素化以及与链霉亲和素或亲和素或其寡聚物的络合,或通过在多糖(例如葡聚糖)中引入羧基残基,并在第二步中采用常规的碳二亚胺化学法,通过伯氨基团将钙调蛋白或抗体或螯合的金属离子或游离螯合剂连接于多糖(如葡聚糖)骨架中的羧基。在一些此处的实施方式中,作用剂(例如受体结合剂或选择剂)所含结合伴侣C与反应剂的一个或多个结合位点Z之间的结合通过金属离子螯合被破坏。金属螯合可例如通过加入EGTA或EDTA完成。
在一些实施方式中,特异性结合所述分子的作用剂的一个或多个结合位点B或V可以来自抗体、其片段、或具有抗体样功能的蛋白质类结合分子。在一些实施方式中,作用剂的结合位点B或V是抗体结合位点,例如是或会抗体的一个或多个互补决定区(CDR)。(重组)抗体片段的例子包括但不限于:Fab片段、Fv片段、单链Fv片段(scFv)、二价抗体片段,例如F(ab)
在一些实施方式中,作用剂(如受体结合剂、选择剂或病毒载体颗粒结合剂)可具有单个结合位点B或V,即其可为单价。单价作用剂的例子包括但不限于:单价抗体片段、具有抗体样结合特性的蛋白质类结合分子或MHC分子。单价抗体片段的例子包括但不限于:Fab片段、Fv片段、单链Fv片段(scFv),包括二价单链Fv片段。
在一些实施方式中,作用剂为抗体或其抗原结合片段,例如Fab片段、Fv片段、单链Fv片段(scFv)、二价抗体片段,如F(ab)
某些方面,作用剂(例如受体结合剂、选择剂或病毒载体颗粒结合剂)可为单价,例如包含单价抗体片段或单价人工结合分子(蛋白质类或其他),例如基于脂质运载蛋白家族多肽的突变蛋白(也称“
具有抗体样功能的蛋白质类结合分子的例子包括基于脂质运载蛋白家族多肽的突变蛋白(参见例如WO 03/029462,Beste等,Proc.Natl.Acad.Sci.U.S.A.(1999)96,1898-1903)。通常,脂质运载蛋白,如胆汁三烯结合蛋白(bilin binding protein)、人嗜中性粒细胞明胶酶相关脂质运载蛋白、人Apo脂质蛋白D或人泪液脂质运载蛋白,具有的天然配体结合位点可被修饰的从而使其结合所定目标。可用作特异性结合细胞表面分子的作用剂(例如受体结合剂或选择剂)的具有抗体样功能的蛋白质类结合分子的其他例子包括但不限于:所谓的糖体(参见例如国际专利申请公开号WO 96/23879)、基于锚蛋白骨架的蛋白质(Mosavi,L.K.等,Protein Science(2004)13,6,1435-1448)或基于晶体骨架的蛋白质(例如国际专利申请公开号WO 01/04144)、Skerra所描述的蛋白质(J.Mol.Recognit.(2000)13,167-187)、阿迪连接素(AdNectins)、四连接素和阿维多聚体(avimers)。通常,包括由人受体结构域家族的外显子改组而成的多价阿维多聚体蛋白的阿维多聚体包含所谓的A-结构域,该结构域在数种细胞表面受体中呈现为为多个结构域的串(Silverman,J.等,NatureBiotechnology(2005)23,1556-1561)。阿迪连接素(通常衍生自人纤连蛋白结构域)代表性地包含3个环,其可被工程化改造用于免疫球蛋白样结合靶标(Gill,D.S.&Damle,N.K.,Current Opinion in Biotechnology(2006)17,653-658)。四连接素(通常衍生自相应的人同三聚蛋白)同样代表性地在C型连接素结构域中包含环结构域,其可被工程化改造用于所需的结合。在某些情况中可用作蛋白质配体的类肽通常为寡聚(N-烷基)甘氨酸,其与肽的去边在于侧链与酰胺氮连接而非与碳原子连接。类肽通常耐受蛋白酶和其他修饰酶,且可比肽具有高得多的细胞穿透性(参见例如Kwon,Y.-U.和Kodadek,T.,J.Am.Chem.Soc.(2007)129,1508-1509)。
合适的蛋白质类结合分子的其他例子包括但不限于:EGF样结构域、环状(Kringle)结构域、I型纤连蛋白结构域、II型纤连蛋白结构域、III型纤连蛋白结构域、PAN结构域、Gla结构域、SRCR结构域、库尼茨(Kunitz)/牛胰蛋白酶抑制剂结构域、淀粉酶抑肽、Kazal型丝氨酸蛋白酶抑制剂结构域、三叶草(P型)结构域、C型血管性血友病因子结构域、过敏毒素样结构域、CUB结构域、I型甲状腺球蛋白重复、LDL受体A类结构域、寿司(Sushi)结构域、连接(Link)结构域、I型血小板反应蛋白结构域、免疫球蛋白结构域或免疫球蛋白样结构域(例如结构域抗体或骆驼重链抗体)、C型连接素结构域、MAM结构域、A型血管性血友病因子结构域、生长调节素B结构域、WAP型四二硫化物核心结构域、C型F5/8结构域、血液结合素结构域、SH2结构域、SH3结构域、层连蛋白型EGF样结构域、C2结构域、“κ体(Kappabodies)”(Ill等,Protein Eng(1997)10,949-57)、所谓“迷你体”(Martin等,EMBO J(1994)13,5303-5309)、双抗体(Holliger等,PNAS USA(1993)90,6444-6448)、所谓“Janusis”(Traunecker等,EMBO J(1991)10,3655-3659或Traunecker等,Int J Cancer(1992)增刊7,51-52)、纳米体、微体、粘合素(affilin)、亲和体、绳结蛋白(knottin)、泛素、锌指蛋白、自荧光蛋白或富亮氨酸重复蛋白。在一些实施方式中,具有抗体样功能的核酸分子可为适体。通常,适体折叠成确定的三维基序,并对给定目标结构具有高亲和力。
1.受体结合剂
在一些实施方式中,作用剂为受体结合剂。在一些实施方式中,受体结合剂结合于细胞表面上的分子(例如受体),该作用剂与该分子之间的结合能够诱导或调节细胞中的信号。在一些情况中,细胞表面分子(例如受体)是信号转导分子。在一些此类情况中,受体结合剂能够特异性结合由一个或多个细胞表达的信号转导分子。在一些情况中,受体结合分子是刺激剂,其可为结合细胞表面分子(例如受体)时能够诱导细胞(例如T细胞)中信号的任何作用物。在一些实施方式中,信号可为免疫刺激信号,在该情况中,受体结合剂或刺激剂能够诱导或调控涉及或刺激细胞(例如T细胞)免疫应答的信号,所述免疫应答为例如增强免疫细胞增殖或扩增、免疫细胞活化、免疫细胞分化、细胞因子分泌、细胞毒活性或免疫细胞的一种或多种其他功能性活性。在一些实施方式中,信号可为抑制性信号,在该情况中,受体结合剂或刺激剂能够诱导或调控细胞(例如T细胞)中参与或抑制免疫应答的信号,例如抑制或减少免疫细胞增殖或扩增、免疫细胞活化、免疫细胞分化、细胞因子分泌、细胞毒活性或免疫细胞的一种或多种其他功能性活性。
在一些实施方式中,受体结合剂是第一受体结合剂。某些方面,第一受体结合剂结合细胞表面的受体分子。因此,某些情形中,第一受体结合剂诱导或调控信号。某些方面,第一受体结合剂的信号诱导或调控影响细胞活化、刺激和/或扩增(增殖)。因此,某些情形中,第一受体结合剂向细胞提供主活化,从而活化细胞。
某些实施方式中,细胞群可以是淋巴细胞群,包括B细胞群、T细胞群或自然杀伤细胞群。细胞群的的示例性例子是带有CD40或CD137的B细胞(两种细胞群可在仅结合提供活化信号的第一作用剂如4-1BB配体;αCD40抗体分子或αCD137抗体分子时活化(参见例如Zhang等,2010,J Immunol,184:787-795))。可用于B细胞扩增的作用剂(第一或第二)的其他示例性例子为结合IgG、CD19、CD28或CD14的作用剂,例如αCD19、αIgG、αCD28或αCD14抗体分子或其抗原结合片段。还可想见,用于B细胞扩增的第一或第二作用剂可包括针对toll样受体或白介素(例如IL-21)的配体(参见例如Dienz O等,2009.J.Exp.Med.206:69)。尤其,本发明还包括脂多糖依赖性B细胞活化,因为脂多糖也可用作第一作用剂,且能配置本文所用的结合伴侣C1。
适合的细胞群的其他示例性例子包括:第一作用剂与TCR/CD3结合且第二作用剂与T细胞上辅助分子(例如CD28)结合而活化后扩增的T细胞群。此外,第一作用剂刺激T细胞中TCR/CD3复合物相关信号,第二作用剂通过结合作为辅助分子的CD28提供第二刺激物。可用于T细胞扩增的试剂还可包括白介素,例如IL-2、IL-7、IL-15或IL-21(参见例如Cornish等,2006,Blood.108(2):600-8,Bazdar和Sieg,2007,Journal of Virology,2007,81(22):12670-12674,Battalia等,2013,Immunology,139(1):109-120)。可用于T细胞扩增的试剂的其他示例性例子是结合CD8、CD45或CD90的试剂,例如αCD8、αCD45或αCD90抗体。T细胞群的示例性例子包括:抗体特异性T细胞、辅助T细胞、细胞毒性T细胞、记忆T细胞(记忆T细胞的示例性例子是CD62L
适合的细胞群的其他示例性例子包括:自然杀伤细胞(NK细胞),其可例如用结合CD16或CD56的作用剂(例如αCD16或αCD56抗体)扩增。此类αCD16抗体的示例性例子是抗体3G8,其VH序列如SEQ ID NO:36所示,VL序列如SEQ ID NO:37所示(参见例如Hoshino等,Blood.1991年12月15日;78(12):3232-40.)。可用于NK细胞扩增的其他试剂可为IL-15(参见例如Vitale等,2002.The Anatomical Record.266:87-92)。适合的细胞群的其他示例性例子包括单核细胞,例如,其可用结合CD14的作用剂(例如αCD14抗体分子)扩增。
在一些实施方式中,第一受体结合剂能够在细胞例如T细胞中刺激TCR/CD3复合物相关的信号。某些方面,第一受体结合剂可为特异性结合CD3的结合剂。某些情形中,特异性结合于CD3的第一受体结合剂可选自:抗CD3抗体、抗CD3抗体的二价抗体片段、抗CD3抗体的单价抗体片段、以及具有抗体样结合特性的蛋白质类CD3结合分子。二价抗体片段可为(Fab’)
在一些实施方式中,抗CD3 Fab片段可衍生自由淋巴瘤细胞系OKT3(
某些实施方式中,受体结合剂是第二受体结合剂。此外,第二受体结合剂结合细胞表面分子,例如受体分子。在一些实施方式中,第二受体结合剂能够增强、减弱或改变通过第一分子递送的信号。在一些实施方式中,第二受体结合试剂诱导或调控例如第二信号或其他信号。某些方面,第二受体结合剂可增强或强化第一受体结合剂传递的信号。在一些实施方式中,第二受体结合试剂结合辅助分子和/或在细胞内刺激或诱导辅助或第二信号。某些方面,第二受体结合剂结合共刺激分子和/或提供共刺激信号。
某些实施例中,受体结合剂(可以是第二受体结合剂)结合(例如特异性结合)第二分子(可以是辅助分子、细胞因子受体、趋化因子受体、免疫哨点或TFN家族或TNF受体家族的成员)。
在一些实施方式中,细胞(例如T细胞)表面上的分子可为CD28,而受体结合剂(例如其可为第二受体结合剂)特异性结合CD28。某些方面,特异性结合CD28的受体结合剂(例如可以是第二受体结合剂)可选自:抗CD28抗体、抗CD28抗体的二价抗体片段、抗CD28抗体的单价抗体片段、以及具有抗体样结合特性的蛋白质类CD28结合分子。二价抗体片段可为F(ab’)
在一些实施方式中,抗CD28 Fab片段可衍生自抗体CD28.3(合成单链Fv构建体,GenBank登录号号AF451974.1;还可参见Vanhove等,BLOOD,2003年7月15日,第102卷,第2期,第564-570页),其重链和轻链分别包含SEQ ID NO:33和34。
在一些实施方式中,细胞(例如T细胞或B细胞)表面上的分子可为CD137,而受体结合剂(例如可以是第二受体结合剂)特异性结合CD137。某些方面,特异性结合于CD137的受体结合剂(例如可以是第二受体结合剂)可选自:抗CD137抗体、抗CD137抗体的二价抗体片段、抗CD137抗体的单价抗体片段、以及具有抗体样结合特性的蛋白质类CD137结合分子。
在一些实施方式中,细胞(例如T细胞)表面上的分子可为CD40,而受体结合剂(例如其可为第二受体结合剂)特异性结合CD40。某些方面,特异性结合CD40的受体结合剂(其可为第二受体结合剂)可选自下组:抗CD40抗体、抗CD40抗体的二价抗体片段、抗CD40抗体的单价抗体片段、以及具有抗体样结合特性的蛋白质类CD40结合分子。
以上任一例举中,二价抗体片段可为F(ab’)
某些方面,受体结合剂(例如刺激剂)特异性靶向靶细胞表面表达分子,所述分子为TCR或嵌合抗原受体。例如,靶细胞表面表达分子选自:T细胞或B细胞抗原受体复合物、CD3链、CD3ζ、T细胞受体或B细胞受体的抗原结合部分、或嵌合抗原受体。在一些情况中,受体结合剂靶向肽:MHC-I复合物。
在一些实施方式中,刺激剂结合靶细胞表面表达分子带His标签的胞外结构域。在一些情况中,刺激剂包含肽序列Trp-Ser-His-Pro-Gln-Phe-Glu-Lys(也称
某些方面,受体结合剂(例如刺激剂)特异性结合重组受体(例如CAR)的抗体部分。在一些情况中,重组受体的抗体部分包括免疫球蛋白恒定区的至少部分,如铰链区如IgG4铰链区和/或CH1/CL和/或Fc区。在一些实施方式中,恒定区或部分是人IgG的,例如IgG4或IgG1的。在一些情况中,反应剂加载有识别IgG4间隔子的αIgG。
2.选择性作用剂
在一些实施方式中,作用剂是选择性作用剂。在一些实施方式中,选择性作用剂结合细胞表面上的分子例如细胞表面分子。在一些情况中,细胞表面分子是选择标志物。在一些此类情况中,选择剂能够特异性结合一个或多个细胞表达的选择标志物。在一些实施方式中,一种或多种选择剂可逆结合反应剂,可用于促进细胞的选择或分离。
某些方面,细胞表面分子可为定义所需细胞群或亚群的抗原,所述细胞群或亚群为例如血细胞群或亚群,如淋巴细胞(例如T细胞、辅助T细胞,如CD4+辅助T细胞,B细胞或自然杀伤细胞)、单核细胞或干细胞,例如CD34+外周干细胞或表达Nanog或Oct-4的干细胞群或亚群。在一些实施方式中,选择标志物可为T细胞或T细胞亚组表面表达标志,例如CD25、CD28、CD62L、CCR7、CD27、CD127、CD3、CD4、CD8、CD45RA和/或CD45RO。T细胞的例子包括如下细胞:例如CMV特异性CD8+T淋巴细胞、细胞毒性T细胞、记忆T细胞和调节T细胞(Treg)。Treg的示例性例子包括CD4 CD25 CD45RA Treg细胞,记忆T细胞的示例性例子包括CD62L CD8+特异性中心记忆T细胞。细胞表面分子(例如选择标志物)也可为肿瘤细胞标志。
在一些实施方式中,选择标志物可为CD4,且选择剂特异性结合CD4。某些方面,特异性结合CD4的选择剂可选自下组:抗CD4抗体、抗CD4抗体的二价抗体片段、抗CD4抗体的单价抗体片段、以及具有抗体样结合特性的蛋白质类CD4结合分子。在一些实施方式中,抗CD4抗体(例如二价抗体片段或单价抗体片段,如CD4 Fab片段)可衍生自抗体13B8.2或仍然特异性结合CD4的13B8.2功能活性突变体。例如,抗体13B8.2或m13B8.2的示例性突变体描述于美国专利号7,482,000、美国专利申请No.US2014/0295458或国际专利申请公开号号WO2013/124474;以及Bes,C等,J Biol Chem 278,14265-14273(2003)。命名为“m13B8.2”的突变Fab片段带有结合CD4的小鼠抗体13B8.2可变区,并且其恒定区包含人恒定CH1区,重链为γ型,轻链为κ型(如美国专利7,482,000中所述)。在一些实施方式中,抗CD4抗体(例如抗体13B8.2的突变体)在可变轻链中包含氨基酸置换H91A,在可变轻链中包含氨基酸置换Y92A、在可变重链中包含氨基酸置换H35A和/或在可变重链中包含氨基酸替代R53A,以上各自均按照Kabat编号。某些方面,与13B8.2 Fab片段的可变区相比,在m13B8.2中,轻链第91位的His残基(SEQ ID NO:30的第93位)突变为Ala,重链第53位的Arg残基(SEQ ID NO:29的第55位)突变为Ala。在一些实施方式中,可逆结合抗CD4或其片段的反应剂是市售或衍生自市售反应剂(例如目录号6-8000-206或6-8000-205或6-8002-100;IBA有限公司,德国哥廷根)。
在一些实施方式中,选择标志物可为CD8,且选择剂特异性结合CD8。某些方面,特异性结合CD8的选择剂可选自下组:抗CD8抗体、抗CD8抗体的二价抗体片段、抗CD8抗体的单价抗体片段、以及具有抗体样结合特性的蛋白质类CD8结合分子。在一些实施方式中,抗CD8抗体(例如二价抗体片段或单价抗体片段,如CD8 Fab片段)可衍生自抗体OKT8(例如ATCCCRL-8014)或仍然特异性结合CD8的其功能活性突变体。在一些实施方式中,可逆结合抗CD8或其片段反应剂是市售或衍生自市售可获得反应剂(例如目录号6-8003或6-8000-201;IBA有限公司,德国哥廷根)。
在一些实施方式中,选择标志物可为CD3,且选择剂特异性结合CD3。某些方面,特异性结合CD3的选择剂可选自下组:抗CD3抗体、抗CD3抗体的二价抗体片段、抗CD3抗体的单价抗体片段、以及具有抗体样结合特性的蛋白质类CD3结合分子。在一些实施方式中,抗CD3抗体(例如二价抗体片段或单价抗体片段,如CD3 Fab片段)可衍生自抗体OKT3(例如ATCCCRL-8001;参见例如Stemberger等,PLoS One.2012;7(4):e35798)或仍然特异性结合CD3的其功能活性突变体。在一些实施方式中,可逆结合抗CD3或其片段反应剂是市售或衍生自市售可获得反应剂(例如目录号6-8000-201、6-8001-100;IBA有限公司,德国哥廷根)。
在一些实施方式中,选择标志物可为CD25,且选择剂特异性结合CD25。某些方面,特异性结合CD25的选择剂可选自下组:抗CD25抗体、抗CD25抗体的二价抗体片段、抗CD25抗体的单价抗体片段、以及具有抗体样结合特性的蛋白质类CD25结合分子。在一些实施方式中,抗CD25抗体(例如二价抗体片段或单价抗体片段,如CD25 Fab片段)可衍生自抗体FRT5(参见例如Stemberger等,20128)或仍然特异性结合CD25的其功能活性突变体。在一些实施方式中,可逆结合抗CD4或其片段反应剂是市售或衍生自市售可获得反应剂(例如目录号6-8000-205或6-8000-207或6-8004-050;IBA有限公司,德国哥廷根)。
在一些实施方式中,选择标志物可为CD62L,且选择剂特异性结合CD62L。某些方面,特异性结合CD62L的选择剂可选自下组:抗CD62L抗体、抗CD62L抗体的二价抗体片段、抗CD62L抗体的单价抗体片段、以及具有抗体样结合特性的蛋白质类CD62L结合分子。在一些实施方式中,抗CD62L抗体(例如二价抗体片段或单价抗体片段,如CD25 Fab片段)可衍生自抗体DREG56(如ATCC HB300,见Stemberger等,2012)或仍然特异性结合CD62L的其功能活性突变体。在一些实施方式中,可逆结合抗CD62L或其片段反应剂是市售或衍生自市售可获得反应剂(例如目录号6-8000-204或6-8005-050;IBA有限公司,德国哥廷根)。
在一些实施方式中,选择标志物可为CD45RA,且选择剂特异性结合CD45RA。某些方面,特异性结合CD45RA的选择剂可选自下组:抗CD45RA抗体、抗CD45RA抗体的二价抗体片段、抗CD45RA抗体的单价抗体片段、以及具有抗体样结合特性的蛋白质类CD45RA结合分子。在一些实施方式中,抗CD45RA抗体(例如二价抗体片段或单价抗体片段,如CD45RA Fab片段)可衍生自抗体MEM56(如Millipore05-1413,见Stemberger等,2012)或仍然特异性结合CD45RA的其功能活性突变体。在一些实施方式中,可逆结合抗CD45RA或其片段的反应剂是市售或衍生自市售可获得反应剂(例如目录号6-8000-208或6-8007-050;IBA有限公司,德国哥廷根)。
在一些实施方式中,选择标志物可为CD45RO,而选择剂特异性结合CD45RO。某些方面,特异性结合CD45RO的选择剂可选自下组:抗CD45RO抗体、抗CD45RO抗体的二价抗体片段、抗CD45RO抗体的单价抗体片段、以及具有抗体样结合特性的蛋白质类CD45RO结合分子。在一些实施方式中,可逆结合抗CD45RO或其片段的反应剂是市售或衍生自市售反应剂(例如目录号6-8000-209或6-8012-020;IBA有限公司,德国哥廷根)。
在一些实施方式中,选择标志物可为CD154,而选择剂特异性结合CD154。某些方面,特异性结合CD154的选择剂可选自下组:抗CD154抗体、抗CD154抗体的二价抗体片段、抗CD154抗体的单价抗体片段、以及具有抗体样结合特性的蛋白质类CD154结合分子。在一些实施方式中,可逆结合抗CD154或其片段的反应剂是市售或衍生自市售反应剂(例如目录号6-8000-202或6-5510-050;IBA有限公司,德国哥廷根)。
3.病毒载体颗粒结合剂
某些实施方式中,作用剂是病毒载体颗粒结合剂(又称病毒颗粒结合剂等),结合病毒颗粒表面分子。某些实施方式中,反应剂(可以是寡聚体或多聚体,如多聚化反应剂)通过结合伴侣可逆结合病毒颗粒结合剂。某些实施方式中,结合伴侣是结合伴侣C(如C1),结合伴侣可逆结合反应剂上的结合位点Z(如Z1)。某些实施方式中,病毒颗粒结合剂具有结合病毒颗粒表面分子的结合位点V(如V1)。
某些实施方式中,病毒颗粒结合剂不是必需的,这样,病毒颗粒可以之间或间接结合反应剂。某些实施方式中,病毒颗粒具有表达在病毒表面的结合伴侣C(如C1),结合伴侣可逆结合反应剂上的结合位点Z(如Z1)。
某些实施方式中,可逆结合病毒载体颗粒结合剂的反应剂还可以可逆结合另一作用剂例如受体结合剂和/或选择剂,这另一作用剂能够结合希望被所述病毒载体颗粒转导的细胞表面的分子。因此,某些实施方式中,反应剂能令被结合于病毒颗粒结合剂的病毒颗粒与结合于受体结合剂或选择剂的细胞近距离接触,由此促进细胞转导。
某些实施方式中,病毒颗粒表面分子结合病毒颗粒结合剂上的结合位点V1。
某些实施方式中,病毒颗粒表面分子包括病毒包膜蛋白、病毒包膜蛋白的组成部分,或其变体,或是嵌合包膜蛋白。某些实施方式中,病毒颗粒是逆转录病毒,例如慢病毒颗粒。某些实施方式中,病毒包膜蛋白如病毒糖蛋白是特定病毒种或株天然就有的,例如逆转录病毒(如慢病毒)天然关联的那些。某些实施方式中,病毒包膜蛋白如病毒糖蛋白不是特定毒株天然就有的。例如,某些实施方式中,病毒颗粒如逆转录病毒颗粒(如慢病毒颗粒)是假型化的,含有其他病毒的包膜糖蛋白,为的是增强或改变病毒的细胞嗜性。例如,某些情形中,逆转录病毒(包括慢病毒)一般嗜性较窄,因为env基因编码的表面糖蛋白只能结合有限细胞类型上的受体。因此,一些时尚服饰,逆转录病毒载体(如慢病毒载体)以以下病毒的包膜蛋白例如表面糖蛋白或嵌合糖蛋白假型化:水疱性口炎病毒(VSV),长臂猿白血病病毒(GALV),鼠白血病病毒(MLV),莫洛尼鼠白血病病毒(MoMuLV或MMLV),辛德毕斯病毒,哈维鼠肉瘤病毒(HaMuSV或HSV),鼠乳腺肿瘤病毒(MuMTV或MMTV),人类免疫缺陷病毒(HIV),劳斯肉瘤病毒(RSV),RD114病毒或I型人T-细胞淋巴细胞病毒(HTLV-1)或其他已知病毒包膜蛋白(见例如Frecha等,2008;和WO2015/036713)。
因此,某些实施方式中,病毒颗粒表面分子可以是或含用来假型化病毒颗粒的病毒包膜蛋白(如病毒包膜糖蛋白)或其变体、组成部分或嵌合体。病毒包膜蛋白(如病毒包膜糖蛋白)的例子包括或衍生自例如:VSV糖蛋白(VSVG或VSV-G),辛德毕斯糖蛋白(如SIN),MMLV糖蛋白,HSV糖蛋白,MMTV糖蛋白,GALV糖蛋白,HIV糖蛋白(包括gp160、gp120和/或gp41)或RSV糖蛋白(包括gp85和/或gp37),或以上所述之变体、组成部分或嵌合体。某些实施方式中,含病毒包膜糖蛋白的病毒颗粒是慢病毒颗粒。
某些实施方式中,病毒包膜蛋白是水疱性口炎病毒-G(VSVG或VSV-G)蛋白或其变体。某些实施方式中,VSVG具有乙二醇修饰(PEG化)或用单甲氧聚乙二醇(monomethoxypoly(ethylene))共价修饰。
某些实施方式中,病毒颗粒表面分子是病毒衣壳蛋白或其变体。衣壳蛋白的例子包括p24衣壳蛋白。
某些实施方式中,病毒颗粒表面分子是病毒基质蛋白或其变体。基质蛋白例子包括p17基质蛋白。
某些实施方式中,病毒颗粒结合剂不中和/或基本上不中和病毒颗粒,即为非中和性病毒颗粒结合剂。某些实施方式中,病毒颗粒结合剂不干扰或基本上不干扰病毒离子为进入而结合细胞受体、病毒粒子进入细胞、内体中基因组脱壳、病毒颗粒聚集和/或包被病毒裂解,例如,相比无所述病毒颗粒结合剂存在下的相应特征,对这些特征的改变不超过2倍或不超过1.5倍。某些实施方式中,相比无病毒颗粒结合剂,病毒颗粒结合剂存在下病毒粒子为进入而结合细胞受体和/或病毒粒子进入细胞的程度不降低或基本不降低。某些实施方式中,病毒颗粒结合剂存在下病毒粒子为进入而结合细胞受体和/或病毒粒子进入细胞的程度或水平是无病毒颗粒结合剂时病毒粒子为进入而结合细胞受体和/或病毒粒子进入细胞之程度或水平的至少50%或以上,例如至少60%、至少70%、至少80%、至少90%、至少95%或以上。
某些实施方式中,病毒颗粒结合剂是抗体或其抗原结合片段。某些实施方式中,病毒颗粒结合剂可为单价,例如单价抗体片段或单价人工结合分子(蛋白质类或其他),例如基于脂质运载蛋白家族多肽的突变蛋白(也称“
某些实施方式中,病毒颗粒结合剂可以是抗VSV-G抗体,抗辛德毕斯糖蛋白(如抗SIN抗体),和抗MMLV糖蛋白,抗HSV糖蛋白,抗MMTV糖蛋白,抗GALV糖蛋白,抗HIV糖蛋白或抗RSV糖蛋白,或它们的抗原结合片段例如二价抗体片段如F(ab’)2片段或二价单链Fv片段,或单价抗体片段如Fab片段,Fv片段和单链Fv片段(scFv)。某些实施方式中,病毒颗粒结合剂可以是抗gp160抗体、抗gp120抗体、抗gp41抗体、抗gp85抗体或抗pg37抗体,或它们的抗原结合片段例如二价抗体片段,如F(ab’)2片段或二价单链Fv片段,或单价抗体片段如Fab片段、Fv片段和单链Fv片段(scFv)。在一些实施方式中,所述抗体是Fab片段。
某些实施方式中,所述抗体是抗VSV-G抗体或其抗原结合片段,例如二价抗体片段如F(ab’)2片段或二价单链Fv片段,或单价抗体片段如Fab片段、Fv片段、和单链Fv片段(scFv)。某些实施方式中,抗VSV-G抗体或其抗原结合片段是或衍生自Lefrancois,JVirol.1984年7月;51(1):208-14中所述抗VSV-G抗体或其他已知抗VSV-G抗体。
某些实施方式中,所述抗体是抗gp120抗体或其抗原结合片段,例如二价抗体片段如F(ab’)2片段或二价单链Fv片段,或单价抗体片段如Fab片段、Fv片段、和单链Fv片段(scFv)。某些实施方式中,所述抗体是抗gp41抗体或其抗原结合片段,例如二价抗体片段如F(ab’)2片段或二价单链Fv片段,或单价抗体片段如Fab片段、Fv片段、和单链Fv片段(scFv)。某些实施方式中,所述抗体是抗gp160抗体或其抗原结合片段,例如二价抗体片段如F(ab’)2片段或二价单链Fv片段,或单价抗体片段如Fab片段、Fv片段、和单链Fv片段(scFv)。某些实施方式中,抗gp120抗体、抗gp160抗体或抗gp41抗体或它们的抗原结合片段是或衍生自Holl等,J Virol.2006年6月;80(12):6177-81中所述或其他已知抗gp120抗体、抗gp160抗体或抗gp41抗体。
某些实施方式中,病毒颗粒结合剂结合的病毒颗粒表面分子是与该病毒异源的非病毒重组分子。某些实施方式中,病毒颗粒表面修饰方法包括例如:假型化,形成融合蛋白,用亲脂残基对蛋白质进行翻译后修饰(如GPI锚定修饰),采用接头分子或直接化学修饰(Metzner和Dangerfield,“病毒基因治疗(Viral Gene Therapy)”的第三章“用于基因治疗的逆转录病毒载体的表面修饰(Surface Modification of Retroviral Vectors forGene Therapy)”,出版日2011年7月20)。
某些方面,病毒颗粒表面修饰所用方法与制备和生产病毒颗粒所用相同。某些情形中,携有用于生产病毒颗粒的基因的质粒载体与含有目标非病毒重组分子编码核酸的构建物共转染可形成展示目标非病毒重组分子的病毒颗粒(Metzner和Dangerfield)。有实验发现,用于生产病毒颗粒(如用于转导靶细胞以表达目标重组分子的病毒颗粒)的细胞可在生产病毒颗粒的过程中表达重组分子(如嵌合抗原受体)。由此想到,由这些生产细胞(如用于生产含有编码抗原受体(如嵌合抗原受体(CAR))的异源核酸的病毒颗粒的生产细胞)生产的病毒颗粒可在病毒颗粒表面展示重组分子(如CAR)。因此,某些方面,病毒颗粒结合剂可以是特异性结合转导细胞以表达抗原受体所用病毒颗粒表面上的抗原受体(如CAR)本身。某些实施方式中,病毒颗粒结合剂是或含针对抗原受体(如CAR)胞外区的抗体或抗原结合片段。某些实施方式中,抗体或抗原结合片段特异性结合CAR的抗原结合片段(如scFv)。某些实施方式中,病毒颗粒结合剂是抗独特性抗体。某些实施方式中,抗体或抗原结合片段特异性结合抗原受体(如CAR)的铰链区,如IgG的铰链区,包括各自文献记载和已知的铰链区。可将类似方法用于其他重组异源分子。
某些实施方式中,病毒颗粒表面具有合成部分如肽,有时这可以是标签(如亲和标签)。某些实施方式中,病毒颗粒经改造而在其表面表达这样的部分如肽或标签(如亲和标签)。例如,某些方面,病毒表面分子如病毒糖蛋白被改造成融合蛋白来表达合成部分如肽或标签(如亲和标签)。此类实施方式中,病毒颗粒结合剂具有结合病毒颗粒表面表达的合成部分、肽或标签的结合位点V(如V1)。
合成部分、肽或标签(如亲和标签)的例子包括:二硝基苯酚或二硝基苯酚,寡聚组氨酸,多聚组氨酸,免疫球蛋白结构域,麦芽糖结合蛋白,谷胱甘肽-S-转移酶(GST),甲壳素结合蛋白(CBP)或硫氧还蛋白,钙调蛋白结合肽(CBP),FLAG-肽,血凝素肽(HA-标签)(YPYDVPDYA,SEQ ID No:20),VSV-G-标签,HSV-标签,T7表位,麦芽糖结合蛋白(MBP),HSV表位,“myc”表位,V5-标签,谷胱甘肽-S-转移酶(GST),链霉亲和素结合肽(如
已知亲和标签的部分例子包括:二硝基苯酚或地高辛、寡聚组氨酸、多聚组氨酸、免疫球蛋白结构域、麦芽糖结合蛋白、谷胱甘肽-S-转移酶(GST)、甲壳素结合蛋白(CBP)或硫氧还蛋白、钙调蛋白结合肽(CBP)、FLAG-肽、HA-标签(序列:Tyr-Pro-Tyr-Asp-Val-Pro-Asp-Tyr-Ala)(SEQ ID NO:20)、VSV-G-标签(序列:Tyr-Thr-Asp-Ile-Glu-Met-Asn-Arg-Leu-Gly-Lys)(SEQ ID NO:21)、HSV-标签(序列:Gln-Pro-Glu-Leu-Ala-Pro-Glu-Asp-Pro-Glu-Asp)(SEQ ID NO:22)、T7表位(Ala-Ser-Met-Thr-Gly-Gly-Gln-Gln-Met-Gly)(SEQ IDNO:23)、麦芽糖结合蛋白(MBP)、单纯疱疹病毒糖蛋白D的序列Gln-Pro-Glu-Leu-Ala-Pro-Glu-Asp-Pro-Glu-Asp(SEQ ID NO:24)的HSV表位、序列为Glu-Gln-Lys-Leu-Ile-Ser-Glu-Glu-Asp-Leu(SEQ ID NO:25)的转录因子c-myc的“myc”表位、V5-标签(序列:Gly-Lys-Pro-Ile-Pro-Asn-Pro-Leu-Leu-Gly-Leu-Asp-Ser-Thr)(SEQ ID NO:26)、或谷胱甘肽-S-转移酶(GST)。
对应结合剂(在此为病毒颗粒结合剂)的例子包括针对所述合成部分例如肽或标签(如亲和标签)的各种已知抗体或抗原结合片段。
某些实施方式中,反应剂直接与病毒载体颗粒表面的合成部分如肽或标签(如亲和标签)结合。因此,某些实施方式中不存在促进病毒载体颗粒与反应剂之间相互作用的病毒颗粒结合剂。某些实施方式中,病毒颗粒表面分子具有结合伴侣C1。某些实施方式中,反应剂通过结合位点Z(如Z1)与病毒颗粒表面的结合伴侣C(如C1)之间的相互作用与颗粒直接可逆结合。
某些实施方式中,病毒颗粒表面分子含有直接或间接偶联合成部分如肽或标签(如亲和标签)的能够可逆结合反应剂上结合位点Z(如Z1)的病毒包膜蛋白、其变体、或其组成部分。某些实施方式中,合成部分如肽是链霉亲和素结合肽。病毒包膜蛋白的例子如前所述并包括慢病毒颗粒的env-糖蛋白复合物,具体包括gp160、gp120或gp41,水疱性口炎病毒-G(VSVG或VSV-G),辛德毕斯病毒包膜蛋白,长臂猿白血病病毒(MoMuLV或MMLV),哈维鼠肉瘤病毒(HaMuSV或HSV),鼠乳腺肿瘤病毒(MuMTV或MMTV),长臂猿白血病病毒(GaLV或GALV),人类免疫缺陷病毒(HIV),劳斯肉瘤病毒(RSV)蛋白或它们的变体。
在一些实施方式中,反应剂是链霉亲和素,例如前文所述链霉亲和素突变蛋白(如SEQ ID NO:3-6所示),病毒颗粒和/或病毒包膜蛋白或其变体中的结合伴侣C(如C1)可以是链霉亲和素结合肽。在一些实施方式中,链霉亲和素结合肽可包含SEQ ID NO:9所示通式的序列,例如包含SEQ ID NO:10所示序列。在一些实施方式中,肽序列具有SEQ ID NO:11所示的通式,例如SEQ ID NO:12所示。在一个实施例中,肽序列为Trp-Arg-His-Pro-Gln-Phe-Gly-Gly(也称
改造病毒颗粒(包括慢病毒颗粒)表面分子以包含合成部分或标签(如亲和标签)的方法是已知的。某些实施方式中,病毒颗粒表面分子是蛋白质(如糖蛋白)且是含有亲和标签和病毒包膜蛋白或其变体的融合蛋白。合成部分如肽或标签(如亲和标签)可位于病毒包膜蛋白或其变体的羧基端、氨基端和/或内部。
可用标准重组分子技术将合成部分引入病毒包膜蛋白(如VSV-G)序列从而表达于病毒颗粒(包括慢病毒颗粒)表面。例如,某些实施方式中,VSV-G含有VSV-G蛋白原有的VSV-G标签“YTDIEMNRLGK”(SEQ ID NO:46)。某些实施方式中,VSV-G含有合成部分或肽插入在对应于天然VSV-G第24位氨基酸处(见例如Guibinga等,Molecular Therapy(2004)9,76–84,其中例举了来自血管性血友病因子胶原蛋白结合域10氨基酸标签“WREPGRMELN”(SEQ IDNO:47)的插入)。某些实施方式中,合成部分如肽或标签(如亲和标签)可融合于VSV-G的N-端(见例如Kameyama等,J Virol Methods.2008年10月;153(1):49-54)。另一实施例中,MLVenv基因和所得蛋白可通过在表面亚基+1位融合亲和标签或蛋白来修饰,参见Verhoeyen等,Blood.2003年3月15日;101(6):2167–2174。某些实施方式中,辛德毕斯病毒糖蛋白(SIN)的E2跨膜结构域可改造为包含合成部分或标签,这有时可插入E2蛋白第70与74氨基酸之间(见例如Yang等,Proc Natl Acad Sci U S A.2006年8月1日,103(31):11479-84;Morizono等,J Gene Med.2009年8月;11(8):655–663)。某些实施方式中,标签是HA-标签,位于E2蛋白第70-74氨基酸之间(见Yang)。某些实施方式中,标签是生物素衔接肽,插入在E2第70氨基酸(见Morizono)。某些实施方式中,合成部分如肽或标签(如亲和标签)还可含有一个或多个接头肽(包括柔性接头肽(包括序列为“GGGS”(SEQ ID NO:48)的接头肽(见Morizono)))。将用类似技术产生病毒糖蛋白与任意合成部分如肽或标签(如亲和标签)的融合蛋白。
某些实施方式中,病毒颗粒结合剂是或包含能够促进如增强病毒转导的聚阳离子或阳离子脂质。聚阳离子的例子包括鱼精蛋白(如硫酸鱼精蛋白)、海美溴铵(hexadimethrine bromide)(
III.转导细胞的方法
此处所述为用寡聚蛋白(如链霉亲和素补体蛋白)反应剂将病毒载体转入细胞的方法。某些实施方式中,所用寡聚蛋白反应剂是多聚化反应剂。某些实施方式中,细胞是用于细胞治疗的细胞,例如过继细胞治疗中用于自体或同种异体移植的原代细胞制备物。某些实施方式中,反应剂还可用于促进一个或多个与制备改造细胞组合物相关的其他步骤,例如细胞的选择、活化和/或刺激。方法还可包括其他细胞处理步骤,例如细胞清洗、分离、区分、制剂化或与制备细胞组合物相关的其他步骤。
某些实施方式中,提供的方法可用于将病毒载体颗粒如逆转录病毒载体颗粒引入细胞如包括T细胞在内的免疫细胞。某些实施方式中,病毒载体颗粒的基因组含有编码抗原受体如嵌合抗原受体(CAR)或转基因T细胞受体(TCR)的核酸。因此,某些实施方式中,提供的方法可用于在免疫细胞如T细胞中表达遗传改造的抗原受体如转基因TCR或CAR。本文还提供用所述颗粒和方法转导的细胞和含此细胞的组合物及其使用方法。
某些实施方式中,逆转录病毒颗粒载体和方法具有产生以下效果的特征:提高免疫细胞和/或特定免疫细胞群和/或亚群的转导效率,所述细胞适合用于过继免疫治疗。本文转导方法和病毒载体颗粒的某些实施方式中,接受转导的群中的细胞如T细胞未经或不必在与逆转录病毒载体颗粒接触或孵育之前或与逆转录病毒载体颗粒接触或孵育相连的刺激和/或激活。
A.用病毒载体颗粒转导细胞的方法
某些实施方式中,本文方法包括将包含多细胞的组合物(本文亦称“输入组合物”)接触(如孵育)以下所述物质来转导细胞的方法:(1)寡聚蛋白(如链霉亲和素突变蛋白)反应剂如多聚化反应剂和(2)病毒颗粒。在一些实施方式中,所述方法包括将细胞与反应剂和与病毒颗粒同时或依次(任意顺序)混合。某些实施方式中,所述方法包括将病毒颗粒与反应剂预混合在一起,然后将该细胞组合物接触与该反应剂关联的病毒颗粒的混合物。某些实施方式中,所述接触进行30分钟至72小时如30分钟至48小时、30分钟至24小时,或1小时至24小时如至少或至少约30分钟、1小时、2小时、6小时、12小时、24小时、36小时或更久。
一些本文方法的实施方式中,(i)孵育包括将靶细胞和反应剂混合,和/或将靶细胞与病毒颗粒混合(依次地以任何顺序),可任选地,其中(a)中的混合和(b)中的混合在不超过1小时、2小时、3小时、4小时、5小时、6小时、7小时、8小时、9小时、10小时、11小时、12小时、18小时、24小时、36小时、48小时、或72小时内进行,和/或(a)中的混合与(b)中的混合相隔不超过1小时、2小时、3小时、4小时、5小时、6小时、7小时、8小时、9小时、10小时、11小时、12小时、18小时、24小时、36小时、或48小时;(ii)孵育包括将靶细胞、反应剂和病毒颗粒混合,所述混合同时或几乎同时进行;(iii)孵育包括将含有靶细胞与病毒颗粒而不含反应剂的组合物混合,任选地,其中:包含靶细胞和反应剂的组合物中的靶细胞不超过5%、10%、20%、30%或40%表达选自下组的表面标志:HLA-DR、CD25、CD69、CD71、CD40L和4-1BB;包括选自下组的细胞因子的胞内表达:IL-2,IFNγ、TNF-α,且/或能够增殖;和/或混合在组合物中的靶细胞和病毒颗粒混合后不超过1小时、2小时、3小时、4小时、5小时、6小时、7小时、8小时、9小时、10小时、11小时、12小时、18小时、24小时、36小时、或48小时内进行;(iv)孵育包括将包含靶细胞和反应剂但不含病毒颗粒的组合物与病毒颗粒混合,可任选地,其中:包含靶细胞和反应剂活化的细胞的组合物中的靶细胞不超过5%、10%、20%、30%或40%表达选自下组的表面标志:HLA-DR、CD25、CD69、CD71、CD40L和4-1BB;包括选自下组的细胞因子的胞内表达:IL-2,IFNγ、TNF-α,且/或能够增殖;和/或混合在组合物中的靶细胞和病毒颗粒混合后不超过1小时、2小时、3小时、4小时、5小时、6小时、7小时、8小时、9小时、10小时、11小时、12小时、18小时、24小时、36小时、或48小时内进行;(iv)孵育包括将包含病毒颗粒和反应剂的组合物与包含靶细胞但不包含病毒颗粒和/或不含反应剂的组合物混合,可任选地,其中:包含靶细胞和反应剂活化的细胞的组合物中的靶细胞不超过5%、10%、20%、30%或40%表达选自下组的表面标志:HLA-DR、CD25、CD69、CD71、CD40L和4-1BB;包括选自下组的细胞因子的胞内表达:IL-2,IFNγ、TNF-α,且/或能够增殖。
在一些实施方式中,孵育包括将细胞与反应剂和病毒颗粒同时或依次(任意顺序)混合。在一些实施方式中,在至少一部分孵育期间,反应剂和病毒颗粒同时与细胞共在或同时与细胞接触。
某些实施方式中,本文方法包括(a)使病毒颗粒与寡聚蛋白反应剂接触,从而产生包括病毒颗粒和反应剂的组合物,其中病毒颗粒任选地与反应剂关联;和(b)将(a)中的组合物与包括靶细胞的多细胞孵育,该方法产生包括被病毒颗粒转导的一个或多个细胞的输出组合物。
某些实施方式中,本发明方法包括将含有病毒颗粒与寡聚蛋白反应剂的组合物和包含靶细胞的多细胞一同孵育,该方法产生含有被病毒颗粒转导的一个或多个细胞的输出组合物。
某些实施方式中,本文方法包括(a)将病毒颗粒与蛋白反应剂接触,所述蛋白反应剂包含链霉亲和素、亲和素链霉亲和素类似物,前述任一之突变蛋白或生物活性片段,和/或前述任一之多个亚单位,从而产生包括病毒颗粒和反应剂的组合物,其中病毒颗粒可任选地与所述反应剂关联;和(b)将(a)中的组合物与多细胞一同孵育,该方法产生包含由病毒颗粒转导的一个或多个细胞的输出组合物。
某些实施方式中,本文方法包括将含有病毒颗粒和蛋白反应剂的组合物与包含靶细胞的多细胞混合,其中蛋白反应剂包括链霉亲和素、亲和素、生物素结合多肽、strep标签结合多肽、链霉亲和素突变蛋白、链霉亲和素类似物、亲和素突变蛋白、亲和素类似物、和/或前述任一的生物活性片段,和/或前述任一的多个亚基;和该方法产生包括被病毒颗粒转导的一个或多个细胞的输出组合物。在一些实施方式中,反应剂和/或每一单体单元和/或每一多聚体单元具有净正电荷或总正电荷。
某些实施方式中,本文方法包括将包含靶细胞的多细胞与一些物质孵育:1)寡聚蛋白反应剂,其具有能够与结合剂可逆结合的多个结合位点,其中一个或多个结合位点可逆结合于结合剂和2)病毒颗粒;(1)中的孵育至少有部分与(2)同时发生;该方法产生包括被病毒颗粒转导的一个或多个细胞的输出组合物。
在一些实施方式中,本文方法包括使(1)含有一个或多个病毒颗粒的组合物(a)与结合剂(b)接触,所述结合剂是病毒结合剂,所述病毒结合剂(i)能与病毒颗粒表面的分子特异性结合且(ii)与包含多个结合位点的反应剂可逆结合,所述结合位点能够与病毒结合剂可逆结合;和(2)在一个或多个病毒颗粒存在下孵育至少含靶细胞的多细胞,其中(1)中的接触和(2)中的孵育同时或以任意顺序依次进行,该方法产生包含被病毒颗粒转导的细胞的输出组合物。
某些本文方法实施方式中,(1)中的接触和(2)中的孵育在不超过1小时、2小时、3小时、4小时、5小时、6小时、7小时、8小时、9小时、10小时、11小时、12小时、18小时、24小时、36小时、48小时、或72小时内进行,和/或(a)中的混合与(b)中的孵育相隔不超过1小时、2小时、3小时、4小时、5小时、6小时、7小时、8小时、9小时、10小时、11小时、12小时、18小时、24小时、36小时、或48小时。
转导步骤中含病毒颗粒和细胞的组合物还可包含一种或多种其他物质,例如促进转导效率的物质,例如包括以下所述的聚阳离子:鱼精蛋白(如硫酸鱼精蛋白)、海美溴铵(hexadimethrine bromide)(
某些实施方式中,输出组合物中的细胞浓度选自:约1.0x 10
某些实施方式中,提供的病毒颗粒有特定比例,即病毒载体颗粒拷贝数或感染单位(IU)与输出组合物中细胞总数或待转导细胞总数之比(IU/细胞)。例如,某些实施方式中,接触期间病毒颗粒存在的量是或约或至少或至少约每细胞0.5、1、2、3、4、5、10、15、20、30、40、50或60IU病毒载体颗粒。
某些实施方式中,病毒载体颗粒的效价在或约在1x 10
某些实施方式中,转导的感染复数(MOI)低于100,例如通常低于60、50、40、30、20、10、5或更低。
某些实施方式中,接触可在溶液中进行,例如采用可溶性寡聚蛋白(如链霉亲和素突变蛋白)反应剂或多聚化反应剂。某些实施方式中,细胞、寡聚反应剂和病毒颗粒的接触所做的体积是或约0.5mL至500mL,例如是或约0.5mL至200mL、0.5mL至100mL、0.5mL至50mL、0.5mL至10mL、0.5mL至5mL、5mL至500mL、5mL至200mL、5mL至100mL、5mL至50mL、5mL至10mL、10mL至500mL、10mL至200mL、10mL至100mL、10mL至50mL、50mL至500mL、50mL至200mL、50mL至100mL、100mL至500mL、100mL至200mL或200mL至500mL。
某些实施方式中,当接触在溶液中进行(例如采用可溶性寡聚蛋白(如链霉亲和素突变蛋白)反应剂),其中可有至少部分接触是带离心的,例如离心转染(如离心转染)。某些实施方式中,含细胞、病毒颗粒和反应剂的组合物可以是旋转着的,通常为低力度或低速度旋转,例如速度低于沉淀细胞所用的速度,例如是或约600rpm至1700rpm(如是或约或至少600rpm、1000rpm或1500rpm或1700rpm)。某些实施方式中,例如据舱壁或腔壁内或外测定,旋转的力度如离心力是或约为100g至3200g(如是或约或至少或至少约100g、200g、300g、400g、500g、1000g、1500g、2000g、2500g、3000g或3200g)。“相对离心力”或RCF一般理解为施加于物体或物质(如细胞、样品或小体和/或旋转舱或腔体旋转容器内一点)、相对于旋转轴的空间内某点处与地球重力相对的作用力。其值可用公知的公式来计算,计算考虑重力、转速和旋转半径(旋转轴至RCF测定处物体、物质或颗粒的距离)。
在一些实施方式中,寡聚反应剂如多聚化反应剂不结合于支持物(如固体表面或固定相)。
在一些实施方式中,寡聚反应剂如多聚化反应剂固定于支持物(如固体表面或固定相)。某些实施方式中,接触在固定相中进行,例如采用色谱基质,基质上固定有蛋白质(如链霉亲和素突变蛋白)如寡聚蛋白(如链霉亲和素突变蛋白)反应剂。与本文方法相关联的此类使用方式的例子如本文所述。因此,某些实施方式中,可进行本发明方法的柱上转导。
某些实施方式中,接触细胞的输入组合物含有活化的细胞。某些实施方式中,输入组合物中的细胞如T细胞至少40%、50%、60%、70%、80%、90%或更多是活化的,例如在某些情形中是以下所述以下或多项阳性的:HLA-DR、CD25、CD69、CD71、CD40L和/或4-1BB。某些实施方式中,细胞用活化剂活化,例如在抗CD3/抗CD28存在下,在所述接触开始之前例如转导开始之前进行。在不含外源生长因子或少量外源生长因子的情况下体外扩增T细胞群的方法在本领域中是已知的(参见例如美国专利6,352,694B1和欧洲专利EP 0 700 430 B1)。一般而言,这些方法采用其上固定有各种结合剂(例如抗CD3抗体和/或抗CD28抗体)的大于1μM的固相表面。例如,
某些实施方式中,细胞活化也在IL-2(例如是或约50IU/mL至200IU/mL,例如是或约100IU/mL)存在下活化。某些实施方式中,活化进行的时间是或约1小时至96小时、1小时至72小时、1小时至48小时、4小时至36小时、8小时至30小时或12小时至24小时、例如至少获至少约6小时、12小时、18小时、24小时、36小时或72小时。某些实施方式中,活化的温度高于或高于约25℃,例如通常高于或高于约32℃、35℃或37℃,例如是或约37℃±2℃,是或约37℃。
某些实施方式中,细胞用活化剂活化,例如在抗CD3/抗CD28存在下,在所述接触开始之前例如转导开始之前进行。某些实施方式中,接触细胞的输入组合物含有多个静息细胞。某些实施方式中,群中至少40%,50%,60%,70%,80%,90%或更多T细胞是静息T细胞(例如缺少T细胞活化标志(例如表面标志或胞内细胞因子或其他标志)的T细胞),或是处于细胞周期G
某些特定情形中,所述方法在T细胞内引起转导无需与寡聚蛋白反应剂如多聚化反应剂接触和/或孵育前的活化。某些实施方式中,方法包括按照本文所述方法在寡聚蛋白反应剂(如链霉亲和素)存在下用病毒载体转导含有静息T细胞或原初
某些实施方式中,寡聚蛋白(如链霉亲和素突变蛋白)是裸露的。
某些实施方式中,寡聚蛋白(如链霉亲和素突变蛋白)是多聚化反应剂,已结合于一个或多个结合剂,所示结合剂能够结合组合物中靶细胞(如T细胞)的表面分子或者某些情形中能够结合病毒颗粒的表面分子。在一些实施方式中,结合剂可逆结合反应剂,反应剂包含能够可逆作用剂的多个结合位点。在一些实施方式中,孵育在令作用剂结合(例如特异性结合)细胞上或病毒颗粒上分子的条件下进行。某些实施方式中,寡聚反应剂上已经可逆固定有(结合有)一个或多个或一种或多种作用剂(如第一或第二或第三或更多作用剂),作用剂包括受体结合剂如刺激剂或辅作用剂、选择剂或病毒结合剂,可用于细胞的选择、刺激、扩增和/或分化或调控细胞转导。
在一些情况中,对于某些受体结合剂(例如刺激剂或辅作用剂),该结合可诱导或调控组合物中靶细胞(例如T细胞)中的信号,例如所描述的主信号或辅信号。在一些实施方式中,作用剂与所示分子的结合造成如下一种或多种影响:组合物中靶细胞的刺激、活化、扩增(增殖)和/或分化。某些实施方式中,反应剂包含能够向细胞提供主活化信号的刺激剂,所述刺激剂包含至少一个结合伴侣C(如C1、C2或C3等),结合伴侣C能够可逆结合寡聚反应剂上用于可逆结合作用剂的结合位点Z1。某些实施方式中,反应剂包含能够向细胞提供辅活化信号的辅作用剂,所述辅作用剂包含至少一个结合伴侣C(如C1、C2或C3等),结合伴侣C能够可逆结合寡聚反应剂上用于可逆结合作用剂的结合位点Z1。某些实施方式中,反应剂包含选择剂,该选择剂特异性定向结合特定细胞表面分子或标志,选择剂包含至少一个结合伴侣C(如C1、C2或C3等),结合伴侣C能够可逆结合寡聚反应剂上用于可逆结合作用剂的结合位点Z1。
某些实施方式中,输入组合物中细胞的活化开始于接触寡聚蛋白反应剂和/或病毒颗粒的时候。某些情形中,寡聚蛋白反应剂上可以已经固定有能够诱导或调控细胞(如T细胞)内信号的结合剂如刺激剂和/或辅作用剂。某些实施方式中,刺激剂含MHC-I:肽复合物或其功能性分部、MHC-II:肽复合物或其功能性分部,且/或能够通过T细胞的TCR/CD3复合物、T细胞的含CD3复合物和/或T细胞的含ITAM分子传递刺激信号。某些实施方式中,寡聚反应剂上可以已经固定有能够向细胞如T细胞提供辅助信号的辅作用剂。某些实施方式中,受体结合剂如刺激剂和/或辅作用剂是各种本文所述的作用剂例如抗CD3和/或抗CD28抗体(如Fab片段)。或者,也可将配体例如引发细胞扩增的受体的天然配体用作第一作用剂。例如,CD19胞外结构域可用于引起经转导而表达嵌合CD19结合抗原受体(CAR)的细胞的胞内信号转导级联反应活化。某些实施方式中,寡聚蛋白(如链霉亲和素)反应能够在接触期间调控细胞转导和活化,例如刺激细胞,或者还能够调控再孵育。某些实施方式中,含刺激剂的寡聚反应剂其结合是可逆的,例如存在竞争剂如生物素的情形中。
在一些实施方式中,所提供的方法能够用于选择性诱导特定细胞群(例如B细胞、T细胞或自然杀伤细胞)的诱导和/或离体扩增。某些实施方式中,寡聚蛋白(如链霉亲和素突变蛋白)反应剂是多聚化反应剂,其中可以包括至少一个选择剂,所示选择剂可逆结合用调控转导的作用剂。某些实施方式中,寡聚反应剂(如链霉亲和素突变蛋白)是多聚化反应剂,它可以在同一反应剂上包括选择剂和第一和/或第二受体结合剂(如刺激剂或辅作用剂)其中之一或两者。某些实施方式中,寡聚蛋白(如链霉亲和素)反应剂如多聚化反应剂既能够调控细胞转导还能够优先定向转导特定的选定或靶定细胞亚群。某些实施方式中,接触或者还包括再孵育期间,寡聚蛋白(如链霉亲和素)反应剂如多聚化反应剂能够调控细胞转导,例如优先定向转导特定的选定或靶定细胞亚群,例如刺激细胞。
某些实施方式中,含结合剂如选择剂和/或刺激剂的寡聚反应剂其结合是可逆的,例如存在竞争剂如生物素的情形中。如后文所述,某些方面,本文方法包括向含细胞、病毒颗粒和寡聚反应剂(如结合于一个或多个或一种或多种结合剂的多聚化反应剂)组合物添加竞争性物质或与使之与竞争性物质一同孵育,从而逆转、解离或破坏一个或多个或一种或多种结合剂与细胞或病毒颗粒的结合。某些实施方式中,所示逆转、解离或破坏之后,可去除组合物中一个或多个组分,例如已解离的寡聚反应剂、结合剂和/或竞争性物质。此类方法的例子如后文所述。
某些实施方式中,本文方法产生的细胞(本文亦称“输出组合物”或“经孵育组合物”)包括被病毒载体转导的细胞,病毒载体例如含有编码异源蛋白如重组受体如CAR的寡核苷酸的病毒载体。在本文中,异源是指通常不由病毒表达和/或不由病毒基因组编码的蛋白质。某些情形中,病毒载体整合到宿主基因组可通过孵育后重组蛋白(如病毒载体颗粒基因组所含核酸编码的异源蛋白)的表达水平来鉴定。可采用用于评价重组分子的表达水平的许多熟知的方法,例如通过如下方法的检测:基于亲和性的方法,例如,基于免疫亲和性的方法,例如,在细胞表面蛋白质方面,例如通过流式细胞术。在一些实例中,通过检测转导标志物和/或报道构建体来测量表达。在一些实施方式中,编码截短表面蛋白的核酸包含在载体内,并用作其表达和/或增强的标志物。
细胞
某些实施方式中,含靶细胞的组合物用病毒载体颗粒转导,如按照本文所述方法。
某些实施方式中,所述细胞一般是真核细胞,例如哺乳动物细胞,并且通常是人细胞。在一些实施方式中,细胞衍生自血液、骨髓、淋巴或淋巴器官,或是免疫系统的细胞,如先天或适应性免疫的细胞,例如,骨髓或淋巴样细胞,包括淋巴细胞,一般是T细胞和/或NK细胞。其他示例性的细胞包括干细胞,如多能(multipotent)和多潜能(pluripotent)干细胞,包括诱导性多潜能干细胞(iPSC)。细胞一般是原代细胞,如直接从对象分离和/或从对象分离并冷冻的那些细胞。在一些实施方式中,细胞包括T细胞或其他细胞类型的一个或多个亚组,如全T细胞群、CD4+细胞、CD8+细胞及其亚群,如由功能、活化状态、成熟、分化潜力、扩增、再循环、定位,和/或持续能力、抗原特异性、抗原受体类型、特定器官或区室中的存在、标志或细胞因子分泌概况,和/或分化程度限定的那些。关于待治疗的对象,细胞可以是同种异体和/或自体的。方法包括现成的方法。某些方面,如对于现成的技术,细胞是多潜能和/或多能的,如干细胞,如诱导性多潜能干细胞(iPSC)。在一些实施方式中,该方法包括从对象分离细胞,对其进行制备、处理、培养和/或工程改造,如本文所述,并且在冷冻保存前或后将其回输给同一患者。
T细胞和/或CD4+和/或CD8+T细胞的亚型和亚群包括:原初T(T
在一些实施方式中,细胞是自然杀伤(NK)细胞。在一些实施方式中,细胞是单核细胞或粒细胞,例如,骨髓细胞、巨噬细胞、嗜中性粒细胞、树突细胞、肥大细胞、嗜酸性粒细胞,和/或嗜碱性粒细胞。
在一些实施方式中,细胞的制备包括一个或多个培养和/或制备步骤。细胞可分离自样品,例如生物样品,如从对象获得或衍生自对象的样品。在一些实施方式中,从中分离细胞的对象是患有一定疾病或病症或需要细胞治疗或将接受细胞治疗的对象。在一些实施方式中,对象是需要特定治疗性介入的人,如过继细胞疗法,用于该疗法的细胞是经分离、加工和/或经工程改造的。
因此,在一些实施方式中,所述细胞是原代细胞,例如,原代人细胞。所述样品包括直接取自对象的组织、体液和其它样品,以及获自一个或多个处理步骤,例如分离、离心、遗传工程改造(例如采用病毒载体的转导)、清洗和/或孵育的样品。所述生物样品可以是直接获自生物来源的样品或经处理的样品。生物样品包括但不限于,体液,例如血液、血浆、血清、脑脊髓液、滑膜液、尿液和汗液,组织和器官样品,包括源自它们的经处理的样品。
某些方面,作为衍生或分离细胞来源的样品是血液或血液源性的样品,或者为或衍生自血浆分离置换法或白细胞去除术产物。示例性样品包括全血、外周血单核细胞(PBMC)、白细胞、骨髓、胸腺、组织活检物、肿瘤、白血病、淋巴瘤、淋巴结、肠相关的淋巴样组织、粘膜相关的淋巴样组织、脾、其它淋巴样组织、肝、肺、胃、肠、结肠、肾、胰腺、乳腺、骨、前列腺、子宫颈、睾丸、卵巢、扁桃体或其它器官,和/或源自其中的细胞。在细胞治疗(如过继细胞治疗)中,样品包括来自自体和同种异体来源的样品。
在一些实施方式中,所述细胞源自细胞系,例如,T细胞系。在一些实施方式中,细胞获自异种异体来源,例如,获自小鼠、大鼠、非人灵长类或猪。
在一些实施方式中,细胞的分离包括一个或多个制备和/或非基于亲和性的细胞分离步骤。在一些实施例中,细胞在一种或多种反应剂的存在下经清洗、离心和/或孵育,例如,以去除不需要的组分,富集所需组分,裂解或去除对某些反应剂敏感的细胞。在一些实施例中,细胞基于一种或多种特性如封闭、粘附性质、尺寸、对某些组分的敏感性和/或抗性来分离。
在一些实施例中,通过例如单采或白细胞去除术获取对象循环血液的细胞。某些方面,所述样品包括淋巴细胞,包括T细胞、单核细胞、粒细胞、B细胞、其它有核血液白细胞、血红细胞和/或血小板,某些方面包括血红细胞和血小板之外的细胞。
在一些实施方式中,采自对象的血液细胞经清洗如去除血浆部分,然后将其置于合适的缓冲液或培养基中留待后用。在一些实施方式中,所述细胞用磷酸盐缓冲盐水(PBS)清洗。在一些实施方式中,清洗溶液不含钙和/或镁和/或许多或所有二价阳离子。某些方面,清洗步骤按照生产商说明,通过半自动化的“流通”离心法(例如,Cobe 2991细胞处理器,百特公司(BaXter))完成。某些方面,清洗步骤按照生产商说明,通过切向流过滤(TFF)完成。在一些实施方式中,在清洗后,所述细胞在多种生物相容缓冲液中重悬,例如,无Ca
在一些实施方式中,所述方法包括基于封闭的细胞分离方法,如通过裂解血红细胞并通过Percoll或Ficoll梯度离心来从外周血制备血液白细胞。
某些实施方式中,本文方法之前无需富集或选择细胞。某些实施方式中,反应剂如寡聚反应剂(如多聚化反应剂)上可以可逆结合有一种或多种选择剂,选择剂能够结合或事实结合细胞表面分子。某些实施方式中,这样的反应剂与用于介导转导的反应剂相同,或是不同的反应剂。某些实施方式中,至少部分实施细胞与病毒颗粒在反应剂存在下的孵育可引起细胞群选择性转导,无需事先选择或富集细胞。
在一些实施方式中,所述分离方法包括,基于细胞中一种或多种特定分子,例如表面标志物,例如,表面蛋白质、胞内标志物或核酸的表达或存在来分离不同的细胞类型。在一些实施方式中,可采用任何基于此类标志进行分离的已知方法。分离方法可包括本文所公开分离方法中的任何一种,包括采用可逆反应剂系统的方法,例如如本文所述,采用作用剂(如受体结合剂或选择剂)和反应剂的方法。
在一些实施方式中,所述分离是基于亲和力或基于免疫亲和力的分离。例如,某些方面,所述分离包括基于细胞的一种或多种标志(通常是细胞表面标志)的表达或表达水平来分离细胞和细胞群,例如,通过与特异性地结合此类标志的抗体或结合伴侣孵育,随后通常是清洗步骤,将已结合所述抗体或结合伴侣的细胞与从未结合至所述抗体或结合伴侣的那些细胞分离。
此类分离步骤可基于正选择,保留已结合所述反应剂的细胞被用于后续应用,和/或负选择,保留未结合至所述抗体或结合伴侣的细胞。在一些实施例中,两种级份均保留用于后续应用。某些方面,当没有可用于在异质群中特异性地鉴定细胞类型的抗体时,负选择可能是特别有用的,这样,分离最好是基于细胞表达的标志而不是基于想要的细胞群。
所述分离的结果必需是特定细胞群或表达特定标志的细胞的100%的富集或去除。例如,特定类型细胞(如表达某标志的细胞)的正选择或富集指的是提高此类型细胞的数量或百分数,其结果不必是不表达该标志的细胞完全消失。同样地,特定类型细胞(如表达某标志的细胞)的负选择、去除或消除指的是减少此类细胞的数量或百分数,其结果不必是此类细胞的完全清除。
在一些实施例中,进行多轮分离步骤,其中,对来自一个步骤的正或负选择的级份进行另一分离步骤,例如后续的正或负选择。在一些实施例中,单个分离步骤同时消除表达多种标志的细胞,例如通过将细胞与分别对负选择目标标志具有特异性的多种抗体或结合伴侣一同孵育。同样地,可同时正选择多种细胞类型,通过将细胞与不同类型细胞上表达的多种抗体或结合伴侣一同孵育。
例如,某些方面,通过正或负选择技术分离特定T细胞亚群,例如一种或多种表面标志阳性细胞或高表达T细胞,例如,CD28
例如,CD3
在一些实施方式中,分离通过如下方式进行:通过正选择富集特定细胞群,或通过负选择消除特定细胞群。在一些实施方式中,正或负选择通过将细胞与特异性地结合一种或多种表面标志的一种或多种抗体或其它结合剂一同孵育来完成,所述一种或多种表面标志物分别在正选择或负选择的细胞上表达(标志物
在一些实施方式中,通过对非T细胞(例如B细胞、单核细胞或其它血液白细胞)上表达的标志(例如CD14)进行负选择来从PBMC样品分离T细胞。某些方面,使用CD4
在一些实施方式中,在CD8
在实施方式中,记忆T细胞存在于CD8
在一些实施方式中,中心记忆T(T
在某具体实施例中,对PBMC样品或其它血液白细胞样品进行CD4
通过鉴定具有细胞表面抗原的细胞群,将辅助CD4
在某一实施例中,为了通过负选择富集CD4
孵育一般在一定条件下进行,所述条件下所述抗体或结合伴侣或分子(如二抗或其它反应剂,其特异性地结合所述抗体或结合伴侣)连接所述磁性颗粒或珠,特异性地结合所述样品中的细胞上的细胞表面分子(如果存在)。
某些方面,将所述样品置于磁场中,并且,具有与其连接的磁性响应或可磁化颗粒的那些细胞将被磁体吸引,并与未标记的细胞分离。对于正选择而言,保留被磁体吸引的细胞;对于负选择而言,保留不被吸引的细胞(未标记的细胞)。某些方面,在同一选择步骤过程中进行正和负选择的组合,其中,保留阳性和阴性部分,并进一步处理或进行进一步分离步骤。
在某些实施方式中,磁响应性颗粒外包被一抗或其它结合伴侣、二抗、凝集素、酶或链霉亲和素。在某些实施方式中,磁性颗粒通过一抗覆层连接细胞,所述一抗对一种或多种标志具有特异性。在某些实施方式中,所述细胞,而非珠,用一抗或结合伴侣标记,然后,添加细胞类型特异性的二抗或其它结合伴侣(例如,链霉亲和素)包被的磁性颗粒。在某些实施方式中,链霉亲和素包被的磁性颗粒与生物素化一抗或二抗联用。
在一些实施方式中,使所述磁响应性颗粒连接和留在待后续孵育、培养和/或工程改造的细胞;某些方面,使所述颗粒连接留在用于给予患者的细胞。在一些实施方式中,从所述细胞去除可磁化的或磁响应性颗粒。用于从细胞去除可磁化颗粒的方法是已知的,包括例如采用竞争性非标记的抗体、可磁化颗粒或与可切割接头相连的抗体等。在一些实施方式中,可磁化颗粒是生物可降解的。
在一些实施方式中,基于亲和性的选择通过磁性活化细胞分选(MACS)(加利福尼亚奥本的美天旎生物技术公司(Miltenyi Biotech))进行。磁性活化细胞分选(MACS)系统能够高纯度选择其上连接有磁化颗粒的细胞。在某些实施方式中,MACS以如下模式操作:在施加外部磁场之后,依次洗脱非目标和目标物质。即,使连接磁化颗粒的细胞保持在原位,而洗脱未连接的物质。然后,在该第一洗脱步骤完成后,将滞留在磁场中且防止被洗脱的物质以使得它们可被洗脱和回收的某种方式释放。在某些实施方式中,标记非靶细胞并将其从异质细胞群中消除。
在某些实施方式中,分离(isolation)或分开(separation)采用系统、器械或设备来进行,它们实施所述方法分离、细胞制备、分开、处理、孵育、培养和/或配制步骤中的一个或多个步骤。某些方面,所述系统用以在封闭或无菌环境中进行这些步骤,为的是例如尽可能减少误差、使用者操作繁复性和/或污染。在某一实施例中,所述系统是国际专利申请公开号WO2009/072003或US 20110003380 A1中描述的系统。
在一些实施方式中,所述系统或设备在集成或独立系统中,和/或以自动化的或可编程的形式,进行分离、处理、工程改造和配制步骤中的一个或多个,例如全部。某些方面,所述系统或设备包括与所述系统或设备信息连通的计算机和/或计算机程序,其允许用户编程、控制、评估所述处理、分离、工程改造和配制步骤的结果,和/或调节所述处理、分离、工程改造和配制步骤的各方面。
某些方面,进行所述分离和/或其它步骤使用CliniMACS系统(美天旎生物技术公司(Miltenyi Biotic))进行,例如,以供在封闭和无菌系统中进行临床级别水平的细胞的自动化分离。组件可包括集成微型计算机、磁性分离单元、蠕动泵和各种夹管阀。某些方面,集成计算机控制仪器的所有组件,并指示所述系统以标准化的顺序进行重复操作。某些方面,磁性分离单元包括可移动的永久磁体和用于选择柱的握持装置(holder)。蠕动泵控制贯穿通过管组的流速,并且与夹管阀一起确保通过所述系统的缓冲液和连续细胞悬液的受控流速。
某些方面,CliniMACS系统使用以无菌、无热源溶液的形式提供的抗体-偶联的可磁化颗粒。在一些实施方式中,在用磁性颗粒标记细胞之后,清洗细胞以去除过量的颗粒。然后,将细胞制备袋连与管组相连,管组再连接含缓冲液的袋和细胞收集袋。所述管组由预组装的无菌管道组成,包括前置柱和分离柱,并且仅用于单次使用。在分离程序启动之后,系统自动将细胞样品上样到分离柱。带标记的细胞留在柱中,而未标记细胞则经一系列清洗步骤去除。在一些实施方式中,用于本文所述方法的细胞群是未标记的,不留在柱中。在一些实施方式中,用于本文所述方法的细胞群是经标记的,并且留在柱中。在一些实施方式中,撤去磁场之后从柱上洗脱用于本文所述方法的细胞群,并将其收集在细胞收集袋中。
在某些实施方式中,分离和/或其它步骤采用CliniMACS Prodigy系统(美天旎生物技术公司)进行。某些方面,CliniMACS Prodigy系统装配有细胞处理单元,所述细胞处理单元允许自动化清洗和离心分级分离细胞。CliniMACS Prodigy系统还可包括内置相机和图像识别软件,通过辨别来源细胞产物的肉眼可见层来确定最优选细胞分级分离终点。例如,外周血可被自动分离成红细胞、血液白细胞和血浆层。CliniMACS Prodigy系统还可包括集成化的细胞培育腔室,其完成细胞培养测序,例如细胞分化和扩增、抗原加载和长期细胞培养。输入端口可允许无菌排出和补充培养基,细胞可采用整合显微镜来监测。参见例如Klebanoff等.(2012)J Immunother.35(9):651–660,Terakura等.(2012)Blood.1:72–82,和Wang等.(2012)J Immunother.35(9):689-701。
在一些实施方式中,本文所述细胞群通过流式细胞术收集和富集(或消除),其中细胞经多种表面标志染色并携载于流体流中。在一些实施方式中,本文所述的细胞群通过制备规模(FACS)-分选法收集和富集(或消除)。在某些实施方式中,本文所述的细胞群通过采用微机电系统(MEMS)芯片联合基于FACS的检测系统来收集和富集(或消除)(参见例如,WO 2010/033140,Cho等(2010)Lab Chip 10,1567-1573;和Godin等(2008)J Biophoton.1(5):355–376。在这两种情况中,细胞都可用多种标志物标记,以允许以高纯度分离明确的T细胞亚组。
在一些实施方式中,抗体或结合伴侣用一种或多种可检测标志物标记,以利于正选择和/或负选择的分离。例如,分离可基于与荧光标记抗体的结合。在一些实施例中,将基于抗体或对一种或多种细胞表面标志具有特异性的其它结合伴侣的结合所进行的细胞分离携载于流体流中,例如通过荧光活化的细胞分选(FACS)(其包括制备规模(FACS)和/或微机电系统(MEMS)芯片),例如与流式细胞术检测系统联合。此类方法允许进行基于多种标志物的同时正选择和负选择。
在一些实施方式中,制备方法包括冷冻例如冻存所述细胞的步骤,在分离、孵育和/或工程改造之前或之后。在一些实施方式中,所述冷冻和后续融化步骤去除细胞群中的粒细胞,并且一定程度去除细胞群中的单核细胞。在一些实施方式中,将所述细胞悬浮于冷冻溶液中,例如在清洗去除血浆和血小板之后。可采用各种已知冷冻溶液和某些方面的参数。例子质疑用到包含20% DMSO和8%人血清白蛋白(HAS)的PBS,或是其它合适的细胞冷冻培养基。然后,用培养基1:1将其稀释,使得DMSO和HSA的终浓度分别是10%和4%。然后,以1℃/分钟的速率将细胞冷冻至-80℃,并贮存在液氮储罐的汽相中。
某些实施方式中,细胞孵育和/或培养在遗传改造之前或与之衔接,例如在按本文方法转导之前或与之衔接。孵育步骤可包括培养、孵育、刺激、活化、和/或增殖。在一些实施方式中,在刺激条件或刺激剂存在下孵育细胞或组合物。这类条件包括设计成诱导群中细胞增殖、繁殖、活化,和/或存活,模拟抗原接触,和/或细胞预备以备遗传改造如导入重组抗原受体的那些条件。
所述条件可包括如下一项或多项:特定培养基、温度、含氧量、二氧化碳含量、时间、用剂如营养物、氨基酸、抗生素、离子,和/或刺激因子,例如细胞因子、趋化因子、抗原、结合伴侣、融合蛋白、重组可溶性受体,和设计用来活化细胞的任何其它物质。
在一些实施方式中,刺激条件或用剂包括一种或多种物质如配体,它能够活化TCR复合物的胞内信号转导结构域。某些方面,所述物质打开或启动T细胞中的TCR/CD3胞内信号转导级联。这样的物质可包括抗体如对TCR组分和/或共刺激受体具有特异性的那些,例如抗-CD3、抗-CD28,所述抗体可以例如结合在固体支持物如珠上,和/或一种或多种细胞因子。任选地,扩增方法还可包括如下步骤:向培养基(如以至少约0.5ng/ml的浓度)添加抗CD3和/或抗CD28抗体。在一些实施方式中,刺激型物质包括1L-2和/或IL-15,例如至少约10单位/mL浓度的IL-2。
某些方面,进行孵育的技术例如授予Riddell等的美国专利号6,040,1 77,Klebanoff等.(2012)J Immunother.35(9):651–660,Terakura等.(2012)Blood.1:72–82和/或Wang等.(2012)J Immunother.35(9):689-701中所述的那些。
在一些实施方式中,T细胞群通过如下方式扩增:在培养启动组合物在添加饲养层细胞,如非分裂型外周血单核细胞(PBMC),(例如令所得细胞群中初始待扩增群中的各T淋巴细胞有至少约5、10、20或40或更多PBMC饲养层细胞);并孵育所述培养物(例如孵育足以扩增所述数量的T细胞的时间)。某些方面,所述非分裂型饲养细胞可包括经γ-辐照的PBMC饲养细胞。在一些实施方式中,所述PBMC用约3000-3600拉德范围内的γ射线辐照以防止细胞分裂。某些方面,所述饲养细胞在添加T细胞群之前添加至培养基。
在一些实施方式中,刺激条件包括适于人T淋巴细胞生长的温度,例如至少约25摄氏度,一般至少约30度,且一般是或约是37摄氏度。可选地,孵育还可包括添加非分裂型EBV-转化的类淋巴母细胞(LCL)作为饲养层细胞。LCL可以用约6000-10000拉德范围内的γ射线辐照。某些方面,LCL饲养细胞以任何合适的量提供,例如LCL饲养细胞与初始T淋巴细胞的比率是至少约10:1。
某些实施方式中,通过用抗原刺激原初或抗原特异性T淋巴细胞来获得抗原特异性T细胞,如抗原特异性CD4+和/或CD8+T细胞。例如,可如下产生对巨细胞病毒抗原的抗原特异性T细胞系或克隆:从感染对象分离T细胞并采用巨细胞病毒抗原体外刺激细胞。
在一些情况中,可采用无需细胞(如T细胞)被活化的载体。某些此类情形中,可在活化前,或不活化,对细胞进行选择和/或转导。
B.可逆结合或破坏及组分的去除
某些实施方式中,所述方法还包括将已经与寡聚蛋白反应剂如多聚化反应剂接触、孵育或培养的细胞与(i)竞争反应剂(如游离结合伴侣C(如C1))或其类似物接触,该竞争反应剂或其类似物能够破坏第一结合伴侣如C1与结合位点Z如Z1之间的连键(如有必要)。本文例举的各种竞争性反应剂均可使用。某些实施方式中,根据特定结合伴侣C及其与结合位点Z的特性,可进一步添加一个或多个第二竞争反应剂。这样,所述结合伴侣与所述结合位点之间的连键被破坏,于是将寡聚反应剂结合的细胞如T细胞释放在洗脱液中(如输出组合物)。
在一些实施方式中,加入游离伴侣或其类似物使得结合伴侣C(例如C1)从多聚化反应剂上被置换下来,这样,由于结合伴侣包含于可逆结合的作用剂中,由此将所述作用剂从多聚化反应剂上置换下来。这一作用剂置换进而导致第一作用剂从细胞表面分子解离,尤其是如果第一作用剂与细胞表面受体之间连键的结合亲和力解离常数(K
某些方面,所述方法还包括在可逆解离或破坏后去除一个或多个组分。可采用前文就破坏和/或组分去除所述的各种方法。在一些实施方式中,可将靶细胞(如T细胞)培养物中的任何未结合或残留的竞争反应剂隔除或去除。在一些实施方式中,将多聚化反应剂从细胞组合物如输出组合物中的细胞中去除、减少或分离。在一些实施方式中,将一个或多个结合剂从细胞组合物如输出组合物中的细胞中去除、减少或分离。在一些实施方式中,将竞争性物质从细胞组合物如输出组合物中的细胞中去除、减少或分离。某些实施方式中,所述方法采用可溶性寡聚反应剂如多聚化反应剂,这样,反应剂和一种或多种其他组分可方便地从细胞组合物中去除,因为细胞可方便地离心沉降,然后弃除含有所述可溶性多聚化反应剂和/或其他组分的上清液。或者,可在去除盒的凝胶渗透基质中从扩增细胞群去除可溶性多聚化反应剂,例如可前文所述(例如国际专利申请公开号号WO 2013/124474)。
例如,在一些实施方式中,分离/去除可采用第二固定相进行。为此,将包含靶细胞如T细胞和寡聚反应剂(例如留在输出组合物中的)的混合物暴露于核酸的固定相,这可以是第二固定相。该固定相可为凝胶过滤基质和/或亲和色谱基质,其中该凝胶过滤和/或亲和色谱基质包含亲和反应剂。包含在色谱树脂上的亲和反应剂包括(特异性)结合寡聚反应剂的结合位点Z1和/或结合位点Z2(若存在)的结合伴侣D,从而将寡聚反应剂固定在固定相上。如果采用基于链霉亲和素的寡聚反应剂且链霉亲和素结合肽作为结合伴侣C1或C2,该固定相所含亲和反应剂的结合伴侣D可以是生物素。然后,用作寡聚化反应剂的链霉亲和素或链霉亲和素突变蛋白的可溶性寡聚体结合通常共价偶联于色谱基质的生物素,所述色谱基质为例如市售biotin-sepharose
在一些实施方式中,从组合物中去除反应剂和其他组分的能力还具有能够免除固体支持物(例如磁珠)的优点。在一些实施方式中,这意味着活化T细胞没有被此类磁珠污染的风险或被磁珠污染的风险最小。在一些实施方式中,这也意味着与其他方法相比,例如与采用Dyna珠而需采取额外措施来确保最终的扩增T细胞群不含磁珠相比,更易于建立符合GMP标准的工艺。在一些实施方式中,由于不存在固相(例如磁珠),本发明还提供了一种用于扩增细胞的自动化封闭系统,该系统可整合到已知细胞扩增系统中,所述已知细胞扩增系统为例如Xuri细胞扩增系统W25和WAVE生物反应器2/10系统,可市售购自GE Healthcare公司(英国白金汉郡小恰尔文(Little Chalfont,Buckinghamshire,United Kingdom)),或则
C.后续处理
某些实施方式中,用于转导(如与细胞改造相联的转导)的步骤还可包括细胞培养、孵育、刺激、活化和/或扩增。在一些实施方式中,在刺激条件或刺激剂存在下孵育细胞或输入和/或输出组合物。这类条件包括设计成在群中诱导细胞增殖、繁殖、活化和/或存活,模拟抗原接触,和/或初始化细胞以备遗传工程改造,如初始化细胞以备为病毒载体转导而活化细胞。
某些实施方式中,可选地,所述方法可包括孵育,其中,再一部分孵育,例如细胞与寡聚反应剂入多聚化反应剂和病毒颗粒接触之后的再一部分孵育。某些实施方式中,所述再孵育在病毒颗粒结合剂与反应剂间和/或选择剂与反应剂间破坏之后。某些实施方式中,再孵育非旋转或离心进行,一般在至少部分旋转如离心孵育之后,例如与离心或离心转染衔接。某些实施方式中,再孵育在固定相之外进行,例如色谱基质外,例如在乳液中进行。某些实施方式中,再孵育条件令病毒载体整合到一个或多个细胞宿主基因组内。
本领域技术人员能够评价和确定孵育是否实现了病毒载体颗粒在宿主基因组内的整合,因此能够确定再孵育的条件。某些情形中,病毒载体整合到宿主基因组可通过孵育后重组蛋白(如病毒载体颗粒基因组所含核酸编码的异源蛋白)的表达水平来鉴定。可采用用于评价重组分子的表达水平的许多熟知的方法,例如通过如下方法的检测:基于亲和性的方法,例如,基于免疫亲和性的方法,例如,在细胞表面蛋白质方面,例如通过流式细胞术。在一些实例中,通过检测转导标志和/或报道构建体来测量表达。在一些实施方式中,编码截短表面蛋白的核酸包含在载体内,并用作表达和/或增强的标志。
某些实施方式中,再孵育在接触所在的同一容器和/或设备中进行。某些实施方式中,再孵育在非接触所在的另一容器或设备中进行,例如在与病毒颗粒和反应剂的接触之后将细胞组合物转移如自动化转移到另一容器或设备。某些实施方式中,再孵育在孵育前不去除输入组合物中的反应剂。某些实施方式中,再孵育在再孵育过程中不去除反应剂。某些实施方式中,至少部分再孵育包含反应剂,例如再孵育的半程,但此后去除组合物中的反应剂,在一个或多个后续步骤之前。某些实施方式中,再孵育之后,细胞制备还包括清洗细胞和配制细胞制剂。
某些实施方式中,再孵育在刺激和/或活化细胞的条件下进行,所述条件可包括如下一项或多项:特定培养基、温度、含氧量、二氧化碳含量、时间、用剂例如营养物、氨基酸、抗生素、离子,和/或刺激因子,例如细胞因子、趋化因子、抗原、结合伴侣、融合蛋白、重组可溶性受体,和经设计用来活化细胞的任何其它物质。
某些实施方式中,刺激条件或用剂包括一种或多种物质(如刺激剂和/或辅助作用剂),例如配体,其能够活化TCR复合物的胞内信号转导结构域。某些方面,所述物质打开或启动T细胞中的TCR/CD3胞内信号转导级联,例如适合传递主信号(如启动ITAM-诱导信号活化)的物质(如对TCR组分具有特异性的物质),和/或促进共刺激信号的物质(如对T细胞共刺激受体组分特异性的物质),如抗CD3、抗CD28或抗41-BB,这些物质可以例如结合在固体支持物如珠上,和/或一种或多种细胞因子。刺激剂包括CD3/CD28磁珠(例如,
某些实施方式中,再孵育在刺激剂如细胞因子(如IL-2)存在下进行。
某些实施方式中,再孵育在室温以上进行,例如高于或高于约25℃,例如一般高于或高于约32℃、35℃或37℃。某些实施方式中,再孵育的温度是或约为37℃±2℃,例如是或约为37℃。
某些实施方式中,孵育(如与一种或多种刺激剂孵育)总时长是或约为1小时至96小时、1小时至72小时、1小时至48小时、4小时至36小时、8小时至30小时或12小时至24小时,如至少或至少约6小时、12小时、18小时、24小时、36小时或72小时。某些实施方式中,再孵育时长是或约为1小时至48小时、4小时至36小时、8小时至30小时或12小时至24小时,包括端点值。
某些实施方式中,再孵育在封闭系统中进行。某些实施方式中,从反应剂上洗脱细胞如洗入容器(如袋、管或器皿)后,含洗脱组合物的容器再孵育一段时间。某些实施方式中,所述容器的孵育温度37℃±2℃,时长是或约为1小时至48小时、4小时至36小时、8小时至30小时或12小时至24小时,包括端点值。
D.被转导细胞的示例性特征
某些实施方式中,所述方法的结果是输出组合物(如洗脱组合物)中含一定数量或一定百分比或子集的转导细胞。例如,某些实施方式中,输出组合物(如洗脱组合物)中总细胞(或特定靶细胞类型如T细胞)的至少2.5%、至少5%、至少6%、至少8%、至少10%、至少20%、至少25%、至少30%、至少40%、至少50%或至少75%被所述病毒载体转导和/或表达所述病毒载体编码的重组基因产物。某些实施方式中,所述方法的结果是,输出组合物(如洗脱组合物)中,组合物中的总细胞如T细胞的至少2.5%、至少5%、至少6%、至少8%、至少10%、至少20%、至少25%、至少30%、至少40%、至少50%或至少75%被所述病毒载体转导和/或表达所述病毒载体编码的重组基因产物。细胞转导可通过检测载体所含重组核酸(如转基因)或细胞中重组核酸的产物来测定。某些实施方式中,在细胞表面测得所述产物表明细胞被成功转导。某些实施方式中,转导的检测包括检测转导标志,例如用来标志被转导细胞的其他转基因或产物,和/或选择标志物。
某些实施方式中,所述方法能够例如这一定条件下实现一定的转导效率。例如,某些实施方式中,输入组合物中病毒与细胞的比例是或约为1感染单位(IU)/细胞至10IU/细胞,例如至少或至少约1感染单位(IU)/细胞,或至少或至少约2IU/细胞、至少或至少约5IU/细胞或至少或至少约10IU/细胞,所述方法能够产出这样的输出组合物,其中至少10%、至少25%、至少30%、至少40%、至少50%或至少75%的细胞含有重组病毒载体例如被其转导。
某些实施方式中,转导方法所得输出组合物如洗脱组合物具有一定的每细胞转导载体平均拷贝数(载体拷贝数(VCN))。VCN可用单个细胞内的拷贝数来表示。或者可表示为总细胞群或组合物(如输出或转导组合物(包含组合物内的非转导细胞,非转导细胞不含任何载体拷贝))的平均数。或者,VCN可表示了仅被转导细胞的平均拷贝数。某些实施方式中,本文方法所得转导或洗脱组合物中所有细胞中,平均VCN不超过或不超过约10、5、4、2.5、1.5或1。某些实施方式中,转导或洗脱组合物中所有含有重组病毒载体或表达重组基因产物的细胞中,平均VCN不超过或不超过约3、2、4、2.5、1.5或1。
某些方面,采用本文方法能够增强或提高某细胞如T细胞亚组的转导,这是可以可逆选择的,即细胞与寡聚反应剂和病毒颗粒接触(如转导)的至少部分期间,孵育或培养中重组至少一种或多种选择剂。某些实施方式中,有特异性结合选择标志物的选择剂存在下进行接触如孵育,相比不存在选择剂的接触如孵育,输出组合物中,选择标志物阳性的细胞(如T细胞)亚组的转导可提高至少1.5-倍、至少2.0-倍、至少3.0-倍、至少4.0-倍、至少5.0-倍、至少6.0-倍、至少7.0-倍、至少8.0-倍、至少9.0-倍、至少10-fold或更多。在一些实施方式中,选择标志物可以是本文所述的任何选择标志物。在一些实施方式中,选择标志物选自:CD25、CD28、CD62L、CCR7、CD27、CD127、CD3、CD4、CD8、CD45RA和/或CD45RO。某些实施方式中,选择性或优先定向转导细胞的能力意味着可在混合细胞群中进行转导而无需在细胞改造如活化和/或转导细胞前先分离或选择细胞。某些实施方式中,本文方法不包括在细胞活化之前或细胞转导开始之前用免疫亲和方法选择或分离细胞的步骤。
本文还提高了前文所述方法产生的组合物。某些实施方式中,组合物含有至少1x10
IV.病毒载体颗粒
某些实施方式中,本文方法包括将细胞组合物如输入组合物与病毒颗粒(亦称“病毒载体颗粒”)在寡聚反应剂如多聚化反应剂存在下接触。某些方面,含病毒载体颗粒集的细胞组合物与病毒载体颗粒结合剂接触,病毒载体颗粒结合剂结合于反应剂或所述病毒载体颗粒结合剂能够与之可逆结合的反应剂。
某些实施方式中,病毒载体颗粒是逆转录病毒载体颗粒,如慢病毒或γ逆转录病毒载体颗粒,所述病毒载体的基因组中含有编码重组和/或异源分子的核酸,所述重组和/或异源分子例如重组或异源蛋白,如重组和/或异源受体,如嵌合抗原受体(CAR)或其他抗原受体。病毒载体颗粒的基因组一般还有重组分子编码核酸之外的序列。这些序列可包括令基因组包装到病毒颗粒中的序列和/或促进重组受体如CAR编码核酸表达的序列。
在一些实施方式中,慢病毒载体颗粒是HIV-1慢病毒载体颗粒。某些实施方式中,病毒载体颗粒如逆转录病毒载体颗粒用VSV-G或其他病毒包膜糖蛋白假型化。某些实施方式中,病毒载体颗粒在其表面有合成部分,例如与所述病毒包膜糖蛋白融合或偶联的肽或标签(如亲和标签)。
A.病毒载体
本文所述病毒载体颗粒含有的基因组来自基于逆转录病毒基因组的载体,例如来自基于γ逆转录病毒或慢病毒基因组的载体。已知大量此类核酸的载体基因组((见例如Koste等,(2014)Gene Therapy 2014年4月3日,doi:10.1038/gt.2014.25;Carlens等,(2000)Exp Hematol 28(10):1137-46;Alonso-Camino等,(2013)Mol Ther Nucl Acids 2,e93;Park等,Trends Biotechnol.,2011年11月29日(11):550-557;Pfeifer和Verma(2001)Annu.Rev.Genomics Hum.Genet.,2:177-211)。所述病毒载体的某些方面,编码重组受体如抗原受体(如CAR)的异源核酸包含在和/或位于载体基因组的5′LTR和3′LTR序列之间。
某些实施方式中,病毒载体基因组是慢病毒基因组(例如HIV-1基因组或SIV基因组)。例如,已经通过多次减弱HIV毒力基因来生成慢病毒载体,例如可删除基因env、vif、vpu和nef使得载体在治疗目的上是安全的。慢病毒载体是本领域熟知的,参见,Naldini等,(1996和1998);Zufferey等,(1997);Dull等,1998,美国专利号6,013,516和5,994,136)。在一些实施方式中,这些病毒载体是基于质粒或病毒的,并且被配置为带有用于掺入外来核酸、用于选择和用于将核酸转移到宿主细胞中的必要序列。已知的慢病毒可以从诸如美国典型培养物保藏中心(“ATCC”;地址10801大学道(University Blvd.),弗吉尼亚州玛纳萨斯,20110-2209)的保藏库或收集物中容易地获得,或者使用常用的技术从已知来源分离。
慢病毒载体的非限制性实例包括衍生自慢病毒的那些,例如人免疫缺陷病毒1(HIV-1),HIV-2,猿免疫缺陷病毒(SIV),人类T淋巴细胞病毒1(HTLV-1),HTLV-2或马感染性贫血病毒(E1AV)。例如,已经通过多次减弱HIV毒力基因来生成慢病毒载体,例如删除基因env、vif、vpr、vpu和nef使得载体在治疗目的上是安全的。慢病毒载体是本领域熟知的,参见,Naldini等,(1996和1998);Zufferey等,(1997);Dull等,1998,美国专利号6,013,516和5,994,136)。在一些实施方式中,这些病毒载体是基于质粒或病毒的,并且被配置为带有用于掺入外来核酸、用于选择和用于将核酸转移到宿主细胞中的必要序列。已知的慢病毒可以从诸如美国典型培养物保藏中心(“ATCC”;10801大学道(University Blvd.),弗吉尼亚州玛纳萨斯,20110-2209)的保藏库或收集物中容易地获得,或者使用常用的技术从已知来源分离。
某些实施方式中,病毒基因组载体可含有逆转录病毒如慢病毒的5′和3′LTR。某些实施方式中,病毒基因组构建体可以包含来自慢病毒5'和3'LTR的序列,尤其,可包含来自慢病毒的5'LTR的R和U5序列以及来自慢病毒的经灭活的或自灭活3'LTR。LTR序列可以是来自任何物种的任何慢病毒的LTR序列。例如,它们可能是来自HIV,SIV,FIV或BIV的LTR序列。通常,所述LTR序列是HIV LTR序列。
在一些实施方式中,病毒载体如HIV病毒载体的核酸没有其他转录单元。载体基因组可包含经灭活的或自灭活3'LTR(Zufferey等,J Virol 72:9873,1998;Miyoshi等,JVirol 72:8150,1998)。例如,用于制造病毒载体RNA的核酸3′LTR的U3区内缺失可用来产生自灭活(SIN)载体。然后可以在逆转录过程中将此缺失转移到原病毒DNA的5'LTR。自灭活载体通常缺失了3'长末端重复序列(LTR)的增强子和启动子序列,这一缺失在载体整合过程中被复制到5'LTR中。在一些实施方式中,可以去除足够的序列(包括去除TATA盒)以消除LTR的转录活性。这可以防止在转导细胞中产生全长载体RNA。某些方面,3'LTR的U3元件含有其TATA盒、Sp1、NF-κB位点和增强子序列的缺失。由于自灭活3'LTR,在进入和逆转录后产生的前病毒将包含失活的5'LTR。这可以通过降低载体基因组动员风险和LTR对附近细胞启动子的影响来提高安全性。自灭活3'LTR可以通过本领域已知的任何方法构建。在一些实施方式中,这不影响载体的载体效价或载体的体外或体内性质。
任选地,来自慢病毒5'LTR的U3序列可以用病毒构建体中的启动子序列如异源启动子序列替代。这可以增加从包装细胞系回收病毒的滴度。增强子序列也可以包括在内。可以使用增加包装细胞系中病毒RNA基因组表达的任何增强子/启动子组合。在一个示例中,使用CMV增强子/启动子序列(US专利5,385,839和US专利5,168,062)。
在某些实施方式中,通过将逆转录病毒载体基因组例如慢病毒载体基因组构建为整合缺陷型来使插入型诱变的风险最小化。可以采用多种方法来产生非整合型载体基因组。某些实施方式中,可在pol基因的整合酶组分中制造突变,使其编码整合酶失活的蛋白质。某些实施方式中,载体基因组本身可以被修饰以通过例如突变或缺失两个附着位点之一或两者或经由缺失或修饰使3'LTR近端多嘌呤道(PPT)失能来防止整合。某些实施方式中,还有非遗传方法;这包括抑制整合酶的一种或多种功能的药剂。这些方法不是相互排斥的,也就是说,一次可以使用其中多种。例如,整合酶和附着位点都可以是非功能性的,或者整合酶和PPT位点可以是非功能性的,或者附着位点和PPT位点可以是非功能性的,或者它们都可以是非功能性的。此类方法和病毒载体基因组是已知且可以获得的(见Philpott和Thrasher,Human Gene Therapy 18:483,2007;Engelman等,J Virol 69:2729,1995;Brown等,J Virol 73:9011(1999);WO 2009/076524;McWilliams等,J Virol 77:11150,2003;Powell和Levin,J Virol 70:5288,1996)。
在一些实施方式中,载体包含用于在宿主细胞例如原核宿主细胞中繁殖的序列。在一些实施方式中,病毒载体的核酸含有在原核细胞如细菌细胞中繁殖的一个或多个复制起点。在一些实施方式中,包含原核生物复制起点的载体也可以含有其表达赋予可检测或选择标志物例如耐药性的基因。
B.核酸
1.重组受体,如嵌合抗原受体
某些实施方式中,病毒载体含有编码异源重组分子的核酸。某些实施方式中,异源重组分子是或包含重组受体如抗原受体,SB顺反子(如用于基因沉默),衣壳蛋白编码转座子,同源双链核酸(如用于基因组重组的)或报道基因(如荧光蛋白(如GFP)或荧光素酶)。
某些实施方式中,异源重组分子是重组受体,如亲和受体。这样的重组受体如异源受体可包括抗原受体,例如功能性非TCR抗原受体,包括嵌合抗原受体(CAR)和其它抗原结合受体如转基因T细胞受体(TCR)。所述受体还可包括其它受体,如其他嵌合受体,例如结合至具体配体的受体和具有与CAR中所含相似的跨膜和/或胞内信号转导结构域的受体。
所有此类实施例中,核酸插入或位于病毒载体的某区域内,例如通常在非必需区域。某些实施方式中,核酸插入病毒基因组替代某段病毒序列从而产生复制缺陷型病毒。
在一些实施方式中,编码的重组抗原受体(例如CAR)能够特异性结合目标疾病或靶细胞细胞上的一种或多种配体,例如癌症、感染性疾病、炎性或自身免疫疾病或其它疾病或病症,包括本文方法和组合物所针对的那些。示例性抗原是孤儿酪氨酸激酶受体RORl、tEGFR、Her2、Ll-CAM、CD19、CD20、CD22、间皮素、CEA、和肝炎B表面抗原、抗叶酸受体、CD23、CD24、CD30、CD33、CD38、CD44、EGFR、EGP-2、EGP-4、0EPHa2、ErbB2、3、或4、FBP、胎儿乙酰胆碱e受体、GD2、GD3、HMW-MAA、IL-22R-α、IL-13R-α2、kdr、κ轻链、Lewis Y、L1-细胞粘附分子、MAGE-A1、间皮素、MUC1、MUC16、PSCA、NKG2D配体、NY-ESO-1、MART-1、gp100、癌胚抗原、ROR1、TAG72、VEGF-R2、癌胚抗原(CEA)、前列腺特异性抗原、PSMA、Her2/neu、雌激素受体、孕酮受体、酪氨酸蛋白激酶B2、CD123、CS-1、c-Met、GD-2、和MAGE A3、CE7、维尔姆斯瘤1(WT-1)、细胞周期蛋白如细胞周期蛋白A1(CCNA1)、和/或生物素化分子,和/或通过HIV、HCV、HBV、HPV和/或其它病原体表达和/或表征的分子,和/或其致癌形式。
示例性的受体,包括CAR和重组TCR,及其生产和引入,在一些实施方式中,包括例如,在国际专利申请公开号WO200014257、WO2013126726、WO2012/129514、WO2014031687、WO2013/166321、WO2013/071154、WO2013/123061,美国专利申请公开号US2002131960、US2013287748、US20130149337,美国专利号6,451,995、7,446,190、8,252,592、8,339,645、8,398,282、7,446,179、6,410,319、7,070,995、7,265,209、7,354,762、7,446,191、8,324,353、和8,479,118,和欧洲专利申请号EP2537416中所述的那些,和/或Sadelain等,CancerDiscov.2013年4月;3(4):388–398;Davila等,(2013)PLoS ONE 8(4):e61338;Turtle等,Curr.Opin.Immunol.,2012年10月;24(5):633-39;Wu等,Cancer,2012年3月18(2):160-75中所述的那些。
a.嵌合抗原受体
某些实施方式中,病毒载体基因组内的核酸编码嵌合抗原受体(CAR)。CAR一般是遗传工程受体,具有胞外配体结合域,如含有抗体或其片段胞外部分,胞外结合域与胞内信号转导组分相连。在一些实施方式中,所述嵌合抗原受体包括跨膜结构域和/或将胞外结构域与胞内信号转导结构域相连的胞内结构域。此类分子通常模拟或模仿通过天然抗原受体的信号和/或通过此类受体联合共刺激受体的信号。
在一些实施方式中,CAR构建成具对特定标志的特异性,例如过继治疗目标细胞类型表达的标志,例如,癌症标志物和/或各种所述抗原。因此,CAR一般包括一个或多个抗体的抗原结合片段、结构域、或部分,或者一个或多个抗体可变结构域、和/或抗体分子。在一些实施方式中,所述CAR包括抗体分子的一个或多个抗原-结合部分,例如可变重链(VH)或其抗原结合部分,或源自单克隆抗体(mAb)的可变重(VH)和可变轻(VL)链的单链抗体片段(scFv)。
某些实施方式中,CAR的胞外部分如抗体结合部分还包括间隔子,例如抗原识别组分(如scFv)与跨膜结构域之间的间隔区。间隔子可以是或包括免疫球蛋白恒区或其变体或其修饰形式的至少一部分,例如铰链区例(如IgG4铰链区)和/或CH1/CL和/或Fc区。在一些实施方式中,恒定区或部分是人IgG(如IgG4或IgG1)的。间隔子的长度可以是:与没有间隔子相比,该长度的间隔子提高抗原结合之后的细胞响应。在一些示例中,间隔子的长度是或约是12个氨基酸,或者不超过12个氨基酸。示例性的间隔子包括具有如下长度的那些:至少约10至229个氨基酸、约10至200个氨基酸、约10至175个氨基酸、约10至150个氨基酸、约10至125个氨基酸、约10至100个氨基酸、约10至75个氨基酸、约10至50个氨基酸、约10至40个氨基酸、约10至30个氨基酸、约10至20个氨基酸或约10至15个氨基酸,并且包括上述所列范围的任何端点之间的整数。在一些实施方式中,间隔区具有约12个氨基酸或更短,约119个氨基酸或更短或约229个氨基酸或更短。示例性间隔子包括单IgG4铰链,IgG4铰链连CH2和CH3结构域,或IgG4铰链连CH3结构域。示例性的间隔物包括但不限于如下文献所述的那些:Hudecek等.(2013)Clin.Cancer Res.,19:3153或国际专利申请公开号WO2014031687。
胞外配体结合域例如抗原识别结构域一般连接至一个或多个胞内信号转导组分,例如模拟通过抗原受体复合物(就CAR而言是TCR复合物)和/或其他细胞表面来活化的信号转导组分。某些实施方式中,跨膜结构域连接胞外配体结合结构域和胞内信号转导结构域。在一些实施方式中,CAR包括与胞外结构域融合的跨膜结构域。实施方式之一中,采用天然关联受体(例如CAR)内结构域之一的跨膜结构域。在一些情况中,跨膜结构域经氨基酸取代选择或修饰,以避免这类结构域结合相同或不同表面膜蛋白的跨膜结构域,尽可能减少与受体复合物其它成员的相互作用。
在一些实施方式中,所述跨膜结构域源自天然或合成来源。当所述来源是天然来源时,某些方面,所述结构域源自任何膜结合或跨膜蛋白。跨膜区包括源自T-细胞受体α、β或ζ链,CD28,CD3ε,CD45,CD4,CD5,CDS,CD9,CD 16,CD22,CD33,CD37,CD64,CD80,CD86,CD134,CD137,CD 154的那些(即包含至少它们的跨膜区域)。在一些实施方式中,所述跨膜结构域是合成的。某些方面,合成跨膜结构域以疏水残基为主,例如亮氨酸和缬氨酸。某些方面,合成跨膜结构域的各末端会有苯丙氨酸、色氨酸和缬氨酸的三联体。在一些实施方式中,连接是通过接头、间隔子和/或跨膜结构域。
在一些实施方式中,存在短的寡肽或多肽接头,例如,长度为2至10个氨基酸的接头,例如包含甘氨酸和丝氨酸(例如,甘氨酸-丝氨酸二联体)的接头,并在CAR的胞质信号转导结构域和跨膜结构域之间形成连接。
受体如CAR一般包括至少一种或一个胞内信号转导组分。在一些实施方式中,受体包括TCR复合物的胞内组分,例如介导T-细胞活化和细胞毒性的TCR CD3链,例如,CD3ζ链。因此,某些方面,抗原-结合部分连接一个或多个细胞信号转导模块。在一些实施方式中,细胞信号转导模块包括CD3跨膜结构域、CD3胞内信号转导结构域,和/或其它CD跨膜结构域。在一些实施方式中,受体如CAR还包括一种或多种其它分子部分,如Fc受体γ、CD8、CD4、CD25或CD16。例如,在一些方面,CAR或其它嵌合受体包括CD3ζ(CD3-ζ)或Fc受体γ与CD8、CD4、CD25或CD16的嵌合分子。
在一些实施方式中,在CAR或其它嵌合受体结合时,受体的胞质结构域或胞内信号转导结构域活化免疫细胞(如经改造表达CAR的T细胞)至少一项正常效应功能或应答。例如,在一些情况中,CAR诱导T细胞诸如溶细胞活性或辅助性T细胞活性等功能,如分泌细胞因子或其它因子。在一些实施方式中,采用抗原受体部分或共刺激分子的胞内信号转导结构域的截短部分来替代完整免疫刺激链,例如,如果其转导效应物功能信号的话。在一些实施方式中,一种或多种胞内信号转导结构域包括T细胞受体(TCR)的胞质序列,某些方面中还包括共同受体(co-receptor),共同受体在天然情况下与受体协同作用在抗原受体接合后引发信号转导;和/或此类分子的任何衍生物或变体,和/或具有相同功能性能力的任何合成序列。
就天然TCR而言,完全活化一般不仅需要通过TCR的信号转导,而且还需要共刺激信号。因此,在一些实施方式中,为了促进完全活化,CAR还包括用于产生次或共刺激信号的组分。在其他实施方式中,CAR不包括用于产生共刺激信号的组分。某些方面,同一细胞表达另一CAR来提供用于产生次或共刺激信号的组分。
某些方面,T细胞活化被认为通过两类胞质信号转导序列介导:引发通过TCR的抗原依赖性主活化的那些(主胞质信号转导序列)和以非抗原依赖性方式作用提供次或共刺激信号的那些(次胞质信号转导序列)。某些方面,CAR包括这些信号转导组分之一或两者。
某些方面,CAR包括主胞质信号转导序列,其调控TCR复合物的主活化。以刺激方式作用的主胞质信号转导序列可包含信号转导基序,这些基序又称基于免疫受体酪氨酸的活化基序或ITAM。ITAM的实例包括主胞质信号转导序列,其包括源自如下的那些:TCRζ,FcRγ,FcRβ,CD3γ,CD3δ,CD3ε,CDS,CD22,CD79a,CD79b,和CD66d。在一些实施方式中,CAR中的胞质信号转导分子包含胞质信号转导结构域,其部分,或源自CD3ζ的序列。
在一些实施方式中,CAR包括共刺激受体的跨膜部分和/或信号转导结构域,如CD28、4-1BB、OX40、DAP10,和ICOS的。某些方面,同一CAR即包含活化组分有包含共刺激组分。
在一些实施方式中,活化结构域包括在一个CAR内,而共刺激组分由识别另一种抗原的另一CAR提供。在一些实施方式中,CAR包括活化或刺激CAR和共刺激CAR,它们表达在同一细胞上(参见WO2014/055668)。某些方面,CAR是刺激性或活化性CAR;在其它方面中,其是共刺激CAR。在一些实施方式中,细胞还具有抑制性CAR(iCAR,参见Fedorov等,Sci.Transl.Medicine,5(215)(2013年12月),例如识别其他抗原的CAR,由此,通过识别第一抗体的CAR传递的活化信号因为该抑制性CAR与其配体的接合而被消减或抑制,由此可以例如减少脱靶效应。
在某些实施方式中,胞内信号转导结构域包含CD28跨膜和信号转导结构域,其与CD3胞内结构域相连。在一些实施方式中,胞内信号转导结构域包含嵌合CD28和CD137共刺激结构域,其与CD3胞内结构域相连。
在一些实施方式中,CAR还可包括转导标志物(例如,tEGFR)。在一些实施方式中,CD8
在一些实施方式中,CAR的胞质部分包含一个或多个例如两个或更多共刺激结构域和活化结构域如主活化结构域。示例性的CAR含有CD3-ζ、CD28和4-1BB的胞内部分。
在一些实施方式中,本文病毒载体内核酸编码的重组受体如CAR还包括一种或多种标志物,例如用于确认细胞被转导或细胞经改造而表达受体和/或选择和/或靶向表达由多核苷酸编码的分子的细胞。某些方面,可由不同的核酸或多核苷酸编码标志物,这可在遗传工程改造过程期间引入,一般通过相同方法,例如由相同载体或相同类型的载体转导。
某些方面,标志物如转导标志物是蛋白质和/或是细胞表面分子。示例性的标志物是天然的,例如内源性标志物如天然细胞表面分子的截短变体。某些方面,与天然或内源性细胞表面分子相比,所述变体具有降低的免疫原性,降低的运输功能,和/或降低的信号转导功能。某些实施方式中,标志是截短的细胞表面受体,如截短EGFR(tEGFR)。在一些方面,标志物包括CD34、NGFR或表皮生长因子受体(例如tEGFR)的全部或部分(例如截短形式)。在一些实施方式中,编码标志物的核酸可操作性地连接编码接头序列(例如可切割接头序列,例如,T2A)的多核苷酸。参见WO2014031687。
在一些实施方式中,标志物是分子,例如,非天然可见于T细胞或T细胞表面的细胞表面蛋白或其组成部分。
在一些实施方式中,所述分子是非自体分子,例如非自体蛋白质,即不被待接受该细胞过继转移的宿主的免疫系统识别为“自身”的蛋白质。
在一些实施方式中,所述标志物无治疗性功能和/或除了用作遗传改造的标志物(例如,用于选择成功被改造的细胞)之外没有任何作用。在其它实施方式中,所述标志物可以是治疗性分子或在其它情况中发挥一些所需效果的分子,例如有待在体内遇到的细胞的配体,例如共刺激或免疫哨点分子,用来增强和/或抑制所述细胞在过继转移和遇到配体之后的响应。
在一些情况中,CAR被称为第一、第二和/或第三代CAR。某些方面,第一代CAR仅在抗原结合后提供CD3-链诱导的信号;某些方面,第二代CAR提供信号和共刺激信号,例如包含共刺激受体如CD28或CD137的胞内信号转导结构域的CAR;某些方面,第三代CAR包含多个不同共刺激受体的共刺激结构域。
在一些实施方式中,所述嵌合抗原受体包括胞外配体接合结构域(如抗原接合部分(如抗体或其片段))和胞内结构域。在一些实施方式中,所述抗体或片段包括scFv或单结构域V
某些实施方式中,受体(如CAR)的跨膜结构域是人CD28或其变体的跨膜结构域,例如人CD28(登录号:P10747.1)的27氨基酸跨膜结构域。在一些实施方式中,胞内信号转导结构域包含人CD28的胞内共刺激信号转导结构域或其功能变体,如其一个41个氨基酸的结构域和/或天然CD28蛋白186-187位有LL至GG取代的结构域。某些实施方式中,胞内结构域包含41BB胞内共刺激信号转导结构域或其功能变体,例如人4-1BB(登录号Q07011.1)的42氨基酸胞质结构域。在一些实施方式中,胞内信号转导结构域包含人CD3ζ刺激信号转导结构域或其功能变体,例如人CD3ζ同种型3(登录号:P20963.2)的112AA胞质结构域,或CD3ζ信号转导结构域,其描述于美国专利号:7,446,190。某些方面,间隔子仅含IgG铰链区,例如仅IgG4或IgG1的铰链区。另一些实施方式中,间隔子是Ig铰链(如IgG4铰链)连CH2和/或CH3结构域。另一些实施方式中,间隔子是Ig铰链(如IgG4铰链)连CH2和/或CH3结构域。另一些实施方式中,间隔子是Ig铰链(如IgG4铰链)仅连CH3结构域。在一些实施方式中,间隔子是或含富甘氨酸-丝氨酸序列或其它柔性接头,例如已知柔性接头。
例如,一些实施方式中,CAR包含:胞外配体接合部分,如特异性结合某抗原(如本文所述抗原)的抗原接合部分,如抗体或其片段(包括sdAb和scFv);间隔子,例如含各种Ig铰链区的间隔子;跨膜结构域,是CD28的组成部分或其变体;胞内信号转导结构域,含有CD28的信号转导部分或其功能性变体;和CD3ζ的信号转导部分或其功能性变体。某些实施方式中,CAR包含:胞外配体接合部分,如特异性结合某抗原(如本文所述抗原)的抗原接合部分,如抗体或其片段(包括sdAb和scFv);间隔子,例如含各种Ig铰链区的间隔子;跨膜结构域,是CD28的组成部分或其变体;胞内信号转导结构域,含有4-1BB的信号转导部分或其功能性变体;和CD3ζ的信号转导部分或其功能性变体。某些实施方式中,此类CAR构建体,例如在CDR下游,还包含核糖体跳跃元件和/或tEGFR序列。
b.T细胞受体(TCR)
在一些实施方式中,由核酸编码的重组分子是或含重组T细胞受体(TCR)。在一些实施方式中,重组TCR具有抗原特异性,一般是靶细胞上的抗原,例如肿瘤特异性抗原,自体免疫或炎性疾病相关细胞类型上表达的抗原,或源自病毒病原体或细菌病原体的抗原。
在一些实施方式中,TCR是从天然T细胞中克隆的。在一些实施方式中,从患者鉴定并分离的针对靶抗原(例如癌症抗原)的高亲和性T细胞克隆。在一些实施方式中,已在用人免疫系统基因(如人白细胞抗原系统或HLA)改造的转基因小鼠中获得针对目标抗原(如肿瘤抗原)的TCR克隆(见,如Parkhurst等,(2009)Clin Cancer Res.15:169–180和Cohen等(2005)J Immunol.175:5799–5808)。某些实施方式中,用噬菌体展示分离针对目标抗原的TCR(参见例如,Varela-Rohena等,(2008)Nat Med.14:1390–1395和Li(2005)NatBiotechnol.23(2009)Clin Cancer Res.15:169–180和Cohen等,(2005)J Immunol.175:5799–5808)。某些实施方式中,用病原体展示来分离针对靶抗原的分离TCR(参见例如,Varela-Rohena等,(2008)Nat Med.14:1390–1395和Li(2005)Nat Biotechnol.23:349–354)。
在一些实施方式中,获得T细胞克隆后,将TCRα和β链分离并克隆入基因表达载体。在一些实施方式中,TCRα和β基因通过小核糖核酸病毒2A核糖体跳跃肽(skip peptide)连接,使得两条链共表达。在一些实施方式中,编码TCR的核酸还包含标志物以确认细胞被转导或被改造而表达该受体。
2.其他调控元件
某些实施方式中,病毒载体基因组中编码重组受体(如抗原受体(如CAR))的核酸序列功能相关地操作性连接其他遗传元件,如转录调控序列(包括启动子和增强子),来调控目标序列以特定方式表达。某些情形中,这样的转录调控序列是对活性进行时间性和/或空间性调控的那些。可用于调节组分表达的表达控制元件是本领域已知的,包括但不限于诱导型启动子、组成型启动子、分泌信号、增强子或其它调控元件。
某些实施方式中,编码编码重组受体(如抗原受体(如CAR))的核酸序列操作性连接内部启动子/增强子调控序列。所用启动子可以是组成型、组织特异性、诱导型和/或适当条件下可用型,用来令导入的DNA片段高表达。启动子可以是异源或内源的。某些实施方式中,启动子和/或增强子是合成的。某些实施方式中,启动子和/或增强子是用重组克隆技术和/或核酸扩增计算产生的。
在一些实施方式中,启动子和/或增强子可以是与核酸序列天然关联的那些,如可通过分离编码片段和/或外显子上游的5′非编码序列获得。或者,在一些实施方式中,编码核酸区段可位于天然环境中通常不与该编码核酸序列关联的重组和/或异源启动子和/或增强子的控制下。例如,用于重组DNA构建的示例性启动子包括但不限于,β-内酰胺酶(青霉素酶)、乳糖、色氨酸(trp)、RNA聚合酶(pol)III启动子包括,人和鼠U6 pol III启动子以及人和鼠H1 RNA pol III启动子;RNA聚合酶(pol)II启动子;巨细胞病毒立即早期启动子(pCMV)、延长因子-1α(EF-1α)、和劳氏肉瘤病毒长末端重复启动子(pRSV)启动子系统。某些实施方式中,启动子可以获自例如多瘤病毒,禽痘病毒,腺病毒,牛乳头瘤病毒,禽肉瘤病毒,巨细胞病毒,逆转录病毒,乙型肝炎病毒和猿猴病毒40(SV40)等病毒的基因组。启动子还可以是例如异源哺乳动物启动子,例如肌动蛋白启动子或免疫球蛋白启动子,热休克启动子或通常与天然序列关联的启动子,条件是这种启动子与靶细胞相容。实施方式之一中,启动子是病毒表达系统中天然病毒启动子。
某些实施方式中,启动子可以是具有组成型活性的。可用组成型启动子的非限制性实例包括泛素启动子(US 5,510,474;WO 98/32869,)、CMV(Thomsen等,PNAS 81:659,1984;US 5,168,062,)、β-肌动蛋白(Gunning等1989Proc.Natl.Acad.Sci.USA 84:4831-4835,)和pgk(参见例如,Adra等1987Gene 60:65-74;Singer-Sam等1984Gene 32:409-417;和Dobson等1982Nucleic Acids Res.10:2635-2637)。
某些实施方式中,启动子可以是组织特异性启动子和/或靶细胞特异性启动子。某些实施方式中,可以选择启动子从而允许目标序列的诱导型表达。已知众多用于诱导型表达的系统,包括四环素响应系统,lac操纵子-阻遏物系统,以及对多种环境或生理变化响应的启动子,包括对热休克、金属离子,如金属硫蛋白启动子,对干扰素、缺氧、类固醇,如孕酮或糖皮质激素受体启动子,对辐射,如VEGF启动子。在一些实施方式中,四环素-(tet)-可调节系统基于大肠杆菌的tet抑制(tetr)对tet操纵子序列(TECO)的抑制作用,可修改用于哺乳动物系统并用作表达盒的可调节元件。此类系统是已知的。(参见Goshen和Badgered,Proc.Natl.Acad.Sci.USA 89:5547-51(1992),Shockett等,Proc.Natl.Acad.Sci.USA 92:6522-26(1996),Lindemann等,Mol.Med.3:466-76(1997))。
也可用启动子组合获得想要的目标基因表达。普通技术人员将能够基于生物体或目标靶细胞想要的基因表达方式来选择启动子。
某些实施方式中,病毒构建体中还可以有内部增强子用来增强目标基因的表达。增强子通常是顺式作用元件,一般长约10-300bp,作用于启动子以增加其转录。已知许多病毒(例如HIV或CMV)基因组内的增强子。例如,可以使用CMV增强子(Boshart等,Cell,41:521,1985)。其他例子包括,例如:复制起点后侧的SV40增强子(bp100-270),巨细胞病毒早期启动子增强子,复制起点后侧的多瘤增强子和腺病毒增强子。某些情形中,增强子来自哺乳动物基因,例如球蛋白,弹性蛋白酶,白蛋白,甲胎蛋白和胰岛素的增强子。增强子可与异源启动子联用。增强子可以在载体内接在目标基因编码序列的5'或3'侧位置,但一般在启动子的5'侧位置。本领域普通技术人员能够根据想要的表达方式选择适当的增强子。
病毒载体基因组还可以含有其他遗传元件。对于可以包含在构建体中的元件的类型没有任何限制,可以由本领域技术人员选择。
例如,可以包含促进靶细胞中病毒基因组核进入的信号。这样的信号的一个示例HIV-1侧翼信号。此外,载体基因组可以包括设计成增强感兴趣的基因表达的一个或多个遗传元件。某些实施方式中,基因组含有转录后调控元件(PRE)或其修饰形式,它们表现转录后活性。例如,某些实施方式中,可将土拨鼠肝炎病毒的转录后响应元件(WPRE)置于构建体中(Zufferey等1999.J.Virol.74:3668-3681;Deglon等2000.Hum.Gene Ther.11:179-190,)。
某些情形中,可以包含超过一个开放读码框,各自编码隔开的异源蛋白。例如,某些实施方式中,如果表达构建体内含有一报导和/或可测和/或可选基因,则可以包含内部核糖体进入位点(IRES)。通常,其他遗传元件操作性连接或受控于独立的启动子/增强子。其他遗传元件可以是报道基因、可选基因或其他需要的基因。
某些实施方式中,其他各自调控元件可以包括转录起始区和/或终止区。表达载体还可以含有终止转录和稳定mRNA所需的序列。这些序列是已知的,通常天然存在于真核或病毒DNA或cDNA的5'(偶尔在3')非翻译区。转录终止区的例子包括但不限于聚腺苷酸化信号序列。聚腺苷酸化信号序列的例子包括但不限于牛生长因子(BGH)多聚(A)、SV40晚期多聚(A)、兔β球蛋白(RBG)多聚(A)、胸苷激酶(TK)多聚(A)序列或它们的变体。
C.病毒载体颗粒的制备
病毒载体基因组通常构建成质粒形式,该质粒形式能够转染到包装细胞系或生产者细胞系中。可用任一已知方法来生产逆转录病毒颗粒,其含有病毒载体基因组的RNA拷贝。某些实施方式中,制造基于病毒的基于递送系统包括至少两个组件:第一,包装质粒,包含产生病毒载体颗粒所必需的酶和结构蛋白;第二,病毒载体本身,即待传递的遗传物质。可以在设计这些组件中的一个或两个时引入生物安全保障措施。
在一些实施方式中,包装质粒可以包含除包膜蛋白以外的全部逆转录病毒(如HIV-)1蛋白(Naldini等,1998)。其他实施方式中,病毒载体可以缺失其他病毒基因,如与毒力相关的病毒基因,例如,vpr,vif,vpu和nef,和/或Tat,HIV的主要反式激活因子。在一些实施方式中,慢病毒载体(例如基于HIV的慢病毒载体)仅含亲本病毒的三个基因:gag,pol和rev,这降低或消除了通过重组再生野生型病毒的可能性。
实施方式之一中,将病毒载体基因组导入包装细胞系,该细胞系含有将由病毒载体基因组转录所得病毒基因组RNA包装到病毒颗粒中所需的全部组分。或者,在一个或多个目标序列之外,病毒载体基因组还包含包括编码病毒组分的一个或多个基因。某些方面,然而,为了防止基因组在靶细胞中复制,通常将复制必需的内源病毒基因去除,而另含于包装细胞系中。
在一些实施方式中,用含有产生颗粒所必需的组分的一种或多种质粒载体转染包装细胞系。在一些实施方式中,用含有病毒载体基因组(包括LTR、顺式作用包装序列和目标序列即编码重组蛋白(如抗原受体(如CAR))的核酸)的质粒和一个或多个编码病毒酶组分和/或结构组分(如Env,Gag,pol和/或rev)的辅助质粒转染包装细胞系。在一些实施方式中,使用多个载体来分隔产生逆转录病毒载体颗粒的各种遗传组分。某些此类实施方式中,向包装细胞提供分开的不同载体,从而减少重组事件的机会,否则重组时间可能产生具有复制能力的病毒。在一些实施方式中,可以使用具有全部逆转录病毒组分的单个质粒载体。
在一些实施方式中,逆转录病毒载体颗粒(如慢病毒载体颗粒)被假型化以增加宿主细胞的转导效率。例如,逆转录病毒载体颗粒(如慢病毒载体颗粒)用VSV-G糖蛋白假型化,提供较宽的宿主范围,由此拓宽可被转导的细胞类型范围。某些实施方式中,包装细胞系用编码非原有包膜蛋白的质粒或聚核苷酸转染,例如引入嗜异性、多嗜性或兼嗜性包膜,例如辛德毕斯病毒包膜,GALV或VSV-G。
某些实施方式中,包装细胞系提供包括病毒调节和结构蛋白的组分,这些组分以反式形式(in trans)为将病毒基因组RNA包装到慢病毒载体颗粒中所需。某些实施方式中,包装细胞系可以是能够表达慢病毒蛋白并产生功能性慢病毒载体颗粒的任何细胞系。某些方面,合适的包装细胞系包括293(ATCC CCL X)、293T、HeLa(ATCC CCL 2)、D17(ATCC CCL183)、MDCK(ATCC CCL 34)、BHK(ATCC CCL-10)和Cf2Th(ATCC CRL 1430)细胞。
某些实施方式中,包装细胞系稳定表达一种或多种病毒蛋白。例如,某些方面,可以构建包含gag、pol、rev和/或其他结构基因但不含LTR并含有包装组分的包装细胞系。某些实施方式中,包装细胞系可以用以下所述瞬时转染:编码一种或多种病毒蛋白的核酸分子和病毒载体基因组,病毒载体基因组含有编码异源蛋白的核酸分子和/或编码包膜糖蛋白的核酸。
在一些实施方式中,病毒载体和包装质粒和/或复制质粒通过转染或感染引入包装细胞系。包装细胞系产生含有病毒载体基因组的病毒载体颗粒。转染或感染的方法是众所周知的。非限制性实例包括磷酸钙,DEAE-葡聚糖和脂质转染方法,电穿孔和显微注射。
当重组质粒与逆转录病毒LTR以及包装序列被导入特定细胞系中(例如通过磷酸钙沉淀),包装序列可允许重组质粒的RNA转录产物包装到病毒颗粒中,然后可分泌到培养基中。在一些实施方式中,然后收集含有重组逆转录病毒的基质,任选地浓缩并用于基因转化。例如,某些方面,在将包装质粒和转移载体共转染至包装细胞系后,从培养基中回收病毒载体颗粒,并通过本领域技术人员使用的标准方法进行滴定。
在一些实施方式中,可在包装细胞系(如HEK 293T细胞系)中生产逆转录病毒颗粒如慢病毒载体,通过导入质粒以允许产生慢病毒颗粒。某些实施方式中,包装细胞被转染了和/或含有编码gag和pol的聚核苷酸和编码重组受体(如抗原受体(如CAR))的聚核苷酸。某些实施方式中,包装细胞系可选性地和/或附加性地转染了和/或含有编码rev蛋白的聚核苷酸。某些实施方式中,包装细胞系可选性地和/或附加性地转染了和/或含有编码非原有包膜糖蛋白如VSV-G的聚核苷酸。某些此类实施方式中,细胞(如HEK 293T细胞)转染后约2天,可收获含有重组慢病毒载体的细胞上清液并进行滴定。
收获和/或产生的逆转录病毒载体颗粒可用于用本文所述方法转导靶细胞。一旦在靶细胞中,病毒RNA被逆转录,导入细胞核并稳定整合到宿主基因组中。病毒RNA整合后1或2天,可以检测到重组蛋白(如可以受体(如CAR))的表达。
V.组合物、制剂和给药方法
本文还提供了包含工程化改造受体(例如工程化改造抗原受体(如CAR或TCR))的组合物,以及包含工程化改造细胞的组合物,包括药物组合物和制剂。本文还提供了使用这些组合物的方法以及这些组合物的用途,如在表达该抗原的疾病、病症和异常的治疗中的使用和用途,以及在检测、诊断和预防方法中的应用。
A.组合物/制剂
术语“药物制剂”指此类形式的制剂:所述其中所含活性成分的生物学活性有效,并且不含对待接受该制剂的对象具有不可接受的毒性的其他成分。
“药学上可接受的运载体”指药物制剂中的一种成分,其不是活性成分,其对对象无毒。药学上可接受的运载体包括但是不限于,缓冲剂、赋形剂、稳定剂或防腐剂。
某些方面,运载体的选择部分决定于具体的细胞和/或给药方法。因此,存在多种合适的配方。例如,所述药物组合物可包含防腐剂。合适的防腐剂可包括,例如,对羟基苯甲酸甲酯、对羟基苯甲酸丙酯、苯甲酸钠和苯扎氯铵。某些方面,采用两种或更多种防腐剂的混合物。防腐剂或其混合物的存在量通常是约0.0001%至约2%(以组合物总重量计)。运载体描述于,例如,《雷明顿药物科学》(Remington'sPharmaceutical Sciences),第16版,Osol,A.编(1980)。在所用剂量和浓度下,药学上可接受的运载体通常是对受者无毒的,包括但不限于:缓冲剂如磷酸盐、柠檬酸盐和其它有机酸缓冲剂;抗氧化剂,包括抗坏血酸和甲硫氨酸;防腐剂(如十八烷基二甲基苄基氯化铵;氯化六烃季铵;苯扎氯铵、苄索氯铵;苯酚、丁基或苄基醇;对羟基苯甲酸烷酯,如对羟基苯甲酸甲酯或丙酯;邻苯二酚;间苯二酚;环己醇;3-戊醇;和间甲酚);低分子量(小于约10个残基)的多肽;蛋白质,如血清白蛋白、明胶或免疫球蛋白;亲水性聚合物,如聚乙烯吡咯烷酮;氨基酸,如甘氨酸、谷胺酰胺、天冬酰胺、组氨酸、精氨酸或赖氨酸;单糖、二糖和其它糖,包括葡萄糖、甘露糖或糊精;螯合剂,如EDTA;糖,如蔗糖、甘露醇、海藻糖或山梨糖醇;形成盐的抗衡离子,如钠;金属络合物(如Zn-蛋白质络合物);和/或非离子型表面活性剂,例如聚乙二醇(PEG)。
某些方面,所述组合物包含缓冲剂。合适的缓冲剂包括,例如,柠檬酸、柠檬酸钠、磷酸、磷酸钾和多种其他酸和盐。某些方面,采用两种或更多种缓冲剂的混合物。缓冲剂或其混合物的存在量通常是约0.001%至约4%(以组合物总重量计)。用于制备可给予的药物组合物的方法是已知的。示例性方法具体描述于,例如,《雷明顿:药物科学与实践》(Remington:The Science and Practice of Pharmacy),LWW公司(Lippincott Williams&Wilkins);第21版(2005年5月1日)。
所述制剂或组合物还可包含超过一种对于待接受细胞治疗的具体适应症、疾病或病症有用的活性成分,优选活性与所用细胞互补的那些,这些活性成分各自的活性剂不会对彼此产生不利影响。这类活性成分适合以有效用于所需目的的用量联合存在。因此,在一些实施方式中,所述药物组合物还包含其它药学活性物质或药物,例如化疗剂,例如,天冬酰胺酶,白消安,卡铂,顺铂,柔红霉素,多柔比星,氟尿嘧啶,吉西他滨,羟基脲,甲氨蝶呤,紫杉醇,利妥昔单抗,长春碱,长春新碱等.在一些实施方式中,细胞或抗体以盐如药学上可接受的盐的形式给予。合适的药学上可接受的酸加成盐包括源自无机酸的那些,例如盐酸、氢溴酸、磷酸、偏磷酸、硝酸和硫酸,和有机酸,例如酒石酸、乙酸、柠檬酸、苹果酸、乳酸、富马酸、苯甲酸、乙醇酸、葡萄糖酸、琥珀酸和芳基磺酸,例如,对甲苯磺酸。
活性成分可包封在微囊剂中,在胶体药物递送系统(例如,脂质体、白蛋白微球、微乳液、纳米颗粒和纳米胶囊)中或在大乳液(macroemulsion)中。在某些实施方式中,所述药物组合物配制成包结复合物(例如环糊精包结复合物)或脂质体。脂质体可用以将宿主细胞(例如T-细胞或NK细胞)定向到具体组织。许多方法可用于制备脂质体,例如描述于,例如,Szoka等,Ann.Rev.Biophys.Bioeng.,9:467(1980)和美国专利4,235,871、4,501,728、4,837,028和5,019,369中的那些。
某些方面,药物组合物采用定时-释放、延迟释放和持续释放递送系统,这样,组合物的递送发生在治疗部位敏化之前发生,并且有足够的时间造成该部位敏化。许多类型的释放递送系统是可得并已知的。此类系统能避免重复给予所述组合物,由此提高对象和医师的便利度。
在一些实施方式中,药物组合物包含有效治疗或预防疾病或病症的量如治疗有效或预防有效量的细胞。在一些实施方式中,通过定期评估治疗的对象来监测治疗或预防功效。对于数天或更长时间的重复给药,可根据所述病症重复治疗直至疾病症状得到所需阻遏。然而,其它剂量方案可能是有用的并可以确定。所需剂量的递送可以通过单次推注(bolus)给予所述组合物,通过多次推注给予所述组合物或通过连续输注给予组合物。
可采用标准给药技术、制剂和/或器械给予细胞。本文提供了用于储存和给予组合物的制剂和装置,如注射器和瓶。所述细胞的给予可以是自体同源或是异源的。例如,可以从一个对象获取免疫抑制细胞或祖细胞,给予同一对象或不同的相容对象。外周血衍生的免疫抑制细胞或其后代(例如,体内、离体或体外衍生的)可通过局部注射给予,包括导管给药、全身注射、局部注射、静脉注射、或胃肠外给药。当给予治疗性组合物(例如含有遗传修饰免疫抑制细胞的药物组合物)时,其通常被配制成单位剂型的可注射形式(溶液、悬液、乳液)。
制剂包括用于口服、静脉内、腹膜内、皮下、肺、透皮、肌肉内、鼻内、粘膜、舌下或栓剂给药的那些。在一些实施方式中,所述细胞群胃肠外给予。本文所用的术语“胃肠外”包括静脉内、肌内、皮下、直肠、阴道和腹膜内给予。在一些实施方式中,所述细胞群通过静脉内、腹膜内或皮下注射采用外围全身递送给予对象。
在一些实施方式中,组合物是无菌液体制剂,例如等渗水性溶液、悬液、乳液、分散系或粘性组合物,其某些方面可缓冲至选定pH。液体制剂通常比凝胶、其他粘性组合物和固体组合物更容易制备。另外,液体组合物一定程度上多少更便于给药,尤其是通过注射给药。在另一方面,粘性组合物可配制在合适的粘度范围以延长与特定组织的接触时间。液体或粘性组合物可包括运载体,其可以是溶剂或分散介质,其含有例如水、盐水、磷酸盐缓冲盐水、多羟基化合物(例如,甘油、丙二醇、液体聚乙二醇)及以上合适的混合物。
可通过将所述细胞纳入溶剂中,例如与合适的运载体、稀释剂、或赋形剂如无菌水、生理盐水、葡萄糖、右旋糖等活化,来制备无菌可注射溶液。也可将该组合物冻干。组合物可含有辅助性物质,如润湿、分散、或乳化剂(例如,甲基纤维素)、pH缓冲剂、胶凝或粘度增强添加剂、防腐剂、风味剂、色素等,这取决于所需的给药和制备途径。某些方面,可查阅标准文件来制备合适制备物。
可添加增强组合物稳定性和无菌性的各种添加剂,包括抗微生物防腐剂、抗氧化剂、螯合剂和缓冲剂。也可通过各种抗细菌剂和抗真菌剂(如对羟基苯甲酸酯类、氯丁醇、苯酚、山梨酸等)确保避免微生物作用。可通过使用延迟吸收的物质(如单硬脂酸铝和明胶)延长可注射药物形式的吸收。
可制备缓释制剂。缓释制剂的合适例子包括含抗体固体疏水性聚合物半渗透基质,其中基质是成型制品的形式,例如膜或微胶囊。
用于体内给药的制剂一般为无菌的。例如,可通过无菌滤膜过滤方便地地做到无菌。
B.给药方法
本文提供给予所述细胞、群和组合物的方法,所述细胞、群和组合物用于治疗或防止疾病、病症和紊乱,包括癌症的应用。在一些实施方式中,将细胞、群和组合物给予具有具体待治疗(例如通过过继细胞治疗(例如过继T细胞治疗))的疾病或病症的对象或患者。在一些实施方式中,将本文提供的方法制备的细胞和组合物(例如在孵育和/或其它处理步骤之后工程改造的组合物和生产终末组合)给予对象,如具有所述疾病或病症或有风险患上所述疾病或病症的对象。某些方面,所述方法由此治疗例如减轻所述疾病或病症的一种或多种症状,例如减小癌症的肿瘤负荷,该癌症表达经改造T细胞识别的抗原。
给予过继细胞治疗所用细胞的方法是已知的,可与本文方法和组合物联用。例如,过继T细胞治疗方法可见例如,Gruenberg等的美国专利申请公开号2003/0170238;Rosenberg的美国专利号4,690,915;Rosenberg(2011)Nat Rev Clin Oncol.8(10):577-85)。参见例如Themeli等.(2013)Nat Biotechnol.31(10):928-933;Tsukahara等.(2013)Biochem Biophys Res Commun 438(1):84-9;Davila等.(2013)PLoS ONE 8(4):e61338。
本文中所用的“对象”是哺乳动物,例如人或其它动物,并且通常是人。在一些实施方式中,向接受所述细胞、细胞群或组合物给予的对象(例如,患者)是哺乳动物,通常是灵长类,例如人。在一些实施方式中,所述灵长类是猴子或猿。所述对象可以是男性或女性,并且可以是任何合适的年龄,包括婴儿,少年,青少年,成人和老年对象。在一些实施方式中,所述对象是非灵长类哺乳动物,例如啮齿类。
本文中所用的术语“治疗”(及其语法变化形式例如“治疗的”和“治疗性”)指完全或部分减轻或减少疾病或病症或紊乱或与其相关的症状、不利作用或后果或表型。所需的治疗效果包括但不限于,预防疾病的发生或复发、减轻症状、减少疾病的任何直接或间接病理学结果、防止转移、减缓疾病进展速度、改善或减轻疾病状态和减轻或改善预后。该术语不表示完全治愈疾病或完全消除任一症状或作用或所有症状或后果。
本文中所用的“延缓疾病的发展”表示推迟、阻碍、减缓、减慢、稳定、遏制和/或拖延所述疾病(例如癌症)的发展。延缓可有不同的时间长度,这取决于疾病的病史和/或待治疗的个体。如本领域技术人员所知,实际上,充分或显著的延缓可涵盖预防(对于未发展成所述疾病的个体而言)。例如,晚期癌症(例如转移的发展)可被延缓。
本文中所用的“预防”包括对于在倾向于发展成某疾病但尚未被诊断为该病的对象中对疾病发生或复发的预防。在一些实施方式中,所提供的细胞和组合物用于延缓疾病发展或减缓疾病进展。
本文中,“阻抑”某功能或活性指相比其他相同仅目标条件或参数不同的情况或者相比另一情况,功能或活性降低。例如,与没有细胞条件下的肿瘤生长速率相比,阻抑肿瘤生长的细胞降低了肿瘤的生长速度。
用剂(如药物制剂、细胞或组合物)就给药而言的“有效量”指某一个量,按一定数量的剂量/用量且作用必要的时间长度,能够有效实现所需效果,例如治疗或预防性效果。
反应剂(如药物制剂或细胞)的“治疗有效量”指某一个量,其按照一定数量的剂量和必需时程,能够有效实现所需治疗效果,例如疾病、病症或紊乱的治疗,和/或该治疗的药物动力学或药代动力学效果。治疗有效量可根据多种因素而不同,例如疾病状态、年龄、性别,和对象体重,以及给予的细胞群。在一些实施方式中,本文方法涉及给予有效量(例如治疗有效量)的所述细胞和/或组合物。
“预防有效量”指某一个量,其按照一定数量的剂量和必要时程,能够有效实现所需预防效果。通常但非一定,由于预防剂量在疾病的早期或之前用于对象,预防有效量将小于治疗有效量。
所治疗的疾病或病症可以是如下所述任何疾病或病症:其中抗原的表达与疾病状况或紊乱的病因相关和/或参与疾病状况或紊乱的病因,例如抗原表达造成、加剧或者涉及该疾病、病症或紊乱。示例性的疾病和病症可包括与细胞恶性化或转化相关的疾病或病症(例如肿癌症)、自身免疫性或炎性疾病或感染性疾病(例如细菌、病毒或其他病原体所致感染)。示例性的抗原,包括与可接受治疗的各自疾病和病症关联的抗原,如前文所描述。某些具体实施方式中,嵌合抗原受体或转基因TCR特异性结合与疾病或病症相关抗原。
因此,本文方法和应用包括用于过继细胞疗法的方法和应用。在一些实施方式中,该方法包括向对象、组织或细胞(如患有、易患或疑患某疾病、病症或紊乱的对象、组织或细胞)给予细胞或含有该细胞的组合物。在一些实施方式中,将所述细胞、群和组合物给予患有具体待治疗(例如通过过继细胞治疗(如过继T细胞治疗))的疾病或病症的对象。在一些实施方式中,给予对象(如患有、易患或疑患疾病或病症的对象)细胞或组合物以缓解疾病或病症的一种或多种症状。
在一些实施方式中,所述细胞治疗(如过继T细胞治疗)通过自体移植进行,其中,自接受细胞治疗的对象分离和/或以其他方法制得细胞,或者从该对象的样品获得细胞。因此,某些方面,细胞源自需要治疗的对象(例如,患者),并在分离和处理后回输给同一对象。
在一些实施方式中,细胞治疗(如过继T细胞治疗)通过同种异体移植进行,其中,作为分离和/或以其他方法制备细胞的来源的对象(如第一对象)不是待接受或最终接受细胞治疗的对象。此类实施方式中,然后将所述细胞给予相同物种的不同对象,例如第二对象。在一些实施方式中,所述第一和第二对象遗传相同。在一些实施方式中,所述第一和第二对象遗传学相似。在一些实施方式中,所述第二对象表达与第一对象病毒相同的HLA类或超型。可用任何合适的手段给予细胞。给药和给予可部分取决于该给予是短期还是长期的。不同给药方案包括但不限于在不同时间点单次或多次给予、推注给予和脉冲输注。
在某些实施方式中,所述细胞或各细胞亚型群按照约1000亿细胞和/或每公斤体重该数量的细胞给予对象,例如100万至约500亿细胞(如约500万细胞、约2500万细胞、约5亿细胞、约10亿细胞、约50亿细胞、约200亿细胞、约300亿细胞、约400亿细胞,或以上任意两个值构成的范围),例如约1000万至约1000亿细胞(如约2000万细胞、约3000万细胞、约4000万细胞、约6000万细胞、约7000万细胞、约8000万细胞、约9000万细胞、约100亿细胞、约250亿细胞、约500亿细胞、约750亿细胞、约900亿细胞,或以上任意两个值构成的范围),有时是约1亿细胞至约500亿细胞(如约1.2亿细胞、约2.5亿细胞、约3.5亿细胞、约4.5亿细胞、约6.5亿细胞、约8亿细胞、约9亿细胞、约30亿细胞、约300亿细胞、约450亿细胞),或以上任一范围内任一数值,和/或每公斤体重以上所述数量的细胞。同样,剂量可根据疾病或紊乱和/或患者和/或其它治疗的具体属性而不同。在一些实施方式中,细胞作为联合治疗的一部分给予,例如与另一治疗性干预(如抗体或经工程改造的细胞或受体或药剂(如细胞毒性或治疗行药剂))同时或以任何顺序依次给予。在一些实施方式中,细胞与一种或多种其它治疗剂共同给予或与另一治疗干预联合给予,或者同时或者以任何顺序依次进行。在一些情况中,所述细胞与其他治疗共同给予,时间上足够接近从而细胞群增强一种或多种其它治疗剂的作用,反之亦然。在一些实施方式中,细胞在一种或多种其它治疗剂之前给予。在一些实施方式中,细胞在一种或多种其它治疗剂之后给予。在一些实施方式中,一种或多种其他治疗剂包括细胞因子如IL-2,例如用于以增强持久性。在一些实施方式中,百万方法包括给予化疗剂。
在给予细胞之后,在一些实施方式中,检测经工程改造细胞群的生物活性,例如采用任意已知方法。用以评估的参数包括:工程改造的或天然T细胞或其它免疫细胞与抗原的特异性结合,体内方式(例如,通过成像)或离体方式(例如,通过ELISA或流式细胞术)。在某些实施方式中,工程改造的细胞破坏靶细胞的能力可采用本领域已知的任何合适的方法来检测,例如描述于如下文献的细胞毒性试验,例如,Kochenderfer等,J.Immunotherapy,32(7):689-702(2009),和Herman等.J.Immunological Methods,285(1):25-40(2004)。在某些实施方式中,通过测定一种或多种细胞因子例如CD 107a,IFNγ,IL-2和TNF的表达和/或分泌来检测细胞的生物活性。某些方面,生物活性通过评估临床效果来检测,例如肿瘤负荷或负载的减少。
在某些实施方式中,所述工程改造的细胞以各种方式进一步修饰,从而增加其治疗或预防功效。例如,通过细胞群表达的工程CAR或TCR可通过接头直接或间接地偶联靶向部分。与化合物偶联是本领域已知的,例如将CAR或TCR连接至靶向部分。参见例如,Wadwa等,J.Drug Targeting 3:1 1 1(1995),和美国专利5,087,616。
VI.制品和试剂盒
本文还提供可用于实施本文方法的系统、设备和试剂盒(反应剂盒)。某些实施方式中,提供的是制品,例如试剂盒或器械,其中包含病毒颗粒和寡聚蛋白(如突变链霉亲和素)反应剂以及可选的使用说明。某些实施方式中,试剂盒可用于转导细胞的方法,例如依照过继细胞治疗用工程细胞制备来使用。
某些实施方式中,制品包括一个或多个容器(一般是多个容器),包装材料和所述一个或多个容器和/或包装上或与之关联的标签或包装插页,标签和插页一般有向对象给予细胞(例如对象细胞转导)的说明。
本文提供的制品含有包装材料。用于包装药用产品的包装材料是本领域技术人员已知的。例如,参见美国专利号5,323,907、5,052,558和5,033,252,各篇在此全文纳入。包装材料的例子包括但不限于泡罩包装、瓶、管、吸入器、泵、袋、小瓶、容器、注射器或瓶。制品可包含针头或其他注射器械用来协助材料的分送。通常,包装与其中的组合物没有相互作用。
某些实施方式中,病毒颗粒和寡聚蛋白(如链霉亲和素)反应剂是分开包装的。某些实施方式中,各容器可具有单个腔室。某些实施方式中,含病毒颗粒的容器方便使用者向其中加入寡聚反应剂或反之,例如通过腔室的开口。可考虑使用各种如下所述的容器或制品:易于形成容纳病毒颗粒和/或寡聚蛋白反应剂的空间且易于通过简单操作添加最终的必要组分来混合形成含有关联寡聚蛋白反应剂的病毒颗粒的组合物。某些实施方式中,寡聚蛋白(如链霉亲和素反应剂)在与细胞接触前加入病毒颗粒中,例如接触细胞前最多1小时。
某些实施方式中,这些材料分开包装在同一容器内以使组分可以在该容器内内混合或合并。某些方面,此类容器的例子包括这样的容器:具有封闭确定空间容纳病毒颗粒且另有封闭确定空间容纳寡聚蛋白反应剂,两空间用易于移动的膜隔开,将膜移除则组分混合。可考虑采用各种组分在其中被隔开的容器或制品。某些实施方式中,制品所含各组分位于比邻的腔室内,腔室用分隔元件(如膜)隔开,当制品受挤压破裂时隔开的组分得以混合。合适是实施方式可见例如美国专利3,539,794和5,171,081中所述的容器。
某些实施方式中还提供可用于转导细胞的系统和设备。某些实施方式中,系统或设备可用于选择和/或混合细胞并转导细胞。某些方面,系统用以在封闭或无菌环境中进行这些步骤中的每一步骤,为的是例如尽可能减少误差、用户操作和/或污染。
某些实施方式中,系统是或含色谱固定相,即是或含色谱基质。某些实施方式中,固定相适合细胞活化、转导和/或刺激中一项或多项。某些实施方式中,第一固定相是凝聚过滤基质和/或亲和层析基质,所述凝聚过滤基质和/或亲和层析基质含有蛋白(如链霉亲和素突变蛋白)反应剂如寡聚蛋白(如链霉亲和素突变蛋白)反应剂。某些实施方式中,蛋白(如链霉亲和素突变蛋白)反应剂如寡聚蛋白(如链霉亲和素突变蛋白)反应剂含有结合位点Z1,结合位点Z1能够特异性结合作用剂中的结合伴侣C1,作用剂可以是第一结合剂(如选择剂和/或刺激剂)。某些实施方式中,蛋白(如链霉亲和素突变蛋白)反应剂如寡聚蛋白(如链霉亲和素突变蛋白)反应剂含有结合位点Z2,结合位点Z2能够特异性结合第二作用剂(如选择剂和/或刺激剂)中的结合伴侣C2。某些实施方式中,固定相能够与病毒颗粒关联,并且,如果含有细胞特异性结合剂,还能够与一个或多个细胞表面分子可逆结合。如此配制中,固定相或者位于色谱柱中,或是平面固定相。
某些实施方式中,固定相是第一固定相,它操作性连接第二或第三固定相,例如类似前文所述。某些实施方式中,固定相中一个或多个(例如每一个)操作性连接含有清除剂的清除舱,清除剂能够高亲和力结合洗脱剂,洗脱剂用于将寡聚蛋白反应剂从通过结合剂的结合伴侣C1或C2与之结合的一个或多个细胞上可逆解离。某些实施方式中,设备(如固定相)可含有适合将病毒颗粒和/或细胞上样到固定相的样品入口。
某些实施方式中,固定相是与生物反应器操作性连接的系统。某些实施方式中,生物反应器适合扩增细胞,而固定相适合细胞选择、细胞活化或刺激和/或细胞转导。某些实施方式中,生物反应器和固定相流体连接。这样的配置可用于前文所述的系列扩增,并可整合到已知细胞扩增系统中,例如
在一些实施方式中,所述封闭系统是自动化的。在一些实施方式中,与所述系统相关联的组件可包括整合的微型计算机、蠕动泵,和各种阀,例如夹管阀或转闩,以控制所述系统的各种部分之间的流体的流。某些方面,集成计算机控制仪器的所有组件,并指示所述系统以标准化的顺序进行重复操作。在一些实施方式中,所述蠕动泵控制通过管组的流速,并且,与夹管阀一起,确保通过所述系统的缓冲液的受控流动。在一些实施方式中,设备可设计为功能性封闭系统。
VII.定义
除非另外定义,本文使用的所有专业术语、符号和其它技术和科学术语或专有词汇旨在具有本发明所属领域技术人员通常所理解的相同含义。在一些情况中,本文出于阐明和/或便于引用目的对具有常规理解含义的术语加以限定,本文中包括此类限定不应理解为表示与本领域常规理解的有显著差异。
如本文所用,单数形式的“一个”、”一种“和”该“包括复数指代对象,除非文本中另有明确说明。例如,”一种“或”一个“指”至少一种或一个”或“一种(个)或多种(个)”。应理解本文中所述的方面和变化形式包括:“由(这些方面和变化形式)组成”和/或“基本由(这些方面和变化形式)组成”。
本公开内容中,请求保护的主题的各个方面均以范围形式呈现。应当理解,范围形式的描述仅仅是为了方便和简洁,并且不应被解释为对所要求保护的主题的范围的硬性限制。因此,范围的描述应当被认为已经具体公开了所有可能的子范围以及该范围内的单个数值。例如,在提供值的范围的情况下,应当理解,在该范围的上限和下限之间的每个中间值以及在所述范围内的任何其他所述的或中间的值均被包括在要求保护的主题内。所述较小范围内可独立地包含这些较小范围的上下限,它们也属于请求保护的主题的范围,除非明确地排除所述范围的上下限。设定范围包含一个或两个限值时,请求保护的主题也包括排除所述限值之一个或两个的范围。这普遍适用,与范围宽度无关。
本文使用的术语“约”是指本技术领域技术人员容易知晓的各值的通常误差范围。提及值或参数时的“约”包括(并公开)涉及该值或参数本身的实施方式。例如,提及“约X”的描述包括“X”的描述。
本文所用术语“载体”指能够扩增与之相连的另一核酸的一种核酸分子。该术语包括自复制核酸结构形式的载体,已经进入宿主细胞(载体引入其中的细胞)基因组的载体。某些载体能够引导与之操作性连接的核酸的表达。此类载体在本文中称为“表达载体”。载体包括病毒颗粒,如逆转录病毒颗粒,如γ逆转录病毒和慢病毒载体。
术语“宿主细胞”、“宿主细胞系”和“宿主细胞培养物”可互换使用,并且指已引入外源核酸的细胞,包括此类细胞的子代。宿主细胞包括“转化株”和“转化细胞”,其包括原代转化细胞及其衍生的子代,不计传代次数。子代的核酸含量与亲本细胞未必完全相同,并可包含突变。本文包括功能或生物活性与在原代转化细胞中筛选或选择的功能或生物活性相同的突变子代。
本文中所用的组合物指,两种或更多种产物、物质或化合物,包括细胞,的任何混合物。组合物可以是溶液、悬液、液体、粉末、糊剂、水性、非水性或其任意组合。
本文中,就一种或多种具体细胞类型或细胞群的“富集”指提高该细胞类型或群的数量或百分比,例如相比组合物中的总细胞数量或所述组合物的体积、或相对于其它细胞类型提高,例如通过基于细胞群或细胞表达标志的正选择,或通过基于待消除细胞群或细胞上没有的标志的负选择。该术语不需要从所述组合物完全去除其它细胞、细胞类型或群,并且不需要如此富集的细胞在组合物中占100%或甚至接近100%。
本文中,称细胞或细胞群就特定标志呈“阳性”指所述细胞上或细胞中存在可测水平的该特定标志物(通常是表面标志)。说到表面标志,该术语指据流式细胞术检测到的表面表达,例如用特异性结合该标志物的抗体染色并检测该抗体,其中,该染色可被流式细胞术以一定水平检测到,该水平显著高于用相同同种型的对照—除该对照之外条件完全相同—用相同方法所得染色水平,和/或实质性近似已知该标志阳性的细胞的水平,和/或显著高于已知该标志阴性的细胞的水平。
本文中,称细胞或细胞群就具体标志呈“阴性”指所述细胞上或细胞中没有可测水平的该标志通常是表面标志。说到表面标志,该术语指据流式细胞术检测到的表面表达,例如用特异性结合该标志的抗体染色并检测该抗体,其中,该染色没有能被流式细胞术以以下所述的水平检测到,该水平显著高于用相同同种型的对照—除该对照之外条件完全相同—用相同方法所得染色水平,和/或检测到的水平显著低于已知该标志阳性的细胞的水平和/或实质性近似已知该标志阴性的细胞的水平。
本文所用术语“表达”是指基于核酸分子编码序列(例如基因)产生多肽的过程。该过程可包括转录、转录后控制、转录后修饰、翻译、翻译后控制、翻译后修饰或其任意组合。
如本文所用,对照是指与测试样品基本相同的样品,区别在于对照未用测试参数处理,或者,如果是血浆样品,对照可以来自未受目标条件/病症影响的正常志愿者。对照也可为内部对照.
VIII.示例性实施方式
本文中提供的实施方式包括:
1.一种转导细胞的方法,包括令含有多细胞的输入组合物与(1)寡聚反应剂和(2)病毒颗粒接触,
可选地,所述方法产生含有一个或多个被转导细胞的输出组合物。
2.如实施方式1所述的方法,其中:
所述寡聚反应剂是寡聚蛋白反应剂;和/或
所述寡聚蛋白反应剂包含多个多肽单体单元,各单元各自可选性地具有至少或至少约10、20、30或40氨基酸的长度,可选地,至少或至少约50、60、65、70、80、90、100、125或150氨基酸的长度,且/或分子量至少是或约20、30、40或50kDa,可选地,所述反应剂含有包含多个多聚体亚基的寡聚体,可选地,所述多聚体亚基是四聚体、多单元并各自含有单体单元;且/或
所述寡聚反应剂的分子量至少是或约100,和/或约150kDa至约2000kDa之间,和/或约150kDa至约1500kDa之间,和/或约150kDa至约1250kDa之间,和/或约150kDa至约1000kDa之间,和/或约150kDa至约500kDa之间,和/或约150kDa至约300kDa之间,约300kDa至约2000kDa之间,约300kDa至约1500kDa之间,约300kDa至约1250kDa之间,约300kDa至1000kDa之间,约300kDa至约500kDa之间,约500kDa至约2000kDa之间,约500kDa至约1500kDa之间,约500kDa至约1250kDa之间,约500kDa至1000kDa之间,约1000kDa至约2000kDa之间,约1000kDa至约1500kDa之间,约1000kDa至约1250kDa之间,约1250kDa至约2000kDa或约1500kDa至约2000kDa之间。
3.如实施方式1或2所述的方法,其中,寡聚蛋白反应剂包含并可选性地包含以下物质的多个单元:链霉亲和素、亲和素、链霉亲和素类似物或突变蛋白或亲和素类似物或突变蛋白,前述任一的生物活性片段,和/或前述之任选的多聚体。
4.一种转导细胞的方法,包括将多细胞与(1)蛋白反应剂和(2)病毒颗粒一同孵育,其中,所述蛋白反应剂包含并可选地包含以下物质的多个单元:链霉亲和素、亲和素、链霉亲和素类似物或突变蛋白、亲和素类似物、前述任一的突变蛋白或生物活性片段,和/或前述任选的多聚体;
可选地,所述方法产生含有一个或多个被转导细胞的输出组合物。
5.如实施方式4所述的方法,所述反应剂是或含寡聚体。
6.如实施方式1-5中任一项所述的方法,其中,接触包括将细胞与反应剂和与病毒颗粒同时或按任意顺序依次混合。
7.如实施方式1-6中任一项所述的方法,其中,至少部分孵育期间,所述反应剂和所述病毒颗粒同时与细胞共在或同时与细胞接触。
8.如实施方式1-7中任一项所述的方法,其中,输出组合物中的一个或多个被转导细胞表达由病毒颗粒所含异源核酸编码的重组蛋白。
9.如实施方式1-8中任一项所述的方法,其中,还包括在细胞接触病毒颗粒后孵育细胞,由此产生含有一个或多个被转导细胞输出组合物。
10.一种转导细胞的方法,所述方法包括:
(a)病毒颗粒与寡聚反应剂接触,由此产生含有与反应剂关联的病毒颗粒的混合物;和
(b)混合物与含多细胞的输入组合物接触,
可选地,所述方法产生含有一个或多个被转导细胞的输出组合物。
11.如实施方式10所述的方法,其中:
所述寡聚反应剂是寡聚蛋白反应剂;和/或
所述寡聚蛋白反应剂包含多个多肽单体单元,各单元各自可选性地具有至少或至少约10、20、30或40氨基酸的长度,可选地,至少或至少约50、60、65、70、80、90、100、125或150氨基酸的长度,且/或分子量至少是或约20、30、40或50kDa,可选地,所述反应剂含有包含多个多聚体亚基的寡聚体,可选地,所述多聚体亚基是四聚体、多单元并各自含有单体单元;且/或
所述寡聚反应剂的分子量至少是或约100,和/或约150kDa至约2000kDa之间,和/或约150kDa至约1500kDa之间,和/或约150kDa至约1250kDa之间,和/或约150kDa至约1000kDa之间,和/或约150kDa至约500kDa之间,和/或约150kDa至约300kDa之间,约300kDa至约2000kDa之间,约300kDa至约1500kDa之间,约300kDa至约1250kDa之间,约300kDa至1000kDa之间,约300kDa至约500kDa之间,约500kDa至约2000kDa之间,约500kDa至约1500kDa之间,约500kDa至约1250kDa之间,约500kDa至1000kDa之间,约1000kDa至约2000kDa之间,约1000kDa至约1500kDa之间,约1000kDa至约1250kDa之间,约1250kDa至约2000kDa或约1500kDa至约2000kDa之间。
12.如实施方式10或11所述的方法,其中,寡聚蛋白反应剂包含并可选性地包含以下物质的多个单元:链霉亲和素、亲和素、链霉亲和素类似物或突变蛋白或亲和素类似物或突变蛋白,前述任一的生物活性片段,和/或前述之任选的多聚体。
13.一种转导细胞的方法,所述方法包括:
(a)病毒颗粒与蛋白反应剂接触,由此产生含有与反应剂关联的病毒颗粒的混合物,所述蛋白反应剂含有并可选地含有以下物质的多个单元:链霉亲和素、亲和素、链霉亲和素类似物或突变蛋白或亲和素类似物或突变蛋白,前述任一的生物活性片段,和/或前述之任选的多聚体;和
(b)混合物与含多细胞的输入组合物接触,
可选地,所述方法产生含有一个或多个被转导细胞的输出组合物。
14.如实施方式13所述的方法,所述反应剂是或含寡聚体。
15.如实施方式10-14中任一项所述的方法,还包括在细胞接触混合物后孵育细胞,由此产生含有一个或多个被转导细胞输出组合物。
16.如实施方式9或15所述的方法,其中,进行所述孵育,且在所述孵育前不从所述组合物中去除所述反应剂,孵育期间不从所述组合物中去除所述反应剂,或者至少在所述孵育的半程不从所述组合物中去除所述组合物。
17.如实施方式1-16中任一项所述的方法,其中:
所述反应剂是裸露的;
所述反应剂不含和/或偶联或可逆结合结合剂;
所述反应剂不含和/或不偶联或不结合具有对细胞表面标志物特异性的结合结构域的分子,可选地,所述分子选自:粘附分子、整联蛋白、趋化因子、细胞因子、生长因子、胞外基质结合分子、病毒蛋白、促进病毒进入的细胞表面受体、肝素、乙酰肝素、乙酰肝素、聚糖、T细胞表面标志、CD3、CD28、CD4和/或CD8;
所述反应剂不含和/或不偶联或不结合哺乳动物细胞表面标志、胞外基质组分、粘附分子、整联蛋白、凝集素、整联蛋白结合蛋白、趋化因子、细胞因子、生长因子、胞外基质结合分子、ECM组分、病毒蛋白、促进病毒进入的细胞表面受体、肝素、乙酰肝素、聚糖;且/或
所述反应剂不含肝素结合结构域和/或不含整联蛋白结合结构域和/或不含VLA4结合结构域和/或不含VLA5结合结构域;且/或
所述反应剂不含和/或不偶联或不结合病毒结合剂或细胞选择剂。
18.如实施方式1-17中任一项所述的方法,其中,在与反应剂接触之前或期间,可选地还在再孵育之前或期间,在刺激剂存在下活化细胞;和/或,所述接触或孵育或其部分在细胞被所述刺激剂刺激或活化的条件下进行,可选地,所述刺激剂是可逆结合于反应剂的结合剂。
19.如实施方式1-18中任一项所述的方法,其中,所述反应剂还含有和/或可逆性结合于多个一种或多种结合剂,所述结合剂各自能特异性结合病毒颗粒表面和/或靶细胞表面的分子,可选地,所述细胞是哺乳动物细胞,可选地,所述哺乳动物细胞是人细胞。
20.一种转导细胞的发,包括含有多细胞的输入组合物与以下所述孵育:
1)含有能够与结合剂可逆结合的多个结合位点的寡聚蛋白反应剂,其中,一个或多个结合位点可逆结合于结合剂;和
2)病毒颗粒,
其中,(1)中的孵育至少有部分与(2)同时进行;且
可选地,所述方法产生含有一个或多个被转导细胞的输出组合物。
21.如实施方式9、15、16和20中任一项所述的方法,其中,
所述孵育和/或再孵育在37℃±2℃或约37℃±2℃下进行;和/或
所述孵育和/或再孵育在能够在所述孵育和/或再孵育至少部分期间将信号递送到T细胞的其他作用剂的存在下进行。
22.如实施方式21所述的方法,所述其他反应剂能够增强或诱导CD3+T细胞、CD4+T细胞和/或CD8+T细胞增殖。
23.如实施方式21所述的方法,其中,所述其他试剂是选自IL-2、IL-15、IL-7和IL-21的细胞因子。
24.如实施方式21-23中任一项所述的方法,其中,所述孵育或再孵育的进行时间不超过14天、不超过12天、不超过10天、不超过8天或不超过6天。
25.如实施方式10-24中任一项所述的方法,其中,所述结合剂是刺激剂和/或能够通过T细胞的TCR/CD3复合物、T细胞的含CD3复合物和/或T细胞的含ITAM分子传递刺激信号。
26.如实施方式19-25中任一项所述的方法,其中:
所述反应剂含有多个能够可逆结合各结合剂的结合位点,所述多个结合位点包含一个或多个结合位点Z,它能够与结合伴侣C结合;且
所述结合剂还含有一个或多个结合伴侣C。
27.如实施方式19-26中任一项所述的方法,所述结合剂是或含受体结合剂。
28.如实施方式27所述的方法,所述受体结合剂包含:
能够通过T细胞的TCR/CD3复合物、T细胞的含CD3复合物和/或T细胞的含ITAM分子传递刺激信号的刺激剂;或
特异性结合TCR/CD3复合物的成员或特异性结合CD3。
29.如实施方式28所述的方法,所述受体结合剂是第一受体结合剂,所述反应剂包含能够与第二受体结合剂可逆结合的多个结合位点,所述第二受体结合剂是能够结合一个或多个细胞表面上第二分子的辅结合剂,可选地,所述第二分子能够诱导或增强、减弱或调整通过第一受体结合剂传递的信号。
30.如实施方式29所述的方法,其中:
所述第一受体结合剂包含结合伴侣C1,结合伴侣C1能够可逆结合反应剂上的结合位点Z1;且
所述第二受体结合剂包含结合伴侣C2,结合伴侣C2能够可逆结合反应剂上的结合位点Z2。
31.如实施方式30所述的方法,其中:
C1和C2相同或基本相同、或者包含相同或基本相同的部分;和/或
Z2和Z1相同或基本相同、或者包含相同或基本相同的部分。
32.如实施方式19-31中任一项所述的方法,其中,所述结合剂是能够特异性结合靶细胞表面表达的分子的选择剂。
33.如实施方式29-32中任一项所述的方法,其中,所述反应剂还含有结合剂,所述结合剂是能够特异性结合靶细胞表面表达的分子的选择剂。
34.如实施方式33所述的方法,其中:
所述第一受体结合剂包含结合伴侣C1,结合伴侣C1能够可逆结合反应剂上的结合位点Z1;且
所述第二受体结合剂包含结合伴侣C2,结合伴侣C2能够可逆结合反应剂上的结合位点Z2。
所述选择剂包含结合伴侣C3,结合伴侣C3能够可逆结合反应剂上的结合位点Z3。
35.如实施方式34所述的方法,其中:
C1、C2和C3相同或基本相同、或者包含相同或基本相同的部分;和/或
Z2、Z1和Z3相同或基本相同、或者包含相同或基本相同的部分。
36.如实施方式31-35中任一项所述的方法,所述分子是或含CD25、CD28、CD62L、CCR7、CD27、CD127、CD3、CD4、CD8、CD45RA、CD45RO和/或CD56。
37.如实施方式31-36中任一项所述的方法,所述方法、所述接触和/或所述孵育的至少部分期间,选择剂结合靶细胞表面表达的分子,由此促进反应剂与靶细胞关联。
38.如实施方式37所述的方法,其中,相比不表达所述分子或不被选择剂特异性结合的非靶细胞转导,反应剂与靶细胞之间的关联能够增强靶细胞的转导。
39.如实施方式18-38中任一项所述的方法,结合剂是或含抗体、抗体片段、单价抗体片段、具有抗体样结合性质的蛋白结合分子、含有Ig结构域的分子、细胞因子、趋化因子、适体、MHC分子,或它们的结合片段。
40.如实施方式39所述的方法,其中,抗体片段含有选自以下所述的片段:Fab片段、Fv片段、(Fab’)
41.如实施方式19-40中任一项所述的方法,其中,多个结合剂包含至少2、4、8、12、16、20、24、28、32、36、40、44、48、52、56、60、64、72或更多。
42.如实施方式18-41中任一项所述的方法,其中,所述结合剂—可选刺激剂—结合细胞表面表达的分子,所述分子是或含CD3和/或CD28。
43.如实施方式42所述的方法,其中,所述结合剂—可选刺激剂—包含抗CD3和/或抗CD28抗体或其片段。
44.如实施方式1-43中任一项所述的方法,其中,所述输入组合物含T细胞。
45.如实施方式44所述的方法,其中,所述T细胞包括CD4+和/或CD8+T细胞和/或其亚群或亚组,且/或是针对以上所述任一细胞群进行了富集的。
46.如实施方式1-45中任一项所述的方法,其中,所述输入组合物还有静息或原初细胞和/或其亚群或亚组和/或是针对以上所述任一细胞群进行了富集的。
47.如实施方式1-46中任一项所述的方法,其中,输入组合物中不超过10%的T细胞具有选自以下所述的T细胞活化标志:HLA-DR、CD25、CD69、CD71、CD40L和4-1BB;和/或缺少选自以下所述细胞因子的胞内表达:IL-2、IFNγ、TNF-α;且/或能够增殖。
48.如实施方式1-47中任一项所述的方法,其中,所述方法在所述孵育之前不包括在促进T细胞活化的条件下刺激群中的细胞。
49.如实施方式1-48中任一项所述的方法,其中,输入组合物中的细胞在所述接触前不曾:(a)离体刺激,包括约37℃孵育和/或选自以下所述一种或多种作用剂存在下孵育:能够激活、诱导T细胞、CD4+T细胞和/或CD8+T细胞内通过TCR复合物的信号的作用剂;能够诱导T细胞、CD4+T细胞和/或CD8+T细胞增殖的作用剂;CD3-结合分子;CD28-结合分子。
50.如实施方式1-45中任一项所述的方法,其中,所述输入组合物含活化细胞。
51.如实施方式1-50中任一项所述的方法,其中,病毒颗粒关联反应剂。
52.如实施方式1-50中任一项所述的方法,其中,所述反应剂对多细胞无毒,或者,接触或可选地进一步孵育后多细胞中至少或至少约75%、85%、90%、95%或更多细胞是活的。
53.如实施方式1-52中任一项所述的方法,其中:
与相同条件下接触或与聚阳离子转导佐剂—可选硫酸鱼精蛋白—或纤连蛋白衍生的转导佐剂—可选RetroNectin的细胞毒性相比,接触和/或进一步孵育后细胞的毒性降低超过或超过约1.2倍、1.5倍、2.0倍、3.0倍、4.0倍、5.0倍或10倍。
与相同条件下接触或与聚阳离子转导佐剂—可选硫酸鱼精蛋白—或纤连蛋白衍生的转导佐剂—可选RetroNectin的细胞毒性相比,接触和/或进一步孵育后细胞的活力降低超过或超过约1.2倍、1.5倍、2.0倍、3.0倍、4.0倍、5.0倍或10倍。
54.如实施方式1-53中任一项所述的方法,其中,寡聚体的个体分子通过多糖或双官能接头交联。
55.如实施方式1-54中任一项所述的方法,其中,所述反应剂具有SEQ ID NO:1或SEQ ID NO:2或与SEQ ID NO:1或SEQ ID NO:2至少85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%相同的氨基酸序列。
56.如实施方式1-55中任一项所述的方法,其中:
所述反应剂包括链霉亲和素类似物或突变蛋白,其在对应于SEQ ID NO:1所示氨基酸序列的链霉亲和素的第44-47位包含氨基酸序列Va1
所述链霉亲和素类似物或突变蛋白在对应于SEQ ID NO:1所示氨基酸序列的链霉亲和素的第44-47位包含氨基酸序列Va1
57.如实施方式1-56中任一项所述的方法,其中,所述反应剂包含链霉亲和素类似物或突变蛋白,所述链霉亲和素类似物或突变蛋白包含:
a)SEQ ID NO:3-6、27和28中任一项所示的氨基酸序列;
b)如下氨基酸序列:与SEQ ID NOS:3-6、27和28中任一序列显示至少85%、86%、87%、88%、89%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更大序列相同性、且包含对应于Va1
c)a)或b)的功能性片段,其可逆结合生物素或其生物活性形式、生物素类似物或突变蛋白或其生物活性片段或链霉亲和素结合肽。
58.如实施方式56或57所述的方法,其中,链霉亲和素类似物或突变蛋白在对应于SEQ ID NO:1所示氨基酸序列的链霉亲和素的第117、120和121位处还包含一个或多个氨基酸取代。
59.如实施方式58所述的方法,其中:
所述一处或多处氨基酸取代选自:Glu117、Asp117、Arg117、Ser120、Ala120、Gly120、Trp121、Tyr121或Phe121;或者
所述一处或多处氨基酸取代为选自Glu117、Gly120或Tyr121中的一项或多项;或者
所述氨基酸取代选自Glu117、Gly120或Tyr121。
60.如实施方式1-59中任一项所述的方法,其中,所述反应剂包含链霉亲和素类似物或突变蛋白,所述链霉亲和素类似物或突变蛋白包含:
a)SEQ ID NO:27或28所示的氨基酸序列;
b)氨基酸序列,其与SEQ ID NO:28显示至少85%、86%、87%、88%、89%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更大序列相同性、且包含对应于Va1
c)a)或b)的功能性片段,其可逆结合生物素或其生物活性片段、生物素类似物或突变蛋白或其生物活性片段或链霉亲和素结合肽。
61.如实施方式19-60中任一项所述的方法,所述结合剂是或含链霉亲和素结合肽。
62.如实施方式61所述的方法,其中,所述链霉亲和素结合肽选自下组:Trp-Ser-His-Pro-Gln-Phe-Glu-Lys(SEQ ID NO:8)、Trp-Ser-His-Pro-Gln-Phe-Glu-Lys-(GlyGlyGlySer)3-Trp-Ser-His-Pro-Gln-Phe-Glu-Lys(SEQ ID NO:17)、Trp-Ser-His-Pro-Gln-Phe-Glu-Lys-(GlyGlyGlySer)2-Trp-Ser-His-Pro-Gln-Phe-Glu-Lys(SEQ IDNO:18)和Trp-Ser-His-Pro-Gln-Phe-Glu-Lys-(GlyGlyGlySer)2Gly-Gly-Ser-Ala-Trp-Ser-His-Pro-Gln-Phe-Glu-Lys(SEQ ID NO:19)。
63.如实施方式19-61中任一项所述的方法,包括破坏所述结合剂与反应剂之间的可逆结合。
64.如实施方式63所述的方法,其中,所述破坏包括:将组合物引至细胞,该组合物含有能逆转第二受体结合试剂和反应剂之间连键的物质,该物质可以是第二反应剂。
65.如实施方式1-64中任一项所述的方法,与没有反应剂存在下的病毒颗粒转导相比,细胞转导率提高超过或超过约或约1.2倍、1.5倍、2倍、3倍、4倍、5倍、10倍或更多。
66.如实施方式1-65中任一项所述的方法,其中,所述病毒载体的基因组含有编码重组蛋白的异源核酸分子。
67.如实施方式66所述的方法,其中,所述重组蛋白是抗原受体。
68.如实施方式1-67中任一项所述的方法,其中,所述病毒颗粒是逆转录病毒。
69.如实施方式68所述的方法,其中,所述逆转录病毒是慢病毒。
70.如实施方式68所述的方法,其中,所述逆转录病毒是γ逆转录病毒。
71.如实施方式1-70中任一项所述的方法,其中,所述病毒颗粒是复制缺陷型的。
72.如实施方式1-71中任一项所述的方法,所述细胞包括血细胞、白细胞、淋巴细胞、B细胞、T细胞或NK细胞。
73.如实施方式1-72中任一项所述的方法,所述细胞包括抗原特异性T细胞或其细胞群、辅助T细胞或其细胞群、细胞毒T细胞或其细胞群、记忆T细胞或其细胞群、调节T细胞或其细胞群、NK细胞或其细胞群、抗原特异性B细胞或其细胞群、记忆B细胞或其细胞群、调节B细胞或其细胞群。
74.如实施方式1-73中任一项所述的方法,其中,所述细胞是原代细胞。
75.如实施方式1-74中任一项所述的方法,其中,所述细胞含T细胞。
76.如实施方式1-75中任一项所述的实施方式,其中,所述T细胞是未分级分离的T细胞、是富集或分离的CD3+T细胞、富集或分离的CD4+T细胞、或者富集或分离的CD8+T细胞。
77.如实施方式1-76中任一项所述的方法,其中反应剂是可溶性的。
78.如实施方式1-77中任一项所述的方法,其中,至少部分所述接触或再孵期间,所述反应剂结合于支持物。
79.如实施方式78所述的方法,其中,所述支持物是固体支持物或固定相。
80.一种组合物,包含关联病毒颗粒的寡聚反应剂。
81.一种试剂盒,包含能够关联病毒载体颗粒的寡聚反应剂、病毒载体颗粒和可选的使用说明。
82.如实施方式80或81所述的试剂盒,其中:
所述寡聚反应剂是寡聚蛋白反应剂;和/或
所述寡聚蛋白反应剂包含多个多肽单体单元,各单元各自可选性地具有至少或至少约10、20、30或40氨基酸的长度,可选地,至少或至少约50、60、65、70、80、90、100、125或150氨基酸的长度,且/或分子量至少是或约20、30、40或50kDa,可选地,所述反应剂含有包含多个多聚体亚基的寡聚体,可选地,所述多聚体亚基是四聚体、多单元并各自含有单体单元;且/或
所述寡聚反应剂的分子量至少是或约100,和/或约150kDa至约2000kDa之间,和/或约150kDa至约1500kDa之间,和/或约150kDa至约1250kDa之间,和/或约150kDa至约1000kDa之间,和/或约150kDa至约500kDa之间,和/或约150kDa至约300kDa之间,约300kDa至约2000kDa之间,约300kDa至约1500kDa之间,约300kDa至约1250kDa之间,约300kDa至1000kDa之间,约300kDa至约500kDa之间,约500kDa至约2000kDa之间,约500kDa至约1500kDa之间,约500kDa至约1250kDa之间,约500kDa至1000kDa之间,约1000kDa至约2000kDa之间,约1000kDa至约1500kDa之间,约1000kDa至约1250kDa之间,约1250kDa至约2000kDa或约1500kDa至约2000kDa之间。
83.如实施方式80-92中任一项所述的组合物,其中,寡聚蛋白反应剂包含并可选性地包含以下物质的多个单元:链霉亲和素、亲和素、链霉亲和素类似物或突变蛋白或亲和素类似物或突变蛋白,前述任一的生物活性片段,和/或前述之任选的多聚体。
84.一种组合物,包含关联病毒载体颗粒的反应剂,其中,所述反应剂是或含且可选地包含以下物质的多个单元:链霉亲和素、亲和素、链霉亲和素类似物或突变蛋白或亲和素类似物或突变蛋白,前述任一的生物活性片段,和/或前述之任选的多聚体。
85.一种试剂盒,包含能够关联病毒载体颗粒的反应剂,病毒颗粒和可选的使用说明,其中,所述反应剂是或含且可选地包含以下物质的多个单元:链霉亲和素、亲和素、链霉亲和素类似物或突变蛋白或亲和素类似物或突变蛋白,前述任一的生物活性片段,和/或前述之任选的多聚体。
86.如实施方式80-85中任一项所述的组合物或试剂盒,其中,病毒颗粒含有编码异源核酸的核苷酸序列。
87.如实施方式80-86中任一项所述的组合物或试剂盒,17。如实施方式1-16中任一项所述的方法,其中:
所述反应剂是裸露的;
所述反应剂不含和/或不偶联或不可逆结合结合剂;
所述反应剂不含和/或不偶联或不结合具有对细胞表面标志物特异性结合结构域的分子,可选地,所述分子选自:粘附分子、整联蛋白、趋化因子、细胞因子、生长因子、胞外基质结合分子、病毒蛋白、促进病毒进入的细胞表面受体、肝素、乙酰肝素、聚糖、T细胞表面标志、CD3、CD28、CD4和/或CD8;
所述反应剂不含和/或不偶联或不结合哺乳动物细胞表面标志、胞外基质组分、粘附分子、整联蛋白、凝集素、整联蛋白结合蛋白、趋化因子、细胞因子、生长因子、胞外基质结合分子、ECM组分、病毒蛋白、促进病毒进入的细胞表面受体、肝素、乙酰肝素、聚糖;且/或
所述反应剂不含肝素结合结构域和/或不含整联蛋白结合结构域和/或不含VLA4结合结构域和/或不含VLA5结合结构域;且/或
所述反应剂不含和/或不偶联或不结合病毒结合剂或细胞选择剂。
88.如实施方式80-87中任一项所述的组合物或试剂盒,其中,所述反应剂还含有和/或可逆性结合于多个一种或多种结合剂,所述结合剂各自能特异性结合病毒颗粒表面和/或靶细胞表面的分子,可选地,所述细胞是哺乳动物细胞,可选地,所述哺乳动物细胞是人细胞。
89.如实施方式88所述的组合物或试剂盒,其中:
所述反应剂含有多个能够可逆结合各结合剂的结合位点,所述多个结合位点包含一个或多个结合位点Z,它能够与结合伴侣C结合;且
所述结合剂还含有一个或多个结合伴侣C。
90.如实施方式88或89所述的组合物或试剂盒,所述结合剂是或含受体结合剂。
91.如实施方式90所述的组合物或试剂盒,所述受体结合剂包含:
能够通过T细胞的TCR/CD3复合物、T细胞的含CD3复合物和/或T细胞的含ITAM分子传递刺激信号的刺激剂;或
特异性结合TCR/CD3复合物的成员或特异性结合CD3。
92.如实施方式91所述的组合物或试剂盒,所述受体结合剂是第一受体结合剂,所述反应剂包含能够与第二受体结合剂可逆结合的多个结合位点,所述第二受体结合剂是能够结合一个或多个细胞表面上第二分子的辅结合剂,可选地,所述第二分子能够诱导或增强、减弱或调整通过第一受体结合剂传递的信号。
93.如实施方式92所述的组合物或试剂盒,其中:
所述第一受体结合剂包含结合伴侣C1,结合伴侣C1能够可逆结合反应剂上的结合位点Z1;且
所述第二受体结合剂包含结合伴侣C2,结合伴侣C2能够可逆结合反应剂上的结合位点Z2。
94.如实施方式93所述的组合物或试剂盒,其中:
C1和C2相同或基本相同、或者包含相同或基本相同的部分;和/或
Z2和Z1相同或基本相同、或者包含相同或基本相同的部分。
95.如实施方式88或89所述的组合物或试剂盒,其中,所述结合剂是能够特异性结合靶细胞表面表达的分子的选择剂。
96.如实施方式90-95中任一项所述的组合物或试剂盒,其中,所述反应剂还含有结合剂,所述结合剂是能够特异性结合靶细胞表面表达的分子的选择剂。
97.如实施方式96所述的组合物或试剂盒,其中:
所述第一受体结合剂包含结合伴侣C1,结合伴侣C1能够可逆结合反应剂上的结合位点Z1;且
所述第二受体结合剂包含结合伴侣C2,结合伴侣C2能够可逆结合反应剂上的结合位点Z2。
所述选择剂包含结合伴侣C3,结合伴侣C3能够可逆结合反应剂上的结合位点Z3。
98.如实施方式97所述的组合物或试剂盒,其中:
C1、C2和C3相同或基本相同、或者包含相同或基本相同的部分;和/或
Z1,Z2和Z3相同或基本相同、或者包含相同或基本相同的部分。
99.如实施方式95-98中任一项所述的组合物或试剂盒,所述分子是或含CD25、CD28、CD62L、CCR7、CD27、CD127、CD3、CD4、CD8、CD45RA、CD45RO和/或CD56。
100.如实施方式88-99中任一项所述的组合物或试剂盒,其中,所述结合剂是或含抗体、抗体片段、单价抗体片段、具有抗体样结合性质的蛋白结合分子、含有Ig结构域的分子、细胞因子、趋化因子、适体、MHC分子,或它们的结合片段。
101.如实施方式100所述的组合物或试剂盒,其中,所述抗体片段含有选自以下所述的片段:Fab片段、Fv片段、(Fab’)
102.如实施方式88-10中任一项所述的组合物或试剂盒,其中,多个结合剂包含至少2、4、8、12、16、20、24、28、32、36、40、44、48、52、56、60、64、72或更多。
103.如实施方式88-102中任一项所述的方法,其中,所述结合剂—可选刺激剂—结合细胞表面表达的分子,所述分子是或含CD3和/或CD28。
104.如实施方式103所述的组合物或试剂盒,其中,所述结合剂—可选刺激剂—包含抗CD3和/或抗CD28抗体或其片段。
105.如实施方式80-104中任一项所述的组合物或试剂盒,其中,寡聚体的个体分子通过多糖或双官能接头交联。
106.如实施方式80-105中任一项所述的组合物或试剂盒,其中,所述反应剂具有SEQ ID NO:1或SEQ ID NO:2或与SEQ ID NO:1或SEQ ID NO:2至少85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%相同的氨基酸序列。
107.如实施方式80-106中任一项所述的组合物或试剂盒,其中:
所述反应剂包括链霉亲和素类似物或突变蛋白,其在对应于SEQ ID NO:1所示氨基酸序列的链霉亲和素的第44-47位包含氨基酸序列Va1
所述链霉亲和素类似物或突变蛋白在对应于SEQ ID NO:1所示氨基酸序列的链霉亲和素的第44-47位包含氨基酸序列Va1
108.如实施方式80-107中任一项所述的组合物或试剂盒,其中,所述反应剂包含链霉亲和素类似物或突变蛋白,所述链霉亲和素类似物或突变蛋白包含:
a)SEQ ID NO:3-6、27和28中任一项所示的氨基酸序列;
b)如下氨基酸序列:与SEQ ID NOS:3-6、27和28中任一序列显示至少85%、86%、87%、88%、89%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更大序列相同性、且包含对应于Va1
c)a)或b)的功能性片段,其可逆结合生物素或其生物活性形式、生物素类似物或突变蛋白或其生物活性片段或链霉亲和素结合肽。
109.如实施方式80-81任一项所述的组合物或试剂盒,所述链霉亲和素类似物或突变蛋白在对应于SEQ ID NO:1所示氨基酸序列的链霉亲和素第117、120和121位处还包含一个或多个氨基酸取代。
110.如实施方式109所述的组合物或试剂盒,其中:
所述氨基酸取代选自:Glu117、Asp117、Arg117、Ser120、Ala120、Gly120、Trp121、Tyr121或Phe121。
所述一处或多处氨基酸取代为选自Glu117、Gly120或Tyr121中的一项或多项;或者
所述氨基酸取代选自Glu117、Gly120或Tyr121。
111.如实施方式80-110中任一项所述的组合物或试剂盒,其中,所述反应剂包含链霉亲和素类似物或突变蛋白,所述链霉亲和素类似物或突变蛋白包含:
a)SEQ ID NO:27或28所示的氨基酸序列;
b)氨基酸序列,其与SEQ ID NO:28显示至少85%、86%、87%、88%、89%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更大序列相同性、且包含对应于Va1
c)a)或b)的功能性片段,其可逆结合生物素或其生物活性片段、生物素类似物或突变蛋白或其生物活性片段或链霉亲和素结合肽。
112.如实施方式88-111中任一项所述的组合物或试剂盒,所述结合剂是或含链霉亲和素结合肽。
113.如实施方式112所述的组合物或试剂盒,其中,所述链霉亲和素结合肽选自下组:Trp-Ser-His-Pro-Gln-Phe-Glu-Lys(SEQ ID NO:8)、Trp-Ser-His-Pro-Gln-Phe-Glu-Lys-(GlyGlyGlySer)3-Trp-Ser-His-Pro-Gln-Phe-Glu-Lys(SEQ ID NO:17)、Trp-Ser-His-Pro-Gln-Phe-Glu-Lys-(GlyGlyGlySer)2-Trp-Ser-His-Pro-Gln-Phe-Glu-Lys(SEQID NO:18)和Trp-Ser-His-Pro-Gln-Phe-Glu-Lys-(GlyGlyGlySer)2Gly-Gly-Ser-Ala-Trp-Ser-His-Pro-Gln-Phe-Glu-Lys(SEQ ID NO:19)。
114.如实施方式80-113中任一项所述的组合物或试剂盒,其中,所述病毒载体的基因组含有编码重组蛋白的异源核酸分子。
115.如实施方式114所述的组合物或试剂盒,其中,所述重组蛋白是抗原受体。
116.如实施方式80-115中任一项所述的组合物或试剂盒,其中,所述病毒颗粒是逆转录病毒。
117.如实施方式116所述的组合物或试剂盒,其中,所述逆转录病毒是慢病毒。
118.如实施方式116所述的组合物或试剂盒,其中,所述逆转录病毒是γ逆转录病毒。
119.如实施方式80-118中任一项所述的组合物或试剂盒,其中,所述病毒颗粒是复制缺陷型的。
120.如实施方式80-119中任一项所述的组合物或试剂盒,其中反应剂是可溶性的。
121.如实施方式80-120中任一项所述的组合物或试剂盒,其中,至少部分所述接触或再孵期间,所述反应剂结合于支持物。
122.如实施方式121所述的组合物或试剂盒,其中,所述支持物是固体支持物或固定相。
123.一种用于转导细胞的方法,所述方法包括:
(1)合并(a)含有多个靶细胞的组合物和(b)选择剂,所述选择剂(i)能够特异性结合至少多个靶细胞之一或多个表达的选择标志物且(ii)可逆结合于反应剂,所述反应剂含有多个能够可逆结合所述选择剂的结合位点;和
(2)在含有病毒颗粒的组合物存在下孵育至少多个靶细胞,所述病毒颗粒所含基因组含有编码重组抗原受体的核酸分子,其中,(1)中的接触和(2)在的孵育同时或任意顺序依次进行,所述方法产生孵育后组合物,其中含有多个被病毒载体转导的靶细胞。
124.如实施方式123所述的方法,其中,所述病毒载体颗粒与反应剂可逆结合,所述反应剂含有多个能直接或间接与病毒颗粒表面的分子可逆结合的结合位点。
125.如实施方式123或124所述的方法,其中:
孵育期间,所述反应剂不是且不结合于、不关联固体支持物、固定相、珠、微粒、磁性颗粒和/或基质;和/或
所述反应剂是柔性的,不含金属或磁性核心,仅含或主要含有机多聚体,不为球形,基本上不为球形或形状不均一,且/或非刚性。
126.如实施方式123-125中任一项所述的方法,其中:
所述反应剂直接或间接固定于或能够直接或间接固定于支持物,由此,选择剂固定于或能够固定于支持物;且
(1)中,还与(c)支持物合并,由此,至少部分孵育期间,至少多个细胞的一个或多个靶细胞通过选择剂固定在支持物上。
127.如实施方式126所述的方法,其中,至少部分孵育期间,一个或多个病毒颗粒通过直接或间接结合所述分子固定在支持物上。
128.如实施方式123-127中任一项所述的方法,其中,所述反应剂包括多个结合位点Z1,多个结合位点Z1能够与选择剂可逆结合,和/或所述反应剂含有多个结合位点Z2,多个结合位点Z2能够与一个或多个病毒颗粒可逆结合。
129.一种转导细胞的方法,所述方法包括:
(1)合并(a)含有多个靶细胞的组合物,(b)选择剂,所述选择剂(i)能够特异性结合至少多个靶细胞之一或多个表达的选择标志物且(ii)直接或间接固定于或能够直接或间接固定于支持物和(c)支持物,其中,至少多个靶细胞之一或多个通过所述选择剂固定到所述支持物上。
(2)在含有多个病毒颗粒的组合物存在下孵育至少多个靶细胞,所述病毒颗粒所含基因组含有编码重组受体的核酸分子,其中,所述所述多个病毒颗粒之一或多个能够直接或间接固定于支持物,其中
(1)中的接触与(2)中的孵育同时或按任意顺序依次进行;
至少部分孵育期间,所述一个或多个靶细胞和所述一个或多个病毒载体颗粒固定在支持物上。
所述方法产生孵育后组合物,其中包含多个被病毒载体转导的靶细胞。
130.如实施方式126-129中任一项所述的方法,其中:
所述支持物是或含固定相;和/或
所述支持物是或含固体支持物。
131.如实施方式128或130所述的方法,其中,反应剂固定于或能够固定于支持物,所述反应剂具有多个结合位点Z1,它们能够可逆结合选择剂,还有多个结合位点Z2,它们能够可逆结合一个或多个病毒颗粒。
132.如实施方式131所述的方法,其中,(1)还包括再与(d)反应剂合并,其中,所述反应剂固定在支持物上。
133.如实施方式132所述的方法,在与选择剂和/或含多个细胞的组合物接触之前将反应剂和支持物合并。
134.如权利要求128和131-133中任一项所述的方法,其中:
所述选择剂包含结合伴侣C1;且
多个结合位点包含两个或更多结合位点Z1,它们各自能够与结合伴侣C1结合形成受体结合试剂与反应剂之间的可逆连键。
135.如实施方式126-6或131-134中任一项所述的方法,其中,所述病毒载体颗粒通过病毒颗粒结合剂可逆结合于反应剂。
136.如实施方式135所述的方法,其中:
所述病毒颗粒结合剂含有结合伴侣C2;且
多个结合位点包含两个或更多结合位点Z2,它们各自能够与结合伴侣C2结合形成受体结合试剂与反应剂之间的可逆连键。
137.如权利要求128和131-136中任一项所述的方法,其中:
C1和C2相同或基本相同、或者包含相同或基本相同的部分;和/或
Z1和Z2相同或基本相同、或者包含相同或基本相同的部分。
138.如实施方式123-137中任一项所述的方法,其中,所述选择剂还含有结合位点B1,所述选择剂与靶细胞上选择标志物之间的特异性结合包括B1与所述标志物之间的相互作用。
139.如实施方式123-138中任一项所述的方法,其中,选择标志物是第一选择标志物,选择剂还能够结合至少多个靶细胞表面表达的第二选择标志物。
140.如实施方式123-129中任一项所述的方法,所述选择剂是第一选择剂,选择标志物是第一选择标志物,并且还在第二选择剂存在下进行孵育,所述第二选择剂能够特异性结合至少多个靶细胞表面表达的第二选择标志物。
141.如实施方式140所述的方法,其中,所述反应剂包含能够可逆结合第二选择剂的多个结合位点,由此所述第二选择剂可逆结合所述反应剂。
142.如实施方式141所述的方法,其中,能够可逆结合第一选择剂的多个结合位点与能够可逆结合第二选择剂的多个结合位点相同或不同。
143.如实施方式142所述的方法,其中:
所述选择剂含有一个或多个结合伴侣C1;且/或
所述第二选择剂含有一个或多个结合伴侣C2,结合伴侣C2能够与结合位点Z1结合;且/或
所述第二选择剂含有一个或多个结合伴侣C2,结合伴侣C2能够与结合位点Z2结合,而所述反应剂还含有一个或多个结合位点Z2。
144.如实施方式139-143中任一项所述的方法,其中,所述第二选择剂含有一个或多个结合位点B3,结合位点B3促进第二选择剂与第二选择标志物之间的特异性结合。
145.如实施方式123-138中任一项所述的方法,其中:
所述选择标志物—可以是靶细胞表面表达的第一选择标志物和/或第二选择标志物—是蛋白质或多肽;和/或
所述选择标志物—可以是第一选择标志物和/或第二选择标志物—是蛋白质或多肽。
146.如实施方式123-145中任一项所述的方法,其中:
所述靶细胞包括血细胞;
所述靶细胞包括白细胞;
所述靶细胞包括淋巴细胞;
所述靶细胞包括B细胞;
所述靶细胞包括B细胞群;
所述靶细胞包括T细胞;
所述靶细胞包括T细胞群;和/或
所述靶细胞包括自然杀伤(NK)细胞;
所述靶细胞包括树突细胞;
所述靶细胞包括巨噬细胞。
147.如实施方式146所述的方法,其中,靶细胞包括抗原特异性T细胞或其细胞群、辅助T细胞或其细胞群、细胞毒T细胞或其细胞群、记忆T细胞或其细胞群、调节T细胞或其细胞群、NK细胞或其细胞群、抗原特异性B细胞或其细胞群、记忆性B细胞或其细胞群、调节B细胞或其细胞群。
148.如实施方式123-147中任一项所述的方法,其中,所述靶细胞包括T细胞。
149.如实施方式148所述的方法,至少40%、至少50%、至少60%、至少70%、至少80%或至少90%的T细胞呈选自以下所述T细胞活化标志物阴性:HLA-DR、CD25、CD69、CD71、CD40L和4-1BB;且/或缺少选自以下所述细胞因子的胞内表达:IL-2、IFNγ、TNF-α;且/或能够增殖。
150.如实施方式123-149中任一项所述的方法,包括在所述孵育之前和/或期间刺激多个靶细胞之一或多个,可选地是多个T细胞之一或多个,所述刺激包括令所述细胞暴露于刺激条件从而诱导一个或多个靶细胞或T细胞扩增。
151.如实施方式150所述的方法,其中,所述刺激条件包括存在如下物质:所述物质能够活化TCR复合物的一种或多种组分的一种或多种胞内信号转导结构域。
152.如实施方式151所述的方法,其中,所述作用剂包含主作用剂和次作用剂,主作用剂特异性结合TCR复合物,次作用剂特异性结合T细胞共刺激分子。
153.如实施方式152所述的方法,其中,主作用剂特异性结合CD3;其/或共刺激分子选自:CD28、CD137(4-1BB)、OX40、CD27或ICOS。
154.如实施方式152或153所述的方法,所述主作用剂和次作用剂包含抗体和/或存在于固体支持物的表面之上。
155.如实施方式123-154中任一项所述的方法,所述方法还包括:
(3)在可逆结合于反应剂的刺激剂存在下培养至少多个细胞,所述反应剂可选地是第二反应剂,该(第二)反应剂含有多个结合位点,所述结合位点各自能够在令所述刺激剂特异性结合细胞表面表达分子从而诱导或调控细胞内信号的条件下结合所述刺激剂。
156.如实施方式155所述的方法,其中,所述培养在所述孵育之前进行和/或开始。
157.如实施方式155或156所述的方法,其中:
孵育期间,所述第二反应剂不是且不结合于、不关联固体支持物、固定相、珠、微粒、磁性颗粒和/或基质;且/或
所述反应剂是柔性的,不含金属或磁性核心,仅含或主要含有机多聚体,不为球形,基本上不为球形或形状不均一,且/或非刚性。
158.如实施方式155或156所述的方法,所述第二反应剂固定在支持物上,可选地,所述支持物是固体支持物或固定相。
159.如实施方式155-158中任一项所述的方法,其中,所述刺激剂含MHC-I:肽复合物或其功能性分部、MHC-II:肽复合物或其功能性分部,且/或能够通过T细胞的TCR/CD3复合物、T细胞的含CD3复合物和/或T细胞的含ITAM分子传递刺激信号。
160.如实施方式155-159中任一项所述的方法,其中,所述刺激剂是第一刺激剂,所述培养还在第二刺激剂存在下进行,所述第二刺激剂能够特异性结合至少多个靶细胞表面表达的第二分子,由此在细胞内诱导第二信号来增强、减弱或调整通过第一分子传递的信号。
161.如实施方式160所述的方法,其中,所述(第二)反应剂包含能够可逆结合第二刺激剂的多个结合位点,由此所述第二刺激剂可逆结合所述反应剂。
162.如实施方式160或161所述的方法,其中,所述第二分子是共刺激分子、辅助分子、细胞因子受体、趋化因子受体、免疫哨点分子,或是TNF家族或TNF受体家族成员。
163.如实施方式155-162中任一项所述的方法,其中,所述孵育和培养分开在分开的但彼此操作性连接—可选管道连接—的容器中进行。
164.如实施方式123-163中任一项所述的方法,其中,所述孵育和培养在封闭系统中进行。
165.如实施方式155-164中任一项所述的方法,还包括收获可逆结合于且经刺激剂刺激的细胞,所述刺激剂可以是第一刺激剂和/或第二刺激剂,由此产生经培养的细胞,所述经培养的细胞是或含多个靶细胞。
166.如实施方式123-148中任一项所述的方法,其中,经如此培养的群中至少40%、至少50%、至少60%、至少70%、至少80%或至少90%的T细胞:
选自以下T细胞活化标志阴性:HLA-DR、CD25、CD69、CD71、CD40L和4-1BB;且/或
缺失选自以下细胞因子的胞内表达:IL-2、IFNγ、TNF-α;且/或
处于细胞周期G
167.如实施方式123-166中任一项所述的方法,其中:
所述选择标志物是B细胞或T细胞共同受体;
所述选择标志物是或含T细胞或T细胞受体复合物的成员;
所述选择标志物是或含CD3链;
所述选择标志物是或含CD3ζ链;
所述选择标志物是或含CD28;
所述选择标志物是或含CD4链;其/或
所述选择剂与所述选择标志物之间的特异性结合不诱导给向靶细胞的信号,或者不包括向靶细胞传递刺激或活化或增殖信号。
168.如实施方式123-167中任一项所述的方法,所述合并之后,还包括从固定化的靶细胞分离和/或去除所述多个细胞中的其他细胞。
169.如实施方式167或168所述的实施方式,还包括清洗步骤。
170.如实施方式168或169所述的方法,所述分离和/或所述清洗步骤在所述孵育开始之前进行。
171.如实施方式123-170中任一项所述的方法,其中:
所述孵育在所述合并之前进行和/或开始;
所述孵育在所述合并之后进行和/或开始。
172.如实施方式123-171中任一项所述的方法,其中,所述合并在至少部分所述孵育期间进行。
173.如实施方式123-172中任一项所述的方法,其中,选择剂在支持物上的固定是可逆的。
174.如实施方式135-173中任一项所述的方法,其中,所述病毒颗粒结合剂还含有结合位点V1,其中,病毒表面分子与病毒颗粒结合剂之间的结合包括B1与所述分子之间的相互作用。
175.如实施方式174所述的方法,其中,病毒颗粒表面分子选自包膜糖蛋白、包膜糖蛋白变体、嵌合包膜糖蛋白、病毒衣壳蛋白,病毒衣壳蛋白变体、病毒基质蛋白、病毒基质蛋白变体、合成部分、肽或标签。
176.如实施方式175所述的方法,其中,所述包膜糖蛋白选自VSV糖蛋白(VSV-G)、辛德比斯糖蛋白(可选SIN)、MMLV糖蛋白、HSV糖蛋白、MMTV糖蛋白、麻疹病毒糖蛋白、HTLV糖蛋白、SIV糖蛋白、GALV糖蛋白、HIV糖蛋白(例如gp160、gp120或gp41)和RSV糖蛋白(可选gp85或gp37),或它们的足以使之被病毒颗粒结合剂结合的组成部分、变体,或者嵌合分子。
177.如实施方式175所述的方法,所述合成部分、肽或标签选自:谷胱甘肽-S-转移酶(GST)、几丁质结合蛋白(CBP)、钙调蛋白结合肽(CBP)、FLAG-肽、血细胞凝集素肽、VSV-G-标签、HSV-标签、T7表位、麦芽糖结合蛋白(MBP)、HSV表位、myc表位、V5-标签和链霉亲和素结合肽。
178.如实施方式175或177所述的方法,其中,所述分子是合成部分、肽或标签,所述病毒颗粒经工程改造而在其表面表达所述合成部分、肽或标签。
179.如实施方式177或178所述的方法,其中,所述链霉亲和素结合肽包含SEQ IDNO:7、8、13、14和15-19中任一项所示的氨基酸序列。
180.如实施方式135-174所述的方法,其中,所述病毒颗粒结合剂选自鱼精蛋白、
181.如实施方式123-134和136-173中任一项所述的方法,其中,
所述病毒颗粒结合剂含有结合伴侣C1或C2;且
所述反应剂含有多个结合位点Z1或Z2,它们能够结合结合伴侣C1或C2,从而在所述病毒颗粒与反应剂之间形成可逆连键。
182.如实施方式181所述的方法,所述病毒颗粒经改造在其表面表达合成部分、肽或标签,所述合成部分、肽或标签是或含结合伴侣C1或C2。
183.如实施方式182所述的方法,其中,所述肽是链霉亲和素结合肽。
184.如实施方式183所述的方法,其中,所述链霉亲和素结合肽包含SEQ ID NO:7、8、13、14和15-19中任一项所示的氨基酸序列。
185.如实施方式123-184中任一项所述的方法,其中,所述病毒颗粒是逆转录病毒载体颗粒。
186.如实施方式123-185中任一项所述的方法,其中,所述病毒颗粒是慢病毒载体颗粒。
187.如实施方式186所述的方法,慢病毒载体颗粒含有衍生自HIV-1的基因组。
188.如实施方式123-185中任一项所述的方法,其中,所述逆转录病毒载体颗粒是γ逆转录病毒颗粒。
189.如实施方式188所述的方法,其中,所述γ逆转录病毒颗粒是鼠白细胞病毒(MLV)颗粒。
190.如实施方式123-189中任一项所述的方法,其中,所述病毒颗粒用病毒包膜糖蛋白假型化。
191.如实施方式190所述的方法,其中,所述病毒包膜糖蛋白是VSV-G.192。
如实施方式123-191中任一项所述的方法,其中,所述重组抗原受体是嵌合抗原受体CAR,其中包含特异性结合靶抗原的胞外抗原识别结构域和含ITAM的胞内信号转导结构域。
193.如实施方式192所述的方法,其中,所述胞内信号转导结构域包括CD3-ζ(CD3ζ)链的胞内结构域。
194.如实施方式192或193所述的方法,还包含连接所述胞外结构域和所述胞内信号转导结构域的跨膜结构域。
195.如实施方式194所述的方法,其中,所述跨膜结构域包含CD28的跨膜部分。
196.如实施方式192-195中任一项所述的方法,其中,胞内信号转导结构域还包含T细胞共刺激分子的胞内信号转导结构域。
197.如实施方式196所述的方法,其中,所述T细胞共刺激分子选自下组:CD28和41BB。
198.如实施方式123-197中任一项所述的方法,其中,所述核酸还包含与重组抗原受体编码核酸操作性相连的启动子。
199.如实施方式123-198中任一项所述的方法,其中:
所述选择剂与所述反应剂—可选第一反应剂—之间的可逆结合能够被添加某种物质破坏;和/或
所述第二选择剂与所述反应剂—可选第一反应剂和/或第二反应剂—之间的可逆结合能够被添加某种物质破坏;和/或
所述病毒表面分子与所述反应剂—可选第一反应剂—之间的可逆结合能够被添加某种物质破坏;和/或
所述病毒颗粒结合剂与所述反应剂—可选第一反应剂—之间的可逆结合能够被添加某种物质破坏;和/或
所述刺激剂与所述反应剂—可选第一反应剂和第二反应剂—之间的可逆结合能够被添加某种物质破坏;和/或
所述第二刺激剂与第二作用剂之间的可逆结合能够被添加某种物质破坏。
200.如实施方式199所述的方法,其中,所述破坏包括将含有所述物质的组合物引至细胞。
201.如实施方式199或200所述的方法,其中,所述物质是游离结合伴侣和/或是竞争剂。
202.如实施方式199-201中任一项所述的方法,其中,所述物质在组合物中对T细胞或对靶细胞无害,和/或与在可比或相同条件下不含该物质进行的T细胞或靶细胞的孵育相比,加入该物质不会令存活T细胞或靶细胞百分比降至低于90%、80%、70%、60%或50%。
203.如实施方式123-202中任一项所述的方法,其中:
所述反应剂是或含链霉亲和素、亲和素、链霉亲和素类似物或突变蛋白、或亲和素类似物或突变蛋白、或其生物活性片段;且
所述物质包含链霉亲和素结合肽、生物素或其生物活性片段、可选地,D-生物素、或生物素类似物或生物活性片段。
204.如实施方式203所述的方法,其中:
所述物质是选自下组的链霉亲和素结合肽:Trp-Ser-His-Pro-Gln-Phe-Glu-Lys(SEQ ID NO:8)、Trp-Ser-His-Pro-Gln-Phe-Glu-Lys-(GlyGlyGlySer)
所述物质是C1或其类似物,或者是C2或其类似物。
205.如实施方式123-204中任一项所述的方法,其中:
所述选择剂,可以是第一选择剂和/或第二选择剂,各自选自抗体片段、单价抗体片段、具有抗体样结合特征的蛋白质结合分子、包含Ig结构域的分子、细胞因子、趋化因子、适体和MHC分子,或它们的结合片段;和/或
所述刺激剂,可以是第一刺激剂和/或第二刺激剂,各自选自抗体片段、单价抗体片段、具有抗体样结合特征的蛋白质结合分子、包含Ig结构域的分子、细胞因子、趋化因子、适体和MHC分子,或它们的结合片段;和/或
所述病毒颗粒结合剂选自抗体片段、单价抗体片段、具有抗体样结合性质的蛋白结合分子、含有Ig结构域的分子、细胞因子、趋化因子、适体、MHC分子,或它们的结合片段。
206.如实施方式123-205中任一项所述的方法,其中:
所述选择剂、刺激剂和/或病毒颗粒结合剂包含抗体片段;
所述选择剂、刺激剂和/或病毒颗粒结合剂包含Fab片段;
述选择剂、刺激剂和/或病毒颗粒结合剂包含是选自F(ab')
述选择剂、刺激剂和/或病毒颗粒结合剂包含选自Fab片段、Fv片段和scFV片段的单价抗体片段;和/或
述选择剂、刺激剂和/或病毒颗粒结合剂包含选自下组的具有抗体样结合特征的蛋白质性结合分子:适体、基于脂质运载蛋白家族多肽的突变蛋白、糖体、基于锚定蛋白骨架的蛋白质、基于晶体骨架的蛋白质、阿迪连接素和阿维多聚体。
207.如实施方式123-206中任一项所述的方法,反应剂是或含:链霉亲和素、亲和素、可逆结合生物素链霉亲和素类似物或突变蛋白、生物素类似物或其生物活性片段;可逆结合链霉亲和素结合肽的亲和素或链霉亲和素类似物或突变蛋白;包含至少两个螯合基团K的反应剂,其中所述至少两个螯合基团能够结合过渡金属离子;能够结合寡聚组氨酸亲和标签的物质;能够结合谷胱甘肽-S转移酶的物质;钙调蛋白或其类似物;能够结合钙调蛋白结合肽(CBP)的物质;能够结合FLAG肽的物质;能够结合HA标签的物质;能够结合麦芽糖结合蛋白(MBP)的物质;能够结合HSV表位的物质;能够结合myc表位的物质;或能够结合生物素化载体蛋白的物质。
208.如实施方式123-207中任一项所述的方法,其中:
所述反应剂是或含可逆结合生物素或其生物活性片段的链霉亲和素类似物或突变蛋白或亲和素类似物或突变蛋白;
所述反应剂是或含可逆结合生物素类似物或其生物活性片段的链霉亲和素类似物或突变蛋白或亲和素类似物或突变蛋白;和/或
所述反应剂是或含可逆结合链霉亲和素结合肽的链霉亲和素类似物或突变蛋白或亲和素类似物或突变蛋白。
209.如实施方式123-208中任一项所述的方法,所述反应剂反应剂是可逆结合生物素或其生物活性片段的链霉亲和素类似物或突变蛋白、亲和素、链霉亲和素的寡聚体或多聚体;可逆结合链霉亲和素结合肽的链霉亲和素或亲和素类似物或突变蛋白;包含至少两个螯合基团K的反应剂,其中所述至少两个螯合基团能够结合过渡金属离子;能够结合寡聚组氨酸亲和标签的物质;能够结合谷胱甘肽-S-转移酶的物质;钙调蛋白或其类似物;能够结合钙调蛋白结合肽(CBP)的物质;能够结合FLAG肽的物质;能够结合HA标签的物质;能够结合麦芽糖结合蛋白(MBP)的物质;能够结合HSV表位的物质;能够结合myc表位的物质;或能够结合生物素化载体蛋白的物质。
210.如实施方式123-209中任一项所述的方法,其中,所述反应剂包括:链霉亲和素类似物或突变蛋白、或和亲和素类似物或突变蛋白、亲和素、链霉亲和素的寡聚体或多聚体。
211.如实施方式209或210所述的方法,其中,寡聚体或多聚体中的个体分子通过多糖或双官能接头交联。
212.如实施方式123-211中任一项所述的方法,其中,多个结合位点包括至少2、4、8、12、16、20、24、28、32、36、40、44、48、52、56、60、64、72或更多个结合位点。
213.如实施方式207-212中任一项所述的方法,其中,所述链霉亲和素结合肽选自下组:Trp-Ser-His-Pro-Gln-Phe-Glu-Lys(SEQ ID NO:8)、Trp-Ser-His-Pro-Gln-Phe-Glu-Lys-(GlyGlyGlySer)3-Trp-Ser-His-Pro-Gln-Phe-Glu-Lys(SEQ ID NO:17)、Trp-Ser-His-Pro-Gln-Phe-Glu-Lys-(GlyGlyGlySer)2-Trp-Ser-His-Pro-Gln-Phe-Glu-Lys(SEQ ID NO:18)和Trp-Ser-His-Pro-Gln-Phe-Glu-Lys-(GlyGlyGlySer)2Gly-Gly-Ser-Ala-Trp-Ser-His-Pro-Gln-Phe-Glu-Lys(SEQ ID NO:19)。
214.如实施方式123-213中任一项所述的方法,其中:
所述反应剂包括链霉亲和素类似物或突变蛋白,其在对应于SEQ ID NO:1所示氨基酸序列的链霉亲和素的第44-47位包含氨基酸序列Va1
所述链霉亲和素类似物或突变蛋白在对应于SEQ ID NO:1所示氨基酸序列的链霉亲和素的第44-47位包含氨基酸序列Va1
215.如实施方式123-214中任一项所述的方法,其中,所述链霉亲和素类似物或突变蛋白包含:
a)SEQ ID NO:3-6、27和28中任一项所示的氨基酸序列;
b)如下氨基酸序列:与SEQ ID NOS:3-6、27和28中任一序列显示至少85%、86%、87%、88%、89%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更大序列相同性、且包含对应于Va1
c)a)或b)的功能性片段,其可逆结合生物素或其生物活性形式、生物素类似物或突变蛋白或其生物活性片段或链霉亲和素结合肽。
216.如实施方式214或215所述的方法,其中,所述链霉亲和素类似物或突变蛋白在对应于SEQ ID NO:1所示氨基酸序列的链霉亲和素位置的第117、120和121位还包含一个或多个氨基酸取代。
217.如实施方式216所述的方法,其中:
所述氨基酸取代选自:Glu117、Asp117、Arg117、Ser120、Ala120、Gly120、Trp121、Tyr121或Phe121;或
所述一处或多处氨基酸取代为选自Glu117、Gly120或Tyr121中的一项或多项;或者
所述氨基酸置换选自Glu117、Gly120或Tyr121。
218.如实施方式123-217中任一项所述的方法,其中,所述链霉亲和素类似物或突变蛋白包含:
a)SEQ ID NO:27或28所示的氨基酸序列;
b)氨基酸序列,其与SEQ ID NO:28显示至少85%、86%、87%、88%、89%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更大序列相同性、且包含对应于Va1
c)a)或b)的功能性片段,其可逆结合生物素或其生物活性片段、生物素类似物或突变蛋白或其生物活性片段或链霉亲和素结合肽。
219.如实施方式123-218中任一项所述的方法,其中,所述结合伴侣C1和/或结合伴侣C2独立地包含选自下组的链霉亲和素结合肽:Trp-Ser-His-Pro-Gln-Phe-Glu-Lys(SEQ ID NO:8)、Trp-Ser-His-Pro-Gln-Phe-Glu-Lys-(GlyGlyGlySer)3-Trp-Ser-His-Pro-Gln-Phe-Glu-Lys(SEQ ID NO:17)、Trp-Ser-His-Pro-Gln-Phe-Glu-Lys-(GlyGlyGlySer)2-Trp-Ser-His-Pro-Gln-Phe-Glu-Lys(SEQ ID NO:18)和Trp-Ser-His-Pro-Gln-Phe-Glu-Lys-(GlyGlyGlySer)2Gly-Gly-Ser-Ala-Trp-Ser-His-Pro-Gln-Phe-Glu-Lys(SEQ ID NO:19)。
220.如实施方式123-219中任一项所述的方法,包括在所述破坏之后收获细胞并对包含孵育后细胞的组合物再进行孵育,由此产生再孵育组合物。
221.如实施方式220所述的方法,其中:
所述孵育和再孵育在相同的容器中进行;和/或
所述再孵育在所述物质的存在下进行;和/或
所述方法不包括在再孵育前从孵育后细胞组合物中去除所述物质、选择剂、刺激剂、病毒颗粒结合剂和/或反应剂。
222.如实施方式220或221所述的方法,所述再孵育在细胞扩增条件下进行。
223.如实施方式124-222中任一项所述的方法,其中:
所述支持物包含树脂或基质;
所述支持物包含凝聚过滤基质;
所述支持物包含色谱基质;和/或
所述支持物包含基于纤维素或基于有机聚合物的膜。
224.如实施方式22所述的方法,其中,色谱基质位于柱中,且/或所述色谱是柱色谱或平面色谱。
225.如实施方式124-222中任一项所述的方法,其中,所述支持物包含微粒、刚性颗粒、磁性颗粒或珠。
226.如实施方式124-222中任一项所述的方法,其中,所述支持物是固定相,孵育和/或接触全程或部分过程中存在于容器中。
227.如实施方式226中任一项所述的方法,其中,所述容器包括选自以下所述的容器:柱、适合双向流的容器、尖头移液管、管和适合液体样品流动通过的柱。
228.如实施方式123-227中任一项所述的方法,其中,所述方法得到表达选择标志物的细胞的选择性转导,所述选择标志物可以是第一选择标志物和/或第二选择标志物。
229.如实施方式228所述的方法,其中,表达选择标志物(第一和/或第二选择标志物)的细胞中的转导高于组合物中不表达选择标志物(第一和/或第二选择标志物)的细胞至少2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍或更多。
230.如实施方式123-229中任一项所述的方法,其中:
所述孵育后组合物中至少2.5%、至少5%、至少6%、至少8%、至少10%、至少20%、至少25%、至少30%、至少40%、至少50%或至少75%的细胞经所述方法被所述病毒载体转导;和/或
所述再孵育后组合物中至少2.5%、至少5%、至少6%、至少8%、至少10%、至少20%、至少25%、至少30%、至少40%、至少50%或至少75%的细胞经所述方法被所述病毒载体转导;和/或
所述孵育后组合物和/或所述再孵育后组合物中至少2.5%、至少5%、至少6%、至少8%、至少10%、至少20%、至少25%、至少30%、至少40%、至少50%或至少75%的细胞表达所述病毒载体内所含异源核酸的产物。
231.如实施方式123-230中任一项所述的方法,其是离体进行的。
232.如实施方式123-231中任一项所述的方法,还包括收获或分离方法所得被转导的细胞。
233.一种被转导细胞,用实施方式123-232中任一项所述方法制得。
234.一种组合物,包含实施方式233所述被转导细胞。
235.一种组合物,包含:
可逆结合于反应剂的病毒载体颗粒结合剂,所述病毒载体颗粒结合剂能够特异性结合病毒颗粒表面分子;或
可逆结合于反应剂的病毒载体颗粒。
236.如实施方式235所述的组合物,其中,所述反应剂含有多个结合位点,它们各自能够可逆结合病毒颗粒结合剂。
237.如实施方式235或236所述的组合物,还包含选择剂,所述选择剂能够可逆结合反应剂并能够特异性结合靶细胞上的选择标志物。
238.如实施方式237所述的组合物,其中,所述选择剂可逆结合于反应剂。
239.如实施方式235-238中任一项所述的组合物,所述组合物还包含支持物,所述反应剂固定在所述支持物上。
240.如实施方式239所述的组合物,其中,所述支持物是或含固定相和/或固体支持物。
241.如实施方式235-240中任一项所述的组合物,还包括:
病毒颗粒;和/或
靶细胞,所述靶细胞可选地含有重组分子或表达所述重组分子的核酸,可选地,所述重组分子是嵌合受体。
242.如实施方式235-241中任一项所述的组合物,还包含能够破坏反应剂与病毒颗粒结合剂之间可逆结合且/或能够在反应剂与选择剂之间进行破坏的物质。
243.一种用于转导靶细胞的制品,所述制品包含:
(a)病毒颗粒结合剂,其能特异性结合病毒颗粒表面分子的;
(b)反应剂,所述反应剂含有多个结合位点,各自能够可逆结合病毒颗粒结合剂。
244.如实施方式243所述的制品,还包含选择剂,所述选择剂能够可逆结合反应剂并能够特异性结合靶细胞上的选择标志物。
245.如实施方式244所述的制品,其中,所述选择剂可逆结合于反应剂。
246.如实施方式243-245中任一项所述的制品,还包含支持物,所述反应剂固定在所述支持物上。
247.如实施方式246所述的制品,其中,所述支持物是或含固定相和/或固体支持物。
248.如实施方式247所述的制品,所述支持物是固定相,所述固定相是或含色谱基质,所述制品还包含容器,可选地,所述容器是第一容器,其中容纳全部或部分所述色谱基质,可选地,所述(第一容器)是柱。
249.一种设备,包含实施方式235-242中任一项所述的组合物或实施方式243-248中任一项所述的制品,可选地,还包含流体入口和/或流体出口,所述入口流体连通所述组合物或流体流通所述设备的一个或多个腔室,所述出口流通连通所述组合物和/或流体流通所述设备的一个或多个腔室。
250.一种设备,所述设备包括:
(a)病毒颗粒结合剂,所述病毒颗粒结合剂能够特异性结合病毒颗粒表面分子并能够可逆结合反应剂;
(b)选择剂,所述选择剂能够可逆结合所述反应剂并能够特异性结合靶细胞表面的选择标志物;
(c)反应剂,所述反应剂能够可逆结合病毒颗粒结合剂和选择剂;和
(d)支持物。
251.如实施方式250所述的设备,其中组分(a)~(e)存在于多个容器中,其中至少一些流体相连,可选地,处于封闭或无菌系统中,由此一种或多种组分在设备中由一个容器通往另一个容器。
252.如实施方式243-251中任一项所述的制品或设备,还包含样品出口,所述出口与至少一个色谱固定相之一流体相连。
253.如实施方式243-252中任一项所述的制品或设备,所述设备是功能性封闭系统。
254.如实施方式243-253中任一项所述的制品或设备,还包含一项或多项控制机制,能够调节或调整一个或多个容器或部分或至少所述至少一个色谱固定相之一的pH、pO
255.如实施方式243-253中任一项所述的制品或设备,还包含与包含培养基和/或一种或多种营养物和/或一个或多个碳源的容器的流体连接,由此该连接能够将所述培养基、营养物和/或碳源递送给设备内的细胞,可选地,所述细胞固定于色谱固定相上。
256.如实施方式243-253中任一项所述的制品或设备,所述至少一个组件和/或其所在容器是能够以无菌或消毒方式从所述设备卸除的。
257.一种病毒载体颗粒,含有链霉亲和素结合肽。
258.如实施方式257所述的病毒载体颗粒,所述链霉亲和素结合肽是与包膜糖蛋白的融合蛋白。
259.如实施方式258所述的病毒载体颗粒,其中,所述包膜糖蛋白是VSV-G.192。
260.如实施方式257-259中任一项所述的病毒载体颗粒,所述病毒载体是逆转录病毒载体,可选地是慢病毒载体。
261.如实施方式257-260中任一项所述的病毒载体颗粒,其中,所述链霉亲和素结合肽选自下组:Trp-Ser-His-Pro-Gln-Phe-Glu-Lys(SEQ ID NO:8)、Trp-Ser-His-Pro-Gln-Phe-Glu-Lys-(GlyGlyGlySer)3-Trp-Ser-His-Pro-Gln-Phe-Glu-Lys(SEQ ID NO:17)、Trp-Ser-His-Pro-Gln-Phe-Glu-Lys-(GlyGlyGlySer)2-Trp-Ser-His-Pro-Gln-Phe-Glu-Lys(SEQ ID NO:18)和Trp-Ser-His-Pro-Gln-Phe-Glu-Lys-(GlyGlyGlySer)2Gly-Gly-Ser-Ala-Trp-Ser-His-Pro-Gln-Phe-Glu-Lys(SEQ ID NO:19)。
262.一种试剂盒,包括:
如实施方式257-261中任一项所述的病毒载体颗粒;和
反应剂,所述反应剂含有一个或多个能够可逆结合所述病毒载体颗粒的结合位点。
263.如实施方式262所述的试剂盒,还含有选择剂,所述选择剂能够结合靶细胞表面的选择标志物,所述反应剂具有一个或多个能够可逆结合选择剂的结合位点。
264.如实施方式257-263中任一项所述的病毒载体颗粒或试剂盒,所述病毒载体颗粒含有编码重组抗原受体的基因组,可选地,所述重组抗原受体是嵌合抗原受体。
IX.实施例
下面的实施例仅是为了阐述,而不是用来限制本发明的范围。
实施例1–含有可逆结合寡聚链霉亲和素突变蛋白反应剂的多聚抗CD3和抗CD28Fab片段的可溶性刺激剂的产生
通过可逆结合多聚反应剂将刺激剂(抗CD3和抗CD28 Fab片段)多聚化,所述多聚化反应剂为寡聚链霉亲和素突变蛋白。反应剂包含针对存在于Fab片段上的肽标签的多个结合位点。寡聚链霉亲和素突变蛋白根据制造商的说明书(Thermo Scientific公司),通过如下物质的聚合制备:命名为
抗CD3和抗CD28 Fab片段通过融合于各Fab片段的链霉亲和素肽结合伴侣与该寡聚链霉亲和素突变蛋白可逆结合。抗CD3 Fab片段衍生自由淋巴瘤细胞系OKT3(
为了实现可逆结合,将带有肽标签的抗CD3和抗CD28 Fab片段与多聚化反应剂在约室温下混合,由此使它们通过与Fab片段上的twin-strep标签相互作用与所述反应剂可逆结合,所述标签是能够可逆结合反应剂上结合位点的结合伴侣。具体地,在本研究中,在室温下,将约0.5μg抗CD3肽标签化Fab片段和约0.5μg抗CD28肽标签化Fab片段加到约3μg可溶寡聚
实施例2:可逆固定于链霉亲和素突变蛋白
将300,000个CD3+CD62L应答T细胞(T
所用αCD3 Fab片段衍生自杂交瘤细胞系OKT3所产生的结合CD3的单克隆抗体。杂交瘤细胞系OKT3和OKT3抗体见美国专利4,361,549,该细胞系已以登录号
两Fab片段均是在大肠杆菌(E.coli)中重组产生(如国际专利申请公开号WO2013/011011和WO 2013/124474中所述),携带作为恒定区(CH1和Cκ)的IgG1共有序列。两Fab片段的重链均在羧基末端与依序排列的两个链霉亲和素结合模块(SAWSHPQFEK(GGGS)
在扩增试验中,将用空白珠(无Fab)刺激的T
实施例3:可逆固定于可溶Strep-tactin的αCD3/αCD28 Fab片段致CD3+T应答细胞刺激/扩增
本实施例中,用可逆固定于可溶寡聚
为体外扩增,将300,000个CD3+应答T细胞(T
实施例4:可逆αCD3/αCD28 Fab-Streptamer多聚体体外刺激(不换培养基)的纯化CD4+和CD8+T应答细胞的增殖动力学
在本实施例中,研究了用可逆固定于可溶寡聚链霉亲和素突变蛋白的αCD3/αCD28Fab片段体外刺激的纯化CD4+和CD8+T应答细胞(T
在本实施例中,将500,000个纯化的CD4+或CD8+应答T细胞(T
由图9A可见,其上可逆固定有αCD3 Fab和αCD28 Fab片段的“较小”可溶反应剂所得的CD4+T细胞扩增量与抗CD3/抗CD28珠(其为迄今为止用于T细胞扩增的标准反应剂)相同,而“较大”可溶多聚作用剂的扩增相比Dyna珠更好。该改进可能是由于可溶较大的多聚体能够比较小的多聚作用剂同时结合更多T细胞,从而能够比“较小”多聚作用剂刺激更多CD4+T细胞。
如图9B所见,采用本文可溶多聚作用剂,CD8+T细胞能在前3天扩增,扩增效率至少与用抗CD3/抗CD28珠一样。值得注意的是,在该时间段中,采用在αCD3 Fab和αCD28 Fab片段(作为第一和第二作用剂)之外还可逆固定有αCD8 Fab片段的可溶反应剂的扩增试验,在这些培养条件下,显示最佳的扩增程度。这表明:可以采用对某特定细胞亚群特异性的刺激物(此处为αCD8 Fab片段)来提高或调控扩增的选择性,从而获得更大量的所需细胞(亚)群。
因此,综上所述,实施例4显示可溶多聚作用剂在引发T细胞扩增方面的功能与目前采用抗CD3/抗CD28珠的同功用标准方法相当。然而,由于可以通过加入竞争剂(例如,就基于链霉亲和素的第一和第二作用剂与反应剂之间可逆相互作用而言是生物素)来控制(和终止,若需要)刺激,本文所述的组合物和方法相比抗CD3/抗CD28珠技术具有显著优势,因为可对扩增条件进行优化(例如,可以在图9B所示试验中在3天后停止刺激)。此外,由于可溶反应剂能方便地从反应中去除(例如通过在扩增反应后令反应剂固定于生物素化的柱上),本文扩增方法可在封闭系统中进行或自动化,举例来说,这能够满足治疗目的细胞的GMP生产要求,无需进行珠(例如抗CD3/抗CD28珠)的去除。
实施例5:可逆αCD3/αCD28 Fab-Streptamer多聚体体外刺激(更换培养基)纯化CD4+和CD8+T应答细胞的增殖动力学
在本实施例中,研究了用可逆固定于可溶寡聚链霉亲和素突变蛋白上的αCD3/αCD28 Fab片段体外刺激的纯化CD4+和CD8+T应答细胞(T
在本实施例中,将400,000个纯化的CD4+或CD8+应答T细胞(T
如图10A所见,其上可逆固定有αCD3 Fab和αCD28 Fab片段的可溶反应剂(多聚作用剂)提供了优于抗CD3/抗CD28珠的CD4+T细胞扩增。
如图10B所见,采用多聚作用剂,CD8+T细胞可在前6天内扩增,扩增效率至少与用抗CD3/抗CD28珠一样。值得注意的是,该时间段中,采用携带αCD3和αCD28 Fab片段(作为第一和第二作用剂)的较大可溶反应剂的扩增试验在这些培养条件下显示最佳的扩增程度。这可能同样是因为可溶性较大多聚作用剂能够比较小多聚化作用剂同时结合更多T细胞,从而能够比“较小”多聚作用剂刺激更多CD4+T细胞。
实施例6:更换或不更换培养基的纯化CD4+和CD8+T细胞的扩增动力学
在本实施例中,将实施例4和5数据合并,并基于“较小”多聚作用剂、阳性和阴性对照的输入细胞数进行标准化。没有获取“较大”多聚作用剂的标准化数据。如实施例4和5中所述,用3μl多聚作用剂(1mg/ml;其上固定有0.5μgαCD3 Fab片段和0.5μgαCD28 Fab片段)的制备物刺激400,000~500,000个CD4+或CD8+应答T细胞(T
实施例7:多克隆活化/扩增的大量CD3+中心记忆T细胞(T
在本实施例中,500,000个CD3+CD62L+CD45RA-应答T
实施例8:扩增的CD8+T细胞的产率和表型——用于刺激的可溶反应剂的大小差异和αCD8-Fab添加
在本实施例中,研究了用可逆固定的可溶寡聚链霉亲和素突变蛋白的αCD3/αCD28Fab片段体外刺激的纯化CD8+T应答细胞的扩增。此外,还研究了将αCD8-Fab加入反应剂以提高CD8+T细胞扩增特异性的效果。
为此,300,000个纯化CD8+应答T细胞(T
此外,比较采用其上共同固定有0.5μgαCD3和0.5μgαCD28 Fab片段的反应剂所得扩增产率(图13B中左起第二柱)与采用仅用αCD3 Fab片段或仅用αCD28Fab片段官能化的两种反应剂所得产率(图13B中左起第三柱),可发现两种试验具有相同的扩增效率。因此,这些试验显示,采用其上共同固定有第一作用剂和第二作用剂的同一反应剂在功能上等同于同时采用分别仅加载有第一作用剂和仅加载有第二作用剂的两反应剂进行扩增。
实施例9:CD8+T细胞的产率和表型——其上固定有不同比例αCD3-和αCD28 Fab片段的各可溶反应剂单独的效价
在本实施例中,研究了用可逆固定于可溶寡聚链霉亲和素突变蛋白上不同量αCD3/αCD28 Fab片段体外刺激的扩增的CD8+T应答细胞(T
为此,将300,000个CD8+应答T细胞(T
实施例10:添加αCD8-Fab来刺激的扩增的CD3+T细胞的亚组组成和产率
试验显示体外用αCD3/αCD28 Fab片段刺激的纯化CD3+T应答细胞的扩增,所述片段可逆固定于作为可溶性反应剂的实施例3的可溶寡聚链霉亲和素突变蛋白。在一个试验中,αCD3/αCD28 Fab片段之外,还将αCD8 Fab片段(市售获自IBA有限公司,德国哥廷根,目录号6-8000-203)固定于可溶寡聚链霉亲和素突变蛋白上,为的是测试是否能够用可逆αCD3/αCD28多聚作用剂体外优先刺激特定T细胞亚群。更具体而言,500,000个纯化CD3+应答T细胞(T
实施例11:Jurkat细胞内的差异胞内钙动员分析
本实施例研究用αCD3抗体克隆OKT3或用OKT3的Fab片段(用
为此,用钙敏感染料Indo-1-AM加载Jurkat细胞,通过注入αCD3单克隆抗体OKT3(由杂交瘤细胞系OKT3产生,见上方,黑色方块)或注入通过其链霉亲和素结合肽可逆结合可溶Strep-Tactin(与藻红蛋白荧光偶联)而多聚化的αCD3 Fab片段(衍生自亲本细胞系OKT3)引发钙释放。在完整多聚OKT3 Fab-Strep-Tactin复合物的情况中,引发钙释放的时长与用亲本抗体克隆(深灰三角)相同。通过注入D-生物素处理的预解离Fab-Strep-Tactin复合物(浅灰圆圈)可完全避免细胞活化,这与注入PBS阴性对照(白色倒三角)相同。施用离子霉素作为钙内流阳性对照。胞内Ca
在图16B所示试验中,indo-1-AM标记的Jurkat细胞用OKT3衍生的αCD3Fab-Strep-Tactin复合物活化(如图16A所述)。注入完整复合物(上图)或预解离复合物(下图)分别作为阳性和阴性对照。此外,用完整Fab-Strep Tactin复合物刺激细胞然后注入D-生物素(靠近t=140秒的峰值活化)造成αCD3 Fab多聚体信号转导的骤然破坏。在预解离Fab复合物组中注入离子霉素作为阳性对照。数据代表3次独立实验。重要的是,图16B显示,在样品中加入D-生物素迅速将Fab片段从Strep-tactin多聚化作用剂上置换下来,由此有效终止了钙释放,即便钙刺激正在进行中也是如此,这表明解离的OKT3 Fab片段不再具有生物学活性。同样,将Streptactin-OKT3Fab样品加到Jurkat细胞前,将生物素加入Strep-tactin-OKT3Fab片段多聚体时,多聚化OKT3 Fab片段也不能引发钙释放。
实施例12:用αCD3 Fab多聚体的细胞可逆染色
本实施例考察用αCD3 Fab多聚体对细胞的可逆染色。将刚分离的PBMC用αCD3单克隆抗体OKT3(左侧点图,Fab多聚体的亲本克隆)或同类藻红蛋白(PE)标记的OKT3 Fab多聚体染色,在用D-生物素处理之前(左起第二栏)或处理之后(中间栏)进行分析。洗涤后用新鲜PE标记的
实施例13:采用CD28 Fab多聚体的细胞的可逆分离
本实施例显示通过与用
实施例14:经可逆αCD3/αCD28 Fab-Streptamer多聚体体外刺激的纯化CD4+和CD8+T应答细胞的活化后的早期细胞簇形成
在本实施例中,将400,000个CD4+或CD8+应答T细胞(T
实施例15:出自大量CD3+中心记忆T细胞的T
在本实施例中,考察了出自纯化的CD3+CD62L+CD45RA-cm应答细胞的选择性抗原特异性(Ag特异性)扩增的动力学和表型。
更详细而言,CD3+CD62L+CD45RA-T
为此,采用3μl经0.5μg带链霉亲和素结合肽的肽:MHC I类复合物官能化和经0.5μgαCD28 Fab官能化的可溶寡聚链霉亲和素多聚反应剂的制备物(如前所述)对500,000个CD3+CD62L+CD45RA-应答T
实施例16:大量中心记忆T细胞中的选择性Ag特异性扩增动力学和表型
本实施例考察了出自纯化CD3+CD62L+CD45RA-T
为此,对500,000个CD3+CD62L+CD45RA-应答T
实施例17:CD19-CAR转导的Jurkat细胞经Streptamer多聚体刺激后的胞内信号级联的活化
在本实施例中,考察了被转导的Jurket细胞胞内信号转导级联活化,所述细胞经修饰而表达肿瘤特异性嵌合抗原受体(CAR),在此即CD19,并用作为可溶多聚化反应剂的实施例3的寡聚
为此,300,000个Jurkat应答细胞(J
因此,该试验表明:原则上,通过结合向细胞群提供主活化信号的作用剂(配体)而活化的任何细胞群都可采用本文所述可逆固定于多聚化反应剂的第一作用剂来扩增。
实施例18:出自单池的T
在本实施例中,考察了出自经多种可逆肽:MHC/αCH28 Fab-Streptamer多聚体体外刺激的T应答细胞单池的平行抗原特异性(Ag特异性)扩增的动力学。
将500,000个CD3+CD62L+CD45RA-应答T
实施例19:经αCD3/αCD8/αCD28 Fab片段可逆官能化的基于链霉亲和素的多聚化反应剂体外刺激的CD3+T应答细胞中CD8+T细胞的优先增殖
300,000个CD3+应答T细胞(T
实施例20:经αCD3和αCD28 Fab片段可逆官能化的基于链霉亲和素的多聚化反应剂体外刺激的CD3+T应答细胞中CD8+T细胞的优先增殖
300,000个CD3+应答T细胞(T
本文制造了寡聚链霉亲和素突变蛋白反应剂并显示其具有转导佐剂活性,相关研究显示,相比现有转导增强佐剂,此类反应剂存在下,T细胞转导增强。
寡聚链霉亲和素突变蛋白反应剂的制造
基本上如实施例1所述制备寡聚链霉亲和素突变蛋白的寡聚体形式:聚合名为
本项研究中,寡聚链霉亲和素突变蛋白反应剂可逆结合一个或多个Fab片段,所述Fab片段含有T细胞表面表达分子特异性结合结构域并在其重链羧基端含有链霉亲和素结合肽标签。本项研究中,采用两种不同的寡聚链霉亲和素突变蛋白反应剂,各自可逆结合有:(1)抗CD3和抗CD28 Fab片段和(2)抗CD8 Fab片段。本项研究中,标签具有连续排列的两个链霉亲和素结合分子,所述链霉亲和素结合分子的氨基酸序列为SAWSHPQFEK(GGGS)2GGSAWSHPQFEK(SEQ ID NO:16),这使得Fab片段能够与寡聚链霉亲和素突变蛋白反应剂上各链霉亲和素突变蛋白部分可逆结合。为了实现可逆结合,约室温下,带有肽标签的Fab片段与寡聚链霉亲和素突变蛋白混合,它们由此通过标签与寡聚反应剂上结合位点之间的相互作用而与反应剂结合。
采用抗体偶联磁珠的T细胞选择和刺激
T细胞通过基于免疫亲和的选择从人外周血单核细胞(PBMC)样品中分离。转导前,所选的细胞通过与抗CD3和抗CD28抗体片段包被的磁珠培养来刺激,37℃约72小时。
转导与扩增
对所得刺激后细胞群中的细胞如下所述在各种条件下进行转导。
将约2.1x 10
活化后第8天(约5.7群倍增后),测定各组合物中成核细胞总数。作为转导效率指标,用基于流式细胞术的试验来测定组合物中CD3+且CAR表面表达阳性活细胞的百分比,此处用带标记的特异性结合CAR胞外结构域(ECD)中鼠可变区部分的羊抗鼠抗体来检测。
条件(1)-(4)的结果见表1,结果提示:相比聚阳离子或基于纤连蛋白的佐剂,转导期间存在寡聚链霉亲和素突变蛋白反应剂提高转导效率,支持此类反应剂作为无毒转导佐剂的应用。采用可逆结合抗CD3/抗CD28 Fab的寡聚反应剂(3)与采用可逆结合抗CD8 Fab片段的寡聚反应剂(4)相比可见相似的转导效率。以上结果提示:第8天表达异源CAR的活T细胞百分比升高是源于相比其他转导佐剂转导增强和/或毒性降低,而不是反应剂上可逆结合的CD3和CD28 Fab片段介导的活化或刺激效应。
表1:
另一套条件(5)中,对选得T细胞刺激24-48小时,基本上按实施例21中就条件(1)-(4)所述进行,区别在于刺激在可逆结合有抗CD3/抗CD28 Fab片段的寡聚链霉亲和素突变蛋白反应剂存在下进行,而非抗CD3/抗CD28包被的磁珠。就此条件,按实施例21所述用γ逆转录病毒颗粒进行转导,但比例为1.0IU病毒/细胞,并且,不添加除刺激期间所用寡聚反应剂之外其他转导佐剂。
测定第8天的转导效率,通过评价CAR阳性活T细胞进行测定,试验如实施例21所述。结果见表2,与表1中的(1)和(2)进行了比较。结果显示,寡聚抗CD3/抗CD28结合的链霉亲和素突变蛋白反应剂存在下刺激、不清除该反应剂也不添加其他转导佐剂实现了T细胞的有效转导。并且,尽管条件(5)采用的病毒量(IU/细胞)减少约70%,所得转导效率却与用抗CD3/抗CD28包被磁珠并在转导开始时添加其他转导增强佐剂所得相当。因此,即便是在转导开始前一天或数天添加寡聚反应剂(且转导前或转导期间不再添加更多或其他佐剂),采用链霉亲和素突变蛋白寡聚反应剂提高转导效率的程度堪比其他转导增强剂。
其他研究中,用不同刺激剂活化T细胞后在不同转导佐剂存在下进行转导,结果显示,当采用抗CD3/抗CD28结合的寡聚链霉亲和素突变蛋白反应剂对T细胞进行转导前活化,输出组合物中可见转导效率提高(测定表达病毒载体所编码异源蛋白的活细胞的百分比),与此一致的结论是:寡聚反应剂能够增强转导,即便是在转导开始前存在数小时或数天;并且,该效果可以与其他转导增强性佐剂(如基于纤连蛋白片段的转导增强剂或聚阳离子转导增强剂)叠加。以上结果显示,可单用寡聚反应剂活化和增强或促进病毒对T细胞的转导,本项研究中仅在转导前一个时间点添加寡聚反应剂。
表2
实施例21所述链霉亲和素突变蛋白寡聚反应剂与CD8特异性Fab片段可逆结合,CD8是一个T细胞亚组的表面标志物,将上述反应剂包含在转导期间的总T细胞组合物中。包含总T细胞(CD4+和CD8+)(通过免疫亲和选择分离自人血源样品)的组合物如实施例21所述在抗CD3/抗CD28磁珠存在下刺激24-48小时。
刺激之后转导起始。γ逆转录载体颗粒编码CAR,将所述颗粒与抗CD8-结合的寡聚链霉亲和素突变蛋白反应剂或基于聚阳离子的转导佐剂混合。将病毒/佐剂混合物加入刺激后T细胞样品以促进转导,然后扩增,基本如实施例21所述进行。用流式细胞术测定表面标志物CAR的表面表达,如实施例21所述。每一种条件,将表面表达CAR的活T细胞百分比与表面CAR阳性活CD4+T细胞百分比比较。
结果见图23,显示CD4表面表达水平(y轴)与活T细胞(CD3+门控)CAR水平(x轴)的关系。结果显示,相比聚阳离子转导佐剂存在下的转导效率,优先提高CD8+T细胞(相比CD4+T细胞)的转导效率(测定表达异源产物(CAR)的活细胞百分比)。
本项研究中,假转导对照中的细胞未见可测的CAR表达,提示试验具备用于评价异源核酸转导的特异性。
以上结果显示,寡聚链霉亲和素突变蛋白反应剂除了能够提高转导效率之外,此类反应剂由可逆结合于寡聚寡聚链霉亲和素突变蛋白反应剂赋予的Fab的特异性还能够用来在混合细胞群中选择性增强CD8+T细胞的转导。与此一致的是,可逆结合有靶分子特异性抗体的寡聚反应剂能够用于优先增强或促进靶细胞转导,例如在含有不含或不表达所述靶分子的一个或多个其他细胞群的混合细胞群中。
本发明并不意在将范围限制于具体公开的实施方式,这些实施方式仅为提供,例如,对于本发明不同方面的说明。本文所述的组合物和方法的各种修饰将在本文的说明和启示后变得显而易见。可实施这类变化而不偏离本公开的真正范围和精神,并且落入本发明的范围内。
序列表
