抑制骨癌引起的异常性疼痛
文献发布时间:2023-06-19 09:23:00
本发明涉及用于抑制骨癌引起的异常性疼痛(allodynia),优选用于抑制骨癌引起的触觉性异常性疼痛(tactile allodynia)的方法。
异常性疼痛意指“其他疼痛”。它是通常不痛苦的刺激引起的疼痛。举例来说,遭受严重晒伤的个体甚至轻触也会经历剧烈的疼痛。更详细地说,日光暴露可使皮肤过度敏感,使得穿衬衫或洗澡可能会非常疼痛。因此,触觉性异常性疼痛(又名静态触觉性异常性疼痛(static tactile allodynia)或机械性异常性疼痛(mechanical allodynia))的患者可能会感到触痛,如将头枕在枕头上或戴帽子、耳环或项链。类似地,动态性异常性疼痛的患者可能会因轻轻梳理头发或剃光脸而感到疼痛。异常性疼痛是与“参照性”疼痛(也称为反射性疼痛)不同的病症,尽管它可以发生在受刺激区域之外。与痛觉过敏(hyperalgesia)不同,它是一种比通常更痛苦的疼痛刺激。实际上,如上所述,异常性疼痛的定义非常明确,“由通常不引起疼痛的刺激引起的疼痛”,与痛觉过敏(通常引起疼痛的刺激引起的疼痛增加)相反。
异常性疼痛不仅在症状水平上而且在分子/细胞水平上与“参照性”疼痛和痛觉过敏不同。已知外周敏化和适应不良的中央变化有助于产生和维持对感觉方式(例如触摸、压力、针刺、冷和热)的反应,在不同亚型的异常性疼痛和痛觉过敏中具有单独的机制。据报道,偏头痛中“皮肤异常性疼痛”的潜在机制是由于特定神经元组(即三叉神经尾核(TNC)中的二阶神经元)的致敏所致。
某些镇痛剂对治疗异常性疼痛无效,这一事实证明了异常性疼痛与其他类型疼痛之间的不同。例如,据报道,异常性疼痛显示对曲普坦类药物(一类在脑中血管和神经末梢充当5-羟色胺5-HT1B和5-HT1D受体激动剂的药物)反应不良,提示异常性疼痛与所述受体不相关(或相关性弱),使得它们不是好的异常性疼痛治疗的候选靶标。
异常性疼痛与某些疾病特别是骨癌有关(例如由其引起)。大约三分之一的晚期癌症患者在其病程中会发生临床相关的骨骼转移。这在患有乳腺癌、前列腺癌或肺癌的患者中最为突出。实际上,骨骼是仅次于肺和肝的第三大常见转移灶。
通常,骨转移随晚期恶性肿瘤出现,并与疼痛(癌症引起的骨痛)有关。骨痛是与功能性结果受损和生活质量差相关的主要临床问题。在溶骨和成骨细胞转移性骨癌患者中,疼痛由骨骼的结构损伤、骨膜刺激和神经卡压引起。疼痛通常被描述为在受损区域内疼痛和灼痛的深度、烦人、局部感觉,通常因承重而加剧。机械性异常性疼痛在转移性骨癌中特别普遍,在咳嗽、床上翻身或肢体轻度移动时引起剧烈疼痛。
阿片类药物治疗晚期骨癌疼痛(例如异常性疼痛)很常见并且相当有效。但是,减轻骨癌疼痛所需的剂量范围会产生无法接受的认知和胃肠道副作用,并且存在许多禁止使用阿片类药物的患者类型(见下文)。此外,目前公认的阿片类药物依赖性问题使人们对此类药物作为合适的止痛药的未来使用(尤其是长期使用)产生了严重的怀疑。
因此,越来越需要替代的抗异常性疼痛疗法/治疗剂。特别地,需要有效抑制骨癌引起的疼痛的替代镇痛剂。
本发明通过提供替代和/或改进的用于抑制骨癌引起的异常性疼痛的手段来解决这个问题。
本发明基于令人惊奇的发现,即非细胞毒性蛋白酶的施用导致异常性疼痛的抑制。鉴于异常性疼痛与例如神经痛(传统上已使用非细胞毒性蛋白酶)相比的独特分子性质,这是令人惊奇的。
除此发现外,本发明人发现非细胞毒性蛋白酶导致特别不舒服(例如与生活质量的显著降低有关)的异常性疼痛类型即骨癌引起的异常性疼痛的抑制。因此,本发明人鉴定了可从非细胞毒性蛋白酶治疗受益的重要的患者亚群(或亚组)。
因此,本发明人不仅发现了非细胞毒性蛋白酶的新使用领域(异常性疼痛),而且还发现了该领域的令人惊奇的技术效果(抑制骨癌引起的异常性疼痛)。
因此,本发明提供用于在患者中抑制骨癌引起的异常性疼痛的方法,所述方法包括对患有骨癌的患者施用治疗有效量的非细胞毒性蛋白酶。
本发明提供相应的治疗性用途,即非细胞毒性蛋白酶用于在患有骨癌的患者中抑制骨癌引起的异常性疼痛。
在本发明的关键优势中,本发明提供非细胞毒性蛋白酶的有利“再利用”,提供对成瘾性镇痛剂如阿片类药物(例如吗啡)的替代治疗。这对于治疗禁忌使用另一种(不同)镇痛剂的患者尤其有利-例如,所有曲普坦类药物禁忌用于患有心血管疾病(冠状痉挛、有症状的冠状动脉疾病、心脏病发作或中风后、无法控制的高血压、雷诺氏病、外周动脉疾病)的患者。大多数曲普坦类药物在怀孕和哺乳期间以及未满18岁的患者中也是禁忌的。阿片类药物(吗啡)存在许多禁忌症,如(以举例的方式)全身性肥大细胞增多症、未处理的甲状腺激素水平降低以及肾上腺功能下降。
在一个实施方案中,对个体施用非细胞毒性蛋白酶。术语“受试者”、“个人”和“患者”在本文中可互换使用,是指哺乳动物受试者。在一个实施例中,“受试者”是人类、陪伴动物(例如宠物,如狗、猫和/或兔子)、牲畜(例如猪、绵羊、牛和/或山羊)和/或马。在一个实施方案中,受试者(患者)是人。
在本发明的方法中,受试者先前可以未诊断为患有骨癌。备选地,受试者先前可以已诊断为患有骨癌。受试者也可以是表现出疾病风险因素的受试者,或者是无骨癌症状的受试者。受试者也可以是患有骨癌或处于发展成骨癌的风险中的受试者。在一个实施方案中,受试者先前已施用骨癌治疗。
在本发明的方法中,受试者先前可以未诊断为患有骨癌引起的异常性疼痛。备选地,受试者先前可以已诊断为患有骨癌引起的异常性疼痛。受试者也可以是表现出疾病风险因素的受试者,或者是无骨癌引起的异常性疼痛症状的受试者。受试者也可以是患有骨癌引起的异常性疼痛或处于发展成骨癌引起的异常性疼痛的风险中的受试者。在一个实施方案中,受试者先前已施用骨癌引起的异常性疼痛治疗。
术语“抑制”在本文中与术语“治疗”同义使用。因此,本发明包括用于在患者中治疗骨癌引起的异常性疼痛的方法,所述方法包括对患有骨癌的患者施用治疗有效量的非细胞毒性蛋白酶。本发明还包括相应的治疗用途,即非细胞毒性蛋白酶用于在患有骨癌的患者中治疗骨癌引起的异常性疼痛。
本文所用的术语“抑制”或“治疗”包括预防性抑制和治疗(例如,以预防骨癌引起的异常性疼痛的发作)以及矫正性抑制和治疗(抑制和治疗已经患有骨癌引起的异常性疼痛的受试者)。在一个优选实施方案中,本文所用的术语“抑制”是指矫正性治疗。在一个优选实施方案中,本文所用的术语“治疗”是指矫正性治疗。术语“抑制”或“治疗”包括抑制和治疗骨癌引起的异常性疼痛及其症状二者。在一些实施方案中,术语“抑制”或“治疗”是指骨癌引起的异常性疼痛的症状。
因此,可以以治疗有效量或预防有效量对受试者施用非细胞毒性蛋白酶和/或镇痛剂分子(优选非细胞毒性蛋白酶)。
“治疗有效量”是非细胞毒性蛋白酶和/或镇痛剂分子(优选非细胞毒性蛋白酶)的任何量,在单独或组合对受试者施用以抑制/治疗骨癌引起的异常性疼痛(或其症状)时,所述量足以达到对骨癌引起的异常性疼痛或其症状的这种抑制/治疗。
“预防有效量”是非细胞毒性蛋白酶和/或镇痛剂分子(优选非细胞毒性蛋白酶)的任何量,在单独或组合对受试者施用时,所述量抑制或延迟骨癌的引起的异常性疼痛(或其症状)的发作或复发。在一些实施方案中,预防有效量完全防止了骨癌引起的异常性疼痛的发作或复发。“抑制”发作是指降低骨癌引起的异常性疼痛(或其症状)发作的可能性,或完全防止发作。
在一个实施方案中,本发明的方法和用途包括选自口服、静脉内、动脉内、腹腔内、肌内、皮下、直肠、或阴道、吸入、局部或其组合中的一个或多个施用步骤。在一个实施方案中,施用是选自静脉内、动脉内(例如通过注射或滴注)、皮下或其组合中的一种或多种。
在一个实施方案中,所述方法/治疗用途包括共同施用镇痛剂(例如阿片剂,如吗啡)。因此,本发明提供包含非细胞毒性蛋白酶组分和阿片类药物组分的治疗组合。该镇痛剂不同于非细胞毒性蛋白酶组分,并且优选以次有效的治疗有效量施用。所述联合治疗达到了意想不到的镇痛效果,并减轻了阿片类药物组分的治疗负担。
治疗组合的组成部分的应用/施用顺序可以改变。非细胞毒性蛋白酶和阿片类药物可以作为单一组合物的一部分或在分开的组合物中同时施用(例如,都按它们各自的特定最佳剂量以达到协同作用)。例如,非细胞毒性蛋白酶可以存在于第一组合物中(例如适于静脉内对受试者施用),而阿片类药物可以存在于第二组合物中(例如适于静脉内、皮下或口服对受试者施用)。
此外,可以在不同时间施用非细胞毒性蛋白酶和阿片类药物(例如,可以预先施用非细胞毒性蛋白酶以使骨癌引起的异常性疼痛对阿片类药物敏感,反之亦然)。因此,在另一个实施方案中,在分开的组合物中在不同时间对受试者施用非细胞毒性蛋白酶和阿片类药物。
在一个实施方案中,在阿片类药物之前施用非细胞毒性蛋白酶组分。在一个实施方案中,非细胞毒性蛋白酶组分与阿片类药物同时施用。在一个实施方案中,在阿片类药物之后施用非细胞毒性蛋白酶。
因此,在使用中,非细胞毒性蛋白酶组分可以在不同的镇痛剂组分之前、同时或之后施用。
在一个实施方案中,异常性疼痛是选自触觉性异常性疼痛(与术语“机械性异常性疼痛”同义)、静态性异常性疼痛(例如,触摸时的疼痛)、动态性异常性疼痛(例如,轻抚时的疼痛)、热性(热或冷)异常性疼痛(例如,受影响之处的正常温和皮肤温度引起的疼痛)、运动性异常性疼痛(例如,关节或肌肉正常运动引起的疼痛)或皮肤性异常性疼痛的一种或多种。
在一个实施方案中,异常性疼痛由以下组成或包含触觉性异常性疼痛(又名静态触觉性异常性疼痛或机械性异常性疼痛)和/或动态异常性疼痛。在一个优选实施方案中,异常性疼痛是触觉性异常性疼痛(例如机械性异常性疼痛)。
施用通常是在选自结构受损的骨、骨膜刺激、神经卡压(nerve entrapment)和/或其他受损区域的局部施用。施用通常在接近骨癌细胞的局部浓度。
在一个实施方案中,施用是直接施用到骨癌细胞中或与其一起的结缔组织中。
不希望受限于理论,认为异常性疼痛更可能由转移性癌症诱发(例如,比良性和/或非转移性癌症更易诱发异常性疼痛)。另一理论认为,异常性疼痛更可能由在转移到骨骼之前(例如,由于周围软组织侵犯的侵袭)的产生自不同(例如非骨骼)组织的转移性癌症诱发。
在一个实施方案中,骨癌是转移性骨癌(例如骨转移)。
在一个实施方案中,骨癌是转移性癌症,其源自除骨以外的组织(例如不同于骨组织的组织)。可以发生癌症(在转移到骨骼之前)的组织的实例包括前列腺、乳房、肺和/或卵巢的组织。
在一个实施方案中,患者(例如受试者)患有一种或多种选自肺癌、乳腺癌、前列腺癌和卵巢癌(优选转移性肺癌、转移性乳腺癌、转移性前列腺癌和转移性卵巢癌)的癌症。患者可以患有肺癌。患者可以患有乳腺癌。患者可以患有前列腺癌。患者可以患有卵巢癌。
在一个实施方案中,骨癌是不同于良性肿瘤的转移性癌。在一个实施方案中,异常性疼痛不是由骨样骨瘤诱发。在一个实施方案中,骨癌不同于骨样骨瘤(即骨癌不包括骨样骨瘤)。
通过参考所附实施例来表明对所述“骨癌引起的异常性疼痛的抑制”的评估,并且可以使用实施例中所述的方法进行评估(例如,实施例1)。例如,实施例1(以及相关的材料和方法)描述了使用电子Von Frey测试测量异常性疼痛的方法。此测试涉及对动物(优选大鼠)的后爪的足底面施加递增的压力。对一只后爪因注射而发炎或受伤、一只后爪正常(例如对照爪)的动物利用该测试,以评价对动物施用的候选剂(例如非细胞毒性蛋白酶)的镇痛作用。该装置施加稳定递增的力,并且将反应阈值测定为引起爪缩回所需的压力(g),以提供观测的“爪缩回阈值(g)”值。
在电子von Frey测试中利用的动物优选大鼠骨癌疼痛的MRMT-1乳腺癌细胞模型(Medhurst S.J.等,“A rat model of bone cancer”,Pain,2002:129-140页;在此引入作为参考),其是用于癌症疼痛的药物测试的良好表征的动物模型。此模型是广泛接受的模型,因为它模拟了与临床前疼痛研究相适应的一段时间内的发病机制和病理学方面。
所述“爪缩回阈值(g)”可以在选自用非细胞毒性蛋白酶处理后2天、4天、6天、8天、10天、12天、14天、15天、16天、17天、18天、19天、20天或21天的一个或多个时间点测量。在一个实施方案中,“爪缩回阈值(g)”可以在选自用非细胞毒性蛋白酶处理和/或损伤动物的爪后14天、18天或21天(优选21天)的一个或多个时间点测量。优选地,还在使爪发炎或受伤之前进行处理前测量。
在一个实方案中,所述“爪缩回阈值(g)”可以在选自用非细胞毒性蛋白酶处理和/或损伤动物的爪后0分钟、30分钟、60分钟、90分钟、120分钟、150分钟、140分钟和160分钟(优选160分钟)的一个或多个时间点测量。优选地,还在使爪发炎或受伤之前进行处理前测量。
在一个实施方案中,本发明的非细胞毒性蛋白酶对骨癌引起的异常性疼痛的抑制比其他缺乏非细胞毒性蛋白酶的相同施用(例如仅施用溶媒)高至少10%、或至少20%、或至少30%、或至少40%、或至少50%、或至少60%、或至少70%、或至少80%、或至少90%或100%(对应于“爪缩回阈值”增加至少10%、或至少20%、或至少30%、或至少40%、或至少50%、或至少60%、或至少70%、或至少80%、或至少90%或100%)。
在一个实施方案中,本发明的非细胞毒性蛋白酶对骨癌引起的异常性疼痛的抑制比其他缺乏非细胞毒性蛋白酶的相同施用(例如仅施用溶媒)高至少2%、或至少4%、或至少6%、或至少8%、或至少10%、或至少12%、或至少14%、或至少16%、或至少18%或20%(对应于“爪缩回阈值”增加至少2%、或至少4%、或至少6%、或至少8%、或至少10%、或至少12%、或至少14%、或至少16%、或至少18%或20%)。
与通过杀死其天然靶细胞起作用的细胞毒性蛋白酶(例如蓖麻毒蛋白、白喉毒素、假单胞菌外毒素)相反,非细胞毒性蛋白酶通过使其天然靶细胞暂时丧失细胞功能来起作用。重要的是,非细胞毒性蛋白酶不会杀死其所作用的天然靶细胞。非细胞毒性蛋白酶的一些最众所周知的实例包括梭菌神经毒素(例如肉毒神经毒素,其以诸如Dysport
本发明的优选的非细胞毒性蛋白酶是梭菌神经毒素如破伤风毒素、肉毒神经毒素(例如BoNT/A、BoNT/B、BoNT/C
本文提到非细胞毒性蛋白酶包括天然和重组梭菌神经毒素蛋白酶、antarease蛋白酶和IgA蛋白酶。这包括血清型杂合体(如BoNT结构域血清型杂合体)、经修饰的神经毒素(如TSI)和多结构域神经毒素(例如多L链BoNT)。
本发明的非细胞毒性蛋白酶实现与梭菌神经毒素能够表明的相同的顺序中毒步骤(见图4)。例如,与梭菌神经毒素的天然靶细胞结合,导致非细胞毒性蛋白酶内体释放进入所述靶细胞的细胞质中,并导致细胞质内的SNARE切割。在一个优选实施方案中,本发明的非细胞毒性蛋白酶实现与BoNT/A(例如BoNT/A
作为实例,典型的蛋白酶(参考)序列包括:
肉毒A型神经毒素-氨基酸残基(1-448)
肉毒B型神经毒素-氨基酸残基(1-440)
肉毒C型神经毒素-氨基酸残基(1-441)
肉毒D型神经毒素-氨基酸残基(1-445)
肉毒E型神经毒素-氨基酸残基(1-422)
肉毒F型神经毒素-氨基酸残基(1-439)
肉毒G型神经毒素-氨基酸残基(1-441)
破伤风神经毒素-氨基酸残基(1-457)
IgA蛋白酶-氨基酸残基(1-959)*
*Pohlner,J.等,(1987).Nature 325,458-462页,在此引入作为参考。
上面提到的参考序列应视为指导,因为根据亚血清型可发生轻微变化。作为实例,US 2007/0166332(在此引入作为参考)引用了略微不同的梭菌序列:
肉毒A型神经毒素-氨基酸残基(M1-K448)
肉毒B型神经毒素-氨基酸残基(M1-K441)
肉毒C型神经毒素-氨基酸残基(M1-K449)
肉毒D型神经毒素-氨基酸残基(M1-R445)
肉毒E型神经毒素-氨基酸残基(M1-R422)
肉毒F型神经毒素-氨基酸残基(M1-K439)
肉毒G型神经毒素-氨基酸残基(M1-K446)
破伤风神经毒素-氨基酸残基(M1-A457)
包含轻链的多种梭菌毒素(clostridial toxin)片段可用于本发明的方面,条件是这些轻链片段可特异性靶向神经递质释放装置的核心成分,从而参与执行整个细胞机制,由此使梭菌毒素蛋白水解切割底物。梭菌毒素的轻链长度约为420-460个氨基酸,并包含酶促结构域。研究表明,梭菌毒素轻链的全长对于酶促结构域的酶促活性不是必需的。作为非限制性实例,酶促活性不需要BoNT/A轻链的前八个氨基酸。作为另一个非限制性实例,酶促活性不需要TeNT轻链的前八个氨基酸。同样,轻链的羧基端对于活性不是必需的。作为非限制性实例,酶促活性不需要BoNT/A轻链的最后32个氨基酸(残基417-448)。作为另一个非限制性实例,酶促活性不需要TeNT轻链的最后31个氨基酸(残基427-457)。因此,此实施方案的方面可包括梭菌毒素轻链,其包含具有例如至少350个氨基酸、至少375个氨基酸、至少400个氨基酸、至少425个氨基酸和至少450个氨基酸的长度的酶促结构域。此实施方案的其他方面可包括梭菌毒素轻链,其包含具有例如至多350个氨基酸、至多375个氨基酸、至多400个氨基酸、至多425个氨基酸和至多450个氨基酸的长度的酶促结构域。
在一个实施方案中,非细胞毒性蛋白酶切割非神经元SNARE蛋白,如SNAP-23蛋白。在一个实施方案中,该非细胞毒性蛋白酶是能够切割SNAP-23的经修饰的肉毒毒素L链。Chen和Barbieri,PNAS,106卷,23期,9180-9184页,2009描述了这种经修饰的L链的实例。
在一个实施方案中,该非细胞毒性蛋白酶是BoNT/A、BoNT/C或BoNT/E蛋白酶,并且优选的SNARE基序是SNAP(例如SNAP 25)基序。在另一个实施方案中,该非细胞毒性蛋白酶是BoNT/B、BoNT/D、BoNT/F或BoNT/G或破伤风神经毒素(TeNT)蛋白酶,并且优选的SNARE基序是VAMP基序。在另一个实施方案中,该非细胞毒性蛋白酶是BoNT/C1蛋白酶,并且优选的SNARE基序是突触融合蛋白基序。
本发明的多肽特别是其蛋白酶组分可以PEG化-这可以帮助提高稳定性,例如提高蛋白酶组分的作用持续时间。在蛋白酶包含BoNT/A、B或C1蛋白酶时,尤其优选PEG化。PEG化优选包括将PEG添加到蛋白酶组分的N端。作为实例,可以用一个或多个可以相同或不同的氨基酸(例如半胱氨酸)残基延伸蛋白酶的N端。所述氨基酸残基中的一个或多个可以具有连接(例如共价连接)其上的其自身的PEG分子。此技术的实例描述于WO2007/104567中,在此以其整体引入作为参考。
该非细胞毒性蛋白酶优选是BoNT/A、BoNT/C
备选地,该非细胞毒性蛋白酶可以是BoNT/B、BoNT/D、BoNT/F或BoNT/G或破伤风神经毒素(TeNT)蛋白酶,并且优选的SNARE基序是VAMP基序。备选地,该非细胞毒性蛋白酶是BoNT/C
在使用中,本发明的非细胞毒性蛋白酶(例如,梭菌神经毒素的L链,或等同的SNARE切割蛋白酶)通常通过与梭菌神经毒素支架组分(即靶向部分(例如,梭菌神经毒素的H
作为实例,典型的易位(参考)序列包括:
肉毒A型神经毒素-氨基酸残基(449-871)
肉毒B型神经毒素-氨基酸残基(441-858)
肉毒C型神经毒素-氨基酸残基(442-866)
肉毒D型神经毒素-氨基酸残基(446-862)
肉毒E型神经毒素-氨基酸残基(423-845)
肉毒F型神经毒素-氨基酸残基(440-864)
肉毒G型神经毒素-氨基酸残基(442-863)
破伤风神经毒素-氨基酸残基(458-879)
上面提到的参考序列应视为指导,因为根据亚血清型可发生轻微变化。作为实例,US 2007/0166332(在此引入作为参考)引用了略微不同的梭菌序列:
肉毒A型神经毒素-氨基酸残基(A449-K871)
肉毒B型神经毒素-氨基酸残基(A442-S858)
肉毒C型神经毒素-氨基酸残基(T450-N866)
肉毒D型神经毒素-氨基酸残基(D446-N862)
肉毒E型神经毒素-氨基酸残基(K423-K845)
肉毒F型神经毒素-氨基酸残基(A440-K864)
肉毒G型神经毒素-氨基酸残基(S447-S863)
破伤风神经毒素-氨基酸残基(S458-V879)
本发明还包括变体易位结构域,只要该变体结构域仍显示必需的易位活性即可。作为实例,变体可与参考易位结构域具有至少70%、优选至少80%、更优选至少90%和最优选至少95%或至少98%的氨基酸序列同源性。在与易位结构域相关使用之时,术语片段是指具有参考易位结构域的至少20个、优选至少40个、更优选至少80个、最优选至少100个氨基酸残基的肽。在梭菌易位结构域的情况下,片段优选具有参考易位结构域(例如H
众所周知,细菌毒素分子的某些结构域能够形成此类孔。还已知病毒表达的膜融合蛋白的某些易位结构域能够形成此类孔。此类结构域可以在本发明中使用。
其他实例包括白喉毒素的易位结构域、假单胞菌外毒素A型的易位结构域、炭疽毒素的易位结构域、流感病毒血凝素、Semliki森林病毒融合蛋白、水泡性口腔炎病毒糖蛋白G、SER病毒F蛋白和泡沫病毒包膜糖蛋白。
在本发明的背景中,包含易位结构域的多种梭菌毒素H
有关肉毒梭菌和破伤风梭菌产生毒素的遗传基础的更多详细信息,请参阅TheClostridia:Molecular Biology and Pathogenesis,Academic press中的Henderson等(1997)。术语H
备选地,易位结构域可以是非梭菌来源的。非梭菌(参考)易位结构域来源的实例包括但不限于白喉毒素的易位结构域[O’Keefe等,Proc.Natl.Acad.Sci.USA(1992)89,6202-6206;Silverman等,J.Biol.Chem.(1993)269,22524-22532;和London,E.(1992)Biochem.Biophys.Acta.,1112,pp.25-51]、假单胞菌外毒素A型的易位结构域[Prior等,Biochemistry(1992)31,3555-3559]、炭疽毒素的易位结构域[Blanke等,Proc.Natl.Acad.Sci.USA(1996)93,8437-8442]、多种具有易位功能的融合或疏水性肽[Plank等,J.Biol.Chem.(1994)269,12918-12924;和Wagner等,(1992)PNAS,89,pp.7934-7938]及两亲性肽[Murata等,(1992)Biochem.,31,1986-1992页]。易位结构域可以反映天然存在的蛋白质中存在的易位结构域,或者可以包括氨基酸变异,只要该变异不破坏易位结构域的易位能力。
适用于本发明的病毒(参考)易位结构域的具体实例包括病毒表达的膜融合蛋白的某些易位结构域。例如Wagner等,(1992)和Murata等,(1992)描述了源自流感病毒血凝素N端区域的许多融合和两亲性肽的易位(即膜融合和囊泡化)功能。已知具有目的易位活性的其他病毒表达的膜融合蛋白是Semliki森林病毒(SFV)融合肽的易位结构域、水泡性口炎病毒(VSV)糖蛋白G的易位结构域、SER病毒F蛋白的易位结构域和泡沫病毒包膜糖蛋白的易位结构域。病毒编码的Aspike蛋白在本发明的背景中具有特定的应用,例如SFV的E1蛋白和VSV的G蛋白。
(参考)易位结构域的用途包括其序列变体的用途。变体可以包含一个或多个保守核酸取代和/或核酸缺失或插入,条件是该变体具有必需的易位功能。变体还可以包含一个或多个氨基酸取代和/或氨基酸缺失或插入,只要该变体具有必需的易位功能。
本发明的多肽可以进一步包含易位促进结构域。所述结构域促进非细胞毒性蛋白酶递送进入靶细胞的细胞质中,并且例如在WO 08/008803和WO 08/008805中进行了描述,在此引入作为参考。
作为实例,适宜的易位促进结构域包括包膜病毒融合肽结构域,例如,适宜的融合肽结构域包括流感病毒融合肽结构域(例如23个氨基酸的甲型流感病毒融合肽结构域)、甲病毒融合肽结构域(例如26个氨基酸的Semliki森林病毒融合肽结构域)、水泡病毒融合肽结构域(例如21个氨基酸的水泡性口炎病毒融合肽结构域)、呼吸道病毒融合肽结构域(例如25个氨基酸的仙台病毒融合肽结构域)、狂犬病病毒融合肽结构域(例如25个氨基酸的犬瘟热病毒融合肽结构域)、肺炎病毒融合肽结构域(例如25个氨基酸的新堡病病毒融合肽结构域)、肝炎病毒融合肽结构域(例如25个氨基酸的亨德拉病毒融合肽结构域)、间质肺炎病毒融合肽结构域(例如25个氨基酸的人间质肺炎病毒融合肽结构域)或泡沫病毒属(Spumavirus)融合肽结构域(如猿猴泡沫病毒融合肽结构域)、或其片段或变体。
作为另一实例,易位促进结构域可包含梭菌毒素H
肉毒A型神经毒素-氨基酸残基(872-1110)
肉毒B型神经毒素-氨基酸残基(859-1097)
肉毒C型神经毒素-氨基酸残基(867-1111)
肉毒D型神经毒素-氨基酸残基(863-1098)
肉毒E型神经毒素-氨基酸残基(846-1085)
肉毒F型神经毒素-氨基酸残基(865-1105)
肉毒G型神经毒素-氨基酸残基(864-1105)
破伤风神经毒素-氨基酸残基(880-1127)
以上序列位置可以根据血清型/亚型而有所不同,适宜的(参考)梭菌毒素H
肉毒A型神经毒素-氨基酸残基(874-1110)
肉毒B型神经毒素-氨基酸残基(861-1097)
肉毒C型神经毒素-氨基酸残基(869-1111)
肉毒D型神经毒素-氨基酸残基(865-1098)
肉毒E型神经毒素-氨基酸残基(848-1085)
肉毒F型神经毒素-氨基酸残基(867-1105)
肉毒G型神经毒素-氨基酸残基(866-1105)
破伤风神经毒素-氨基酸残基(882-1127)
任何上述促进结构域可与任何适用于本发明的前述易位结构域肽组合。因此,作为实例,非梭菌促进结构域可以与非梭菌易位结构域肽或与梭菌易位结构域肽组合。备选地,可将梭菌毒素H
肉毒A型神经毒素-氨基酸残基(449-1110)
肉毒B型神经毒素-氨基酸残基(442-1097)
肉毒C型神经毒素-氨基酸残基(450-1111)
肉毒D型神经毒素-氨基酸残基(446-1098)
肉毒E型神经毒素-氨基酸残基(423-1085)
肉毒F型神经毒素-氨基酸残基(440-1105)
肉毒G型神经毒素-氨基酸残基(447-1105)
破伤风神经毒素-氨基酸残基(458-1127)
作为实例,典型的靶向部分(参考)序列包括:
肉毒A型神经毒素-氨基酸残基(Y1111-L1296)
肉毒B型神经毒素-氨基酸残基(Y1098-E1291)
肉毒C型神经毒素-氨基酸残基(Y1112-E1291)
肉毒D型神经毒素-氨基酸残基(Y1099-E1276)
肉毒E型神经毒素-氨基酸残基(Y1086-K1252)
肉毒F型神经毒素-氨基酸残基(Y1106-E1274)
肉毒G型神经毒素-氨基酸残基(Y1106-E1297)
破伤风神经毒素-氨基酸残基(Y1128-D1315)。
可以以1-100U/kg患者的剂量、优选以10-50U/kg患者的剂量施用非细胞毒性蛋白酶。
例如,可以以选自5U/kg、10U/kg、20U/kg或40U/kg(优选40U/kg)的一种或多种剂量施用非细胞毒性蛋白酶。
在一个实施方案中,非细胞毒性蛋白酶在至少2个月的时期内、优选在至少3个月的时期内以单剂量施用形式施用。
序列同源性
可以使用多种序列比对方法中的任何一种来确定百分比同一性,包括但不限于全局方法、局部方法和混合方法,例如片段方法。确定百分比同一性的流程是本领域技术人员范围内的常规程序。全局方法从分子的开始到末端比对序列,并通过累加各个残基对的分值并施加空位罚分来确定最佳比对。非限制性方法包括例如CLUSTAL W,参见例如JulieD.Thompson等,CLUSTAL W:Improving the Sensitivity of Progressive MultipleSequence Alignment Through Sequence Weighting,Position-Specific Gap Penaltiesand Weight Matrix Choice,22(22)Nucleic Acids Research 4673-4680(1994);和迭代改进,参见例如Osamu Gotoh,Significant Improvement in Accuracy of MultipleProtein.Sequence Alignments by Iterative Refinement as Assessed by Referenceto Structural Alignments,264(4)J.MoI.Biol.823-838(1996)。局部方法通过鉴定所有输入序列共有的一个或多个保守基序来比对序列。非限制性方法包括例如Match-box,参见例如Eric Depiereux和Ernest Feytmans,Match-Box:A Fundamentally New Algorithmfor the Simultaneous Alignment of Several Protein Sequences,8(5)CABIOS 501-509(1992);Gibbs采样,参见例如C.E.Lawrence等,Detecting Subtle Sequence Signals:A Gibbs Sampling Strategy for Multiple Alignment,262(5131)Science 208-214(1993);Align-M,参见例如Ivo Van WaIIe等,Align-M-A New Algorithm for MultipleAlignment of Highly Divergent Sequences,20(9)Bioinformatics:1428-1435(2004)。
因此,通过常规方法确定百分比序列同一性。参见例如Altschul等,Bull.Math.Bio.48:603-16,1986及Henikoff和Henikoff,Proc.Natl.Acad.Sci.USA89:10915-19,1992。简言之,使用空位开放罚分10、空位延伸罚分1及Henikoff和Henikoff(出处同上)的“blosum 62”评分矩阵对两个氨基酸序列进行比对,以优化比对分值,如下文所示(氨基酸表示为标准单字母代码)。
两个或多个核酸或氨基酸序列之间的“百分比序列同一性”是所述序列共有的相同位置数的函数。因此,%同一性可以用相同核苷酸/氨基酸的数目除以核苷酸/氨基酸的总数乘以100来计算。%序列同一性的计算也可以考虑需要引入以优化两个或多个序列的比对的缺口的数目和每个缺口的长度。可以使用本领域技术人员熟悉的特定数学算法(如BLAST)进行两个或多个序列之间的序列比较和百分比同一性的确定。
基本上同源的多肽的特征在于具有一个或多个氨基酸取代、缺失或添加。这些改变优选具有次要性质,其为保守氨基酸取代(见下文)和其他不显著影响多肽的折叠或活性的取代;小的缺失,通常缺失1至约30个氨基酸;小的氨基或羧基端延伸,如氨基端甲硫氨酸残基,多达约20-25个残基的小接头肽或亲和标签。
保守氨基酸取代
碱性氨基酸 精氨酸
赖氨酸
组氨酸
酸性氨基酸 谷氨酸
天冬氨酸
极性氨基酸 谷氨酰胺
天冬酰胺
疏水性氨基酸 亮氨酸
异亮氨酸
缬氨酸
芳香族氨基酸 苯丙氨酸
色氨酸
酪氨酸
小氨基酸 甘氨酸
丙氨酸
丝氨酸
苏氨酸
甲硫氨酸
除20种标准氨基酸外,非标准氨基酸(如4-羟基脯氨酸、6-N-甲基赖氨酸、2-氨基异丁酸、异缬氨酸和α-甲基丝氨酸)可以取代本发明的多肽的氨基酸残基。有限数量的非保守氨基酸、不是由遗传密码编码的氨基酸和非天然氨基酸可以取代多肽氨基酸残基。本发明的多肽还可以包含非天然存在的氨基酸残基。
有限数量的非保守氨基酸、不是由遗传密码编码的氨基酸、非天然存在的氨基酸和非天然氨基酸可以取代本发明的多肽的氨基酸残基。
可以按照本领域已知的方法,如定点诱变或丙氨酸扫描诱变(Cunningham和Wells,Science 244:1081-5,1989),鉴定本发明多肽中的必需氨基酸。生物相互作用的位点也可以通过结构的物理分析来确定,如通过诸如核磁共振、晶体学、电子衍射或光亲和标记之类的技术结合推定的接触位点氨基酸的突变来确定。参见例如de Vos等,Science255:306-12,1992;Smith等,J.Mol.Biol.224:899-904,1992;Wlodaver等,FEBS Lett.309:59-64,1992。还可以从与本发明的多肽的相关组分(例如易位或蛋白酶组分)的同源性分析推断出必需氨基酸的身份。
可以使用已知的诱变和筛选方法产生并测试多种氨基酸取代,如Reidhaar-Olson和Sauer(Science 241:53-7,1988)或Bowie和Sauer(Proc.Natl.Acad.Sci.USA 86:2152-6,1989)所公开的那些。简言之,这些作者公开了同时使多肽中的两个或多个位置随机化、选择功能性多肽、然后对诱变的多肽进行测序以确定每个位置上可允许的取代的范围的方法。可以使用的其他方法包括噬菌体展示(例如Lowman等,Biochem.30:10832-7,1991;Ladner等,美国专利号5,223,409;Huse,WIPO公开WO 92/06204)和区域定向诱变(Derbyshire等,Gene46:145,1986;Ner等,DNA7:127,1988)。
除非另有定义,否则本文使用的所有技术和科学术语具有与本公开所属领域的普通技术人员的通常理解相同的含义。Singleton等,DICTIONARY OF MICROBIOLOGY ANDMOLECULAR BIOLOGY,第20版,John Wiley and Sons,New York(1994)和Hale&Marham,THEHARPER COLLINS DICTIONARY OF BIOLOGY,Harper Perennial,NY(1991)为技术人员提供了本公开中所用的许多术语的通用词典。
本公开不受限于本文中公开的示例性方法和材料,与本文中描述的那些方法或材料类似或等同的任何方法和材料都可以用于实施或测试本公开的实施方案。数字范围包括定义该范围的数字。除非另有说明,否则任何核酸序列均以5'至3'方向从左至右书写;氨基酸序列以氨基至羧基方向从左至右书写。
本文中提供的标题不是本公开的多个方面或实施方案的限制。
氨基酸在本文中使用氨基酸名称、三字母缩写或单字母缩写来指代。本文所用的术语“蛋白质”包括蛋白质、多肽和肽。本文所用的术语“氨基酸序列”与术语“多肽”和/或术语“蛋白质”同义。在一些情况下,术语“氨基酸序列”与术语“肽”同义。在一些情况下,术语“氨基酸序列”与术语“酶”同义。术语“蛋白质”和“多肽”在本文中可互换使用。在本公开和权利要求书中,可以使用氨基酸残基的常规单字母和三字母代码。氨基酸的三字母代码根据IUPACIUB生化命名联合委员会(JCBN)定义。还应理解,由于遗传密码的简并性,多肽可以由一个以上的核苷酸序列编码。
术语的其他定义可在整个说明书中出现。在更详细地描述示例性实施方案之前,应当理解,本公开不限于所描述的具体实施方案,因为这些实施方案可以变化。还应理解,本文中使用的术语仅出于描述具体实施方案的目的,而无意于限制,因为本公开内容的范围仅由所附权利要求书限定。
在提供值的范围时,应理解为也明确公开了该范围的上限和下限之间的每个中间值(除非文中另有明确说明,否则直到下限的单位的十分之一)。所述范围内的任何所述值或中间值之间的每个较小范围和所述范围内的任何其他所述值或中间值也包括在本公开之内。这些较小范围的上限和下限可以独立地包括在该范围之内或排除该范围之外,并且其中两个限值之一、两个限值中没有一个或两个限值都包含在该较小范围内的每个范围也包括在本公开之内,服从于所述范围内任何明确排除的限值。在所述范围包括一个或两个限值的情况下,排除所包括的那些限值中的任一个或两个的范围也包括在本公开中。
必须注意的是,除非文中另有明确说明,本文和所附权利要求书中所使用的单数形式“一个”、“一种”和“该”包括复数指示物。因此,例如,提到“毒素”包括多个这类毒素,提到“该毒素”包括提到本领域技术人员已知的一种或多种毒素及其等同物,等等。
本文讨论的出版物仅为了其在本申请的提交日期之前的公开内容而提供。本文中的任何内容均不应解释为承认此类出版物构成了所附权利要求的现有技术。
附图简述
现将参考以下附图和实施例仅以实例的方式描述本发明的实施方案。
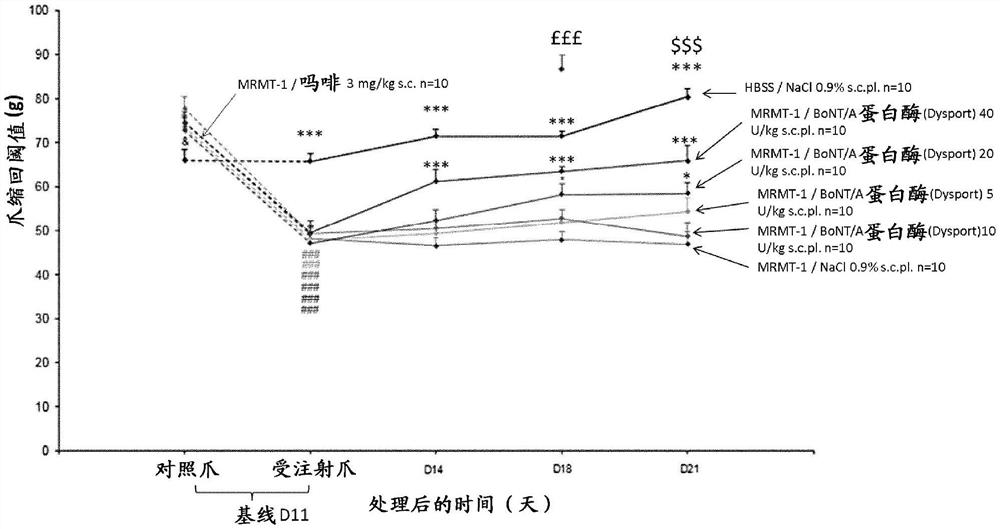
图1显示了BoNT/A蛋白酶(
图2和图3显示了比较研究,显示了在MRMT-1诱发的骨癌疼痛大鼠模型中评估的单次施用吗啡的效果。
图4显示非细胞毒性蛋白酶中毒的过程可以描述为包括四个步骤:1)非细胞毒性蛋白酶通过结合结构域(例如,通过梭菌神经毒素的HC或等同的靶向部分)结合至存在于细胞表面的结合位点;2)结合位点(加上结合的非细胞毒性蛋白酶)内化到细胞中;3)非细胞毒性蛋白酶实现(例如通过梭菌神经毒素的HN或等同的易位结构域)从内体释放到细胞质中(即易位事件);4)然后释放的非细胞毒性蛋白酶(例如,梭菌神经毒素的L链或等同的SNARE切割蛋白酶)能够作用于其细胞内(SNARE蛋白)靶标。
实施例
现将参考以下实施例仅通过举例的方式描述本发明。
材料和方法
大鼠骨癌疼痛的MRMT-1乳腺癌细胞模型(Medhurst S.J.等,“A rat model ofbone cancer”,Pain,2002:pp.129-140)是用于癌症疼痛的药物测试的良好表征的动物模型。此模型是广泛接受的模型,因为它模拟了与临床前疼痛研究相适应的一段时间内发病机制和病理学方面。
动物和圈养条件
选择了六十(60)只在手术期间重175-200g的雄性Sprague-Dawley大鼠(SPF状态,Janvier,法国)进行这些研究。
将大鼠圈养在温度(20-24℃)和相对湿度(45%-65%)受控的房间内,使其适应12小时光照(上午6:30至下午6:30)/12小时黑暗的人工昼/夜循环。大鼠可自由获取自来水,并可随意取食颗粒状的完全饮食。每笼圈养4只动物(E型笼),并在进行任何测试之前适应至少5天。每只大鼠通过尾部标记识别。
试剂
表1中列出了所使用的非细胞毒性蛋白酶(BoNT/A
表1
下表2中列出了参考物质(吗啡)的详细信息。
表2
下表3中列出了所用溶媒(例如,用于仅使用溶媒的对照实验)的详细信息。
表3
利用0-9%NaCl作为非细胞毒性蛋白酶和作为吗啡溶液的溶媒。
下表4中列出了MRMT-1细胞和HBSS的详细信息。
表4
主要设备和数据处理系统
在疼痛测试(例如,评估触觉性异常性疼痛)中利用了电子von Frey(EVF3型号,Bioseb,法国)。
使用以下工具进行了分析(例如统计分析):
·SigmaStat软件3.5版(SPSS科学软件,埃尔克拉特,德国)。
·Lab X直接软件2.4版(梅特勒-托利多,法国)。
·Dragon Naturally Speaking软件13.0版(Nuance,法国)。
疼痛测试
使用电子Von Frey测试评估触觉性异常性疼痛。此测试需要在后爪的足底部位(plantar aspect)施加递增的压力。对一只后爪因注射而发炎或受伤、另一只后爪正常的动物利用该测试,以评价药物的镇痛作用。该装置施加稳定递增的力,并且将反应阈值确定为引起爪缩回所需的压力(g)。对于两个后爪,每个反应阈值测量均重复3次,间隔约2-3分钟。
实验设计
使用了10只大鼠的六(6)组。
第1组:HBSS,胫骨内,溶液
+0.9%NaCl,
足底内,溶液
第2组:含30,000个MRMT-1细胞的HBSS,胫骨内,溶液
+0.9%NaCl,足底内,溶液
第3组:含30,000个MRMT-1细胞的HBSS,胫骨内,溶液
+在0.9%NaCl中的BoNT/A(Dysport 5U/kg),足底内,溶液
第4组:含30,000个MRMT-1细胞的HBSS,胫骨内,溶液
+在0.9%NaCl中的BoNT/A(Dysport 10U/kg),足底内,溶液
第5组:含30,000个MRMT-1细胞的HBSS,胫骨内,溶液
+在0.9%NaCl中的BoNT/A(Dysport 20U/kg),足底内,溶液
第6组:含30,000个MRMT-1细胞的HBSS,胫骨内,溶液
+在0.9%NaCl中的BoNT/A(Dysport 40U/kg),足底内,溶液
第7组:含30,000个MRMT-1细胞的HBSS,胫骨内,溶液
+吗啡HCl,3mg/kg于0.9%NaCl中,皮下,溶液
剂量以游离活性物质表示。
用30G针头以70μl/kg下的体积在受损的后足中通过足底途径施用溶媒和BoNT/A蛋白酶(Dysport)。
吗啡按5ml/kg皮下施用。
手术流程
在D0通过将30,000MRMT-1乳腺癌细胞植入麻醉大鼠(赛拉嗪10mg/kg腹腔内,氯胺酮60mg/kg腹腔内)的胫骨髓腔来诱发骨癌疼痛。
在左胫骨接近一半上方的皮肤上产生一个1厘米的罗氏尾状切口,以使骨骼暴露,而对周围的肌肉或血管的损伤最小。使用21号针头刺骨骼,并插入连接至汉密尔顿注射器的细导管,使其到达胫骨的髓内管。然后轻柔地注入10μl细胞悬液(癌症组)或HBSS(假组)。使用骨蜡和手术胶封闭注射部位,用0.9%NaCl彻底清洗,并用手术缝合线缝合伤口。
行为测试
癌细胞植入后11天(D11),对所有组测量两只后爪的爪缩回阈值(基线)。
第1组至第6组的大鼠通过用30G针头在气体麻醉下(3.5%异氟烷/3L/分钟)足底内注射入受伤的左爪来接受溶媒或BoNT/A蛋白酶
在D14和D21皮下施用吗啡。
实验结束时,通过吸入CO
体重
从手术至D10的每天(除星期六和星期日外)和每个实验日、测试前,对大鼠称重。
数据呈现和统计分析
结果表示为(对于每只动物):
■爪缩回阈值,其定义为施加在每个后爪上的以克(g)表示的压力并计算为每个后爪三个连续测量值的平均值的。
对于每个处理组,
■爪缩回阈值计算为动物的平均值的(平均值±s.e.m.)
■从溶媒处理组的平均值计算爪子退缩阈值的变化百分比。
为了确定测试物质和参考物质的统计效应,取决于结果的正态分布,通过参数或非参数检验分析数据。显著性水平设定为p<0.05。
溶解冻干物
调节所用批次的小瓶中装量500U的冻干物形式的BoNT/A蛋白酶
用适当体积的0.9%NaCl溶解冻干物,以获得500U/ml的母液:
-用带25G或26G针头的注射器穿过中隔,并注入1ml,避免气泡。
-快速取出带针头的注射器,以避免真空抽吸。
-毒素溶解后,可能打开小瓶,用自动移液器精确地添加或不添加体积,以获得500U/ml的溶液。
将此溶液用作母液,并在24小时内保存于+4℃。
稀释
用于稀释的容器是玻璃,并避免系列稀释。
在每个测试日结束时,用次氯酸钠的0.5%氯活性溶液灭活剩余的BoNT/A
为了使体积大约为20μl/大鼠,按以下浓度制备以下溶液。类似地配制其他溶液:
表5
实施例1
BoNT/A蛋白酶(
在MRMT-1诱发的骨癌疼痛大鼠模型中评估了单次足底内施用BoNT/A蛋白酶
实施例2
吗啡比较研究
在比较研究中,在相同的MRMT-1诱发的骨癌疼痛大鼠模型中评估了单次施用吗啡的效果。在癌细胞植入后,在D14(见图2)或D21(见图3)施用吗啡。结果表明爪缩回阈值差值逆转,从而表明骨癌引起的异常性疼痛减少。
这些结果与实施例1中所示的非细胞毒性蛋白酶(BoNT/A)获得的结果相辅相成,表明可以将镇痛剂分子(例如阿片剂,如吗啡)与非细胞毒性蛋白酶共同施用,以提供骨诱导的异常性疼痛的协同抑制。
实施例3
大鼠体重比较研究
在与实施例1相比的研究中监测了相应的大鼠体重,尽管采用了略有不同的BoNT/A蛋白酶
表6
体重(g)
结果表示为平均值±s.e.m
- 抑制骨癌引起的异常性疼痛
- 用于预防和/或治疗化疗引起的神经性疼痛的GPR132抑制剂
