治疗特征在于纺锤体和着丝粒相关复合物亚基3(SKA3)基因的高表达水平的癌症的方法
文献发布时间:2023-06-19 09:47:53
本申请要求于2018年5月23日提交的美国临时专利申请第62/675,228号的优先权。上述申请的全部教导通过引用并入本文。
酪氨酸苏氨酸激酶(TTK),也称为单极纺锤体1(MPS1),是纺锤体组装检查点(SAC)的关键调节子,其功能是维持基因组完整性。TTK是保守的多特异性激酶,当其在大肠杆菌中表达时能够将丝氨酸、苏氨酸和酪氨酸残基磷酸化(Mills等,J.Biol.Chem.1992 22(5):16000-16006)。TTK mRNA在人体中大多数生理正常组织中不表达(同上)。TTK mRNA在一些快速增殖的组织(例如,睾丸和胸腺)以及在某些肿瘤中表达。例如,TTK mRNA在肾细胞癌中不表达,但在50%的乳腺癌样品中、在睾丸肿瘤和卵巢癌样品中表达。参见,同上。相对于正常对应物,TTK在一些癌细胞系和肿瘤中表达(同上;也参见WO 02/068444A1)。TTK已成为包括三阴性乳腺癌(TNBC)在内的人类癌症的有希望的治疗靶标。几种TTK抑制剂(TTKi)正在临床试验中进行评估,并且对介导TTKi敏感性和抗性的机制的了解可能会为此类药物的成功开发提供信息。
靶向癌症治疗剂的开发强化了鉴定具有预测患者对特定靶向疗法的反应的潜力,从而使医生能够定制针对每一个患者特异性的治疗方案的生物标志物的兴趣。本文公开了特别适合于用TTK抑制剂治疗的患者群体。
部分地基于表达较高水平的SKA3的癌细胞系对TTK抑制的反应更高和发现(见图2-4),本文提供了选择可能对TTK抑制治疗有反应的患者(即表达较高水平的SKA3的那些患者),和然后用一种或多种TTK抑制剂治疗所述患者的方法。因此,一个方面,本公开提供了一种治疗患有以SKA3的高表达水平为特征的癌症的患者的方法。
本教导提供了用于治疗患有以SKA3基因的高表达水平为特征的癌症的患者的方法,该方法包括向患者施用治疗有效量的TTK抑制剂。
本教导还提供了识别可能对TTK抑制剂有反应的患者的方法。该方法包括提供来自癌症患者的样品;确定样品中的SKA3基因表达水平;和如果患者的癌症表现出高的SKA3表达水平,则向其施用治疗有效量的TTK抑制剂。
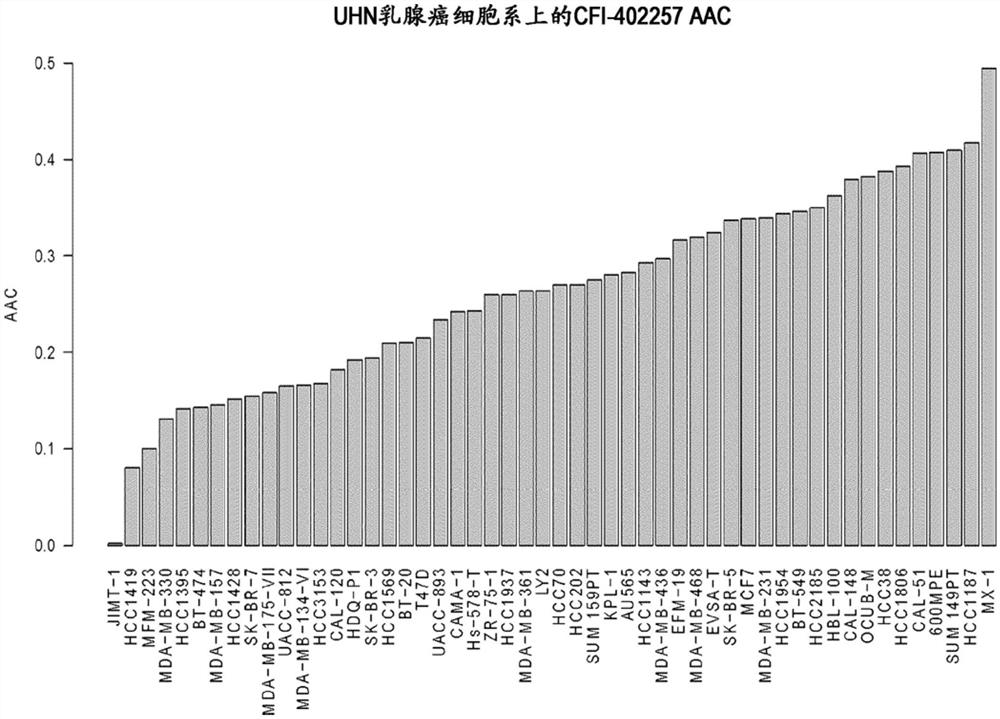
图1示出了在52个乳腺癌细胞系的组(panel)中CFI-402257的药物剂量-反应曲线(AAC)上面积的分布。
图2是代表基因和药物敏感性(AAC)之间所有单变量相关性的强度(估计值)和显著性(-log10(p-值))的火山图。
图3示出了关于乳腺癌细胞系的分子亚型在SKA3表达与化合物CFI-402257敏感性(通过AAC测量的)之间的相关性。
图4是箱形图,其显示了表达高于中值表达的SKA3 mRNA的细胞系(SKA3高;蓝色框),和表达低于或等于中值表达的SKA3 mRNA的细胞系(SKA3低;红色框)的药物敏感性(药物剂量-反应曲线[AAC]上方的面积)的分布。CI:一致性指数;P值:一致性指数的统计学显著性。它显示了表达小于或大于中值表达的SKA3的细胞系显著不同的药物敏感性。
图5是小提琴图,其显示了各种TCGA肿瘤类型和乳腺肿瘤分子亚型上SKA3表达水平的分布和概率密度。仅包含500或更多患者的肿瘤类型。
图6是显示743名乳腺癌患者(除Luminal A外的所有亚型,因为其未出现在BC细胞系的组中)的SKA3表达值(log2(TPM+0.001);TPM用Kallisto估计)的图。表达阈值确定为这一大组肿瘤的中位值(前50%)。黑色垂直箭头表示具有高SKA3表达的肿瘤的实例。
具体实施方式
纺锤体和着丝粒相关(SKA)蛋白复合物是异三聚体复合物(SKA1、SKA2、SKA3),其在核被膜破裂后积聚在纺锤体微管上和着丝粒处,在中期时变为最多富集在着丝粒上。体外研究表明Ska1以及可能Ska3上的结构域与微管结合(Welburn等,Dev Cell 2009(16),374–385;Jeyaprakash等,Mol Cell 2012(46),274–286;Schmidt等,Dev Cell 2012(23),968–980)。纺锤体和着丝粒相关亚基3(SKA3)是编码纺锤体和着丝粒相关蛋白复合物的成分的基因,其在有丝分裂过程中调节微管附着于着丝粒。编码的蛋白质定位于外部的着丝粒,并可能是正常染色体分离和细胞分裂所必需的。
一个方面,在用治疗有效量的TTK抑制剂治疗之前,癌症确定为表现出高的SKA3表达水平。该确定可以通过常规的诊断方法来进行,该方法从患者获得癌细胞。这些方法包括但不限于活检、血液检查和其他诊断方法,其获得癌细胞样品,例如组织样品、循环肿瘤细胞或癌症特征性的生物分子,例如循环核酸。然后确定癌细胞中的SKA3表达水平。通过本领域已知的方法来确定癌症是否表现出高SKA3表达水平,例如,通过RNA测序(RNA-Seq)、微阵列、定量PCR或NanoString
在另一方面,本发明是一种治疗患有癌症的患者的方法,其包括提供来自癌症患者的癌细胞;确定癌细胞中的SKA3表达水平(见图4-5);和如果患者的癌症(癌细胞)表现出高SKA3表达水平,则向患者施用治疗有效量的TTK抑制剂。在一个实施方式中,该方法进一步包括如果患者的癌症(癌细胞)未表现出高SKA3表达水平,则排除向患者施用TTK抑制剂。本发明中使用的癌细胞可以从(但不限于)组织、血液(包含血液成分)、淋巴液、痰、粪便、尿液、支气管灌洗液或其他体液的样品中获得。
在另一方面,本文提供了选择可能对TTK抑制剂的治疗有反应的患者的方法,所述方法包括确定患者的癌症的SKA3表达水平,其中如果癌症的SKA3表达水平高,则所述患者可能对治疗有反应。
在另一方面,本文提供了一种治疗患有癌症的患者的方法,该方法包括:确定癌症的SKA3表达水平,并且如果癌症的SKA3表达水平高,则施用治疗有效量的TTK抑制剂,和如果患者的癌症未表现出高SKA3表达水平,则使用TTK抑制剂以外的抗癌疗法来治疗患者。
在一个方面,SKA3的高表达水平通过落入来自随机患者群体中相同癌症类型癌细胞的SKA3表达水平的前50%之内的表达水平表征。可以从适合于确定SKA3表达水平的方法获得SKA3表达水平,例如从RNA测序得到的表达水平,如标准化的阅读计数和TPM(每百万转录本(Transcripts Per Million)),或者从对于SKA3的严格标准化(分位数2.5%和97.5%分别设置为-1和+1)的RT-PCR测量得到的标准化循环阈值(Ct)水平。
如本文所用,“高表达”是指落在所述表达水平的前5%、10%、15%、20%、25%、30%、40%、45%或50%内的表达水平。例如,“前50%”可以通过收集来自具有相同癌症的随机受试者群体(例如,至少25个受试者、至少50个受试者、至少100个受试者、至少500个受试者、至少1000个受试者等)的癌细胞(例如,来自组织样品)的SKA3表达水平,然后评估新受试者的表达水平是否在前50%百分位数内来获得。表达水平可以是,例如SKA3的水平,其可以在材料和方法部分中如在实施例1中所描述的来确定。
可选地,“高表达”是指,与参考水平相比,如通过本文所述的方法测定的,患者癌症中的SKA3水平高于定义的参考水平25%、30%、40%、50%、60%、70%、80%、85%、90%、95%、100%、150%、200%、250%或更高。
“参考水平”是指在没有癌症的健康个体群体中获得的与癌症相同细胞类型的细胞中确定的平均SKA3表达水平。在可选的方面,可以在从患者获得的与癌症相同细胞类型的非癌细胞中确定参考水平。
在一个方面,可以通过确定平均标准化SKA3表达[其可以从适合于确定SKA3表达水平的方法获得,例如,从RNA测序得到的表达水平,如标准化的阅读计数和TPM(每百万转录本),或者从用于SKA3严格的标准化(分位数2.5%和97.5%分别设置为-1和+1)的RT-PCR测量的标准化循环阈值(Ct)水平]而获得参考水平。
在一个方面,TTK抑制剂之外的抗癌疗法包括但不限于外科手术、放射疗法、免疫疗法、内分泌疗法、基因疗法和施用TTK抑制剂外的抗癌剂。在另一方面,TTK抑制剂之外的抗癌疗法包括但不限于外科手术、放射疗法、免疫疗法、内分泌疗法、基因疗法和表观遗传疗法,包括施用TTK抑制剂之外的药剂。
免疫疗法(也称为生物反应调节剂疗法、生物疗法、生物制剂疗法、免疫治疗或生物学治疗)是利用免疫系统的一部分抵抗疾病的治疗。免疫疗法可以帮助免疫系统识别癌细胞,或增强对抗癌细胞的反应。免疫疗法包括主动和被动免疫疗法。主动免疫疗法刺激人体自身的免疫系统,而被动免疫疗法通常会使用在体外产生的免疫系统成分。主动免疫疗法的实例包括但不限于疫苗,其包括癌症疫苗、肿瘤细胞疫苗(自体或同种异体)、树突状细胞疫苗、抗原疫苗、抗独特型疫苗、DNA疫苗、病毒疫苗或具有白介素2(IL-2)的肿瘤浸润淋巴细胞(TIL)疫苗或者淋巴因子激活的杀伤(LAK)细胞疗法。此外,被称为免疫检查点抑制剂的免疫疗法药物设计为解除患者自身免疫系统细胞攻击肿瘤细胞的束缚。实例包括药物纳武单抗(Opdivo)和派姆单抗(Keytruda),它们是识别PD-1抗原的单克隆抗体,已获准用于治疗晚期经典霍奇金淋巴瘤;阿特珠单抗(Tecentriq),一种针对蛋白质程序性细胞死亡配体1(PD-L1)的完全人源化单克隆抗体,已获准用于膀胱癌治疗;和伊匹单抗(Yervoy)其是一种通过靶向CTLA-4蛋白激活免疫系统的单克隆抗体。
被动免疫疗法的实例包括但不限于单克隆抗体和包含毒素的靶向疗法。单克隆抗体包括裸抗体和缀合的单克隆抗体(也称为加标记的、标记的或负载的抗体)。裸单克隆抗体不具有附连的药物或放射性物质,而缀合的单克隆抗体与例如,化疗药物(化学标记的)、放射性颗粒(放射性标记的)或毒素(免疫毒素)接合。这些裸单克隆抗体药物的实例包括但不限于,利妥昔单抗(Rituxan),它是抗CD20抗原的抗体,用于治疗例如,B细胞非霍奇金淋巴瘤;曲妥珠单抗(Herceptin),一种抗HER2蛋白的抗体,用于治疗例如,晚期乳腺癌;阿仑单抗(Campath),一种抗CD52抗原的抗体,用于治疗例如,B细胞慢性淋巴细胞性白血病(B-CLL);西妥昔单抗(Erbitux),一种抗EGFR蛋白的抗体,用于例如,与依立替康联合治疗例如,晚期结肠直肠癌和头颈癌;及贝伐单抗(Avastin),其是一种抗血管生成的治疗,作用于VEGF蛋白并与例如,化学疗法联合用于治疗例如,转移性结肠直肠癌。缀合的单克隆抗体的实例包括但不限于,放射性标记的抗体替伊莫单抗(Ibritumomab tiuxetan,Zevalin),一种针对CD20抗原的单克隆抗体,其直接向癌性B淋巴细胞传递放射性,并用于治疗例如,B细胞非霍奇金淋巴瘤;放射性标记的抗体托西莫单抗(Bexxar),另一种识别CD20抗原的单克隆抗体,用于治疗例如,某些类型的非霍奇金淋巴瘤;和免疫毒素Gemtuzumab ozogamicin(Mylotarg),一种与细胞毒素剂加利车霉素连接的CD33的单克隆抗体,可用于治疗例如,急性骨髓性白血病(AML)。BL22是用于治疗例如,毛细胞白血病的缀合单克隆抗体,用于治疗例如白血病、淋巴瘤和脑肿瘤的免疫毒素以及放射性标记的抗体。
涉及基因疗法的被动免疫疗法的另一个实例包括CAR(嵌合抗原受体)T细胞疗法,该疗法涉及对患者自身的T细胞进行遗传修饰以靶向并增强其抗癌能力。FDA批准的CAR-T疗法包括axicabtagene ciloleucel(Yescarta),其靶向CD19抗原并被批准用于治疗弥漫性大B细胞淋巴瘤;以及tisagenlecleucel(Kymriah),用于治疗复发/难治性B细胞前体急性淋巴母细胞白血病。
一个方面,可以在本教导中使用的免疫疗法包括佐剂免疫疗法。实例包括细胞因子,例如粒细胞-巨噬细胞集落刺激因子(GM-CSF)、粒细胞-集落刺激因子(G-CSF)、巨噬细胞炎性蛋白(MIP)-1-α、白介素(包括IL-1、IL-2、IL-4、IL-6、IL-7、IL-12、IL-15、IL-18、IL-21和IL-27)、肿瘤坏死因子(包括TNF-α)和干扰素(包括IFN-α、IFN-β和IFN-γ);以及它们的组合,例如,如白介素(例如IL-2)与其他细胞因子(例如IFN-α)的组合。
内分泌疗法是增加、阻断或去除激素的治疗。例如,可以阻断雌激素产生或活性的化学治疗剂已经用于治疗乳腺癌。另外,免疫系统的激素刺激已用于治疗特定的癌症,例如,肾细胞癌和黑色素瘤。在一个实施方式中,内分泌疗法包括施用天然激素、合成激素或其他合成分子,它们可以阻断或增加人体的天然激素的产生或活性。在另一个实施方式中,内分泌疗法包括去除产生某种激素的腺体。
基因疗法是将基因插入受试者的细胞和生物组织中以治疗疾病,例如癌症。示例性基因疗法包括但不限于种系基因疗法和体细胞基因疗法,包括患者来源的免疫T细胞的遗传修饰,称为CAR-T细胞疗法。
在一个方面,除TTK抑制剂外的癌症疗法是其他抗癌剂。“抗癌剂”是当以有效量向患有癌症的受试者施用时,其可以部分或基本上实现以下一种或多种的化合物:阻止癌症的生长、减轻癌症的程度(例如,减少肿瘤的大小)、抑制癌症的生长速度和缓解或改善与癌症相关的临床症状或指标(例如组织或血清成分)或延长受试者的寿命。
适用于本文所述方法的抗癌剂包括已被批准用于治疗癌症的抗癌剂。在一个方面,抗癌剂包括但不限于靶向抗体、免疫检查点抑制剂、血管生成抑制剂、表观遗传剂、烷化剂、抗代谢物、长春花生物碱、紫杉烷、鬼臼毒素、拓扑异构酶抑制剂、激素类抗肿瘤药和其他抗肿瘤药。
可用于本教导的方法的烷化剂的实例包括但不限于,氮芥(例如,甲基氯乙胺、环磷酰胺、苯丁酸氮芥、美法仑等)、乙烯亚胺和甲基三聚氰胺(例如,六甲基三聚氰胺、三胺硫磷)、烷基磺酸酯(例如,白消安)、亚硝基脲类(例如,卡氮芥、洛莫司丁(lomusitne)、赛氮芥、链脲菌素等)或三氮烯(鸨烯咪胺等)。在本教导的方法中有用的抗代谢物的实例包括但不限于,叶酸类似物(例如,甲氨蝶呤)或嘧啶类似物(例如,氟尿嘧啶、氟尿苷(floxouridine)、阿糖胞苷)、嘌呤类似物(例如,巯基嘌呤、硫代鸟嘌呤、喷司他丁)。植物生物碱和萜类化合物或其衍生物的实例包括但不限于,长春花生物碱(例如,长春新碱、长春碱、长春瑞滨、长春地辛),鬼臼毒素和紫杉烷类(例如,紫杉醇、多西他赛)。拓扑异构酶抑制剂的实例包括但不限于,伊立替康、托泊替康、安吖啶、依托泊苷、依托泊苷磷酸酯和替尼泊苷。抗肿瘤剂的实例包括但不限于,放线菌素、蒽环类药物(例如,阿霉素、柔红霉素、戊柔比星、伊达比星、表柔比星)、博来霉素、普卡霉素和丝裂霉素。
在一个方面,可以在本教导中使用的抗癌剂包括阿霉素、放线菌素、博来霉素、长春花碱、顺铂、阿西维辛;阿柔比星;盐酸阿考达唑;阿克罗宁;阿多来新;阿地白介素;六甲蜜胺;安波霉素;醋酸阿米蒽醌;氨鲁米特;安吖啶;阿那曲唑;氨茴霉素;天冬酰胺酶;曲林菌素(asperlin);阿扎胞苷;阿扎替派(azetepa);阿佐霉素;巴马司他;苯佐替派;比卡鲁胺;盐酸比生群;二甲磺酸双奈法德(bisnafide dimesylate);比折来新;硫酸博来霉素;布喹那钠;溴匹立明;白消安;放线菌素C;卡鲁睾酮;卡醋胺;卡贝替姆;卡铂;卡莫司汀;盐酸卡柔比星;卡折来新;西地芬戈;苯丁酸氮芥;西罗霉素;克拉屈滨;crisnatol mesylate;环磷酰胺;阿糖胞苷;氮烯唑胺;盐酸柔红霉素;地西他滨;右奥马铂;地扎胍宁;甲磺酸地扎胍宁;地吖醌;多柔比星;盐酸多柔比星;屈洛昔芬;柠檬酸屈洛昔芬;丙酸屈他雄酮;达佐霉素;依达曲沙;盐酸依氟鸟氨酸;依沙芦星;恩洛铂;恩普氨酯;依匹哌啶(epipropidine);盐酸表柔比星;厄布洛唑;盐酸依索比星;雌莫司汀;磷雌氮芥;依他硝唑;依托泊苷;磷酸依托泊苷;艾托卜宁;盐酸法倔唑;法扎拉滨;芬维A胺;氟尿苷;磷酸氟达拉滨;氟尿嘧啶;氟西他滨;磷喹酮;福司曲星钠;吉西他滨;盐酸吉西他滨;羟基脲;盐酸伊达比星;异环磷酰胺;伊莫福新;白介素II(包括重组白介素II或rIL2)、干扰素α-2a;干扰素α-2b;干扰素α-n1;干扰素α-n3;干扰素β-Ia;干扰素γ-Ib;异丙铂;盐酸依立替康;醋酸兰瑞肽;来曲唑;醋酸亮丙瑞林;盐酸利阿唑;洛美曲索钠;洛莫司丁;盐酸洛索蒽醌;马索罗酚;美登素;盐酸氮芥;乙酸甲地孕酮;醋酸美仑孕酮;美法仑;美诺立尔;巯基嘌呤;甲氨蝶呤;甲氨蝶呤钠;氯苯氨啶(metoprine);美妥替哌;米丁度胺;mitocarcin;mitocromin;米托洁林;米托马星;丝裂霉素;米托司培;米托坦;盐酸米托蒽醌;霉酚酸;诺考达唑;诺加霉素;奥马铂;奥昔舒仑;培门冬酶;培利霉素;戊氮芥;硫酸培来霉素;培磷酰胺;哌泊溴烷;哌泊舒凡;盐酸吡罗蒽醌;普卡霉素;普洛美坦;卟吩姆钠;泊非霉素;泼尼莫司汀;盐酸丙卡巴肼;嘌呤霉素;盐酸嘌呤霉素;吡唑呋喃菌素;利波腺苷;罗谷亚胺;沙芬戈;盐酸沙芬戈;司莫司汀;辛曲秦;sparfosate钠;稀疏霉素;盐酸锗螺胺;螺莫司汀;螺铂;链黑菌素;链脲菌素;磺氯苯脲;他利霉素;替可加兰钠;替加氟;盐酸替洛蒽醌;替莫卟吩;替尼泊苷;替罗昔隆;睾内酯;硫咪嘌呤;硫鸟嘌呤;噻替派;tiazofurin;替拉扎明;柠檬酸托瑞米芬;醋酸曲托龙;磷酸曲西立滨;曲美沙特;葡萄糖醛酸曲美沙特;曲普瑞林;盐酸妥布氯唑;尿嘧啶氮芥;乌瑞替派;伐普肽;维替泊芬;硫酸长春碱;硫酸长春新碱;长春地辛;硫酸长春地辛;硫酸长春匹定;硫酸长春甘酯;硫酸长春罗新;酒石酸长春瑞滨;硫酸长春罗定;硫酸长春利定;伏氯唑;折尼铂;净司他丁;盐酸佐柔比星。
可在本教导中使用的其他抗癌剂/药物包括但不限于:20-epi-1,25二羟基维生素D3;5-乙炔尿嘧啶;阿比特龙;阿柔比星;acylfulvene;腺环戊醇(adecypenol);阿多来新;阿地白介素;ALL-TK拮抗剂;六甲蜜胺;氨莫司汀;amidox;氨磷汀;氨基乙酰丙酸;氨柔比星;安吖啶;阿那格雷;阿那曲唑;穿心莲内酯;血管生成抑制剂;拮抗剂D;拮抗剂G;antarelix;抗背突形态发生蛋白1;抗雄激素;抗雌激素;抗瘤酮;反义寡核苷酸;甘氨酸阿非迪霉素;凋亡基因调节剂;凋亡调节剂;脱嘌呤核酸;ara-CDP-DL-PTBA;精氨酸脱氨酶;asulacrine;阿他美坦;阿莫司汀;axinastatin 1;axinastatin 2;axinastatin 3;阿扎司琼;azatoxin;重氮酪氨酸;浆果赤霉素III衍生物;balanol;巴马司他;BCR/ABL拮抗剂;benzochlorins;benzoylstaurosporine;β-内酰胺衍生物;β-alethine;β-clamycin B;桦木酸;bFGF抑制剂;比卡鲁胺;比生群;双吖丙啶基精胺(bisaziridinylspermine);双奈法德;bistratene A;比折来新;breflate;溴匹立明;布朵替坦;丁硫氨酸亚砜胺;钙泊三醇;卡弗他丁C;喜树碱衍生物;金丝雀痘IL-2;卡培他滨;氨甲酰-氨基-三唑;羧胺三唑;CaRestM3;CARN 700;软骨衍生抑制剂;卡折来新;酪蛋白激酶抑制剂(ICOS);粟精胺;天蚕素B;西曲瑞克;chlorlns;氯喹喔啉磺酰胺;西卡前列素;顺卟啉;克拉屈滨;氯米芬类似物;克霉唑;collistycin A;collismycin B;康普瑞汀A4;康普瑞汀类似物;conagenin;crambescidin 816;克雷斯托;念珠藻素8;念珠藻素A衍生物;curacin A;环戊蒽醌;cycloplatam;cypemycin;阿糖胞苷烷磷酯(cytarabine ocfosfate);溶细胞因子;cytostatin;达昔单抗;地西他滨;dehydrodidemnin B;德舍瑞林;地塞米松;右异环磷酰胺(dexifosfamide);右雷佐生;右维拉帕米;亚丝醌;膜海鞘素B;didox;二乙基去甲精胺;二氢-5-氮杂胞苷;9-dioxamycin;二苯基螺莫司汀;二十二醇;多拉司琼;去氧氟尿苷;屈洛昔芬;屈大麻酚;duocarmycin SA;依布硒;依考莫司汀;依地福新;依决洛单抗;依氟鸟氨酸;榄香烯;乙嘧替氟;表柔比星;依立雄胺;雌氮芥类似物;雌激素激动剂;雌激素拮抗剂;依他硝唑;磷酸依托泊苷;依西美坦;法倔唑;法扎拉滨;芬维A胺;非格司亭;非那雄胺;flavopiridol;氟卓斯汀;fluasterone;氟达拉滨;盐酸fluorodaunorunicin;福酚美克;福美斯坦;福司曲星;福莫司汀;gadolinium texaphyrin;硝酸镓;加洛他滨;加尼瑞克;明胶酶抑制剂;吉西他滨;谷胱甘肽抑制剂;hepsulfam;heregulin;六亚甲基二乙酰胺;金丝桃素;伊班膦酸;伊达比星;艾多昔芬;伊决孟酮;伊莫福新;伊洛马司他;imidazoacridones;咪喹莫特;免疫刺激肽;胰岛素样生长因子-1受体抑制剂;干扰素激动剂;干扰素;白介素;碘苄胍;碘阿霉素;甘薯苦醇,4-;伊罗普拉;伊索拉定;isobengazole;isohomohalicondrinB;伊他司琼;jasplakinolide;kahalalide F;片螺素-N三醋酸酯;兰瑞肽;leinamycin;来格司亭;硫酸香菇多糖;leptolstatin;来曲唑;白血病抑制因子;白细胞α干扰素;亮丙瑞林+雌激素+孕酮;亮丙瑞林;左旋咪唑;利阿唑;线性多胺类似物;亲脂性二糖肽;亲脂性铂化合物;lissoclinamide 7;洛巴铂;蚯蚓磷脂;洛美曲索;氯尼达明;洛索蒽醌;洛伐他汀;洛索立宾;勒托替康;lutetium texaphyrin;lysofylline;美坦辛;mannostatin A;马马司他;马索罗酚;maspin;基质溶解因子抑制剂;基质金属蛋白酶抑制剂;美诺立尔;merbarone;meterelin;蛋氨酸酶;甲氧氯普胺;MIF抑制剂;米非司酮;米替福新;米立司亭;错配的双链RNA;米托胍腙;二溴卫矛醇;丝裂霉素类似物;米托萘胺;mitotoxin成纤维细胞生长因子-皂草素;米托蒽醌;莫法罗汀;molgramostim;单克隆抗体、人绒毛膜促性腺激素;单磷酰脂质A+myobacterium菌细胞壁sk;莫哌达醇;多药耐药基因抑制剂;基于多肿瘤抑制因子1的治疗;芥末抗癌剂;mycaperoxide B;分枝杆菌细胞壁提取物;myriaporone;N-乙酰地那林;N-取代的苯甲酰胺;那法瑞林;nagrestip;纳洛酮+喷他佐辛;napavin;naphterpin;那托司亭;奈达铂;奈莫柔比星;奈立膦酸;中性内肽酶;尼鲁米特;nisamycin;一氧化氮调节剂;氮氧抗氧化剂;nitrullyn;O6-苄基鸟嘌呤;奥曲肽;okicenone;寡核苷酸;onapristone;ondansetron;ondansetron;oracin;口服细胞因子诱导剂;奥马铂;奥沙特隆;奥沙利铂;oxaunomycin;palauamine;palmitoylrhizoxin;帕米膦酸;人参三醇;帕诺米芬;parabactin;pazelliptine;培门冬酶;peldesine;戊聚糖多硫酸钠;喷司他丁;pentrozole;全氟溴烷;培磷酰胺;紫苏醇;phenazinomycin;乙酸苯酯;磷酸酶抑制剂;picibanil;盐酸匹鲁卡品;吡柔比星;吡曲克辛;placetin A;placetin B;纤溶酶原激活物抑制剂;铂络合物;铂化合物;铂-三胺络合物;卟菲尔钠;泊非霉素;强的松;丙基双-吖啶酮;前列腺素J2;蛋白酶体抑制剂;基于蛋白A的免疫调节剂;蛋白激酶C抑制剂;蛋白激酶C抑制剂,蛋白酪氨酸磷酸酶抑制剂;嘌呤核苷磷酸化酶抑制剂;紫红素;吡唑啉吖啶(pyrazoloacridine);吡啶醇基化(pyridoxylated)血红蛋白聚氧乙烯缀合物;raf拮抗剂;雷替曲塞;雷莫司琼;ras法呢基蛋白转移酶抑制剂;ras抑制剂;ras-GAP抑制剂;脱甲基化瑞替普汀;羟乙膦酸铼Re 186;利索新;核酶;RII retinamide;罗谷亚胺;罗希吐碱;罗莫肽;罗喹美克;rubiginone B1;ruboxyl;沙芬戈;saintopin;SarCNU;sarcophytol A;沙格司亭;Sdi 1模拟物;司莫司汀;衰老衍生抑制剂1;有义寡核苷酸;信号转导抑制剂;信号转导调制器;单链抗原结合蛋白;西佐喃;索布佐生;硼卡钠(sodium borocaptate);苯乙酸钠;solverol;生长调节素结合蛋白;索纳明;膦门冬酸;spicamycin D;螺莫司汀;斯耐潘定;spongistatin 1;角鲨胺;干细胞抑制剂;干细胞分裂抑制剂;stipiamide;基质溶素抑制剂;sulfinosine;超活性血管活性肠肽拮抗剂;suradista;苏拉明;苦马豆素;合成的糖胺聚糖;他莫司汀;它莫西芬甲碘化物;牛磺莫司汀;他扎罗汀;替可加兰钠;替加氟;tellurapyrylium;端粒酶抑制剂;替莫泊芬;替莫唑胺;替尼泊苷;tetrachlorodecaoxide;tetrazomine;thaliblastine;thiocoraline;促血小板生成素;促血小板生成素模拟物;胸腺法新;促胸腺生成素受体激动剂;胸腺曲南;甲状腺刺激激素;tin ethyl etiopurpurin;替拉扎明;环戊二烯钛二氯化物;topsentin;托瑞米芬;全能干细胞因子;翻译抑制剂;维甲酸(tretinoin);三乙酰基尿苷;曲西立滨;曲美沙特;曲普瑞林;托烷司琼;妥罗雄脲;酪氨酸激酶抑制剂;酪氨酸磷酸化抑制剂;UBC抑制剂;泌尿生殖窦源性生长抑制因子;尿激酶受体拮抗剂;伐普肽;variolin B;维拉雷琐;藜芦胺;verdins;维替泊芬;长春瑞滨;vinxaltine;vitaxin;伏氯唑;扎诺特隆;折尼铂;zilascorb;和净司他丁斯酯。
在一个方面,癌症疗法是适合于治疗白血病的抗癌剂。示例性治疗包括但不限于
本文所述的TTK或MPS1抑制剂包括,例如,能够抑制酪氨酸苏氨酸激酶或单极纺锤体1活性的小分子。可以在体外、体内或从其组合测量抑制。在一个方面,本文所述方法中的TTK或MPS1抑制剂包括但不限于在下列文献中所述的那些:WO2014075168、WO2015070349、WO2013053051、WO2014056083、WO 2009024824、WO 2013087579、WO 2014198647、WO2014195408、WO 2014009219、WO 2014131739、WO 2016034507、WO 2009156315、WO2010007756、Hewitt等J Cell Biol(2010)190:25–34;Wengner等Mol Cancer Ther(2016)15:583–592;Tardif等Mol Cancer Ther(2011)10:2267–2275;Jemaa等Cell Death Differ(2013)20:1532–1545;Kwiatkowski等Nat Chem Biol(2010)6:359–368;Tannous等J NatlCancer Inst(2013)105:1322–1331;Colombo等Cancer Res(2010)70:10255–10264;Maia等Ann Oncol(2015)26:2180–2192;Santaguida等J Cell Biol(2010)190:73–87;和Schmidt等EMBO Rep(2005)6:866–872。
在一个方面,本文所述方法中的TTK/MPS1抑制剂是
或
在一个方面,本文所述方法中的TTK/MPS1抑制剂选自于:
S81694/NMS-P153;BOS172722;NTRC 0060-0;NTRC 1501-0;或其药学上可接受的盐。
当仅通过结构指明本文所述的TTK/MPS1抑制剂中关于环丁基或环己基的立体化学时,该结构意在相对于另一个手性中心的立体化学描绘环丁基/环己基中手性中心之一的相对立体化学,而不是环丁基或环己基中任一手性中心的绝对立体化学。例如,当关于环丁基的立体化学仅通过结构描述为反式时,相对于所描绘的关于环丁基的反式构型,化合物的立体化学纯度为按重量计至少85%、至少90%、至少95%、至少97%、至少98%或至少99%,即,组合物中在环丁基处具有反式立体化学的TTK/MPS1抑制剂的重量百分比为按重量计至少85%、至少90%、至少95%、至少97%、至少98%或至少99%。例如,下式表示的TTK/MPS1抑制剂:
当本文描述的方法的TTK/MPS1抑制剂中手性中心的绝对立体化学在结构上和通过“R”或“S”指明时,应理解该描述意指所描述的立体异构体立体化学纯度为按重量计至少85%、至少90%、至少95%、至少97%、至少98%或至少99%,即组合物中表示的TTK/MPS1抑制剂的指定立体异构体的重量百分比。例如,下式表示的TTK/MPS1抑制剂:
当在结构上描绘化合物而未在手性中心指示立体化学时,应理解该结构包括在手性中心处的任何构型,或可替代地,在手性中心立体异构体的构型的任何混合物。
如本文所用,术语“受试者”和“患者”可以互换使用,并且是指需要治疗的哺乳动物,例如伴侣动物(例如,狗、猫等)、农场动物(例如,牛、猪、马、绵羊、山羊等)和实验动物(例如,大鼠、小鼠、豚鼠等)。通常,受试者是需要治疗的人。
如本文所用,术语“治疗”、“处理”和“进行治疗”是指逆转、减轻或抑制癌症或其一种或多种症状的进展,如本文所述。癌症的示例性类型包括,例如,心脏:肉瘤(血管肉瘤、纤维肉瘤、横纹肌肉瘤、脂肪肉瘤)、粘液瘤、横纹肌瘤、纤维瘤、脂肪瘤和畸胎瘤;肺:支气管癌(鳞状细胞、未分化的小细胞、未分化的大细胞、腺癌)、肺泡(支气管)癌、支气管腺瘤、肉瘤、淋巴瘤、软骨性错构瘤、间皮瘤;胃肠道:食道(鳞状细胞癌、腺癌、平滑肌肉瘤、淋巴瘤)、胃(癌、淋巴瘤、平滑肌肉瘤)、胰腺(导管腺癌、胰岛瘤、高血糖素瘤、胃泌素瘤、类癌瘤、神经内分泌肿瘤、血管活性肠肽瘤(vipoma))、小肠(腺癌、淋巴瘤、类癌瘤、卡波西肉瘤、平滑肌瘤、血管瘤、脂肪瘤、神经纤维瘤、纤维瘤)、大肠(腺癌、管状腺瘤、绒毛状腺瘤、错构瘤、平滑肌瘤);泌尿生殖道:肾脏(腺癌、威尔姆氏肿瘤(肾母细胞瘤)、淋巴瘤、白血病)、膀胱和尿道(鳞状细胞癌、移行细胞癌、腺癌)、前列腺(腺癌、肉瘤、小细胞神经内分泌癌和类癌)、睾丸(精原细胞瘤、畸胎瘤、胚胎癌、畸胎瘤、绒毛膜癌、肉瘤、间质细胞癌、纤维瘤、纤维腺瘤、腺瘤样肿瘤、脂肪瘤);肝:肝瘤(肝细胞癌)、胆管癌、肝母细胞瘤、血管肉瘤、肝细胞腺瘤、血管瘤;骨:成骨肉瘤(骨肉瘤)、纤维肉瘤、恶性纤维组织细胞瘤、软骨肉瘤、尤因氏肉瘤、恶性淋巴瘤(网状细胞肉瘤)、多发性骨髓瘤、恶性巨细胞肿瘤软骨瘤、骨软骨瘤(osteochronfroma)(骨软骨外生骨疣)、良性软骨瘤、软骨母细胞瘤、软骨黏液纤维瘤、骨样骨瘤和巨细胞瘤;神经系统:头骨(骨瘤、血管瘤、肉芽肿、黄瘤、畸形性骨炎)、脑膜(脑膜瘤、脑膜肉瘤,胶质瘤病)、脑(星形细胞瘤、髓母细胞瘤、神经胶质瘤、室管膜瘤,生殖细胞瘤(松果体瘤)、多形性胶质母细胞瘤、少突胶质瘤、神经鞘瘤、视网膜母细胞瘤、弥漫性固有桥脑胶质瘤(DIPG)、先天性肿瘤)、脊髓神经纤维瘤、脑膜瘤、神经胶质瘤、肉瘤);妇科:子宫(子宫内膜癌)、子宫颈(宫颈癌、肿瘤前宫颈发育不良)、卵巢(卵巢癌(浆液性囊腺癌、粘液性囊腺癌、未分类癌)、输卵管(癌)、颗粒-卵泡膜细胞瘤、Sertoli-Leydig细胞肿瘤、无性细胞瘤(dysgerminoma)、恶性畸胎瘤)、外阴(鳞状细胞癌、上皮内癌、腺癌、纤维肉瘤、黑色素瘤)、阴道(透明细胞癌、鳞状细胞癌、葡萄状肉瘤(胚胎型横纹肌肉瘤));血液:髓性白血病(急性和慢性)、急性淋巴母细胞性白血病、慢性淋巴细胞性白血病、骨髓增生性疾病(原发性骨髓纤维化、真性红细胞增多症、特发性血小板增多症)、多发性骨髓瘤、骨髓增生异常综合症、霍奇金病、非霍奇金淋巴瘤(霍奇金淋巴瘤);皮肤:恶性黑色素瘤、基底细胞癌、鳞状细胞癌、卡波西肉瘤、moles dysplastic nevi、Merkel细胞癌、脂肪瘤、血管瘤、皮肤纤维瘤、瘢痕瘤(keloids)、牛皮癣;和肾上腺:神经母细胞瘤。
在一个方面,特征在于SKA3的高表达的癌症选自于乳腺癌、前列腺癌、子宫内膜癌、卵巢癌、脑癌、皮肤癌、甲状腺癌、肺癌、间皮瘤癌、膀胱癌、结肠直肠癌、肝癌、黑色素瘤、成胶质细胞瘤、白血病和淋巴瘤。在一个实施方式中,癌症是乳腺癌。在一个实施方式中,所述癌症是三阴性乳腺癌。在另一个实施方式中,所述癌症是管腔型乳腺癌。在另一个实施方式中,所述癌症是HER阳性乳腺癌。在另一个实施方式中,所述癌症是肝细胞癌、卵巢癌、间皮瘤或肺癌。
在另一方面,以SKA3的高表达为特征的癌症选自血管肉瘤、纤维肉瘤、横纹肌肉瘤、脂肪肉瘤、黏液瘤、横纹肌瘤、纤维瘤、脂肪瘤、畸胎瘤、鳞状细胞癌、未分化的小细胞癌、未分化的大细胞癌、腺癌、肺泡癌、支气管腺瘤、肉瘤、淋巴瘤、软骨瘤性错构瘤、间皮瘤、平滑肌肉瘤、癌瘤、导管腺癌、胰岛瘤、高血糖素瘤、胃泌素瘤、类癌瘤、血管活性肠肽瘤、类癌肿瘤、卡波西肉瘤、平滑肌瘤、Merkel细胞癌、血管瘤、脂肪瘤、神经纤维瘤、纤维瘤、管状腺瘤、绒毛状腺瘤、错构瘤、Wilm’s瘤、移行细胞癌、精原细胞瘤、畸胎瘤、胚胎性癌,畸胎癌、绒毛膜癌、间质细胞癌、纤维瘤、纤维腺瘤、腺瘤样肿瘤、脂肪瘤、肝细胞癌、胆管癌、肝母细胞瘤、血管肉瘤、肝细胞腺瘤、血管瘤、成骨性肉瘤、纤维肉瘤、恶性纤维组织细胞瘤、软骨肉瘤、尤文氏肉瘤、网织细胞肉瘤、多发性骨髓瘤、恶性巨细胞肿瘤脊索瘤、骨软骨瘤、良性软骨瘤、软骨母细胞瘤、软骨粘液纤维瘤、骨样骨瘤、巨细胞瘤、骨瘤、血管瘤、肉芽肿、黄瘤、畸形性骨炎、脑膜瘤、脑膜肉瘤、胶质瘤病、星形细胞瘤、髓母细胞瘤、神经胶质瘤、室管膜瘤、生殖细胞瘤、多形性胶质母细胞瘤、少突胶质细胞瘤、神经鞘瘤、视网膜母细胞瘤、先天性肿瘤、脊髓神经纤维瘤、脑膜瘤、子宫内膜癌、宫颈癌、瘤前宫颈发育不良、卵巢癌、颗粒-卵泡膜细胞瘤、Sertoli-Lydig细胞瘤、上皮内癌、透明细胞癌、鳞状细胞癌、急性髓系白血病、慢性髓系白血病、急性淋巴母细胞性白血病、慢性淋巴细胞性白血病、骨髓增生性疾病、骨髓增生异常综合征、霍奇金病、非霍奇金淋巴瘤(恶性淋巴瘤)和神经母细胞瘤。
术语“药学上可接受的载体、佐剂或媒介物”是指无毒的载体、佐剂或媒介物,其不会不利地影响与其一起配制的化合物的药理活性,并且对于人类使用也是安全的。可以用于本发明的组合物中的药学上可接受的载体、佐剂或媒介物包括但不限于,离子交换剂、氧化铝、硬脂酸铝、硬脂酸镁、卵磷脂、血清蛋白(例如人血清白蛋白)、缓冲物质(例如磷酸盐)、甘氨酸、山梨酸、山梨酸钾、饱和植物脂肪酸的部分甘油酯混合物、水、盐或电解质如硫酸鱼精蛋白、磷酸氢二钠、磷酸氢钾、氯化钠、锌盐、胶体二氧化硅、三硅酸镁、聚乙烯吡咯烷酮、纤维素基物质(例如,微晶纤维素、羟丙基甲基纤维素、乳糖一水合物、十二烷基硫酸钠和交联羧甲基纤维素钠)、聚乙二醇、羧甲基纤维素钠、聚丙烯酸酯、蜡、聚乙烯-聚氧丙烯嵌段聚合物、聚乙二醇和羊毛脂。
本文的组合物和施用方法可以是口服、肠胃外、通过吸入喷雾、局部、直肠、鼻、颊、阴道或经植入型储库。本文所用的术语“肠胃外”包括皮下、静脉内、肌内、关节内、滑膜内、胸骨内、鞘内、肝内、病变内和颅内注射或输注技术。
还应理解,针对任何特定患者的具体剂量和治疗方案将取决于多种因素,包括所用具体化合物的活性、年龄、体重、总体健康状况、性别、饮食、给药时间、排泄速率、药物组合以及治疗医师的判断和所治疗的特定疾病的严重程度。本文所述的TTK抑制剂在组合物中的量也将取决于组合物中的特定化合物。
整个本申请中引用的所有参考文献(包括文献类参考文献、授权专利、公开的专利申请和共同待决的专利申请)的内容在此明确地全文引入作为参考。除非另有定义,否则本文中使用的所有技术和科学术语均与本领域普通技术人员通常已知的含义一致。
实施例1
组装了先前描述的乳腺癌细胞系组(Marcotte等,Cell,164(1-2),2016 293-309)用于体外药物敏感性谱分析,并与可用的基因表达数据配对。使用Kallisto途径将RNA-seq阅读片段与Ensembl Genome Reference Consortium版本GRCh38进行比对(Bray等,NatureBiotechnology,2016 34(5),525–527)。将表达值计算为log
使用磺基罗丹明B(sulforhodamine B,SRB)分析评估了乳腺癌细胞系对化合物CFI-402257(TTK抑制剂,参见以下结构)的反应。如前所述合成该化合物(参见Liu等,ACSMedicinal Chemistry Letters,2016 7(7),671–675)。
将细胞接种在96孔板中,并用系列药物稀释液处理。处理5天后,将细胞固定,用SRB染色,溶解,并在分光光度计上定量吸光度。对于所有药物反应分析,细胞活力报告为药物中相对于DMSO处理的条件的生长比例。使用PharmacoGx途径为每一个细胞系生成药物反应度量,包括药物剂量-反应曲线(AAC)上面积,其中较高的AAC值表示较高的药物敏感性(Smirnov等人,Bioinformatics,2016 32(8),1244–1246)。
在整个乳腺癌细胞系组中观察到对化合物CFI-402257的差异体外敏感性(图1)。
实施例2
表达较高水平的SKA3的细胞系对TTK抑制敏感
为了确定与药物敏感性强相关的基因表达,基于线性回归模型开发了一种机器学习方法。该模型假设分子特征与药物反应之间的线性关系。尽管违反此假设可能导致有偏的预测,但线性模型对数据中的变化或噪声具有鲁棒性,从而在诸如药物基因组学的高维环境中不太容易使他们过拟合。因此,使用细胞系中的基因表达作为预测变量(针对癌细胞系的起源组织进行调整)和将其对给定药物的敏感性值作为因变量通过拟合线性模型对每一个分子特征与对给定药物的反应之间的相关性进行评估。为了评估每一个基因与给定药物的相关性,如下为每一个数据集构建了两个线性模型。
(1)M
(2)M
其中T代表作为大小为N×1的向量的起源组织;N是细胞系的数目;Y表示大小N×1的药物敏感性向量,其包含由目的药物处理的细胞系的药物敏感性值(AAC);X
为了确定药物敏感性的单变量预测因子,进行了AAC、药物反应的可靠量度和基因表达之间的关联。该分析鉴定了与基因SKA3的强且高度统计学显著的相关性,大大超过了药物敏感性与任何其他单个基因之间的相关性(图2)。为了评估对化合物CFI-402257的敏感性与公认的乳腺癌分子亚型内药物敏感性之间的相关性,评估了SKA3表达与CFI-402257敏感性之间的相关性(通过AAC测量的)。在所有乳腺癌细胞系中,以及在细胞系集合所代表的分子亚型内,鉴定了强的和统计学上显著的相关性(图3)。
一旦建立了连续的SKA3表达与对CFI-402257的敏感性(AAC)之间的线性关系,我们基于所有测试的乳腺癌细胞系中的SKA3表达中值估计了将细胞系简单二元分类为SKA3低/高的预测性(参见图4)。我们使用一致性指数(随机分类器的CI=0.5,而CI=1表示理想的分类)估计了这种二元分类器的预测性[REF:Newson R:Confidence intervals forrank statistics:Somers’D and extensions.Stata Journal 6:309-334;2006]及使用Noether公式[PMID:
实施例3
SKA3表达在不同癌细胞系中变化
为了表征SKA3生物标志物在临床癌症中的分布,图5绘制了来自癌症基因组图谱数据集的SKA3基因表达。值得注意的是,仅包括500或更多患者的肿瘤类型。图5证明了在乳腺癌以及其他肿瘤类型中基因表达的显著变异性。患者乳腺肿瘤中SKA3表达的这种变异性表明,可以鉴定出具有高或低肿瘤SKA3表达的个体,并且其可以表现出对化合物CFI-402257或其他TTK抑制剂的差异敏感性。
这些数据表明,SKA3表达水平可以用作选择使用TTK抑制剂治疗的癌症患者亚群的标准,因为观察到值的宽范围,具有可以表征为“高”SKA3表达者的独特亚群。
尽管我们已经描述了本发明的多个实施方式,但是显然可以改变我们的基础实施例以提供利用本发明的化合物和方法的其他实施方式。因此,将理解,本发明的范围将由所附权利要求书而不是由实施例表示的特定实施方式来限定。
- 治疗特征在于纺锤体和着丝粒相关复合物亚基3(SKA3)基因的高表达水平的癌症的方法
- 用于癌症诊断、预后和治疗选择的着丝粒/动粒蛋白基因
