一种血清二氧化碳测定试剂球的制备方法及试剂球
文献发布时间:2023-06-19 12:18:04
技术领域
本发明实施例涉及医学免疫体外诊断技术领域,尤其涉及一种血清二氧化碳测定试剂球的制备方法及试剂球。
背景技术
血清或血浆中90%~95%的CO
目前,临床上用于测定血清二氧化碳的酶法,一方面,试剂液需要额外添加还原性辅酶I(NADH)的循环再生系统,并且,稳定性较差。另一方面,其干粉试剂复溶后稳定性较差,液体试剂有效期较短,且依赖大型全自动生化分析仪,难以应用在病人身边即时诊断(point-of-care,POCT),使用上受到一定限制。虽然,现有用于检测其它项目的冻干试剂球,但是,现有的冻干试剂球形态较差,难以完全冻干,导致其具有较低的稳定性和准确性。
发明内容
本发明实施例主要解决的技术问题是提供一种血清二氧化碳测定试剂球的制备方法、试剂球及微流控芯片,采用该方法制备得到的试剂球,能使试剂球保持活性,稳定性好,并具有较好的形态及复融溶解性,具有较高精密度。
为解决上述技术问题,第一方面,本发明实施例中提供给了一种血清二氧化碳测定试剂球的制备方法,包括:
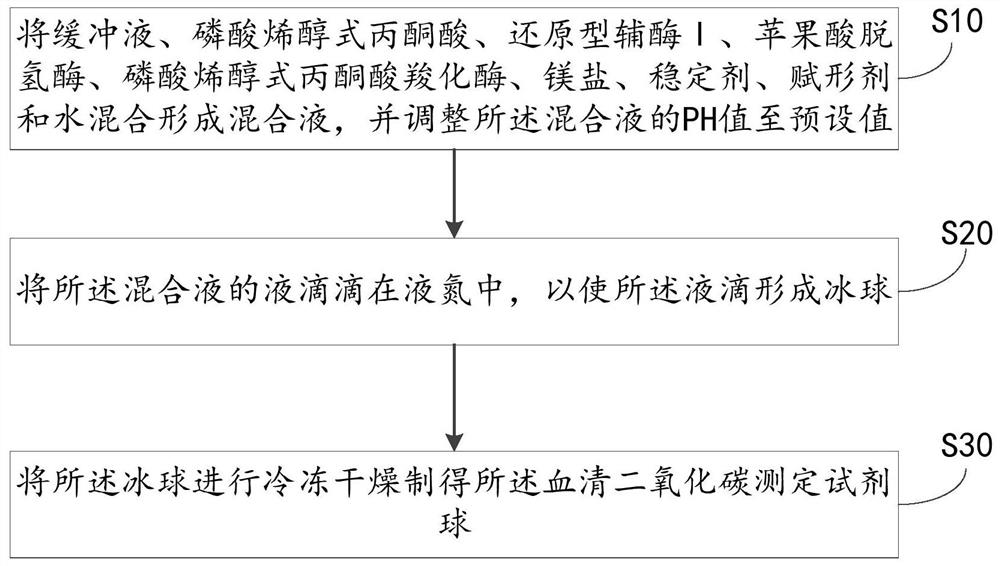
将缓冲液、磷酸烯醇式丙酮酸、还原型辅酶Ⅰ、苹果酸脱氢酶、磷酸烯醇式丙酮酸羧化酶、镁盐、稳定剂、赋形剂和水混合形成混合液,并调整所述混合液的PH值至预设值;
将所述混合液的液滴滴在液氮中,以使所述液滴形成冰球;
将所述冰球进行冷冻干燥制得所述血清二氧化碳测定试剂球;
其中,所述混合液包括以下组分:缓冲液5-150mmol/L,磷酸烯醇式丙酮酸5-20g/L,还原型辅酶Ⅰ:0.1-10g/L,苹果酸脱氢酶5-20KU/L,磷酸烯醇式丙酮酸羧化酶0.1-5KU/L,稳定剂0.1-10g/L,赋形剂10-100g/L。
在一些实施例中,所述将缓冲液、磷酸烯醇式丙酮酸、还原型辅酶Ⅰ、苹果酸脱氢酶、磷酸烯醇式丙酮酸羧化酶、镁盐、稳定剂、赋形剂和水混合形成混合液,并调整所述混合液的PH值至预设值,包括:
将所述缓冲液加入第一预设定量的水中;
待所述缓冲液在所述水中完全溶解后,依次加入稳定剂、赋形剂和镁盐,得到第一溶液,并调节所述第一溶液的PH值至所述预设值,其中,所述预设值的范围为7.5-9.0;
将所述磷酸烯醇式丙酮酸、所述还原型辅酶Ⅰ、所述苹果酸脱氢酶和所述磷酸烯醇式丙酮酸羧化酶依次加入所述第一溶液中,并将第二预设定量的水加入所述第一溶液中,得到第三预设定量的所述混合液。
在一些实施例中,所述赋形剂包括海藻糖、甘露醇、肌醇、水溶性淀粉、葡聚糖1万、葡聚糖4万中的至少一种。
在一些实施例中,所述稳定剂包括丝氨酸、甘氨酸、蔗糖、牛血清白蛋白、乙二胺四乙酸中的至少一种。
在一些实施例中,所述缓冲液包括Tris缓冲液、甘氨酸-氢氧化钠缓冲液、HEPES缓冲液中的至少一种。
在一些实施例中,所述镁盐包括硫酸镁或乙酸镁。
在一些实施例中,所述冰球的体积为2.5ul-3.5ul。
为解决上述技术问题,第二方面,本发明实施例中提供给了一种试剂球,采用如上第一方面所述的血清二氧化碳测定试剂球的制备方法制备得到。
为解决上述技术问题,第三方面,本发明实施例中提供给了一种微流控芯片,包括芯片本体和如上第二方面所述的试剂球,其中,所述试剂球设置于所述芯片本体内部。
为解决上述技术问题,第四方面,本发明实施例中提供给了一种生化分析仪,包括分析仪本体、反应槽以及如上第三方面所述的微流控芯片,其中,所述反应槽开设于所述分析仪本体内,所述微流控芯片安装于所述反应槽。
本发明实施例的有益效果:区别于现有技术的情况,本发明实施例提供的血清二氧化碳测定试剂球的制备方法,该方法是将一定量的缓冲液、磷酸烯醇式丙酮酸、还原型辅酶Ⅰ、苹果酸脱氢酶、磷酸烯醇式丙酮酸羧化酶、镁盐、稳定剂、赋形剂和水混合形成混合液,然后将混合液以液滴的形式滴在液氮中,使液滴形成冰球,再将冰球进行冷冻干燥制得血清二氧化碳测定试剂球,其中,混合液包括以下组分:缓冲液5-150mmol/L,磷酸烯醇式丙酮酸5-20g/L,还原型辅酶Ⅰ:0.1-10g/L,苹果酸脱氢酶5-20KU/L,磷酸烯醇式丙酮酸羧化酶0.1-5KU/L,稳定剂0.1-10g/L,赋形剂10-100g/L。该剂量范围的赋形剂能够保证试剂球的形态及复融溶解性,保护反应物活性,并有益于试剂球完全冻干。也即,通过该方法制备出的血清二氧化碳测定试剂球,具有较好的形态及复融溶解性,能完全冻干,从而,具有较高的稳定性和精密度。
附图说明
一个或多个实施例通过与之对应的附图中的图片进行示例性说明,这些示例性说明并不构成对实施例的限定,附图中具有相同参考数字标号的元件表示为类似的元件,除非有特别申明,附图中的图不构成比例限制。
图1为发明一实施例提供的血清二氧化碳测定试剂球的制备方法的流程示意图;
图2为图1所示中步骤S10的一子流程示意图;
图3为临床相关性分析中相关方程的拟合线示意图;
图4为线性范围测试中相关方程的拟合线示意图。
具体实施方式
下面结合具体实施例对本发明进行详细说明。以下实施例将有助于本领域的技术人员进一步理解本发明,但不以任何形式限制本发明。应当指出的是,对本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进。这些都属于本发明的保护范围。
为了使本申请的目的、技术方案及优点更加清楚明白,以下结合附图及实施例,对本申请进行进一步详细说明。应当理解,此处所描述的具体实施例仅用以解释本申请,并不用于限定本申请。
需要说明的是,如果不冲突,本发明实施例中的各个特征可以相互结合,均在本申请的保护范围之内。另外,虽然在装置示意图中进行了功能模块划分,在流程图中示出了逻辑顺序,但是在某些情况下,可以以不同于装置中的模块划分,或流程图中的顺序执行所示出或描述的步骤。此外,本文所采用的“第一”、“第二”、“第三”等字样并不对数据和执行次序进行限定,仅是对功能和作用基本相同的相同项或相似项进行区分。
除非另有定义,本说明书所使用的所有的技术和科学术语与属于本发明的技术领域的技术人员通常理解的含义相同。本说明书中在本发明的说明书中所使用的术语只是为了描述具体的实施方式的目的,不是用于限制本发明。本说明书所使用的术语“和/或”包括一个或多个相关的所列项目的任意的和所有的组合。
此外,下面所描述的本发明各个实施方式中所涉及到的技术特征只要彼此之间未构成冲突就可以相互组合。
本发明实施例提供一种血清二氧化碳测定试剂球的制备方法,能够制备出球形的血清二氧化碳测定试剂,请参阅图1,该方法包括如下步骤:
S10:将缓冲液、磷酸烯醇式丙酮酸、还原型辅酶Ⅰ、苹果酸脱氢酶、磷酸烯醇式丙酮酸羧化酶、镁盐、稳定剂、赋形剂和水混合形成混合液,并调整所述混合液的PH值至预设值。
在此实施例中,分别量取缓冲液、磷酸烯醇式丙酮酸、还原型辅酶Ⅰ、苹果酸脱氢酶、磷酸烯醇式丙酮酸羧化酶、镁盐、稳定剂、赋形剂和水(各组分),然后将各组分充分混合,得到混合液。可以采用PH试纸等方法测试该混合液的PH值,并通过加入氢氧化钠调节该混合液的PH值至预设值。其中,预设值在血清二氧化碳测定时所需的PH值范围内,从而,使得该混合液符合血清二氧化碳测定所需的碱性环境。
为了使得混合液混合充分以及各组分含量准确,请参阅图2,在一些实施例中,该步骤S10具体包括以下步骤:
S11:将所述缓冲液加入第一预设定量的水中。
S12:待所述缓冲液在所述水中完全溶解后,依次加入稳定剂、赋形剂和镁盐,得到第一溶液,并调节所述第一溶液的PH值至所述预设值,其中,所述预设值的范围为7.5-9.0。
S13:将所述磷酸烯醇式丙酮酸、所述还原型辅酶Ⅰ、所述苹果酸脱氢酶和所述磷酸烯醇式丙酮酸羧化酶依次加入所述第一溶液中,并将第二预设定量的水加入所述第一溶液中,得到第三预设定量的所述混合液。
具体的,在1L烧杯中加入800ml的水,即第一预设定量为800ml,称取缓冲液成分,加入该盛有800ml水的烧杯中,待缓冲液在水中完全后溶解后,依次加入稳定剂、赋形剂和镁盐,得到第一溶液。从而,使得水、缓冲液、镁盐、稳定剂和赋形剂可以完全充分混合。
然后,通过加入氢氧化钠调节第一溶液的PH值至7.5-9.0,为后续加入的各反应酶提供环境,有利于保护反应物活性。依次加入磷酸烯醇式丙酮酸、还原型辅酶Ⅰ、苹果酸脱氢酶和磷酸烯醇式丙酮酸羧化酶,使得各酶组分能与第一溶液充分混合。最后,通过加入第二预设定量的水以将烧杯中的溶液定容至1L,即得到1L(第三预设定量)的混合液。
基于调节PH值时加入的氢氧化钠的量未定,一次确定水的量,容易导致后续总量(即第三预设定量)超标,使得各组分的含量不准确。在此实施例中,通过两次加入预设定量的水,有益于配制出各组分准确的混合液,并且各组分分批次加入,使得各组分能够混合均匀,有利于混合液的稳定性,提高检测精度。
此外,混合液包括以下组分:缓冲液5-150mmol/L,磷酸烯醇式丙酮酸5-20g/L,还原型辅酶Ⅰ:0.1-10g/L,苹果酸脱氢酶5-20KU/L,磷酸烯醇式丙酮酸羧化酶0.1-5KU/L,稳定剂0.1-10g/L,赋形剂10-100g/L,其中,所述稳定剂用于维持所述磷酸烯醇式丙酮酸羧化酶和所述苹果酸脱氢酶的活性,所述稳定剂为蛋白类或二糖类稳定剂。
其中,缓冲液包括Tris缓冲液、甘氨酸-氢氧化钠缓冲液、HEPES缓冲液中的至少一种。可以理解的是,缓冲液为试剂提供碱性环境,以使其它组分能发挥有效作用。
其中,如以下公式所示,在碱性环境下,磷酸烯醇式丙酮酸羧化酶(PEPC)催化血清样本中的HCO
在检测反应的过程中,镁盐为磷酸烯醇式丙酮酸羧化酶(PEPC)的激活剂,有利于上述反应顺利进行。可以理解的是,镁盐可以为硫酸镁或乙酸镁。
其中,赋形剂不会与其它组分发生反应,性质稳定,不产生副作用,即不会影响试剂精度。并且,该剂量范围的赋形剂能够赋予试剂球良好的外观,使试剂球疏松,易于复溶,从而,能够保证试剂球的形态及复融溶解性,良好的形态有益于试剂球完全冻干。
在一些实施例中,赋形剂包括海藻糖、甘露醇、肌醇、水溶性淀粉、葡聚糖1万、葡聚糖4万中的至少一种。可以理解的是,基于赋形剂能够赋予试剂球良好的外观,使试剂球疏松,从而,使得试剂球与检测样本接触后,溶解性良好,与样本反应充分。
在一些实施例中,稳定剂包括丝氨酸、甘氨酸、蔗糖、牛血清白蛋白、乙二胺四乙酸中的至少一种。稳定剂用于维持试剂的稳定性。
S20:将所述混合液的液滴滴在液氮中,以使所述液滴形成冰球。
在配制好混合液后,可以通过点胶机将混合液的液滴滴在液氮中,使液滴在液氮中凝结成冰球。本领域技术人员可以根据实际需要调整滴入液氮中的混合液的液滴的大小,并通过控制液滴的大小来调整冰球的体积。可选的,在一些实施例中,冰球的体积为2.5ul-3.5ul。
S30:将所述冰球进行冷冻干燥制得所述血清二氧化碳测定试剂球。
在获得冰球后,将冰球置于真空冷冻干燥机进行冷冻干燥,获得血清二氧化碳测定试剂球,待氮气复压后将血清二氧化碳测定试剂球收集并保存在干燥的铝瓶中。
其中,冷冻干燥是指将冰球预先进行降温冻结成固体,在低温减压条件下利用水的升华性能,使试剂原料低温脱水而达到干燥目的的一种干燥方法。冷冻干燥后,冰球中除水外的各组分(缓冲液、磷酸烯醇式丙酮酸、还原型辅酶Ⅰ、苹果酸脱氢酶、磷酸烯醇式丙酮酸羧化酶、镁盐、稳定剂、赋形剂)本身留在冻结时的冰架中,因此冷冻干燥后的冰球疏松多孔且体积不变。由于冰球干燥前始终处于冻结状态,同时冰晶均匀分布于物质中,升华过程不会因脱水而发生浓缩现象。故冷冻干燥后得到的试剂球呈海绵状疏松多孔,体积基本与干燥前的冰球保持不变,极易溶于水而恢复原状。
在本实施例中,通过设置含量较高的赋形剂和稳定剂,能够保证试剂球的形态及复融溶解性,有益于试剂球完全冻干。从而,通过该方法制备出的血清二氧化碳测定试剂球,具有较好的形态及复融溶解性,能完全冻干,从而,具有较高的稳定性和精密度,并能实现及时诊断。
本发明实施例还提供了一种试剂球,该试剂球采用如上实施例中血清二氧化碳测定试剂球的制备方法制备得到,与由上实施例中血清二氧化碳测定试剂球的制备方法制备得到的试剂球具有相同的结构和功能,在此不再一一赘述。
本发明实施例还提供了一种微流控芯片,该微流控芯片包括芯片本体和上述任一实施例提供的试剂球,其中,试剂球设置于芯片本体内部。在一些实施例中,芯片本体由注塑成型的塑料基底和光学膜通过粘结胶层粘贴而成,芯片本体包括样本槽、稀释液槽、定量槽、混合槽、废液槽、液流通道和比色孔等结构。芯片本体还包括多个可存放试剂球的比色孔,检测样本进入比色孔后与试剂球发生化学反应。
本发明实施例还提供了一种生化分析仪,包括分析仪本体、反应槽以及如上所述的微流控芯片,其中,反应槽开设于分析仪本体内,微流控芯片可安装于反应槽,从而,能够对微流控芯片中的检测样本进行分析检测。其中,微流控芯片与上述各实施例中微流控芯片的结构和作用完全相同,在此不再一一赘述。
为进一步阐述本发明的技术方案,以下提供本发明的血清二氧化碳测定试剂球的制备方法的若干实施例。
实施例1:
在本实施例中,缓冲液包括Tris缓冲液,稳定剂包括牛血清白蛋白,赋形剂包括甘露醇,镁盐包括硫酸镁。血清二氧化碳测定试剂球的制备方法如下:将一定量的Tris缓冲液、牛血清白蛋白、甘露醇、硫酸镁、磷酸烯醇式丙酮酸、还原型辅酶Ⅰ、苹果酸脱氢酶、磷酸烯醇式丙酮酸羧化酶和水混合形成混合液,将混合液的液滴滴在液氮中形成体积约为3.0ul的冰球,将该冰球进行冷冻干燥制得血清二氧化碳测定试剂球。并采用该血清二氧化碳测定试剂球制得微流控芯片。
具体的,在本实施例中,混合液包括以下组分:Tris缓冲液5-150mmol/L,硫酸镁0.1-10g/L,牛血清白蛋白0.1-10g/L,甘露醇10-100g/L,磷酸烯醇式丙酮酸5-20g/L,还原型辅酶Ⅰ:0.1-10g/L,苹果酸脱氢酶5-20KU/L,磷酸烯醇式丙酮酸羧化酶0.1-5KU/L。
实施例2:
在本实施例中,缓冲液包括甘氨酸-氢氧化钠缓冲液,镁盐包括乙酸镁,稳定剂包括蔗糖,赋形剂包括葡聚糖1万和水溶性淀粉。血清二氧化碳测定试剂球的制备方法如下:将一定量的甘氨酸-氢氧化钠缓冲液、乙酸镁、蔗糖、葡聚糖1万和水溶性淀粉、磷酸烯醇式丙酮酸、还原型辅酶Ⅰ、苹果酸脱氢酶、磷酸烯醇式丙酮酸羧化酶和水混合形成混合液,将混合液的液滴滴在液氮中形成体积约为2.5ul的冰球,将该冰球进行冷冻干燥制得血清二氧化碳测定试剂球。并采用该血清二氧化碳测定试剂球制得微流控芯片。
具体的,在本实施例中,混合液包括以下组分:甘氨酸-氢氧化钠缓冲液缓冲液5-150mmol/L,乙酸镁0.1-10g/L,蔗糖0.1-10g/L,葡聚糖1万10-100g/L,水溶性淀粉10-100g/L,磷酸烯醇式丙酮酸5-20g/L,还原型辅酶Ⅰ:0.1-10g/L,苹果酸脱氢酶5-20KU/L,磷酸烯醇式丙酮酸羧化酶0.1-5KU/L。
实施例3:
在本实施例中,缓冲液包括HEPES缓冲液,镁盐包括硫酸镁,稳定剂包括乙二胺四乙酸,赋形剂包括海藻糖。血清二氧化碳测定试剂球的制备方法如下:将一定量的HEPES缓冲液、硫酸镁、乙二胺四乙酸、海藻糖、磷酸烯醇式丙酮酸、还原型辅酶Ⅰ、苹果酸脱氢酶、磷酸烯醇式丙酮酸羧化酶和水混合形成混合液,将混合液的液滴滴在液氮中形成体积约为3.5ul的冰球,将该冰球进行冷冻干燥制得血清二氧化碳测定试剂球。并采用该血清二氧化碳测定试剂球制得微流控芯片。
具体的,在本实施例中,混合液包括以下组分:HEPES缓冲液5-150mmol/L,硫酸镁0.1-10g/L,EDTA:0.1-10g/L,海藻糖10-100g/L,磷酸烯醇式丙酮酸5-20g/L,还原型辅酶Ⅰ:0.1-10g/L,苹果酸脱氢酶5-20KU/L,磷酸烯醇式丙酮酸羧化酶0.1-5KU/L。
下面结合具体的测试对比实验,对本发明实施例1中制备得到的试剂球的性能进行说明。
在空气湿度8%的环境中,将实施例1中的试剂球装入微流控芯片的芯片本体内,向该微流控芯片中注入检测样本,然后,使用深圳市锦瑞生物有限公司便携式自动生化分析仪vp10进行检测,检测37℃下340nm波长吸光度的变化值。并使用英国朗道公司提供的校准品进行定标,可计算得到检测样本中血清二氧化碳的浓度。
1)精密度测试:采用本发明实施例1提供的微流控芯片检测已知血清二氧化碳浓度的检测样本1#,该检测样本1#的血清二氧化碳浓度为15.4mmol/L,检测20次,得到20个检测到的浓度值。
计算这20个浓度值的均值、标准差和变异系数,得到均值为15.19mmol/L,标准差SD=0.40,变异系数CV=0.97%。
可知,测得浓度(15.19mmol/L)与实际浓度(15.4mmol/L)十分接近,准确度高,并且,标准差和变异系数均较小,说明血清二氧化碳测定试剂球的稳定性好。
2)准确度测试:采用本发明实施例1提供的微流控芯片,测试已知血清二氧化碳浓度为17.1mmol/L的检测样本2#,重复检测三次,获得浓度值,计算出3次测得的浓度值的平均值为17.08mmol/L,相对偏差为-0.11%。
可知,测得浓度17.08mmol/L与实际浓度17.1mmol/L接近,准确度高,并且,相对偏差较小。
3)临床相关性分析
准备不同二氧化碳浓度的血清样本集A1,即A1包括若干份不同浓度的血清样本,采用实施例1中的微流控芯片检测样本集A1中各血清样本的二氧化碳浓度,以及,采用全自动生化分析仪日立7180检测样本集A1中各血清样本的二氧化碳浓度。检测结果如表1所示,对于同一浓度的样本编号1,采用日立7180测得的二氧化碳浓度为16.18mmol/L,采用本发明实施例1提供的微流控芯片测得的二氧化碳浓度为16.13mmol/L。
表1临床相关性分析的检测结果
将表1中,将日立7180对应的检测浓度值作为X轴的值,将微流控芯片对应的检测浓度值作为Y轴的值,得到两组检测结果之间的相关方程如下:
Y=1.002x+0.1854;
该相关方程的拟合线如图3所示,其中,相关系数R=0.9947,相关系数越接近1代表两组数据之间的相关性越强。因此,本发明实施例提供的微流控芯片与日立7180的测试结果相关性强。
4)线性范围测试
测试方法如下:用接近线性范围([10,35]mmol/L)上限的高浓度(活性)样本和接近线性范围下限的低浓度(活性)样本,按表2所示混合成6个稀释浓度的血清样本。
表2
采用本发明实施例1提供的微流控芯片分别测试6个血清样本的二氧化碳浓度,每个血清样本测试3次,分别求出6个血清样本中二氧化碳测得浓度值的平均值(y
Y=1.0326x-0.9322;
该相关方程的拟合线如图4所示,其中,相关系数R=0.9996,相关系数R越接近1,则说明采用本发明实施例中微流控芯片测得的结果与稀释后的实际结果越接近,即测得值接近实际值。通常,当试剂盒检测CO
5)热稳定性测试
在空气湿度8%的环境中,将本发明实施例1中的微流控芯片封袋,在37℃避光环境中贮存0、2、3、4、6、8天。以朗道校准品和质控品为检测样本,测试本发明实施例中微流控芯片的准确度,相对偏差应在±10.0%以内。具体的,由朗道公司提供两组质控品(样本1#和样本2#),分别采用达到上述存储要求后的微流控芯片分别检测样本1#和样本2#,对于同种类的微流控芯片,检测三次。
表3为样本1#通过存储各天数后的微流控芯片检测到的检测结果,表4为样本2#通过存储各天数后的微流控芯片检测到的检测结果。其中,平均值为三次检测到的浓度的平均值,靶值为样本中二氧化碳的实际浓度。
从表3和表4中可以得出,本发明实施例提供的微流控芯片在环境中存储2、3、4、6和8天后,相对偏差的绝对值仍在10.0%以内,因此,具有较好的热稳定性,在环境中储存多天后仍能确保其检测结果的准确性。
表3样本1#的检测结果
表4样本2#的检测结果
6)长期稳定性测试
在空气湿度8%的环境中,将本发明实施例1中的微流控芯片封袋,在2-8℃避光环境中贮存0、3、6、9、12、15个月后。以朗道校准品和质控品为检测样本时,测试该微流控芯片的准确度,相对偏差应在±10.0%以内。具体的,由朗道公司提供两组质控品(样本3#和样本4#),分别采用在2-8℃避光环境中贮存0、3、6、9、12、15个月后的微流控芯片检测样本3#和样本4#,对于同种类的微流控芯片,检测三次。
表5为在2-8℃避光环境中贮存0、3、6、9、12、15个月后的微流控对样本3#的检测结果,表6为在2-8℃避光环境中贮存0、3、6、9、12、15个月后的微流控对样本4#的检测结果。其中,平均值为三次检测到的浓度的平均值,靶值为样本中二氧化碳的实际浓度。
从表5和表6中可以得出,本发明实施例提供的微流控芯片在环境中存储0、3、6、9、12、15个月后,相对偏差的绝对值仍在10.0%以内,因此,具有较好的长期稳定性,在环境中储存较长时间后仍能确保其检测结果的准确性。
表5样本3#的检测结果
表6样本4#的检测结果
7)抗干扰能力
为了验证试剂球的抗干扰能力,采用本发明实施例1中的微流控芯片,测试混入其它干扰物质的样本5#-样本7#。其中,样本5#的血清二氧化碳浓度为16.2mmol/L,含40mg/dl的胆红素,样本6#的血清二氧化碳浓度为16.2mmol/L,含400mg/dl的血红蛋白,样本7#的血清二氧化碳浓度为16.2mmol/L,含1000mg/dl甘油三酯。
表7抗干扰测试结果
从抗干扰测试结果可知,检测结果与实际的相对偏差均较小,在1%范围内,从而,可以证明本发明实施例1中的微流控芯片具有较好的抗干扰能力,即本发明实施例中的血清二氧化碳测定试剂球具有较好的抗干扰能力。
综上所述,本发明实施例提供的血清二氧化碳测定试剂球的制备方法,该方法是将一定量的缓冲液、磷酸烯醇式丙酮酸、还原型辅酶Ⅰ、苹果酸脱氢酶、磷酸烯醇式丙酮酸羧化酶、镁盐、稳定剂、赋形剂和水混合形成混合液,然后将混合液以液滴的形式滴在液氮中,使液滴形成冰球,再将冰球进行冷冻干燥制得血清二氧化碳测定试剂球,其中,混合液包括以下组分:缓冲液5-150mmol/L,磷酸烯醇式丙酮酸5-20g/L,还原型辅酶Ⅰ:0.1-10g/L,苹果酸脱氢酶5-20KU/L,磷酸烯醇式丙酮酸羧化酶0.1-5KU/L,稳定剂0.1-10g/L,赋形剂10-100g/L。该剂量范围的赋形剂能够保证试剂球的形态及复融溶解性,保护反应物活性,还有益于试剂球完全冻干。也即,通过该方法制备出的血清二氧化碳测定试剂球,具有较好的形态及复融溶解性,能完全冻干,从而,具有较高的稳定性和精密度,并能实现及时诊断。
最后应说明的是:以上实施例仅用以说明本发明的技术方案,而非对其限制;在本发明的思路下,以上实施例或者不同实施例中的技术特征之间也可以进行组合,步骤可以以任意顺序实现,并存在如上所述的本发明的不同方面的许多其它变化,为了简明,它们没有在细节中提供;尽管参照前述实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。
- 一种血清二氧化碳测定试剂球的制备方法及试剂球
- 一种血清葡萄糖测定试剂、试剂球的制备方法及测定芯片
