新型人源性单克隆中和性抗体XG-81与XG-83的制备方法
文献发布时间:2023-06-19 12:24:27
技术领域
本发明涉及单克隆抗体制备技术领域,具体为新型人源性单克隆中和性抗体XG-81与XG-83的制备方法。
背景技术
SARS-CoV-2,是国际病毒分类委员对新型冠状病毒的正式命名,其刺突蛋白S主要通过受体结合域RBD介导病毒与宿主细胞表面受体的血管紧张素转换酶ACE2结合,是决定病毒入侵易感细胞的关键因子。故而,阻止病毒S蛋白RBD与宿主细胞受体ACE2的结合,切断病毒入侵宿主细胞是防治SARS-CoV-2感染的有效手段,因此,S蛋白也成了治疗性抗体研制的主要靶点。目前,筛选具有中和活性的单克隆抗体是防御新发病毒性疾病的一线技术,全人源化抗体则以低免疫原性与高亲和力的特点成为单克隆抗体的制备首选。
然而,传统方法制备出的单克隆抗体普遍存在抗体亲和力与中和活性较低的问题,无法对患者体内的抗体进行精确的活体病灶特异性定位诊断,影响了抗体治疗效果的可靠性,难以将抗体的毒副作用控制在合理水平,不可避免的增加了抗体的安全风险。
因此,设计新型人源性单克隆中和性抗体XG-81与XG-83的制备方法是很有必要的。
发明内容
本发明的目的在于提供新型人源性单克隆中和性抗体XG-81与XG-83的制备方法,以解决上述背景技术中提出的问题。
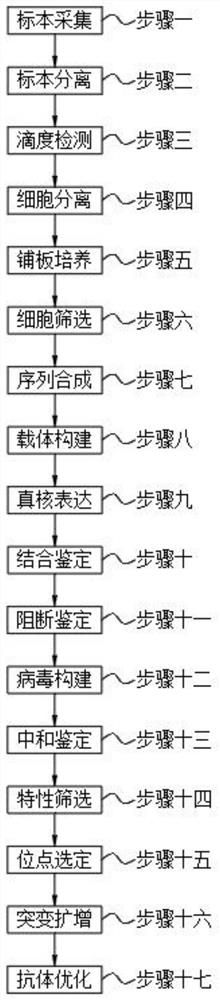
为了解决上述技术问题,本发明提供如下技术方案:新型人源性单克隆中和性抗体XG-81与XG-83的制备方法,包括以下步骤:步骤一,标本采集;步骤二,标本分离;步骤三,滴度检测;步骤四,细胞分离;步骤五,铺板培养;步骤六,细胞筛选;步骤七,序列合成;步骤八,载体构建;步骤九,真核表达;步骤十,结合鉴定;步骤十一,阻断鉴定;步骤十二,病毒构建;步骤十三,中和鉴定;步骤十四,特性筛选;步骤十五,位点选定;步骤十六,突变扩增;步骤十七,抗体优化;
其中在上述步骤一中,根据入选标准招募20名康复期患者,并采用非干预性研究方法,对前来复诊的康复期患者每人一次性抽取外周血30mL,得到外周血标本;
其中在上述步骤二中,将步骤一中得到的外周血标本加入人外周血淋巴细胞分离液中,通过梯度离心法,分离出血清标本和PBMC标本;
其中在上述步骤三中,通过化学发光法对步骤二中得到的血清标本进行抗RBD抗体IgG滴度,并利用竞争ELISA法检测血清阻断病毒S蛋白RBD与宿主细胞受体ACE2结合的能力,筛选出高IgG滴度且有阻断能力的血清标本,再以血清标本所对应的PBMC标本作为分离标本;
其中在上述步骤四中,将步骤三中选出的分离标本进行充分悬置,通过CD19+磁珠在磁场中进行细胞分离,并利用BD FACSAria去除分离标本中IgM+、IgD+和IgA+的B细胞,筛选出IgG+的记忆B细胞,再对IgG+的记忆B细胞进行流式检测,得到纯度超过90%的CD19+IgG+B细胞;
其中在上述步骤五中,对步骤四中得到的CD19+IgG+B细胞进行计数,并用含有IL-2、IL-21等细胞因子和3T3-msCD40L饲养细胞的培养基重悬,再按照每孔2个CD19+IgG+B细胞的密度,加入到348孔板中,置于孵箱中培养14天,得到细胞培养液;
其中在上述步骤六中,对步骤五中得到的细胞培养液进行上清液收集,利用化学发光法检测上清液中抗SARS-CoV-2病毒RBD抗体IgG的含量,并根据所得IgG浓度判断CD19+IgG+B细胞的活性和功能,再筛选出阳性孔中具有RBD特异性的CD19+IgG+B细胞的细胞培养液,作为表达B细胞;
其中在上述步骤七中,对步骤六中得到的表达B细胞进行总RNA提取,并以mRNA为模板反转录得到cDNA,再设计重链Fab段的通用性引物,进行PCR扩增,并通过高通量测序方法分析出抗体序列信息,接着设计重链Fab段或轻链Fab段的特异性引物,进行巢式PCR扩增,合成抗体基因组,并通过琼脂糖凝胶电泳方法鉴定并回收目的基因片段,得到具有SARS-CoV-2抗体H和L链基因序列的扩增产物;
其中在上述步骤八中,通过双酶切法对步骤七中得到的扩增产物进行酶切,连接并转化到DH5α感受态细胞中,将抗体基因分别克隆到相应的表达载体上,再挑选菌落并提取抗体表达质粒,得到具有SARS-CoV-2抗体重轻链的抗体真核表达载体;
其中在上述步骤九中,将步骤八中得到的抗体真核表达载体共转染到293F细胞上,收集上清液,得到转染上清液,并使用Protein A重力柱从转染上清液中纯化抗体,再利用BCA法测定抗体中的蛋白浓度,并通过SDS-PAGE凝胶电泳方法验证抗体表达情况,筛选出高蛋白浓度的抗体;
其中在上述步骤十中,利用重组表达的病毒RBD蛋白包被免疫板,并加入适量步骤九中得到的抗体和进行孵育,并设置对照,再加入偶联辣根过氧化物酶的抗人二抗进行孵育,并使用酶标仪测量OD450值,对抗体结合能力鉴定,挑选出强结合性抗体;
其中在上述步骤十一中,使用ACE2包被96孔板,将步骤九中得到的抗体与RBD蛋白孵育后加入,并设置阴性对照,再加入辣根过氧化物酶偶联的抗人二抗,孵育完成后加底物显色,酶标仪下测量吸光度,在吸光值低的样本中挑选出强阻断性抗体;
其中在上述步骤十二中,将高效表达SARS-CoV-2密码子优化后S蛋白的真核表达质粒pCMV-SARS-CoV-2、HIV慢病毒包装质粒pBS-CMV-gag/pol和转移质粒pCMV-EGFP三个质粒载体共转染到293F细胞上,包装成SARS-CoV-2假病毒,并设置对照,再通过SARS-CoV-2假病毒感染的人呼吸道上皮细胞HAE中标记基因EGFP表达的分析,确定SARS-CoV-2假病毒能有效进入细胞,建立可在BSL-2级实验室操作的SARS-CoV-2病毒中和试验技术平台,验证所表达抗体的功能,并综合分析全球不同来源的SARS-CoV-2病毒RBD基因序列,选择对S蛋白传播力与毒力影响较大的突变位点,分别构建不同的强效假病毒;
其中在上述步骤十三中,将步骤九中得到的抗体与强效假病毒在96孔板中共孵育,并加入HAE细胞,裂解细胞,检测荧光素酶活性,根据50%抑制浓度检测抗体中和活性,再利用不同的强效假病毒与抗体共同孵育,对抗体中和能力的强弱和广度进行鉴定,挑选出强中和活性抗体;
其中在上述步骤十四中,对步骤十中得到的强结合性抗体、步骤十一中得到的强阻断性抗体和步骤十三中得到的强中和活性抗体的编码基因序列进行生物信息学分析,比较不同的抗体在不同SARS-CoV-2患者体内的比例,分析不同抗体对SARS-CoV-2感染及疾病转归的影响,进而在步骤就中得到的抗体中挑选出具有强保护作用的强结合阻断中和活性抗体;
其中在上述步骤十五中,将步骤十四中得到的强结合阻断中和活性抗体的抗体序列与RBD蛋白的抗原序列输入Discovery Studio软件系统,并与NCBI晶体库模型比对,选择与目标序列相似度最高的晶体结构,进行同源建模,再通过ZDOCK软件程序对RBD蛋白分子进行柔性对接,使用RDOCK将对接结果优化,并通过计算RBD蛋白与抗体结合表位,选取关键氨基酸的突变位点;
其中在上述步骤十六中,根据十五中得到的突变位点,利用重叠PCR原理设计引物,对强结合阻断中和活性抗体的不同突变位点进行突变,以步骤八中得到的抗体表达质粒为模板,利用引物对每个突变位点分别进行PCR扩增,得到突变扩增产物;
其中在上述步骤十七中,利用双酶切法,对步骤十六中得到的突变扩增产物进行酶切,连接并转化到DH5α感受态细胞中,将突变抗体基因分别克隆到相应的表达载体上,再挑选菌落并提取突变抗体表达质粒,将相应的表达载体共转染到293F细胞上,接着收集上清液,得到转染上清液,使用Protein A柱纯化抗体,并通过SDS-PAGE凝胶电泳方法验证抗体表达情况,挑选出突变表达抗体,利用ELISA法进行亲和力分析,对比分析同浓度的突变表达抗体与RBD抗原的相互作用,得出突变表达抗体的亲和力值,再通过不断突变与筛选,优化高亲和力抗体表达工艺,即得SARS-CoV-2人源性高亲和力单克隆抗体。
根据上述技术方案,所述步骤一中,入选标准为签署书面知情同意、年满18岁且小于85岁、符合新型冠状病毒肺炎的诊断标准、经治疗后康复出院的康复期在14天至3个月以内的患者。
根据上述技术方案,所述步骤四中,BD FACSAria为高速流式细胞分选仪。
根据上述技术方案,所述步骤七中,重链为H链和L链,轻链为κ链和λ链。
根据上述技术方案,所述步骤九中,BCA法为BCA工作试剂蛋白质定量法。
根据上述技术方案,所述步骤九中,SDS-PAGE凝胶电泳方法为聚丙烯酰胺凝胶电泳方法。
根据上述技术方案,所述步骤十二中,对照选择编码VSV.G包膜蛋白的质粒pMD.G、HIV慢病毒包装质粒pBS-CMV-gag/pol和转移质粒pCMV-EGFP。
与现有技术相比,本发明所达到的有益效果是:该发明通过分离SARS-CoV-2康复患者外周血的血清和PBMC,进行CD19+B细胞的富集、B细胞体外培养,成功获得SARS-CoV-2RBD蛋白特异性B细胞,且通过单细胞测序筛选出四个单克隆抗体对应的重轻链序列,构建真核表达体系和功能验证体系,选定抗体基因突变位点,重叠PCR扩增纯化出单克隆抗体,并优化高亲和力抗体表达工艺,从而提高了单克隆抗体的抗体亲和力与中和活性。
附图说明
附图用来提供对本发明的进一步理解,并且构成说明书的一部分,与本发明的实施例一起用于解释本发明,并不构成对本发明的限制。在附图中:
图1是本发明的方法流程图。
具体实施方式
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
请参阅图1,本发明提供一种技术方案:新型人源性单克隆中和性抗体XG-81与XG-83的制备方法,包括以下步骤:步骤一,标本采集;步骤二,标本分离;步骤三,滴度检测;步骤四,细胞分离;步骤五,铺板培养;步骤六,细胞筛选;步骤七,序列合成;步骤八,载体构建;步骤九,真核表达;步骤十,结合鉴定;步骤十一,阻断鉴定;步骤十二,病毒构建;步骤十三,中和鉴定;步骤十四,特性筛选;步骤十五,位点选定;步骤十六,突变扩增;步骤十七,抗体优化;
其中在上述步骤一中,根据入选标准招募20名康复期患者,入选标准为签署书面知情同意、年满18岁且小于85岁、符合新型冠状病毒肺炎的诊断标准、经治疗后康复出院的康复期在14天至3个月以内的患者,并采用非干预性研究方法,对前来复诊的康复期患者每人一次性抽取外周血30mL,得到外周血标本;
其中在上述步骤二中,将步骤一中得到的外周血标本加入人外周血淋巴细胞分离液中,通过梯度离心法,分离出血清标本和PBMC标本;
其中在上述步骤三中,通过化学发光法对步骤二中得到的血清标本进行抗RBD抗体IgG滴度,并利用竞争ELISA法检测血清阻断病毒S蛋白RBD与宿主细胞受体ACE2结合的能力,筛选出高IgG滴度且有阻断能力的血清标本,再以血清标本所对应的PBMC标本作为分离标本;
其中在上述步骤四中,将步骤三中选出的分离标本进行充分悬置,通过CD19+磁珠在磁场中进行细胞分离,并利用BD FACSAria去除分离标本中IgM+、IgD+和IgA+的B细胞,BDFACSAria为高速流式细胞分选仪,筛选出IgG+的记忆B细胞,再对IgG+的记忆B细胞进行流式检测,得到纯度超过90%的CD19+IgG+B细胞;
其中在上述步骤五中,对步骤四中得到的CD19+IgG+B细胞进行计数,并用含有IL-2、IL-21等细胞因子和3T3-msCD40L饲养细胞的培养基重悬,再按照每孔2个CD19+IgG+B细胞的密度,加入到348孔板中,置于孵箱中培养14天,得到细胞培养液;
其中在上述步骤六中,对步骤五中得到的细胞培养液进行上清液收集,利用化学发光法检测上清液中抗SARS-CoV-2病毒RBD抗体IgG的含量,并根据所得IgG浓度判断CD19+IgG+B细胞的活性和功能,再筛选出阳性孔中具有RBD特异性的CD19+IgG+B细胞的细胞培养液,作为表达B细胞;
其中在上述步骤七中,对步骤六中得到的表达B细胞进行总RNA提取,并以mRNA为模板反转录得到cDNA,再设计重链Fab段的通用性引物,进行PCR扩增,并通过高通量测序方法分析出抗体序列信息,接着设计重链Fab段或轻链Fab段的特异性引物,重链为H链和L链,轻链为κ链和λ链,进行巢式PCR扩增,合成抗体基因组,并通过琼脂糖凝胶电泳方法鉴定并回收目的基因片段,得到具有SARS-CoV-2抗体H和L链基因序列的扩增产物;
其中在上述步骤八中,通过双酶切法对步骤七中得到的扩增产物进行酶切,连接并转化到DH5α感受态细胞中,将抗体基因分别克隆到相应的表达载体上,再挑选菌落并提取抗体表达质粒,得到具有SARS-CoV-2抗体重轻链的抗体真核表达载体;
其中在上述步骤九中,将步骤八中得到的抗体真核表达载体共转染到293F细胞上,收集上清液,得到转染上清液,并使用Protein A重力柱从转染上清液中纯化抗体,再利用BCA法测定抗体中的蛋白浓度,BCA法为BCA工作试剂蛋白质定量法,并通过SDS-PAGE凝胶电泳方法验证抗体表达情况,SDS-PAGE凝胶电泳方法为聚丙烯酰胺凝胶电泳方法,筛选出高蛋白浓度的抗体;
其中在上述步骤十中,利用重组表达的病毒RBD蛋白包被免疫板,并加入适量步骤九中得到的抗体和进行孵育,并设置对照,再加入偶联辣根过氧化物酶的抗人二抗进行孵育,并使用酶标仪测量OD450值,对抗体结合能力鉴定,挑选出强结合性抗体;
其中在上述步骤十一中,使用ACE2包被96孔板,将步骤九中得到的抗体与RBD蛋白孵育后加入,并设置阴性对照,再加入辣根过氧化物酶偶联的抗人二抗,孵育完成后加底物显色,酶标仪下测量吸光度,在吸光值低的样本中挑选出强阻断性抗体;
其中在上述步骤十二中,将高效表达SARS-CoV-2密码子优化后S蛋白的真核表达质粒pCMV-SARS-CoV-2、HIV慢病毒包装质粒pBS-CMV-gag/pol和转移质粒pCMV-EGFP三个质粒载体共转染到293F细胞上,包装成SARS-CoV-2假病毒,并设置对照,对照选择编码VSV.G包膜蛋白的质粒pMD.G、HIV慢病毒包装质粒pBS-CMV-gag/pol和转移质粒pCMV-EGFP,再通过SARS-CoV-2假病毒感染的人呼吸道上皮细胞HAE中标记基因EGFP表达的分析,确定SARS-CoV-2假病毒能有效进入细胞,建立可在BSL-2级实验室操作的SARS-CoV-2病毒中和试验技术平台,验证所表达抗体的功能,并综合分析全球不同来源的SARS-CoV-2病毒RBD基因序列,选择对S蛋白传播力与毒力影响较大的突变位点,分别构建不同的强效假病毒;
其中在上述步骤十三中,将步骤九中得到的抗体与强效假病毒在96孔板中共孵育,并加入HAE细胞,裂解细胞,检测荧光素酶活性,根据50%抑制浓度检测抗体中和活性,再利用不同的强效假病毒与抗体共同孵育,对抗体中和能力的强弱和广度进行鉴定,挑选出强中和活性抗体;
其中在上述步骤十四中,对步骤十中得到的强结合性抗体、步骤十一中得到的强阻断性抗体和步骤十三中得到的强中和活性抗体的编码基因序列进行生物信息学分析,比较不同的抗体在不同SARS-CoV-2患者体内的比例,分析不同抗体对SARS-CoV-2感染及疾病转归的影响,进而在步骤就中得到的抗体中挑选出具有强保护作用的强结合阻断中和活性抗体;
其中在上述步骤十五中,将步骤十四中得到的强结合阻断中和活性抗体的抗体序列与RBD蛋白的抗原序列输入Discovery Studio软件系统,并与NCBI晶体库模型比对,选择与目标序列相似度最高的晶体结构,进行同源建模,再通过ZDOCK软件程序对RBD蛋白分子进行柔性对接,使用RDOCK将对接结果优化,并通过计算RBD蛋白与抗体结合表位,选取关键氨基酸的突变位点;
其中在上述步骤十六中,根据十五中得到的突变位点,利用重叠PCR原理设计引物,对强结合阻断中和活性抗体的不同突变位点进行突变,以步骤八中得到的抗体表达质粒为模板,利用引物对每个突变位点分别进行PCR扩增,得到突变扩增产物;
其中在上述步骤十七中,利用双酶切法,对步骤十六中得到的突变扩增产物进行酶切,连接并转化到DH5α感受态细胞中,将突变抗体基因分别克隆到相应的表达载体上,再挑选菌落并提取突变抗体表达质粒,将相应的表达载体共转染到293F细胞上,接着收集上清液,得到转染上清液,使用Protein A柱纯化抗体,并通过SDS-PAGE凝胶电泳方法验证抗体表达情况,挑选出突变表达抗体,利用ELISA法进行亲和力分析,对比分析同浓度的突变表达抗体与RBD抗原的相互作用,得出突变表达抗体的亲和力值,再通过不断突变与筛选,优化高亲和力抗体表达工艺,即得SARS-CoV-2人源性高亲和力单克隆抗体。
基于上述,本发明的优点在于,本发明通过分离SARS-CoV-2康复患者外周血的血清和PBMC,进行CD19+B细胞的富集、B细胞体外培养,成功获得SARS-CoV-2RBD蛋白特异性B细胞,单细胞测序筛选到四个单克隆抗体对应的重轻链序列,构建真核表达体系和功能验证体系,选定抗体基因突变位点,重叠PCR扩增纯化出单克隆抗体,并优化高亲和力抗体表达工艺,从而提高了单克隆抗体的抗体亲和力与中和活性。
需要说明的是,在本文中,诸如第一和第二等之类的关系术语仅仅用来将一个实体或者操作与另一个实体或操作区分开来,而不一定要求或者暗示这些实体或操作之间存在任何这种实际的关系或者顺序。而且,术语“包括”、“包含”或者其任何其他变体意在涵盖非排他性的包含,从而使得包括一系列要素的过程、方法、物品或者设备不仅包括那些要素,而且还包括没有明确列出的其他要素,或者是还包括为这种过程、方法、物品或者设备所固有的要素。
最后应说明的是:以上所述仅为本发明的优选实施例而已,并不用于限制本发明,尽管参照前述实施例对本发明进行了详细的说明,对于本领域的技术人员来说,其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 新型人源性单克隆中和性抗体XG-81与XG-83的制备方法
- 一种人源抗新型冠状病毒(SARS-CoV-2)的中和活性单克隆抗体
