一种骨髓间充质干细胞外泌体及其制备方法和应用
文献发布时间:2023-06-19 13:49:36
技术领域
本发明涉及外泌体类生物制剂技术领域,具体涉及一种骨髓间充质干细胞外泌体及其制备方法和应用。
背景技术
外泌体(exosomes)是一种机体内大多数细胞分泌的微小囊泡,直径约为30-150nm,具有脂质双分子层膜结构,通过“内吞-融合-外排”的生理过程产生。从首次发现外泌体至今,已有30多年的历史,外泌体最初被认为是细胞的“垃圾”,是细胞排泄废物的一种方式。但是经过大量研究发现,外泌体和微囊泡、凋亡小体明显不同,有鲜明的特点和潜在价值,外泌体已逐步成为科研热点。外泌体是作为天然的胞间信息载体,分子结构较小且生物相容性好,且与干细胞治疗相比不存在伦理问题,具有将其开发成具有治疗效果的生物制剂或者药物的潜能。
腱骨结合部位于肌腱和骨之间,是力学过渡的关键结构,但是腱骨结合部由于组织结构复杂,损伤后难以恢复到正常组织结构和正常功能。特别是,在前叉、后叉韧带损伤、肩袖损伤后的手术治疗中通常会以肌腱替代韧带,并通过构建骨髓道将肌腱与骨连接起来,但是肌腱与骨髓道之间的愈合困难。因此,如何促进早期腱骨愈合强度是急需解决的关键问题,目前尚缺少具有上述功能且具有良好生物相容性和生物利用度的药物。
发明内容
本发明意在提供一种骨髓间充质干细胞外泌体的制备方法,以解决缺少具有促进腱骨愈合功能且具有良好生物相容性的药物的技术问题。
为达到上述目的,本发明采用如下技术方案:
一种骨髓间充质干细胞外泌体的制备方法,包括以下依次进行的步骤:
S1:制备过表达Scleraxis蛋白的骨髓间充质干细胞,获得BMMSC
S2:刺激所述BMMSC
本方案还提出了一种骨髓间充质干细胞外泌体,其由过表达Scleraxis蛋白的骨髓间充质干细胞分泌获得。
本方案还提出了一种骨髓间充质干细胞外泌体在制备促进腱骨愈合的药物中的应用。
采用上述技术方案的原理以及有益效果:
本方案使用基因工程技术改造骨髓间充质干细胞,在该细胞中过表达scleraxis蛋白,再诱导经过基因工程改造的骨髓间充质干细胞大量分泌外泌体,上述外泌体具有效促进腱骨愈合的作用。该外泌体可以作为一种促进腱骨愈合的生物制剂应用于医疗实践中。Scleraxis(Scx)是肌腱特异性的标记基因,在肌腱组织和细胞中特异表达。在本技术方案中,发明人通过大量实验研究发现,在骨髓间充质干细胞过表达Scleraxis蛋白,Scleraxis蛋白可以改变骨髓间充质干细胞的外泌体中的microRNA的种类以及含量,使得有利于腱骨愈合的microRNA得到富集,从而实现了增强疗效的作用。
本方案首次发现了Scleraxis蛋白具有诱导与腱骨愈合相关的microRNA大量表达的作用,并利用该现象大量制备具有治疗功效的外泌体。外泌体药物相对于传统药物具有显著优势,其体现在:外泌体是作为天然的胞间信息载体,分子结构较小且生物相容性好;相对于普通药物,外泌体的生物利用度高且靶向性好。本方案研发的促进腱骨愈合的外泌体类生物制剂,相对于直接使用Scleraxis蛋白进行治疗,具有更理想的应用前景。
进一步,在S1中,所述Scleraxis蛋白的基因序列如SEQ ID NO.1所示。
Scleraxis蛋白是一种转录因子,其在肌腱发生、分化和再生起了重要的作用。本方案采用过表达该蛋白的细胞来制备外泌体,获得的外泌体中与腱骨愈合相关的microRNA的含量得到了显著提升。
进一步,在S1中,采用慢病毒感染的方法构建过表达Scleraxis蛋白的骨髓间充质干细胞。
慢病毒感染制备转基因细胞的方法是现有技术常规的制备过表达目的蛋白的细胞株系的方法,该方法原理明确、技术成熟且易操作,用此法可以制备出稳定的表达Scleraxis蛋白的骨髓间充质干细胞的细胞株系。
进一步,慢病毒感染的方法的操作过程如下:使用SCX病毒悬液感染骨髓间充质干细胞;所述SCX病毒悬液的制备方法为:接种293T细胞,并使用DMEM培养基将293T细胞培养至细胞密度为70%-80%;在DMEM培养基中加入转染体系,转染过程持续10-12h;所述转染体系包括整合有SCX基因的质粒。上述过程为病毒悬液和慢病毒感染的常规方式,操作简便且结果可靠。
进一步,将SCX基因整合在PGMLV-CMV-MCS-ZsGreen1-T2A-Blasticidin上,获得整合有SCX基因的质粒。PGMLV-CMV-MCS-ZsGreen1-T2A-Blasticidin为现有技术中常规空载质粒,易于获取和操作。
进一步,在S2中,使用CORNING DMEM/F12培养基培养BMMSC-SCX细胞至细胞密度为80%;将CORNING DMEM/F12培养基更换为无外泌体血清培养基,继续培养至细胞密度达到90-100%,然后收取细胞上清液。刺激细胞分泌外泌体的技术成熟,采用上述方法可以稳定地获取大量细胞外泌体。
进一步,在S2中,通过梯度离心的方法从所述细胞上清液中提取外泌体。梯度离心法是获取外泌体的常规方法,可稳定获取外泌体且操作简单。
进一步,一种骨髓间充质干细胞外泌体,其含有序列如SEQ ID NO.2所示的microRNA。
经过microRNA表达谱分析,发现按照本方案制备的外泌体中的microRNA的种类和表达量发生较大变化。其中,mir-6924-5p的功能在现有技术中并未有过报道,但在本次研究中发现其在scleraxis蛋白过表达的情况下产生的外泌体中大量富集,并且实验证明这种microRNA具有非常显著地促进肌腱组织和骨组织之间的愈合的功效。
附图说明
图1为实施例1的P0代BMMSC的显微图。
图2为实施例1的P3代BMMSC的显微图。
图3为实施例1的BMMSC的流式细胞术检测结果图。
图4为实施例1的BMMSC的免疫荧光检测结果图。
图5为实施例1的WB检测SCX基因表达结果图。
图6为实施例1的转染后细胞激光共聚焦鉴定结果。
图7为实施例1的细胞转染后荧光图像。
图8为实施例1的WB鉴定转染后细胞蛋白表达量的实验结果。
图9为实施例1的三种细胞成骨分化实验结果。
图10为实施例1的三种细胞成腱分化实验结果。
图11为实施例1的三种细胞成软骨球分化实验结果。
图12为实施例1的三种细胞成脂分化实验结果。
图13为实施例1的三种细胞凋亡流式分析结果。
图14为实施例1的三种细胞增殖BRDU流式分析结果。
图15为实施例2的三种外泌体的粒径鉴定图。
图16为实施例2的三种外泌体的电镜鉴定图。
图17为实施例2的三种外泌体的WB鉴定图。
图18为实施例3的BMMSC
图19为实施例3的BMMSC
图20为实施例3的BMMSC
图21为实施例3的BMMSC
图22为实施例3的BMMSC
图23为本发明实施例4的小鼠腱骨愈合模型的手术步骤及示意图。
图24为本发明实施例4的体内细胞治疗的实验结果。
图25为本发明实施例4的体内外泌体治疗的实验结果。
图26为本发明实施例5的mir-6924-5p的治疗后相关基因表达情况(RT-PCR结果)。
图27为本发明实施例5的双荧光素酶报告系统验证miR-6924-5p的靶基因结合位点的实验结果。
图28为本发明实施例5的mir-6924-5p作用通路研究实验结果图。
图29为本发明实施例6的agomir-6924-5p治疗的TRAP染色和番红固绿染色图像。
图30为本发明实施例6的agomir-6924-5p治疗的生物力学实验结果统计图。
图31为本发明实施例7的三组BMMSCs的条件培养基对破骨细胞的影响的研究结果。
图32为本发明实施例7的BMMSC
图33为本发明实施例7的可溶性因子和外泌体的作用效果研究结果。
图34为本发明实施例7的三种BMMSCs来源的外泌体的体外诱导破骨细胞分化的研究结果。
图35为本发明实施例8的mir-6924-5p的富集情况的研究结果。
图36为本发明实施例8的mir-6924-5p对人源破骨细胞的抑制作用的研究。
图37为本发明实施例8的mir-6924-5p在BMMSC
具体实施方式
下面结合实施例对本发明做进一步详细的说明,但本发明的实施方式不限于此。若未特别指明,下述实施例所用的技术手段为本领域技术人员所熟知的常规手段;所用的实验方法均为常规方法;所用的材料、试剂等,均可从商业途径得到。
实施例1:制备scleraxis蛋白的过表达的骨髓间充质干细胞(BMMSC)
一、原代BMMSC的提取
使用现有技术的全骨髓粘附方法分离和培养BMMSC,参见现有技术文献Isolationof mouse mesenchymal stem cells on the basis of expression of Sca-1 andPDGFR-a,Diarmaid D Houlihan1,Nature Protocols,2012,7(12):2103-2111.(DOI:10.1038/nprot.2012.125)。具体的过程详见该文献2105-2109页中“PROCEDURE”中的详细描述,由于该步骤为现有技术中的常规方式,所以在此不做赘述。P1代细胞图像参见图1,P3代细胞图像参见图2。流式细胞术检测显示分离的细胞高表达两种阳性干细胞标记物CD44和CD90,结果如图3所示。免疫荧光检测BMMSC表面标志物的表达情况,结果如图4所示。
二、SCX病毒悬液的制备
本部分的SCX病毒悬液委托有资质的生物技术公司制备,具体过程如下:
1)构建整合SCX基因的质粒:
SCX基因序列如SEQ ID NO.1所示,其转录本号为NM_198885.3。
将SCX基因按照现有技术中的常规手段整合在PGMLV-CMV-MCS-ZsGreen1-T2A-Blasticidin(空载体)中,获得目的基因过表达载体。更具体的过程为:通过目的片段两端所含酶切位点(XhoI-ctcgag/BamHI-ggatcc)将目的片段切出,将其连入同样经过酶切后的过表达载体PGMLV-CMV-MCS-ZsGreen1-T2A-Blasticidin上;将连接产物转入制备好的细菌感受态细胞,对长出的单克隆菌落进行测序,比对正确的克隆即为构建成功的目的基因过表达载体。本方案通过Western Blot方法检测目的基因的表达,实验结果如图5所示(ECL试剂盒显色和X光显影),S1为空白对照,S2为阴性对照(PGMLV-CMV-MCS-eGFP-T2A-Blasticidin),S3为转染目的基因过表达载体的实验组(PGMLV-CMV-SCX-eGFP-T2A-Blasticidin),通过实验结果可知,目的基因过表达载体构建成功,可大量表达目的蛋白。
2)病毒包装
采用现有技术的常规方法,抽提高纯度、无内毒素的慢病毒载体及其辅助包装原件载体质粒(gag/pol;rev;VSV-G),使用HG transgene reagent将构建好的慢病毒载体及其辅助包装原件载体质粒共转染进293T细胞,转染10-12h后加Enhancing buffer,接着8h后更换新鲜培养基,继续培养48h后,收集富含慢病毒颗粒的细胞上清液,对其浓缩后得到高滴度的慢病毒浓缩液。包装质粒的类型为gag/pol;rev;VSV-G(pHelper 1.0 includinggag/pol and pHelper 2.0 including VSVG/pHelper 3.0 including rev)。慢病毒的包装细胞为293T,为贴壁依赖型成上皮样细胞,生长培养基为DMEM(含10%FBS)。贴壁细胞经培养生长增殖形成单层细胞。
转染前一天,将已经长好的细胞以合适的比例传代到10cm培养皿中,当细胞长到70%-80%时准备转染。转染前1-2h将需要转染的细胞换新鲜的培养基,12ml/10cm皿。取无菌的1.5ml EP管或15ml离心管,配制转染体系(DMEM 1ml、质粒10μg、Lenti-HG Mix 10μl(10μg)、HG transgene reagent 60μl)。混匀后,室温放置15min-20min后,均匀滴加到提前换过液的培养皿中,后置于CO
三、慢病毒感染
BMMSC细胞常规培养,至70%左右传代,计数铺6孔板,15-20万/孔,培养24h;按每个细胞5个病毒的比例加入SCX病毒悬液,感染细胞48h;镜下观察,细胞可见绿色荧光;消化细胞,用含2μg/ml杀稻瘟菌素(blasticidin)的完全培养基培养;每三天换含2μg/ml杀稻瘟菌素(blasticidin)的完全培养基,细胞扩增起来后消化细胞,计数,按1个/孔铺96孔板,用含2μg/ml杀稻瘟菌素(blasticidin)的完全培养基常规培养约2周;镜下挑选出只有一个克隆团的孔,消化下细胞,转移至6孔板用含2μg/ml杀稻瘟菌素(blasticidin)的完全培养基培养(取3个);等细胞长至70%左右,传至培养瓶,用含2μg/ml杀稻瘟菌素(blasticidin)的完全培养基常规培养,传代,冻存;同时收取蛋白进行WB检测,鉴定出强阳细胞株;用此感染细胞作后续细胞实验;感染细胞即过表达scleraxis蛋白的BMMSC细胞(称为BMMSC
对BMMSC细胞、BMMSC
对BMMSC细胞、BMMSC
实施例2:外泌体的制备
一、收取细胞上清液
使用CORNING DMEM/F12培养基(50/50,1×,Mediatech 10-092-CVR)复苏BMMSC细胞(未进行慢病毒感染的细胞)、BMMSC
二、提取及制备外泌体
将样本取出,25℃水浴解冻,冰上放置;4℃,2,000×g,离心10min,取上清;4℃,10,000×g,离心30min,取上清;样本转移至超高速离心管中,4℃,110,000×g,离心75min,弃上清;用1mL1×PBS重悬沉淀,重悬后各用1×PBS稀释,0.22μm膜过滤;样本转移至超高速离心管,4℃,110,000×g,离心75min,弃上清;沉淀用相应的1×PBS重悬,分装,-80℃保存。获得BMMSC细胞(未进行慢病毒感染)、BMMSC-NC细胞和BMMSC-SCX细胞的外泌体(分别为BMMSC-exos、BMMSC
实施例3:
对实施例2中制备的外泌体进行mirRNA的表达谱分析,此部分委托有资质的生物技术公司进行。BMMSC
还比较了BMMSC
实施例4:体内实验研究
一、构建腱骨愈合模型
构建骨髓道:0.5%的戊巴比妥钠麻醉小鼠,然后将右后肢跟腱前方皮肤切开,显露并游离跟腱(见图23左1),将取下的跟腱放在加入PBS冰盒上的细菌培养皿中保存。然后在右后肢膝盖前方做纵切口,用1mL的注射器针头垂直于胫骨轴,从胫骨干近端前内侧向后外侧钻孔,构建骨髓道(将图23左2)。
药物治疗:将药物溶液缓慢注射至骨髓道中,注意避免溶液漏出,等待2-3min,待溶液完全被周围骨质吸收。在本实施例中,药物溶液采用了空白对照(具体为PBS)、BMMSC细胞悬液(细胞密度为10
构建腱骨愈合模型:将PBS中保存的跟腱一端用缝线标记,通过牵拉缝线将跟腱穿过骨髓道,跟腱两端分别固定在周围骨膜上(图23右1)。
一、生物力学测试实验
造模后21天,使用现有的生物力学测试仪操进行动物标本测试。按照生物力学测试仪说明书进行操作,测试肌腱-骨恢复强度。具体操作为:取下新鲜胫骨标本浸泡在冰盒细胞培养皿的PBS中,剪断跟腱两端的缝线,游离跟腱附着部。然后将跟腱一端固定在生物力学测试机上,以骨髓道纵轴方向按照0.05mm/s的速度持续牵拉跟腱。拔出力为跟腱完全拔出时的最大力或跟腱断裂时的力。然后计算腱骨愈合强度:拔出力(N)/骨髓道长度(mm)。
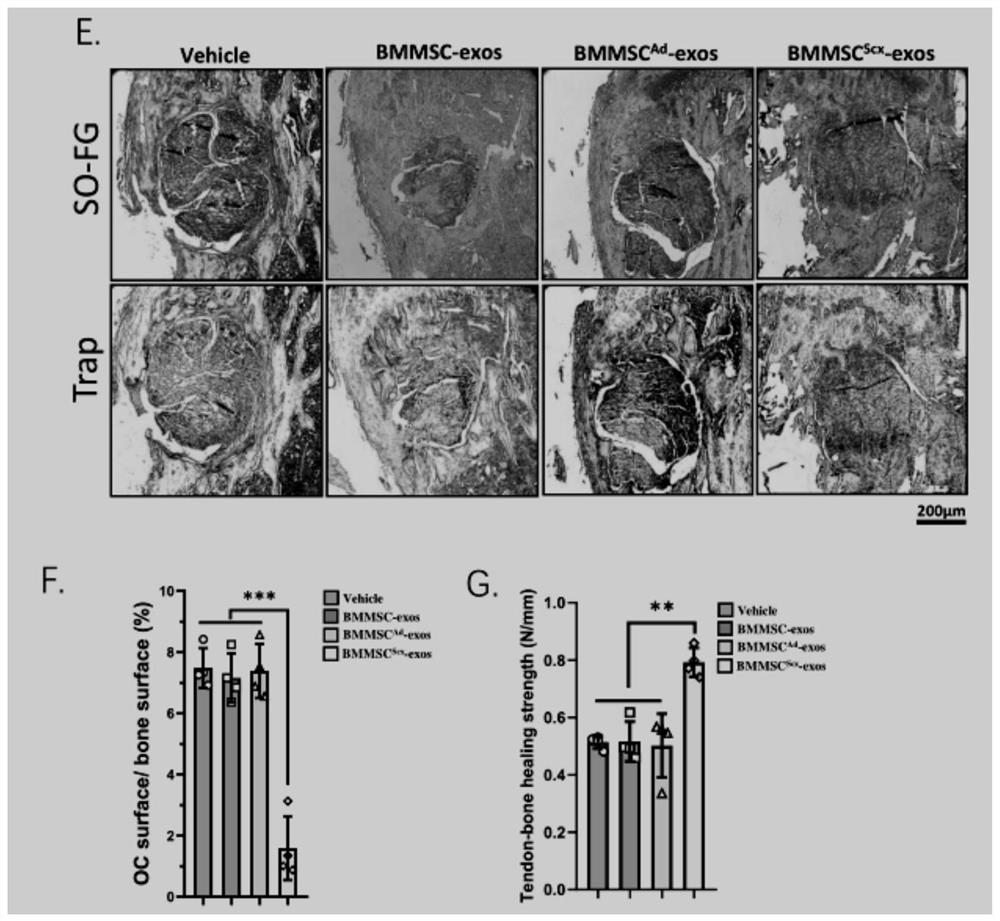
腱骨愈合情况实验结果如图24C和图25G所示。在图24C中,数据统计柱从左到右依次为:空白对照、BMMSC细胞悬液、BMMSC
二、组织染色实验
造模后14天,收集胫骨样本,用4%多聚甲醛固定48小时,然后用EDTA脱钙业脱钙10天,并制作石蜡切片。
TRAP染色:通过TRAP染色观察外泌体治疗对骨髓道周围骨质中破骨细胞激活的影响,将切片用二甲苯脱蜡,并在梯度酒精中复水,PBS洗去酒精。用0.5mL TRAP染色液覆盖切片上的组织样本,室温孵育30分钟。用PBS洗去多余染液,然后在0.1M AMPD-HCl缓冲液浸泡切片10分钟。
番红固绿染色:通过番红固绿染色观察骨小梁面积,用0.1%番红溶液浸泡3min,然后在0.1%固绿溶液中浸泡10秒,然后用1%醋酸溶液分色,洗去多余溶液后封片观察。
TRAP染色和番红固绿染色实验结果如图24A和图25E所示,TRAP阳性的面积比总骨小梁面积统计结果参见图24B和图25F。图24A展示了细胞治疗的实验结果,组织化学分析显示骨溶解在用骨髓间充质干细胞治疗后被阻止(图24A上,番红固绿染色)。图25E展示了外泌体治疗的实验结果,组织化学分析显示骨溶解在用外泌体治疗后被阻止(图25E上,番红固绿染色)。因为破骨细胞负责腱-骨愈合过程中的骨溶解,我们检测了破骨细胞在体内的状态。TRAP染色显示(图24A和B),BMMSC
实施例5:
1.mir-6924-5p的作用靶点研究
本方案使用的mir-6924-5p的序列为3’-UGAAGCGGUUUAGGGGUAGGAGA-5’(SEQ IDNO.2),转染后,mir-6924-5p在小鼠原代破骨前体细胞中的表达量上调,检测小鼠破骨前体细胞中的基因表达情况。小鼠原代破骨前体细胞的提取方法为取将骨髓从小鼠骨髓腔冲洗出来,并种植在24孔板中。细胞培养于完全培养基中(10%FBS,1%双抗,α-minimalessential medium(MEM)培养基),同时加入M-CSF(巨噬细胞集落刺激因子)刺激24h。然后将悬浮细胞转移至新的细胞培养板,用M-CSF(50ng/mL)和RANKL(50ng/mL)刺激。每两天更换一次培养基,经培养获得小鼠原代破骨前体细胞。
(1)转染:将小鼠原代破骨前体细胞中的mir-6924-5p上调的方法是使用agomiR-6924-5p(上海吉玛公司合成)转染小鼠破骨前体细胞,agomiR-6924-5p是现有技术中常规的用于提升细胞内源mir-6924-5p水平的核酸。agomiR-6924-5p为互补的双链结构,包括序列如SEQ ID NO.3所示的正义链和序列如SEQ ID NO.4所示的反义链,具体如下:
正义链:5’-ACACTCCAGCTGGGAGAGGATGGGGATTTGG-3’(SEQ ID NO.3);
反义链:5’-TGGTGTCGTGGAGTCG-3’(SEQ ID NO.4)。
更具体为:将agomiR-6924-5p(浓度0.06OD)或对照品(agomir N.C,为通用随机对照,来源于商业途径)与转染试剂INVI DNA RNA Transfection reagent混合15min,agomiR-6924-5p或对照品与INVI DNA RNA Transfection reagent的体积比为1:1,获得混合试剂。小鼠原代破骨前体细胞在α-minimal essential medium(MEM)培养基中,按照现有技术常规形式进行体外培养,然后将混合试剂加入到细胞培养基中,混合试剂的加入量为15μL。在37℃细胞培养箱中孵育24h。24h后,吸弃培养基,更换为新鲜培养基继续培养24h,取细胞获得转染后的细胞样本。
(2)RT-PCR检测:收集转染后的细胞样本,用TRIzol处理样本,按照现有技术的常规方法提取总RNA,并逆转录为cDNA,然后以GAPDH为内参,检测上述预测靶基因的mRNA水平。通过三种miRNA靶基因预测的数据库筛查miR-6924-5p的潜在靶基因,获得大量的候选靶基因(116个)。然后通过转染agomiR-6924-5p到破骨前体细胞中,使用PCR法检测这些待确定的靶基因是否表现出表达量明显降低的现象。实验结果如图26(mean±SD,n=3)所示,由实验结果可知,在细胞内过表达mir-6924-5p,小鼠破骨前体细胞的OCSTAMP、CXCL12以及PRLR的表达水平显著降低,提示这三种基因可能是miR-6924-5p的潜在靶基因。
OCSTAMP(osteoclast stimulatory trans-membrane protein)是在破骨细胞中发现的新基因,其在单核细胞分化为破骨细胞的过程中表达被上调。OCSTAMP的基因表达产物在其羧基末端保守,它的主要作用是作为破骨细胞的融合和分化过程中的关键分子。OCSTAMP基因表达的上调会促进破骨细胞形成,并对腱骨愈合形成抑制。趋化因子CXCL12(chemokine(C-X-C motif)ligand 12)又称基质细胞衍生因子-1(SDF-1),是小分子的细胞因子。CXCL12过表达可促进破骨前体细胞的分化。催乳素受体(Prolactin Receptor,PRLR)在乳腺癌的骨转移中可调控破骨细胞的活化。
2.双荧光素酶报告系统验证
构建目的质粒m-Cxcl12-3UTR、m-OCSTAMP-3UTR、m-PRLR-3UTR,构建方法为:将Cxcl12的3’UTR的片段(野生型wt以及突变型mut)、OCSTAMP的3’UTR片段(野生型wt以及突变型mut)、PRLR的3’UTR片段(野生型wt以及突变型mut),按照现有技术中的常规方法,分别整合在空载质粒pSI-Check2上,获得六种目的质粒。
将293T细胞接种于96孔板中,待细胞密度达到50%-70%进行转染。将10ul DMEM与0.16ug的目的质粒以及5pmol的agomiR-6924-5p(或者阴性对照,agomir N.C)充分混匀后室温放置(溶液A),之后将10ul DMEM与0.3ul的转染试剂(转染试剂为汉恒生物产品,浓度为0.8mg/ml)充分混匀(溶液B),室温放置5min。将溶液A与溶液B充分混匀,室温放置20min,获得转染混合物。转染前为细胞换取新鲜培养基,之后将A和B的转染混合物加入混匀。37℃,5%CO
将5×PLB(Passive Lysis Buffer)用蒸馏水稀释至1×PLB,以96孔板每孔100μl的量加入,用移液枪吹打打散细胞,置于室温摇床上缓慢摇15min后,将细胞裂解液吸至1.5ml离心管,4℃、12000rpm离心10min,取上清移入新的离心管。新的96孔板中加入Luciferase Assay Reagent II(LAR II)(Luciferase Assay Reagent,Promega)工作液100μl,再加入20μl细胞裂解液,移液枪吹打混匀2-3次,测定记录萤火虫荧光素酶(Fireflyluciferase)值,此值为内参值。加入100μl终止液(Stop&
3.mir-6924-5p作用通路研究
接下来,我们检测过表达OCSTAMP或CXCL12是否可以逆转mir-6924-5p对破骨细胞形成的抑制作用。我们首先证实含有OCSTAMP(OCSTAMP质粒)或CXCL12(CXCL12质粒)基因的质粒转染后,可以有效上调这两个基因的mRNA水平(图28A)。转染OCSTAMP质粒或CXCL12质粒后,将agomir-6924-5p转染到破骨细胞前体细胞(OCPs)中。TRAP活性检测显示agomir6924-5p可显著下调OCSTAMP质粒处理组和CXCL12质粒组的TRAP蛋白表达(图28B)。一致地,TRAP染色显示过表达这两个基因可以逆转mir-6924-5p对破骨细胞形成的影响(图28C和28D)。Real-time PCR分析显示,OCSTAMP质粒处理组和CXCL12质粒组转染agomir-6924-5p后,破骨生物标志物表达下调(图28E和28F)。这些数据表明,mir-6924-5p通过靶向OCSTAMP和CXCL12抑制破骨细胞的形成。
实施例6:mir-6924-5p体内实验研究
参照实验例4的实验方法进行体内实验,以验证mir-6924-5p的作用效果。实验分组包括:空白对照组、agomir-6924-5p组和agomir N.C组。治疗方法为:将agomir-6924-5p溶液(20μM,50μl)或者agomir N.C或者PBS缓慢注射至骨髓道中,注意避免溶液漏出,等待2-3min,待溶液完全被周围骨质吸收。组织染色实验结果如图29所示,TRAP染色展示了注射agomir-6924-5p后,骨髓道周围破骨细胞面积较对照组明显减少,骨溶解缓解;番红固绿染色展示了骨小梁面积,说明了agomir-6924-5p促进mir-6924-5p表达量上调,可以保留骨小梁,抑制骨溶解。
腱骨愈合强度实验结果如图30所示(mean±SD,n=4,agomir-6924-5p组和agomirN.C组存在显著差异,p<0.5),mir-6924-5p水平上调之后,可获得更大的腱骨结合部力学强度,有助于腱骨愈合的进程。
实施例7:BMMSC
为了探讨BMMSC
为了探索BMMSC
然后,我们比较了三种类型的BMMSCs来源的外泌体在体外诱导破骨细胞分化的能力。TRAP染色显示破骨细胞的数量,BMMSC
实施例8:mir-6924-5p抑制破骨细胞的体外实验研究
我们检测了三组BMMSCs中mir-6924-5p的水平,BMMSC
为了研究mir-6924-5p是否可能成为腱骨愈合的潜在治疗靶点,我们将agomir-6924-5p转染到破骨细胞前体细胞(人源),然后诱导成骨(使用M-CSF和RANKL诱导)。TRAP染色显示,与NC组相比,agomir-6924-5p处理组破骨细胞较少(图36A和B)。与阴性对照组相比,agomir-6924-5p处理组的破骨细胞生物标志物ACP5、CALCR、NFATc1和ITGB3的mRNA水平显著下调(图36C)。这些结果表明,mir-6924-5p也能有效地阻止人破骨细胞的形成。
我们探讨了mir-6924-5p在BMMSC
以上所述的仅是本发明的实施例,方案中公知的具体技术方案和/或特性等常识在此未作过多描述。应当指出,对于本领域的技术人员来说,在不脱离本发明技术方案的前提下,还可以作出若干变形和改进,这些也应该视为本发明的保护范围,这些都不会影响本发明实施的效果和专利的实用性。本申请要求的保护范围应当以其权利要求的内容为准,说明书中的具体实施方式等记载可以用于解释权利要求的内容。
SEQUENCE LISTING
<110> 中国人民解放军陆军军医大学第一附属医院
<120> 一种骨髓间充质干细胞外泌体及其制备方法和应用
<130> 2021.10.09
<160> 4
<170> PatentIn version 3.5
<210> 1
<211> 624
<212> DNA
<213> 人工序列
<400> 1
atgtccttcg ccatgctgcg ttcagcgccg ccgccgggtc gctacctgta ccctgaggtg 60
agcccgctgt cggaggatga ggaccgcgga agcgagagct cgggctccga cgagaaaccc 120
tgccgtgtgc atgctgcgcg ctgtggcctc cagggcgccc ggcggcgggc aggaggacgg 180
agggccgcgg gtagcgggcc aggacccggg gggcggccag gccgcgagcc ccggcagcgg 240
cacacagcga atgcgcgcga gcgggaccgc accaacagcg tgaacacggc cttcactgcg 300
ctgcgcacac tcatccccac cgagccagcg gaccgcaagc tctccaagat tgagacgctg 360
cgcctggcct ccagctacat ttctcacctg ggcaatgtgc tgctggtggg tgaggcctgt 420
ggcgacgggc aaccatgcca ctcgggaccc gctttcttcc acagcggtcg tgcgggcagc 480
ccactgccac cgccgccgcc gccaccacca ctggccagag acggcggcga gaacacccag 540
cccaaacaga tctgcacctt ctgcctcagc aaccagagaa agttgagcaa agaccgtgac 600
agaaagacgg cgattcgaag ttag 624
<210> 2
<211> 23
<212> RNA
<213> 人工序列
<400> 2
agaggauggg gauuuggcga agu 23
<210> 3
<211> 31
<212> DNA
<213> 人工序列
<400> 3
acactccagc tgggagagga tggggatttg g 31
<210> 4
<211> 16
<212> DNA
<213> 人工序列
<400> 4
tggtgtcgtg gagtcg 16
- 一种丹参饮刺激的骨髓间充质干细胞外泌体及其制备方法和应用
- 促进血管生成的骨髓间充质干细胞外泌体及其制备方法和应用
