一种高活性合生元微胶囊及其制备方法
文献发布时间:2023-06-19 13:51:08
技术领域
本发明涉及一种高活性合生元微胶囊及其制备方法,特别是涉及一种可在肠道内定植并保持较高活性的合生元微胶囊包埋益生菌及其制备方法,属于合生元制品技术领域。
背景技术
2001年,FAO/WHO《食品益生菌评价指南》明确规定,食品用益生菌是指“当摄取适当数量后,对宿主健康有益的活的微生物”。益生菌想要对有机体发挥益生作用,不仅要保证摄入到体内的益生菌是有活性的,同时还要使益生菌有足够的数量在肠道内定植,通过促进肠道内有益菌的生长繁殖、抑制致病菌的活性达到改善人体肠道功能的特性。这就要求益生菌能够耐受人体中的胆汁盐溶液和胃酸的胁迫。
微胶囊技术是指通过某些特定的方法,将天然或是合成的高分子材料制备成具有半透性或密封性的微型胶囊,该胶囊对包裹在里边的液体、固体或者是气体物质起到一种保护作用的技术。被包裹的物质对酸性环境的耐受性得到提高,在适宜的环境中,又能及时的被释放出来发挥作用。益生菌的微胶囊化,即将所要试验的益生菌选用某些适合的壁材将其包裹起来,既能使益生菌顺利通过胆盐、胃酸环境,又因其良好的溶解性可以将益生菌及时在肠道内释放定植,从而促进益生菌对人体保健作用的发挥。同时,在微胶囊制备过程中添加适当的益生元,可以更好的保护益生菌的活性,提高所得微胶囊的活菌数。
发明内容
本发明目的在于针对益生菌活性的有效保护,提供一种高活性合生元微胶囊,本发明制备的微胶囊工艺简单,成本较低,易于储存运输,且消化道实验稳定性较好,耐热,具有一定的储存稳定性。
本发明的目的是这样实现的:一种高活性合生元微胶囊,其特征在于,所述合生元微胶囊包括芯材溶液和壁材溶液;所述芯材溶液由益生植物乳杆菌菌Grx16和冻干保护剂水溶液组成;所述壁材溶液由含有天然高分子材料溶液制备而成;
所述冻干保护剂水溶液由蔗糖、菊粉、脱脂乳三种成分组成;
所述天然高分子材料溶液包括海藻酸钠、乳清分离蛋白两种成分。
所述冻干保护剂水溶液由8.2%蔗糖溶液、8.2%菊粉溶液、8%脱脂乳溶液组成。
所述天然高分子材料溶液中:乳清分离蛋白质量分数为4%-8%,海藻酸钠质量分数1%-9%。
壁材溶液和芯材溶液的体积比即胶菌比为2∶1(mL:mL)-10∶1(mL:mL)。
高活性合生元微胶囊的制备方法,其特征在于,包括以下步骤:
(1)制备活化益生菌菌液:将益生植物乳杆菌菌Grx16菌粉接种至已灭菌冷却的MRS液体培养基中,在37℃恒温培养两代后,收集对数期末期的菌液,8000r/min离心5min,并用生理盐水洗涤,得到菌泥,将菌泥与无菌生理盐水以质量比 1∶1混匀后,调节 pH 至6.5制得浓缩菌液;
(2)制备保护剂溶液:称取蔗糖、菊粉、脱脂乳,加水去离子水溶解,制备成质量分数分别为8.2%蔗糖溶液、8.2%菊粉溶液、8%脱脂乳溶液冻干保护剂体系,8.2%蔗糖溶液、8.2%菊粉溶液、8%脱脂乳溶液组成冻干保护剂水溶液;
(3)制备芯材溶液:将步骤(1)得到的浓缩菌液与步骤(2)得到的冻干保护剂溶液以体积比 2∶1 混合均匀,得到芯材溶液;
(4)制备壁材溶液:将乳清分离蛋白溶解于去离子水中800r /min搅拌过夜后,80°C 加热30min以完成蛋白质的变性,冷却至室温;将海藻酸钠粉末溶于水中,70℃下水浴加热过夜至粉末充分溶解后,121℃下,灭菌10min,将乳清分离蛋白和海藻酸钠溶液混合,制备出壁材溶液;
(5)制备高活性合生元微胶囊:将步骤(4)制备得到的壁材溶液和步骤(3)获得的芯材溶液混匀后即为水相;然后将所得水相以1:5 (v/v)的比例逐滴加入到含有吐温80(0.2%)的大豆油中,并以700r /min的速度混合10min;为了分离油包水 (w/o) 乳液,从烧杯的下方快速加入氯化钙 (0.1 M);在 30 min内形成微珠后,通过 300×g离心 10 min收集它们并用林格氏试剂洗涤两次后即为湿微胶囊,置于真空冷冻干燥机中干燥得到冻干微胶囊。
所述步骤(1)中,MRS液体培养基为:葡萄糖20.0 g,蛋白胨10.0 g,乙酸钠5.0 g,磷酸氢二钾2.0 g,柠檬酸三铵2.0 g,七水硫酸镁0.20 g,硫酸锰0.05 g,吐温-80 1.0 mL,牛肉膏10.0 g,酵母膏5.0 g,加蒸馏水补充至1000mL,pH 6.5,121℃条件下灭菌15min。
所述步骤(1)中,培养时间为18-24h,接种比例为每100.0mL培养基中接种3.0mL菌种;生理盐水的质量浓度为0.9%。
所述步骤(4)中,壁材溶液中乳清分离蛋白质量分数4%-8%,海藻酸钠质量分数1%-9%。
所述步骤(4)中,壁材溶液和芯材溶液体积比即胶菌比为2:1-10:1 (mL : mL);林格氏试剂:氯化钠8.6g,氯化钾0.3g,氯化钙0.28g,加蒸馏水补充至1000mL。
所述步骤(5)中,将制备好的高活性合生元微胶囊进行冰箱预冻,预冻温度为-60℃,预冻时间为3 h;冻结完全后将预冻好的高活性合生元微胶囊放入冷阱温度为-53.2℃,真空度为 0.162 mbar 的真空冷冻干燥机内冻干 48 h,然后置于-20 ℃冰箱中保存备用。
本发明方法先进科学,通过本发明提供的一种高活性合生元微胶囊,所述合生元微胶囊包括芯材和壁材,所述芯材由益生菌和冻干保护剂的水溶液制备而成;所述壁材由含有天然高分子材料的溶液制备而成。所述冻干保护剂包括蔗糖、菊粉、脱脂乳三种成分组成;所述天然高分子材料包括海藻酸钠、乳清分离蛋白;在所述水溶液中,所述冻干保护剂的水溶液体系由质量分数分别为8.2%蔗糖溶液、8.2%菊粉溶液、8%脱脂乳溶液;所述天然高分子材料的溶液:分离乳清蛋白质量分数为4%-8%,海藻酸钠质量分数1%-9%。壁材溶液和芯材溶液的体积比即胶菌比为2∶1(mL:mL)-10∶1(mL:mL)。
本发明的另一目的在于提供一种上述合生元微胶囊的制备方法。制备时,包括以下步骤:
(1)制备活化益生菌菌液:将益生菌菌粉接种至已灭菌冷却的MRS液体培养基中,在37℃恒温培养两代后,收集对数期末期的菌液,8000r/min离心5min,并用生理盐水洗涤,得到菌泥,将菌泥与无菌生理盐水以质量比1∶1 混匀后,调节 pH 至 6.5 左右制得浓缩菌液;
(2)制备保护剂溶液:称取一定量的蔗糖、菊粉、脱脂乳,加去离子水溶解,制备成质量分数分别为8.2%蔗糖溶液、8.2%菊粉溶液、8%脱脂乳溶液冻干保护剂体系;
(3)制备芯材混合液:将步骤(1)浓缩菌液与步骤(2)保护剂溶液以体积比2∶1 混合均匀,得到芯材混合液;
(4)制备壁材混合液:,将分离乳清蛋白溶解于去离子水中800r /min搅拌过夜后,80°C 加热30min以完成蛋白质的变性,冷却至室温;将海藻酸钠粉末溶于水中,70℃下水浴加热过夜至粉末充分溶解后,121℃下,灭菌15min,将一定量的分离乳清蛋白和海藻酸钠溶液混合,制备出壁材混合液;
(5)制备高活性合生元微胶囊:将步骤(4)制备的壁材混合液和步骤(3)获得的芯材混合液按照一定比例混匀后即为水相;然后将所得水相以1:5 (v/v)的比例逐滴加入到含有吐温80的大豆油中,并以700r /min的速度混合10min。为了分离油包水 (w/o) 乳液,从烧杯的下方快速加入氯化钙 (0.1 M)。在 30 min内形成微珠后,通过 300×g离心 10min收集它们并用林格氏试剂洗涤两次后即为湿微胶囊,置于真空冷冻干燥机中干燥可得冻干微胶囊。
优选的,所述步骤(1)中,MRS液体培养基为:葡萄糖20.0 g,蛋白胨10.0 g,乙酸钠5.0 g,磷酸氢二钾2.0 g,柠檬酸三铵2.0 g,七水硫酸镁0.20 g,硫酸锰0.05 g,吐温-801.0 mL,牛肉膏10.0 g,酵母膏5.0 g,加蒸馏水补充至1000mL,pH 6.5,121℃条件下灭菌15min。
优选的,所述步骤(1)中,所述的培养时间为18-24h,接种比例为每100.0mL培养基中接种3.0mL菌种。
优选的,所述步骤(1)中,生理盐水的质量浓度为0.9%。
优选的,所述步骤(2)中,保护剂溶液为8.2%蔗糖溶液、8.2%菊粉溶液、8%脱脂乳溶液任意一种,两种或三种。
优选的,所述步骤(4)中,壁材混合液中分离乳清蛋白质量分数4%-8%,海藻酸钠质量分数1%-9%。
优选的,所述步骤(4)中,壁材混合液和芯材混合液体积比即胶菌比为2:1-10:1(mL : mL);林格氏试剂:氯化钠8.6g,氯化钾0.3g,氯化钙0.28g,加蒸馏水补充至1000mL。
优选的,所述步骤(5)中,将制备好的样品进行冰箱预冻(-60 ℃,3 h),冻结完全后将预冻好的样品放入冷阱温度为-53.2 ℃,真空度为 0.162 mbar 的真空冷冻干燥机内冻干 48 h,然后置于-20 ℃冰箱中保存备用。
本发明在一方面提供了高活性合生元微胶囊的用途,该合生元微胶囊可用于保健食品和食品中的添加剂或具有治疗作用的药剂。
本发明采用内源乳化法制备合生元微胶囊,微胶囊的芯材为益生菌和由益生元菊粉等组成的冻干保护剂的水溶液制备而成,壁材由海藻酸钠和分离乳清蛋白构成,极大的提高了合生元微胶囊冻干后菌体的存活率;β-乳球蛋白是乳清蛋白中的主要成分,可以与有良好生物相容性和肠溶性的海藻酸钠发生交联凝聚发应,在胃中形成耐酸性更强的复合微胶囊。该复合微胶囊即可发挥乳清蛋白高营养价值、网络锁水功能和对于益生菌的活性保护作用;又可利用外层凝胶避免其胃中水解,在肠道酶和肠道微生物存在条件下定点释放能力增强。因而,本发明的微胶囊包埋益生菌的存活率更高,在胃环境中不崩解,而在肠液中易破裂,高效释放出菌体。
综上,本发明公开一种高活性合生元微胶囊及其制备方法,该合生元微胶囊包括芯材和壁材,所述芯材由益生菌和冻干保护剂的水溶液组成;所述壁材为海藻酸钠和分离乳清蛋白。其中,所述冻干保护剂的水溶液体系由质量分数分别为8.2%蔗糖、8.2%菊粉、8%脱脂乳组成。该合生元微胶囊具有较好的胃肠道耐受性和储藏稳定性能。
附图说明
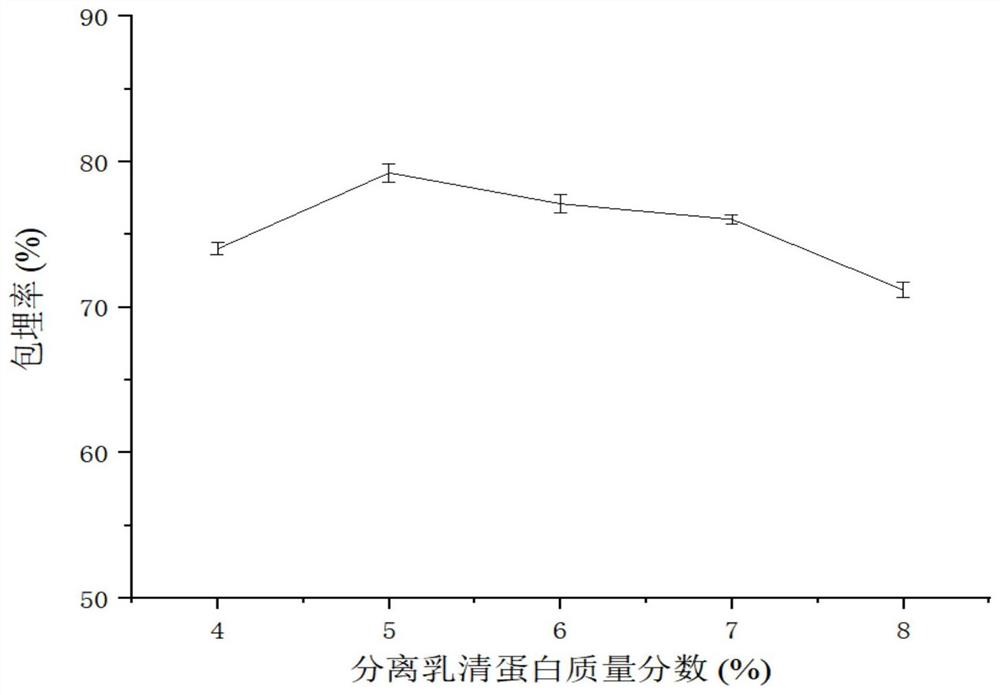
图1是分离乳清蛋白质量分数对高活性合生元微胶囊包埋率的影响。
图2是海藻酸钠质量分数对高活性合生元微胶囊包埋率的影响。
图3是胶菌比质量分数对高活性合生元微胶囊包埋率的影响。
图4是不同保护剂组成对微胶囊冻干存活率的影响
图5是体外消化道中的益生菌存活率变化情况。
图6是微胶囊在模拟肠液中的释放情况。
图7是微胶囊在不同储存温度下益生菌活菌数随时间变化。
具体实施方式
本发明的描述中,“溶液”没有特殊说明的话,一般指水溶液。
微胶囊包埋益生菌活性测定方法;
本发明中微胶囊包埋益生菌活性测定方法按照下面的文献中记载的方法进行:Yonekura ,L .,Sun ,Y .H .,Soukoulis ,C .,Fisk ,I .(2014) .Microencapsulationof Lactobacillus acidophilus NCIMB 701748in matrices containing soluble fibreby spray drying:Technological characterization ,storage stability andsurvival after in vitro digestion[J] .Journal of Functional Foods ,6 ,205-214.将样品悬浮在 PBS中,并在室温下通过机械振荡混合10 min以确保微胶囊完全溶解。从初始悬浮液制备系列稀释液,并倾倒在 MRS 琼脂上。在厌氧条件下将平板在 37°C下培养72h,并计算菌落数。结果表示为log cfu/g。
微胶囊包埋益生菌的包埋率测量方法;
本发明中微胶囊包埋益生菌的包埋率测量的方法按照下面的文献中记载的方法进行:Annan,N T,BORZA A D,HANSEN L T.Encapsulation in alginatecoated gelatinmicrospheres improves survival of the probiotic Bifidobacterium adolescentis15703T during exposure to simulated gastro-intestinal conditions[J]. FoodResearch International, 2008,41(2):184-193. 其中包埋效率(EE)的计算公式为:
EE(%)=N/N
其中N为微囊释放的活细胞数,log cfu/g;N
微胶囊包埋益生菌的冻干存活率测量方法;
本发明中微胶囊在肠道中的释放实验测定方法按下列方式进行:菌体存活率=冻干后微胶囊中的活菌数/冻干前微胶囊中的活菌数)参数单位均为:log CFU/g。
微胶囊消化道试验;
本发明中消化道试验微胶囊包埋益生菌的活性测定方法按照下面的文献中记载的方法进行:刘仁杰,李哲,毛思凝,梁珊,赵悦,王玉华.复配及多层包埋植物乳杆菌微胶囊的制备及表征[J].食品工业科技,2020,41(05):12-16.人工唾液中益生菌存活率测定:实验组:将制得的微胶囊1.0g加入9 mL人工唾液中,37 ℃、150 r/min 匀速摇动 10 min,每隔 2 min 按 GB 4789.35-2016 使用涂布平板法进行活菌计数。对照组: 将 1 mL 植物乳杆菌Grx16菌液加入 9 mL 人工唾液中,37 ℃、150 r/min 匀速摇动10 min,每隔2 min按同样方法进行活菌计数。人工胃液与肠液中益生菌存活率测定:实验组:将上述已通过人工唾液的微胶囊加入10mL人工胃液中,37 ℃、150 r/min 匀速摇动 120 min,通过人工胃液的微胶囊加入 10 mL人工肠液中匀速摇动 120 min,每隔 30 min 进行活菌计数。对照组: 通过人工唾液的植物乳杆菌Grx16离心后加入 9 mL 人工胃液中, 37 ℃、 150 r/min匀速摇动120 min,通过人工胃液的植物乳杆菌Grx16离心后加入到 9 mL 人工肠液中匀速摇动120 min,每隔 30 min 进行活菌计数。存活率的计算公式如下:
存活率(%)=S/S
式中: S 表示处理后的益生菌活菌数,log CFU/g;S
微胶囊在肠道中的释放实验:
本发明中微胶囊在肠道中的释放实验测定方法按下列方式进行:取1.0 g 微胶囊置于9.0 mL 肠液中,于37 ℃、150r/min 分别处理 0、30、60、90、120 min 后取样计数;
微胶囊储藏稳定性试验;
本发明中微胶囊储藏稳定性试验测定方法按照下面的文献中记载的方法进行:Savedboworn W, Teawsomboonkit K, Surichay S,et al. Impact of protectants onthe storage stability of freeze-dried probiotic Lactobacillus plantarum[J].Food Science and Biotechnology,2019,28(3):795-805.将微胶囊分别置于25℃、4℃和-18℃下储存60天,每15天进行一次活细胞计数。
下面结合具体实施例,进一步阐述本发明。具体实施例是在以本发明技术方案为前提下进行实施的,给出了详细的实施方式和操作过程。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件进行。
下列实施例1中,植物乳杆菌Grx16由江苏省乳品生物技术与安全控制重点实验室提供。
实施例1
高活性合生元微胶囊的制备包括以下步骤:
(1)制备活化益生菌菌液:将益生菌菌粉接种至已灭菌冷却的MRS液体培养基中,在37℃恒温培养两代后,收集对数期末期的菌液,8000r/min离心5 min,并用生理盐水洗涤,得到菌泥,将菌泥与无菌生理盐水以质量比 1∶1 混匀后,调节 pH 至 6.5左右制得浓缩菌液;
(2)制备保护剂溶液:称取一定量的蔗糖、菊粉、脱脂乳,加水去离子水溶解,制备成质量分数分别为8.2%蔗糖溶液、8.2%菊粉溶液、8%脱脂乳溶液冻干保护剂体系;
(3)制备芯材混合液:将步骤(1)浓缩菌液与步骤(2)保护剂溶液以体积比 2∶1 混合均匀,得到芯材混合液;
(4)制备壁材混合液:将分离乳清蛋白溶解于去离子水中800r /min搅拌过夜后,80°C加热30 min以完成蛋白质的变性,冷却至室温;将海藻酸钠粉末溶于水中,70℃下水浴加热过夜至粉末充分溶解后,121℃下,灭菌10 min,将一定量的分离乳清蛋白和海藻酸钠溶液混合,制备出壁材混合液;
(5)制备高活性合生元微胶囊:将步骤(4)制备的壁材混合液和步骤(3)获得的芯材混合液按照一定比例混匀后即为水相;然后将所得水相以1:5 (v/v)的比例逐滴加入到含有吐温80(0.2%)的大豆油中,并以700r /min的速度混合10min。为了分离油包水 (w/o)乳液,从烧杯的下方快速加入氯化钙 (0.1 M)。在 30 min内形成微珠后,通过 300×g离心10 min收集它们并用林格氏试剂洗涤两次后即为湿微胶囊,置于真空冷冻干燥机中干燥可得冻干微胶囊。
本实施例1主要对高活性合生元微胶囊的制备条件进行优化。
单因素实验设计:
保持海藻酸钠浓度为1%,胶菌比为4:1,考察不同分离乳清蛋白质量分数(4%、5%、6%、7%、8%)对合生元微胶囊包埋率的影响。研究发现,当分离乳清蛋白质量分数为5%时,包埋率最高,达79.24%。
保持乳清分离蛋白质量分数为5%,菌胶比4:1, 考察不同海藻酸钠质量分数(1%、3%、5%、7%、9%)对合生元微胶囊包埋率的影响。研究发现,当海藻酸钠质量分数为3%时,包埋率最高,达78.29%。
保持海藻酸钠浓度为1%,乳清蛋白质量分数为5%,考察不同的胶菌比(2:1、4:1、6:1、8:1、10:1)对合生元微胶囊包埋率的影响。研究发现,当胶菌比为6:1时,包埋率最高,达76.75%。
响应面实验设计:
在单因素实验的基础上,以分离乳清蛋白质量分数4%、5%、6%(A)、海藻酸钠质量分数1%、3%、5%(B)、胶菌比4:1、6:1、8:1mL/mL(C)为因素进行3因素3水平试验,以包埋率为评价指标,确定合生元微胶囊制备的最佳条件。研究发现,当分离乳清蛋白质量分数4.23%、海藻酸钠质量分数3.25%、胶菌比5.80% (mL/mL)时,包埋率达到最大值93.25%。
实施例2
本实例是对获得的微胶囊进行冻干性能测试,制备方法与实施例1完全一致,不同在于保护剂组成为单一组分或不同组分复配、分离乳清蛋白质量分数5.22%、海藻酸钠质量分数3.30%、菌胶比6.63(mL:mL)。研究发现,当保护剂体系由8.2%蔗糖、8.2%菊粉、8%脱脂乳复配构成时,冻干保护效果最好,菌体存活率可达95.41%。
实施例3
本实例是对获得的微胶囊进行应用性测试,制备方法与实施例1完全一致,不同在于保护剂成分由8.2%蔗糖、8.2%菊粉、8%脱脂乳复配构成;分离乳清蛋白质量分数5.22%、海藻酸钠质量分数3.30%、菌胶比6.63(mL:mL)。
(1)微胶囊消化道实验:经唾液处理后,冻干微胶囊中的菌体存活率都在97%以上;经过唾液处理后的冻干微胶囊,在pH 3.0 的模拟胃液中处理2h后,菌体存活率仍保持在91%以上;通过模拟胃液处理后,冻干微胶囊在pH 8.0 的模拟肠液中处理2h后,菌体存活率在82.49%以上。
(2)微胶囊肠溶性试验:经过胃液处理的微胶囊与肠液接触30min后,已经基本完成崩解,60min后肠液中的活菌数无显著差异(
(3)微胶囊储藏稳定性实验:冻干后微胶囊分别置于室温(25℃)、冷藏(4℃)和冷冻(-18℃)下储存60天。-20℃储存60天后,冻干微胶囊活菌数为9.91 log cfu/g;4℃下储存60天后,活菌数为9.78 log cfu/g;储存温度为25℃时,60天后活菌数分别为9 log cfu/g。
通过以上实验可知,本发明高活性合生元微胶囊包埋率较高。在此条件下制备的合生元微胶囊,冻干后的微胶囊包埋的益生菌存活率仍保持较高的活性;经体外消化道处理,仍待保持较高的活菌数;肠溶性较好,能达到缓释的目的;并具有一定储藏稳定性。为开发合生元微胶囊系列产品提供参考。
- 一种高活性合生元微胶囊及其制备方法
- 一种甘露寡糖合生元肠溶微胶囊的制备方法
