一种L-丙氨酸的发酵生产方法
文献发布时间:2023-06-19 18:29:06
技术领域
本发明属于生物工程技术领域,具体涉及一种L-丙氨酸的发酵生产方法。
背景技术
L-丙氨酸,学名L-氨基丙酸(L-alanine;L-lactamine),分子式CH
L-丙氨酸在生物体的代谢中有重要的作用。有研究表明,血液中含有8%的氨基酸,其中主要是L-丙氨酸。并且L-丙氨酸作为一种带有特殊甜味的氨基酸,在医药、食品工业、日化等方面的应用相当广泛:
(1)丙氨酸在食品工业的应用
作为防腐剂,丙氨酸与二元羧酸(如乙酸钠、富马酸)、氧化性酸的混合物是保存面条的上佳防腐剂,并且能保鲜。丙氨酸与辣椒油、山梨酸钾等的混合物能有效地抑制酵母菌、大肠杆菌、黑曲霉等有害菌,可适用于水产品、面条、腌制品、海产品、豆制品、畜产品、饲料、化妆品以及药品的保鲜。
作为风味调味料,丙氨酸具有独特的改善风味效果,它与其它氨基酸配合能加强食品与饮料的风味,尤其是丙氨酸与其他氨基酸和糖类(如葡萄糖、阿拉伯糖、甘露糖、果糖、蔗糖、麦芽糖等)以任意比例混合以后,对改善食品、饲料的风味,强化食品的营养更具特色,在日本成了各种食品和炒菜必不可少的添加剂。
作为氨基酸低度酒和饮料,氨基酸近年来也被添加在营养饮料中。特别是丙氨酸具有促进酒精代谢和对醛类的解毒作用,所以被广泛用于制取低度酒,如在0.14%~0.15%的丙氨酸溶液中,滴几滴胡椒油或生姜精,与市售的烈性酒、威士忌、葡萄酒混合,即可得到风味上佳、口感柔和的饮料。又如将L-丙氨酸与薄荷汁配成15%的溶液,冷冻成冰决,即可得松脆、清新、解渴的降温防暑物。
(2)丙氨酸在医药上的应用
氨基酸是蛋白质的合成原料,许多氨基酸影响着人体的生理活动。L-丙氨酸是一种潜在的胰高血糖分泌的刺激剂,已应用于急性和慢性胰腺炎患者的高血糖素的研究中。
众所周知,酒精是通过肝脏进行代谢的,长期多量摄入酒精时,会引起脂肪肝、纤维化、肝硬化等症。即使饮入的酒量还未引起上述症状,也会引起血糖下降,使人的行动受到抑制。而L-丙氨酸可以有效地减轻酒精对肝脏的损害。
L-丙氨酸具有减肥功效,肥胖者可每天口服50gL-丙氨酸节食治疗2周,低血糖将明显好转,肌肉组织代谢减少。
L-丙氨酸是合成VB6的重要原料,是营养剂《补精氨基酸营养输液》的组分之一。
以L-丙氨酸为主要成分的《氨基酸注射液-800》,主治肝、脑病,并促使肝昏迷患者迅速苏醒,同时也是一种利尿的良药。
(3)丙氨酸在日化领域的应用
丙氨酸在日化方面的应用则是以用于洗涤剂中螯合剂MGDA生产为主。MGDA是一种优质新型环保螯合剂,自10年巴斯夫建立首座世界级装置以来,MGDA逐渐发展成最优质的绿色螯合剂之一,
目前主要用于家用自动洗碗机专用洗涤剂。
目前L-丙氨酸的生产方法主要为酶转化法和生物发酵法。生物发酵法的出发原料为葡萄糖,是由玉米淀粉生产得到的一种可再生资源。随着石油等化工资源的日渐枯竭,生物发酵法将越来越具有市场竞争力和战略意义。
申请人的在前申请(CN 107312728A)公开了一种高产高光学纯L-丙氨酸的大肠杆菌,保藏编号为CGMCC No.14067,保藏日期为2017年4月24日。但是该菌种必须在微好氧和厌氧条件下进行L-丙氨酸的发酵生产,此过程溶氧值很低,溶氧电极难以检出,因此该发酵过程参数的精准控制成为难点;而且,CN 107312728A所公开的发酵方法的产物含量、转化率水平偏低,发酵周期较长。因此,有待于开发一种产物含量、转化率更高,发酵周期更短的发酵生产L-丙氨酸的方法。
发明内容
针对现有技术存在的不足,本发明的目的在于提供一种L-丙氨酸的发酵生产方法。该方法能够提高放罐L-丙氨酸的含量、原料的转化率以及发酵效果的稳定性,缩短发酵周期。
为达此目的,本发明采用以下技术方案:
本发明提供一种L-丙氨酸的发酵生产方法,所述方法包括如下步骤:
将大肠杆菌CGMCC14067的种子液接种至发酵培养基中进行发酵生产L-丙氨酸;
其中,发酵0-8h控制发酵液的氧化还原电位为0~45mV(例如可以是0mV、5mV、10mV、15mV、20mV、25mV、30mV、35mV、40mV或45mV等),发酵8-35h控制发酵液的氧化还原电位为-180~-140mV(例如可以是-180mV、-170mV、-160mV、-150mV或-140mV等),发酵35h之后控制发酵液的氧化还原电位为-120~-80mV(例如可以是-120mV、-110mV、-100mV、-90mV或-80mV等)直至发酵结束。
发明人通过研究大肠杆菌CGMCC 14067生长代谢特性及其发酵合成代谢过程中对于溶氧的要求,将整个发酵过程分为三个阶段,即:第一阶段(约0-8h)为菌体生长阶段,该阶段为菌种停滞期至指数生长前期,需要相对较高的通气量,确保菌体在有氧呼吸的情况下快速生长至一定的OD值;第二阶段(约8-35h)为菌体生长及产物合成的稳定期,由于菌体发酵合成L-丙氨酸的关键步骤为利用L-丙氨酸脱氢酶将丙酮酸转化为L-丙氨酸,该步骤需要在还原性环境中进行(消耗还原型辅酶NADH),因此厌氧程度直接影响到L-丙氨酸的合成效率;第三阶段(约35-45h)为菌体衰亡及代谢衰减期,该阶段需要适当提高通气量,来对抗代谢能力的减弱,刺激加速发酵液中剩余残糖的消耗,避免放罐残糖过高影响后提取生产。
本发明将氧化还原电位作为发酵过程参数来调控发酵过程,即使培养基中仅含有痕量氧,也可以在氧化还原电极上产生信号,可以检测到普通溶氧电极量程之外的测量值。本发明通过控制三个阶段发酵液的氧化还原电位在上述范围内,使得菌体的生长和代谢达到了最适条件,从而提高了放罐L-丙氨酸的含量、原料的转化率以及发酵效果的稳定性,缩短了发酵周期。
在本发明一些实施方式中,所述种子液的制备方法包括如下步骤:
将冻存的大肠杆菌CGMCC 14067接种于试管斜面,在35-39℃下培养40-48h,然后转入平板培养基中,在35-39℃下培养30-36h(可置于4℃冰箱保存,用于平时种子液的发酵,同一批平板培养基使用时间不超过2周);
将所述平板培养基上的菌种接种于液体种子培养基中,在温度为35-39℃,转速为200-300r/min的条件下培养至OD
在本发明一些实施方式中,所述平板培养基为LB培养基。
在本发明一些实施方式中,所述液体种子培养基包括如下组分:甘油10-14g/L、酵母浸粉2-6g/L、胰蛋白胨6-10g/L和余量的水。
在本发明一些实施方式中,所述种子液的接种量为所述种子液与发酵培养基总体积的5-10%;例如可以是5%、6%、7%、8%、9%或10%等。
在本发明一些实施方式中,所述发酵培养基包括如下组分:
葡萄糖130-160g/L、玉米浆干粉8-12g/L、磷酸二氢钾7-11g/L、硫酸铵10-14g/L、七水硫酸镁1-5g/L、FeSO
在本发明一些实施方式中,通过调节通气量控制发酵液的氧化还原电位。
在本发明一些实施方式中,所述发酵过程中控制发酵液的pH为6.4-6.8;例如可以是6.4、6.5、6.6、6.7、6.8或6.9等。
在本发明一些实施方式中,所述发酵过程中通过添加氨水调节pH。
在本发明一些实施方式中,所述氨水的浓度为18-25wt%;例如可以是18wt%、19wt%、20wt%、21wt%、22wt%、23wt%、24wt%或25wt%等。
在本发明一些实施方式中,所述发酵的温度为35-39℃;例如可以是35℃、35.5℃、36℃、36.5℃、37℃、37.5℃、38℃、38.5℃或39℃等。
在本发明一些实施方式中,所述发酵过程中进行搅拌,搅拌速率为150-250rpm;例如可以是150rpm、160rpm、180rpm、190rpm、200rpm、210rpm、220rpm、230rpm、240rpm或250rpm等。
在本发明一些实施方式中,所述发酵过程中控制压力为0.01-0.03MPa;例如可以是0.01MPa、0.015MPa、0.02MPa、0.025MPa或0.03MPa等。
在本发明一些实施方式中,当发酵液中葡萄糖的浓度降至0.2wt%以下时结束发酵。
在本发明一些实施方式中,所述发酵生产方法包括如下步骤:
(1)将冻存的大肠杆菌CGMCC 14067接种于试管斜面,在35-39℃下培养40-48h,然后转入LB平板培养基中,在35-39℃下培养30-36h;
将所述平板培养基上的菌种接种于液体种子培养基中,在温度为35-39℃,转速为200-300r/min的条件下培养至OD
其中,所述平板培养基为LB培养基;
所述液体种子培养基包括如下组分:甘油10-14g/L、酵母浸粉2-6g/L、胰蛋白胨6-10g/L和余量的水;
(2)将步骤(1)得到的种子液接种至灭菌的发酵培养基中,接种量为所述种子液与发酵培养基总体积的5-10%;
所述发酵培养基包括如下组分:葡萄糖130-160g/L、玉米浆干粉8-12g/L、磷酸二氢钾7-11g/L、硫酸铵10-14g/L、七水硫酸镁1-5g/L、FeSO
发酵过程中,用浓度为18-25wt%的氨水控制pH为6.4-6.8,控制温度为35-39℃,搅拌速率为150-250rpm,压力为0.01-0.03MPa,且通过调节通气量控制发酵液的氧化还原电位,使得发酵0-8h的氧化还原电位为0~45mV,发酵8-35h的氧化还原电位为-180~-140mV,发酵35h之后的氧化还原电位为-120~-80mV,当发酵液中葡萄糖的浓度降至0.2wt%以下时结束发酵。
与现有技术相比,本发明具有以下有益效果:
本发明将氧化还原电位作为发酵过程参数来调控发酵过程,即使培养基中仅含有痕量氧,也可以在氧化还原电极上产生信号,可以检测到普通溶氧电极量程之外的测量值。本发明通过控制菌种生长代谢三个阶段发酵液的氧化还原电位,使得菌体的生长和代谢达到了最适条件,从而提高了放罐L-丙氨酸的含量、原料的转化率以及发酵效果的稳定性,缩短了发酵周期。
附图说明
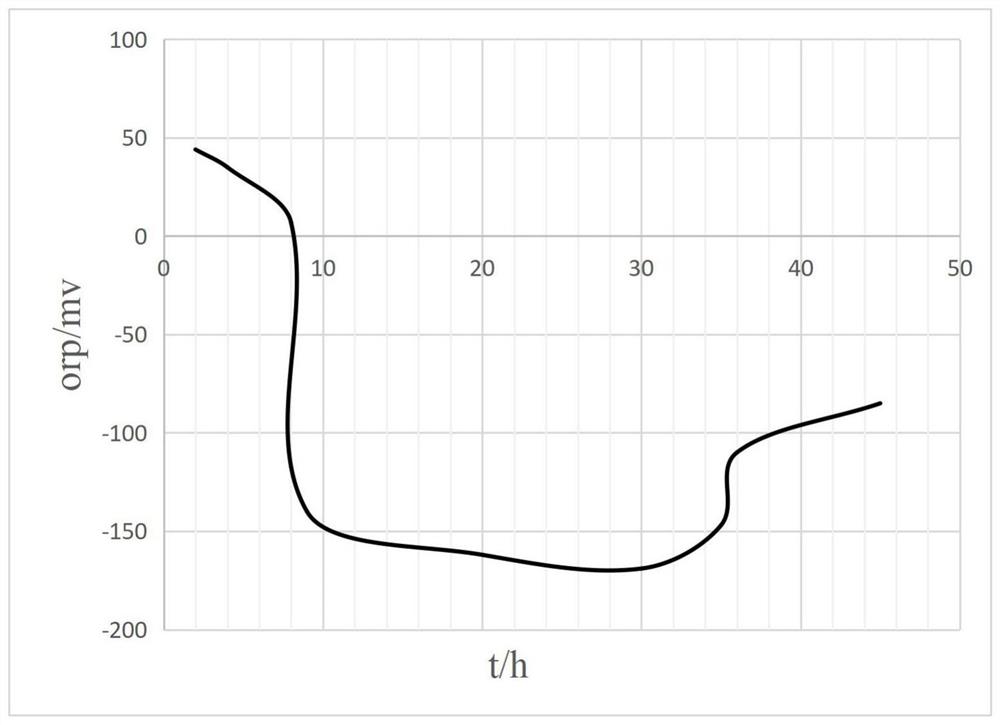
图1为本发明实施例1中发酵液ORP值随时间变化的曲线图;
图2为本发明实施例2中发酵液ORP值随时间变化的曲线图;
图3为本发明实施例3中发酵液ORP值随时间变化的曲线图;
图4为本发明对比例1-4中发酵液ORP值随时间变化的曲线图。
具体实施方式
下面结合附图并通过具体实施方式来进一步说明本发明的技术方案。本领域技术人员应该明了,所述具体实施方式仅仅是帮助理解本发明,不应视为对本发明的具体限制。
本发明实施例中,使用的大肠杆菌CGMCC 14067种子液按照如下方法进行制备:
将大肠杆菌CGMCC 14067从冻存管中接种于试管斜面,在37℃下培养40h,然后转入LB平板培养基中,在37℃下培养32h,最后置于4℃冰箱保存,用于平时种子液的发酵,同一批平板培养基使用时间不超过2周;
取一个上述新鲜平板接种于液体种子培养基(100mL/500mL锥形瓶)中,纱布封口后,在温度为37℃,转速为250r/min的条件下培养18h,检测OD
其中,液体种子培养基成分为:甘油12g/L、酵母浸粉4g/L、胰蛋白胨8g/L,溶剂为水。
实施例1
本实施例提供一种L-丙氨酸的发酵生产方法,步骤如下:
使用50L发酵罐,将大肠杆菌CGMCC 14067种子液按照10%的接种量(约3L)接入高温蒸汽灭菌(121℃,30min)后的发酵培养基中,接种后发酵液的初始体积为30L;
其中发酵培养基的成分为:葡萄糖150g/L、玉米浆干粉10g/L、磷酸二氢钾8g/L、硫酸铵10g/L、七水硫酸镁2.5g/L、FeSO
发酵过程中用25wt%的氨水控制pH值为6.7±0.2,温度控制为36±0.5℃,搅拌转速维持为200rpm,罐压维持为0.02Mpa。并且发酵过程中通过调节无菌空气的通气量控制发酵液的氧化还原电位,即:第一阶段0-8小时调节进气量(实际进气量2.5~5.5L/min区间内微调),控制ORP值在0~45mV范围;第二阶段8-35小时调节进气量(实际进气量0.2~2.2L/min区间内微调),控制ORP值在-180~-140mV范围;第三阶段35-45小时调节进气量(实际进气量2~4L/min区间内微调),控制ORP值在-120~-80mV范围,发酵液ORP值随时间的变化曲线如图1所示。最终发酵45小时,检测发酵液葡萄糖浓度为0.2%以下达到放罐要求,采用液相色谱检测此时发酵液中L-丙氨酸的含量,并计算葡萄糖到L-丙氨酸的转化率。
实施例2
本实施例提供一种L-丙氨酸的发酵生产方法,步骤如下:
使用500L发酵罐,将大肠杆菌CGMCC 14067种子液按照10%的接种量(约30L)接入高温蒸汽灭菌(121℃,30min)后的发酵培养基中,接种后发酵液的初始体积为300L;
其中发酵培养基的成分为:葡萄糖140g/L、玉米浆干粉8g/L、磷酸二氢钾8g/L、硫酸铵10g/L、七水硫酸镁2g/L、FeSO
发酵过程中用25wt%的氨水控制pH值为6.7±0.2,温度控制为36±0.5℃,搅拌转速维持为150rpm,罐压维持为0.02Mpa。并且发酵过程中通过调节无菌空气的通气量控制发酵液的氧化还原电位,即:第一阶段0-8小时调节进气量(实际进气量20~50L/min区间内微调),控制ORP值在0~45mV范围;第二阶段8-35小时调节进气量(实际进气量15~25L/min区间内微调),控制ORP值在-180~-140mV范围;第三阶段35-45小时调节进气量(实际进气量15~35L/min区间内微调),控制ORP值在-120~-80mV范围,发酵液ORP值随时间的变化曲线如图2所示。最终发酵45小时,检测发酵液葡萄糖浓度为0.2%以下达到放罐要求,采用液相色谱检测此时发酵液中L-丙氨酸的含量,并计算葡萄糖到L-丙氨酸的转化率。
实施例3
本实施例提供一种L-丙氨酸的发酵生产方法,步骤如下:
使用50L发酵罐,将大肠杆菌CGMCC 14067种子液按照10%的接种量(约3L)接入高温蒸汽灭菌(121℃,30min)后的发酵培养基中,接种后发酵液的初始体积为30L;
其中发酵培养基的成分为:葡萄糖145g/L、玉米浆干粉11g/L、磷酸二氢钾11g/L、硫酸铵12g/L、七水硫酸镁2g/L、FeSO
发酵过程中用25wt%的氨水控制pH值为6.6±0.2,温度控制为38±0.5℃,搅拌转速维持为250rpm,罐压维持为0.01Mpa。并且发酵过程中通过调节无菌空气的通气量控制发酵液的氧化还原电位,即:第一阶段0-8小时调节进气量(实际进气量2.5~5.5L/min区间内微调),控制ORP值在0~45mV范围;第二阶段8-35小时调节进气量(实际进气量0.2~2.2L/min区间内微调),控制ORP值在-180~-140mV范围;第三阶段35-45小时调节进气量(实际进气量2~4L/min区间内微调),控制ORP值在-120~-80mV范围,发酵液ORP值随时间的变化曲线如图3所示。最终发酵45小时,检测发酵液葡萄糖浓度为0.2%以下达到放罐要求,采用液相色谱检测此时发酵液中L-丙氨酸的含量,并计算葡萄糖到L-丙氨酸的转化率。
对比例1-4
对比例1-4各提供一种L-丙氨酸的发酵生产方法,与实施例1的区别仅在于,通气策略不同,具体如下表1所示:
表1
对比例1-4发酵过程中,发酵液ORP值随时间的变化曲线如图4所示。
对比例5
本对比例提供一种L-丙氨酸的发酵生产方法,与实施例1的区别仅在于,发酵0-10小时控制ORP值在0~45mV范围;发酵10-37小时控制ORP值在-180~-140mV范围;发酵37小时至发酵结束控制ORP值在-120~-80mV范围。
对比例6
本对比例提供一种L-丙氨酸的发酵生产方法,与实施例1的区别仅在于,发酵0-6小时控制ORP值在0~45mV范围;发酵6-33小时控制ORP值在-180~-140mV范围;发酵33小时至发酵结束控制ORP值在-120~-80mV范围。
对比例7
本对比例提供一种L-丙氨酸的发酵生产方法,与实施例1的区别仅在于,第一阶段0-8小时控制ORP值在50~80mV范围。
对比例8
本对比例提供一种L-丙氨酸的发酵生产方法,与实施例1的区别仅在于,第一阶段0-8小时控制ORP值在-30~0mV范围。
对比例9
本对比例提供一种L-丙氨酸的发酵生产方法,与实施例1的区别仅在于,第二阶段8-35小时控制ORP值在-130~-100mV范围。
对比例10
本对比例提供一种L-丙氨酸的发酵生产方法,与实施例1的区别仅在于,第二阶段8-35小时控制ORP值在-220~-190mV范围。
对比例11
本对比例提供一种L-丙氨酸的发酵生产方法,与实施例1的区别仅在于,第三阶段35小时至发酵结束控制ORP值在-70~-40mV范围。
对比例12
本对比例提供一种L-丙氨酸的发酵生产方法,与实施例1的区别仅在于,第三阶段35小时至发酵结束控制ORP值在-160~-130mV范围。
上述实施例和对比例中,当发酵液中葡萄糖的浓度降至0.2wt%以下时结束发酵。
上述实施例和对比例的发酵效果数据如下表2所示:
表2
从表2的实验结果以及图1~4可以看出,本发明通过控制大肠杆菌CGMCC14067生长代谢三个阶段发酵液的氧化还原电位,使得菌体的生长和代谢达到最适条件,提高了放罐L-丙氨酸的含量、原料的转化率,缩短了发酵周期,且不同批次的发酵效果差异较小,发酵稳定性好。
对比例1由于全程不通气,进行厌氧发酵,菌体生长和能量代谢效率低下,因此发酵周期被大幅度延长,且存在发酵后期残糖无法耗尽的风险。对比例2和对比例3全程保持较高的通气量,菌体有氧呼吸作用被大大激活,菌体生长旺盛,导致更多原料流转向生长代谢,同时不能确保丙氨酸合成所需的还原性环境,因此目的产物含量和转化率大幅降低。对比例4的通气策略下,发酵液的ORP值也不满足本发明要求的范围,对比例5-12的发酵阶段与ORP值不满足本发明要求的范围,因此放罐L-丙氨酸含量和转化率相较于实施例1均明显下降。
虽然,上文中已经用一般性说明、具体实施方式及试验,对本发明作了详尽的描述,但在本发明基础上,可以对之作一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
- 一种提高L-丙氨酸生产效率的方法及其应用
- 高产L-丙氨酸的菌株及生物发酵法生产L-丙氨酸的方法
- 高产L-丙氨酸的菌株及生物发酵法生产L-丙氨酸的方法
