通过抑制白介素-6、TNF-α和其他细胞因子以及通过减少C-反应蛋白来预防和抑制COVID-19发病率和死亡率的方法和化合物
文献发布时间:2023-06-19 19:07:35
相关申请
本非临时专利申请要求Chitre等人于2020年5月3日提交的美国临时专利申请号63/019,412的优先权的权益,并且其全部内容在此通过引用并入。
背景技术
迄今为止,COVID-19疾病仅影响了相对较小百分比的全球人口,其影响的严重程度在各个国家之间差异很大。据估计,在撰写本文的未来几个月内,超过55%的世界人口会是COVID-19疾病阳性。高达75%的阳性病例可以是无症状的,而无症状的携带者继续传播病毒。在大多数情况下,COVID-19疾病的体征和症状为轻度至中度并消散。然而,在易受攻击的人群中,这种疾病表现为无法抵抗的和潜在致命的病况。除了高龄之外,由于各种原因,诸如高血压、糖尿病、充血性心力衰竭、肥胖、癌症和免疫抑制的易感病况导致疾病强度增加,预后差。COVID-19疾病似乎会产生失控的炎症,直接破坏参与气体交换的肺细胞及其受损的再生能力,并加速那些严重受影响的肺部瘢痕形成。
已经开发了一些针对COVID-19疾病的疫苗,但是必须在超低温度下储存,例如在-80℃和-60℃之间储存。这些疫苗的常见副作用是发冷、头痛、疼痛、疲劳和/或注射部位的红肿,但是很少发现疫苗会引发过敏性反应。CDC建议在施用疫苗后15-30分钟的等待时间进行监测。随着病毒在被感染人群中不断突变成新的毒株,疫苗的长期功效目前未知。
除了疫苗之外,美国FDA目前已经颁发了瑞德西韦(Remdesivir,一种广谱抗病毒药物)的紧急使用授权(Gilead Sciences,Foster City,CA)。恢复期血浆疗法也被有条件地批准用于治疗一些Covid-19患者。
证据表明,由于过度炎症、缺氧、制动和弥散性血管内凝血,感染COVID-19疾病可使个体易于发生静脉和动脉血栓栓塞。据估计,高达31%的患者会发生这种情况,因此通过给予适当的预防和防范性治疗来预防这些情况是重要的。
对患有COVID-19疾病并发急性呼吸窘迫综合征(ARDS)的患者的尸检分析显示,由于免疫系统的过度激活,细胞毒性T细胞高度活化。白介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)和其他细胞因子的显著激增被认为是这种增强的T细胞活性的介质。
附图说明
图1是制备示例BV-4051制剂的批量约220000片的示例过程的图。
图2是白介素-6水平的图,作为疾病修饰活性的直接读数指标来测量。
图3是图2的白介素-6水平在32周时的图。
图4是在用示例BV-4051制剂治疗类风湿性关节炎期间,在第16周时类风湿性因子(RF)效价降低的图。
图5-6是在用示例BV-4051制剂治疗类风湿性关节炎期间,在第16周时ESR水平和CRP水平降低的图。
图7是在施用示例BV-4051制剂期间来自脂多糖(LPS)诱导的巨噬细胞的TNF-α水平降低的图。
图8是在Covid-19患者中中和Covid-19疾病特异性促炎细胞因子的示例方法的流程图。
图9是显示III期临床试验的受试者处置的表,该临床试验题为“多中心、随机、双盲、安慰剂对照的III期临床研究,以评估BV-4051片剂结合当前护理标准的安全性和功效及其对无并发症中度SARS-CoV-2感染(COVID-19)受试者的炎症生物标志物的影响”。
图10是显示III期临床试验的人口统计学特征的表,该临床试验题为“多中心、随机、双盲、安慰剂对照的III期临床研究,以评估BV-4051片剂结合当前护理标准的安全性和功效及其对无并发症中度SARS-CoV-2感染(COVID-19)受试者的炎症生物标志物的影响”。
图11是显示III期临床试验的主要功效分析(ITTI人群)表,该临床试验题为“多中心、随机、双盲、安慰剂对照的III期临床研究,以评估BV-4051片剂结合当前护理标准的安全性和功效及其对无并发症中度SARS-CoV-2感染(COVID-19)受试者的炎症生物标志物的影响”。
图12是显示III期临床试验的主要功效分析(PP人群)的表,该临床试验题为“多中心、随机、双盲、安慰剂对照的III期临床研究,以评估BV-4051片剂结合当前护理标准的安全性和功效及其对无并发症中度SARS-CoV-2感染(COVID-19)受试者炎症生物标志物的影响”。
具体实施方式
概述
本申请描述了通过抑制白介素-6、TNF-α和其他细胞因子以及通过减少C反应蛋白来预防和抑制COVID-19发病率和死亡率的方法和化合物。
本文描述了用于预防和治疗由COVID-19病毒疾病引起的病况的使用方法、制剂,用于增强人体免疫系统的制剂,以及用于预防和对抗在SARS-CoV-2病毒感染和其他病毒感染中所见的细胞因子风暴的方法和制剂。示例制剂由某些植物的协同和特定组成,例如,以口服施用的片剂、胶囊或液体剂型形式。
在一个实施方案中,本文称为BV-4051的制剂可抑制COVID-19疾病病中的IL-6和TNF-α。最近在大约176名中度Sars-COV2感染受试者中进行的III期随机、双盲、安慰剂对照临床研究在本申请的后面部分作为支持证据提出。在一个实施方案中,BV-4051的制剂被称为Artovid-20。
示例临床环境
目前的报道描述了患有COVID-19疾病的危重病患者的免疫学特征。免疫过度激活是由包括白介素-6(IL-6)在内的关键免疫介质激增引起的,这些介质导致呼吸衰竭、休克和多器官功能障碍。很可能许多促炎细胞因子的严重风暴同时造成这种疾病的严重破坏和死亡。通过体外和计算分析方法正在研究多种先前已知的针对SARS、埃博拉(Ebola)和MERS靶标的药剂。在美国退伍军人管理局医院以及法国、中国和巴西进行临床试验后,药剂(如羟氯喹和氯喹)未能产生所希望的治疗效果。类似地,有前途的抗病毒治疗剂(如瑞德西韦)没能产生早期研究中预期的影响,但由于缺乏更明确的疗法,仍然被开出处方。
靶向IL-6受体并阻断细胞因子的下游促炎作用的人源化单克隆抗体(托珠单抗,tocilizumab)已被推广用于COVID-19疾病,而没有考虑其副作用和高成本。已经尝试了生物制剂来阻断TNF-α。这些生物制剂包括依那西普(etanercept)、英夫利昔单抗(infliximab)、阿巴西普(abatacept)和阿达鲁米单抗(adalumimab),它们是由TNF-α介导的疾病的主要治疗方式。生物制剂在积极的研究中被测试用于治疗COVID-19疾病。然而,生物制剂可具有严重的副作用,例如结核病再活化和针对压倒性感染的防御的降低,以及对淋巴瘤或致命恶性肿瘤的发展倾向。成本也很高,对于大量的人口来说是难以承受的。
鉴于上述关于目前正在考虑用于COVID-19疾病的预防和治疗方案的挑战,并且考虑到全球病例数量的惊人增长,即使在两剂量的疫苗已分配给数百万人之后,对安全、成本有效、易于储存且易于施用(例如,以固体或液体剂型口服)的选择的需求可为全球COVID-19流行病的合适疗法或辅助手段。
示例制剂
在一个实施方案中,示例制剂减轻了COVID-19疾病的细胞因子风暴后果,和/或降低了病毒载量。称为BV-4051的制剂包含药用植物的特定提取物,包括例如Ashwagandha(睡茄,茄科)、Shallaki(乳香,橄榄科)、生姜(姜,姜科)和Turmeric(姜黄,姜科)。这些药剂的组合可以解决自身免疫病症病况,其可与COVID-19疾病具有相似的病理生理学,并且可以提供免疫调节和抗炎症特性。组合可以防止可导致其他严重或致命并发症的凝血。
在示例制剂中,例如,四种类型植物的活性成分通过Chitre等人的美国专利号8,808,769所描述的技术来提取,该专利名称为“Method for Extraction of FractionsContaining Pharmacologically Active Ingredients with Less Cytotoxicity fromOne or More Plants”,其通过引用以其整体并入本文。在特别的比例、标准化和表征方面,以及在描述的制造方法中,示例制剂显示了在炎症的多个阶段抑制IL-6和TNF-α的功效。示例制剂可以帮助COVID-19患者预防症状的发作或严重性,以及降低COVID-19疾病的表现强度和发病率。示例制剂可在SARS-CoV-2病毒的多个毒株中起作用。
示例制剂可与COVID-19疫苗联合使用,也可作为已暴露于活动性COVID-19疾病的人的预防措施,如那些从事使其更易暴露于SARS-CoV-2病毒并感染其的职业的人。
BV-4051制剂的示例提取和制备
例如,Chitre等人在美国专利号8,808,769中描述的示例提取方法,由于浓缩、纯化、小心保存和不破坏所选植物的所需活性化学物质,产生了生物活性化合物,其可比通过常规提取方法提取的那些生物活性化合物在药理学上更有效。
从一种或多种类型的植物获得的植物材料在水不溶性溶剂的存在下经历水醇提取。水醇提取包括将植物材料浸泡在水性醇和水不溶性溶剂的混和物中预定的时间。用于水醇提取的水不溶性溶剂可以是例如氯仿、丙酮、二氯甲烷和四氯甲烷中的一种,但不限于他们。可以偶尔搅拌混和物,同时允许植物材料浸泡。可以使用本领域已知的方法来完成搅拌,如实验室或工业搅拌器/摇床,或者任选地,可以通过使用合适的搅拌器手动搅拌混和物。为了有效地提取药理学上的活性成分,混和物中存在的水不溶性溶剂和水性醇应该渗透植物材料的组织和/或细胞特定的时间,并定期搅动或搅拌。
然后可将次级代谢物溶解在溶剂中并进一步提取。将植物材料浸泡在水性醇和水不溶性溶剂的混和物中导致在两个不同的相中提取一种或多种植物的药理学上的活性成分。两种不同的相可以是水醇相和水不溶性相。预定的浸泡时间结束后,过滤混和物。可以使用液-液萃取领域中通常已知和使用的方法进行过滤。或者,可以使用实验室或工业过滤程序来实现过滤。过滤混和物的结果是,获得第一残余物和第一滤液。干提取物经历脱色素过程、脱脂过程和/或解毒过程中的一种或多种。
在示例BV-4051的制剂中,生植物部分,例如睡茄的根、乳香的树胶树脂以及姜和姜黄的根各自单独收集。洗涤后,将它们切碎并在醇-水混和物中浸泡过夜,并如Chitre等人的美国专利号8,808,769中描述的进行处理。在进行标准化的测试之前,以及在通过高效液相色谱(HPLC)、高压薄层液相色谱(HPTLC)和紫外分光光度法进行分析测试之前,可以通过脱脂剂清除混和物。一旦获得了四种提取物,就按如下所述进一步制成片剂剂型。提取物可以进一步开发成液体制剂,如下文进一步所述。
示例片剂制造方法
图1显示了制造批量约为220,000片的示例方法。参考图1,现在提供进一步的细节:
i.不锈钢(SS)容器可以用316优质不锈钢板制成。
ii.在一个过程中,仅使用不锈钢勺和刮刀来除去所需量的提取物。
i.准确称取生姜提取物(10.60kg)和姜黄提取物(3.96kg)。
ii.将玉米淀粉(5.11kg)和胶体无水二氧化硅(3.10kg)通过40目SS筛。
iii.将上述成分与聚克立林钾(2.60kg)在合适的质量混和器中混和30分钟。
iv.加入生姜提取物和姜黄提取物,混和均匀。
v.使用异丙醇(IPA)(14升)对材料进行造粒。
vi.将上述混和物过30目筛。
vii.在45-50℃干燥颗粒,直到干燥失重(LOD)仅为2-3%。
i.在SS容器中准确称取睡茄提取物(39.60kg),并通过16目SS筛。
ii.在SS容器中准确称取粉末形式的乳香提取物(29.00kg),并通过2mm多磨筛。收集在合适的SS容器中。
iii.将两种提取物与胶体二氧化硅(例如,Aerosil)(3.80kg)、玉米淀粉(16.45kg)和聚克立林钾(6.60kg)混和。
iv.使用IPA(4.5升)将上述材料制粒
v.将上述混和物过30目筛。
vi.将混和物干燥15min。
vii.在45℃-50℃干燥颗粒,直至LOD为2-3%。
i.在快速混和造粒机中混和A部分和B部分颗粒10分钟。用胶体二氧化硅(2.60kg)、姜黄提取物(3.96kg)、乳香提取物(10.60kg)、聚克立林钾(2.60kg)、微晶纤维素(2.20kg)和月桂基硫酸钠(1.20kg)与IPA(4.5升)制粒,然后过40#筛。加入快速混和造粒机,混合至所需的稠度。
ii.混和15分钟。
iii.在室温下,在流化床干燥器(FBD)中干燥湿物质20分钟。
iv.使用12目筛将该物质通过多磨机,以形成均匀的颗粒。
v.在入口空气温度为60-70℃的流化床干燥器中干燥这些形成的颗粒,直到出口空气温度达到38℃(或直到颗粒的含湿量为2-3%)。
vi.通过16目筛筛分半干燥的颗粒,并使用1.5mm筛通过多磨机和cad-磨机研磨保留物。
vii.将干燥的颗粒装入双锥搅拌机中,混和10分钟。
viii.用40#筛筛分润滑材料。
ix.向干燥颗粒中加入润滑材料,并混和10分钟。
x.在压片机上压制片剂
xi.在Ganscota上用透明彩色包衣(4.96kg)完成薄膜包被。
过程中测试在以下阶段完成:
i.在必要的尺寸减小和干燥后,检查两种颗粒的含湿量。Q.A.人员抽取复合样品。
ii.例如,使用卡尔费瑟滴定仪(Karl Fischer Titrimeter)测定含湿量。从Q.A.获得合规报告后,进行进一步处理(步骤A颗粒的限值:2-3%,步骤B颗粒的限值:2-3%)
iii.例如,由Q.A.人员检查最终混合片剂(准备灌装)的含湿量。
iv.在压制片剂过程中,每小时监测温度和相对湿度的大气条件。每15分钟检查片剂的平均重量。
用于老年COVID-19患者的示例BV-4051液体制剂
液体或糖浆形式的示例BV-4051制剂在更易受感染的人群中有效地实施治疗,例如老年患者。对于老年个体来说,吞咽片剂可能具有挑战性。植物的液体剂型的制剂,如上面使用的四个示例草药,可以以相似的功效给药,解决了这个问题。如前所述,COVID-19疾病的最高死亡率发生在老年年龄组中,至少在大流行的一个阶段是如此。液体制剂的选择有助于最终递送和患者对治疗方案的依从性。
为了生成示例液体形式,使用水乙醇提取方法单独提取植物。丙二醇用作共溶剂,例如作为50%的水混和物。丙二醇是一种无色无嗅的液体,有甜味。它在食品、饮料和饮品中用作增溶剂、香味增强剂和粘度调节剂,并广泛应用于漱口水和牙膏。丙二醇具有广泛的优点,如生物相容性、生物降解性、稳定性、吸湿性、无毒,更重要的是水溶性。它还具有抑细菌特性和抑真菌特性,因此可以作为防腐剂。
植物提取物,例如上述四个草药的提取物,以与上述固体片剂形式大致相同的比例混和。通过高效液相色谱(HPLC)和薄层色谱(TLC)记录生物活性标记物的浓度。这确保了相同活性存在于液体形式与口服片剂或胶囊中。混和物是具有令人愉快的味道的透明液体,其可以容易地给老年或者或生病患者施用用,并且易于在普通人群中使用。
示例结果
BV-4051降低IL-6水平-类风湿性关节炎(RA)研究
本临床研究共注册了182名患者,其中有165例可评估病例。这165名患者中的89名用示例BV-4051的制剂治疗,而93名患者接受安慰剂。两组研究人群的平均年龄为45岁,两队列在基线人口统计学上匹配良好。在完成16周的治疗和对所得数据的分析后,选择继续治疗以延长药物的评估。来自BV-4051组的自愿参加者被注册到该研究的开放标签阶段(OLP),治疗再继续进行为期16周。所有患者在OLP随访32周,之后随访52周,其中一部分随访10年。
在图2中,测量白介素-6的水平,作为疾病修饰活性(disease-modifyingactivity)的直接读数指标。在研究的初始双盲期的16周结束时,BV-4051表现出非常积极的趋势。
在图3中,进一步继续至32周时,IL-6在p值为0.03*时具有统计学显著性。此外,与基线相比,32周时的IL-6水平具有高度统计学显著性p<0.005**(Wilcoxon符号秩检验)。
BV-4051降低类风湿因子(RF)-RA研究
类风湿因子(RF)是免疫系统产生的蛋白质,可攻击体内健康组织。血液中类风湿因子水平的升高最常与自身免疫性疾病有关,如类风湿性关节炎等。对RF的影响是类风湿性关节炎进展中治疗缓解的直接指标。
在图4中,在16周结束时,观察到示例BV-4051的制剂导致RF效价减少。与安慰剂组相比,这种减少具有统计学显著性(通过Mann Whitney秩和检验,p值<0.05)。
BV-4051降低ESR和CRP-RA研究
血液中的高红细胞沉降率(ESR)或高水平C-反应蛋白(CRP)是持续炎症的标志。这可能是由多种病况引起的,从感染到癌症。高CRP水平也可表明有心脏动脉中的炎症,这可意味着心脏病发作或心肌梗塞的风险更高。
在图5-6中,用示例BV-4051的制剂治疗16周趋向于降低ESR和CRP水平。在使用方案进行32周的累积治疗后,这种减少具有统计学意义。这两个参数在连续评估中的变化分别显示在图5和图6中。
BV-4051降低脂多糖(LPS)诱导的巨噬细胞的TNF-α
参考图7,用10ng/ml LPS刺激小鼠巨噬细胞系(RAW 267.7)以诱导炎症途径。24小时后收集细胞上清液,并使用酶联免疫吸附测定(ELISA)检测TNF-α产生。观察到示例BV-4051的制剂在减少TNF-α方面的剂量依赖性效应。在较高剂量下,效果与地塞米松(dexamethasone)类似(如果不是更好的话),地塞米松是一种皮质类固醇,通过阻断核因子κB(NF-κB)途径来抑制经由LPS受体的信号传导。
睡茄增强心肺功能
作为支持使用BV-4051制剂治疗COVID-19疾病的进一步证据,分离制剂主要成分之一,睡茄或Ashwagandha,可增强心肺功能。心血管健康影响氧气递送到全身的速率。其读数包括最大心输出量、肺扩散、血容量和血流量。最大有氧能力(VO
固体和液体剂型的示例BV-4051制剂通过阻断多种促炎细胞因子如IL-6和TNF-α来减轻COVID-19症状。BV-4051制剂可以降低疾病的严重性及其临床表现,从而降低发病率和死亡率。BV-4051制剂还可以抵消在中度和重度COVID-19患者中所见的严重炎症。BV-4051制剂稳定体内凝血因子,提供针对血栓栓塞事件的防范。BV-4051制剂还可针对多种炎症途径,包括NfκB、p38 MAP激酶和TBK-1。BV-4051制剂可以阻止病毒的增殖,阻断这种病毒继续其生命周期所必需的一些常用的细胞宿主因子。BV-4051制剂的安全性已在受控的临床前研究和临床研究中确定。示例BV-4051制剂可以与其他药剂一起使用,如磷酸氯喹、羟氯喹、RNA依赖性聚合酶(RdRp)抑制剂、瑞德西韦、干扰素-α、洛匹那韦(lopinavir)、利托那韦(ritonavir)、利巴韦林(ribavirin)、法匹拉韦(favipiravir)和许多其他药剂。
作为治疗剂或防范剂,BV-4051制剂也可单独使用或与诸如维生素C、赖氨酸、锌等药剂组合使用,以形成安全有效的屏障来刺激身体的防御机制,并有助于针对COVID-19疾病或相关病况的发展。
示例方法
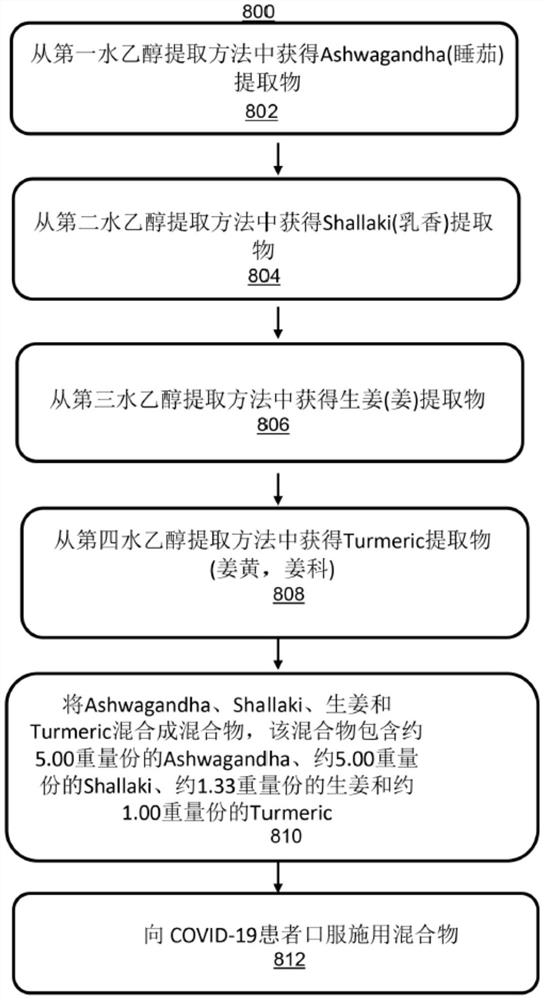
图8显示了在Covid-19患者中中和Covid-19疾病特异性促炎细胞因子的示例方法800。示例方法800的操作在单独的方框中示出。
在方框802,从第一水乙醇提取方法(hydro glycolic extraction process)中获得睡茄提取物。
在方框804,从第二水乙醇提取方法中获得乳香提取物。
在方框806,从第三水乙醇提取方法中获得姜提取物。
在方框808,从第四水乙醇提取方法中获得姜黄提取物。
在方框810中,将睡茄、乳香、姜和姜黄混和成混和物,该混和物包含约5.00重量份的睡茄、约5.00重量份的乳香、约1.33重量份的姜和约1.00重量份的姜黄。
在方框812中,向COVID-19疾病患者施用化合物。
三期临床试验
从2020年9月至2021年4月,进行了多中心、随机、双盲、安慰剂对照的III期临床研究,以评估示例BV-4051配制的片剂结合当前护理标准的安全性和功效,以及示例BV-4051对无并发症的中度SARS-CoV-2感染(COVID-19)受试者的炎症生物标志物的影响。
按照方案、国际协调会议(ICH)以及所有适用的良好临床实践(GCP)和法规进行研究。所有必需的研究文件都按照监管机构的要求存档。研究由位于加利福尼亚州圣何塞(San Jose,California)的全球临床研究组织Klinera Global Services管理。方案于2020年8月31日提交到印度药品管理总局,并于2021年9月16日修订。方案还于2020年8月31日同一天提交到印度政府Ayush部门,并于2021年9月16日修订。研究已在印度临床试验注册中心注册,详情如下:
http://ctri.nic.in/Clinicaltrials/showallp.php?mid1=46041&EncHid=&userName=BV-4051CTRI/2020/09/027817[注册时间:2020年9月15日]
BV-4051临床研究方案概要-药品代码:BV-4051
标题:多中心、随机、双盲、安慰剂对照的III期临床研究,以评估BV-4051片剂结合当前护理标准的安全性和功效及其对无并发症的中度SARS-CoV-2感染(COVID-19)受试者炎症生物标志物的影响。
研究中心:4个研究中心,竞争注册方法。
临床开发阶段:III期
群体:
纳入标准:
1.男性,女性
2.18至65岁
3.患有急性无并发症中度冠状病毒感染、需要住院治疗且体温≥38℃(100.4°F)的受试者;加上至少一种呼吸道症状(鼻塞、喉咙痛、咳嗽、呼吸困难{呼吸频率≥每分钟24次呼吸或室内空气中的氧饱和度(SpO
4.在第1次访视前,通过逆转录聚合酶链反应(RT-PCR)或其他经批准的市售或公共卫生测定确定为实验室确诊SARS-CoV-2感染(COVID-19)的受试者。
5.在第1次访视前至少48小时但不超过96小时症状发作(筛查;研究药物施用访视)。症状发作被定义为:
a.体温首次升高至≥38℃(100.4°F)的时间;或者
b.受试者经历至少一种全身或呼吸道症状的时间。
6.能够理解并愿意签署知情同意书(ICF)的受试者。
7.愿意并能够遵守所有预定访视、治疗计划、实验室检测、生活方式考虑和其他研究程序的受试者。
8.所有有生育能力的女性受试者都必须记录阴性尿妊娠检验结果。所有有生育能力的女性受试者和男性受试者及其配偶/伴侣同意在整个研究期间使用医学上可接受的避孕方法(例如,禁欲、避孕环、双重屏障方法,如避孕套+杀精剂或避孕套+杀精剂隔膜、埋植避孕药、口服避孕药或有确认为无精子症的输精管切除的伴侣),研究药物停用后女性持续30天,男性持续90天。
排除标准:
1.需要加强住院治疗的严重COVID-19感染受试者。
2.第1天随机分组时需要机械通气或ECMO的受试者。
3.出现严重症状的受试者,如呼吸频率>每分钟30次呼吸或室内空气中的氧饱和度(SpO
4.筛查前患有其他并发感染、需要系统性抗病毒治疗的受试者。
5.在第一次给药前的前4周内施用免疫调节剂、干扰素诱导剂、顺势疗法、激素替代疗法以外的激素和抗病毒药物。允许使用皮质类固醇作为当前护理标准的一部分。
6.患有以下任何记录在案的病况的受试者:不受控制的高血压(收缩压>140毫米汞柱或舒张压>90毫米汞柱)、糖尿病、哮喘(任何当前或近期的,如果已治愈,则非儿童时期)、COPD(任何)、心脏、肝脏、肾脏(包括eGFR<60)和造血障碍、出血倾向或出血性疾病、神经系统疾病、免疫系统受损(包括接受免疫抑制剂治疗的患者,或过去5年内患有癌症或人类免疫缺陷病毒[HIV]感染的患者)、内分泌障碍(包括甲状腺障碍)。
7.患有解剖性鼻塞或大体解剖异常的受试者。比如鼻息肉或者明显的鼻中隔弯曲。
8.BMI≥40的临床肥胖受试者。
9.近期(6个月内)有酗酒或物质滥用史的受试者。
10. 1个月内或研究期间参与其他临床试验。
11.怀孕或哺乳的女性受试者
12.对研究药物成分过敏或已知过敏。
13.吞咽胶囊或片剂有困难的既往病史。
14.研究者认为可能限制或妨碍参与研究或影响研究结果的任何其他相关疾病或病况。
功效参数:
主要参数:调查与安慰剂相比,在减少疾病持续时间和严重性方面的改善。
其中疾病持续时间定义为:缓解所有症状的时间长度,包括发热、鼻塞、咽喉痛、咳嗽、呼吸困难、持续疼痛和断续疼痛、疲劳、头痛、发冷/出汗、腹泻、呕吐、嗅觉障碍和味觉障碍。
从时间0(首次施用研究药物)到症状缓解的时间来计算缓解持续时间。
发烧缓解:口腔温度低于37.3℃(99.10°F),且稳定至少24小时。
其他症状的缓解:症状小于或等于轻度(得分为1或0)且稳定至少24小时。
次要参数:
1.个体症状缓解持续时间的减少:从时间0(首次施用研究药物)到症状小于或等于轻度且稳定至少24小时的时间。
2.发烧缓解持续时间的减少:从时间0(首次施用研究药物)到口腔温度低于37.3℃(99.10°F)的时间。
3.在第一次给药后至第14天结束时,每24小时经历COVID-19症状缓解的受试者的百分比。
4.出现并发症的受试者百分比。
5.在第一次给药后至第14天结束时每24小时严重性评分的平均值。
6.基于自我评估问卷的生活质量评估。
7.需要加强住院治疗的具有严重COVID-19症状的受试者的住院率。
探索性参数:
1.病毒脱落的持续时间:定义为从治疗开始到COVID-19病毒RNA通过定量RT-PCR首次阴性的时间和/或使用其他批准的市售或公共卫生诊断测定的首次阴性COVID-19病毒检测结果的时间。
2.从基线到受试者出院日(从医院治疗后开始)的病毒脱落减少。
3.促炎生物标志物即乳酸脱氢酶(LDH)的改善。c-反应蛋白(CRP)、白介素-6(IL-6)、肿瘤坏死因子(TNF)和红细胞沉降率(ESR)。
安全参数:
通过监测和记录所有AE和严重不良事件(SAE)来评估安全性;定期监测全血细胞计数、临床化学和尿液分析;体检结果、定期测量生命体征,和心电图(EKG)。
合并用药:
研究期间,方案不允许在治疗COVID-19或相关症状时使用除了当前护理标准允许之外的任何其他药物;包括但不限于抗病毒药物、激素药物、解热镇痛药和任何草药或补充剂。
撤回标准
研究者的决定
1.研究者认为可使受试者无资格参与该研究的并发症或生理异常。
2.受试者接受了少于80%或多于120%的研究药物。
3.研究者认为,出于安全原因,有严重不良事件的受试者会需要退出BV-4051研究。
4.使用方案禁用药物的受试者。
5.受试者停止服用研究药物或拒绝遵守研究访视、治疗计划、实验室检测、生活方式考虑和其他研究程序。
6.万一发生研究参与者变得严重,需要加强住院治疗;服用口服研究产品可能会有困难。因此,受试者会退出研究;然而,会记录直至他们出院前的进展。
受试者的决定
研究的参与是自愿的,允许受试者随时退出研究,无论有无任何理由。
在所有撤回的病例中,研究药物在完成或停止参与试验的48小时内以原包装返回到站点。
统计分析
·人口统计学、处置和基线特征按治疗分配制成表格。
·为所有连续变量提供了描述性统计数据(n、平均值、标准偏差[SD]、中位数、最小值和最大值)。为分类变量提供了患者的频率计数(n)和百分比(%)。
·对连续数据使用ANOVA/ANCOVA以及对分类数据使用卡方检验来分析所有功效和安全性终点。
·对药物不良反应进行了统计描述。χ
·除非另有说明,所有统计检验均在5%显著性水平下进行。
结果
该多中心研究在印度西部马哈拉施特拉邦的4家医院进行。自大流行开始以来,这个邦的COVID-19疾病病例最多,是排名第二的邦的3倍多。此外,这个邦的COVID-19死亡人数最多,是排名第二的邦的4倍多。这显示了研究受试者人群中疾病的严重性。每个站点都是COVID-19治疗多专科医院,拥有所有超现代诊断设备,以及全面的重症监护病房和心脏监护病房,用于治疗中度至重度COVID-19患者,并处理疾病所有可能的并发症。过去,主要研究者和临床试验人员在开展严格的临床研究方面训练有素且经验丰富。
在2020年9月下旬至2021年2月15日的第一波大流行期间,招募并完成了82名受试者的研究。在2021年2月15日至2021年4月3日的第二波期间招募并完成了94名受试者的研究。第二波是由于双突变病毒变体,即B.1.617。报道这种变体是从加利福尼亚和南非的其他变体发展而来的。
样本大小
1.筛选了总共215名中度COVID-19受试者以纳入本试验。其中,206名受试者被随机分组,其中176名受试者完成了为期14天的研究。
2.根据第1天的随机方案,所有随机受试者以1:1的比例被分配到两组中的一组。
A)A组:BV-4051片剂+当前护理标准,89名受试者。
B)B组:安慰剂片剂+当前护理标准,87名受试者。
受试者访视于2021年4月3日结束。整个分析工作范围和生物统计学需要几个星期才能完成。积极治疗组和安慰剂组之间的人口统计学数据非常匹配。积极治疗的受试者中未报告重大不良事件。在研究期间,积极治疗组的体征和症状没有恶化,也没有死亡。对主要疗效——疾病持续时间的缩短进行了中期分析。BV-4051制剂在缓解所有症状方面实现了统计学显著性,在意向治疗分析中p=0.038,按照方案分析p=0.027。
治疗COVID-19最常用的两种非疫苗药物是瑞德西韦和托珠单抗。Wang和他的同事报道了在2020年5月完成的在237名受试者中使用瑞德西韦的第一项研究显示没有显著效果。美国国立卫生研究院(ACTT-1)进行的第二项研究对1063名受试者进行了研究,结果显示,与安慰剂组的15天出院相比,瑞德西韦组的11天出院具有优势。Spinner及其同事报道的在美国、欧洲和亚洲的105家医院对584名受试者进行的一项更广泛的研究显示,在主要终点和次要终点分析中,积极治疗组(N=193)与安慰剂组(N=200)没有差异。
在对243名受试者的研究中,托珠单抗药物未显示出预防插管或死亡的功效。此外,它在控制COVID-19疾病方面也没有显示任何确定的功效。
示例BV-4051制剂,也称为Artovid-20,即使在第二波COVID-19感染期间也显示出功效的统计学显著性,这是由于SARS-CoV-2病毒的双突变变体。这种BV-4051制剂在防范和治疗SARS-CoV-2病毒突变株方面可具有额外的优势。
临床试验的数据表
图9显示了III期临床试验的受试者处置,该临床试验题为“多中心、随机、双盲、安慰剂对照的III期临床研究,以评估BV-4051片剂结合当前护理标准的安全性和功效及其对无并发症中度SARS-CoV-2感染(COVID-19)受试者的炎症生物标志物的影响”。
图10显示了III期临床试验的人口统计学特征,该临床试验题为“多中心、随机、双盲、安慰剂对照的III期临床研究,以评估BV-4051片剂结合当前护理标准相的安全性和功效及其对无并发症中度SARS-CoV-2感染(COVID-19)受试者的炎症生物标志物的影响。”
图11显示了III期临床试验的主要功效分析(ITTI人群),该临床试验题为“多中心、随机、双盲、安慰剂对照的III期临床研究,以评估BV-4051片剂结合当前护理标准的安全性和功效及其对无并发症中度SARS-CoV-2感染(COVID-19)受试者的炎症生物标志物的影响。”
图12显示了III期临床试验的主要功效分析(PP人群),该临床试验题为“多中心、随机、双盲、安慰剂对照的III期临床研究,以评估BV-4051片剂结合当前护理标准的安全性和功效及其对无并发症中度SARS-CoV-2感染(COVID-19)受试者的炎症生物标志物的影响。”
在前述说明书中,已经描述了本发明的具体实施方案。然而,本领域的普通技术人员可以理解,在不脱离如下面权利要求中阐述的本发明的范围的情况下,可以进行各种修改和变化。因此,说明书和附图被认为是示例说明性的,而不是限制性的,并且所有这样的修改都旨在包括在本发明的范围内。益处、优势、问题的解决方案以及可导致任何益处、优势或解决方案出现或变得更加显著的任何元件都不应被解释为任何或所有权利要求的关键的、必需的或必要的特征或元件。本发明仅由所附权利要求限定,包括在本申请悬而未决期间所做的任何修改以及所发布的那些权利要求的所有等同物。
- 用于治疗、预防或改善阿尔茨海默氏症的组合物、用于抑制脑神经细胞死亡的组合物、用于抑制由β淀粉样蛋白诱导的小胶质细胞激活的组合物、及用于抑制由β淀粉样蛋白诱导的PGE2、TNF-α或IL-1β产生的组合物
- 包含神经营养剂、凋亡信号传导片段抑制剂(FAS)或FAS配体(FASL)抑制剂、肿瘤坏死因子-α(TNF-α)或TNF受体抑制剂、线粒体肽、寡核苷酸、趋化因子抑制剂或半胱氨酸-天冬氨酸蛋白酶抑制剂的药物递送系统
