无形变组织透明化用脱脂脱色组合物及其应用
文献发布时间:2023-06-19 19:38:38
技术领域
本发明涉及组织透明化领域,具体地涉及一种无形变组织透明化用脱脂脱色组合物及其应用。
背景技术
组织透明化(optical clearing)是指通过对组织的处理,减小组织内折射率的不均一性,从而使光可以穿透厚组织进行成像,并增强成像效果。组织透明化技术使动物组织器官的完整三维结构成像及重建成为可能,从而促进对于复杂生物系统的构建方式进行系统地理解。
组织透明化的本质在于移除或者匹配组织中不均一折射率的成分,从而减小光在穿透折射率界面时的折射和反射,从宏观上来看就是组织变得透明。组织中具有较高折射率的组分包括不可溶的纤维蛋白束(1.52)、脂膜及富含脂膜的细胞器(1.4-1.5)、胞浆(1.4)等,而具有低折射率的组分主要是细胞外液(1.33-1.37)。因此,如何将这些不均折射率的组分匹配到同一水平是各类组织透明化技术开发的关键。无论何种折射率匹配方案,均要将组织中的脂质成分脱除,这样才能保证组织的透明度,所以脱脂与脱色试剂的使用是组织透明化的核心步骤。
组织透明化技术按照原理可以大致分为三类:水性透明化技术、有机溶剂透明化技术和凝胶透明化技术。水性透明化技术,例如CUBIC-X、ScaleA2、ScaleS等技术,主要使用高浓度尿素(4M)配合非离子型表面活性剂(例如,TritonX-100)进行透明化。尿素作为可跨膜的蛋白变性剂,可以和蛋白结构中疏水的部分形成氢键从而改变蛋白结构,由此使得本身不可溶或溶剂化程度低的蛋白高度溶剂化,或称为超水化作用(hyperhydration)。超水化的蛋白组分将更趋向于和溶剂的折射率保持一致,将尿素和表面活性剂的脱脂作用结合,整体组织在较长浸泡时间后可以达到比较好的透明度。但是,采用这种方法,蛋白超水化会导致蛋白的不可逆变性进而导致内源荧光信号的损失,并且纤维蛋白结构的疏松会导致组织整体严重的膨胀变形。
有机溶剂透明化技术,例如iDisco和BABB等,利用不溶于水的有机试剂进行脱脂、脱水和折射率匹配。通常有机溶剂相比于水性试剂会更加强烈地使蛋白质变性,并很难保持内源荧光的稳定,同时会造成比较剧烈的组织皱缩。绝大多数有机溶剂透明化试剂都是有毒的,需要配备安全防范措施。
凝胶透明化技术,例如CLARITY、PACT、SHIELD等,使用聚丙烯酰胺或环氧树脂等水凝胶网格包被组织,限制其中生物大分子的移动,再使用高浓度的离子型强洗涤剂(例如,SDS)与脂质结合,并通常使用电场加速带负电的脂质团脱离组织。由于SDS也是一种比较强的蛋白变性剂,所以与水性透明化效果类似,凝胶透明化技术也会导致荧光信号的损失以及组织的膨胀变形,但是使用电场促进后速度快于大部分水性透明化方法。
由于透明化要求对组织各组分的性质有比较大的变化,几乎所有现有的透明化方法都无法实现组织尺度的维持与组织形态的保证,也就是无法排除透明化方法本身对器官组织结构的影响。此外,各类透明化方法对于内源荧光的保持是不够的,这样就无法对弱信号进行更有效的检测。对宏观形态的维持和对内源荧光的保持,两者其本质都是对蛋白结构的保护。现有的水性透明化方法中常用的高浓度尿素、有机溶剂透明化方法中的有溶剂以及凝胶透明化方法中的高浓度强阴离子型洗涤剂都是导致蛋白变性的因素。
水性透明化的ScaleS技术使用低浓度的洗涤剂和高浓度尿素以及高浓度的糖类,在组织膨胀之后又将组织收缩到了原有的大小。这是因为尿素引起的蛋白超水化舒展作用力和高浓度糖类引起的渗透压力达到了平衡。但是该方法在微观上依然没有从原理上保持细胞的形态,并且在处理过程中有高浓度尿素使组织膨胀到两倍左右的一个过程。此外,该方法由于没有有效移除脂质,所以透明度比较有限。
因此,需要开发一种快速高效的、对组织没有形态学影响的、保持组织内生物大分子活性的组织透明化用脱脂脱色配方。
发明内容
针对现有技术中的上述问题,本发明的主要目的在于提供一种新型组织透明化用脱脂脱色组合物,其对蛋白质结构影响小,不引起宏观的组织形变,而且对内源荧光有很好的保护作用,从而能够高效、快速实现组织透明化。
本发明的另一个目的在于提供使用根据本发明的组织透明化用脱脂脱色组合物进行组织透明化的方法,其能够在保持内源荧光信号与蛋白活性的同时避免脱脂脱色过程中组织的形变。
而且,由于采用本发明的组织透明化用脱脂脱色组合物对组织处理过程中没有或几乎没有组织形变,因此可以对动物进行经心灌注,从而进一步加快透明化的均匀度与速度。此外,由于不会或几乎不会引起组织形变,还可以将本发明的组织透明化用脱脂脱色组合物应用于组织切片在玻片上的透明化,以应用于高信噪比的超分辨成像与大批量快速透明化成像。
因此,在一方面,本发明提供了一种组织透明化用脱脂脱色组合物,所述组合物包含:含脂肪酸侧链的甜菜碱类表面活性剂;和含胆酸侧链的阴离子表面活性剂。
在一些实施方式中,在根据本发明的组织透明化用脱脂脱色组合物中,所述含脂肪酸侧链的甜菜碱类表面活性剂可以选自月桂酰胺丙基羟磺基甜菜碱LHSB、十二烷基二甲基羟丙基磺基甜菜碱和十四烷基二甲基羟丙基磺基甜菜碱中的一种或多种。
在一些实施方式中,在根据本发明的组织透明化用脱脂脱色组合物中,所述含胆酸侧链的阴离子表面活性剂可以包含源自胆酸类化合物的侧链。优选地,所述胆酸类化合物可以选自胆酸、石胆酸、脱氧胆酸和鹅脱氧胆酸中的一种或多种。在一些具体实施方式中,所述含胆酸侧链的阴离子表面活性剂可以进一步与胺类化合物形成铵盐复合物。
在一些实施方式中,根据本发明的组织透明化用脱脂脱色组合物还可以包含流动性增强剂。
在另一方面,本发明提供了一种组织透明化方法,所述方法包括使用根据本发明的组织透明化用脱脂脱色组合物处理组织样品。
在一些实施方式中,根据本发明的组织透明化方法包括:使用第一脱脂脱色组合物处理组织样品;和
将经第一脱脂脱色组合物处理的组织样品转移至第二脱脂脱色组合物中,
其中,所述第一脱脂脱色组合物和所述第二脱脂脱色组合物可以相同或不同。
在一些具体实施方式中,所述第一脱脂脱色组合物不同于所述第二脱脂脱色组合物。在一些优选实施方式中,所述第一脱脂脱色组合物不含流动性增强剂。在一些优选实施方式中,所述第二脱脂脱色组合物包含比所述第一脱脂脱色组合物更高含量的含脂肪酸侧链的甜菜碱类表面活性剂。
在一些实施方式中,根据本发明的组织透明化方法还包括将经脱脂脱色组合物处理的组织样品置于水性折射率匹配液中保持。
在本发明中,通过将甜菜碱类表面活性剂以及胆酸类表面活性剂和胺类进行复配,提供了一种全新的水性透明化脱脂脱色配方。通过根据本发明的组织透明化用脱脂脱色组合物或使用其的组织透明化方法,能够获得极佳的脱脂脱色效果,同时不改变组织形态,进而可以保护内源荧光。本发明的组织透明化用脱脂脱色组合物的脱脂效率远高于现有技术中常用的水性脱脂方法(例如,CUBIC-X),并且由于其不改变组织形态的特性,可以使用其进行经心灌注,能够极大地加速脱脂过程,例如将长达数周的脱脂过程缩短到两天以下。此外,由于本发明的组织透明化用脱脂脱色组合物的非形变特性,还可以将其应用于组织切片在玻片上的透明化,从而应用于高信噪比的超分辨成像与大批量快速透明化成像。
本发明的组织透明化用脱脂脱色组合物或使用其的组织透明化方法可以适用于离体组织、在体器官、厚切片、薄切片、全器官,但不限于此。特别是,由于其可进行灌注脱脂的优点,使得在大型动物(例如,非人灵长类)等中具有巨大的应用潜力。
附图说明
本发明所描述的附图仅为了对本发明的选定实施方式进行说明,而不是所有可能的实施方式,其并非意在限制本发明的范围。
图1示出了几类不同的脱脂分子的化学结构示意图,其中,1类为尿素类,例如尿素;2类为脂肪酸链阴离子表面活性剂,例如十二烷基硫酸根离子;3类为非离子型表面活性剂,例如Triton X-100;4类为胆酸链两性离子表面活性剂,例如3-[3-(胆酰胺丙基)二甲氨基]丙磺酸内盐(CHAPS),例如桂酰胺丙基羟磺基甜菜碱(LHSB);5类为胆酸阴离子表面活性剂,例如脱氧胆酸根离子;6类为脂肪酸链两性离子表面活性剂(甜菜碱类表面活性剂)。
图2示出了几类不同的脱脂分子对组织尺寸的影响,其中1至6分别如图1所示。可以看出,5类的胆酸阴离子表面活性剂,包括N,N-二异丙基乙醇胺-胆汁酸盐(DIDC),不会引起组织形变;6类甜菜碱类表面活性剂也不会引起组织形变,而其他类别均引起不同程度的组织膨胀。
图3示出了几类不同的脱脂分子的脱脂能力的测定结果,其中1至6分别如图1所示。
图4是示出与现有技术的透明化方法相比使用根据本发明的实施方式的脱脂脱色组合物进行组织透明化的脱脂效果的结果的图。
图5是示出与现有技术的透明化方法相比使用根据本发明的实施方式的脱脂脱色组合物进行组织透明化的组织形变、脱脂效率和荧光信号保持的结果的图。
图6示出了使用根据本发明的实施方式的脱脂脱色组合物对小鼠进行全器官透明化的结果的照片。上图从左到右依次为小鼠脑脱脂脱色前、脱脂脱色后、折射率匹配后的照片;下图示出了经透明化后的小鼠的心、肝、脾、肺、肾、脑的形态的照片。
图7示出了对经透明化处理的200微米厚的Thy1-YFP小鼠脑切片进行成像的结果的照片。其中,a)仅进行折射率匹配而未经脱脂脱色剂处理;b)使用快速预脱脂脱色试剂处理并进行折射率匹配;c)使用快速预脱脂脱色试剂和最终脱脂脱色试剂处理并进行折射率匹配;d)三维成像的两个视角的最大亮度投影图像,左侧为透明化处理后,右侧为透明化处理前;e)经完整透明化处理后的明场图像;f)仅进行折射率匹配的明场图像;g)不进行任何透明化处理的100微米小鼠脑切片明场图像。
具体实施方式
在下文中,将更详细地描述本发明的实施方式以帮助理解本发明。应当理解,对于这些实施方式的描述仅出于说明性目的,而并非意在以任何方式对本发明所要求的保护范围进行限制。
由于透明化要求对组织各组分的性质有比较大的变化,几乎所有现有技术中的透明化方法都无法实现组织尺度的维持与组织形态的保证,也就是无法排除透明化方法本身对器官组织结构的影响。此外,各类现有技术的透明化方法对于内源荧光的保持是不够的,这样就无法对弱信号进行更有效的检测。对宏观形态的维持和对内源荧光的保持,两者其本质都是对蛋白结构的保护。现有的水性透明化方法中常用的高浓度尿素、有机溶剂透明化方法中的有溶剂以及凝胶透明化方法中的高浓度强阴离子型洗涤剂都是导致蛋白变性的因素。
发明人深入研究了各类表面活性剂在脱脂能力、对组织形态影响、对内源荧光蛋白方面的影响后发现,通过采用甜菜碱类表面活性剂和胆酸类表面活性剂进行复配,不仅能够实现显著优于现有技术的方法的脱脂脱色,并且特别是在排除了尿素及尿素类似物或具有超水化作用的含有酰胺键的试剂以及十二烷基硫酸钠(SDS)等强离子表面活性剂的情况下,不会造成组织的形变。
图1示出了几类不同的脱脂分子的化学结构示意图,其中,1类为尿素类,例如尿素;2类为脂肪酸链阴离子表面活性剂,例如十二烷基硫酸根离子;3类为非离子型表面活性剂,例如Triton X-100;4类为胆酸链两性离子表面活性剂,例如3-[3-(胆酰胺丙基)二甲氨基]丙磺酸内盐(CHAPS);5类为胆酸阴离子表面活性剂,例如脱氧胆酸根离子;6类为脂肪酸链两性离子表面活性剂(甜菜碱类表面活性剂),例如桂酰胺丙基羟磺基甜菜碱(LHSB)。图2示出了几类不同的脱脂分子对组织尺寸的影响,其中1至6分别是图1所示的1至6类。可以看出,5类的胆酸阴离子表面活性剂,包括N,N-二异丙基乙醇胺-胆汁酸盐(DIDC),不会引起组织形变;6类甜菜碱类表面活性剂也不会引起组织形变,而其他类别均引起不同程度的组织膨胀。
因此,在一方面,本发明提供了一种组织透明化用脱脂脱色组合物,所述组合物包含:含脂肪酸侧链的甜菜碱类表面活性剂;和含胆酸侧链的阴离子表面活性剂。
含脂肪酸侧链的甜菜碱类表面活性剂具有快速的组织脱脂效果、不引起组织形变的性质、良好的内源荧光维持能力、高化学稳定性和极高的溶解度、对其它功能性脱色试剂的增溶性。在一些实施方式中,所述含脂肪酸侧链的甜菜碱类表面活性剂可以选自月桂酰胺丙基羟磺基甜菜碱LHSB、十二烷基二甲基羟丙基磺基甜菜碱和十四烷基二甲基羟丙基磺基甜菜碱中的一种或多种,但不限于此。
在一些实施方式中,所述组合物可以包含约1%w/v至约50%w/v的含脂肪酸侧链的甜菜碱类表面活性剂。优选地,所述含脂肪酸侧链的甜菜碱类表面活性剂的含量为约1%w/v至约50%w/v,更优选为约3%w/v至约30%w/v,最优选为约3%w/v至约25%w/v。
在一些实施方式中,含胆酸侧链的阴离子表面活性剂可以包含源自胆酸类化合物的侧链。优选地,所述胆酸类化合物可以包括胆酸、石胆酸、脱氧胆酸或鹅脱氧胆酸中的一种或多种,但不限于此。在一些具体实施方式中,所述含胆酸侧链的阴离子表面活性剂可以进一步与胺类化合物形成铵盐复合物。特别地,通过将碱性的胺类脱色剂(例如,N,N-二异丙基乙醇胺)与胆酸类化合物混合,获得偏碱性的胺-胆酸盐复合物,同时具有快速脱脂和快速脱色的能力,且不会引入其他无效离子,例如脱氧胆酸钠中的钠离子。优选地,所述胺类化合物选自N,N-二异丙基乙醇胺、N-丁基二乙醇胺、N,N’,N,N’-四-羟丙基乙胺四乙酸(Quadrol)、1-(3-氨基丙基)咪唑、三乙醇胺和N-甲基二乙醇胺中的一种或多种,但不限于此。
在一些实施方式中,所述组合物可以包含约1%w/v至30%w/v的含胆酸侧链的阴离子表面活性剂。优选地,所述含胆酸侧链的阴离子表面活性剂的含量为约1%w/v至约30%w/v,更优选为约5%w/v至约25%w/v,最优选为约15%w/v至约25%w/v。
在一些实施方式中,含胆酸侧链的阴离子表面活性剂可以进一步与胺类化合物形成铵盐复合物。优选地,所述胺类化合物选自N,N-二异丙基乙醇胺、N-丁基二乙醇胺、Quadrol、1-(3-氨基丙基)咪唑、三乙醇胺和N-甲基二乙醇胺中的一种或多种,但不限于此。在一些具体实施方式中,基于所述组织透明化用脱脂脱色组合物,所述含胆酸侧链的阴离子表面活性剂的浓度为1%w/v至15%w/v,优选为3%w/v至15%w/v。在一些具体实施方式中,基于所述组织透明化用脱脂脱色组合物,所述胺类化合物的浓度为1%w/v至20%w/v,优选为3%w/v至12%w/v。
在一些实施方式中,根据本发明的组织透明化用脱脂脱色组合物还可以包含流动性增强剂。在一些实施方式中,所述流动性增强剂可以选自硫脲类化合物和尿素,优选地,所述硫脲类化合物包括硫脲。通过在脱脂脱色组合物进一步加入流动性增强剂,可以增加细胞膜流动性、增加脂质溶解度、帮助在脱脂初期维持组织形态。在优选实施方式中,脱脂脱色组合物包含5%w/v至25%w/v的流动性增强剂。
在一些实施方式中,根据本发明的脱脂脱色组合物不含尿素或尿素类似物。在一些实施方式中,根据本发明的脱脂脱色组合物不含如十二烷基硫酸钠(SDS)等强离子表面活性剂。
在另一方面,本发明提供了一种组织透明化方法,所述方法包括使用根据本发明的组织透明化用脱脂脱色组合物处理组织样品。
在一些实施方式中,根据本发明的组织透明化方法包括:使用第一脱脂脱色组合物处理组织样品;和
将经第一脱脂脱色组合物处理的组织样品转移至第二脱脂脱色组合物中,
其中,所述第一脱脂脱色组合物和所述第二脱脂脱色组合物可以相同或不同。
在一些具体实施方式中,所述第一脱脂脱色组合物不同于所述第二脱脂脱色组合物。在一些优选实施方式中,所述第一脱脂脱色组合物不含流动性增强剂。在一些优选实施方式中,所述第二脱脂脱色组合物包含比所述第一脱脂脱色组合物更高含量的含脂肪酸侧链的甜菜碱类表面活性剂。
在特别优选的实施方式中,第一脱脂脱色组合物是用于快速预脱脂脱色的组合物,其包含约12%w/v脱氧胆酸钠、约10%w/v N,N-二异丙基乙醇胺和约3%w/v月桂酰胺丙基羟磺基甜菜碱。在特别优选的实施方式中,第二脱脂脱色组合物是用于最终脱脂脱色的组合物,其包含约12%w/v脱氧胆酸钠、约10%w/v N,N-二异丙基乙醇胺、约25%w/v月桂酰胺丙基羟磺酸甜菜碱和约16%w/v硫脲。在某些优选实施方式中,可以采用包含约12%w/v脱氧胆酸钠、约10%w/v N,N-二异丙基乙醇胺和约3%w/v月桂酰胺丙基羟磺基甜菜碱的第一脱脂脱色组合物进行快速预脱脂脱色,其能够在初期迅速对组织进行脱脂,并较快达到饱和;并且在经第一脱脂脱色组合物快速预脱脂脱色后,采用包含约12%w/v脱氧胆酸钠、约10%w/v N,N-二异丙基乙醇胺、约25%w/v月桂酰胺丙基羟磺酸甜菜碱和约16%w/v硫脲的第二脱脂脱色组合物进行最终脱脂脱色,从而最大限度地对剩余的脂质和色素进行脱除。
在一些实施方式中,根据本发明的组织透明化方法还包括将经脱脂脱色组合物处理的组织样品置于水性折射率匹配液中保持。
在一些具体实施方式中,组织透明化方法可以包括以下步骤:
1)获得待进行透明化的组织样品;
2)使用第一脱脂脱色组合物对获得的组织样品进行至少一次第一脱脂脱色;优选地,所述第一脱脂脱色在约34℃至45℃进行约8至24小时;
3)使用第二脱脂脱色组合物对经第一脱脂脱色的组织样品进行第二脱脂脱色;优选地,所述第二脱脂脱色在34℃至45℃进行约8至24小时;;
4)对经第二脱脂脱色的组织样品进行洗涤,并转移到水性折射率匹配液中保持。
在一些具体实施方式中,所述第一脱脂脱色可以进行至少一次,例如进行1次、2次或3次以上。
在一些具体实施方式中,所述组织样品包括离体组织、在体器官、厚切片、薄切片、全器官,但不限于此。在一些具体实施方式中,所述组织样品获自哺乳动物,例如牛、马、猪、狗、羊、大鼠、小鼠、非人灵长类等,但不限于此。
在下文中,将通过实施例更详细地说明本发明。然而,提供以下实施例仅出于说明性目的,而非意在限制本发明的保护范围。本领域技术人员可以在不脱离本发明的范围和精神的情况下可以进行各种修改和变化,并且所述修改和变化也落在本发明的范围之内。
实施例
材料和方法
实验动物:实验使用8-16周的成年雄性或雌性C57BL/6N小鼠。小鼠在进行灌注前使用过量戊巴比妥钠(>100mg/kg)进行麻醉。
试剂、材料、仪器:
1)磷脂浓度的测定:磷脂检测试剂盒(MAK122,Sigma-Aldrich);Nanodrop3000微量分光光度计(ThermoFisher);EnVision多功能酶标仪(Perkin)。
2)组织尺寸明场成像、荧光成像等:全自动数字玻片扫描系统Axio Z1(Zeiss);转盘共聚焦显微镜Dragonfly(Andor)。
3)主要试剂:脱氧胆酸(D2510,Sigma-Aldrich),脱氧胆酸钠(264103,Sigma-Aldrich),N,N-二异丙基乙醇胺(D838068,Macklin),N-丁基二乙醇胺(N802391,Macklin),1-(3-氨基丙基)咪唑(272264,Sigma-Aldrich),月桂酰胺丙基羟磺基甜菜碱(LHSB,Greensense),3-[3-(胆酰胺丙基)二甲氨基]丙磺酸内盐(CHAPS-RO,Sigma-Aldrich),十二烷基硫酸钠(V900859,Sigma-Aldrich),十二烷基苯磺酸钠(PHR1305,Sigma-Aldrich),TritonX-100(T8787,Sigma-Aldrich),尿素(U5128,Sigma-Aldrich),硫脲(T7875,Sigma-Aldrich)。
实施例1.脱脂脱色组合物的制备
图1示出了几类不同的脱脂分子的化学结构示意图,其中,1类为尿素类,例如尿素;2类为脂肪酸链阴离子表面活性剂,例如十二烷基硫酸根离子;3类为非离子型表面活性剂,例如Triton X-100;4类为脂肪酸链两性离子表面活性剂(甜菜碱类表面活性剂),例如桂酰胺丙基羟磺基甜菜碱(LHSB);5类为胆酸阴离子表面活性剂,例如脱氧胆酸根离子;6类为胆酸链两性离子表面活性剂,例如3-[3-(胆酰胺丙基)二甲氨基]丙磺酸内盐(CHAPS)。发明人针对这几类脱脂分子的脱脂能力以及其对组织尺寸的影响进行了测试。
后固定小鼠脑4小时后,使用振动切片机将小鼠脑切成100微米脑片,使用PBS制备临时装片并使用明场照相机拍摄,提取脑片面积;将脑片浸置在对应试剂中37℃24小时,使用对应试剂制备临时装片并使用明场照相机拍摄,提取脑片面积,获得相对面积。参见图2,其中示出了采用上述几类不同的脱脂分子进行脱脂脱色后对组织尺寸造成的影响。其中1至6分别是图1所示的1至6类。可以看出,5类的胆酸阴离子表面活性剂,包括乙醇胺-胆汁酸盐(DIDC),不会引起组织形变;6类甜菜碱类表面活性剂也不会引起组织形变,而其他类别均引起不同程度的组织膨胀。
进一步,通过测定脑组织切片在不同脱脂剂中浸泡2小时和32小时内最高的磷脂浓度(c(PL))以评定不同脱脂剂的脱脂能力。参见图3可以看出,5类的胆酸阴离子表面活性剂或乙醇胺-胆汁酸盐以及6类的甜菜碱类表面活性剂具有最高的脱脂能力以及脱脂速率。因此,为实现最佳脱脂效果,发明人将这两类脱脂剂进行了复配。
将脱氧胆酸钠、N,N-二异丙基乙醇胺和月桂酰胺丙基羟磺酸甜菜碱以及可选的硫脲在溶液中混合并制备本发明的脱脂脱色组合物。具体地,制备了包含12%w/v脱氧胆酸钠、10%w/v N,N-二异丙基乙醇胺和3%w/v月桂酰胺丙基羟磺基甜菜碱的脱脂脱色组合物作为快速预脱脂脱色试剂,其具有在初期迅速对组织进行脱脂的能力,会较快达到饱和。此外,还制备了含12%w/v脱氧胆酸钠、10%w/v N,N-二异丙基乙醇胺、25%w/v月桂酰胺丙基羟磺酸甜菜碱和16%w/v硫脲的脱脂脱色组合物作为最终脱脂脱色试剂,其能够最大限度对剩余的脂质和色素进行脱除。
实施例2.厚切片被动脱脂脱色透明化
通过使用实施例1中制备的快速预脱脂脱色试剂和最终脱脂脱色试剂,对厚组织切片进行被动脱脂脱色透明化,具体步骤如下:
1-通过振动切片机或冷冻切片获得厚度为300微米的小鼠脑切片,将固定后的组织切片置于快速预脱脂脱色试剂中,37℃处理12h。
2-置于新的快速预脱脂脱色试剂中37℃继续处理12h。
3-将组织切片转移到最终脱脂脱色试剂37℃处理12h。
4-置于新的最终脱脂脱色试剂中继续处理12h。
5-使用PBS在常温下漂洗三次,每次10分钟。
6-转移到水性折射率匹配液中,并使用水性折射率匹配液进行封片。
实施例3.切片玻片上脱脂脱色透明化
通过使用实施例1中制备的快速预脱脂脱色试剂和最终脱脂脱色试剂,对贴附于载玻片上的组织切片进行脱脂脱色透明化,具体步骤如下:
1-通过振动切片机或冷冻切片获得50微米厚的小鼠脑切片,将该组织切片贴附于载玻片上并将该载玻片置于PBS中充分洗除包埋剂2-3次。
2-将玻片置于染色缸中,加入快速预脱脂脱色试剂中,37℃孵育1h。
3-将染色缸中的试剂更换为最终脱脂脱色试剂37℃孵育1h。
4-将载玻片置于PBS中充分洗除脱脂脱色剂2-3次。
5-移除多余的PBS并使用水性折射率匹配液进行封片。
实施例4:在体经心灌注全器官透明化
通过使用实施例1中制备的快速预脱脂脱色试剂和最终脱脂脱色试剂,对小鼠进行经心灌注全器官透明化,具体步骤如下:
1-使用预冷肝素-生理盐水溶液对小鼠进行经心灌注,直至血液充分排干。
2-使用4%多聚甲醛(含0.01M磷酸盐缓冲液)对小鼠进行经心灌注15min。
3-使用15ml快速预脱脂脱色试剂对小鼠进行经心灌注,并建立循环回收液体继续进行灌注,连续灌注8h。
4-更换新的15ml快速预脱脂脱色试剂,循环灌注8h。
5-更换15ml最终脱脂脱色试剂,循环灌注8h。
6-更换新的15ml最终脱脂脱色试剂,循环灌注8h。
7-取出器官,使用PBS漂洗,洗除脱脂脱色剂。
8-将器官浸入水性折射率匹配液中。
图6示出了使用根据本发明的实施方式的脱脂脱色组合物对小鼠进行全器官透明化的结果的照片。上图从左到右依次为小鼠脑脱脂脱色前、脱脂脱色后、折射率匹配后的照片;下图示出了经透明化后的小鼠的心、肝、脾、肺、肾、脑的形态的照片。其中,在通过灌注的方法进行脱脂脱色后,再使用折射率匹配剂进行折射率匹配,实现了全器官的透明化。
实施例5:快速脱脂脱色组合物的脱脂效果
我们进一步将本发明的快速脱脂脱色剂与现有技术中常用的脱脂脱色试剂和方法在脱脂速率、组织形变以及对荧光信号的保护等方面进行了比较。
将后固定1天、30%蔗糖脱水2天的小鼠脑组织使用冰冻切片机切成300微米的切片,并立刻称重。加入相当于小鼠脑切片20倍质量的实施例1中制备的快速预脱脂脱色试剂(包含12%w/v脱氧胆酸钠、10%w/v N,N-二异丙基乙醇胺和3%w/v月桂酰胺丙基羟磺基甜菜碱)进行组织透明化处理。此外,对于相同的小鼠脑切片分别使用CUBIC-X脱脂剂(25%w/v尿素,5%w/v Quadrol(N,N’,N,N’-四-羟丙基乙胺四乙酸),15%w/v TritonX-100)或ScaleS透明化试剂(24%w/v尿素,10%w/v甘油,40%w/v山梨糖醇,0.2%w/v TritonX-100,15%w/v DMSO)进行组织透明化处理。在不同时间点对分别用本发明的快速脱脂脱色剂、CUBIC-X脱脂剂或ScaleS透明化试剂处理的小鼠脑切片取样,并分别测定三组脑片的相对面积变化、上清液磷脂含量以及相对荧光变化。对于荧光测定,使用thy1-YFP小鼠,并测定被荧光标记的细胞的绿色荧光强度。
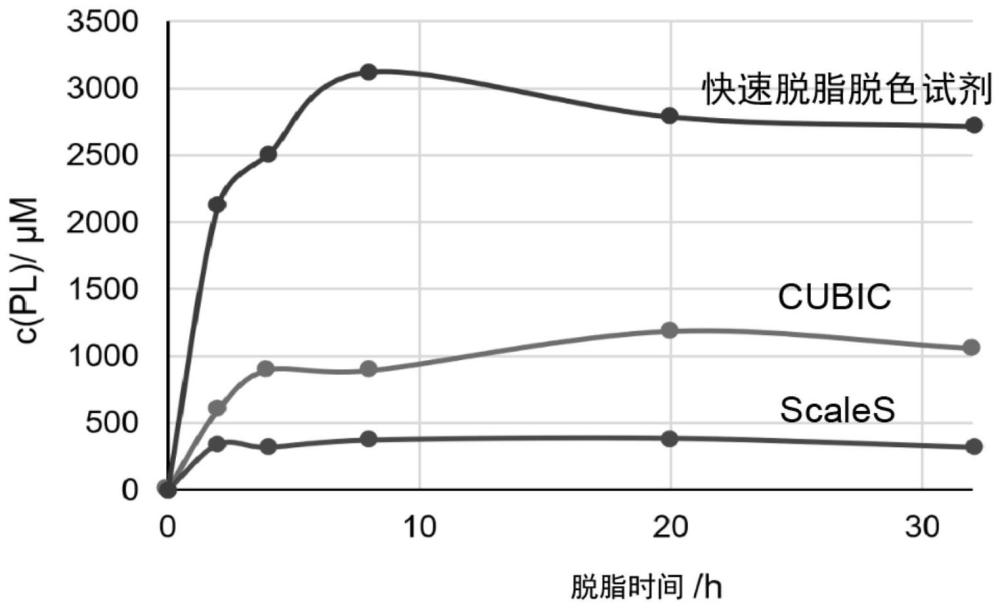
图4是示出与现有技术的透明化方法相比使用根据本发明的实施方式的脱脂脱色组合物进行组织透明化的脱脂效果的结果的图。可以看出,与使用经典水性透明化方法CUBIC和ScaleS中的脱脂脱色试剂相比,使用实施例1的快速预脱脂脱色试剂的脱脂速率明显更快。图5是示出与现有技术的透明化方法相比使用根据本发明的实施方式的脱脂脱色组合物进行组织透明化的组织形变、脱脂效率和荧光信号保持的结果的图。可以看出,与使用经典水性透明化方法CUBIC和ScaleS中的脱脂脱色试剂相比,使用实施例1的快速预脱脂脱色试剂在脱脂脱色过程中不造成脑切片组织形变(左),脱脂效率更高(中),并且更好地保护了GFP荧光信号(右)。
实施例6:脱脂脱色组合物对成像效果的影响
进一步测试了采用本发明的脱脂脱色剂进行组织透明化对成像效果的改善。使用实施例1中制备的快速预脱脂脱色试剂和最终脱脂脱色试剂进行组织透明化。图7示出了对经透明化处理的200微米厚的Thy1-YFP小鼠脑切片进行成像的结果的照片。图7中的a、b、c、d使用转盘共聚焦显微镜拍摄,其中a、b、c使用10倍空气镜进行拍摄,d使用20倍空气镜进行拍摄,均拍摄488/520绿色荧光通道;图7中的e、f、g使用宽场显微镜明场光源和摄像机拍摄。
在图7中,a)仅进行折射率匹配而未经脱脂脱色剂处理;b)使用快速预脱脂脱色试剂处理并进行折射率匹配;c)使用快速预脱脂脱色试剂和最终脱脂脱色试剂处理并进行折射率匹配(完整透明化处理);d)三维成像的两个视角的最大亮度投影图像,左侧为透明化处理后,右侧为透明化处理前;e)经完整透明化处理后的明场图像;f)仅进行折射率匹配的明场图像;g)不进行任何透明化处理的100微米小鼠脑切片明场图像。由图7可以看出,与完全不进行透明化处理或仅进行折射率匹配处理的组织切片相比,通过使用本发明的脱脂脱色剂处理后的成像效果明显改善;此外,与仅采用快速预脱脂脱色试剂相比,在快速预脱脂脱色试剂处理后进一步使用最终脱脂脱色试剂处理实现了更好的成像效果。
- 无碱铝硅酸盐玻璃用组合物、无碱铝硅酸盐玻璃及其制备方法和应用
- 用于生物组织透明化处理的脱脂组合物
- 应用于PVC透明片材的无流纹高二次加工热弹性树脂组合物
