人参皂苷脂质体在免疫调控中的应用
文献发布时间:2024-04-18 19:58:21
技术领域
本申请涉及生物技术领域,特别涉及人参皂苷脂质体在免疫调控中的应用。
背景技术
机体免疫系统在肿瘤发生和病毒感染中扮演重要的角色。免疫系统是由免疫细胞、细胞因子和其他免疫调节分子组成的复杂网络,对于调节免疫应答和维持免疫平衡起着至关重要的作用。然而,在某些疾病状态下,尤其是肿瘤和病毒感染等疾病条件下,免疫微环境中常常存在一些免疫抑制性细胞,它们削弱了针对肿瘤或病毒感染的免疫反应,限制了机体清除肿瘤和病毒的能力。因此,要提高传统化疗和抗病毒治疗的疗效,必须克服免疫抑制性微环境所带来的挑战。
在免疫系统中,髓系来源的抑制细胞(Myeloid-derived suppressor cell,MDSC)是一类高度异质且功能强大的细胞,主要由骨髓分化而来。在肿瘤和病毒感染的条件下,炎症因子和细胞因子的释放促使骨髓中造血干细胞向MDSC分化,其比例显著增加。
MDSC在肿瘤发生和病毒感染期间通过多种机制发挥了多重免疫抑制作用。首先,它们通过产生免疫抑制性分子(如精氨酸酶-1和转化生长因子-β)来抑制T细胞的活性和增殖。其次,MDSC能消耗局部微环境中的重要营养物质,如精氨酸和半胱氨酸,进一步抑制T细胞的功能。此外,MDSC还通过膜结合转化生长因子-β使NKG2D的表达下调,抑制自然杀伤细胞的功能。通过上述机制共同作用下形成了免疫抑制性微环境。因此,面向MDSC开发的治疗策略为克服免疫逃逸所面临的困境,提供了全新的策略和机遇。
人参皂苷Rg3是人参主要的有效成分之一,可介导T、B细胞活化,促进细胞因子分泌,提高机体免疫功能,且毒副反应小,安全性高。但由于Rg3溶解性差、稳定性差、半衰期短、易消除、易降解、生物利用度低等理化性质限制了其临床应用。
基于Rg3和胆固醇的结构相似性,将Rg3替代脂质体中胆固醇开发了人参皂苷脂质体(Rg3-lipo)。人参皂苷脂质体是利用Rg3对脂质体进行修饰,Rg3的疏水性母核结构能够插入脂质膜内部,而亲水性糖基则暴露在脂质体的表面,这种仿生性修饰可有效提高其稳定性、逃避免疫系统的清除以延长其血液循环时间,并能主动靶向肿瘤细胞,减轻药物非靶向释放引起的副反应。在胃癌、胶质瘤和乳腺癌等多种动物模型中,以人参皂苷脂质体作为化疗药物的载体展现出了显著的疗效提升。然而,与人参皂苷脂质体对肿瘤的直接靶向作用相比,目前对人参皂苷脂质体免疫调控机制的认识还十分有限,对人参皂苷脂质体的免疫学机制的深入了解有助于推进其在肿瘤和病毒感染性疾病治疗中的临床应用进程。
肿瘤和病毒感染引起的免疫抑制是当前医学研究的难点。尽管细胞毒性药物在肿瘤治疗中得到广泛应用,但由于肿瘤本身以及化疗药物引起的免疫抑制性微环境,大多数患者都无法对这些治疗产生持久的反应。与此同时,病毒感染性疾病也对免疫系统产生持续的抑制作用,尽管抗病毒治疗可以控制病毒的复制,但并不能完全恢复免疫系统功能,导致病毒无法完全清除。因此,针对肿瘤和病毒感染引起的免疫抑制性微环境这一困境,亟待开发新型药物载体协同负载药物改善免疫抑制性微环境,为提高临床疗效提供新策略。
发明内容
鉴于以上所述现有技术的缺点,为解决现有技术中免疫抑制性微环境导致现有细胞毒性药物和抗病毒药物在肿瘤和病毒感染性疾病中治疗效果有限这一技术问题,本申请的目的在于提供人参皂苷脂质体在免疫调控中的应用,用于解决现有技术中的问题。
本申请研究发现:对于晚期肿瘤和病毒感染性疾病,细胞毒性药物和抗病毒治疗是目前采用的主要治疗方法。化疗和抗病毒药物作为应用最为广泛的治疗方案,对治疗后免疫微环境的影响尚未明确。以往临床经验表明,采用常规剂量的化疗、抗病毒治疗方案,机体肿瘤细胞和感染细胞在受到杀伤的同时,患者的免疫能力也会受到显著的抑制,致使依赖于相对健全免疫系统的免疫疗法难以与化学疗法联合发挥应有的协同效应。因此,探索具有免疫调节作用的药物载体对于改善肿瘤和病毒感染性疾病的临床实践是十分必要的。
既往研究已经证实人参皂苷脂质体具有良好的安全性,同时发现以人身皂苷脂质体作为药物载体可提高药物稳定性、延长其血液循环时间、减轻毒副反应,并主动靶向肿瘤细胞。但对人参皂苷脂质体免疫调控作用机制的研究非常有限,为探究其能否与其他化学疗法联用改善免疫微环境,激活机体免疫从而取得协同治疗效果,进一步开展了系列研究。
本研究首次揭示了人参皂苷脂质体对免疫系统,尤其是对MDSC这一关键免疫抑制性细胞的调控作用。人参皂苷脂质体-药物组合物可以通过与MDSC表面的葡萄糖转运体Glut3结合,从而削弱MDSC的免疫抑制功能,并逆转免疫抑制性微环境,进一步提高所载药物的抗肿瘤和抗病毒免疫疗效,该免疫调节作用此前未有报道。这一发现为人参皂苷脂质体药物递送系统的临床应用提供了新的可能,为晚期肿瘤和病毒感染性疾病患者的治疗提供新选择。
为实现上述目的及其他相关目的,本申请第一方面提供人参皂苷脂质体-药物组合物在制备至少具备以下功效之一的产品中的用途:
1)削弱MDSC的免疫抑制功能;
2)降低MDSC细胞在免疫细胞中的比例;
3)降低MDSC细胞免疫抑制性标记物的表达;
4)增加树突状细胞和/或巨噬细胞在免疫细胞中的比例;
5)增加促炎性标记物的表达;
6)诱导T细胞的活化;
7)促进效应因子的分泌;
8)增强T细胞的增殖;
9)通过下游葡萄糖转运体依赖的方式发挥作用;
10)重塑机体免疫格局;
11)免疫微环境调控;
12)激活机体的抗肿瘤免疫反应;
13)激活机体的抗病毒免疫反应;
其中,所述人参皂苷脂质体-药物组合物中,人参皂苷脂质体包裹药物。
本申请第二方面提供一种免疫微环境调控药物,包括有效剂量的前述的人参皂苷脂质体-药物组合物。
与现有技术相比,本申请的有益效果为:
1、本研究首次揭示了人参皂苷脂质体-药物组合物对免疫系统,尤其是对MDSC这一关键免疫抑制性细胞的调控作用。人参皂苷脂质体-药物组合物可以通过与MDSC表面的葡萄糖转运体Glut3结合,从而削弱MDSC的免疫抑制功能,并逆转免疫抑制性微环境,进一步提高所载药物的抗肿瘤和抗病毒免疫疗效,该免疫调节作用此前未有报道。这一发现为人参皂苷脂质体药物递送系统的临床应用提供了新的可能,为晚期肿瘤和病毒感染性疾病患者的治疗提供新选择。
2、本申请的人参皂苷脂质体-药物组合物通过削弱MDSC的免疫抑制功能,进而促进T细胞的增殖和活化。
3、本申请的人参皂苷脂质体作为新型药物载体,可用于显著改善、增强所载药物在肿瘤和病毒感染性疾病中的治疗效果,避免传统治疗药物引起的耐药,适用于晚期肿瘤和病毒感染性疾病的治疗,尤其为后续治疗提供更好的抗肿瘤和抗感染免疫反应。
4、本申请的人参皂苷脂质体-药物组合物的研究突破将有望把免疫治疗领域推向一个新的前沿,节省资源、时间,并最终挽救患者的生命。人参皂苷脂质体有望成为一种全新具有免疫调节功能的药物载体,为晚期肿瘤患者和病毒感染性疾病患者提供治疗新选择。
附图说明
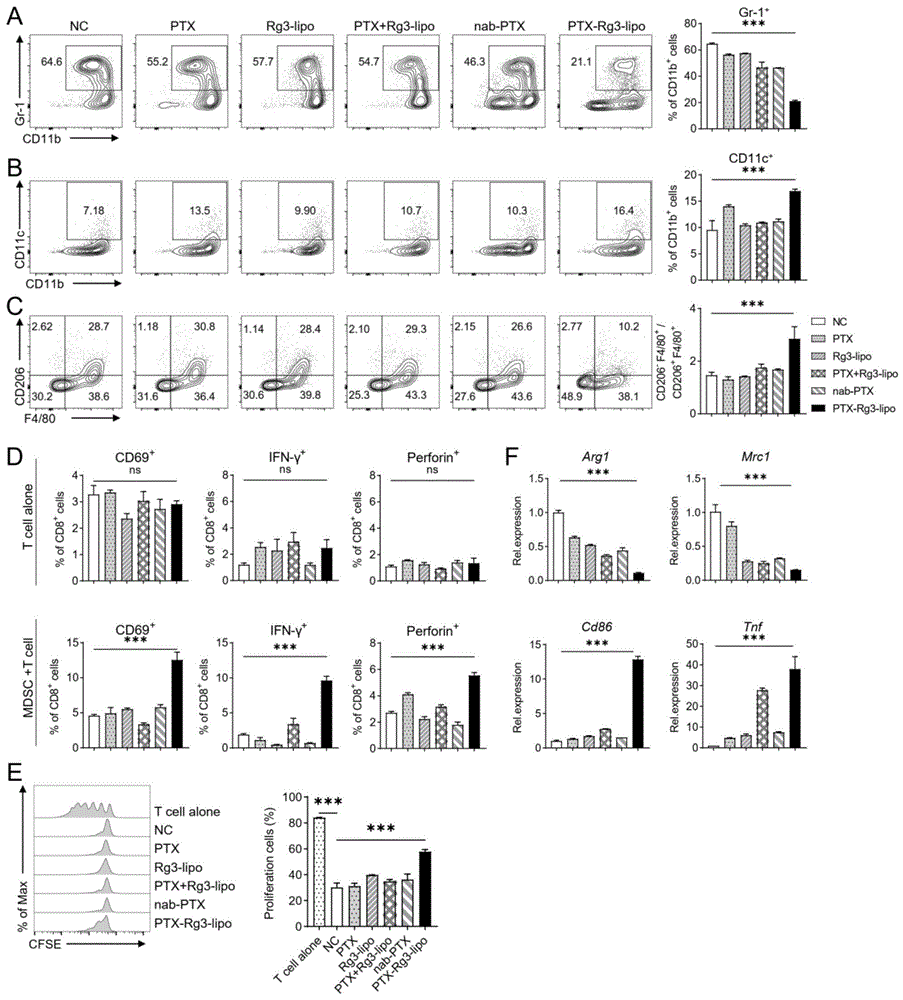
图1为PTX-Rg3-lipo体外削弱MDSC免疫抑制性功能。其中,A-B.MDSC、树突状细胞(Dendritic cell,DC)占免疫细胞的比例;C.促炎型巨噬细胞与抑炎型巨噬细胞的比值;D.CD8
图2为PTX-Rg3-lipo通过Glut3削弱MDSC免疫抑制。其中,A-B.利用人肠癌单细胞数据,分析不同细胞类型葡萄糖转运体的转录水平;C.肿瘤细胞、T细胞和MDSC表达Slc2a1(Glut1)和Slc2a3(Glut3)的水平;D.siRNA敲除MDSC上Glut3的效率;E.siNC和siSlc2a3处理MDSC后予以PTX-Rg3-lipo,检测MDSC、DC的比例;F.siNC和siSlc2a3处理MDSC后予以PTX-Rg3-lipo干预,再与CD8
图3为PTX-Rg3-lipo抗肿瘤治疗效果。其中,A.小鼠皮下荷瘤3×10
图4为PTX-Rg3-lipo改善免疫抑制性微环境。其中,A.小鼠肿瘤局部髓系细胞(Myeloid cell)、MDSC、巨噬细胞(Macrophage)、树突状细胞占免疫细胞的比例;B.分泌IFN-γ、Perforin的CD8
图5为PTX-Rg3-lipo改善免疫抑制性微环境的作用依赖于MDSC。其中,A.小鼠皮下荷瘤3×10
具体实施方式
为了使本申请的发明目的、技术方案和有益效果更加清晰,下面结合实施例对本申请作进一步说明。应理解,所述实施例只用于解释本申请,并非用于限定申请的范围。下述实施例中所使用的试验方法如无特殊说明,均为常规方法,熟悉此技术的人士可由本说明所揭露的内容容易地了解本申请的其他优点及功效。
本申请的发明人经过大量探索研究,发现了人参皂苷脂质体在免疫调控中的应用,在此基础上完成了本申请。
人参皂苷脂质体是利用Rg3对脂质体进行修饰,Rg3的疏水性母核结构能够插入脂质膜内部,而亲水性糖基则暴露在脂质体的表面,这种仿生性修饰可有效提高其稳定性、逃避免疫系统的清除以延长其血液循环时间,并能主动靶向肿瘤细胞,减轻药物非靶向释放引起的副反应。
本申请一方面提供人参皂苷脂质体-药物组合物在制备至少具备以下功效之一的产品中的用途:
1)削弱MDSC的免疫抑制功能;
2)降低MDSC细胞在免疫细胞中的比例;
3)降低MDSC细胞免疫抑制性标记物的表达;
4)增加树突状细胞和/或巨噬细胞在免疫细胞中的比例;
5)增加促炎性标记物的表达;
6)诱导T细胞的活化;
7)促进效应因子的分泌;
8)增强T细胞的增殖;
9)通过下游葡萄糖转运体依赖的方式发挥作用;
10)重塑机体免疫格局;
11)免疫微环境调控;
12)激活机体的抗肿瘤免疫反应;
13)激活机体的抗病毒免疫反应;
其中,所述人参皂苷脂质体-药物组合物中,人参皂苷脂质体包裹药物。
本申请的药物例如紫杉醇经过人参皂苷脂质体包裹之后,可以更好地发挥靶向作用和免疫调控作用。具体地,人参皂苷脂质体作为新型药物载体,可用于显著改善、增强所载药物例如紫杉醇在肿瘤和病毒感染性疾病中的效果,避免传统治疗药物引起的耐药,适用于晚期肿瘤和病毒感染性疾病的治疗,尤其为后续治疗提供更好的免疫反应。人参皂苷脂质体-药物组合物的研究突破将有希望把免疫治疗领域推向一个新的前沿,节省资源、时间,并最终挽救患者的生命。人参皂苷脂质体有望成为一种全新具有免疫调节功能的药物载体,为晚期肿瘤患者和病毒感染性疾病患者提供治疗新选择。
本申请提供的用途中,人参皂苷脂质体-药物组合物中的药物与人参皂苷脂质体中的人参皂苷的质量比为1:1~1.5;具体地,可以为1:1~1.2、1:1.2~1.4、或1:1.4~1.5等。人参皂苷脂质体包裹药物的包封率≥98%。包封率是指被包裹药物在脂质体悬液中占药物总量的百分量。
本申请提供的用途中,人参皂苷脂质体-药物组合物中的药物选自抗肿瘤药物或抗病毒药物。
在一些实施方式中,抗肿瘤药物选自紫杉醇、白蛋白紫杉醇、多西他赛、卡巴他赛、替司他赛、奥他他赛、拉洛他赛、司莫他赛、盐酸伊立替康、羟基喜树碱、氨基喜树碱、7-乙基-10-羟基喜树碱、顺铂、卡铂、奥沙利铂、三尖杉酯碱、高三尖杉酯碱、雷公藤甲素、阿糖胞苷、磷酸依托泊甙、去氧鬼臼毒素、石杉碱甲、酒石酸长春瑞滨、硫酸长春新碱、硫酸长春碱、埃博霉素A、埃博霉素B、埃博霉素C、埃博霉素D、埃博霉素E、埃博霉素F、地西他滨、三氧化二砷、全反式维甲酸、阿奇霉素、盐酸表柔比星、盐酸多柔比星、盐酸氨柔比星中的一种或多种。在本申请一具体实施例中,抗肿瘤药物选自紫杉醇。
在一些实施方式中,抗病毒药物选自艾尔巴韦、格卡瑞韦、阿苏瑞韦、伏西瑞韦、维帕他韦、来迪派韦索磷布韦、盐酸达拉他韦、格卡瑞韦哌仑他韦中的一种或多种。
本申请提供的用途中,削弱MDSC的免疫抑制功能通过下游葡萄糖转运体依赖的方式实现。葡萄糖转运体选自Glut3。在一些实施方式中,人参皂苷脂质体-药物组合物可以通过与MDSC表面的葡萄糖转运体Glut3结合,从而削弱MDSC的免疫抑制功能,并逆转免疫抑制性微环境,进一步提高所载药物的抗肿瘤和抗病毒免疫疗效,该免疫调节作用此前未有报道。这一发现为人参皂苷脂质体药物递送系统的临床应用提供了新的可能,为晚期肿瘤和病毒感染性疾病患者的治疗提供新选择。
本申请提供的用途中,增加巨噬细胞在免疫细胞中的比例包括上调促炎型巨噬细胞与抑炎型巨噬细胞的相对比例。
本申请提供的用途中,效应性标记物选自Cd86或Tnf。
本申请提供的用途中,效应因子选自穿孔素或干扰素。
本申请提供的用途中,抗肿瘤免疫反应中的肿瘤选自肠癌、肾上腺皮质癌、膀胱尿路上皮癌、乳腺癌、宫颈鳞状细胞癌、宫颈内腺癌、胆管癌、淋巴样肿瘤、弥漫性大B细胞淋巴瘤、食管癌、多形性成胶质细胞瘤、头颈部鳞状细胞癌、肾嫌色细胞癌、肾透明细胞癌、肾乳头状细胞癌、急性髓性白血病、脑胶质瘤、肝细胞癌、肺腺癌、肺鳞状细胞癌、间皮细胞癌、卵巢癌、胰腺癌、嗜铬细胞瘤和副神经节瘤、前列腺癌、恶性肉瘤、黑色素瘤、胃癌、睾丸生殖细胞肿瘤、甲状腺癌、胸腺癌、子宫内膜癌、子宫肉瘤、葡萄膜黑色素瘤、多发性骨髓瘤、急性淋系白血病、慢性淋系白血病、慢性髓性白血病、T细胞淋巴瘤中的一种或多种的组合。
本申请提供的用途中,抗病毒免疫反应中的病毒选自流感病毒、腮腺炎病毒、柯萨奇病毒、埃可病毒、肠道病毒、轮状病毒、诺如病毒、肝炎病毒、麻疹病毒、冠状病毒、疱疹病毒、水痘病毒、巨细胞病毒、狂犬病病毒、人乳头瘤病毒中的一种或多种的组合。
本申请另一方面提供一种免疫微环境调控药物,包括有效剂量的前述的人参皂苷脂质体-药物组合物。有效剂量是指药物可以出现药效的剂量。因为药物要有一定的剂量被机体吸收后,才能达到一定的药物浓度,只有达到一定的药物浓度才能出现药物作用。如果剂量过小,在体内不能获得有效浓度,药物就不能发挥其有效作用。但是如果剂量过大,超过一定限度,药物的作用可出现质的变化,对机体可能产生不同程度的毒性。因此要发挥药物的有效作用,同时又要避免其不良反应,就必须严格掌握用药的剂量范围。
本申请提供的免疫微环境调控药物中,还包括药学上可接受的载体、或辅料。
“药学上可接受的”是指当分子本体和组合物适当地给予动物或人时,它们不会产生不利的、过敏的或其它不良反应。
“药学上可接受的载体或辅料”应当与溶酶体调节因子相容,即能与其共混而不会在通常情况下大幅度降低药物的效果。可作为药学上可接受的载体或辅料的一些物质的具体例子是糖类,如乳糖、葡萄糖和蔗糖;淀粉,如玉米淀粉和土豆淀粉;纤维素及其衍生物,如甲基纤维素钠、乙基纤维素和甲基纤维素;西黄蓍胶粉末;麦芽;明胶;滑石;固体润滑剂,如硬脂酸和硬脂酸镁;硫酸钙;植物油,如花生油、棉籽油、芝麻油、橄榄油、玉米油和可可油;多元醇,如丙二醉、甘油、山梨糖醇、甘露糖醇和聚乙二醇;海藻酸;乳化剂,如Tween;润湿剂,如月桂基硫酸钠;着色剂;调味剂;压片剂、稳定剂、抗氧化剂;防腐剂;无热原水;等渗盐溶液;和磷酸盐缓冲液等。这些物质根据需要用于帮助配方的稳定性或有助于提高活性或它的生物有效性或在口服的情况下产生可接受的口感或气味。
本申请所提供的药物可以适应于任何形式的给药方式,可以是口服或胃肠外给药,例如,可以是经肺、经鼻、经直肠和/或静脉注射,更具体可以是真皮内、皮下、肌内、关节内、腹膜内、肺部、口腔、舌下含服、经鼻、经皮、阴道、口服或胃肠外给药。
本领域技术人员可根据给药方式,选择合适的制剂形式,例如,适合于口服给药的制剂形式可以是包括但不限于丸剂、片剂、咀嚼剂、胶囊剂、颗粒剂、滴剂或糖浆等,再例如,适合于胃肠外给药的制剂形式可以是包括但不限于溶液、悬浮液、可复水的干制剂或喷雾剂等,再例如,适合于直肠给药的通常可以是栓剂。
与现有技术相比,本申请的有益效果为:
1、本研究首次揭示了人参皂苷脂质体-药物组合物对免疫系统,尤其是对MDSC这一关键免疫抑制性细胞的调控作用。人参皂苷脂质体-药物组合物可以通过与MDSC表面的葡萄糖转运体Glut3结合,从而削弱MDSC的免疫抑制功能,并逆转免疫抑制性微环境,进一步提高所载药物的抗肿瘤和抗病毒免疫疗效,该免疫调节作用此前未有报道。这一发现为人参皂苷脂质体药物递送系统的临床应用提供了新的可能,为晚期肿瘤和病毒感染性疾病患者的治疗提供新选择。
2、本申请的人参皂苷脂质体作为新型药物载体,可用于显著改善、增强所载药物在肿瘤和病毒感染性疾病中的治疗效果,避免传统治疗药物引起的耐药,适用于晚期肿瘤和病毒感染性疾病的治疗,尤其为后续治疗提供更好的抗肿瘤和抗感染免疫反应。
3、本申请的人参皂苷脂质体-药物组合物的研究突破将有望把免疫治疗领域推向一个新的前沿,节省资源、时间,并最终挽救患者的生命。人参皂苷脂质体有望成为一种全新具有免疫调节功能的药物载体,为晚期肿瘤患者和病毒感染性疾病患者提供治疗新选择。
下面通过实施例对本申请予以进一步说明,但并不因此而限制本申请的范围。
实施例1
1、体外细胞实验
1)体外诱导分化MDSC
a)收集6周龄C57BL/6小鼠的骨髓细胞,ACK破红3min;
b)10倍体积PBS终止,离心4℃,400g 5min,使用小鼠骨髓来源单核细胞诱导培养基(RPMI-1640含有10%FBS、1000U/mL双抗、2mM的谷氨酰胺,1%非必需氨基酸、1%丙酮酸钠)重悬;
c)加入GM-CSF 40ng/mL、IL-6 10ng/mL诱导5天后,将贴壁细胞置于24孔板中;
d)分别予以紫杉醇、人参皂苷脂质体、分离的人参皂苷脂质体和紫杉醇、白蛋白紫杉醇、人参皂苷脂质体-紫杉醇药物组合物处理MDSC细胞。通过流式细胞术检测MDSC表型,通过qPCR检测MDSC转录水平变化,特别是MDSC细胞免疫抑制性标记物和促炎性标志物例如Cd86、Tnf的表达情况。
2)T细胞增殖与活化
将步骤1)处理后的MDSC细胞通过与T细胞共培养,检测T细胞的活化、效应分子IFN-γ、Perforin的分泌及增殖情况。
2、小鼠肠癌模型及给药方案
选取6周C57BL/6小鼠经两周适应性饲养后进行建模,皮下种植3×10
在清除小鼠MDSC实验中,C57BL/6小鼠皮下荷瘤后,分别隔日予以腹腔注射IgG或Gr-1抗体(100μg/只,BioXCell,Clone:RB6-8C5,货号:BE0075),直至实验结束。
紫杉醇(PTX)购自Selleck,用含1%DMSO的5%葡萄糖溶液配制成浓度为10mg/mL(以紫杉醇浓度计)的溶液,使用0.22μm滤器过滤除杂除菌,现配现用。
白蛋白紫杉醇(nab-PTX)购自Celgene Corporation,并用0.9%生理盐水配置成浓度为10mg/mL(以紫杉醇浓度计)的溶液,使用0.22μm滤器过滤除杂除菌,现配现用。
人参皂苷脂质体(Rg3-lipo)由厦门本素药业提供,并用0.9%生理盐水配制成浓度为10mg/mL(以Rg3浓度计)的溶液,使用0.22μm滤器过滤除杂除菌,现配现用。
人参皂苷脂质体-紫杉醇药物组合物(PTX-Rg3-lipo)是人参皂苷脂质体包裹药物后的混合物,由厦门本素药业提供,紫杉醇与所述的Rg3的质量比为1:1.5,PTX-Rg3-lipo中紫杉醇的包封率≥98%。用5%葡萄糖溶液配制成浓度为10mg/mL(以紫杉醇浓度计)的溶液,使用0.22μm滤器过滤除杂除菌,现配现用。
分离的人参皂苷脂质体和紫杉醇(PTX+Rg3-lipo),其浓度及配比与PTX-Rg3-lipo一致。
3、肿瘤浸润免疫细胞分离
a)用颈椎脱臼法处死小鼠,收集小鼠肿瘤组织,尽快取下置于预冷的PBS液体中;
b)将肿瘤组织用剪刀剪碎,根据肿瘤组织解离试剂盒(美天旎,货号:130-096-730)提供的说明书加入2~3mL消化液,于37℃180rpm 45min水平震荡消化小鼠肿瘤组织成单个细胞;
c)离心4℃,400g 5min,用PBS重悬细胞,通过100μm细胞滤器滤去杂质;
d)离心4℃,400g 5min,用PBS重悬细胞,缓慢置于40%/70%Percoll的最上层,形成0%/40%/70%Percoll分离体系,注意不要破坏液面;
e)无刹车室温离心2000rpm 20min后,吸取40%/70%中间悬浮的白色云雾层细胞即为肿瘤浸润单个核细胞;
f)加入大量PBS,离心4℃,400g 5min,重悬于1mL PBS中置于4℃待测。
4、外周血单个核细胞(Peripheral blood mononuclear cell,PBMC)提取
a)准备好EDTA抗凝管,抓取小鼠使其眼球突出,用眼科弯镊摘除眼球,让血液流入抗凝管中,获得足量血液后对小鼠进行安乐死;
b)抗凝血加入等体积的PBS,轻轻混匀后,缓慢置于1mL淋巴细胞分离液(密度为1.084)的上层,注意不要破坏液面;
c)无刹车室温离心2000rpm 20min后,吸取中间悬浮的白色云雾层细胞即为外周血单个核细胞;
d)加入大量PBS清洗细胞,离心4℃,400g 5min;
e)弃上清,加入500μL ACK裂解液,室温破红3min后加入大量PBS清洗细胞,离心4℃,400g 5min,重悬于PBS中置于4℃待测。
5、细胞表面、胞核染色及流式细胞学分析
a)检测细胞因子,在48孔板中每孔加入350μL细胞因子刺激培养基及50μL细胞悬液,置于37℃细胞培养箱中培养6h;收集细胞,将细胞转移至5mL流式管中;
b)使用PBS重悬、洗涤细胞,离心4℃,400g 5min;
c)弃上清,后用Vortex涡旋重悬细胞;
d)设置空白管、单染管等,各管中按说明书要求加入适量的表面染色抗体,4℃避光染色30min;抗体信息如表1:
表1抗体信息
e)加2mLPBS洗涤细胞,离心4℃,400g 5min,加PBS100μL重悬;
f)检测细胞因子,每管加入100μLIC固定液,室温固定30min;
g)加1×穿膜液每管2mL,400g 4℃离心5min,弃上清后重悬,重复2次;
h)各管中按说明书要求加入适量的胞质染色抗体,4℃避光染色40min;
i)加1×穿膜液每管2mL,400g 4℃离心5min,弃上清后重悬,重复2次;
j)应用多色流式细胞仪检测,通过Flowjo分析流式结果。
6、siRNA转染
siRNA由苏州吉玛生物科技有限公司设计,用于下调Glut3的表达水平。siRNA序列如下:对照siRNA,5'-UUCUUCGAACGUGUCACGUTT-3'(SEQ ID NO:1);Sl2c2a3-siRNA,5'-GCCAUGAGCUUUGUCUGUATT-3'(SEQ ID NO:2)。MDSC使用ECM830方形波电穿孔仪(HarvardApparatus BTX;Harvard Apparatus,Holliston,MA,USA)进行电转染。MDSC被收集并在预冷的Opti-MEM(Gibco)中洗涤3次后悬浮。电转染采用500V(300ms/脉冲)进行。随后,将细胞转移到预温的Opti-MEM中,24小时后进行后续实验。
Glut3核苷酸序列(SEQ ID NO:3)如下:
gcctacttaggagcctacgtttttatcatcttcgctgccttcctcatcttcttcctaatcttcaccttcttcaaagtcccggagaccaaaggcaggactttcgaggacattgcccgggccttcgaggggcaggcgcactctggaaaaggccctgccggtgtggagttgaacagcatgcagccggtcaaggagacccctggcaacgcctgagccgggagcacctccttcacctccctccactgtggaaagccacctccccttaagtggggagacctcatcaggatgaaccaggactgcttctgagtgctgctattctcaccccacacactccatgaaaactcagctgcacccaatgctggggttgaccagatcgccaatggcttttaagtgtttgatttgggggatacttcccttgtaatcaggaaagaccaaggaagcctacctttatattgggagggaaggggccgcagctccccttaggttctaaaacccgctaactaggacaactagggagtaggagtagggtgcagcaccgcccccaccaccaccttagtttgccaggaaacagatcttcatacccagtgtggagggccctgggggattgaacaaaagaccccctcctcacttgatacagctctgcacagcaaagtaacttgagttttatttattttatcttcaggttgaattgcataaatatttatttttttaattgtaattttaccaaataatgagacagtaacgaaattgaggttggagggaggtgtttaaagagaggttcaggaggaaagaaagtttggtgctggagagaggttacaacagggaggatggatgttactggtggcctgtgagtcacttcctttgtagatgaagggacactatcccttgttatttctcagaagagcgagtgcctgtactaaaaggctcatggctttctgtgggccttttcttttaagattatagtttttatgtagtgttactaaaatctaggcttgttactaaagtggtctttgtagttagtgatattgatggatttttatgttgcatggagtccagacaagggaggggtcaccgcaagcctctcctttccctggaccaacaccctctctgtcctgtgagctcgctttttcttttctgatggtcaagcccattaccaaacgggcgggcgagcgagcgagccgtgtggatgagacacaaagacagtagttgttgagaggcattagtttcttcaacttagtttttttttaagagattttaggtgttggtttgtttcattttggtttaaagggattcatagctaacttggattttgttacctcagctctgggagaggattttcgctggatgactattaatgacttgttttgagggagtacatttgttgctctagagttgtggcatgctagcctatgtctgttacagtctcaggctgcccttgtttccaggttcctgtgctattgtgctacatgcccaaggggccttggctctgctacacacattagagacagtgactgaatgtgcagtgtggtccacgcatgagggcacaaatgtctgtgcattgtcactttgctctgggcatgaagtccctggtcccttggctcctgtagctttttattgatcgactattagaactcaaccctgtgtacagaagcagcactgcctctgctaggtggagcttgcacccaggattagatgccacccattgggttccctgtccctgttggagagaggtgcttccttgaggtctgaggttggaaggctctacctcactacagctaggaggcgcaatggaaaggtgtgaggtcagggctgtggctcctgaagacccagttgtgggccaagggtggctttatttaaagggagttaagaaacatggcatattggtatgttgatatcaccaagattcccttctgccataggtcacagacaccttcccaactgtcccctcctccacttccataaatggagacaaccctgatggacctcaccccttttccacaggtcactggatcccactgtcaccctcggtgcttacacatttcagaccctttaggcaaacccttgcatagagtggtagagccatatctcagtgctcggtttcagtattcaactctccactccctgtggccagttgggatttaaaaactcagattgctatggaaaggggctttgctgggaaaggcgactcctctaacttcacctcttcagttcctccagtggagtttttacatttgccaatggccatcttgtgaatatcttcatacatactttctattaatgttactgtagtttctgttttgaaataaaacttctgaatgta。
7、RNA的提取及逆转录合成cDNA
7.1RNA的提取
a)每孔细胞转移到RNase-free无菌EP离心管后,加入1mL Trizol室温放置5min,转移到RNase-free无菌EP离心管;
b)每管加200μL氯仿,Vortex涡旋20~30s充分震荡成乳状,离心4℃12000rpm15min;
c)吸取上层400μL到新的RNase-free无菌EP离心管,每管加异丙醇500μL,充分颠倒30次后,室温静置10min;
d)离心4℃10000rpm 10min;
e)弃上清,每管加用RNase-free水配置的75%酒精1mL,轻轻颠倒混匀溶解沉淀;
f)离心4℃7500rpm 5min;
g)弃上清,室温晾干10min后,每管加入适量DEPC水,轻轻颠倒混匀溶解沉淀。
7.2转录合成cDNA
按照NanoDrop说明书检测总RNA的浓度和纯度。根据OD260/OD280比值确定RNA纯度,检测浓度和质量合格的RNA备用。
按逆转录试剂盒说明书,配置下列体系:
混匀后置于42℃2min。
按逆转录试剂盒说明书,配置下列体系:
混匀后25℃5min,55℃15min,85℃5min,得到逆转录产物。
8、实时定量荧光PCR
使用Applied Biosystems 7500Real-Time PCR System,按说明书配置下述体系进行相对定量分析,每个样本准备3个复孔:
上述反应体系混匀后加入专用适配的96孔板内,按下述扩增程序进行设置:
引物信息
实验结果
1.PTX-Rg3-lipo能显著削弱MDSC的免疫抑制功能
从小鼠骨髓间充质前体细胞诱导小鼠原代MDSC,分别予以PTX、Rg3-lipo、PTX+Rg3-lipo、nab-PTX、PTX-Rg3-lipo处理。通过流式细胞术检测MDSC表型发现,PTX-Rg3-lipo降低MDSC的比例(图1A),同时增加树突状细胞比例以及促炎型巨噬细胞与抑炎型巨噬细胞的比值(图1B-C)。进一步,通过与T细胞共培养试验发现,PTX-Rg3-lipo处理后的MDSC能显著诱导T细胞的活化、效应分子IFN-γ、Perforin的分泌及增殖能力,而不是PTX-Rg3-lipo直接处理T细胞(图1D-E)。利用qPCR检测MDSC转录水平变化,发现MDSC细胞免疫抑制性标记物Arg1、Mrc1表达显著降低,而Cd86、Tnf等促炎性标志物表达显著升高(图1F)。以上结果表明,PTX-Rg3-lipo通过削弱MDSC的免疫抑制功能,进而促进T细胞的增殖和活化。
由图1可知,单独的PTX、Rg3-lipo、PTX+Rg3-lipo、nab-PTX都对MDSC的比例没有显著性降低作用,对树突状细胞比例以及促炎型巨噬细胞与抑炎型巨噬细胞的比值没有显著增强作用,对T细胞的活化、效应分子IFN-γ、Perforin的分泌及增殖能力也没有显著增强作用,对MDSC细胞免疫抑制性标记物没有显著降低,对促炎性标志物表达也没有显著升高作用,只有PTX-Rg3-lipo表现出显著性差异,可见本申请首次披露PTX-Rg3-lipo通过削弱MDSC细胞从而影响T细胞的作用。
2.PTX-Rg3-lipo通过Glut3靶向MDSC削弱其免疫抑制功能
通过分析肠癌单细胞数据及体外实验发现,相比肿瘤细胞,免疫细胞尤其是MDSC以表达葡萄糖转运体Glut3为主(图2A-C)。进一步,敲除Glut3后对MDSC行PTX-Rg3-lipo干预后检测其表型(图2D)。结果显示,敲除Glut3后,PTX-Rg3-lipo降低免疫抑制性细胞MDSC的效果被削弱,同时无法进一步增加免疫正性细胞树突状细胞的比例(图2E)。此外,Glut3敲除后PTX-Rg3-lipo无法促进T细胞分泌IFN-γ、Perforin等效应分子(图2F)。以上结果表明,PTX-Rg3-lipo通过下游葡萄糖转运体Glut3依赖的方式削弱MDSC免疫抑制功能。
3.将人参皂苷脂质体作为载体能够显著增强紫杉醇在肠癌中的疗效
与对照组相比,PTX-Rg3-lipo可显著抑制肿瘤的生长(图3A、B、D),小鼠肿瘤质量显著降低(图3C)。实验过程中小鼠无明显不良反应,体重无明显减轻,提示安全性好(图3E)。以上结果表明,将人参皂苷脂质体作为载体能够显著增强紫杉醇在肠癌中的疗效。
4.Rg3-lipo能协同PTX显著降低MDSC比例,改善肿瘤抑制性免疫微环境
从小鼠肿瘤局部提取免疫细胞后,使用多色流式细胞术分析小鼠肿瘤免疫微环境发现,PTX-Rg3-lipo可显著降低肿瘤局部的免疫抑制性细胞MDSC的比例,同时增加巨噬细胞、树突状细胞等免疫正性细胞的比例(图4A);还可促进T细胞分泌IFN-γ、Perforin等效应分子(图4B-C)。对外周血单个核细胞进行检测发现,可显著降低外周免疫抑制性细胞MDSC的比例,同时增加免疫正性细胞树突状细胞的比例,但不影响巨噬细胞的比例(图4C);还可促进外周T细胞分泌IFN-γ、Perforin等效应分子(图4D)。因此,人参皂苷脂质体作为药物载体可改善肿瘤抑制性免疫微环境,激活机体的抗肿瘤免疫反应,提升负载药物的疗效。
进一步通过Gr-1抗体特异性敲除MDSC实验,外周和肿瘤局部敲除效率达到90%(图5A)。结果发现,敲除MDSC后PTX-Rg3-lipo无法进一步增强抗肿瘤效果(图5B-C)。而且敲除MDSC后PTX-Rg3-lipo无法进一步提升巨噬细胞的比例,以及无法提升促炎型巨噬细胞与抑炎型巨噬细胞的比值(图5D)。以上结果表明PTX-Rg3-lipo能重塑荷瘤小鼠免疫格局,激活机体的抗肿瘤免疫反应,该效果部分依赖于PTX-Rg3-lipo对MDSC的调控作用。
总的来说,本申请发现应用人参皂苷脂质体作为药物载体可以通过选择性削弱MDSC的免疫抑制性功能,改善免疫微环境,激活机体免疫反应,进一步协同所载药物提升疗效。因此本申请认为,使用人参皂苷脂质体-药物组合物制成用于在恶性肿瘤和病毒感染性疾病发挥免疫调节作用之新型方法是具有良好的开发应用前景。
上述实施例仅例示性说明本发明的原理及其功效,而非用于限制本申请。任何熟悉此技术的人士皆可在不违背本申请的精神及范畴下,对上述实施例进行修饰或改变。因此,举凡所属技术领域中具有通常知识者在未脱离本发明所揭示的精神与技术思想下所完成的一切等效修饰或改变,仍应由本申请的权利要求所涵盖。
- 人参皂苷Rh1在制备结肠癌免疫治疗药物及调节结肠癌肠道菌群药物中的应用
- 人参PgMYB2转录因子及其在调控人参皂苷合成中的应用
