用于建立和维持早期胚胎样细胞的培养基和方法
文献发布时间:2024-04-18 19:58:21
技术领域
本发明涉及用于建立和维持哺乳动物早期胚胎样细胞的培养基和方法。
背景技术
哺乳动物胚胎发生是导致胚胎发育的细胞分裂和分化的复杂过程。精子与卵母细胞的成功受精会触发胚胎发生的开始。这个被严格控制的过程从一个受精卵中产生了数十亿个具有不同功能和形态的细胞。所有有性繁殖生物体的巨大的细胞复杂性都始于胚胎发生。一开始,单个受精卵会分裂形成2个细胞。然后这2个细胞会继续分裂形成4细胞、8细胞和16细胞。在进一步扩增后,胚胎变成由两个区域组成的囊胚(blastocyst),这两个区域分别称为内细胞团(ICM)和滋养外胚层(TE),直到这个阶段,胚胎发育被称为植入前(preimplantation,在子宫壁)阶段。在植入(post-implantation)后的发育阶段,ICM细胞将产生羊膜和所有胎儿组织,而TE细胞将产生胎盘。所有这些发育阶段都已在小鼠中得到了很好的表征,因为我们可以容易地在无伦理问题的情况下从小鼠胚胎中获取这些细胞。Evans和Kaufman的开创性工作表明,可以从小鼠囊胚的ICM中提取细胞,然后在适当的培养条件下在体外无限期地培养这些细胞(Evans and Kaufman,1981)。这些细胞被称为胚胎干细胞(ESC),是小鼠囊胚的ICM内的细胞的代表。小鼠ESC是多能的,但不是全能的,这意味着它们只能分化成胚胎的全部三个胚层(外胚层、中胚层和内胚层),因此可以产生对应于所有胎儿组织的细胞。相反,全能性是细胞形成包括胚胎细胞和胚胎外细胞的整个生物体的能力,而不仅仅是多能细胞情况下产生胎儿组织。在小鼠早期胚胎中,早于4细胞阶段的细胞是全能性的,而在人中,全能性至少持续到8细胞(8C)阶段(Hu,2019)。在Evans和Kaufman的发现的17年后,Thomson及其同事能够从人ICM产生人ESC(Thomson et al.,1998)。
由于人PSC在疾病建模和再生医学方面的巨大潜力,因此进行了大量研究以寻找这些细胞的替代来源,而无需破坏人胚胎。2006年,Takahashi和Yamanaka发现了一种从已经分化的细胞产生诱导PSC(induced PSC,iPSC)的方法,而无需考虑伦理问题(Takahashiand Yamanaka,2006)。ESC和iPSC非常相似,在本文统称为PSC。
尽管小鼠ESC和人ESC均来源于植入前囊胚的ICM,但它们表现出不同的特征。在传统条件下培养的人PSC显示出多能性的始发态(primed)状态,类似于源自植入后外胚层的小鼠外胚层干细胞(EpiSC)(Brons et al.,2007;Tesar et al.,2007)。始发态人PSC显示扁平集落形态,作为单细胞传代后存活率低,需要成纤维细胞生长因子2(FGF2)和转化生长因子-β1(TGFβ1)/ACTIVIN A/NODAL信号转导(signaling),并且无法促进人-小鼠种间嵌合体形成。相比之下,小鼠ESC处于更接近植入前ICM的原始态
最近,已经公开了多种方法来衍生和维持人和非人灵长类PSC的改变的状态(Gafni et al.,2013;Takashima et al.,2014;Theunissen et al.,2014),其表现出人原始态(植入前样)特征。这些细胞与小鼠胚胎干细胞在形态和分子上有一些相似之处。然而,这些报道的人原始态PSC是否真的与植入前ICM相似仍在争论中。此外,目前的每一种方法都有特定的缺点,例如冗长、产生不同水平的原始态特异性基因、用于原始态诱导的转基因依赖性、基因组不稳定、印记丢失、无法进行多谱系分化以及低效或没有适当的嵌合体形成能力。
PSC具有用于再生医学中的细胞治疗以及通过患者特异性疾病建模来研究疾病的巨大潜力(Shi et al.,2017)。目前,研究人员正在使用始发态PSC作为这些研究的源材料。原始态细胞开始发挥作用的一个领域是种间嵌合体的产生。这些实验涉及将一个物种的PSC注射到另一个物种的发育的胚胎中,然后测量对生物体有促成作用的细胞百分比。然而,目前对嵌合体的促成作用非常低(<0.01%)。我们相信在转录和表观遗传学上更接近早期胚胎的PSC在整体上会改善嵌合体的促成作用和PSC的实际功能。
PSC的另一个令人兴奋的研究领域是类囊胚(blastoid)形成。类囊胚是囊胚样结构,目前通过ESC和TE细胞的强制聚集在体外形成(Shahbazi and Zernicka-Goetz,2018)。这些早期胚胎的体外模型将为发育过程提供新的思路,并可用于对影响胚胎发生的疾病建模。然而,目前最先进的模型需要混合几种类型的细胞,而不是所有细胞都来自单个细胞和自组织,并且类囊胚的行为不能像真正的囊胚一样,例如,它们不能正确形成原肠胚(Li etal.,2019)。我们相信,使用在转录和表观遗传学上更接近早期胚胎的细胞将改善这一过程,并能够导致真实类囊胚的形成。
发育中细胞命运转变的主要控制者是表观遗传。这意味着操纵表观基因组,我们就应该能够产生匹配任何发育阶段的细胞。这种探索的最好实例之一是从体细胞产生iPSC。在这里,转录因子的瞬时表达或化合物足以将完全分化的细胞转变为PSC(Hou etal.,2013;Takahashi and Yamanaka,2006)。其他实例包括上述使用表观遗传通路的小分子抑制剂和细胞因子将始发态状态PSC转化成原始态状态。表观基因组的关键组成部分之一是DNA甲基化,其在基因调控中起着核心作用。早期胚胎发生中细胞的总体DNA甲基化含量是高度动态的。已知植入前囊胚的DNA甲基化程度远低于植入后胚胎,并且有趣的是,也低于8C胚胎(Zhu et al.,2018)。因此,将始发态PSC逆转到ICM样状态需要显著降低整体DNA甲基化水平,而相应地,要捕获8C样阶段则需要更可控的降低。此外,鉴于印记控制区域(ICR)应保持半甲基化,在逆转过程中需要对DNA甲基化景观(landscape)进行正确重排(rewire)。因此,DNA甲基化机制的微调对于产生早期胚胎样细胞是绝对必要的。
发明内容
一方面,本公开公开了一种用于培养PSC的化学成分限定的培养基(chemicallydefined culture medium),其包含用于培养干细胞的基础培养基,并补充有S-腺苷高半胱氨酸水解酶(S-adenosylhomocysteine hydrolase,SAH)抑制剂、组蛋白脱乙酰酶(histonedeacetylase,HDAC)抑制剂和WNT/β-连环蛋白信号转导抑制剂。
在一个或多个实施方案中,SAH抑制剂是多梳抑制复合物(Polycomb repressivecomplexe,PRC)和/或EZH2抑制剂。
在一个或多个实施方案中,WNT/β-连环蛋白信号转导抑制剂是端锚聚合酶抑制剂。
在一个或多个实施方案中,化学成分限定的培养基进一步补充有一种或多种选自由L-抗坏血酸或其衍生物、JAK/STAT3信号转导激活剂和丝裂原活化蛋白激酶/细胞外信号调节激酶(mitogen-activated protein kinase/extracellular signal-regulatedkinase,MAPK/ERK)信号转导抑制剂组成的组的组分;任选地,培养基进一步补充有一种或多种选自由ACTIVIN/NODAL信号转导激活剂、Rho相关蛋白激酶(Rho-associated proteinkinase,ROCK)抑制剂和细胞外基质组成的组的组分。
在一个或多个实施方案中,SAH/PRC/EZH2抑制剂选自由3-去氮腺嘌呤A(3-deazaneplanocin A,DZNep)和CPI-1205组成的组。
在一个或多个实施方案中,DZNep以5至80nM、优选5至50nM的终浓度存在于培养基中。
在一个或多个实施方案中,CPI-1205以0.5至5mM、优选1至3mM的终浓度存在于培养基中。
在一个或多个实施方案中,HDAC抑制剂选自由曲古抑菌素A(trichostatin A,TSA)、丙戊酸(valproic acid,VPA)和丁酸钠(sodium butyrate,NaB)组成的组。
在一个或多个实施方案中,TSA以3至30nM、优选3至25nM的终浓度存在于培养基中。
在一个或多个实施方案中,VPA以0.25至2mM、优选0.5至1.5mM的终浓度存在于培养基中。
在一个或多个实施方案中,NaB以0.25至2mM、优选0.5至1.5mM的终浓度存在于培养基中。
在一个或多个实施方案中,端锚聚合酶抑制剂选自由IWR1和XAV939组成的组。
在一个或多个实施方案中,培养基中WNT/β-连环蛋白信号转导抑制剂的终浓度为2至8μM。
在一个或多个实施方案中,培养基中L-抗坏血酸的终浓度为40至70μg/ml。
在一个或多个实施方案中,培养基中JAK/STAT3信号转导激活剂的终浓度为10至50ng/mL。
在一个或多个实施方案中,JAK/STAT3信号转导激活剂是LIF。
在一个或多个实施方案中,培养基中PD0325901的终浓度为0.5至3μM。
在一个或多个实施方案中,MAPK/ERK信号转导抑制剂是PD0325901。
在一个或多个实施方案中,ACTIVIN/NODAL信号转导激活剂的终浓度为10至25ng/ml。
在一个或多个实施方案中,ACTIVIN/NODAL信号转导激活剂选自由ACTIVIN A和NODAL组成的组。
在一个或多个实施方案中,培养基中ROCK抑制剂的终浓度为0.5至2μM。
在一个或多个实施方案中,ROCK抑制剂选自由Y27632、thiazovivin和羟基法舒地尔(hydroxyfasudil)组成的组。
在一个或多个实施方案中,培养基中细胞外基质的量为0.1至0.5%(v/v)。
在一个或多个实施方案中,细胞外基质选自由Matrigel
在一个或多个实施方案中,培养基包含终浓度为5至15nM的DZNep或终浓度为0.5至3mM的CPI-1205;终浓度为3至10nM的TSA,或终浓度为0.25至1mM的VPA,或终浓度为0.25至1mM的NaB;终浓度为40至70μg/ml的L-抗坏血酸;终浓度为10至30ng/mL的LIF;终浓度为0.5至1.5μM的PD0325901;和终浓度为2至8μM、优选3至6μM的IWR1或XAV939;并且进一步补充有:
(1)终浓度为10至25ng/ml的ACTIVIN A或NODAL;终浓度为0.5至2μM的Y27632、thiazovivin或羟基法舒地尔;和0.1%至0.5%(v/v)的量的细胞外基质;或
(2)终浓度为10至25ng/ml的ACTIVIN A或NODAL;和终浓度为0.5至2μM的Y27632、thiazovivin或羟基法舒地尔;或
(3)终浓度为10至25ng/ml的ACTIVIN A或NODAL;和0.1%至0.5%(v/v)的量的细胞外基质;或
(4)终浓度为0.5至2μM的Y27632、thiazovivin或羟基法舒地尔;和0.1%至0.5%(v/v)的量的细胞外基质;或
(5)终浓度为10至25ng/ml的ACTIVIN A或NODAL;或终浓度为0.5至2μM的Y27632、thiazovivin或羟基法舒地尔;或0.1%至0.5%(v/v)的量的细胞外基质。
在一个或多个实施方案中,培养基包含10nM的DZNep或1mM的CPI-1205;5nM的TSA,或0.5mM的VPA,或0.5mM的NaB;50μg/ml的L-抗坏血酸;20ng/mL的LIF;1μM的PD0325901;和5μM的IWR1或5μM的XAV939;并且进一步补充有(1)20ng/mL的人ACTIVIN A或人NODAL,1μM的Y27632、thiazovivin或羟基法舒地尔,和0.2%(v/v)的细胞外基质;或(2)20ng/mL的ACTIVIN A或NODAL,和1μM的Y27632、thiazovivin或羟基法舒地尔;(3)20ng/mL的ACTIVINA或NODAL,和0.2%(v/v)的细胞外基质;或(4)1μM的Y27632、thiazovivin或羟基法舒地尔,和0.2%(v/v)的细胞外基质;或(5)20ng/mL的ACTIVIN A或NODAL,或1μM的Y27632、thiazovivin或羟基法舒地尔,或0.2%(v/v)的细胞外基质。
在一个或多个实施方案中,培养基包含终浓度为40至70nM的DZNep或终浓度为2至4mM的CPI-1205;终浓度为10至30nM的TSA,或终浓度为0.5至1.5mM的VPA,或终浓度为0.5至1.5mM的NaB;终浓度为40至70μg/ml的L-抗坏血酸;终浓度为10至30ng/mL的LIF;终浓度为0.5至1.5μM的PD0325901;和终浓度为2至8μM、优选3至6μM的IWR1或XAV939;并且进一步补充有:
(1)终浓度为10至25ng/ml的ACTIVIN A或NODAL;终浓度在0.5至2μM范围内的Y27632、thiazovivin或羟基法舒地尔;和0.1%至0.5%(v/v)的量的细胞外基质;或
(2)终浓度为10至25ng/ml的ACTIVIN A或NODAL;和终浓度在0.5至2μM范围内的Y27632、thiazovivin或羟基法舒地尔;或
(3)终浓度为10至25ng/ml的ACTIVIN A或NODAL;和0.1%至0.5%(v/v)的量的细胞外基质;或
(4)终浓度在0.5至2μM范围内的Y27632、thiazovivin或羟基法舒地尔;和0.1%至0.5%(v/v)的量的细胞外基质;或
(5)终浓度为10至25ng/ml的ACTIVIN A或NODAL;或终浓度在0.5至2μM范围内的Y27632、thiazovivin或羟基法舒地尔;或0.1%至0.5%(v/v)的量的细胞外基质。
在一个或多个实施方案中,培养基包含50nM DZNep或3mM CPI-1205;20nM TSA,或1mM VPA,或1mM NaB;50μg/ml L-抗坏血酸;20ng/mL LIF;1μM PD0325901;和5μM IWR1或5μM XAV939;并且进一步补充有(1)20ng/mL的ACTIVIN A或NODAL,1μM的Y27632、thiazovivin或羟基法舒地尔,和0.2%(v/v)的细胞外基质;或(2)20ng/mL的ACTIVIN A或NODAL,和1μM的Y27632、thiazovivin或羟基法舒地尔;(3)20ng/mL的ACTIVIN A或NODAL,和0.2%(v/v)的细胞外基质;或(4)1μM的Y27632、thiazovivin或羟基法舒地尔,和0.2%(v/v)的细胞外基质;或(5)20ng/mL的ACTIVIN A或NODAL,或1μM的Y27632、thiazovivin或羟基法舒地尔,或0.2%(v/v)的细胞外基质。
在一个或多个实施方案中,基础培养基选自由以下组成的组:Dulbecco改良的eagle培养基(DMEM)、最小必需培养基(MEM)、基础培养基Eagle(BME)、RPMI1640、F10、F12、α最小必需培养基(αMEM)、格拉斯哥最小必需培养基(GMEM)、Iscove改良的Dulbecco培养基、Neurobasal培养基、DMEM/F12和高级(Advanced)DMEM/F12及其组合;优选地,基础培养基为高级DMEM/F12和Neurobasal的1:1(v/v)比例的培养基的混合物。
在一个或多个实施方案中,所述培养基进一步补充有一种或多种选自由以下组成的组的组分:血清替代物、替代碳源、非必需氨基酸、L-谷氨酰胺或其替代物和抗生素。
在一个或多个实施方案中,所述血清替代物选自由以下组成的组:Knockout
另一方面,本公开公开了一种用于将灵长类PSC转化为植入前ICM样细胞(ICM-like cell,ICLC)和/或8细胞胚胎样细胞(8-cell embryo-like cell,8CLC)的方法,包括在SAH/PRC/EZH2抑制剂、组蛋白脱乙酰酶(histone deacetylase,HDAC)抑制剂和WNT/β-连环蛋白信号转导抑制剂的存在下培养所述灵长类PSC或ICLC。本公开还公开了一种用于将ICLC转化为8CLC的方法,包括在SAH/PRC/EZH2抑制剂、组蛋白脱乙酰酶(HDAC)抑制剂和WNT/β-连环蛋白信号转导抑制剂的存在下培养所述ICLC。
在一个或多个实施方案中,该方法包括在SAH/PRC/EZH2抑制剂、组蛋白脱乙酰酶(HDAC)抑制剂和WNT/β-连环蛋白信号转导抑制剂和一种或多种选自由L-抗坏血酸、JAK/STAT3信号转导激活剂和MAPK/ERK信号转导抑制剂组成的组的组分的存在下、并且任选地在一种或多种选自由ACTIVIN/NODAL信号转导激活剂、ROCK抑制剂和细胞外基质组成的组的组分的存在下,培养所述灵长类PSC或ICLC。
在一个或多个实施方案中,所述SAH/PRC/EZH2抑制剂选自由DZNep和CPI-1205组成的组。
在一个或多个实施方案中,所述HDAC抑制剂选自由TSA、VPA和NaB组成的组。
在一个或多个实施方案中,所述WNT/β-连环蛋白信号转导抑制剂是端锚聚合酶抑制剂。
在一个或多个实施方案中,所述端锚聚合酶抑制剂选自由IWR1和XAV939组成的组。
在一个或多个实施方案中,所述WNT/β-连环蛋白信号转导抑制剂或所述端锚聚合酶抑制剂的终浓度为2至8μM。
在一个或多个实施方案中,在终浓度为5至80nM、优选5至50nM的DZNep或终浓度为0.5至5mM、优选1至3mM的CPI-1205的存在下,并且在终浓度为3至30nM、优选3至25nM的TSA,或终浓度为0.25至2mM、优选0.5至1.5mM的VPA,或终浓度为0.25至2mM、优选0.5至1.5mM的NaB的存在下,并且在终浓度为2至8μM、优选3至6μM的IWR1或XAV939的存在下,培养所述灵长类PSC或ICLC。在一个或多个实施方案中,L-抗坏血酸以40至70μg/ml的终浓度存在。
在一个或多个实施方案中,所述JAK/STAT3信号转导激活剂的终浓度为10至50ng/mL。
在一个或多个实施方案中,所述JAK/STAT3信号转导激活剂是LIF。
在一个或多个实施方案中,所述MAPK/ERK信号转导抑制剂的终浓度为0.5至3μM。
在一个或多个实施方案中,所述MAPK/ERK信号转导抑制剂是PD0325901。
在一个或多个实施方案中,所述ACTIVIN/NODAL信号转导激活剂的终浓度为10至25ng/ml。
在一个或多个实施方案中,所述ACTIVIN/NODAL信号转导激活剂选自由人ACTIVINA和人NODAL组成的组。
在一种或多种实施方式中,所述ROCK抑制剂的终浓度为0.5至2μM。
在一个或多个实施方案中,所述ROCK抑制剂选自由Y27632、thiazovivin和羟基法舒地尔组成的组。
在一个或多个实施方案中,所述细胞外基质以0.1-0.5%(v/v)的量存在。
在一个或多个实施方案中,所述细胞外基质选自由Matrigel
另一方面,本公开还公开了一种用于将灵长类PSC转化为ICLC的方法,包括在本公开的培养基中培养所述PSC以转化为ICLC,其中所述培养基的基础培养基选自由以下组成的组:Dulbecco改良的eagle培养基(DMEM)、最小必需培养基(MEM)、基础培养基Eagle(BME)、RPMI1640、F10、F12、α最小必需培养基(αMEM)、格拉斯哥最小必需培养基(GMEM)、Iscove改良的Dulbecco培养基、Neurobasal培养基和DMEM/F12及其组合;优选地,所述基础培养基为高级DMEM/F12和Neurobasal培养基的1:1(v/v)比例的混合物。
另一方面,本公开公开了一种用于将灵长类PSC或ICLC转化为8CLC的方法,包括在本公开的培养基中培养所述灵长类PSC或ICLC以将灵长类PSC转化为ICLC或8CLC,其中所述培养基的基础培养基选自由以下组成的组:Dulbecco改良的eagle培养基(DMEM)、最小必需培养基(MEM)、基础培养基Eagle(BME)、RPMI1640、F10、F12、α最小必需培养基(αMEM)、格拉斯哥最小必需培养基(GMEM)、Iscove改良的Dulbecco培养基、Neurobasal培养基、DMEM/F12和高级DMEM/F12及其组合;优选地,所述基础培养基为高级DMEM/F12和Neurobasal培养基的1:1(v/v)比例的混合物。
在一个或多个实施方案中,所述灵长类PSC选自由以下组成的组:
(i)来自ESC系和/或ECC系的细胞;
(ii)来自iPSC系的细胞;
(iii)来自体外培养的植入前囊胚的ICM的细胞;
(iv)来自体外培养的植入后囊胚的ICM的细胞;
(v)体外培养的8C期至桑葚胚期的胚胎的细胞。
在一个或多个实施方案中,在一种或多种选自由以下组成的组的条件下培养所述灵长类PSC或ICLC:(i)在饲养细胞上;(ii)在没有饲养细胞的细胞外基质上;(iii)在没有饲养细胞的悬浮液中;(iv)在约37℃的温度的低氧或常氧条件下增殖;(v)每3至4天以1:4至1:8的平分比数(split ratio)作为单细胞传代;(vi)每天更换培养基。
另一方面,本公开提供了一种分离的ICLC,其具有接近相应灵长类植入前ICM的转录组、转座因子谱、DNA甲基化组、染色质景观和代谢状态。
在一个或多个实施方案中,所述灵长类ICLC的特征还在于以下特征中的一种或多种:
1)能够在培养物中自我更新和保持多能性;
2)根据核型在培养物中保持基因组稳定性;
3)能够产生3个胚层的细胞;
4)能够产生原始生殖细胞样细胞;
5)能够整合到小鼠胚胎中并且对胚胎组织和胚胎外组织有促成作用;
6)能够在体外转换(transit)至胚胎外细胞命运;和
7)能够在体外形成囊胚样结构。
在一个或多个实施方案中,所述ICLC是通过本申请中描述的用于产生ICLC的任一方法获得的。
另一方面,本公开提供了一种分离的灵长类8CLC,其表达的8C胚胎特异性标志物的水平显著高于ICLC和/或始发态PSC;优选地,所述细胞具有接近相应灵长类8C期胚胎的转录组、转座因子谱和染色质景观。
在一个或多个实施方案中,所述8CLC的特征还在于以下特征中的一种或多种:
1)根据核型在培养物中保持基因组稳定性;
2)能够产生3个胚层的细胞;
3)能够产生原始生殖细胞样细胞;
4)能够整合到小鼠胚胎中并且对胚胎组织和胚胎外组织有促成作用;
5)能够在体外转换至胚胎外细胞命运;和
6)能够在体外形成囊胚样结构。
在一个或多个实施方案中,所述8CLC是通过本申请中描述的用于产生8CLC的任一方法获得的。
本发明还提供了一种细胞培养物,包含本申请的任一实施方案中所述的灵长类ICLC和/或8CLC和培养基;优选地,所述培养基为本申请的任一培养基实施方案中所定义的。
本公开还提供了一种试剂盒,包含SAH/PRC/EZH2抑制剂、组蛋白脱乙酰酶(HDAC)抑制剂和WNT/β-连环蛋白信号转导抑制剂,和任选地
(1)一种或多种选自由L-抗坏血酸、JAK/STAT3信号转导激活剂和MAPK/ERK信号转导抑制剂组成的组的组分;
(2)一种或多种选自由ACTIVIN/NODAL信号转导激活剂、ROCK抑制剂和细胞外基质组成的组的组分;
(3)一种或多种选自由基础培养基、血清替代物、替代碳源、非必需氨基酸、L-谷氨酰胺或其替代物和抗生素组成的组的组分。
在一个或多个实施方案中,试剂盒包含如本申请的任一培养基实施方案中定义的培养基。
本公开还提供了一种组合物,其包含SAH/PRC/EZH2抑制剂、组蛋白脱乙酰酶(HDAC)抑制剂和WNT/β-连环蛋白信号转导抑制剂,和任选地
(1)一种或多种选自由L-抗坏血酸、JAK/STAT3信号转导激活剂和MAPK/ERK信号转导抑制剂组成的组的组分;和
(2)一种或多种选自由ACTIVIN/NODAL信号转导激活剂和ROCK抑制剂组成的组的组分。
在一个或多个实施方案中,本申请的组合物包含DZNep或CPI-1205,和TSA或VPA或NaB,和IWR1或XAV939,和LIF,和PD0325901和任选的L-抗坏血酸;优选地,每种组分的存在量使得包含所述组合物的培养基包含:(a)5至15nM、优选10nM的DZNep,或0.5至2mM、优选1mM的CPI-1205;(b)4至6nM、优选5nM的TSA,或0.25至1mM、优选0.5mM的VPA,或0.25至1mM、优选0.5mM的NaB;(c)3至6μM、优选5μM的IWR1或XAV939;(d)10至30ng/mL、优选20ng/mL的LIF;(e)0.5至1.5μM、优选1μM的PD0325901,和任选地(f)40至90μg/mL、优选50μg/mL的L-抗坏血酸。所述组合物还可包含ACTIVIN A或NODAL,和/或Y27632、thiazovivin或羟基法舒地尔,和/或细胞外基质,其中每种组分的存在量使得包含所述组合物的培养基包含10至25ng/mL、优选20ng/mL ACTIVIN A或NODAL,和/或0.5至2μM、优选1μM的Y27632、thiazovivin或羟基法舒地尔,和/或0.1%至0.5%(v/v)的细胞外基质。
在一个或多个实施方案中,本申请的组合物包含DZNep或CPI-1205,和TSA或VPA或NaB,和IWR1或XAV939,和LIF,和PD0325901,和任选的L-抗坏血酸;优选地,每种组分的存在量使得包含所述组合物的培养基包含:40至70nM、优选50nM的DZNep,或2至4mM、优选3mM的CPI-1205;10至30nM、优选20nM的TSA,或0.5至1.5mM、优选1mM的VPA,或0.5至1.5mM、优选1mM的NaB;3至6μM、优选5μM的IWR1或XAV939;10至30ng/mL、优选20ng/mL的LIF;0.5至1.5μM、优选1μM的PD0325901;和任选地40至90μg/mL、优选50μg/mL的L-抗坏血酸。所述组合物还可包含ACTIVIN A或NODAL,和/或Y27632、thiazovivin或羟基法舒地尔,和/或细胞外基质,其中每种组分的存在量使得包含所述组合物的培养基包含10至25ng/mL、优选20ng/mLACTIVIN A或NODAL,和/或0.5至2μM、优选1μM的Y27632、thiazovivin或羟基法舒地尔,和/或0.1%至0.5%(v/v)的细胞外基质。
本公开还提供了能够促进STELLA(也称为DPPA3和PGC7)表达或提高STELLA活性的试剂在制备用于促进灵长类PSC转化为ICLC或促进灵长类PSC或ICLC转化为8CLC的制剂、培养基或试剂盒中的用途,以及能够促进STELLA表达或提高STELLA活性的试剂用于促进灵长类PSC转化为ICLC或促进灵长类PSC或ICLC转化为8CLC的用途。
在一个或多个实施方案中,能够促进STELLA表达或提高STELLA活性的试剂为SAH/PRC/EZH2抑制剂,其包括但不限于DZNep和CPI-1205。优选地,SAH/PRC/EZH2抑制剂,例如DZNep和CPI-1205,以如本申请中描述的任一实施方案中描述的量用于上述用途。
本公开还提供了能够促进KHDC1L、TRIM60和/或属于真哺乳亚纲全能细胞同源盒(eutherian totipotent cell homeobox,ETCHbox)家族的基因(包括TPRX1和ARGFX)的表达或提高KHDC1L、TRIM60和/或属于ETCHbox家族的蛋白质(包括TPRX1和ARGFX)的活性的试剂在制备用于促进灵长类PSC或ICLC转化为8CLC的制剂、培养基或试剂盒中的用途,以及能够促进KHDC1L、TRIM60和/或属于ETCHbox家族的基因(包括TPRX1和ARGFX)的表达或提高KHDC1L、TRIM60和/或属于ETCHbox家族的蛋白质(包括TPRX1和ARGFX)的活性的试剂用于促进灵长类PSC或ICLC转化为8CLC的用途。
在一个或多个实施方案中,能够促进TPRX1、KHDC1L和/或TRIM60的表达或提高TPRX1、KHDC1L和/或TRIM60的活性的试剂是SAH/PRC/EZH2抑制剂,其包括但不限于DZNep和CPI-1205。优选地,SAH/PRC/EZH2抑制剂,例如DZNep和CPI-1205,以如本申请中描述的任一实施方案中描述的量用于上述用途。
附图说明
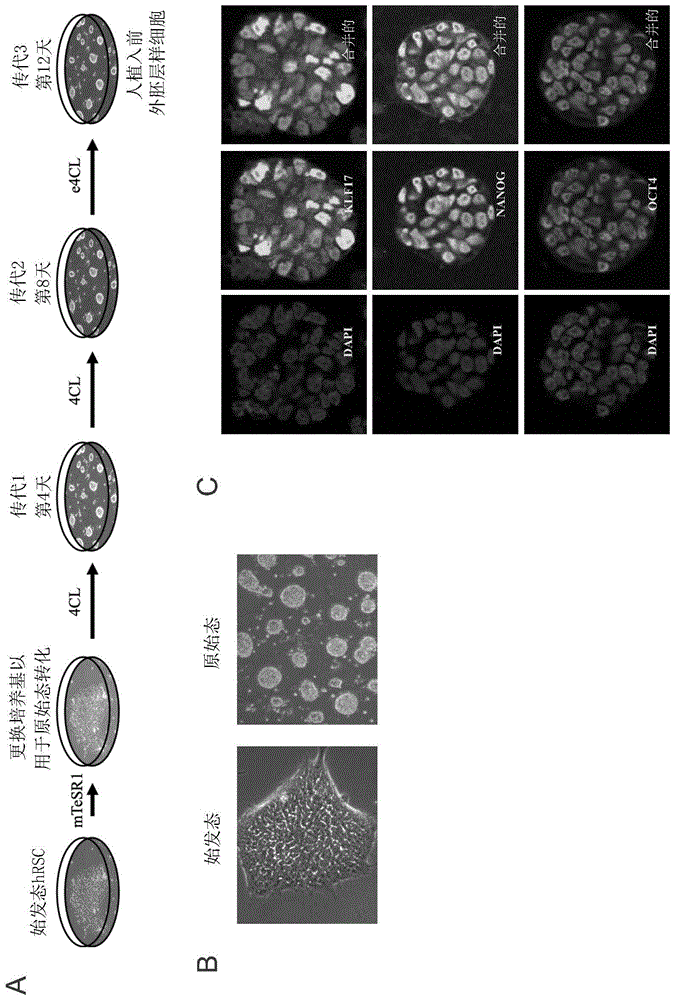
图1.(A)示意性表示发明人用于产生人ICLC的方案。简而言之,将在mTeSR培养基中培养的始发态人PSC更换到ICLC转化培养基(4CL)中并培养12天,并在第4天和第8天对细胞进行传代。(B)相差显微镜图像显示了始发态人PSC(左图)和通过4CL培养基1转化的ICLC(右图)的形态。(C)ICLC集落的代表性免疫荧光显微镜图像。细胞核用抗KLF17(上行,中间列)、抗NANOG(中间行,中间列)或抗OCT4(下行,中间列)染色,并用DAPI(左侧列)复染。合并了不同的通道(右侧列)。
图2.(A)二维散点图显示了处于始发态状态(第0天)和然后在4CL培养基1中培养后第1、2、3、5、8和12天的H9细胞的UMAP转化的单细胞RNA-seq基因表达。发明人还使用了已公开的来自胚胎第3天(E3)、第4天(E4)、第5天(E5)、第6天(E6)和第7天(E7)的人胚胎细胞的单细胞RNA-seq数据(来自E-MTAB-3929)。(B)热图示出了始发态H9、4CL培养基1转化的H9和人ICM细胞(来自GSE101571)中的已知原始态标志物的表达水平(右图)。
图3.(A)二维散点图显示了处于始发态状态(第0天)和然后在4CL培养基1中培养后第1、2、3、5、8和12天的H9细胞的UMAP转化的单细胞RNA-seq转座因子(TE)表达。发明人还使用了已公开的来自胚胎第3、4、5、6和7天的人胚胎细胞的单细胞RNA-seq TE表达数据(来自E-MTAB-3929)。(B)热图示出了始发态H9、4CL培养基1转化的H9和人ICM细胞(来自GSE101571)中的已知原始态TE的表达水平。
图4.吉姆萨染色后的染色体的代表性图像,说明细胞在长期培养过程中保持稳定的核型。对始发态H9(左上图)、第15代4CL培养基1转化的H9(右上图)、始发态UH10(左下图)和第15代4CL培养基1转化的UH10(右下图)进行核型分析。
图5.箱形图显示了整个基因组(左侧柱)和所有基因TSS周围2kb处(右侧柱)的CpG甲基化水平。
图6.热图显示了与4CL的转化细胞相比人ICM细胞中选定ICR的CpG甲基化水平。
图7.(A-D)二维散点图显示了始发态和ICLC单细胞中在KLF17、DPPA3/STELLA、DPPA5、CD70、POU5F1和THY1基因座处的染色质可及性的UMAP可视化。
图8.(A)始发态人PSC和在使用4CL培养基1转化为ICLC的过程中的细胞中差异化可及的染色质区域。在转化为ICLC期间,在始发态中封闭的区域变得开放(上图)。在转化为ICLC期间,在始发态中开放的区域会封闭(下图)。(B)基序富集分析显示了在始发态向ICLC转化期间从封闭到开放的区域(上)和从开放到封闭的区域(下)中富集的一系列基序。(C)条形图显示了始发态人PSC中和转化12天后的ICLC中TFAP2C、KLF5、SOX3和ZIC3的表达水平。
图9.(A)条形图显示了与始发态人PSC相比,4CL培养基1转化的ICLC中氧化磷酸化(OxPhos)相关基因的增加。(B)热图显示了始发态、ICLC和人ICM中选定代谢基因的表达水平(来自GSE101571)。
图10.源于ICLC的畸胎瘤组织的苏木精和伊红染色显示了所有三个胚层的结构:中胚层(左图)、内胚层(中图)和外胚层(右图)。
图11.(A)条形图显示了与H9 ICLC相比,由H9 ICLC分化的TSCLC中始发态、ICM和TSC标志物的表达水平。(B)免疫荧光显微镜图像显示了TSC标志物GATA3、TFAP2C和KRT7的表达。(C)比较4CL转化的H9(H9-4CL)、TSCLC(H9-TSCLC)、滋养层癌细胞系JEG3和BeWo、以及妊娠期人胎盘分离滋养层细胞(EGFR和HLAG)的转录组的主成分分析。(D)甲基化图显示了始发态、ICLC和TSCLC中ELF5启动子的CpG甲基化状态。
图12.(A)表格显示了使用始发态、4CL或e4CL培养基转化细胞进行囊胚注射的次数,以及具有整合到ICM和/或TE中的标记细胞的胚胎的数量。(B)显微镜图像显示了注射DsRed标记的始发态人PSC或ICLC的小鼠囊胚的相差(左)和红色荧光通道(右)。(C)用抗OCT4、抗CDX2染色或用DAPI复染的注射和未注射胚胎的免疫荧光。
图13.(A)图像显示了E10.5小鼠胚胎(左)、胎盘(中)和卵黄囊(右)的相差(上)和红色荧光通道(下)。(B)免疫荧光图像显示了E10.5小鼠胚胎中GATA6(红色)和人核抗原(hN)(绿色)的表达。细胞核用DAPI(蓝色)复染。(C)免疫荧光图像显示了E10.5小鼠胎盘中DsRed(红色)和GATA3(绿色)的表达。在胎盘组织切片中用DAPI(蓝色)对细胞核进行复染。
图14.(A)显示了来自ICLC的自形成类囊胚的相差显微镜图像。(B)用抗OCT4(红色)、抗GATA3(绿色)抗体或核复染DAPI(蓝色)染色的自形成类囊胚的免疫荧光图像。
图15.条形图显示了已使用4CL培养基1转化为ICLC的H9、H1、HUES1和WIBR3人ESC系中ICM和始发态标志物的表达水平。
图16.RT-qPCR数据的条形图,显示在使用4CL培养基1在Geltrex
图17.RT-qPCR数据的条形图,显示在使用4CL培养基1在悬浮液中转化的ICLC中,一组植入前外胚层标志物KLF17、DNMT3L、DPPA5、STELLA、TFCP2L1、KLF4、MAEL和REX1被显著诱导。在条形图中,每个基因的左侧柱代表在饲养细胞上培养,右侧柱代表在悬浮液中培养。
图18.(A-C)RT-qPCR数据的条形图,显示在分别通过4CL培养基2、4CL培养基3和4CL培养基4转化的ICLC中,一组植入前ICM标志物KLF17、DNMT3L、DPPA5、STELLA、TFCP2L1、KLF4、MAEL和REX1被显著诱导。
图19.(A)示意图显示了产生8CLC的两种方法。简而言之,将始发态人PSC培养基(例如mTeSR1)更换为e4CL培养基或4CL培养基。然后使细胞在e4CL中连续生长,或在4CL培养基中传代2次后更换为e4CL培养基。(B)条形图显示了始发态H9和H9-e4CL细胞中选定的原始态多能性标志物的表达水平。(C)条形图显示了H9-e4CL细胞和H9-4CL细胞中选定的原始态多能性标志物的表达水平。(D)两种方法中8C特异性基因的诱导相似。(E)免疫荧光显微图像显示了始发态H9、H9-4CL和H9-e4CL中ZSCAN4(绿色)或DAPI复染核(蓝色)的表达。
图20.(A)二维散点图显示了处于始发态状态(第0天)和然后在e4CL培养基中培养后第1、2、3和5天的H9细胞的UMAP转化的单细胞RNA-seq数据。发明人还使用了已公开的来自E3、4、5、6和7的人胚胎细胞的单细胞RNA-seq基因表达数据(来自E-MTAB-3929)。(B)热图示出了始发态H9、e4CL转化的H9和人8C胚胎细胞(来自E-MTAB-3929)中已知的8C标志物的表达水平。
图21.(A)二维散点图显示了处于始发态状态(第0天)和然后在e4CL培养基中培养后第1、2、3和5天的H9细胞的UMAP转化的单细胞RNA-seq TE表达。发明人还使用了已公开的来自第3、4、5、6和7天的人胚胎细胞的单细胞RNA-seq TE表达数据(来自E-MTAB-3929)。(B)热图示出了始发态H9、e4CL转化的H9和人8C胚胎细胞(来自E-MTAB-3929)中已知的原始态TE的RNA基因表达。
图22.吉姆萨染色后的染色体代表性图像,说明H9(左上图)、e4CL-H9(右上图)、始发态UH10(左下图)和e4CL-UH10(右下图)细胞具有正常核型。
图23.箱形图显示了全基因组(左图)和TSS周围2kb内(右图)的CpG甲基化。
图24.热图显示了与8CLC相比人ICM(来自GSE101571)中选定ICR的CpG甲基化。
图25.始发态人PSC和在转化为ICLC的过程中的细胞中差异可及的染色质区域。在转化为8CLC期间,在始发态中封闭的区域变得开放(上图)。在转换为8CLC期间,在始发态中开放的区域会封闭(下图)。
图26.热图显示了始发态H9、H9 8CLC和人8C胚胎细胞中选定代谢基因的表达(来自E-MTAB-3929)。
图27.源于8CLC的畸胎瘤组织的苏木精和伊红染色显示了所有三个胚层的结构:中胚层(左图)、内胚层(中图)和外胚层(右图)。
图28.条形图显示与未分化的8CLC相比,在TSCLC中多种TSC标志物例如GATA3、CGA、ELF5、TP63、KRT18、KRT8、PSG6和CCR7被显著诱导。
图29.(A)显微镜图像显示了注射DsRed标记的始发态人PSC或8CLC的小鼠囊胚的相差(左)或红色荧光通道(右)。(B)用抗OCT4、抗CDX2染色或用DAPI复染的胚胎的免疫荧光图像。
图30.(A)显示E10.5小鼠胚胎(左)、胎盘(中)或卵黄囊(右)的相差(上)或红色荧光通道(下)的显微镜图像。(B)显示小鼠胚胎中GATA6(红色)和hN(绿色)的表达或用DAPI(蓝色)复染的免疫荧光图像。(C)显示小鼠胎盘中DsRed(红色)和KRT7(绿色)的表达或用DAPI(蓝色)复染的免疫荧光图像。
图31.(A)显示来自8CLC的自形成类囊胚的相差的显微镜图像。(B)用抗OCT4(红色)和抗GATA3(绿色)抗体染色或用DAPI(蓝色)复染的自形成类囊胚的免疫荧光图像。
图32.RT-qPCR数据的条形图,显示在使用e4CL培养基在悬浮液中转化的8CLC中,8C标志物ZSCAN4、ARGFX、TPRX1、ZNF280A和ZSCAN5B被显著诱导。在条形图中,每个基因的左侧柱代表在饲养细胞上培养,右侧柱代表在悬浮液中培养。
图33.RT-qPCR数据的条形图,显示在从多个hPSC系转化的8CLC中,8C标志物ZSCAN4、ARGFX、TPRX1、ZNF280A、ZSCAN5B、DUXA、DUXB和MBD3L2被显著诱导。如图33所示,在始发态HN10和UH10中这些基因中的每一个的柱基本不存在,表明这些基因在始发态HN10和UH10中的表达极低。
图34.RT-qPCR数据的条形图,显示在常氧条件下通过4CL培养基1转化的ICLC中植入前ICM标志物KLF17、DNMT3L、DPPA5、STELLA、TFCP2L1、KLF4、MAEL和REX1的表达水平与低氧条件下相当。
图35.(A)热图显示了在通过4CL和通过已公开的原始态PSC培养基(包括NHSM、
图36.(A)相差成像显示,在补充有WNT信号转导激活剂CHIR99021的4CL(4CL+CHIR)培养基中的集落比4CL培养基中的集落更平坦。(B)RT-qPCR显示,与4CL相比,在4CL+CHIR中植入前ICM基因没有被充分诱导。(C)免疫染色图像显示了4CL和4CL+CHIR中共有的多能性标志物(NANOG)和植入前ICM标志物(KLF17)的表达,其中NANOG出现于4CL和4CL+CHIR二者中,但KLF17仅出现于4CL中。(D)热图显示,与4CL相比,在4CL+CHIR中植入前ICM基因的表达没有被充分诱导。
图37.(A)相差成像显示,不包括WNT/β-连环蛋白信号转导抑制剂的4CL(4CL-IWR1)培养基中的菌落比4CL培养基中的菌落更平坦。(B)RT-qPCR显示,与4CL相比,在4CL-IWR1中植入前ICM基因没有被充分诱导。(C)免疫染色图像显示了4CL和4CL-IWR1中共有的多能性标志物(NANOG)和植入前ICM标志物(KLF17)的表达,其中NANOG出现于4CL和4CL-IWR1二者中,但KLF17仅出现于4CL中。(D)热图显示与4CL相比,在4CL-IWR1中植入前ICM基因的表达没有被充分诱导。
图38.(A)RT-qPCR显示了相对于e4CL,e4CL+CHIR中8C胚胎基因获取的阻断。(B)RT-qPCR显示了相对于e4CL,e4CL-IWR1中8C胚胎基因获取的阻断。(C)热图显示了相对于e4CL,e4CL+CHIR和e4CL-IWR1中8C胚胎基因获取的阻断。
图39.RT-qPCR数据的条形图显示,与在血清/Lif培养基和本领域已知的其他原始态转化培养基中培养的小鼠ESC相比,在由多个小鼠ESC系转化的2C样细胞中,小鼠2C标志物Zscan4、Zscan4b、Zscan4c、Zscan4d、Dux、Tcstv1、Tcstv3、Gm4340、Zfp352和Dub1被显著诱导。上图中每个基因的五个柱从左到右分别代表E14血清+Lif、E14 4CL、E14 5iLAF R14PXGL和E14 e4CL;下图中每个基因的五个柱从左到右分别代表Mervl-GFP血清+Lif、Mervl-GFP 4CL、Mervl-GFP 5iLAF、Mervl-GFP PXGL和Mervl-GFP e4CL。
图40.RT-qPCR数据的条形图表明,与始发态人PSC细胞相比,在使用补充有不同剂量的PD0325901、DZNep或TSA的4CL培养基转化的ICLC中,植入前ICM标志物KLF17、DNMT3L、DPPA5、STELLA、TFCP2L1、KLF4、MAEL和REX1被显著诱导。右图中每个基因的五个柱从左到右分别代表DZNep-0nM、DZNep-5nM、DZNep-10nM、DZNep-20nM和DZNep-50nM。
图41.(A)RT-qPCR数据的条形图,显示了shRNA对TPRX1、KHDC1L和TRIM60的敲低效率。(B)RT-qPCR数据的条形图,证明在ICLC向8CLC转化过程中,8C特异性基因诱导被TPRX1、KHDC1L和TRIM60的敲低所抑制。
具体实施方式
目前用于衍生和维持原始态人PSC的方法(Chan,Goke et al.2013;Takashima,Guo et al.2014;Theunissen,Powell et al.2014)表现出小鼠ESC的一些特征,其接近于小鼠植入前ICM。使用目前的方法衍生原始态人PSC存在例如冗长、产生不同水平的原始态特异性基因、用于原始态诱导的转基因依赖性、基因组不稳定和印记丢失、无法进行多谱系分化以及低效或没有适当的嵌合体形成能力的问题。这些研究均未报告接近8C期的细胞的产生。
为了克服上述问题,发明人首先对靶向与人植入前ICM发育相关的表观遗传调节和不同信号转导通路的一组抑制剂进行了筛选,并且发现SAH/PRC/EZH2抑制剂、HDAC抑制剂和WNT/β-连环蛋白信号转导抑制剂和其他调节剂(例如JAK/STAT3激活剂和MAPK/ERK抑制剂)的组合优于其他已公开的培养条件,其允许重排培养的PSC的表观遗传景观以更接近人植入前ICM,这将传统的人PSC转化为具有背景技术部分所述的人植入前ICM的所有主要特征的ICLC。值得注意的是,发明人还发现WNT/β-连环蛋白信号转导的激活会抑制从始发态PSC向ICLC的转化。因此,应从培养基中排除激活WNT/β-连环蛋白信号转导的调节剂,例如GSK抑制剂CHIR99021(一种广泛用于已公开的原始态和扩展的PSC培养条件的抑制剂),而需要抑制WNT/β-连环蛋白信号转导的调节剂,例如IWR1、XAV939。因此,在包括本文所述的培养基、试剂盒、组合物和方法的本申请各个方面的优选实施方案中,CHIR99021、优选GSK抑制剂、更优选激活WNT/β-连环蛋白信号转导的任何试剂都不包含在培养基、试剂盒或组合物中,或不用于培养细胞的方法。
因此,在本申请中提供了多种促进灵长类ICLC的稳健衍生的方法和化学成分限定的培养基。本文所述的方法可应用于许多人和非人灵长类PSC系,这些细胞系处于始发态状态,如通过多能性表面标志物如SSEA-3、SSEA-4、TRA-1-81和TRA-1-60的存在证实的,或处于植入前ICM样状态,如通过诸如DNMT3L、STELLA、DPPA5和KLF17的基因的表达证实的。可用于本申请的灵长类PSC系包括但不限于常规灵长类PSC和ICM样PSC。本文所述的方法也可应用于从灵长类植入前ICM中分离ICLC。所描述的方法是无需转基因且直接的,所提供的灵长类PSC可以在一种培养条件下在约2周内转化为ICLC。
据我们所知,目前还没有合适的方法在体外诱导灵长类8CLC。为此,发明人进一步优化了用于诱导ICLC的配方,并且发现通过仅增加培养基中SAH/PRC/EZH2抑制剂和HDAC抑制剂的剂量,就可以将始发态人PSC和/或ICLC转化为8CLC。因此,在本申请中提供了促进灵长类8CLC的衍生的化学成分限定的培养基。本文所述的方法可应用于许多人和非人灵长类PSC系,这些细胞系处于始发态状态,如通过多能性表面标志物如SSEA-3、SSEA-4、TRA-1-81和TRA-1-60的存在证实的,或处于植入前ICM样状态,如通过诸如DNMT3L、STELLA、DPPA5和KLF17的基因的表达证实的。可用于本申请的灵长类PSC系包括但不限于始发态灵长类PSC和ICM样PSC。本文所述的方法也可应用于从灵长类8C胚胎中分离8CLC。所描述的方法是无需转基因且直接的,所提供的灵长类PSC可以在一种培养条件下在大约1周内转化为8CLC。事实上,WNT/β-连环蛋白信号的激活也会抑制8CLC的形成。因此,应从培养条件中排除激活WNT/β-连环蛋白信号转导的调节剂,例如GSK抑制剂CHIR99021(一种广泛用于已公开的原始态和扩展的PSC培养条件的抑制剂),而需要抑制WNT/β-连环蛋白信号转导的调节剂,例如IWR1、XAV939。
下面将详细描述本发明。应当理解,各个实施方案中描述的特征可以相互组合形成优选的技术方案,这些技术方案也涵盖在本申请的范围内。
I.术语
除非另有说明,否则本文使用的所有术语具有本领域技术人员通常理解的含义。为了便于理解本发明,本文中使用的一些术语定义如下。
在说明书和权利要求中使用的单数“一个”和“这个”包括复数引用,除非上下文另有明确说明。例如,术语“(一个)细胞”包括多个细胞,包括其混合物。
所有数字指标,例如pH、温度、时间、浓度和分子量(包括范围)都是近似值。重要的是要理解,虽然并不总是明确说明,但所有数字指标前面都有术语“约”。还应理解,虽然并不总是明确描述,但本文描述的试剂仅是示例并且它们的等价物是本领域已知的。
本文中使用的术语“基础培养基”是指能够支持细胞生长的任何培养基。基础培养基提供标准无机盐,如锌、铁、镁、钙和钾,以及维生素、葡萄糖、缓冲体系和关键氨基酸。本申请可使用的基础培养基包括但不限于Dulbecco改良的eagle培养基(DMEM)、最小必需培养基(MEM)、基础培养基Eagle(BME)、RPMI1640、F10、F12、α最小必需培养基(αMEM)、格拉斯哥最小必需培养基(GMEM)、Iscove改良的Dulbecco培养基、Neurobasal培养基和DMEM/F12。本领域技术人员知道如何选择适合所培养细胞的基础培养基。在一个优选的实施方案中,在本申请中使用的基础培养基是DMEM/F12和Neurobasal培养基的1:1(v/v)比例的混合物。
术语“无血清”是指不存在任何物种的任何血清,包括但不限于不存在胎牛血清、小牛血清、人血清等或其组合。
如本文所用,术语“血清替代物”是指用于基础培养基中以部分或完全替代血清以支持细胞存活和生长的添加剂。血清替代物一般包括诸如胰岛素、金属蛋白、微量元素、维生素等的因子。这些因子通常不包含在基础培养基中,而是由常用的培养细胞的血清提供。血清替代物包括以下支持细胞生长的组分中的至少一种或多种:一种或多种胰岛素和胰岛素替代物、一种或多种金属蛋白和金属蛋白替代物、一种或多种微量元素、一种或多种维生素、一种或多种氨基酸、一种或多种多种激素和激素样化合物、血清白蛋白或血清白蛋白替代物、以及一种或多种脂质等。多种商业血清替代物是本领域已知的,包括KOSR、N2、B27、胰岛素-转铁蛋白-硒补充剂(ITS)、G5等,这些都是本领域技术人员容易获得的。这些替代物各有明确的组成,因此各组分的浓度可根据它们各自在培养基中的比例来确定。
本领域技术人员可以根据现有技术、待培养细胞的类型等方面容易地配置血清替代物。优选地,本文所用的血清替代物为通过将KOSR、N2和/或B27按一定比例混合得到的混合添加剂。更优选地,本文使用的血清替代物是N2和B27的1:1(w/w)的比例的混合物。
本文所用术语“灵长类”或“灵长类动物”是指属于灵长类的动物,包括人和非人灵长类。非人灵长类包括原猴类(Prosimian)和猿类(Simiae)动物。具体的非人灵长类包括但不限于猕猴、狐猴、长臂猿、猩猩和狒狒。
本文中使用的术语“多能干细胞”(PSC)是指源自原肠胚形成之前任何时间的胚胎的多能细胞和从体细胞重编程产生的iPSC。根据它们的来源和培养方法,PSC可能处于不同状态,其中包括始发态PSC、原始态PSC、扩展PSC和延展潜能干细胞(Gafni et al.,2013;Gao et al.,2019;Takashima et al.,2014;Theunissen et al.,2014;Yang et al.,2017)。PSC具有在适当条件下能够产生不同细胞类型的后代的特性,这些后代是所有三个胚层(内胚层、中胚层和外胚层)的衍生物,根据标准的本领域接受的测试,例如在8-12周大的SCID小鼠中形成畸胎瘤的能力,并且也可能在适当的条件下能够产生胎盘的不同细胞类型。当群体中相当大比例的干细胞及其衍生物表现出未分化细胞的形态学特征时,PSC培养物被描述为“未分化”,以将它们与胚胎或成体来源的分化细胞区分开来。应当理解,群体中未分化细胞的集落可能被分化的相邻细胞包围。
本申请可以使用各种类型的干细胞来实施。特别适用于本申请的是灵长类PSC。非限制性实例是原代培养物或已建立的ESC和iPSC系。任何非灵长类哺乳动物的PSC也可用于实施本申请。
在一个或多个实施方案中,可用于本申请的灵长类PSC可选自由以下组成的组:
(i)来自ESC系和/或ECC系的细胞;
(ii)来自iPSC系的细胞;
(iii)来自体外培养的植入前囊胚的ICM的细胞;
(iv)来自体外培养的植入后囊胚的ICM的细胞;和
(v)体外培养的8C期至桑葚胚期的胚胎的细胞。
非限制性PSC包括但不限于本领域已建立的任何细胞系,例如人ESC系,例如H1(雄性)、H9(雌性)、HN10(雌性)、HUES1(雌性)和WIBR3(雌性);人iPSC系,例如CBC14(雌性)、C11(雌性)、Phoenix(雌性)、DiPS 1016SevA(雄性)、STiPS O-XX1(雌性)和UH10(雄性)。
II.培养基
本文所公开的培养基为化学成分限定的培养基,其可在2周内高效地将灵长类PSC从始发态状态转化为植入前ICM样状态以产生ICLC,而不需要挑取集落。本申请的培养基还可以在约一周内将灵长类PSC从始发态状态和/或植入前ICM样状态转化为8C样状态以产生8CLC。因此,这种培养基在本申请中也可称为“转化培养基”。在一些实施方案中,本申请的培养基还可以支持植入前ICM样状态的细胞的衍生、传代后存活和/或恢复、自我更新和增殖。在一些其他实施方案中,本申请的培养基还可以支持细胞外基质上的植入前ICM样状态的细胞的传代后存活和/或恢复、自我更新和增殖,而不需要饲养细胞或条件培养基。在一些实施方案中,本申请的培养基可以支持悬浮液中的植入前ICM样状态的细胞的传代后存活和/或恢复、自我更新和增殖,而不需要饲养细胞或条件培养基。在一些其他实施方案中,本申请的培养基可以支持饲养细胞上的植入前ICM样状态的细胞的传代后存活和/或恢复、自我更新和增殖。优选地,本申请的化学成分限定的培养基是无血清的。
本申请的培养基包含能够支持细胞生长,特别是能够支持人和非人灵长类PSC生长的基础培养基,其补充有SAH抑制剂、HDAC抑制剂和WNT/β-连环蛋白信号转导抑制剂,和任选地一种或多种选自由L-抗坏血酸、JAK/STAT3信号转导激活剂、MAPK/ERK信号转导抑制剂组成的组的组分。本申请中使用的优选基础培养基是高级DMEM/F12和Neurobasal培养基的1:1(v/v)比例的混合物。应当理解,SAH也可以通过PRC和/或EZH2的抑制来抑制。因此,在一些实施方案中,PRC抑制剂和/或EZH2抑制剂(PRC/EZH2抑制剂)也是SAH抑制剂。在本申请的上下文中,术语“SAH/PRC/EZH2抑制剂”是指SAH、PRC和/或EZH2的抑制剂。
在所描述的培养条件下SAH/PRC/EZH2抑制剂的存在对于诱导控制着人原始态多能性网络的多个调节因子(包括STELLA、DNMT3L和MAE)至关重要。STELLA是DNA甲基化调节因子,其在体细胞中的异位过表达可以通过干扰DNA甲基化调节因子UHRF1的功能来诱导全面的DNA去甲基化。STELLA缺失引起的UHRF1功能障碍会导致卵子发生过程中异常DNA甲基化的积累(Li et al.,2018)。发现STELLA的诱导是剂量依赖性的。发明人进一步揭示了STELLA的功能作用,并且发现STELLA敲除阻碍了ICLC和8CLC的诱导。在始发态PSC向ICLC的转化过程中,在STELLA缺失后,植入前ICM标志物包括KLF17、DPPA5、DNMT3L、TFCP2L1和MAEL无法被诱导。在始发态PSC和ICLC向8CLC的转化过程中,在STELLA缺失后,8C标志物包括TPRX1、TRIM60、KHDC1L、YPEL2、ALPG、ZNF280F、FAM151A和CCNA1无法被诱导。如本申请中所证实的,在4CL或e4CL转化期间,与野生型细胞相比,STELLA敲除细胞中的全DNA甲基化水平显著更高。因此,在向ICLC和8CLC的转化过程中,STELLA是控制DNA去甲基化所必需的。总而言之,本申请发现添加SAH/PRC/EZH2抑制剂通过重排组蛋白修饰和DNA甲基化景观促进人ICLC和8CLC的诱导。
任何可以作为SAH/PRC/EZH2抑制剂的物质都可以用于本申请的培养基中,包括但不限于DZNep(CAS NO:102052-95-9,一种作用于SAH的抑制剂)和CPI-1205(CAS NO:1621862-70-1,一种作用于SAH/PRC/EZH2的抑制剂)。SAH/PRC/EZH2抑制剂可以单独或组合用于本申请的培养基中,通常以它们各自的不会导致细胞死亡的常规量使用。例如,DZNep可以以5至80nM、优选5至50nM的终浓度用在培养基中,而CPI-1205可以以0.5至5mM、优选1至3mM的终浓度用在培养基中。在一个或多个实施方案中,SAH/PRC/EZH2抑制剂是PRC抑制剂。
任何可以作为HDAC抑制剂的物质都可以用于本申请的培养基中,包括但不限于TSA、VPA和NaB。HDAC抑制剂可以单独或组合用于本申请的培养基中,通常以它们各自的不会导致细胞死亡的常规量使用。例如,TSA可以以3至30nM、优选3至25nM的终浓度用在培养基中,VPA可以以0.25至2mM、优选0.5至1.5mM的终浓度用在培养基中,并且NaB可以以0.25至2mM、优选0.5至1.5mM的终浓度用在培养基中。
发明人还发现,当SAH/PRC/EZH2抑制剂和HDAC抑制剂二者以较高浓度使用时,用本申请的培养基可以从始发态PSC和/或ICLC获得8CLC。具体地,在一些实施方案中,为了产生8CLC,当它们中的每一种单独使用时,DZNep可以以40nM或更高,例如40至80nM,优选约50nM的浓度使用;CPI-1205可以以2mM或更高,例如2至5mM,优选约3mM的浓度使用;TSA可以以10nM或更高,例如10至30nM,优选约20nM的浓度使用;VPA可以以1.0mM或更高,例如1.0至2.0mM,优选约1.5mM的浓度使用;并且NaB可以以1.0mM或更高,例如1.0至2.0mM,优选约1.5mM的浓度使用。应当理解,当使用两种或更多种SAH/PRC/EZH2抑制剂或两种或更多种HDAC抑制剂时,每种SAH/PRC/EZH2抑制剂或每种HDAC抑制剂的终浓度应降低至足以通过这些SAH/PRC/EZH2抑制剂或HDAC抑制剂的组合诱导8CLC的量。基于本申请的公开内容和本领域的常规知识,本领域技术人员可以容易地确定这些量。
此外,还应了解,过量的SAH/PRC/EZH2抑制剂和HDAC抑制剂可能会导致细胞死亡。因此,为了在尽可能减少细胞死亡的同时诱导ICLC,可以以相对低的浓度使用SAH/PRC/EZH2抑制剂和HDAC抑制剂中的一种或两种。具体地,当它们中的每一种单独使用时,DZNep可以以5至15nM、优选约10nM的终浓度使用,CPI-1205可以以0.5至3mM、优选约1mM的终浓度使用,TSA可以以3至10nM、优选4至6nM、更优选约5nM的终浓度使用,VPA可以以0.25至1mM、优选0.5mM的终浓度使用,并且NaB可以以0.25至1mM、优选0.5mM的终浓度使用。在一些实施方案中,SAH/PRC/EZH2抑制剂可以以相对高的浓度使用,例如,DZNep可以以5至80nM、优选5至50nM的终浓度使用,CPI-1205可以以0.5至5mM、优选1至3mM的终浓度用在培养基中,而HDAC抑制剂以相对低的浓度使用,例如,TSA以3至10nM、优选4至6nM、更优选约5nM的终浓度使用,VPA以0.25至0.5mM的终浓度使用,并且NaB以0.25至0.5mM的终浓度使用。在一些实施方案中,SAH/PRC/EZH2抑制剂以相对低的浓度使用,例如,DZNep以5至15nM的终浓度使用,CPI-1205以0.5至2mM的终浓度使用,而HDAC抑制剂可以以相对高的浓度使用,例如TSA可以以3至30nM、优选3至25nM的终浓度用在培养基中,VPA可以以0.25至2mM、优选0.5至1.5mM的终浓度用在培养基中,并且NaB可以以0.25至2mM的终浓度用在培养基中。这样的培养基可以将灵长类PSC转化为ICLC。
可以将抑制标准WNT信号转导的一种或多种WNT/β-连环蛋白信号转导抑制剂添加到本申请的培养基中。可以使用任何已知的WNT/β-连环蛋白信号转导抑制剂,尤其是通常用于干细胞培养的抑制剂是优选的,包括但不限于端锚聚合酶抑制剂,例如IWR1(CAS No.:1127442-82-3)和XAV939(CAS No.:284028-89-3)。WNT/β-连环蛋白信号转导抑制剂可以以常用于培养干细胞的量使用。WNT/β-连环蛋白信号转导抑制剂的示例性终浓度可以在2至8μM、优选3至6μM的范围内。例如,对于IWR1和XAV939,它们各自在本申请的培养基中的终浓度可以在2至8μM的范围内,优选3至6μM,更优选约5μM。可以组合使用两种或更多种WNT/β-连环蛋白信号转导抑制剂(每种抑制剂的量都减少)。
L-抗坏血酸被发现通过增强含有Jumonji结构域的组蛋白去甲基化酶来改善从体细胞产生和维持小鼠iPSC(接近小鼠ESC),如申请号CN 200910041331.9中所述,其内容通过引用并入本文。因此,发明人假设L-抗坏血酸对灵长类植入前ICM样状态的形成具有相似的作用。通过适当的测试,发明人发现当以40至70μg/ml的终浓度使用时,其有效地增加了ICM特异性基因例如DNMT3L、STELLA、DPPA5和KLF17的表达水平。在优选的实施方案中,L-抗坏血酸以约50μg/ml的终浓度使用。
L-抗坏血酸的衍生物也可用于本申请,其是指与L-抗坏血酸具有类似结构和抗氧化活性的类似化合物。该衍生物在保持L-抗坏血酸生物活性的同时更稳定或更容易被细胞吸收。L-抗坏血酸的衍生物包括但不限于L-抗坏血酸磷酸酯和L-抗坏血酸有机酯,例如L-抗坏血酸棕榈酸酯。本申请培养基中衍生物的量不受限制,但通常应足以产生足量的如上所定义的L-抗坏血酸。
可以将一种或多种JAK/STAT3信号转导激活剂添加到培养基中,其可协同诱导本申请的早期胚胎特异性基因的子集。可以使用任何已知的JAK/STAT3激活剂,尤其是那些通常用于干细胞培养的激活剂是优选的。JAK/STAT3激活剂的示例性终浓度可以在10至50ng/mL的范围内。一种这样的JAK/STAT3激活剂是LIF。本文所用的LIF是指白血病抑制因子,为常添加到培养干细胞中的生长因子。优选地LIF是人LIF。JAK/STAT3激活剂可以以常用于培养干细胞的量使用。例如,对于LIF,尤其是人LIF,其在本申请的培养基中的终浓度可以在10至50ng/mL的范围内,优选地10至30ng/mL,更优选约20ng/mL。
可以将一种或多种MAPK/ERK信号转导抑制剂添加到培养基中,这有助于与本申请培养基中的其他组分协同以减少DNA甲基化。可以使用任何已知的MAPK/ERK抑制剂,尤其是那些常用于干细胞培养的抑制剂是优选的。一种这样的MAPK/ERK抑制剂是PD0325901(CASNo.:391210-10-9)。MAPK/ERK抑制剂可以以常用于培养干细胞的量使用。MAPK/ERK抑制剂的示例性终浓度可以在0.5至3μM的范围内,优选0.5至1.5μM。例如,对于PD0325901,其在本申请的培养基中的终浓度可以在0.5至3μM的范围内,优选0.5至1.5μM,更优选约1μM。
在一个或多个优选实施方案中,本申请的培养基包含终浓度为5至15nM的DZNep或终浓度为0.5至2mM的CPI-1205;终浓度为3至30nM的TSA,或终浓度为0.25至2mM的VPA或终浓度为0.25至2mM的NaB,优选地,终浓度为3至10nM的TSA,或终浓度为0.25至1mM的VPA或终浓度为0.25至1mM的NaB;和各自的终浓度为2至8μM、优选3至6μM的IWR1或XAV939;浓度为40至70μg/ml的L-抗坏血酸;终浓度为10至30ng/mL的LIF;终浓度为0.5至1.5μM的PD0325901。在一个或多个实施方案中,本申请的培养基包含终浓度为5至80nM、优选5至50nM的DZNep或终浓度为0.5至5mM、优选0.5至3mM的CPI-1205;终浓度为3至10nM的TSA,或终浓度为0.25至0.5mM的VPA或终浓度为0.25至0.5mM的NaB;和各自的终浓度为2至8μM、优选3至6μM的IWR1或XAV939;终浓度为40至70μg/ml的L-抗坏血酸;终浓度为10至30ng/mL的LIF;终浓度为0.5至1.5μM的PD0325901。更优选地,本申请的培养基包含10nM DZNep或1mM CPI-1205;5nMTSA,或0.5mM VPA,或0.5mM NaB;和5μM IWR1或5μM XAV939;50μg/ml L-抗坏血酸;20ng/mLLIF;1μM PD0325901。这些培养基优选用于将灵长类PSC转化为ICLC。
在一个或多个优选实施方案中,本申请的培养基包含终浓度为40至70nM的DZNep或终浓度为2至4mM的CPI-1205;终浓度为10至30nM的TSA,或终浓度为0.5至1.5mM的VPA或终浓度为0.5至1.5mM的NaB;终浓度为40至70μg/ml的L-抗坏血酸;和各自的终浓度为2至8μM、优选3至6μM的IWR1或XAV939;终浓度为10至30ng/mL的LIF;终浓度为0.5至1.5μM的PD0325901。更优选地,本申请的培养基包含50nM DZNep或3mM CPI-1205;20nM TSA,或1mMVPA,或1mM NaB;5μM IWR1或5μM XAV939;50μg/ml L-抗坏血酸;20ng/mL LIF;1μMPD0325901。这些培养基优选用于将灵长类PSC或ICLC转化为8CLC。
本申请的培养基还可包含至少一种或多种选自由细胞外基质、ACTIVIN/NODAL信号转导激活剂和ROCK抑制剂组成的组的添加剂。
与始发态人PSC相比,在通过本文所述方法衍生的ICLC和8CLC中NODAL(ACTIVIN/NODAL信号转导激活剂)的表达水平增加。这一观察表明ACTIVIN/NODAL信号转导在转化过程和自我更新过程中是内源性/自动激活的。因此,在本申请的一些实施方案中,培养基进一步包含ACTIVIN/NODAL信号转导激活剂以加速转化过程。任何已知的ACTIVIN/NODAL信号转导激活剂都可以添加到本申请的培养基中,包括但不限于人ACTIVIN A和人NODAL,其氨基酸序列是本领域众所周知的。人ACTIVIN A或人NODAL可以以10至25ng/ml,优选约20ng/ml的终浓度存在于本申请的培养基中。也可以使用人ACTIVIN A和人NODAL的组合。通常,培养基中人ACTIVIN A和人NODAL的总浓度在10至25ng/ml的范围内,优选约20ng/ml。
在转化为ICLC和/或8CLC后,对于作为单细胞传代后的存活不再需要抑制ROCK信号。然而,提供低浓度的ROCK抑制剂会增加ICLC和8CLC的产量,这将有利于扩大培养规模。因此,在本发明的一些实施方案中,培养基还包含ROCK抑制剂。本申请的培养基中可以使用任何已知的ROCK抑制剂,包括但不限于Y27632(CAS No.:146986-50-7)、thiazovivin(CASNo.:1226056-71-8)和羟基法舒地尔(CAS No.:105628-72-6)。ROCK抑制剂可以以0.5至2μM的范围内、优选约1μM的终浓度使用。两种或多种ROCK抑制剂可以组合使用,它们在培养基中的总浓度在0.5至2μM的范围内、优选约1μM。
发明人发现,当在本申请的培养基中培养PSC时,它们可以在没有饲养细胞的悬浮培养物中转化和保持,并且转化的细胞可以自我更新并增殖为球状集落。因此,在本申请的一些实施方案中,所描述的方法、培养条件和培养基是无需饲养细胞的。
在一些其他实施方案中,发明人发现在转化和维持期间,提供细胞外基质将促进球形定植。在此条件下,90%或更多的PSC可以在转化过程中转变为圆顶形集落,表达ICM标志物,例如DNMT3L和KLF17。因此,在一些实施方案中,细胞外基质用在用于培养ICLC和8CLC的培养基中。细胞外基质是从Engelbreth-Holm-Swarm小鼠肉瘤中提取的可溶性基底膜制备物(Matrigel
因此,在一个或多个优选实施方案中,本申请的培养基包含:
(A)终浓度为5至15nM的DZNep或终浓度为0.5至2mM的CPI-1205,以及终浓度为3至30nM的TSA,或终浓度为0.25至3mM的VPA或终浓度为0.25至3mM的NaB,优选终浓度为3至10nM的TSA,或终浓度为0.25至1mM的VPA或终浓度为0.25至1mM的NaB;或者终浓度为5至80nM、优选5至50nM的DZNep或终浓度为0.5至5mM、优选0.5至3mM的CPI-1205,以及终浓度为3至10nM的TSA,或终浓度为0.25至0.5mM的VPA或终浓度为0.25至0.5mM的NaB,以及终浓度为2至8μM、优选3至6μM的IWR1或XAV939;
(B)终浓度为40至70μg/ml的L-抗坏血酸;
(C)终浓度为10至30ng/mL的LIF;
(D)终浓度为0.5至1.5μM的PD0325901;并且进一步补充有:
(1)终浓度为10至25ng/ml的ACTIVIN A或NODAL;终浓度在0.5至2μM范围内的Y27632、thiazovivin或羟基法舒地尔;和0.1%至0.5%(v/v)的量的细胞外基质;或
(2)终浓度为10至25ng/ml的ACTIVIN A或NODAL;和终浓度在0.5至2μM范围内的Y27632、thiazovivin或羟基法舒地尔;或
(3)终浓度为10至25ng/ml的ACTIVIN A或NODAL;和0.1%至0.5%(v/v)的量的细胞外基质;或
(4)终浓度在0.5至2μM范围内的Y27632、thiazovivin或羟基法舒地尔;和0.1%至0.5%(v/v)的量的细胞外基质;或
(5)终浓度为10至25ng/ml的ACTIVIN A或NODAL;或终浓度在0.5至2μM范围内Y27632、thiazovivin或羟基法舒地尔;或0.1%至0.5%(v/v)的量的细胞外基质。这些培养基优选用于将灵长类PSC转化为ICLC。
更优选地,本申请的培养基包含10nM的DZNep或1mM的CPI-1205;5nM的TSA,或0.5mM的VPA,或0.5mM的NaB;50μg/ml的L-抗坏血酸;20ng/mL的LIF;1μM的PD0325901;和5μM的IWR1或5μM的XAV939;并且进一步补充有(1)20ng/mL的ACTIVIN A或NODAL,1μM的Y27632、thiazovivin或羟基法舒地尔,和0.2%(v/v)的细胞外基质;或(2)20ng/mL的ACTIVIN A或NODAL,和1μM的Y27632、thiazovivin或羟基法舒地尔;(3)20ng/mL的ACTIVIN A或NODAL,和0.2%(v/v)的细胞外基质;或(4)1μM的Y27632、thiazovivin或羟基法舒地尔,和0.2%(v/v)的细胞外基质;或(5)20ng/mL的ACTIVIN A或NODAL,或1μM的Y27632、thiazovivin或羟基法舒地尔,或0.2%(v/v)的细胞外基质。这些培养基优选用于将灵长类PSC转化为ICLC。
在一个或多个优选实施方案中,本申请的培养基包含终浓度为40至70nM的DZNep或终浓度为2至4mM的CPI-1205;终浓度为10至30nM的TSA,或终浓度为0.5至1.5mM的VPA或终浓度为0.5至1.5mM的NaB;终浓度为40至70μg/ml的L-抗坏血酸;终浓度为10至30ng/mL的LIF;终浓度为0.5至1.5μM的PD0325901;和各自的终浓度为2至8μM、优选3至6μM的IWR1或XAV939;并且进一步补充有:
(1)终浓度为10至25ng/ml的ACTIVIN A或NODAL;终浓度在0.5至2μM范围内的Y27632、thiazovivin或羟基法舒地尔;和0.1%至0.5%(v/v)的量的细胞外基质;或
(2)终浓度为10至25ng/ml的ACTIVIN A或NODAL;和终浓度在0.5至2μM范围内的Y27632、thiazovivin或羟基法舒地尔;或
(3)终浓度为10至25ng/ml的ACTIVIN A或NODAL;和0.1%至0.5%(v/v)的量的细胞外基质;或
(4)终浓度在0.5至2μM范围内的Y27632、thiazovivin或羟基法舒地尔;和0.1%至0.5%(v/v)的量的细胞外基质;或
(5)终浓度为10至25ng/ml的ACTIVIN A或NODAL;或终浓度在0.5至2μM范围内的Y27632、thiazovivin或羟基法舒地尔;或0.1%至0.5%(v/v)的量的细胞外基质。这些培养基优选用于将灵长类PSC或ICLC转化为8CLC。
更优选地,本申请的培养基包含50nM DZNep或3mM CPI-1205;20nM TSA,或1mMVPA,或1mM NaB;50μg/ml L-抗坏血酸;20ng/mL LIF;1μM PD0325901;和5μM IWR1或5μMXAV939;并且进一步补充有(1)20ng/mL的ACTIVIN A或NODAL,1μM的Y27632、thiazovivin或羟基法舒地尔,和0.2%(v/v)的细胞外基质;或(2)20ng/mL的ACTIVIN A或NODAL,和1μM的Y27632、thiazovivin或羟基法舒地尔;(3)20ng/mL的ACTIVIN A或NODAL,和0.2%(v/v)的细胞外基质;或(4)1μM的Y27632、thiazovivin或羟基法舒地尔,和0.2%(v/v)的细胞外基质;或(5)20ng/mL的ACTIVIN A或NODAL,或1μM的Y27632、thiazovivin或羟基法舒地尔,或0.2%(v/v)的细胞外基质。这些培养基优选用于将灵长类PSC或ICLC转化为8CLC。
除上述组分外,本申请的培养基中还可以添加用于培养干细胞的培养基中常用的其他添加剂,包括但不限于血清替代物,例如N2和/或B27;替代碳源,例如丙酮酸盐,例如丙酮酸钠;非必需氨基酸;L-谷氨酰胺或其替代物,例如Glutamax
III.试剂盒和组合物
还公开了含有本申请培养基或含有用于配制培养基的本申请培养基的全部或部分组分的试剂盒。
在一些实施方案中,本申请的试剂盒包含即用型培养基,其组分在上述培养基的任一实施方案中有所描述。在一些实施方案中,本申请的试剂盒包含如本申请的任一实施方案中所述的用于将灵长类PSC转化为ICLC的转化培养基和/或如本申请的任一实施方案中所述的用于将灵长类PSC或ICLC转化为8CLC的转化培养基。
在另一些实施方案中,本申请的试剂盒至少包含SAH/PRC/EZH2抑制剂、HDAC抑制剂和WNT/β-连环蛋白信号转导抑制剂,其可以单独包装或可以作为混合物提供在一个容器中。试剂盒还可包含一种或多种选自由L-抗坏血酸、JAK/STAT3信号转导激活剂、MAPK/ERK信号转导抑制剂组成的组的组分,当呈现时,其可以单独包装或以组分的任何组合的混合物提供。优选地,试剂盒可包含SAH/PRC/EZH2抑制剂和HDAC抑制剂,以及L-抗坏血酸、JAK/STAT3信号转导激活剂、MAPK/ERK信号转导抑制剂和WNT/β-连环蛋白信号转导抑制剂。此外,试剂盒还可以包含一种或多种选自由ACTIVIN/NODAL信号转导激活剂和ROCK抑制剂组成的组的组分。试剂盒中可包含常规细胞外基质,例如Matrigel
说明书可以包含在试剂盒中,其可以包括关于培养基的配制及其使用的文本。
在一些实施方案中,还提供了包含SAH/PRC/EZH2抑制剂、HDAC抑制剂和WNT/β-连环蛋白信号转导抑制剂的组合物。该组合物还可包含一种或多种选自由L-抗坏血酸、JAK/STAT3信号转导激活剂和MAPK/ERK信号转导抑制剂组成的组的组分。此外,该组合物还可以包含一种或多种选自由ACTIVIN/NODAL信号转导激活剂和ROCK抑制剂组成的组的组分。在优选实施方案中,组合物包含SAH/PRC/EZH2抑制剂、HDAC抑制剂、L-抗坏血酸、JAK/STAT3信号转导激活剂、MAPK/ERK信号转导抑制剂和WNT/β-连环蛋白信号转导抑制剂,和任选地ACTIVIN/NODAL信号转导激活剂和任选地ROCK抑制剂。应当理解,当存在于组合物中时,上述各组分的存在量应使得它们各自在包含组合物的培养基中的量落入如本申请的任意实施方案中所定义的每种培养基的它们各自的范围内。更优选地,使用该组合物可以配制如本申请中所述的任一实施方案的培养基。
在一个或多个优选实施方案中,本申请的组合物包含DZNep或CPI-1205,和TSA或VPA或NaB,和IWR1或XAV939,和任选的L-抗坏血酸,任选的LIF,任选的PD0325901;优选地,每种组分的存在量使得包含该组合物的培养基包含:5至15nM、优选10nM的DZNep,或0.5至2mM、优选1mM的CPI-1205;2至8nM、优选5nM的TSA,或0.25至1mM、优选0.5mM的VPA(VPA),或0.25至1mM、优选0.5mM的NaB;2至8μM、优选3至6μM、更优选5μM的IWR1或XAV939;和任选地40至90μg/mL、优选50μg/mL的L-抗坏血酸,任选地10至30ng/mL、优选20ng/mL的LIF,任选地0.5至1.5μM、优选1μM的PD0325901。该组合物还可包含ACTIVIN A或NODAL,和/或Y27632、thiazovivin或羟基法舒地尔,和/或细胞外基质,其中每种组分的存在量使得包含该组合物的培养基包含10至25ng/mL、优选20ng/mL ACTIVIN A或NODAL,和/或0.5至2μM、优选1μM的Y27632、thiazovivin或羟基法舒地尔,和/或0.1%至0.5%(v/v)的细胞外基质。
在一个或多个实施方案中,本申请的组合物包含DZNep或CPI-1205,和TSA或VPA或NaB,和IWR1或XAV939,和任选的L-抗坏血酸,任选的LIF,任选的PD0325901;优选地,每种组分的存在量使得包含该组合物的培养基包含:40至70nM、优选50nM的DZNep,或2至4mM、优选3mM的CPI-1205;10至30nM、优选20nM的TSA,或0.5至1.5mM、优选1mM的VPA,或0.5至1.5mM、优选1mM的NaB;2至8μM、优选3至6μM、更优选5μM的IWR1或XAV939;和任选地40至90μg/mL、优选50μg/mL的L-抗坏血酸,任选地10至30ng/mL、优选20ng/mL的LIF,任选地0.5至1.5μM、优选1μM的PD0325901。该组合物还可包含ACTIVIN A或NODAL,和/或Y27632、thiazovivin或羟基法舒地尔,和/或细胞外基质,其中每种组分的存在量使得包含该组合物的培养基包含10至25ng/mL、优选20ng/mL ACTIVIN A或NODAL,和/或0.5至2μM、优选1μM的Y27632、thiazovivin或羟基法舒地尔,和/或0.1%至0.5%(v/v)的细胞外基质。
在一些实施方案中,试剂盒可包含上述组合物。
本申请的试剂盒还可以包含用于维持PSC的培养基,例如mTeSR1或E8培养基,和/或用于类囊胚形成的培养基,例如REM培养基(REM是改良的重建胚胎培养基(ZhangShaopeng et al.2019)),补充有8-15μM Y27632或不含Y27632。试剂盒中也可提供常规用于干细胞培养的试剂。此类试剂包括但不限于PBS、EDTA溶液和/或TrypLE:0.5mM EDTA(1:1)。试剂盒中还可以提供饲养细胞和/或细胞外基质。
IV.方法和用途
本申请的培养基可用于将灵长类体细胞重编程为ICLC、将灵长类PSC转化为ICLC以及将灵长类PSC或ICLC转化为8CLC。
因此,本申请的一个方面公开了一种用于将灵长类体细胞重编程为ICLC的方法,其包括在转化培养基中培养体细胞,所述转化培养基包含SAH/PRC/EZH2抑制剂、HDAC抑制剂、L-抗坏血酸、JAK/STAT3信号转导激活剂、MAPK/ERK信号转导抑制剂和WNT/β-连环蛋白信号转导抑制剂、任选的ACTIVIN/NODAL信号转导激活剂和任选的ROCK抑制剂,有或没有细胞外基质。所得ICLC可用于将ICLC转换为8CLC的方法。优选地,转化培养物是在本申请的任意实施方案中描述的那些。
本申请的另一个方面公开了一种用于将灵长类PSC转化为ICLC、或用于将灵长类PSC或ICLC转化为8CLC的方法,其包括在转化培养基中培养灵长类PSC,所述转化培养基包含SAH/PRC/EZH2抑制剂、HDAC抑制剂、L-抗坏血酸、JAK/STAT3信号转导激活剂、MAPK/ERK信号转导抑制剂和WNT/β-连环蛋白信号转导抑制剂、任选的ACTIVIN/NODAL信号转导激活剂和任选的ROCK抑制剂,有或没有细胞外基质。在优选的实施方案中,转化培养基是上述实施方案中任一个所定义的培养基。
在一个或多个优选实施方案中,该方法是用于将灵长类PSC转化为ICLC的方法,并且转化培养基为上述任一实施方案中定义的具有相对较低浓度的SAH/PRC/EZH2抑制剂和HDAC抑制剂的培养基。
在一些其他优选实施方案中,该方法是用于将灵长类PSC或ICLC转化为8CLC的方法,并且转化培养基是上述任一实施方案中定义的具有相对较高浓度的SAH/PRC/EZH2抑制剂和HDAC抑制剂的培养基。
可使用用于培养干细胞的常规条件将PSC转化为ICLC或8CLC。例如,可以将单始发态PSC铺在常规培养基,例如mTeSR1或E8中,任选地补充5至15μM ROCK抑制剂,例如Y27632。培养一段时间后,例如24小时后,将培养基换成本申请的培养基并且继续培养细胞,直至产生期望的ICLC或8CLC。在培养过程中,培养基可以根据需要进行更新,优选每日更新。对于传代,可以用常规方法将细胞解离成单细胞,然后用本申请的培养基再次铺板和培养,直到形成ICLC或8CLC。优选每3至4天以1:4至1:8、优选1:6至1:8的平分比数将细胞作为单细胞传代,并且通常,细胞将在约2周内由始发态PSC转化为ICLC,将在约1周内由始发态PSC转化为8CLC,并且在用包含相对较高浓度的SAH/PRC/EZH2抑制剂和HDAC抑制剂的培养基培养ICLC后3-5天内由ICLC转化为8CLC。应当理解的是,用于转化为8CLC的ICLC可以是通过本文所述的任一方法培养灵长类PSC得到的ICLC,或可以是已知的ICLC或由本领域已知的任何方法制备的ICLC。
一般情况下,细胞可在37℃在常氧条件(5% CO
在本申请的一些实施方案中,细胞可以在一种或多种选自由以下组成的组的条件下培养:(i)在饲养细胞上;(ii)在没有饲养细胞的细胞外基质上;(iii)在没有饲养细胞的悬浮液中;(iv)在约37℃的温度的低氧或常氧条件下;(v)每3至4天以1:4至1:8的平分比数作为单细胞传代;(vi)每天更换培养基。
在一些实施方案中,为了将灵长类PSC转化为ICLC,将单始发态灵长类PSC铺在补充有5至15μM ROCK抑制剂(例如Y27632)的mTeSR1或E8培养基中的饲养细胞上,并培养一段时间,例如24小时,然后将mTeSR1或E8培养基换成本申请的具有相对较低浓度的SAH/PRC/EZH2抑制剂和HDAC抑制剂的转化培养基,并且将细胞在约37℃温度的低氧或常氧条件下培养,每天更新培养基。在培养过程中,每3至4天以1:4至1:8的平分比数将细胞作为单细胞传代,直至获得ICLC。在一些实施方案中,按上方所述培养单始发态灵长类PSC,除了将细胞铺在DMEM-F12包被的板中的约1%(v/v)的细胞外基质(例如Geltrex
在一些实施方案中,为了将灵长类PSC转化为ICLC,使用补充有5至15μM ROCK抑制剂(例如Y27632)的mTeSR1或E8培养基将单始发态灵长类PSC铺板并培养一段时间,例如24小时,然后将mTeSR1或E8培养基换成本申请中具有相对较低浓度的SAH/PRC/EZH2抑制剂和HDAC抑制剂的转化培养基,并且在低氧条件下培养细胞;形成小球后,将球转移到烧瓶中悬浮培养,每天更换培养基;其中每4至5天以1:4至1:8的平分比数将细胞作为单细胞传代,直至获得ICLC。
在一些实施方案中,为了从灵长类PSC转化为8CLC,使用补充有5至15μM ROCK抑制剂(例如Y27632)的mTeSR1或E8培养基将单始发态PSC铺在饲养细胞上一段时间,例如24小时,然后将培养基换成本申请的具有相对较高浓度的SAH/PRC/EZH2抑制剂和HDAC抑制剂的转化培养基,并且将细胞在低氧或常氧条件下培养,每天更换培养基;其中每3至4天以1:4至1:8的平分比数将细胞作为单细胞传代。
在一些实施方案中,为了从ICLC转化为8CLC,从ICLC解离单细胞,并铺在使用本申请的具有相对较低浓度的SAH/PRC/EZH2抑制剂和HDAC抑制剂的转化培养基的饲养细胞上一段时间,例如24小时,然后将培养基换成本申请中具有相对较高浓度的SAH/PRC/EZH2抑制剂和HDAC抑制剂的转化培养基,细胞不传代培养3-5天,每天更新培养基。
在一些实施方案中,为了从ICLC转化为8CLC,从ICLC解离单细胞并悬浮在本申请的具有相对较低浓度的SAH/PRC/EZH2抑制剂和HDAC抑制剂的转化培养基中用于悬浮培养一段时间,其中转化培养基补充有5至15μM ROCK抑制剂(例如Y27632);在形成小团块后,将培养基换成本申请的具有相对较高浓度的SAH/PRC/EZH2抑制剂和HDAC抑制剂的转化培养基,但不添加额外的ROCK抑制剂(例如Y27632),用于在不传代的情况下转化数天,每天更新培养基。
本申请的任意实施方案中描述的任意转化培养基在将灵长类体细胞重编程为ICLC、将灵长类PSC转化为ICLC、或将灵长类PSC或ICLC转化为8CLC中的用途,或在制造用于将灵长类体细胞重编程为ICLC、或用于将灵长类PSC转化为ICLC、或用于将灵长类PSC或ICLC转化为8CLC的培养基或试剂盒中的用途也包括在本申请中。
在一些实施方案中,本申请还包括SAH/PRC/EZH2抑制剂、HDAC抑制剂和WNT/β-连环蛋白信号转导抑制剂在制造用于将灵长类体细胞重编程为iPSC、或用于将灵长类PSC转化为ICLC、或用于将灵长类PSC或ICLC转化为8CLC的培养基或试剂盒中的用途。优选地,培养基或试剂盒可进一步包含一种或多种选自由以下组成的组的组分:L-抗坏血酸、JAK/STAT3信号转导激活剂、MAPK/ERK信号转导抑制剂、ACTIVIN/NODAL信号转导激活剂、ROCK抑制剂(例如Y27632)和细胞外基质。
在一些其他实施方案中,用于将灵长类PSC转化为ICLC以及将灵长类PSC或ICLC转化为8CLC的方法可以包括基因工程改造步骤,以在用本申请的培养基培养灵长类PSC之前通过敲低和/或敲除细胞中的一个或多个相关基因来降低PSC的SAH、PRC和/或EZH2的活性,和/或降低细胞的HDAC的活性。优选地,为了降低PSC的SAH、PRC和/或EZH2的活性,可以通过诸如siRNA技术敲低SAH、PRC和EZH2调节因子中任意的表达,或者可以通过例如CRISPR/Cas9技术敲除任意基因。类似地,可以通过与上述相同的方式敲低或敲除HDAC调节因子的表达。在敲低或敲除后,可使用上述方法在本申请的任意培养基中培养所得细胞。在一些实施方案中,当PSC的SAH、PRC和/或EZH2的活性降低时,用于培养基因工程灵长类PSC的培养基可以包含或不含SAH/PRC/EZH2抑制剂。类似地,如果PSC的HDAC活性的降低,则培养基可以包含或不含HDAC抑制剂。在SAH、PRC和/或EZH2的活性以及HDAC的活性均降低的情况下,培养基可能既不包含SAH/PRC/EZH2抑制剂也不包含HDAC抑制剂,或者可以包含SAH/PRC/EZH2抑制剂或HDAC抑制剂。
因此,在一些实施方案中,本申请还提供了既不包含SAH/PRC/EZH2抑制剂也不包含HDAC抑制剂,或者包含SAH/PRC/EZH2抑制剂或HDAC抑制剂的培养基,其他组分和量与第II部分中培养基的上述任意实施方案相同。在一些实施方案中,培养基可包含用于脂质体转染的试剂。例如,在上述方法中,将灵长类PSC培养在培养基中,所述培养基包含用于表达针对例如SAH、PRC和EZH2调节因子中的任意种的shRNA的载体,以及用于将该载体转染到用于基因工程的PSC中的脂质体转染试剂,以及第II部分中描述的培养基中描述的其他组分,并且培养基可包含或不包含SAH/PRC/EZH2抑制剂。
V.STELLA的生物学功能
STELLA是DNA甲基化调节因子。其在体细胞中的异位过表达可以通过干扰DNA甲基化调节因子UHRF1的功能来诱导全面的DNA去甲基化。STELLA缺失引起的UHRF1功能障碍会导致卵子发生过程中异常DNA甲基化的积累(Li et al.,2018)。还记录了STELLA通过在特定基因座保护5mC免受Tet3介导的转化为5hmC来维持母体印记(Nakamura et al.,2012)。
在本申请中,发明人首次发现STELLA敲除阻碍了ICLC和8CLC的诱导。因此,STELLA是转化过程中控制DNA去甲基化所必需的。发明人还发现添加SAH/PRC/EZH2抑制剂通过重排组蛋白修饰和DNA甲基化景观促进了ICLC和8CLC的诱导。
因此,在一些实施方案中,本申请进一步包括能够促进STELLA表达或提高STELLA活性的试剂在制造用于促进灵长类PSC转化为ICLC或用于促进灵长类PSC或ICLC转化为8CLC的制剂、培养基或试剂盒中的用途,和能够促进STELLA表达或提高STELLA活性的试剂用于促进灵长类PSC转化为ICLC或用于促进灵长类PSC或ICLC转化为8CLC的用途。
还提供了用于促进灵长类PSC转化为ICLC或灵长类PSC或ICLC转化为8CLC的方法,其包括在有效量的能够促进STELLA表达或提高STELLA活性的试剂的存在下培养灵长类PSC。基于本申请的公开内容和现有技术的教导,本领域技术人员可以容易地确定试剂的有效量。
在一些优选实施方案中,能够促进STELLA表达或提高STELLA活性的试剂是SAH/PRC/EZH2抑制剂,其包括但不限于DZNep和CPI-1205。SAH/PRC/EZH2抑制剂可以单独或组合使用,通常以它们各自不会导致细胞死亡的常规量使用。例如,DZNep可以以5至80nM、优选5至50nM的终浓度用在培养基中,并且CPI-1205可以以0.5至5mM、优选1至3mM的终浓度用在培养基中。在一个或多个实施方案中,SAH/PRC/EZH2抑制剂通常称为PRC抑制剂。
在一些另外的优选实施方案中,用于促进灵长类PSC转化为ICLC的方法包括在5至15nM、优选10nM的DZNep,或0.5至2mM、优选1mM的CPI-1205的存在下培养灵长类PSC。在一些其他优选的实施方案中,用于促进灵长类PSC或ICLC转化为8CLC的方法包括在40至70nM、优选50nM的DZNep,或2至4mM、优选3mM的CPI-1205的存在下培养灵长类PSC。用于促进灵长类PSC转化为ICLC或者灵长类PSC或ICLC转化为8CLC的方法中的SAH/PRC/EZH2抑制剂也包括在本申请中。
VI.细胞
本申请还提供了分离的灵长类ICLC。本申请的ICLC具有接近人植入前ICM的转录组,具有接近人植入前ICM的转座因子谱,具有接近人植入前ICM的DNA甲基化组,具有接近人植入前ICM的染色质景观,并且具有接近人植入前ICM的代谢状态。
如本文所用,术语“接近”旨在表示“基本上相同”或“无实质差异”。基于本领域的公知常识,本领域技术人员能够认识到,本申请的细胞(包括来自本申请的ICLC或8CLC的细胞)与天然ICM细胞或8C胚胎细胞基本上相同,尽管可能存在一些细微差异。
优选地,本申请的ICLC表现出显著更高的植入前ICM标志物表达水平,包括KLF17、DNMT3L、DPPA5、STELLA、TFCP2L1、MAEL和REX1。更优选地,本申请的ICLC中上述植入前ICM标志物中的至少一种的表达水平比始发态人PSC中的相应植入前ICM标志物的表达水平高10倍或更多倍;优选地,本申请的ICLC中所有上述植入前ICM标志物的表达水平是始发态人PSC中相应植入前ICM标志物的表达水平的10倍或更多倍。
优选地,本申请的ICLC的特征还在于以下特征中的一种或多种:
1)能够在培养物中自我更新和保持多能性;
2)根据核型在培养物中保持基因组稳定性;
3)能够产生3个胚层的细胞;
4)能够产生原始生殖细胞样细胞;
5)能够整合到小鼠胚胎中并且对胚胎组织和胚胎外组织有促成作用;
6)能够在体外转换至胚胎外细胞命运;和
7)能够在体外形成囊胚样结构。
可以通过本申请的任一实施方案中描述的任意方法培养灵长类PSC来获得此类ICLC。因此,在一些实施方式中,本申请还包括通过本文所述的任意方法获得的细胞,特别是ICLC。
本申请还提供了分离的8CLC,其表达显著高于植入前ICM样状态或始发态状态细胞的水平的8C状态特异性标志物,包括ZSCAN4、TPRX1、ZIM3、ZSCAN5B、ZNF280A和ARGFX。优选地,至少一种特异性标志物表现出比始发态PSC或ICLC中相应8C特异性标志物的表达水平高5倍或更多倍的表达水平。优选地,所有上述特异性标志物表现出比始发态PSC或ICLC中相应8C特异性标志物的表达水平高5倍或更多倍的表达水平。
优选地,本申请的8CLC具有接近于人8C期胚胎的转录组、转座因子谱和染色质景观。更优选地,本申请的8CLC还具有以下特征中的一种或多种:
1)根据核型在培养物中保持基因组稳定性;
2)能够产生3个胚层的细胞;
3)能够产生原始生殖细胞样细胞;
4)能够整合到小鼠胚胎中并且对胚胎组织和胚胎外组织有促成作用;
5)能够在体外转换至胚胎外细胞命运;和
6)能够在体外形成囊胚样结构。
通过使用本申请的转化培养基对体细胞进行重编程而获得的ICLC也涵盖在本申请中。
包含本申请的细胞(特别是本申请的ICLC和/或8CLC)的细胞培养物也涵盖在本申请中。任何本申请中描述的培养基也可以包括在细胞培养物中。
本发明将在以下非限制性实施例中进行描述。应当理解,这些实施例仅用于说明目的,而不以各种方式限制本发明的范围。可以在本申请的精神内进行各种变化和修改。所涉及的技术,如无特殊说明,均为本领域技术人员所熟知的分子生物学、细胞生物学、生物化学等各个领域的常规技术。
实施例1
材料和方法
4CL基础培养基
1:1混合的Neurobasal培养基(Gibco)和高级DMEM/F12(Gibco),补充有N2补充剂(1X,Gibco)、B27补充剂(1X,Gibco)(可以使用自制的N2和B27)、丙酮酸钠(1X,Hyclone)、非必需氨基酸(NEAA)(Gibco)、Glutamax
4CL补充剂
4CL培养基1,在4CL基础培养基中补充:
SAH/PRC/EZH2抑制剂(10nM DZNep)、HDAC抑制剂(5nM TSA)、WNT/β-连环蛋白信号转导抑制剂(5μM IWR1)、L-抗坏血酸(50μg/ml)、JAK/STAT3激活剂(20ng/ml人LIF)、MAPK/ERK抑制剂(1μM PD0325901)、ACTIVIN A/NODAL激活剂(20ng/ml人ACTIVIN A)、细胞外基质(0.2%(v/v)Geltrex
表1
REM培养基
高级DMEM F12(Gibco)和RPMI 1460(Gibco)的1:1混合物,补充有17.5%胎牛血清(NATOCOR)、1×Glutmax
细胞
H9人ESC系。
程序:
1)始发态人PSC的维持
所有提供的人PSC都常规维持在mTeSR1或E8培养基中的Matrigel
2)在饲养细胞上转化为ICLC
在转化开始前一天,将始发态人PSC用PBS洗涤一次,然后解离成单细胞,并在补充有10μM Y27632的mTeSR1或E8培养基中以1,000至1,500个细胞/cm
3)囊胚样结构(也称为类囊胚)形成
将始发态人PSC或ICLC消化成单细胞,并用40μm滤网过滤。用血细胞计数器对细胞数计数。将24孔板的孔用200μl解冻的Geltrex包被并置于37℃的培养箱中7分钟以形成半固体基质。对于每个孔,将30,000个细胞均匀地重悬到500ul REM培养基中用于类囊胚形成,其补充有10μM Y27632。之后,将细胞混合物铺到半固体Geltrex上并放回培养箱中并在37℃、5% CO
实验结果
图1(A)是从始发态人PSC诱导ICLC的示意图。图1(B)显示了始发态人PSC(左图)和ICLC(右图)在相差显微镜下的集落形态的代表性图像。平坦的始发态人PSC在转化后变成圆顶形ICLC。图1(C)是RT-qPCR和免疫染色数据,表明与始发态人PSC细胞相比,在ICLC中一组植入前ICM标志物KLF17、DNMT3L、DPPA5、STELLA、TFCP2L1、KLF4、MAEL和REX1被显著诱导。图1(D)显示在常氧或低氧条件下诱导的ICLC具有类似的植入前ICM标志物基因表达水平。为了在单细胞水平上表征ICLC的基因表达谱,发明人对处于始发态阶段(Primed-D0)和然后在4CL培养基1中培养后第1、2、3、5、8和12天(4CL-D1/2/3/5/8/12)的细胞进行了单细胞RNA-Seq(scRNA-seq)。图2(A)是在不同时间点对细胞进行UMAP分析的二维散点图,连同胚胎第3、4、5、6和7天(E3/4/5/6/7)的体内人胚胎的公开的scRNA-seq数据(来自E-MTAB-3929)。其表明常规人PSC在4CL培养基中逐渐获得类似于人胚胎第5天细胞的基因表达谱,这对应于早期植入前囊胚阶段。图2(B)是使用始发态人PSC、ICLC和人植入前ICM细胞(GSE101571)的bulk RNA-seq的热图,显示ICLC中已知ICM标志物的表达水平上调至ICM细胞的水平。本领域已知诸如SVA_D的TE亚组在从人胚胎的8C到植入前ICM阶段被特异性激活。为了研究ICLC中激活的TE,发明人从图2(A)中提到的scRNA-seq数据中提取了TE谱。图3(A)是处于始发态阶段(Primed-D0)和然后在4CL培养基1中培养后第1、2、3、5、8和12天(D1/2/3/5/8)的细胞以及胚胎第3、4、5、6和7天(E3/4/5/6/7)的人胚胎细胞(来自E-MTAB-3929)中TE表达谱的UMAP分析的二维散点图。其描述了4CL培养基中的始发态人PSC逐渐捕获了类似于胚胎第4天(桑葚胚期)和第5天(囊胚期)的人胚胎细胞的TE谱。图3(B)进一步表明ICLC中多个TE亚群的表达水平被诱导至人植入前胚胎(来自GSE101571)的表达水平。
图4表明ICLC在长期培养后保持正常核型(在第15代进行测试,在4CL培养基1中约60天)。示出了一种雌性人ESC系(H9)和一种雄性人iPSC系(UH10)。这些结果表明,通过4CL培养基1衍生的ICLC获得植入前ICM样基因表达谱,并在扩展培养后保持稳定的基因组。
在表观遗传景观中,与植入后ICM相比,植入前ICM的基因组是低甲基化的,并且染色质更加开放。为确定4CL培养基1对DNA甲基化状态的影响,发明人对ICLC和始发态人PSC进行了简并代表性亚硫酸氢盐测序(RRBS)。图5是箱线图,显示与始发态人PSC相比,ICLC中整个基因组的CpG DNA甲基化(左上图)显著降低的,而TSS的甲基化状态显示出轻微的差异(右上图)。值得注意的是,通过敲除STELLA阻止了全局DNA甲基化水平的降低(左下图)。图6显示ICLC的印迹状态保持与ICM相似。
为了确定ICLC的染色质可及性,发明人进行了单细胞ATAC-seq(scATAC-seq)和bulk ATAC-seq。图7(A)显示了在单细胞水平上始发态人PSC和ICLC染色质可及性的清晰分离。图7(B)显示,植入前ICM特异性基因的基因座例如KLF17、STELLA、DPPA5、CD70在ICLC中大部分是开放的。图7(C)显示共有的多能性基因如POU5F1在始发态人PSC和ICLC之间保持相似的染色质开放状态,而植入后特异性基因变得封闭,如THY1(图7,D)。图8中的时程bulkATAC-seq显示了在始发态人PSC向ICLC的转化过程中染色质可及性的逐步变化。在始发态人PSC中封闭的植入前特异性基因座(例如TFAP2C、KLF5和TFE3)在转化过程中逐渐开放,而在始发态人PSC中开放的植入后特异性基因座(例如ZIC3和FOXA2)逐渐封闭(图8A)。基序富集分析表明,封闭到开放的区域可被植入前ICM特异性转录因子(例如DUX、TFAP2C和KLF5)结合(图8,B,上图),而开放到封闭的区域可被植入后相关转录因子(例如SOX3、NKX6.1和NEUROD1)结合(图8,下图)。图8(C)显示了基因表达和染色质可及性的相关性。这些结果表明4CL培养基1成功地将表观遗传景观重排到植入前ICM。
发明人进一步研究了在4CL培养基1中诱导的ICLC的代谢状态。植入前ICM主要依赖于氧化磷酸化(OxPhos)作为其能量来源,而植入后主要依赖于糖酵解。图9显示,与始发态人PSC相比,与氧化磷酸化相关的基因的表达水平在ICLC中显著上调。这些结果表明氧化磷酸化在ICLC中被激活。
为了确定ICLC的分化潜能,发明人使用裸鼠作为受体动物进行了畸胎瘤形成测定。图10显示了皮下注射100万个ICLC后2个月形成的苏木精和伊红染色的畸胎瘤组织的代表性图像。他们显示存在来自全部三个胚层的细胞:中胚层(左图)、内胚层(中间图)和外胚层(右图)。本领域已知人ICLC能够产生滋养外胚层。因此,发明人使用先前公开的方案从ICLC诱导了滋养层干细胞(TSC)。如图11(A)所示,与未分化的ICLC相比,在TSC中多个TSC标志物如GATA3、CGA、ELF5、TP63、KRT18、KRT8、PSG6和CCR7显著升高。图11(B)是显示已知TSC标志物GATA3、TFAP2C和KRT7的表达的免疫荧光图像。图11(C)是主成分分析(PCA)的散点图,显示与ICLC和胎盘细胞(EGFR和HLAG)相比,ICLC衍生的TSC的转录组更接近人胎盘绒毛膜癌细胞系JEG3和BeWo。图11(D)显示了ICLC衍生的TSC和其他细胞类型的ELF5启动子区域的DNA甲基化状态。这些结果表明,ICLC获得了与人植入前胚胎相当的发育潜能。
出于伦理考虑,无法使用人胚胎测试ICLC的发育潜能。因此,发明人通过将ICLC与小鼠8C期卵裂球聚集来进行跨物种嵌合实验。在体外培养24小时后进行检查时,发现人ICLC已成功整合到大多数小鼠胚胎中并形成嵌合囊胚(图12,A-C)。在此阶段,人ICLC位于嵌合囊胚的ICM和TE部分。图12(A)是在囊胚期使用DsRed标记的始发态人PSC和DsRed标记的ICLC进行嵌合体测定的总结。图12(B)是代表性图像,显示了从与DsRed标记的始发态人PSC(上)或DsRed标记的ICLC(下)聚集的小鼠8C卵裂球发育而来的囊胚的相差(左)或红色荧光通道(右)。图12(C)是用抗OCT4(ICM,绿色)、抗CDX2(TE,灰色)染色的嵌合囊胚的免疫荧光,红色信号来自整合的DsRed标记的ICLC,DAPI(蓝色)用作核复染。当这些嵌合囊胚被转移到假孕小鼠的子宫中并发育到胚胎第10.5天(E10.5)时,人细胞可以与小鼠胚胎一起发育并促成不同的组织,包括胚胎组织、胚胎外胎盘和卵黄囊,如图13中的显微镜图像所示。图13(A)是显示E10.5嵌合胚胎(左)、胎盘(中)或卵黄囊(右)的相差(上)或红色荧光通道(下)的代表性图像。图13(B)是免疫荧光图像,显示hN(绿色)染色的人细胞分化成GATA6(红色)阳性内胚层组织。图13(C)是免疫荧光图像,显示DsRed标记的人细胞(红色)分化成由GATA3(绿色)标记的胎盘组织。综上所述,这些结果表明ICLC可以稳健地整合到小鼠囊胚中,并在体内促成小鼠E10.5胚胎和胚胎外组织。
最近,从小鼠扩展的PSC中产生了囊胚样结构(称为类囊胚)(Li et al.,2019)。然而,这种使用人体细胞的模型尚未得到很好的研究。当将ICLC应用于富含细胞外基质的培养基时,发明人观察到囊胚样结构仅从ICLC发育而来,而没有从始发态PSC发育而来(图14,A-B)。图14(A)显示了在REM培养基中由ICLC产生的类囊胚的形态。图14(B)是用抗OCT4(ICM,红色)、抗GATA3(TE,绿色)抗体染色或用DAPI(蓝色)复染的自形成类囊胚的免疫荧光图像。
GSK抑制剂(例如CHIR99021,其激活WNT/β-连环蛋白信号转导通路)被广泛用于已公开的原始态或扩展PSC培养基中。然而,包含它时会抑制ICLC的形成(图36)。图36(A)显示集落形态更平坦,表明类似于始发态人PSC的状态。图36(B-D)表明当将GSK抑制剂添加到4CL(4CL+CHIR)时,人植入前ICM富集基因的激活被阻断。一致地,从4CL中撤回WNT/β-连环蛋白信号转导抑制剂IWR1(其抑制WNT/β-连环蛋白信号转导通路)(4CL-IWR1)抑制了ICLC形成(图37)。这些结果表明GSK抑制剂激活WNT/β-连环蛋白信号转导通路不利于ICLC的形成。
实施例2
材料和方法
4CL基础培养基
与实施例1相同。
4CL补充剂
与实施例1相同。
细胞
人ESC系:H1(雄性)、HN10(雌性)、HUES1(雄性)和WIBR3(雌性);人iPSC系:CBC14(由发明人制成,雌性)、C11(由发明人制成,雌性)、Phoenix(来自Ulrich Martin实验室的馈赠,雌性)、DiPS 1016SevA(购自哈佛干细胞研究所,雄性)、STiPS O-XX1(购自哈佛干细胞研究所,雌性)、UH10(雄性)。
程序
使用与实施例1相同的程序。
实验结果
图15是RT-qPCR数据的条形图,显示在从多个始发态人PSC系转化的ICLC中,植入前ICM标志物KLF17、DNMT3L、DPPA5、STELLA、TFCP2L1、KLF4、MAEL和REX1被显著诱导。这表明4CL培养基1普遍适用于人PSC。
实施例3
材料和方法
4CL基础培养基
与实施例1相同。
4CL补充剂
与实施例1相同。
细胞
H9人ESC系。
程序
使用与实施例1相同的程序,除了将细胞铺在DMEM-F12(cat#)包被板上的1%(v/v)Geltrex
实验结果
图16是RT-qPCR数据的条形图,显示在使用4CL培养基1在Geltrex
实施例4
材料和方法
4CL基础培养基
与实施例1相同。
4CL补充剂
与实施例1相同。
细胞
H9人ESC系。
程序
按照与实施例1相同的程序培养始发态人PSC。在转化开始前一天,将始发态人PSC解离成单细胞,并使用补充有10μM Y27632的mTeSR1或E8培养基以60,000个细胞/孔将其铺在Aggrewell
实验结果
图17是RT-qPCR数据的条形图,显示在使用4CL培养基1在悬浮液中转化的ICLC中,植入前ICM标志物KLF17、DNMT3L、DPPA5、STELLA、TFCP2L1、KLF4、MAEL和REX1被显著诱导。这表明4CL培养基1对悬浮培养也有效。
实施例5
材料和方法
4CL基础培养基
与实施例1相同。
4CL补充剂
4CL培养基2(减去细胞外基质),在4CL基础培养基中补充:
SAH/PRC/EZH2抑制剂(10nM DZNep)、HDAC抑制剂(5nM TSA)、WNT/β-连环蛋白信号转导抑制剂(5μM IWR1)、L-抗坏血酸(50μg/ml)、JAK/STAT3激活剂(20ng/ml人LIF)、MAPK/ERK抑制剂(1μM PD0325901)、ACTIVIN A/NODAL激活剂(20ng/ml人ACTIVIN A)和ROCK抑制剂(1μM Y27632)。
4CL培养基3(减去ROCK抑制剂),在4CL基础培养基中补充:
SAH/PRC/EZH2抑制剂(10nM DZNep)、HDAC抑制剂(5nM TSA)、WNT/β-连环蛋白信号转导抑制剂(5μM IWR1)、L-抗坏血酸(50μg/ml)、JAK/STAT3激活剂(20ng/ml人LIF)、MAPK/ERK抑制剂(1μM PD0325901)、ACTIVIN A/NODAL激活剂(20ng/ml人ACTIVIN A)、细胞外基质(0.2%(v/v)Geltrex
4CL培养基4(减去ACTIVIN/NODAL激活剂),在4CL基础培养基中补充:
SAH/PRC/EZH2抑制剂(10nM DZNep)、HDAC抑制剂(5nM TSA)、WNT/β-连环蛋白信号转导抑制剂(5μM IWR1)、L-抗坏血酸(50μg/ml)、JAK/STAT3激活剂(20ng/ml人LIF)、MAPK/ERK抑制剂(1μM PD0325901)、细胞外基质(0.2%(v/v)Geltrex
细胞
H9人ESC系
程序:
使用与实施例1相同的程序。
实验结果
图18显示了RT-qPCR数据的条形图,显示在分别使用4CL培养基2、4CL培养基3和4CL培养基转化的ICLC中,植入前ICM标志物KLF17、DNMT3L、DPPA5、STELLA、TFCP2L1、KLF4、MAEL和REX1被显著诱导。这些结果表明,不含Geltrex
实施例6
材料和方法
4CL基础培养基
与实施例1相同。
e4CL补充剂
e4CL培养基,在4CL基础培养基中补充:
SAH/PRC/EZH2抑制剂(50nM DZNep,或3mM CPI-1205)、HDAC抑制剂(20nM TSA,或1mM VPA,或1mM NaB)、WNT/β-连环蛋白信号转导抑制剂(5μM IWR1,或5μMXAV939)、L-抗坏血酸(50μg/ml)、JAK/STAT3激活剂(20ng/ml人LIF)、MAPK/ERK抑制剂(1μM PD0325901)、ACTIVIN A/NODAL激活剂(20ng/ml人ACTIVIN A,或20ng/ml人NODAL)、ROCK抑制剂(1μMY27632,或1μM thiazovivin,或1μM羟基法舒地尔)和细胞外基质(0.2%(v/v)Geltrex
细胞
H9、H1、UH10人ESC系。
程序:
1)从始发态人PSC转换为8CLC
按照与实施例1相同的程序培养始发态人PSC。在转化开始前一天,将始发态人PSC解离成单细胞,并使用补充有10μM Y27632的mTeSR1或E8培养基以2,000至3,000个细胞/cm
2)从ICLC转换为8CLC
在转化开始前一天,将ICLC解离成单细胞,并使用4CL培养基以2,000至3,000个细胞/cm
3)类囊胚形成
使用与实施例1相同的程序。
实验结果
图19(A)是两种方式的8CLC诱导程序的方案,一种是从始发态PSC直接诱导,另一种是从ICLC诱导。图19(B-C)是RT-qPCR数据的条形图,显示在由始发态人PSC(图19,B)或ICLC(图19,C)转化的8CLC中,人8C特异性标志物ZSCAN4、TPRX1、ZIM3、ZSCAN5B、ZNF280A和ARGFX被显著诱导。8C特异性基因的诱导水平在两种转化方式中类似(图19,D)。图19(E)显示了8CLC中ZSCAN4的表达的免疫荧光图像。为了在单细胞水平表征8CLC的基因表达谱,发明人对处于始发态阶段(primed-D0)和在e4CL培养基中培养ICLC后第1、2、3和5天(e4CL-D1/2/3/5)的细胞进行了scRNA-Seq。图20(A)是不同时间点细胞的UMAP分析的二维散点图,以及已公开的胚胎第3、4、5、6和7天(E3/4/5/6/7,左图)体内人胚胎的scRNA-seq数据(来自E-MTAB-3929)。其表明e4CL培养基中的细胞逐渐获得类似于胚胎第3天(8C期)和第4天(桑葚胚期)的人胚胎细胞的基因表达谱。图20(B)显示8CLC中人8C期特异性标志物的表达水平上调至人8C期胚胎(GSE101571)的表达水平。总之,这些结果表明通过e4CL培养基衍生的8CLC获得了人体内桑葚胚和8C期胚胎样基因表达谱。
为了研究8CLC中激活的TE,发明人从图20(A)中提到的scRNA-seq数据中提取了TE谱。图21(A)是处于始发态阶段(primed-D0)和然后在e4CL培养基中培养后第1、2、3和5天(D1/2/3/5)的细胞以及胚胎第3、4、5、6和7天(E3/4/5/6/7)的人胚胎细胞(来自E-MTAB-3929)中TE表达的UMAP分析的2D散点图。其描述了e4CL培养基中的细胞逐渐获得类似于胚胎第3天(8C期)和第4天(桑葚胚期)的人胚胎的细胞的TE表达谱。图21(B)进一步说明8CLC中多个TE亚组的表达水平被诱导至人8C期胚胎(来自GSE101571)的表达水平。图22表明8CLC保持正常核型。示出了一个雌性人ESC系(H9)和一个雄性人iPSC系(UH10)。这些结果表明,由4CL培养基1衍生的ICLC获得了人8C期胚胎样的基因表达和TE谱,并保持了稳定的基因组。
为了确定8CLC的DNA甲基化状态,发明人已对8CLC和始发态PSC进行了RRBS。图23是箱形图,显示与始发态人PSC相比,在8CLC中整个基因组的CpG DNA甲基化(左上图)显著降低,而TSS的甲基化状态显示出轻微的差异(右上图)。值得注意的是,通过敲除STELLA阻止了全局DNA甲基化水平的降低(左下图)。图24显示了8CLC的印迹状态与体内人胚胎DNA甲基化数据的比较。除了DNA甲基化,染色质可及性也发生了变化。
图25中的Bulk ATAC-seq显示了始发态人PSC和8CLC之间染色质可及性的差异。在始发态人PSC中封闭的8C特异性基因座在8CLC中变得开放,而在始发态人PSC中开放的植入后特异性基因座变得封闭。这些结果表明4CL培养基1成功地将表观遗传景观重排到8C样状态。
发明人进一步研究了在e4CL培养基中诱导的8CLC的代谢状态。人8C期胚胎主要依赖于氧化磷酸化(OxPhos)作为能量来源,而植入后主要依赖于糖酵解。图26显示与始发态人PSC相比,与氧化磷酸化相关的基因的表达水平在8CLC中显著上调。这些结果表明氧化磷酸化在8CLC中被激活。
为了确定8CLC的分化潜能,发明人使用裸鼠作为受体动物进行了畸胎瘤形成测定。图27是注射100万个8CLC后8周形成的苏木精和伊红染色的畸胎瘤组织的图像。它们显示了全部三种胚层结构的存在:中胚层(左图)、内胚层(中图)和外胚层(右图)。发明人还使用先前公开的方案使用8CLC来诱导滋养层干细胞样细胞(TSCLC)。如图28所示,与未分化的8CLC相比,在TSCLC中多种TSC标志物如GATA3、CGA、KRT18、KRT8、PSG6和CCR7被显著诱导。这些结果表明8CLC具有胚胎和胚胎外发育潜能。
出于伦理考虑,不能使用人胚胎来测试发育潜能。因此,发明人通过将8CLC与小鼠8C期卵裂球聚集来进行跨物种嵌合体实验。在体外培养24小时后检查时,发现人8CLC成功整合到大多数小鼠胚胎中并形成嵌合囊胚。在此阶段,人8CLC位于嵌合囊胚的ICM和TE部分。图29(A)是显示从与DsRed标记的始发态人PSC(上)或DsRed标记的8CLC(下)聚集的小鼠8C卵裂球发育而来的囊胚的相差(左)或红色荧光通道(右)的代表性图像。图29(B)是用抗OCT4(ICM,绿色)、抗CDX2(TE,灰色)染色的嵌合囊胚的免疫荧光,红色信号来自整合的DsRed标记的8CLC,DAPI(蓝色)用作核复染。当这些嵌合囊胚被转移到假孕小鼠的子宫中并使其发育到胚胎第10.5天(E10.5)时,人细胞可以与小鼠胚胎一起发育并促成不同的组织,包括胚胎组织和胚胎外胎盘和卵黄囊(如图30中的显微镜图像所示)。图30(A)是显示E10.5嵌合胚胎(左)、胎盘(中)或卵黄囊(右)的相差(上)或红色荧光通道(下)的代表性图像。图30(B)是免疫荧光图像,显示hN(绿色)染色的人细胞分化成GATA6(红色)阳性内胚层组织。图30(C)是免疫荧光图像,显示DsRed标记的人细胞(红色)分化成由GATA3(绿色)标记的胎盘组织。综上所述,这些结果表明8CLC可以稳健地整合到小鼠囊胚中,并在体内促成小鼠E10.5胚胎和胚胎外组织。
为了确定8CLC的囊胚样结构形成潜力,发明人已将8CLC应用于富含基质的培养基并观察到5天内形成的囊胚样结构,但始发态人PSC则无法形成(图31,A)。图31(B)是用抗OCT4(ICM,红色)、抗GATA3(TE,绿色)抗体或核复染DAPI(蓝色)染色的自形成类囊胚的免疫荧光图像。
我们的8CLC可以作为8C调节因子功能研究的稳健模型。在试点研究中,发明人鉴定了控制8C状态的3种潜在的新调节因子TPRX1、KHDC1L和TRIM60。图37显示,在ICLC向8CLC转化期间8C特异性基因的诱导被敲低的TPRX1、KHDC1L或TRIM60所抑制。
GSK抑制剂(如CHIR99021,其激活WNT/β-连环蛋白信号转导通路)被广泛用于已公开的原始态或扩展PSC培养基中。然而,包含它时会抑制8CLC形成(图38)。图38表明当GSK抑制剂被添加到e4CL(e4CL+CHIR)时,人8C胚胎富集基因的激活被阻断。一致地,从e4CL中撤回WNT/β-连环蛋白信号转导抑制剂IWR1(其抑制WNT/β-连环蛋白信号转导通路)(e4CL-IWR1)抑制了8CLC的形成。这些结果证明GSK抑制剂激活的WNT/β-连环蛋白信号转导通路不利于8CLC的形成。
实施例7
材料和方法
e4CL基础培养基
与实施例1相同。
e4CL补充剂
与实施例6相同。
细胞
H9人ESC系。
程序:
在悬浮液中从ICLC转化为8CLC
按照与实施例1相同的程序培养ICLC。在转化开始前一天,将ICLC解离成单细胞并以300,000个细胞/ml的密度重悬于4CL培养基中。将细胞悬浮液加入烧瓶中进行悬浮培养(Greiner Bio-One,658190)。24小时后,细胞形成小的聚集体,将培养基改为不添加Y27632的e4CL。每天更换培养基,在不传代的情况下细胞在3至5天内转化为8CLC。
实验结果
图32是RT-qPCR数据的条形图,显示在使用e4CL培养基在悬浮液中转化的8CLC中,8C标志物ZSCAN4、ARGFX、TPRX1、ZNF280A和ZSCAN5B被显著诱导。这表明e4CL培养基对悬浮培养也有效。
实施例8
材料和方法
e4CL基础培养基
与实施例1相同。
e4CL补充剂
与实施例6相同。
细胞
人ESC系:HN10和UH10
程序:
与实施例6相同。
实验结果
图33是RT-qPCR数据的条形图,显示在从多个hPSC系转化的8CLC中,8C标志物ZSCAN4、ARGFX、TPRX1、ZNF280A、ZSCAN5B、DUXA、DUXB、MBD3L2、STELLA、KLF17和KHDC1L被显著诱导。这表明e4CL培养基普遍适用于人PSC。
实施例9
材料和方法
e4CL基础培养基
与实施例1相同。
e4CL补充剂
与实施例6相同。
细胞
小鼠ESC系:E14和Mervl-GFP
程序:
在转化开始前一天,将在血清/LIF条件下培养的小鼠ESC解离成单细胞,并使用血清/LIF培养基将其铺在饲养细胞上。二十四小时后,将培养基换成e4CL培养基。每天更新培养基。在不传代的情况下,细胞在3天内转化为小鼠2C样状态。
实验结果
图39显示,在从多个小鼠ESC系转化的2C样细胞,2C标志物Zscan4、Zscan4b、Zscan4c、Zscan4d、Dux、Tcstv1、Tcstv3、Gm4340、Zfp352和Dub1被显著诱导。这表明e4CL培养基也能有效诱导小鼠2C样状态,并且不是细胞系特异性的。
实施例10
材料和方法
4CL基础培养基
与实施例1相同。
4CL补充剂
与实施例1相同,但还使用了不同剂量的PD0325901、DZNep或TSA:PD0325901,0.5μM;TSA,20nM;DZNep,5nM、20nM或50nM。
细胞
H9人ESC系。
程序:
与实施例1相同。
实验结果
图40描绘了与始发态人PSC细胞相比,在使用补充有不同剂量的PD0325901、DZNep或TSA的4CL培养基1转化的ICLC中,植入前ICM标志物KLF17、DNMT3L、DPPA5、STELLA、TFCP2L1、KLF4、MAEL和REX1被显著诱导。
参考文献
Brons,I.G.,Smithers,L.E.,Trotter,M.W.,Rugg-Gunn,P.,Sun,B.,Chuva deSousa Lopes,S.M.,Howlett,S.K.,Clarkson,A.,Ahrlund-Richter,L.,Pedersen,R.A.,etal.(2007).Derivation of pluripotent epiblast stem cells from mammalianembryos.Nature 448,191-195.
Evans,M.J.,and Kaufman,M.H.(1981).ESTABLISHMENT IN CULTURE OFPLURIPOTENTIAL CELLS FROM MOUSE EMBRYOS.Nature 292,154-156.
Gafni,O.,Weinberger,L.,Mansour,A.A.,Manor,Y.S.,Chomsky,E.,Ben-Yosef,D.,Kalma,Y.,Viukov,S.,Maza,I.,Zviran,A.,et al.(2013).Derivation of novelhuman ground state naive pluripotent stem cells.Nature 504,282-286.
Gao,X.,Nowak-Imialek,M.,Chen,X.,Chen,D.,Herrmann,D.,Ruan,D.,Chen,A.C.H.,Eckersley-Maslin,M.A.,Ahmad,S.,Lee,Y.L.,et al.(2019).Establishment ofporcine and human expanded potential stem cells.Nat Cell Biol 21,687-699.
Honda,A.,Hatori,M.,Hirose,M.,Honda,C.,Izu,H.,Inoue,K.,Hirasawa,R.,Matoba,S.,Togayachi,S.,Miyoshi,H.,et al.(2013).Naive-like conversionovercomes the limiteddifferentiation capacity of induced pluripotent stemcells.J Biol Chem 288,26157-26166.
Hou,P.,Li,Y.,Zhang,X.,Liu,C.,Guan,J.,Li,H.,Zhao,T.,Ye,J.,Yang,W.,Liu,K.,et al.(2013).Pluripotent stem cells induced from mouse somatic cells bysmall-molecule compounds.Science 341,651-654.
Hu,K.(2019).On Mammalian Totipotency:What Is the MolecularUnderpinning for the Totipotency of Zygote?Stem Cells Dev 28,897-906.
Li,R.,Zhong,C.,Yu,Y.,Liu,H.,Sakurai,M.,Yu,L.,Min,Z.,Shi,L.,Wei,Y.,Takahashi,Y.,et al.(2019).Generation of Blastocyst-like Structures from MouseEmbryonic and Adult Cell Cultures.Cell 179,687-702 e618.
Li,Y.,Zhang,Z.,Chen,J.,Liu,W.,Lai,W.,Liu,B.,Li,X.,Liu,L.,Xu,S.,Dong,Q.,et al.(2018).Stella safeguards the oocyte methylome by preventing de novomethylation mediated by DNMT1.Nature 564,136-140.
Macfarlan,T.S.,Gifford,W.D.,Driscoll,S.,Lettieri,K.,Rowe,H.M.,Bonanomi,D.,Firth,A.,Singer,O.,Trono,D.,and Pfaff,S.L.(2012).Embryonic stemcell potency fluctuates with endogenous retrovirus activity.Nature 487,57-63.
Nakamura,T.,Liu,Y.J.,Nakashima,H.,Umehara,H.,Inoue,K.,Matoba,S.,Tachibana,M.,Ogura,A.,Shinkai,Y.,and Nakano,T.(2012).PGC7 binds histoneH3K9me2 to protect against conversion of 5mC to 5hmC in early embryos.Nature486,415-419.
Nichols,J.,and Smith,A.(2011).The origin and identity of embryonicstem cells.Development 138,3-8.
Shahbazi,M.N.,and Zernicka-Goetz,M.(2018).Deconstructing andreconstructing the mouse and human early embryo.Nat Cell Biol 20,878-887.
Shi,Y.,Inoue,H.,Wu,J.C.,and Yamanaka,S.(2017).Induced pluripotentstem cell technology:a decade of progress.Nat Rev Drug Discov 16,115-130.
Takahashi,K.,and Yamanaka,S.(2006).Induction of pluripotent stemcells from mouse embryonic and adult fibroblast cultures by definedfactors.Cell 126,663-676.
Takashima,Y.,Guo,G.,Loos,R.,Nichols,J.,Ficz,G.,Krueger,F.,Oxley,D.,Santos,F.,Clarke,J.,Mansfield,W.,et al.(2014).Resetting transcription factorcontrol circuitry toward ground-state pluripotency in human.Cell 158,1254-1269.
Tesar,P.J.,Chenoweth,J.G.,Brook,F.A.,Davies,T.J.,Evans,E.P.,Mack,D.L.,Gardner,R.L.,and McKay,R.D.(2007).New cell lines from mouse epiblastshare defining features with human embryonic stem cells.Nature 448,196-199.
Theunissen,T.W.,Powell,B.E.,Wang,H.,Mitalipova,M.,Faddah,D.A.,Reddy,J.,Fan,Z.P.,Maetzel,D.,Ganz,K.,Shi,L.,et al.(2014).Systematic Identificationof Culture Conditions for Induction and Maintenance of Naive HumanPluripotency.Cell Stem Cell 15,524-526.
Thomson,J.A.,Itskovitz-Eldor,J.,Shapiro,S.S.,Waknitz,M.A.,Swiergiel,J.J.,Marshall,V.S.,and Jones,J.M.(1998).Embryonic stem cell lines derivedfrom human blastocysts.Science282,1145-1147.
Yang,Y.,Liu,B.,Xu,J.,Wang,J.,Wu,J.,Shi,C.,Xu,Y.,Dong,J.,Wang,C.,Lai,W.,et al.(2017).Derivation of Pluripotent Stem Cells with In Vivo Embryonicand Extraembryonic Potency.Cell 169,243-257 e225.
Ying,Q.L.,Wray,J.,Nichols,J.,Batlle-Morera,L.,Doble,B.,Woodgett,J.,Cohen,P.,and Smith,A.(2008).The ground state of embryonic stem cell self-renewal.Nature 453,519-523.
Zhu,P.,Guo,H.,Ren,Y.,Hou,Y.,Dong,J.,Li,R.,Lian,Y.,Fan,X.,Hu,B.,Gao,Y.,et al.(2018).Single-cell DNA methylome sequencing of human preimplantationembryos.Nat Genet 50,12-19.
- 建立和维持早期胚胎样细胞的培养基和方法
- 包含作为从鸟类的蛋分离的细胞的胚盘多能干细胞、神经干细胞、胚胎成纤维细胞条件培养基作为有效成分的用于细胞增殖、皮肤再生及皱纹改善的培养基组合物
