一种配体及其制备方法和应用
文献发布时间:2024-04-18 19:58:30
技术领域
本发明涉及湿法冶金技术领域,尤其是涉及一种配体及其制备方法和应用。
背景技术
镍、钴是重要的战略资源,在合金工业、催化剂制备、新能源领域有着广泛的应用。随着高品位镍、钴矿资源的枯竭,从含镍、钴的二次资源(如含镍、钴的废催化剂、废旧锂离子三元电池、废弃硬质合金及不锈钢等)中提取回收镍、钴是资源循环利用以及环境保护的重要措施。加之“双碳”政策对工业排放的要求,开发高效短流程萃取提纯镍、钴的方法对于镍、钴冶金工业愈发重要。
镍、钴的湿法冶金过程一般包括以下几个步骤:浸出让金属进入溶液体系中,再通过结晶、蒸馏、沉淀、溶剂萃取、离子交换、电渗析、膜分离等操作,将目标金属和杂质进行分离。其中溶剂萃取因其提取和分离效率高、反应速度快、过程能耗低且易于实现规模化等优点,在水溶液中金属离子分离以及重金属污水处理中有着广泛的应用,如镍/钴分离、稀土分离,以及核污水中铀元素的处理等。目前,工业上提取镍、钴主要采用的是有机磷酸萃取剂P204和P507,前者主要用于预先去除镍钴溶液中的杂质,后者主要用于镍、钴分离。然而,常用的几种磷酸萃取剂对金属萃取的优先顺序中,镍、钴优先级均较后,且与一些金属极为接近,存在严重的共萃现象,严重影响产品质量,造成繁杂的分离流程。因此,在多金属溶液体系,需进行前处理操作除去优先级在镍、钴之前或与镍、钴相近的金属,而这些分离操作较复杂且成本较高,在工业上通常采用沉淀等方法除去含量较大的杂质,但此过程存在镍损失大、易产生二次污染等问题;虽然可以采用多种萃取剂进行多步萃取分离,而此方法易导致多种萃取剂之间混合互溶,不仅使萃取分离效果变差,还让萃取剂无法循环使用。因此,改变传统萃取体系中的萃取优先顺序,提高镍、钴的选择性,是实现高效短流程提纯镍、钴的重点。
而影响萃取效果的主要因素包括萃取剂以及和萃取剂具有协同作用的配体等。因此提供性能更优的萃取用试剂非常重要。
发明内容
本发明旨在至少解决现有技术中存在的技术问题之一。为此,本发明提出一种配体,能够有效提高镍钴萃取过程中,镍钴和其他干扰金属离子的分离系数,提升了镍钴的萃取率,还提升了镍和钴之间的分离系数。
本发明还提供了上述配体的制备方法。
本发明还提供了包括上述配体的有机相。
本发明还提供了上述配体在镍/钴萃取中的应用。
根据本发明第一方面的实施例,提供了一种配体,所述配体具有如式I所示结构:
其中,R为C
根据本发明实施例的配体,至少具有如下有益效果:
本发明设计的配体为双齿吡啶配体,可在镍、钴离子的内层配位,排挤出配位水分子,再与萃取剂(例如二壬基萘磺酸阴离子)形成稳定的配合物,促进镍、钴的萃取;同时由于对R的限定,限定了所述配体在和金属离子配位时的位阻,在其用于萃取镍钴时,显著提升了镍钴和其他金属离子之间的分离系数,提升镍钴的萃取效率。
根据本发明的一些实施例,式I中,R为C
根据本发明的一些实施例,所述配体为浅黄色至黄色油状物质。
根据本发明的一些实施例,所述含支链的C
根据本发明第二方面的实施例,提供了一种所述有机配体的制备方法,所述制备方法包括使2-(1H-吡唑-3-基)吡啶和R-Br发生亲核取代反应。
本发明提供的制备方法简单、易于实现,方便所述配体在工业上的大规模使用。
根据本发明的一些实施例,所述2-(1H-吡唑-3-基)吡啶(CAS:75415-03-1)可以自制,也可以商购。
根据本发明的一些实施例,所述自制,步骤包括:
D1.将乙醛,和氢化钠、四氢呋喃的混合悬浮液混合,并加热;
D2.将2-吡啶羧酸乙酯(CAS:2524-52-9)四氢呋喃溶液逐滴加入步骤D1所得混合物中,继续反应;
D3.冷却步骤D2所得混合物,并调整pH;
D4.采用乙醚萃取步骤D3所得混合物,并采用盐水洗涤所得有机相,并干燥、浓缩所得有机相;得3-氧代-3-(吡啶-2-基)丙醇;
D5.将步骤D4所得混合物和水合肼反应并去溶剂。
根据本发明的一些实施例,步骤D1中,所述混合的方法为搅拌;时长为10~30min。实际工业生产中,该混合的方法和时长均不进行严格限定,只要可以充分传质即可。
根据本发明的一些实施例,步骤D1中,所述加热的目标温度为50~70℃,例如具体可以是约60℃。
根据本发明的一些实施例,步骤D2中,所述继续反应的温度为步骤D1加热的目标温度。
根据本发明的一些实施例,步骤D2中,所述继续反应的时长为10~30min。例如具体可以是约20min。
根据本发明的一些实施例,步骤D3中,所述冷却所得混合物的温度为-5~5℃,例如具体可以是约0℃。
根据本发明的一些实施例,步骤D3中,所述pH,调整后的范围为8~9。
根据本发明的一些实施例,步骤D4中,所述干燥的方法为无水硫酸镁干燥。
根据本发明的一些实施例,步骤D4结束至步骤D5开始之间的时间≤10min。
根据本发明的一些实施例,步骤D5中,所述反应的时长为80~100min。例如具体可以是约90min。
根据本发明的一些实施例,步骤D5中,所述去溶剂的方法为减压蒸馏。
根据本发明的一些实施例,所述亲核取代反应包括如下步骤:
S1.将所述2-(1H-吡唑-3-基)吡啶、氢氧化钠和甲苯混合;
S2.将R-Br和步骤S1所得混合物混合,并回流。
根据本发明的一些实施例,步骤S1中,所述混合的方法为搅拌。所述混合的温度为15~40℃,例如具体可以是约25℃。所述混合的时长为30~90min,例如具体可以是约60min。
根据本发明的一些实施例,步骤S1中,所述2-(1H-吡唑-3-基)吡啶和氢氧化钠的物质的量比为1:10~15。例如具体可以是约1:12。
根据本发明的一些实施例,步骤S1中,所述2-(1H-吡唑-3-基)吡啶和甲苯的摩尔比为1:35~45。例如具体可以是约1:41。
根据本发明的一些实施例,步骤S1中,所述氢氧化钠以其溶液的形式添加。该溶液的浓度为35~45%,例如具体可以是约40%。
根据本发明的一些实施例,步骤S2中所述R-Br,和步骤S1中,所述2-(1H-吡唑-3-基)吡啶的量按计量比过量5~15%。例如具体可以是过量10%。该过量的计算基准是化学计量比,例如按照化学计量酸需要1mol,则实际添加量为1.05~1.1mol。
根据本发明的一些实施例,步S2中,所述混合的方式为,向步骤S1所得混合物中缓慢添加所述R-Br。这种添加方式可防止不可控剧烈反应带来的安全问题。
根据本发明的一些实施例,所述缓慢添加是指添加的时间≤2min。例如具体可以是约1min。
根据本发明的一些实施例,步骤S2中,所述回流的时长为70~80h。例如具体可以是约72h。
根据本发明的一些实施例,所述亲核取代反应,还包括在步骤S2中进行所述配体的纯化。
根据本发明的一些实施例,所述纯化的方法为:过硅胶柱色谱法、甲苯为洗脱剂去除样品中的杂质,以乙酸乙酯作为洗脱剂冲洗柱中产物。最后,通过高真空除去洗脱剂。
根据本发明第三方面的实施例,提供了一种有机相,所述有机相的原料包括所述的配体、萃取剂和稀释剂;所述萃取剂包括二壬基萘磺酸。
根据本发明实施例的有机相,至少具有以下有益效果:
由于双齿吡啶配体与二壬基萘磺酸等萃取剂之间存在分子间相互作用,两者形成的分子缔合体抑制了配体与杂质离子的配位,从而实现镍钴的优先萃取;进一步的,由于,镍、钴的萃取pH50不同,可以通过改变pH和有机相的配方实现镍和钴的分步分离。
本发明提供的有机相,易与水相分离,且不易乳化。
根据本发明的一些实施例,所述有机相中,所述萃取剂和配体的摩尔比为0.25~4:1。例如具体可以是约1:1、1.5:1或2:3。
根据本发明的一些实施例,所述有机相中,所述萃取剂的浓度为0.01~0.5mol/L。例如具体可以是约0.02mol/L、0.03mol/L、0.04mol/L、0.05mol/L、0.06mol/L、0.08mol/L或0.1mol/L。
根据本发明的一些实施例,所述有机相中,所述稀释剂包括甲苯。
根据本发明第四方面的实施例,提供了一种所述的有机相在镍/钴萃取中的应用。
由于所述应用采用了上述实施例的配体的全部技术方案,因此至少具有上述实施例的技术方案所带来的所有有益效果。具体的,在镍/钴萃取的过程中,可提升镍/钴,特别是镍和其他杂质金属离子之间的分配系数,并提升镍/钴,特别是镍的萃取效率;本发明的镍/钴萃取中,不需要进行严格、冗长的除杂程序,由此可显著降低镍/钴萃取的难度和耗时。
根据本发明的一些实施例,所述镍/钴萃取包括采用有机相对待萃水溶液进行第一次萃取;
所述待萃水溶液包括镍离子和钴离子中的至少一种。
本发明提供的应用中,采用特定的有机相,可直接萃取分离镍、钴(包括将镍钴和其他杂质离子分来,以及镍钴之间的分离),分离选择性高,无需对萃取剂进行皂化,在pH<2时依然有较高的镍萃取率。
根据本发明的一些实施例,所述待萃水溶液的pH为1.5~3.0。例如具体可以是约2。通常,含有大量金属离子的水溶液pH较低,因此,如果实际生产中,来料水溶液的pH不在上述范围内,则需要进行pH调整,例如具体可以添加一定量的氢氧化钠。
根据本发明的一些实施例,所述第一次萃取的O/A比为0.25~4:1。例如具体可以是约0.5:1、1:1、2:1或1:3。
根据本发明的一些实施例,所述第一次萃取为单级萃取。
根据本发明的一些实施例,所述第一次萃取的时长为25~35min,例如具体可以是约30min。该时长为混合的时长。其中混合的手段包括震荡和搅拌中的至少一种。当混合的手段为搅拌时,搅拌的转速为200~500rpm,例如具体可以是约300rpm。
根据本发明的一些实施例,所述第一次萃取的温度为15~40℃,例如具体可以是约25℃。即采用环境温度即可,不需要进行额外的温度调整。
根据本发明的一些实施例,所述镍/钴萃取还包括对所述第一次萃取所得一级负载有机相进行返萃。
根据本发明的一些实施例,对所述一级负载有机相进行返萃中,所用水相为酸水溶液。
根据本发明的一些实施例,所述酸水溶液的H
根据本发明的一些实施例,所述酸水溶液的溶质包括硫酸。
根据本发明的一些实施例,对所述一级负载有机相进行返萃中,O/A比为1:1~5;例如具体可以是约1:4。
根据本发明的一些实施例,对所述一级负载有机相进行返萃中,时长为5~20min。例如具体可以是约10min。在上述时长范围内,需将有机相和水相进行混合,所述混合的方式包括震荡和搅拌中的至少一种。当混合的手段为搅拌时,搅拌的转速为200~500rpm,例如具体可以是约300rpm。
根据本发明的一些实施例,对所述一级负载有机相进行返萃中温度为15~40℃。例如具体可以是约25℃。
根据本发明的一些实施例,所述镍/钴萃取还包括对所述返萃所得空白有机相进行洗涤,得再生有机相。
根据本发明的一些实施例,镍/钴萃取包括以下步骤:
B1.采用有机相对待萃水溶液进行第一次萃取,得萃余相和一级负载有机相;
B2.采用酸水溶液对所述一级负载有机相进行返萃;得富镍水相和空白有机相;
B3.洗涤步骤B2所得空白有机相,得重生有机相。
根据本发明的一些实施例,所述富镍水相中还可能包括钴。具体的,包括钴的比例,由步骤B1中,第一次萃取的O/A比,以及有机相的组成决定。换个角度讲,所述有机相对镍离子和钴离子都有较强的亲和性,因此如果有机相是过量的,那么可能同时将待萃水溶液中的镍和钴萃取进入一级负载有机相,进而转移至富镍水相中;但是镍离子和钴离子相比,有机相对镍离子的亲和性更高,因此控制有机相的用量,可使大部分的钴离子留在萃余相中,而富镍水相中,除镍外的金属离子含量很低。
根据本发明的一些实施例,当所述待萃水溶液包括镍离子和钴离子时;所述镍/钴萃取还包括以所述有机相对第一次萃取所得萃余相进行第二次萃取;
所述第一次萃取和第二次萃取所用有机相的配比可以相同也可以不同。
根据本发明的一些实施例,所述萃余相的pH为1.5~3.0。例如具体可以是约2。如果萃余相的pH发生了变化,需要进行调节,例如可以采用硫酸或氢氧化钠作为pH调节剂。
根据本发明的一些实施例,所述第二次萃取的O/A比为0.25~4:1。例如具体可以是约0.5:1、1:1、2:1或1:3。
具体的,第二次萃取和第一次萃取的条件可以相同,也可以不同。如果只为了将镍/钴和其他杂质离子分开,则可以采用相同的条件进行萃取。如果为了提升镍和钴之间的分离效率,则需要根据镍和钴的pH50对有机相和水相的组成进行微调。
根据本发明的一些实施例,所述镍/钴萃取还包括对所述第二次萃取所得二级负载有机相进行返萃。其中,所用水相为酸水溶液;进一步的,所述酸水溶液的H
对一级负载有机相和二级负载有机相的反萃,条件可以相同也可以不同。
根据本发明的一些实施例,所述待萃水溶液中,还包括Mn
根据本发明的一些实施例,当所述待萃水溶液中同时包括镍和钴时,所述镍/钴萃取的步骤为:
B1.采用有机相对待萃水溶液进行第一次萃取,得萃余相和一级负载有机相;
B2.采用酸水溶液对所述一级负载有机相进行返萃;得富镍水相和空白有机相;
B3.洗涤步骤B2所得空白有机相,得重生有机相。
采用有机相对所述萃余相进行第二次萃取,得杂质水相和二级负载有机相;
B4.采用酸水溶液对所述二级负载有机相进行返萃;得富钴水相和空白有机相。
B5.洗涤步骤B4所得空白有机相,得重生有机相。
由此,重生有机相可返回步骤B1和步骤B3用在第一次萃取或第二次萃取,原料的循环利用,显著提升了所述应用中的原料成本,并降低了废弃原料对环境的负面影响。
通过两步简单的萃取,不仅可将镍钴和其他杂质金属离子分开,还可以将镍、钴之间进行简单的分离,和传统萃取相比,显著降低了镍/钴萃取的流程和成本。如果不需要进行镍钴之间的分离,则只需要进行第一次萃取,而不需要进行第二次萃取。
步骤B1~B5的顺序,仅是为了方便阐述,并不做严格限定,只要满足实际可行的逻辑即可,例如第一次萃取应早于第二次萃取;每一次萃取需早于对应的反萃;每一次反萃应早于每一次的空白有机相的洗涤。整体上来说,实际生产中可根据设备条件和场地条件对步骤顺序进行调整。
根据本发明的一些实施例,步骤B3和步骤B5中的洗涤,是指采用纯水洗涤。由此可知,包括所述配体的有机相,重生方法简单,易于操作,这进一步降低了镍/钴萃取的难度。
根据本发明的一些实施例,步骤B3中,所述杂质水相中,含有除镍钴之外的,几乎所有的杂质离子。
整体上,本发明提供了一种包括所述配体的有机相在萃取镍/钴中的应用,具体采用了一种高效且短流程的萃取方法从硫酸介质酸性多金属溶液中选择性萃取提纯镍、钴,特别是能在不进行溶液前处理以及有机相的皂化操作条件下,直接实现镍、钴离子与杂质金属离子的有效分离;本发明的操作简单、萃取效率高、分离效果好、操作成本低、有机相可循环利用,易于实现工业化。
若无特殊说明,本发明的“约”实际表示的含义是允许误差在±2%的范围内,例如约100实际是100±2%×100。
若无特殊说明,本发明中的“在……之间”包含本数,例如“在2~3之间”包括端点值2和3。
本发明的其它特征和优点将在随后的说明书中阐述,并且,部分地从说明书中变得显而易见,或者通过实施本发明而了解。
附图说明
本发明的上述和/或附加的方面和优点从结合下面附图对实施例的描述中将变得明显和容易理解,其中:
图1是本发明实施例2所得配体的核磁氢谱;
图2是本发明实施例2所得配体的核磁碳谱;
图3是本发明实施例3所得配体的衰减全反射红外光谱。
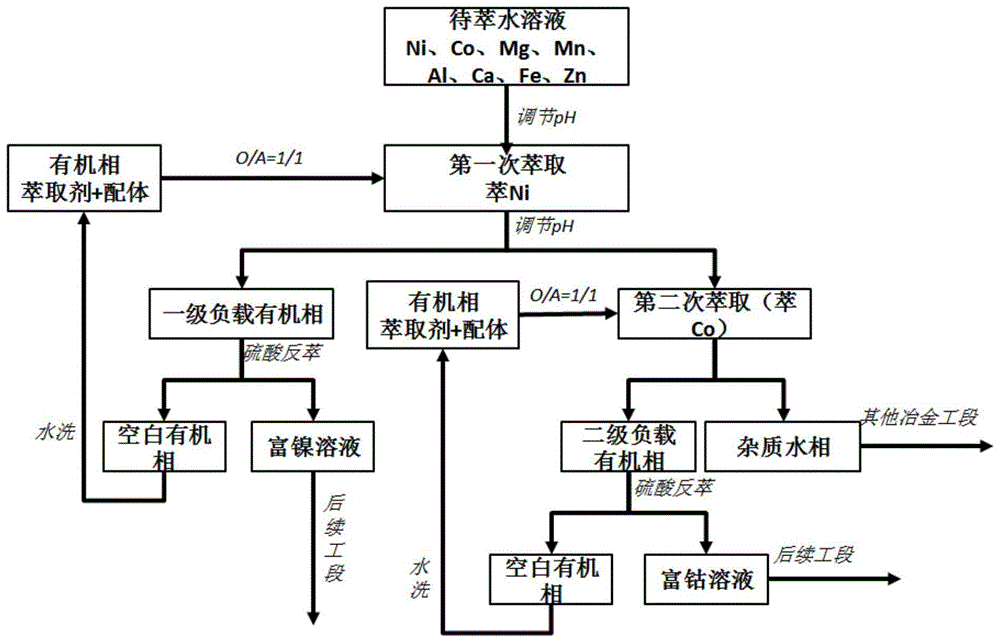
图4是本发明应用例中萃取的流程示意图。
具体实施方式
以下将结合实施例对本发明的构思及产生的技术效果进行清楚、完整地描述,以充分地理解本发明的目的、特征和效果。显然,所描述的实施例只是本发明的一部分实施例,而不是全部实施例,基于本发明的实施例,本领域的技术人员在不付出创造性劳动的前提下所获得的其他实施例,均属于本发明保护的范围。
本发明的描述中,参考术语“一个实施例”、“一些实施例”、“示意性实施例”、“示例”、“具体示例”、或“一些示例”等的描述意指结合该实施例或示例描述的具体特征、结构、材料或者特点包含于本发明的至少一个实施例或示例中。在本说明书中,对上述术语的示意性表述不一定指的是相同的实施例或示例。而且,描述的具体特征、结构、材料或者特点可以在任何的一个或多个实施例或示例中以合适的方式结合。
若无特殊说明,具体实施方式中分配比D、分离系数β、萃取率E
D=C
β
β
E
E
其中,式(1)中C
实施例1
本例制备了一种R为C
S1.将2-(1H-吡唑-3-基)吡啶与氢氧化钠溶液在甲苯中室温(约25℃)搅拌混合1h;其中2-(1H-吡唑-3-基)吡啶、氢氧化钠和甲苯的摩尔比为1:12:41;2-(1H-吡唑-3-基)吡啶的质量为1g;本例所用氢氧化钠溶液的浓度为40%。
S2.步骤S1所得混合物中缓慢加入(1~2min内添加完成,匀速添加)略过量(比化学计量所需量过量10%)的溴丁烷(CAS:109-65-9),回流72h;
S3.通过硅胶柱色谱法、甲苯为洗脱剂去除样品中的杂质,以乙酸乙酯作为洗脱剂冲洗柱中产物;最后,通过高真空除去洗脱剂,得到浅黄色油状的双齿配体。
实施例2~4分别制备了一种R为C
实施例2中,将步骤S2中的溴丁烷,替换为等物质的量的溴代辛烃(CAS:111-83-1);
实施例3中,将步骤S2中的溴丁烷,替换为等物质的量的溴十二烷(CAS:112-29-8);
实施例4中,件步骤S2中的溴丁烷,替换为等物质的量的2-丁基-1-溴辛烷(CAS:85531-02-8)。
测试例1
本例测试了实施例1~4所得配体的红外和核磁结果,以证明本发明确实合成了对应的配体。其中实施例2所得配体的结果如图1~3所示。由于结果类似,实施例1和实施例3~4的结果在此不进行赘述。
实施例5
本实施例提供了一组有机相,具体组成如表1所示。
表1实施例5中有机相的组成
应用例1
本例以实施例5所得C
待萃水溶液的组成为:Ni
萃取为单级萃取,O/A比为1:1,温度为25℃;混合的时长为30min,混合的方法为300rpm的转速搅拌。
本例中,各金属离子的萃取率如表2所示,分配比和分离系数如表3所示。
表2应用例1中金属离子的萃取率
表3应用例中镍、钴和其他金属离子之间的分离系数
表3中,分配比和分离系数的下角标1~3,分别对应组别A~C。
根据以上结果可知,单独使用二壬基萘磺酸或吡啶吡唑双齿配体(实施例2)萃取镍,都表现出较差的选择性,其中,单独二壬基萘磺酸萃取金属的能力较强,其优先顺序为Al>Fe>Ca>Zn>Co>Ni>Mg,吡啶吡唑双齿配体的萃取能力较弱,对所含金属的萃取能力比较接近;但是当采用两者混合体系的萃取镍时,Ni的萃取率接近90%,而Fe、Al、Ca、Zn、Mg杂质金属的萃取率则低于10%,镍、钴存在轻微共萃。由此说明,本发明提供的有机相中,萃取剂和配体之间发生了协同,共同提升了对镍的萃取率,并抑制了对其他金属的萃取。
从结果中还可以发现:Ni与其他金属杂质的分离系数≥90,甚至接近500,Ni、Co之间分离系数达到了30以上。因此,本发明提供的有机相对镍有明显的协同萃取作用,且该单级萃取过程可以较好的将Ni与其他金属分离,包括镍和钴之间的分离。
应用例2
本例以实施例5所得四种有机相对红土硫酸浸出液(同应用例1)进行单级萃取,以验证配体支链类型对待萃水溶液中金属离子的萃取效果。萃取的条件和应用例1相同。结果如表4所示。
表4包含不同配体的有机相的性能
结果显示:随着烷基链的增长,空间位阻的增大使得配体对杂质抑制作用进一步增强;同时,由于L配体疏水性增强,促进了Ni的萃取;但是,如果烷基链上具有较大的支链结构,则会进一步增大位阻效应,这将导致金属萃取率均降低,但并未改变Ni萃取的优先性。因此,对于配体结构的设计可以调节配体分子的空间位阻和烷基链结构,促进体系对杂质的抑制、增强镍的萃取。
应用例3
本例以实施例5所得C
表5 O/A比对萃取效果的影响
结果显示,随着O/A的降低,镍钴的萃取率下降较为明显,杂质的萃取率变化趋势不大,但镍、钴的萃取率依然高于其他杂质的萃取率,这可能是由于特定的待萃水溶液和有机相匹配时,当O/A为1:1左右时,恰好达到了有机相对镍的饱和负载量,如果降低有机相的用量,则会降低镍和钴的萃取率。综合考虑镍钴的分离因子,当O/A=1:1时,该体系对各金属的分离效果最好,镍的萃取率接近90%,钴的萃取率在20%附近,其他杂质金属都在10%左右,单级萃取可以达到镍、钴以及其它金属杂质之间的初步分离。但是该比例受待萃水溶液组成和有机相组成的影响,如果上述条件变化,该比例也可能发生变化。
应用例4
本例以实施例5所得C
表6pH对萃取率的影响
以上结果显示,不管在何pH条件下,单一的二壬基萘磺酸萃取剂均无法实现镍的选择性分离。采用本发明提供的有机相,在待萃水溶液初始pH=1.67的条件下仍可萃取46%的镍,其余杂质共萃率低,在待萃水溶液初始pH为2.01时,镍的萃取效率为65%左右,当待萃水溶液的初始pH为3.00时镍的萃取率超过了90%,其他杂质离子萃取并未显著提升;这符合酸性萃取剂阳离子交换的萃取机理;因而有望实现pH=1.5~2.0范围对镍选择性萃取。
应用例5
本例对应用例1中C组所得负载有机相进行返萃,验证了返萃所用水相的组成对返萃效率的影响,具体的:
返萃的O/A比为1:1、混合时间30min、搅拌速率为300r/min、温度25℃。
返萃所用水相为硫酸水溶液,其硫酸浓度和萃取效果如表7所示。
表7返萃所用水相浓度对返萃效率的影响
结果显示,随酸度的提升,镍和钴的返萃效率都有一定的提升,考虑到成本和镍钴分离的效果,2mol/L的硫酸水溶液,已经是比较合适的浓度选择。但也可以根据实际情况对返萃所用水相的酸浓度进行调整。
应用例6
本例对应用例1中C组所得萃余相进行第二次萃取,并对所得二级负载有机相进行返萃,其中:
萃余相的组成为:Ni
萃取:采用实施例5中C
反萃:采用的水相为2mol/L硫酸,O/A比为1:1,混合时间为10min,搅拌速率为300r/min,温度25℃,进行单级反萃取。
应用例1中C组的萃取过程、应用例5的返萃过程和本例三者结合的流程示意图如图4所示。本例萃取和返萃的结果如表8所示。
表8第二次萃取和返萃的结果
根据以上结果可知,在钴萃取中,对于萃余液中剩余镍的萃取率接近100%,而对于钴的萃取能达到65%;尽管仍优先萃取镍,但萃余液中镍含量低,且其他杂质金属的萃取率均在10%以下,因此该萃取剂体系可以优先萃镍后进一步萃取分离钴。也就是采用图4提供的流程,可实现镍和钴的初步分离,并实现镍/钴和其他杂质的高效分离。萃取的流程很短,可降低镍、钴湿法冶金的资金成本和时间成本。
应用例7
本例验证了有机相中配体和萃取剂摩尔比对萃取效果的影响,具体的:
待萃水溶液:废旧三元锂离子电池硫酸浸出液,包含Ni
有机相:如实施例5中C
萃取的条件和应用例1相同。测试结果如表9所示。
表9有机相组成对萃取效果的影响
本例结果和应用例1所得结果部分类似:单独的萃取剂和配体时无金属分离性能,但萃取剂/配体的摩尔比例在1~1.5:1之间时,镍的萃取效率明显提高,与其余金属的分离能力增大,说明本发明提供的有机相对废旧三元锂离子电池硫酸浸出液中镍具有优先萃取分离能力。
应用例8
本例验证了有机相中萃取剂和配体浓度对萃取效果的影响,具体的:
待萃水溶液:废加氢催化剂的硫酸浸出液,其中含有Ni
有机相:二壬基萘磺酸和实施例2所得配体的摩尔比为1:1;二壬基萘磺酸和配体的总浓度分别为0.0.04mol/L、0.08mol/L、0.12mol/L、0.16mol/L、0.20mol/L。
萃取的具体条件和应用例1相同。测试结果如表10所示。
表10有机相浓度对萃取效果的影响
结果显示,二壬基萘磺酸和本发明提供的配体对废加氢催化剂的硫酸浸出液中镍离子具有较强的优先萃取能力,且随着浓度增大,镍萃取率明显提升,但Al、Fe杂质共萃较少。
结合所有应用例可以看出,本发明提供的有机相,普适性高,无论待萃水溶液的来源是什么,均可以实现镍钴之间的分离,还可以实现镍钴和其他杂质之间的分离,关键是镍钴的萃取率高。
上面结合附图对本发明实施例作了详细说明,但是本发明不限于上述实施例,在所属技术领域普通技术人员所具备的知识范围内,还可以在不脱离本发明宗旨的前提下作出各种变化。此外,在不冲突的情况下,本发明的实施例及实施例中的特征可以相互组合。
- 一种检测外泌体的适配体组、侧流式适配体生物传感器及其制备方法
- 一种含有至少一种环状配体结构的化合物的制备方法和纯化方法
- 一种带有表面配体的CdSe/CdS核壳结构光催化剂及其制备方法和应用
- 一种自组装核酸适配体/蛋白质复合纳米探针、制备方法、试剂盒及其应用
- 一种聚苯乙烯固载的手性二胺类配体及其制备方法和应用
- 双吡啶基类配体及其制备方法、含双吡啶基类配体的钌超分子自组体及其制备方法和应用
- 双吡啶基类配体及其制备方法、含双吡啶基类配体的钌超分子自组体及其制备方法和应用
