一种无抗性质粒生产系统及其应用
文献发布时间:2024-04-18 19:58:30
技术领域
本发明涉及生物技术领域,尤其涉及一种无抗性质粒生产系统及其应用。
背景技术
近年来,基因治疗方法越来越引起人们的关注,特别是DNA或RNA疫苗在很多方面上克服了传统疫苗或病毒载体疫苗的缺陷,不管是DNA或RNA疫苗还是病毒载体疫苗等对质粒需求量通常非常大。
传统的质粒系统在基因治疗的应用上有较多的缺陷,一方面传统质粒携带有抗生素标记基因,但是抗性基因的过表达对大肠杆菌代谢、生长会有一定的副作用,并且抗生素在环境中传播会使人群普遍产生抗生素耐药性,同时质粒中残留的抗生素也可能会引起敏感个体的过敏反应;另一方面传统质粒携带有原核细菌骨架,大多含有未甲基化CpG序列,容易诱发先天免疫系统。不管是携带抗生素标记基因还是原核细菌骨架,都会使外源基因表达盒外的序列在质粒中占比过大,增大了质粒的体积,不仅影响质粒的产量,还会导致转染效率降低,这在基因治疗中是一个负面影响。较小尺寸的超螺旋质粒能更有效地到达细胞核,并且使外源基因能持续、持久表达,所以缺乏抗性基因和同时具有较短原核骨架的质粒具有更大的优势。
为了提高基因治疗的安全性,不含抗生素耐药标记的新一代质粒骨架系统陆续被开发出来,主要包括如下:1、基于营养不良菌株的互补:通过将某一个维持细菌生长的必需基因引入缺失或突变来修饰菌株,从而导致菌株营养不良无法生长;然后将携带缺失基因的质粒导入菌株后即可恢复菌株生长。2、毒性-抗毒性系统:将毒性基因插入到细菌基因组中,使细菌无法生长,将抗毒性基因克隆到质粒上,导入菌株后恢复菌株生长。3、操纵基因/阻遏蛋白系统:在细菌基因组生长必须基因上游引入某种阻遏蛋白,抑制必须基因表达,将含有一个或多个操纵基因序列的质粒引入细菌,竞争性地滴定阻遏物,从而允许基因的表达。4、生长必需基因的过表达:在大肠杆菌中过度表达某些生长必需基因(fabl或murA)可以降低它们对抗菌化合物的敏感性,但是抑制剂存在于培养基中,必须从纯化的质粒DNA中去除。以上几种新型的无抗质粒系统虽然解决了抗生素标记基因的使用,但是依旧存在两个主要的问题:1、目的基因表达盒外的序列在质粒中占比过大,导致质粒体积加大,从而在相同的单位重量下,质粒产量一部分由没有效用的原核序列骨架贡献,目的基因表达盒拷贝数占比相对减少,影响目的表达盒产量。2、虽然有的系统不需要使用抗生素,但是还是需要添加其他辅助抑制剂,而这些抑制剂在最终的质粒产品中无法保证100%去除,不仅会增加质粒制备的成本,其残留在基因治疗中的影响也是不可控的。所以目前这些无抗性载体系统无法被有效普及使用。
一方面传统质粒携带有抗生素标记基因,但是抗性基因的过表达对大肠杆菌代谢、生长会有一定的副作用,并且抗生素在环境中传播会是人群普遍产生抗生素耐药性;同时质粒中残留的抗生素也可能会引起敏感个体的过敏反应。另一方面传统质粒携带的原核细菌骨架较大,使得外源基因表达盒外的序列在质粒中占比过大,增大了质粒的体积,不仅影响质粒的产量,还会影响转染效率;并且原核细菌骨架大多含有未甲基化CpG序列,容易诱发先天免疫系统。
而现有的新型无抗质粒系统虽然解决了抗生素标记基因的使用,但是质粒中其他抑制基因的插入依旧无法解决外源基因表达盒外的序列在质粒中占比过大,导致质粒体积加大,产量无法提高等问题;虽然有的系统不需要使用抗生素,但是还是需要添加其他辅助抑制剂,而这些抑制剂在最终的质粒产品中无法保证100%去除,不仅会增加质粒制备的成本,其残留在基因治疗中的影响也是不可控的。
发明内容
有鉴于此,本发明提供了一种无抗性质粒生产系统及其应用。该生产系统不需要使用抗生素和其他辅助抑制剂,质粒拷贝数可达常规质粒产量的4-5倍,提高应用安全性的同时大大降低了生产成本。
为了实现上述发明目的,本发明提供以下技术方案:
本发明提供一种质粒生产系统,其特征在于,包括宿主细胞表达盒和质粒(记为miniVec质粒);
所述宿主细胞表达盒包括毒性基因表达盒和抗毒性基因表达盒;
所述毒性基因表达盒包括启动子和转录毒性转录本的核酸片段1;毒性转录本包括对宿主产生毒性的基因和/或非编码RNA;
所述抗毒性基因表达盒包括启动子、操纵子和转录抗毒性转录本的核酸片段2;所述抗毒性转录本对毒性转录本产生的毒性具有抵抗作用;其中,所述抗毒性转录本包括抗毒性基因转录本和/或对所述毒性转录本的毒性具有抵抗作用的非编码RNA;
所述质粒包括编码小RNA的核酸片段3和Ori复制起始位点,所述核酸片段3与所述核酸片段1反向互补,从而抑制毒性转录本的功能。
本发明所述质粒生产系统中,操纵子调控启动子的开启和关闭,从而操纵抗毒性基因的表达。所述抗毒性转录本中,当毒性转录本单独表达时,宿主细胞无法生长或生长受抑制;所述抗毒性转录本的产物对毒性转录本产生的毒性具有抵抗作用,当毒性转录本和抗毒性转录本同时表达时,毒性转录本的毒性作用被抑制,宿主细胞能够正常生长。
一些实施方案中,所述操纵子为阿拉伯糖操纵子、Lac操纵子、鼠李糖分解代谢操纵子、色氨酸操纵子、gab操纵子和Gal操纵子中的任意一种。所述操纵子调控的启动子为araBAD启动子、T7lac启动子、Tac启动子、Trc启动子、LacUV5启动子、tetA启动子、rhaBAD、gabP、galP1启动子中的任意一种;所述操纵子的阻遏蛋白基因为AraC、LacI、CAP、rhaS/R、四环素、csiR或galR,包括但不仅限于此。
一些实施方案中,所述核酸片段3与所述核酸片段1反向完全互补或至少具有20%的序列反向互补或至少连续10bp反向互补。
一些实施方案中,所述核酸片段1包括UTR序列和毒性基因,所述UTR序列选自1)~4)中的任一项:
1)如SEQ ID NO:1第1~252位所示的核酸序列;
2)在1)所示的序列中取代、缺失或添加一个或多个核苷酸且功能相同或相似的序列;
3)与1)、2)或所示序列互补的序列;
4)与1)、2)3)所示序列至少具有50%同源性且功能不发生改变的序列。
一些实施方案中,所述UTR序列还可选自如SEQ ID NO:2第1~64位所示的核酸序列。
本发明中,所述毒性基因选自ccdB、ParE、MazF、Kid、HicA、RelE、VapC、Doc、RatA、HipA、Zeta、ToxN、YeeV、CptA、GhoT、Hok、TisB、SymE、PasA中的任意一种;所述抗毒性转录本为抗毒性基因;其中,所述抗毒性基因选自ccdA、ParD、MazE、Kis、HicB、RelB、VapB、Phd、RatB、HipB、Epsilon、ToxI、YeeU、CptB、GhoS、Sok、IstR-1、SymR、PasB/C中的任意一种。
一些实施方案中,所述毒性基因为ccdB基因,所述毒性基因表达盒包括启动子、UTR序列和ccdB基因;所述转录抗毒性转录本的核酸片段2为ccdA基因,所述抗毒性基因表达盒包括araBAD启动子、阿拉伯糖操纵子和ccdA基因。
一些具体实施例中,所述UTR序列为5’UTR序列,5’UTR序列和毒性基因融合表达,融合后的序列如SEQ ID NO:1或SEQ ID NO:2所示:
SEQ ID NO:1
gtttaaggaattttgtggctggccacgccgtaaggtggcaaggaactggttctgatgtggatttacaggagccagaaaagcaaaaaccccgataatcttcttcaactttggcgagtacgaaaagattaccggggcccacttaaaccgtatagccaacaattcagctatgcggggagtatagttatatgcccggaaaagttcaagacttctttctgtgctcgctccttctgcgcattgtaagtgcaggatggtgtgcagtttaaggtttacacctataaaagagagagccgttatcgtctgtttgtggatgtacagagtgatattattgacacgcccgggcgacggatggtgatccccctggccagtgcacgtctgctgtcagataaagtctcccgtgaactttacccggtggtgcatatcggggatgaaagctggcgcatgatgaccaccgatatggccagtgtgccggtctccgttatcggggaagaagtggctgatctcagccaccgcgaaaatgacatcaaaaacgccattaacctgatgttctggggaatataa。
SEQ ID NO:2
Ggtagacacacatcttgtcatatgatataatggtttcgccaaaaatcaataatcagacaacaaggtgcagtttaaggtttacacctataaaagagagagccgttatcgtctgtttgtggatgtacagagtgatattattgacacgcccgggcgacggatggtgatccccctggccagtgcacgtctgctgtcagataaagtctcccgtgaactttacccggtggtgcatatcggggatgaaagctggcgcatgatgaccaccgatatggccagtgtgccggtctccgttatcggggaagaagtggctgatctcagccaccgcgaaaatgacatcaaaaacgccattaacctgatgttctggggaatataa。
一些具体实施例中,所述抗毒性基因表达盒的核苷酸序列如SEQ ID NO:9所示。
一些具体实施例中,本发明所述的质粒生产系统的宿主细胞表达盒中,所述抗毒性基因表达盒的个数和毒性基因表达盒的个数均选自≥1的整数。本领域技术人员可结合所选择的毒性基因及其毒性以及抗毒性基因对毒性的抑制作用,选择适宜的个数,从而保证当毒性转录本和抗毒性转录本同时表达时,毒性转录本的毒性作用被抑制。在一些具体实施例中,所述毒性基因表达盒的个数为1个,抗毒性基因表达盒的个数具体为1个、2个、3个、4个或更多个。在一个具体实施例中,所述毒性基因表达盒中毒性基因为ccdB基因,所述抗毒性基因表达盒中抗毒性基因为ccdA基因,毒性基因表达盒为1个,抗毒性基因表达盒的个数为2个。
本发明中,根据复制起始位点Ori的类型,所述宿主细胞表达盒还可引入一个质粒复制所需的Rep蛋白,如R6K质粒复制必需蛋白R6KRep,适用于R6K等需要辅助蛋白进行条件性复制的质粒制备。
本发明所述的miniVec质粒包括启动子和转录小RNA的核酸片段3(本记为VecSeqB);所述核酸片段3的序列选自如下a)~d)中的任意一种:
a)如SEQ ID NO:3~7任一项所示的序列;
b)在a)所示序列中取代、缺失或添加一个或多个核苷酸且功能相同或相似的序列;
c)与a)或b)所示序列互补的序列;
d)与a)、b)或c)所示序列至少具有50%同源性且功能不发生改变的序列。
其中,SEQ ID NO:3所示序列为:
Agtcacaccatcctgcacttacaatgcgcagaaggagcgagcacagaaagaagtcttgaacttttccgggcatataactatactccccgcatagctgaattgttggctatacggtttaagtgggccccggtaatcttttcgtactcgccaaagttgaagaagattatcggggtttttgcttttctggctcctgtaaatccacatcagaaccagttccttgccaccttacggcgtggccagccacaaaattccttaaac(VecSeqB1/
SEQ ID NO:4所示序列为:
agaaggagcgagcacagaaagaagtcttgaacttttccgggcatataactatactccccgcatagctgaattgttggctatacggtttaagtgggccccggtaatcttttcgtactcgccaaagttgaagaagattatcggggtttttgcttttctggctcctgtaaatccacatcagaaccagttccttgccaccttacggcgtggccagccacaaaattccttaaac(VecSeqB1/
SEQ ID NO:5所示序列为:
agaaggagcgagcacagaaagaagtcttgaacttttccgggcatataactatactccccgcatagctgaattgttggctatacggtttaagtgggccccggtaatcttttcgtactcgccaaagttgaagaagattatcggggtttttgcttttctggctcctgtaaatccacatcagaac(VecSeqB1/
SEQ ID NO:6所示序列为:
agaaggagcgagcacagaaagaagtcttgaacttttccgggcatataactatactccccgcatagctgaattgttggctatacggtttaagtgggccccggtaatcttttcgtactcgccaaagttgaagaagattatcggggtttttgctttt(VecSeqB1/
SEQ ID NO.7所示序列为:
cttttccgggcatataactatactccccgcatagctgaattgttggctatacggtttaagtgggccccggtaatcttttcgtactcgccaaagttgaagaagattatcggggtttttgctttt(VecSeqB1/
一些实施方案中,所述核酸片段3还可选自SEQ ID NO:8所示的序列:
Gtagaattggtaaagagagtcgtgtaaaatatcgagttcgcacatcttgttgtctgattattgatttttggcgaaaccatttgatcatatgacaagatgtgtatctaccttaacttaatgattttgataaaaatcatta(VecSeqB2/
一些实施方案中,本发明所述核酸片段3的序列与SEQ ID NO:3~8任一项所示的序列或其互补序列的同源性具体可为50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、98%、99%、100%等。
一些实施方案中,所述Ori复制起始位点选自ColE1、pBR322、pMB1、R6K、pUC、F1、p15A、2μori或oriV。
本发明提供的miniVec Plasmid还包括目的基因。具体的,所述miniVecPlasmid包括顺序连接的启动子、目的基因、Ori复制起始位点和转录小RNA的核酸片段3.
本发明中,所述质粒中的启动子和毒性基因表达盒中的启动子可以是本领域常用的病毒、原核生物和真核生物启动子或合成型启动子,如CMV,EF1A,EFS,CAG,CBh,SFFV,MSCV,SV40,mPGK,hPGK,UBC,RSV,Nanog,Nes,Tubala,Camk2a,SYN1,Hb9,Th,NSE,GFAP,Ibal,ProA1,hRK,hRHO,hBEST1,Prnp,Cnp,K14,BK5,mTyr,cTnT,aMHC,Myog,ACTA1,MHCK7,SM22a,EnSM22a,Runx2OC,Collal,Col2al,aP2,Adipoq,Tiel,Cd144,CD68,CD1b,Afp,Alb,TBG,MMTV,Wap,HIP,Pdxl,Ins2,Hcn4,NPHS2,SPB,CD144,TERT,TRE,TRE3G,GAL1,MET17,CUP1,AOX1,sCMV,bactin2,Ubi,cmlc2,zK5,503unc,HSP70,5x UAS,CaMV35S,Nos,ZmUbi,TEF1,GPD,ADHl,GAP,actin5C,Polyubiquitin,a 1-tubulin,Rh2,Mtn,U6,U3,H1,U6-26,TK,RSV,MC1,GAL1,PH,p5,p10,p40,p41,araBAD,cspA,Hsp68,pL,pR,EM7,T7,SP6,AmpR启动子等,包括但不仅限于此。
一些实施方案中,本发明所述的miniVec质粒中,目的基因的3’端还可以添加polyA序列,所述的miniVec质粒,包括顺序连接的启动子、目的基因、polyA序列、Ori复制起始位点和编码小RNA抑制因子的核酸片段。
一些实施方案中,本发明提供的无抗性质粒生产系统还包括宿主,即所述生产系统包括宿主细胞表达盒、质粒和宿主,其中,所述宿主为宿主菌或宿主细胞,所述宿主菌、宿主细胞来源于大肠杆菌、农杆菌、柄杆菌、芽孢杆菌或酵母菌,本领域技术人员可以根据实际情况进行选择适宜的宿主类型,本发明没有特殊限制。在本发明的具体实施例中,所述宿主为大肠杆菌。将本发明所述宿主细胞表达盒整合到所述宿主菌或宿主细胞的基因组上,获得整合有本发明宿主细胞表达盒的菌株(即miniVec stable)。基于此,本发明提供的无抗性生产质粒包括miniVec stable菌株和miniVec Plasmid。
本发明还提供了所述质粒生产系统在生产质粒中的应用,或在制备细胞基因治疗的产品中的应用。
本发明还提供了改造的大肠杆菌菌株(简称miniVec stable),其基因组上整合所述的宿主细胞表达盒。
其中,所述大肠杆菌为本领域常用的菌株,包括DH5α、TOP10、NEB stable、BL21、EPI300、DH10B、JM109、SURE、Stbl3、XL10及上述菌株的变种。所述整合位点为大肠杆菌基因组的安全位点,本领域常见的即可。
以阿拉伯糖操纵子为例,阐述本发明提供的无抗性质粒生产系统对质粒进行筛选的原理:miniVec stable菌株在不添加阿拉伯糖的情况下,araC基因会抑制araBAD启动子的活性,ccdA抗毒性基因无法正常表达,ccdB毒性基因正常表达,菌株死亡;在添加了阿拉伯糖的作用下,抗毒性基因ccdA能正常表达,从
当miniVec stable菌株转入有所述miniVec质粒时,所述所述宿主细胞表达盒中的VecSeqA与miniVec质粒中的VecSeqB通过碱基互补结合,二者结合能够形成复合物,造成的位阻效应能够有效地抑制毒性蛋白(如ccdB蛋白)翻译,从而使菌株存活。具体的,实验表明,VecSeqA与VecSeqB结合产生的位阻效应能够有效地控制毒性转录本中毒性基因的表达。
当miniVec stable菌株不含miniVec Plasmid时,由于培养基中缺乏阿拉伯糖,无法激活ccdA蛋白表达,进而无法抑制毒性蛋白(如ccdB蛋白)的毒性,所以不含miniVecPlasmid的菌株会在培养过程中致死,无法继续分裂。
本发明还提供了一种生产质粒的方法,将本发明所述质粒生产系统中的质粒转入整合有所述宿主细胞表达盒的宿主中。一些具体实施例中,所述转入的方式为化转或电转,具体步骤不作限定,按照本领域常规步骤操作即可。
本发明将毒性转录本/抗毒性转录本、操纵子相关元件和小RNA组合设计,构建了一种新型无抗性质粒生产系统,包括宿主细胞表达盒和质粒,通过miniVec Plasmid的VecSeqB序列与宿主细胞表达盒中VecSeqA序列的结合,控制改造菌株中毒性基因的表达,不需要使用抗生素和其他辅助抑制剂,该无抗性骨架可以和多种类型的质粒复制起始位点(Ori)组合,形成一套新型的无抗性质粒生产系统。与现有技术相比,本发明具有如下优势:
1、整个质粒生产过程不需要添加抗生素或其他辅助抑制剂,解决了抗生素和抑制剂对质粒在基因治疗中的危害,降低了质粒制备和纯化成本。
2、根据不同的Ori长度和复制特点,可将原核骨架序列大大缩短,质粒拷贝数可达常规质粒产量的4-5倍,提高应用安全性的同时大大降低了生产成本。
3、本发明提供的质粒骨架只包含自我复制所需的Ori,以及小RNA抑制因子(VecSeqB),其余序列为目的基因表达。传统质粒原核骨架区域在2000-2500bp之间,通常为miniVec Plasmid原核骨架区域的4-5倍,miniVec Plasmid原核骨架区域在质粒中的占比大大减少,解决外源基因表达盒外的序列在质粒中占比过大,产量无法提高等问题。
附图说明
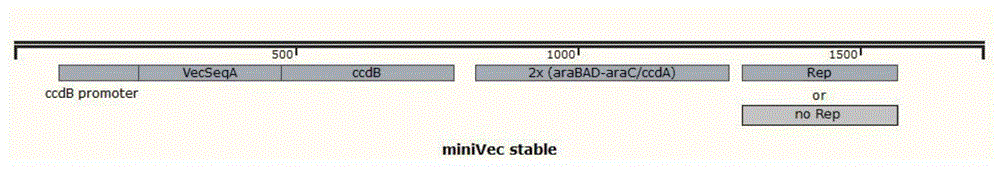
图1示miniVec stable菌株功能元件示例图;
图2示miniVec Plasmid的图谱;
图3示VecSeqA/VecSeqB与araBAD-ccdB/cddA的协同作用图;
图4示Intermediate Vector1图谱;
图5示IntermediateVector2图谱;
图6示pHelperVector1图谱;
图7示pHelperVector2图谱;
图8示IntermediateVector3图谱。
具体实施方式
本发明提供了一种无抗性质粒生产系统及其应用。本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明。本发明的方法及应用已经通过较佳实施例进行了描述,相关人员明显能在不脱离本发明内容、精神和范围内对本文的方法和应用进行改动或适当变更与组合,来实现和应用本发明技术。
本发明构建了一种新型无抗性质粒生产系统及其应用,该系统将毒性转录本/抗毒性转录本、操纵子相关元件和小RNA组合设计,构建了一种新型无抗性质粒生产系统,该系统包括宿主细胞表达盒和质粒。通过质粒的VecSeqB序列控制整合有宿主表达盒的菌株中毒性基因的表达,不需要使用抗生素和其他辅助抑制剂,该无抗性骨架可以和多种类型的质粒复制起始位点(Ori)组合,形成一套新型的无抗性质粒生产系统。进一步地,根据不同的Ori长度和复制特点,可将原核骨架序列大大缩短,质粒拷贝数可达常规质粒产量的4-5倍,提高应用安全性的同时大大降低了生产成本。
具体地,本发明转录毒性转录本的核酸片段1包括UTR序列(标记为VecSeqA)和毒性基因ccdB,转录抗毒性转录本的核酸片段2为抗毒性基因ccdA,质粒中转录小RNA的核酸片段3标记为VecSeqB,以此为例对本发明无抗性质粒生产系统进行如下详细说明:
(一)miniVec stable菌株
(1)利用ccdB/ccdA系统改造大肠杆菌基因组,即在大肠杆菌菌株基因组安全位点上插入一个ccdB毒性基因表达盒和2个串联的araBAD-araC/ccdA抗毒性基因表达盒。在不添加阿拉伯糖的情况下,araC基因会抑制araBAD启动子的活性,ccdA抗毒性基因无法正常表达,ccdB毒性基因正常表达,菌株死亡;在添加了阿拉伯糖的作用下,抗毒性基因ccdA能正常表达,从
(2)在ccdB起始密码子之前插入一段5’UTR序列(简称VecSeqA),该序列可被miniVec上的小RNA抑制因子结合,从而使得在不添加阿拉伯糖的情况下,只要该菌株含有足够多拷贝的miniVec质粒,提供足够拷贝的小RNA抑制因子来抑制ccdB毒性基因的表达,该菌株就可存活,进一步地可从存活的菌株中提取到高拷贝的质粒。(3)可选地,根据复制起始位点Ori的类型,可在大肠杆菌菌株的基因组上引入一个Rep蛋白,如R6K质粒复制必需蛋白R6KRep,适用于R6K等需要辅助蛋白进行条件性复制的质粒制备。菌株功能元件(即宿主细胞表达盒)示例如图1。
(二)miniVec Plasmid无抗性质粒
只含有质粒自身复制所需的Ori和转录一个小RNA抑制因子的核酸片段3(命名为VecSeqB),其余序列为目的基因表达盒(如图2)。传统质粒原核骨架区域在2000-2500bp之间,而根据不同的Ori选择,miniVec Plasmid原核骨架区域在质粒中的占比可大大减少,通常可减少4-5倍的序列长度。
VecSeqB与VecSeqA/ccdB、araBAD-araC/ccdA的协同作用如图3。当miniVecstable菌株含有miniVec Plasmid时,VecSeqA与VecSeqB结合,形成复合物,造成位阻效应抑制ccdB蛋白翻译,使细菌得以存活;当miniVec stable菌株不含miniVec Plasmid时,由于培养基中缺乏阿拉伯糖,无法激活ccdA蛋白表达,进而无法抑制ccdB蛋白毒性,所以不含miniVec Plasmid的细菌会在培养过程中致死,无法继续分裂。整个质粒生产过程不需要添加抗生素或其他辅助抑制剂,解决了抗生素和抑制剂对质粒在基因治疗中的危害,同时还可以降低质粒制备和纯化成本。
本发明采用的试材皆为普通市售品,皆可于市场购得。
下面结合实施例,进一步阐述本发明:
实施例1
1.miniVec stable菌株改造:
miniVec stable菌株1:在DH5α菌株中插入一个VecSeqA1/ccdB蛋白表达盒(即毒性基因表达盒)和1个araC/ccdA蛋白表达盒(抗毒性基因表达盒),以及一个R6KRep蛋白表达盒。
miniVec stable菌株2:在DH5α菌株中插入一个VecSeqA1/ccdB蛋白表达盒和2个串联的araC/ccdA蛋白表达盒,以及一个R6KRep蛋白表达盒。
1.1.中间载体(Intermediate Vector,该中间载体含有与细菌基因组重组的同源臂HA)构建:
Intermediate Vector1:表达VecSeqA1/ccdB蛋白(SEQ ID NO:1)、1个araC/ccdA蛋白,以及R6KRep蛋白,如图4;
Intermediate Vector2:表达VecSeqA1/ccdB蛋白(SEQ ID NO:1)、2个串联的araC/ccdA蛋白,以及R6KRep蛋白,如图5。
1.2.温敏型辅助质粒(pHelperVector)构建:
pHelperVector1:一个鼠李糖诱导表达pRed/ET同源重组酶的30℃温敏型辅助质粒,该质粒为Tet抗性,如图6。
pHelperVector2:一个阿拉伯糖诱导表达Flp/Frt位点重组酶的30℃温敏型辅助质粒,该质粒为Tet抗性,如图7。
1.3.用AarI酶切IntermediateVector1和Intermediate Vector2,回收重组片段如下:
重组片段1:DH5αHA-VecSeqA1/ccdB-araC/ccdA-Frt-Chl-Frt-R6KRep-DH5αHA,7195bp;
重组片段2:DH5αHA-VecSeqA1/ccdB-2(araC/ccdA)-Frt-Chl-Frt-R6KRep-DH5αHA,9033bp;
1.4.将1μg pHelpervector1电转DH5α菌株,涂布Tet平板,30℃过夜培养。隔天挑单克隆,菌落PCR鉴定pHelperVector是否进入DH5α菌株,阳性克隆保菌,称为:Intermediate Strain,作为下一步实验的菌株。
1.5.制备Intermediate Strain电转感受态:
将1mLIntermediate Strain菌液接至100mLTetLB培养基中,30℃培养至OD600为0.2-0.3,加入2mL 10%鼠李糖,37℃培养45min,诱导pHelperVecto1表达重组酶,同时去除pHelper vector1,按常规步骤制备获得Intermediate Strain电转感受态。
1.6.将1.3回收的1μg重组片段1和重组片段2分别电转Intermediate Strain感受态,涂Chl+Tet+0.37%阿拉伯糖平板,37℃过夜培养。此时重组片段1和重组片段2上的DH5α基因组同源臂在重组酶的作用下与DH5α基因组发生重组,VecSeqA1/ccdB-araC/ccdA-Frt-Chl-Frt-R6K Rep或VecSeqA1/ccdB-2(araC/ccdA)-Frt-Chl-Frt-R6KRep插入DH5α基因组中,分别获得初始菌株:miniVec stable菌株1和miniVec stable菌株2。
1.7.分别菌落PCR鉴定miniVec stable菌株1和miniVec stable菌株2是否插入重组目的片段,将菌落PCR的阳性克隆送测,确定重组目的片段完整性,测序结果如下:
miniVec stable菌株1:VecSeqA1/ccdB-araC/ccdA-Frt-Chl-Frt-R6K Rep目的片段中ccdB序列有突变,使得ccdB蛋白无毒性。即1个araC/ccdA表达的ccdA蛋白不足以抑制ccdB蛋白毒性,以至于菌株自身发生突变而获得生存能力。
miniVec stable菌株2:VecSeqA1/ccdB-2(araC/ccdA)-Frt-Chl-Frt-R6K Rep目的片段中ccdB序列完整无突变或缺失,ccdB蛋白保持毒性功能;说明2个araC/ccdA表达的ccdA蛋白足以抑制ccdB蛋白毒性,使得菌株正常生长。此时该菌株称为:miniVec stable-Chl-A1。
1.8.按常规步骤制备获得miniVec stable-Chl-A1电转感受态。
1.9.将1μg含有表达Flp重组酶的pHelper Vector2电转miniVec stable-Chl-A1感受态,涂0.37%阿拉伯糖平板,30℃过夜培养。
1.10.筛选Frt重组后Chl抗性基因删除的菌株,将阳性克隆送测,验证片段VecSeqA1/ccdB-2(araC/ccdA)-Frt-R6KRep完整性,37℃培养去除pHelper vector2,此菌株为miniVec stable-A1菌株。
2.miniVec Plasmid构建
根据Ori和VecSeqB的不同,用Gibson同源重组反应构建表1中不同的miniVecPlasmid:
表1不同miniVec Plasmid汇总表
其中,miniVec Plasmid 2质粒中,VecSeqB1序列的长度为229bp,其序列如SEQ IDNO:4所示,即SEQ ID NO:3第30~258位所示的核苷酸序列。
miniVec Plasmid 3质粒中,VecSeqB1序列的长度为181bp,其序列如SEQ ID NO:5所示,即SEQ ID NO:3第30~210位所示的核苷酸序列。
miniVec Plasmid4质粒中,VecSeqB1序列的长度为154bp,其序列如SEQ ID NO:6所示,即SEQ ID NO:3第30~183位所示的核苷酸序列。
miniVec Plasmid 5质粒中,VecSeqB1序列的长度为123bp,其序列如SEQ ID NO:7所示,即SEQ ID NO:3第61~183位所示的核苷酸序列。
3.VecSeqA1/VecSeqB1与miniVec stable-A1菌株协同作用效果测试
将100ng miniVec Plasmid 1-6分别与miniVec stable-A1菌株电转,涂布无抗常规平板,37℃过夜培养。结果见表2。从表2中可见,Group 1中miniVec菌株不含miniVecPlasmid,无抗平板克隆数比加阿拉伯糖的平板克隆数降低2.99E+05倍,说明在阿拉伯糖不存在的情况下,araC可以抑制ccdA表达,ccdB蛋白使菌株致死,克隆数明显减少。Group 2、3、4和Group7中,miniVec Plasmid转入miniVec菌株,无抗平板克隆数比Group 1的无抗平板增加2.07E+03-1.27E+04倍,说明VecSeqB1(SEQ ID NO:3~5)与VecSeqA1(SEQ ID NO:1)的结合,可以高效抑制ccdB蛋白表达。Group 2、3、4和Group7为不同Ori的miniVecPlasmid,其筛选结果差别不大,说明miniVec菌株可适用于R6K、pUC等多种类型Ori的质粒制备。Group 5和Group 6的数据中,miniVec Plasmid4和5转入miniVec stable-A1菌株,无抗平板克隆数比Group 1的无抗平板只增加了1-5倍,即长出来的克隆几乎与Group 1的无抗平板数相当,说明不同的VecSeqB1序列与VecSeqA1具有不同的结合效率,VecSeqB1/
表2转化效果数据汇总表
3.1.ccdB基因测序验证:
将Group 2-Group 4的克隆,以及Group 1的0.37%阿拉伯糖平板和无抗平板上各挑3个克隆,送测序验证ccdB元件的完整性。测序结果汇总如表3:
表3ccdB基因序列完整性测序结果汇总表
从表4可见,Group 1的无抗平板克隆的ccdB序列出现不同程度的缺失或突变,说明在阿拉伯糖不存在的情况下,ccdA蛋白无法表达,菌株想要存活,只能依靠自身突变或缺失ccdB元件序列,丧失ccdB的毒性。阿拉伯糖平板克隆的测序结果表明,ccdB序列都是正常的,所以阿拉伯糖可以激活ccdA蛋白表达,使菌株存活。Group 2-Group 4中,miniVecPlasmid的加入,即使在阿拉伯糖不存在的情况下,ccdB序列也没有发现突变或缺失,说明VecSeqB1与VecSeqA1的结合,可以显著有效抑制ccdB蛋白的表达。
3.2.miniVec Plasmid质粒提取,对比不同miniVec Plasmid质粒产量:
从Group 2-Group 7无抗平板分别挑取3个克隆,接菌5mLLB培养基,37℃过夜培养。
产量见表4,并与传统菌株DH5α+传统抗性质pAAV[Exp]-CMV>EGFP(https://www.vectorbuilder.cn/vector/VB191212-1252ttc.html)作为对照。
表4miniVec Plasmid产量汇总表
/>
从表3可见,Group 5和Group 6由于ccdB自身突变使得菌株存活,无法起到高效的筛选效果,从而进入到相应菌株的质粒拷贝数明显下降。相反,与传统抗性质粒产量对比,Group 2-Group 4和Group 7中miniVec质粒产量可提高2-3倍左右,且不同Ori的miniVecPlasmid(miniVec Plasmid 1和miniVec Plasmid 6),其质粒产量差别不大,说明miniVec菌株可适用于R6K、pUC质粒等多种类型质粒制备。表达相同的目的基因的情况下,传统质粒序列总长度比miniVec Plasmid多2倍左右,即相同重量的质粒,miniVec Plasmid的拷贝数是传统质粒的2倍,意味着采用本发明菌株和质粒生产的目的基因的质粒拷贝数可提高4-6倍。
实施例2
将毒性基因的5’UTR换成其他序列VecSeqA2(SEQ ID NO:2第1~64位所示的核酸序列),同时将miniVec载体上的序列更换为VecSeqB2(SEQ ID NO:8),进一步测试效果。
1.miniVec stable菌株改造:
miniVec stable菌株3:在DH5α菌株中插入一个VecSeqA2/ccdB蛋白表达盒和2个araC/ccdA蛋白表达盒,以及一个R6KRep蛋白表达盒。
1.1.中间载体(Intermediate Vector,该中间载体含有与细菌基因组重组的同源臂HA)构建:
Intermediate Vector3:表达VecSeqA2/ccdB蛋白(SEQ ID NO:2)、2个araC/ccdA蛋白,以及R6KRep蛋白,如图8;
1.2.温敏型辅助质粒(pHelperVector)构建:
与实施例1的1.2相同。
1.3.用AarI酶切IntermediateVector3,回收重组片段如下:
重组片段3:DH5αHA-VecSeqA2/ccdB-araC/ccdA-Frt-Chl-Frt-R6KRep-DH5αHA,8704bp,如图8;
1.4.将1μg pHelpervector1电转DH5α菌株,涂布Tet平板,30℃过夜培养。隔天挑单克隆,菌落PCR鉴定pHelperVector是否进入DH5α菌株,阳性克隆保菌,称为:Intermediate Strain,作为下一步实验的菌株。
1.5.制备Intermediate Strain电转感受态:
将1mLIntermediate Strain菌液接至100mLTetLB培养基中,30℃培养至OD600为0.2-0.3,加入2mL 10%鼠李糖,37℃培养45min,诱导pHelperVecto1表达重组酶,同时去除pHelper vector1,按常规步骤制备获得Intermediate Strain电转感受态。
1.6.将1.3回收的1μg重组片段3电转Intermediate Strain感受态,涂Chl+Tet+0.37%阿拉伯糖平板,37℃过夜培养。此时重组片段3上的DH5α基因组同源臂在重组酶的作用下与DH5α基因组发生重组,VecSeqA2/ccdB-araC/ccdA-Frt-Chl-Frt-R6K Rep插入DH5α基因组中,分别获得初始菌株:miniVec stable菌株3。
1.7.分别菌落PCR鉴定miniVec stable菌株3是否插入重组目的片段,将菌落PCR的阳性克隆送测,确定重组目的片段完整性,测序结果如下:
miniVec stable菌株3:VecSeqA2/ccdB-2(araC/ccdA)-Frt-Chl-Frt-R6K Rep目的片段中ccdB序列完整无突变或缺失,ccdB蛋白保持毒性功能;再次说明2个araC/ccdA表达的ccdA蛋白足以抑制ccdB蛋白毒性,使得菌株正常生长。此时该菌株称为:miniVecstable-Chl-A2。
1.8.按常规步骤制备获得miniVec stable-Chl-A2电转感受态。
1.9.将1μg含有表达Flp重组酶的pHelper Vector2电转miniVec stable-Chl-A2感受态,涂0.37%阿拉伯糖平板,30℃过夜培养。
1.10.筛选Frt重组后Chl抗性基因删除的菌株,将阳性克隆送测,验证片段VecSeqA2/ccdB-2(araC/ccdA)-Frt-R6KRep完整性,37℃培养去除pHelper vector2,此菌株为miniVec stable-A2菌株。
2.miniVec Plasmid构建
用Gibson同源重组反应构建表5的miniVec Plasmid 7:
表5miniVec Plasmid 7信息表
3.VecSeqA2/VecSeqB2与miniVec stable-A2菌株协同作用效果测试
将100ng miniVec Plasmid 7分别与miniVec stable-A2菌株电转,涂布无抗常规平板,37℃过夜培养。结果见表6。从表6中可见,Group 8中miniVec菌株不含miniVecPlasmid,无抗平板克隆数比加阿拉伯糖的平板克隆数降低3.87E+05倍,再次说明在阿拉伯糖不存在的情况下,araC可以抑制ccdA表达,ccdB蛋白使菌株致死,克隆数明显减少。Group9中,miniVec Plasmid7转入miniVec stable-A2菌株,无抗平板克隆数比Group 8的无抗平板增加1.48E+03倍,说明VecSeqB2(SEQ ID NO:8)与VecSeqA2(SEQ ID NO:2第1~64位所示的核酸序列)的部分互补结合,可以高效抑制ccdB蛋白表达;miniVec-A2菌株和miniVec-A1菌株的VecSeqA序列完全不同,但只要miniVec载体上的VecSeqB序列能产生与之互补的序列,对ccdB的抑制作用仍然有效,以此说明在ccdB起始密码子之前可插入不同序列版本的5’UTR,并设计出与之互补匹配的VecSeqB便能达到筛选效果。
表6miniVec Plasmid 7转化效果数据汇总表
从Group 9无抗平板分别挑取3个克隆,接菌5mLLB培养基,37℃过夜培养。产量见表7。
表7miniVec Plasmid7产量汇总表
从表7产量可见,VecSeqB2与VecSeqA2的结合,可以抑制ccdB蛋白表达,实现质粒的筛选;但是质粒产量不稳定,不同克隆产量不同。
结果表明,只要miniVec载体的RNA序列与毒性转录本存在部分或完全互补,即可实现质粒的筛选。
以上仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 一种无抗性标记基因枯草表达重组质粒及其构建方法与应用
- 一种酵母中重复序列介导的基因无抗性整合系统及应用
