一种芒草耐盐基因MsMYB112及其应用
文献发布时间:2024-04-18 20:01:30
技术领域
本发明属于基因工程技术领域,具体公开了一种芒草耐盐基因及其应用。
背景技术
当前,土壤盐碱化已经成为一个全球性的问题。我国现有盐碱地面积约9913万hm
芒草(Miscanthus)是禾本科的多年生C4类草本植物,具有生物质产量高、纤维素含量丰富,种植成本低、适应能力强等特点,近年来备受人们的关注,被认为是一种开发潜力巨大的理想能源植物。芒草在中国种类丰富,分布广,芒草根系发达,有助于保持水土和改良土壤,对水肥依赖小,非常适合在干旱、盐碱等边际土地种植,从而实现不与粮争地。在提供生物质能源的同时,也具有良好的生态效应。选育耐盐碱芒草品种,增大盐碱地芒草种植面积,是解决我国“粮油争地”矛盾,保障食用油脂安全的一个有效途径。耐盐基因的挖掘是芒草抗性育种的基础。因此,耐盐基因的功能鉴定及分子机制研究,对借助转基因技术或分子辅助育种选育耐盐碱芒草品种,从而提高盐碱地利用效率具有重要意义。
MYB是植物转录因子中最大的家族之一,大多数植物的MYB以在其N端含有一段约51-52个氨基组成的MYB结构域为共同特征,MYB蛋白的分类主要是根据这个高度保守的DNA结合结构域,这个结构域通常是由至多4个氨基酸残基序列的重复组成,每一个都形成3个α-螺旋,每一个重复的第二个和第三个螺旋形成一个带有3个有规律的间隔色氨酸残疾(或疏水的)的螺旋-转角-螺旋(HTH)结构,形成一个3D(HTH)疏水核心结构,对维持HTH的构型有极为重要的意义。MYB转录因子的生物学功能很广泛,已经在拟南芥,水稻等中有很多报道,主要集中于次植物初生和次生代谢的调控,控制细胞的成长和分化,调控植物体对生物和非生物胁迫反应,参与植物生长过程的信号转导等。目前,芒草中已经明确具有耐盐功能的基因尚少。亟需挖掘鉴定芒草耐盐基因,为芒草分子辅助育种提供基因资源和理论基础。
发明内容
为了克服现有技术的缺陷,利用转基因技术,将MsMYB112基因转到拟南芥中进行过表达,该基因的转入显著降低了转基因拟南芥的耐盐性。同时,利用VIGS技术,将芒草中的MsMYB112基因进行沉默,沉默MsMYB112基因的芒草,其耐盐性显著增加。该发明提供了一种芒草耐盐基因及其应用。
本发明提供了一种芒草耐盐基因,所述芒草耐盐基因的核苷酸序列为SEQ IDNo.1,所述芒草耐盐基因的氨基酸序列为SEQ ID No.2。
进一步的,所述耐盐基因的开放阅读框为1056bp,共编码351个氨基酸。
本发明还公开了一种芒草耐盐基因的应用,以芒草幼嫩叶片的提取RNA,并反转录为cDNA,以此cDNA为模板,利用引物MsMYB112-F和MsMYB112-R进行PCR扩增,构建MsMYB112的过表达载体,采用农杆菌介导的花序浸染法转化拟南芥,分析并鉴定转基因拟南芥的耐盐性。
进一步的,所述引物MsMYB112-F和MsMYB112-R的序列分别为:
MsMYB112-F:5’-
MsMYB112-R:5’-
进一步的,所述PCR扩增体系为ddH2O、含Mg2+的缓冲液、dNTP、MsMYB112-F、MsMYB112-R、高保真PCR酶和芒草cDNA模板。
进一步的,所述PCR扩增引物的反应条件为:95℃预变性30s;95℃变性10s,55℃退火10s,75℃ 40s,36个循环;75℃后延伸10min。
进一步的,所述芒草耐盐基因在转基因拟南芥中的表达量上升。
进一步的,所述芒草耐盐基因可应用于降低转基因拟南芥的耐盐性。
本发明还公开了一种芒草耐盐基因的应用,其步骤如下:以芒草幼嫩叶片为材料提取RNA,并反转录为cDNA,以此cDNA为模板,利用引物MsMYB112-vigs-F和MsMYB112-vigs-R进行PCR扩增,构建MsMYB112的病毒介导的基因沉默(VIGS)载体,用于芒草的侵染,分析并鉴定芒草的耐盐性。
进一步的,所述引物MsMYB112-VIGS-F和MsMYB112-R的序列分别为:
MsMYB112-VIGS-F:
MsMYB112-VIGS-R:
进一步的,所述PCR扩增体系为ddH2O、含Mg2+的缓冲液、dNTP、MsMYB112-VIGS-F、MsMYB112-VIGS-R、高保真PCR酶和芒草cDNA模板。
进一步的,所述PCR扩增引物的反应条件为:95℃预变性30s;95℃变性10s,55℃退火10s,72℃ 30s,36个循环;72℃后延伸5min。
进一步的,所述芒草耐盐基因
进一步的,所述芒草耐盐基因可应用于提高转基因芒草的耐盐性。
与现有技术相比,本发明的优点和技术效果是:利用转基因技术,将芒草基因
附图说明
图1 MsMYB12-OX载体示意图
图2 MYB112-OX转基因拟南芥与野生型的生长状况对比图
图3 MYB112-OX转基因拟南芥与野生型绿叶率统计
图4 pTRV2-MsMYB112芒草基因沉默植株表达量鉴定
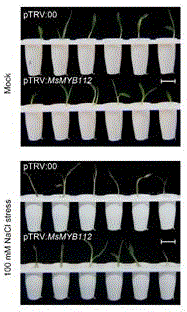
图5 MsMYB112基因沉默芒草与对照在NaCl处理下的表型
图6 盐胁迫下MsMYB112基因沉默芒草与对照的存活率
具体实施方式
下面结合实施例对本发明的技术方案做进一步的说明,但并不局限于此,凡是对本发明技术方案进行修改或者等同替换,而不脱离本发明技术方案的精神和范围,均应涵盖在本发明的保护范围中。
实施例1:芒草
(1)芒草总RNA提取及cDNA合成
为了得到
根据phytozome公布的中国芒序列,使用NCBI Primer-BLAST在线网站设计正向和反向的特异性引物,引物名称:MsMYB112-F和MsMYB112-R,引物序列如下:
MsMYB112-F:5’-
MsMYB112-R:5’-
以芒草cDNA为模板,使用特异引物MsMYB112-F和MsMYB112-R进行扩增,通过PCR的方法分离克隆MsMYB112基因的编码区即CDS序列(序列见SEQ ID NO:1),其蛋白质序列如SEQ ID NO:2所示。
在优选地实施方式中,所述芒草为南荻或者中国芒 。
实施例2:植物过表达载体的构建
以质粒pCambia1301作为载体,对该载体采用BamH I进行单酶切,随后利用同源重组酶对PCR扩增产物与BamH I酶切产物进行连接;10μL连接体系如下:2×同源重组酶混合物:5μl,BamH I单酶切后的载体:1μl;PCR扩增产物:4μl;50℃反应15分钟后,降至4℃或立即置于冰上冷却。在冰上解冻DH5α感受态细胞,将上述10μl重组产物加入到100μl感受态细胞中,轻弹管壁混匀(请勿振荡混匀),冰上静置30min。42℃水浴热激45sec后,立即置于冰上冷却2-3min。
加入900μl不添加抗生素的LB培养基,37℃摇菌1h(转速200-250rpm)。
将含有卡那霉素抗性的LB固体培养基平板在37℃培养箱中预热。5,000rpm离心5min,弃掉900μl上清。用剩余培养基将菌体重悬,用无菌涂布棒在含有50mg/L卡那霉素抗性的平板上轻轻涂匀。37℃培养箱中倒置培养12-16h。
将菌落PCR鉴定为阳性的菌落,接种至含有卡那霉素的液体LB培养基中培养过夜,提取质粒进行测序。所得的表达载体命名为
实施例3
取1μg实施例2中得到的
将鉴定为阳性的农杆菌单菌落接种于含50mg/L卡那霉素和25mg/L的利福平的YEB抗性液体培养基中,在28℃、220rpm下培养20小时,取1mL菌液接种于含50mg/L卡那霉素和25mg/L的利福平的300mL YEB抗性液体培养基中,在28℃、200rpm下培养至OD=0.7。培养结束后,5000rpm离心15分钟收集菌体,再将沉淀溶于300mL含有5%蔗糖的MS侵染液中,慢慢摇匀,将已经去果荚的野生型拟南芥花倒置入侵染液进行侵染,种子经过50mg/L的潮霉素筛选,得到转化MsMYB112基因的拟南芥。获取T2代
实施例4:转
得到的阳性拟南芥种子,在分别含有100mM和150mM NaCl的1/2 MS固体培养基上进行耐盐情况的表型观察。图2为过表达
实施例5:MsMYB112的基因沉默载体的构建
将TRV2载体用KpnI和NcoI双酶切,并回收酶切产物;随后利用同源重组酶对PCR扩增获得的产物片段与KpnI和NcoI双酶切后的载体片段进行连接;10μL连接体系设计如下:2×同源重组酶混合液:5μl,KpnI和NcoI双酶切后的载体片段:1μl;PCR扩增产物片段:4μl;50℃反应15分钟,降至4℃或立即置于冰上冷却。在冰上解冻DH5α感受态细胞,将上述10μl重组产物加入到100μl感受态细胞中,轻弹管壁混匀(请勿振荡混匀),冰上静置30min,42℃水浴热激45sec后,立即置于冰上冷却2-3min。加入900μl不添加抗生素的LB培养基,37℃摇菌1h(转速200-250rpm)。5,000rpm离心5min,弃掉900μl上清。用剩余培养基将菌体重悬,用无菌涂布棒在含有50mg/L卡那霉素抗性的平板上轻轻涂匀。37℃培养箱中倒置培养12-16h。
将菌落PCR鉴定为阳性的菌落,接种至含有卡那霉素的液体LB培养基中培养过夜,提取质粒进行测序。所得的载体命名为pTRV2-MsMYB112。
实施例6:病毒介导的MsMYB112基因沉默
取1μg实施例5中得到的pTRV2-MsMYB112重组质粒加入到100μ GV3101农杆菌感受态中,轻轻混匀;电击转化后,加入600μL YEB液体培养基(不含抗生素),28℃ 180rpm复苏4h;5000 rpm离心5min后,弃掉部分上清,剩余150 μL重悬菌体,涂于YEB平板(含50 mg/LKan);28℃倒置培养2-3d。
将鉴定为阳性的农杆菌单菌落接种于含50mg/L卡那霉素和25mg/L的利福平的YEB抗性液体培养基中,在28度、220rpm下培养20小时,取1mL菌液接种于含50mg/L卡那霉素和25mg/L的利福平的300mL LB抗性培养液体中,在28度、200rpm下培养达到OD=0.7。同时,将pTRV1接种于含50mg/L卡那霉素和25mg/L的利福平的300mL LB抗性培养液体中进行培养达到OD=0.7。然后将TRV1和pTRV2-MsMYB112菌液照1:1的比例进行等体积混合,在上述混合液中加入100μM乙酰丁香酮,3.3mM半胱氨酸,5mg/L吐温20,用于后续的侵染。
选取饱满的的芒草种子,播种到有2层湿润滤纸的培养皿中,然后放置于30℃的培养箱中进行萌发至芽长度0.5-1.0mm,进行下一步的实验。
将发芽的芒草种子浸入到混合液中,使用真空设备(LabServ LS-VO50)进行抽真空渗透侵染,真空压力为-0.095Mpa,时间为90min,然后放入28℃,200rpm/m的摇床中共培养5小时。共培养结束后将种子放在湿润的滤纸上或者土壤中进行生长,放入18℃生长箱中进行培养。
实施例:MsMYB112基因的表达量分析
采用Trizol法提取芒草总RNA,利用Nano Drop微量分光光度计检测总RNA的质量,并保存于-80℃备用;采用TransScript®One-Step gRemoval and c DNA SynthesisSuper Mix试剂盒(北京全式金生物技术有限公司),反转录为cDNA。使用荧光定量PCR仪(Thermofisher ABI QuantStudio 1)进行实时荧光RT-PCR反应。PCR反应体系:模板cDNA 2μl,2×SYBR PCR Mix 10μl,Primer F 0.8μL,Primer R 0.8μl,加水补足至20μl。
引物如下:RT-MsMYB112F:5’-TGTTGATGAACGGCGGAGAT-3’,RT-MsMYB112R:5’-TGAGCTCCGGGTCTTGAAAC-3’
相对表达量的计算采用2-ΔΔCt法,以Actin1为内参基因,其引物如下Rt-MsActin1F: CACCTGAACCTTTCTGACCCAA
RT-MsActin1R: CTCGCCTATGTTGCCCTTGA
采用转pTRV1和pTRV2空载体作为对照,命名为pTRV:00,从图4中可以看出,经过病毒侵染的植株,MsMYB112基因表达量明显下降。
实施例8:
通过病毒介导的基因沉默,获得MsMYB112基因降低的植株,使用100mM进行处理,图5显示为基因沉默的植株与对照相比在100mM的NaCl处理下的表型,MsMYB112基因沉默后,芒草表现出较强的耐盐表型,图6统计了盐胁迫下的芒草的存活率,可以看出,MsMYB112基因沉默显著高于对照。这一结果表明,MsMYB112基因与芒草的耐性表型相关,而基于这一结果,可为芒草耐盐新品种培育奠定一定技术和理论基础。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
SEQ ID No.1
ATGGCCGCAACACAGCAGATCAGGAGCAGGAGCAGCGCCGCCGCCGCCGCCAAGGCTGCTGCTTGCTCCCGGCCGGCCGTTGCTCCCGTTGATGAGGTCGTCGACGAGGAGCACGGCGGCCACCGCCGCCAGCAGGGAGGTGGAGCGCAGGAGGAGGCCGAGAAGAAGCCGGAGCTCCGGCGTGGCCCGTGGACCGTAGACGAGGACCTCACCCTCGTCAACTACATCGCCGACAACGGCGAGGGCCGCTGGAACAACCTCGCCCGCGCCGCCGGTCTGAAGCGGACGGGCAAGAGCTGCCGCCTGCGGTGGCTCAACTACCTCCGGCCCGACGTGAAGCGCGGCAACTTCAGCGCCGACGAGCAGCTGCTCATCCTCGACCTCCACACACGCTGGGGCAACCGGTGGTCAAAGATCGCGCAGCACCTGCCGGGGAGGACGGACAACGAGATCAAGAACTACTGGAGGACCCGGGTGCAGAAGCACGCCAAGCAGCTCAACTGCGACGCCAACAGCAAGCGCTTCAAGGACGCCATGCGCTACCTCTGGATGCCACACCTCGTCGACATCGACATCGCCGCTGCTGCGGCCGACGACCACCACCTACGCCTCCTCCACCACCAGCAGCATGCTGCGGCCGCCGGCGCTGGCAACGACCTCGCTGGTGGCTACGCTGCCGCTGACGTCCAGCTGCATGCGCTGTCGTCGGGCATGGCGGCGATGACGACGACTACGTCGTCGTCCGACTCGCTCGCGTCGGAGTCGTACGAGGACGGCGGCGGCCTCTTCGCGAACGTGCGCGCCGGCGAGATGTTGATGAACGGCGGAGATTGGGCGGCGCAGGAGGCCAACCACCAGGGGCTATGGCCGTCGTCTGATCATGATCAGTCGGCCGTGCAGGTGCAGGCTACTACCGGTGGGCAGTTTCAAGACCCGGAGCTCAGTGGATGGGTGCAAGGCTTCTCCGAGAGCATTACCGACAACTTTTGGCCGGGCCTTGGAGGAAATTTGGAAGATGCAATGAGCAATTTTACGTTTTACACATCCAAAGACTGA
SEQ ID No.2
MAATQQIRSRSSAAAAAKAAACSRPAVAPVDEVVDEEHGGHRRQQGGGAQEEAEKKPELRRGPWTVDEDLTLVNYIADNGEGRWNNLARAAGLKRTGKSCRLRWLNYLRPDVKRGNFSADEQLLILDLHTRWGNRWSKIAQHLPGRTDNEIKNYWRTRVQKHAKQLNCDANSKRFKDAMRYLWMPHLVDIDIAAAAADDHHLRLLHHQQHAAAAGAGNDLAGGYAAADVQLHALSSGMAAMTTTTSSSDSLASESYEDGGGLFANVRAGEMLMNGGDWAAQEANHQGLWPSSDHDQSAVQVQATTGGQFQDPELSGWVQGFSESITDNFWPGLGGNLEDAMSNFTFYTSKD*。
- 一种透明小间距LED显示屏
- 一种LED显示屏及LED显示屏模组
- 一种防磕碰的小间距LED显示屏
- 一种灯面防磕碰的小间距LED显示屏
