一种麻醉药物电化学传感器及其制备方法
文献发布时间:2023-06-19 19:20:08
技术领域
本申请涉及药物浓度监测技术领域,特别涉及一种麻醉药物电化学传感器及其制备方法。
背景技术
治疗性药物浓度监测(Therapeuticdrugmonitoring,TDM)是一种持续监测治疗药物浓度以优化单个患者用药剂量的临床技术,大大促进了临床用药的个体化及精准化。随着全身麻醉的普及,精准化和个体化地给予适量麻醉镇静药物,避免药物过量所致的镇静过度和药物不足所致的术中知晓,是保障患者麻醉安全的重要前提。因此,实施麻醉镇静药物TDM对全身麻醉和ICU镇静都具有非常重要的意义。遗憾的是,目前绝大多数研究采用色谱法、质谱法或者光学法监测镇静药物,如丙泊酚、咪达唑仑和右美托嘧啶等的血药浓度。尽管这些方法灵敏度较高,但由于检测设备昂贵、测量耗时长、无法实时连续监测,且需要专业技术人员操作等问题,上述技术均无法转化应用于临床。
随着微电子技术和纳米器件技术的迅猛发展,具备操作简单,价格便宜,灵敏度高,可自动化等特点的电化学法已广泛地应用于化工、环保、医药、卫生等领域。在科研领域,电化学技术已被尝试用于镇静药物血药浓度监测,但是由药物及其反应产物形成的“化学污染”及患者血液中的蛋白质、细胞等物质产生的“生物污染”会严重影响电化学传感器的性能,如灵敏度、连续性、再现性和可靠性。因此,“抗污染”已成为电化学传感器TDM的关键技术问题。目前常用的抗污染措施包括电极表面修饰和电化学表面清洗。然而上述技术仍存在诸多问题,如修饰材料不具备长期、连续使用的物理和机械性能,清洗方式繁琐,改良技术复杂、以及材料成本昂贵无法量产等。
因此,构建抗污染,高性能,可转化的镇静药物TDM电化学传感器势在必行。
发明内容
本申请实施例提供一种麻醉药物电化学传感器及其制备方法,以解决相关技术中难以实现麻醉镇静药物浓度的实时监测的临床问题。
本申请提供的技术方案具体如下:
第一方面,本申请提供了一种麻醉药物电化学传感器,包括工作电极,所述工作电极包括丝网印刷电极和负载于所述丝网印刷电极上的表面修饰层;
所述表面修饰层包括亲水性碳纳米材料。
一些实施例中,所述亲水性碳纳米材料包括改性材料和碳纳米管。
一些实施例中,所述改性材料包括聚多巴胺和两性离子聚合物;
所述碳纳米管包括羧基化多壁碳纳米管。
一些实施例中,所述两性离子聚合物包括3-[N,N-二甲基-[2-(2-甲基丙-2-烯酰氧基)乙基]铵]丙烷-1-磺酸内盐。
第二方面,本申请提供了一种麻醉药物电化学传感器的制备方法,包括如下步骤:
制备亲水性碳纳米材料分散液;
将亲水性碳纳米材料分散液滴加于所述丝网印刷电极表面,干燥。
一些实施例中,“制备亲水性碳纳米材料分散液”包括如下步骤:
将羧基化多壁碳纳米管溶于乙醇中,超声分散,加入缓冲液、多巴胺和两性离子聚合物,搅拌,干燥,得到亲水性碳纳米材料;
将亲水性碳纳米材料分散于溶剂中,超声分散,即得亲水性碳纳米材料分散液。
一些实施例中,所述多巴胺与所述羧基化多壁碳纳米管的质量比为1:1。
一些实施例中,所述亲水性碳纳米材料分散液的浓度为1mg/ml–3mg/ml。
一些实施例中,所述亲水性碳纳米材料分散液的滴加量为5-7μl。
一些实施例中,所述溶剂包括去离子水和乙醇的混合物。
本申请提供的技术方案带来的有益效果包括:
本申请提供的电化学传感器,以丝网印刷电极作为工作电极的基底,丝网印刷电极易于改良修饰、可做多样性设计、材料兼容性强、成本低廉和可大规模量产,在其表面修饰亲水性碳纳米材料,一方面碳纳米材料活性表面积大、电催化性能优良、表面易修饰、抗污染性强和生物相容性强,应用于麻醉镇静药物的浓度监测,具有灵敏度高、稳定性和选择性强等优点,另一方面,亲水性碳纳米材料能够在表面形成水化层,降低分子、蛋白质等的吸附,提高抗污染性,实现对麻醉镇静药物长时间的连续监测。此外,该电化学传感器制备方法简单、体积小、造价低、操作简便,适合在医院手术室和重症监护病房使用。
附图说明
为了更清楚地说明本申请实施例中的技术方案,下面将对实施例描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本申请的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
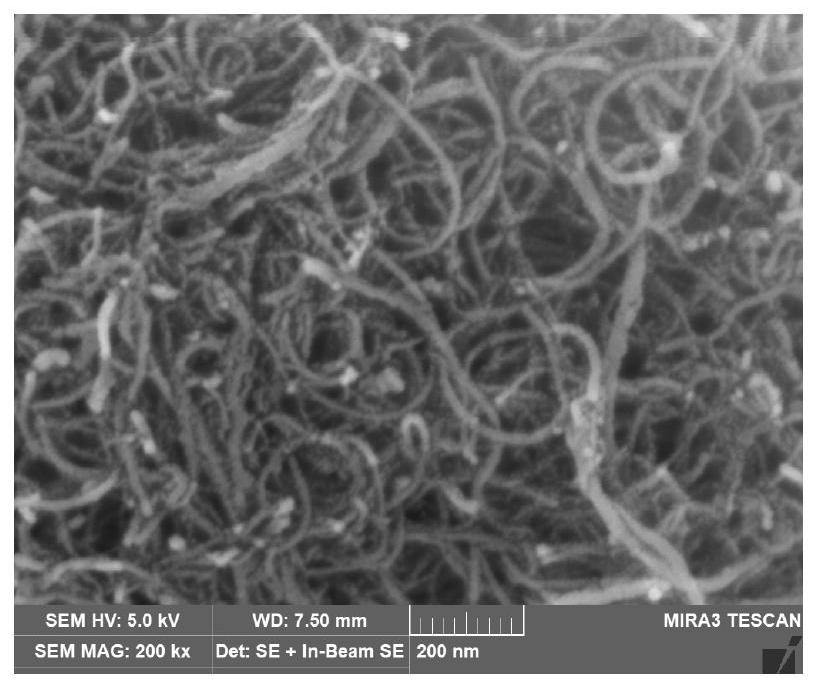
图1为本申请实施例提供的麻醉药物电化学传感器中工作电极表面的扫描电子显微镜(Scanning Electron Microscopy,SEM)图;
图2为本申请实施例2提供的循环伏安图;
图3为本申请实施例2提供的峰电流与丙泊酚浓度的线性关系图;
图4为本申请实施例3提供的氧化峰电流值关系图;
图5为本申请实施例4提供的循环伏安图;
图6为本申请实施例4提供的峰电流与丙泊酚浓度的线性关系图;
图7为本申请实施例5提供的循环伏安图,其中图(A)为电化学传感器A和B的循环伏安图,图(B)为电化学传感器C和D的循环伏安图,图(C)为电化学传感器E和F的循环伏安图;
图8为本申请实施例5提供的不同材料修饰电极的电流抑制率柱状图;
图9为本申请实施例6提供的循环伏安图;
图10为本申请实施例6提供的峰电流与丙泊酚浓度的线性关系图;
图11为本申请实施例7提供的氧化峰电流值关系图;
图12为本申请实施例8提供的氧化峰电流存留百分比柱状图;
图13为本申请实施例9提供的不同改良材料电极的氧化峰电流下降值柱状图;
图14为本申请实施例11提供的不同质量比多巴胺:羧基化碳纳米管电极的测量前后电流密度柱状图。
具体实施方式
为使本申请实施例的目的、技术方案和优点更加清楚,下面将结合本申请实施例,对本申请实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例是本申请的一部分实施例,而不是全部的实施例。基于本申请中的实施例,本领域普通技术人员在没有做出创造性劳动的前提下所获得的所有其他实施例,都属于本申请保护的范围。
第一方面,本申请实施例提供了一种麻醉药物电化学传感器,包括工作电极,所述工作电极包括丝网印刷电极和负载于所述丝网印刷电极上的表面修饰层;
所述表面修饰层包括亲水性碳纳米材料。
本申请提供的电化学传感器,以丝网印刷电极作为工作电极的基底,丝网印刷电极易于改良修饰、可做多样性设计、材料兼容性强、成本低廉和可大规模量产,在其表面修饰亲水性碳纳米材料,一方面碳纳米材料活性表面积大、电催化性能优良、表面易修饰、抗污染性强和生物相容性强,应用于麻醉镇静药物的浓度监测,具有灵敏度高、稳定性和选择性强等优点,另一方面,亲水性碳纳米材料能够在表面形成水化层,降低分子、蛋白质等的吸附,提高抗污染性,可以连续准确地在多种环境(体外环境、动物血液、患者血液)下进行麻醉镇静药物浓度监测。此外,该电化学传感器制备方法简单、体积小、造价低、操作简便,适合在医院手术室和重症监护病房使用。
具体的,所述麻醉药物电化学传感器还包括碳对电极和银参比电极。
在一些实施例中,所述亲水性碳纳米材料包括改性材料和碳纳米管。
所述改性材料用于对碳纳米材料进行改良以提高碳纳米材料的亲水性,从而提高表面修饰层抗污染性能。
在一些实施例中,所述改性材料包括聚多巴胺和两性离子聚合物;
所述碳纳米管包括羧基化多壁碳纳米管。
具体的,羧基化多壁碳纳米管(CNT-COOH)主要由呈六边形排列的碳原子构成数层到数十层的同轴圆管,管上碳原子的P电子形成大范围的离域π键,由于共轭效应显著,使其具有良好的导电性能;同时,CNT-COOH交织在一起呈多孔状的复杂结构(参见图1)不利于污染物质在其表形成完整的污染层,从而增加其抗污染作用;
聚多巴胺(PDA)是一种新型的生物涂层材料,作为一种强粘剂可以稳定地固定在各种材料上,形成坚固的界面,提高碳纳米材料与丝网印刷电极的结合力;此外PDA会引入羧基、羟基、氨基等亲水性基团,以提高膜表面的亲水性,发挥抗污染作用;
两性离子聚合物(ZW)是一类整体呈电中性,在同一单体侧链上同时含有阴、阳离子基团的高分子材料,由于两性离子的超亲水特性,通过氢键与水分子的相互作用形成紧密结合的水化层,水化层起到物理和能量屏障的作用,防止分子、蛋白质和其他物质的吸附,避免污染。
由于以上特性,一方面,麻醉镇静药物的氧化产物不会在电极表面形成平整的钝化层阻碍电子的转移,影响测量结果;另一方面,电极表面借助其亲水性形成水化层,可明显减少氧化产物、蛋白以及细胞等吸附,因此本电化学传感器具有良好的抗污染性能,可以进行麻醉镇静药物长时间的连续监测。
在一些实施例中,所述ZW包括3-[N,N-二甲基-[2-(2-甲基丙-2-烯酰氧基)乙基]铵]丙烷-1-磺酸内盐。
第二方面,本申请提供了一种麻醉药物电化学传感器的制备方法,包括如下步骤:
制备亲水性碳纳米材料分散液;
将亲水性碳纳米材料分散液滴加于所述丝网印刷电极表面,干燥。
本申请提供的电化学传感器制备方法简单,可大规模工业化生产。
在一些实施例中,“制备亲水性碳纳米材料分散液”包括如下步骤:
将CNT-COOH溶于乙醇中,超声分散,缓冲液中加入多巴胺(简称DA)和ZW,室温搅拌,干燥,得到亲水性碳纳米材料;
将亲水性碳纳米材料分散于溶剂中,超声分散,即得亲水性碳纳米材料分散液。
在一些实施例中,所述DA与所述CNT-COOH的质量比为1:1。
具体的,所述DA在上述体系中发生聚合反应得到所述PDA。
具体的,所述缓冲液为pH=8.5、浓度为50mM的Tris-HCl缓冲液。
在优选的实施例中,“将CNT-COOH溶于乙醇中”后,超声分散30min。
在优选的实施例中,“加入DA和ZW”后,搅拌24h,然后采用真空冷冻干燥机干燥24h。
在优选的实施例中,“将亲水性碳纳米材料分散于溶剂中”后,超声分散30min。
在一些实施例中,所述亲水性碳纳米材料分散液的浓度为1mg/ml–3mg/ml。
在一些实施例中,所述亲水性碳纳米材料分散液的滴加量为5-7μl。
在一些实施例中,所述溶剂包括去离子水和乙醇的混合物。
具体的,“将亲水性碳纳米材料分散液滴加于所述丝网印刷电极表面,干燥”后还包括如下步骤:
将表面修饰后的丝网印刷电极插入适配器,即得麻醉药物电化学传感器。
以下通过具体实施例对本申请进行进一步的说明。
实施例1
麻醉镇静药物电化学传感器的制备:
S1:将CNT-COOH溶于乙醇中,超声分散30min,加入pH=8.5、50mM的Tris-HCL缓冲液,加入DA和3-[N,N-二甲基-[2-(2-甲基丙-2-烯酰氧基)乙基]铵]丙烷-1-磺酸内盐,室温搅拌24h,然后真空冷冻干燥机干燥24h,得到亲水性碳纳米材料,其中,DA与CNT-COOH的质量比为1:1;
S2:将亲水性碳纳米材料分散于去离子水和乙醇混合溶剂中,超声分散30min,即得亲水性碳纳米材料分散液。
S3:将亲水性碳纳米材料分散液滴加于丝网印刷电极的工作电极表面,干燥;
S4:将丝网印刷电极插入适配器,即得麻醉药物电化学传感器。
实施例2
选择临床最常用的麻醉镇静药物丙泊酚为代表在PBS缓冲液中进行不同浓度的测量:
S1:在PBS缓冲液中配置不同浓度的丙泊酚试剂,浓度分别为1.25,2.5,4.98,9.9,19.6,38.8,56.6和74.07μM;
S2:将实施例1提供的麻醉药物电化学传感器连接电化学工作站,采用循环伏安法进行测量,参数设置为0-0.6V,扫速为100mV/s,初始扫描极性为阳极,灵敏度为10
S3:使用移液枪抽取50μlPBS缓冲液滴在工作电极上进行测量,作为背景数据;
S4:随后每次抽取50μl步骤S1制备的丙泊酚试剂,从浓度低到高依次测量,记录氧化峰电流值(见图2);
S5:将各个氧化峰电流值减去背景数据后,进行浓度与峰电流的线性分析(见图3),结果显示该电化学传感器可以连续进行不同浓度的测量,同时丙泊酚浓度与峰电流具有良好的线性关系,公式为Ipa=0.1444c+1.005(R
实施例3
PBS缓冲液中麻醉镇静药物丙泊酚相同浓度的测量:
S1:在PBS缓冲液中配置50μM的丙泊酚试剂;
S2:将实施例1提供的麻醉药物电化学传感器连接电化学工作站,采用循环伏安法进行测量,参数设置为0-0.6V,扫速为100mV/s,初始扫描极性为阳极,灵敏度为10
S3:使用移液枪抽取50μlPBS缓冲液滴在工作电极上进行测量,作为背景数据;
S4:随后每次抽取50μl步骤S1制备的丙泊酚试剂,进行连续测量,记录氧化峰电流值(见图4),结果显示该电化学传感器可以连续测量相同浓度丙泊酚达40次,并且相对标准偏差为2.399%,说明该传感器具有良好的抗污染性能和稳定性。
实施例4
进行血浆中麻醉镇静药物丙泊酚不同浓度的测量
S1:在血浆中配置不同浓度的丙泊酚试剂,浓度分别为2.5,4.98,9.9,19.6,38.8,56.6和74.07μM;
S2:将实施例1提供的麻醉药物电化学传感器连接电化学工作站,采用循环伏安法进行测量,参数设置为0-0.6V,扫速为100mV/s,初始扫描极性为阳极,灵敏度为10
S3:使用移液枪抽取50μl血浆在工作电极上进行测量,作为背景数据;
S4:随后每次抽取50μl步骤S1制备的丙泊酚试剂,从浓度低到高依次测量,记录氧化峰电流值(见图5);
S5:将各个氧化峰电流值减去背景数据后,进行浓度与峰电流的线性分析(见图6),结果显示在血浆中该电化学传感器可以进行连续不同浓度的测量,同时丙泊酚浓度与峰电流具有良好的线性关系,公式为Ipa=0.0222c+1.005(R
实施例5
不同碳纳米材料对抗污性能的影响:
S1:参照实施例1的方法,分别提供以下电化学传感器,记为A-F,与实施例1的区别仅仅在于修饰层材质,其中,A的修饰层为羧基化多壁碳纳米管(简称CNT-COOH);B的修饰层为CNT-COOH和聚多巴胺;C的修饰层为碳纳米角(简称CNH);D的修饰层为CNH和聚多巴胺;E的修饰层为氧化石墨烯(简称GO);F的修饰层为GO和聚多巴胺;
S2:在PBS缓冲液中配置100μM的丙泊酚试剂;
S3:将步骤S1提供的各电化学传感器连接电化学工作站,采用差分脉冲伏安法进行丙泊酚测量,参数设置为0-0.6V,振幅为0.05V,脉宽为0.05s,灵敏度为10
S4:使用移液枪抽取50μl5.0mM[Fe(CN)
S5:每次抽取50μl步骤S2制备的丙泊酚试剂,进行DPV连续20次测量;
S6:随后再进行5.0mM[Fe(CN)
S7:计算电流抑制率,公式为:电流抑制率(%)=(测量丙泊酚前电流密度-测量丙泊酚后电流密度)/测量丙泊酚前电流密度×100%。比较不同电极在5.0mM[Fe(CN)
实施例6
麻醉镇静药物电化学传感器的选择性:
S1:在PBS中配置不同浓度的丙泊酚试剂,浓度分别为10、30、50、70和90μM,各浓度试剂中均包含100μM的对乙酰氨基酚(简称APAP);
S2:将实施例1提供的麻醉药物电化学传感器连接电化学工作站,采用循环伏安法进行测量,参数设置为0-0.6V,扫速为100mV/s,初始扫描极性为阳极,灵敏度为10
S3:使用移液枪抽取50μlPBS缓冲液滴在工作电极上进行测量,作为背景数据;
S4:随后每次抽取50μl步骤S1制备的丙泊酚试剂,从浓度低到高依次测量,记录氧化峰电流值(见图9);
S5:将各个氧化峰电流值减去背景数据后,进行浓度与峰电流的线性分析(见图10),结果显示该电化学传感器具有良好的选择性。
实施例7
麻醉镇静药物电化学传感器的重复性:
S1:参照实施例1的方法,制备10个相同的麻醉镇静药物电化学传感器;
S2:将步骤S1提供的电化学传感器连接电化学工作站,在5.0mM[Fe(CN)
实施例8
麻醉镇静药物电化学传感器的稳定性:
S1:将实施例1提供的麻醉药物电化学传感器连接电化学工作站,在5.0mM[Fe(CN)
S2:分别记录在室温和4℃条件下,第1天和第30天的氧化峰电流值(见图12),结果显示本申请提供的麻醉药物电化学传感器具有良好的长时间稳定性,30天后电流均保持在初始电流95%以上。
实施例9
不同表面修饰层对蛋白污染的影响:
S1:配置1%的BSA(牛血清蛋白)溶液;
S2:参照实施例1的方法,分别提供表面修饰层为CNT-COOH/PDA,CNT-COOH/PDA/ZW,CNT-COOH/PDA/BSA的三类电化学传感器;
S3:在5.0mM[Fe(CN)
S4:将电极浸润在1%BSA溶液中24h;
S5:取出电极用去离子水冲洗后,再次在5.0mM[Fe(CN)
S6:比较测量前后的峰电流值下降程度(见图13),结果显示CNT-COOH/PDA/ZW传感器与初始值相比,电流下降幅度最低,具有良好的抗蛋白污染作用。
实施例10
麻醉药物电化学传感器的准确度:
S1:在PBS缓冲液中配置浓度为56.6μM的丙泊酚试剂;
S2:采用实施例1提供的麻醉药物电化学传感器进行循环伏安法测量,参数设置为-0.1-0V,扫速为100mV/s,初始扫描极性为阳极,灵敏度为10
S3:使用移液枪抽取50μlPBS缓冲液滴在工作电极上进行测量,作为背景数据;
S4:随后抽取50μl步骤S1制备的丙泊酚试剂,记录氧化峰电流值,平行测定3次;
S5:计算测量浓度,进行回收率计算(如表1所示);
表1
结果显示回收率为范围为96.54–104.87%,表明本申请提供的麻醉药物电化学传感器具有较高的准确度。
实施例11
不同比例DA和CNT-COOH对丙泊酚氧化产物所致电极污染的影响:
S1:参照实施例1的方法,分别提供不同比例质量比DA:CNT-COOH电化学传感器,质量比分别为0.5:1,1:1,2:1,3:1。
S2:在PBS缓冲液中配置100μM的丙泊酚试剂;
S3:将步骤S1提供的各电化学传感器连接电化学工作站,采用循环伏安法进行丙泊酚测量,参数设置为0-0.6V,扫速为100mV/s,初始扫描极性为阳极,灵敏度为10
S4:使用移液枪抽取50μl5.0mM[Fe(CN)
S5:每次抽取50μl步骤S2制备的丙泊酚试剂,进行循环伏安法连续20次测量;
S6:随后再进行5.0mM[Fe(CN)
S7:随后计算峰电流密度。
结果显示,当DA与CNT-COOH的质量比为1:1时(见图14),,电极测量前后的峰电流密度下降幅度最低,抗污染性最优。
需要说明的是,在本申请中,术语“包括”、“包含”或者其任何其他变体意在涵盖非排他性的包含,从而使得包括一系列要素的过程、方法、物品或者设备不仅包括那些要素,而且还包括没有明确列出的其他要素,或者是还包括为这种过程、方法、物品或者设备所固有的要素。在没有更多限制的情况下,由语句“包括一个……”限定的要素,并不排除在包括所述要素的过程、方法、物品或者设备中还存在另外的相同要素。
以上所述仅是本申请的具体实施方式,使本领域技术人员能够理解或实现本申请。对这些实施例的多种修改对本领域的技术人员来说将是显而易见的,本文中所定义的一般原理可以在不脱离本申请的精神或范围的情况下,在其它实施例中实现。因此,本申请将不会被限制于本文所示的这些实施例,而是要符合与本文所申请的原理和新颖特点相一致的最宽的范围。
