一种青春双歧杆菌的培养基
文献发布时间:2024-04-18 19:48:15
技术领域
本发明涉及培养基,属于一种青春双歧杆菌的培养基。
背景技术
益生菌一类对宿主有益的活性微生物,它们可以调节肠道内菌群平衡,促进营养吸收,保持肠道健康,从而有利于人体健康。双歧杆菌(Bifidobacteriumspp.)是一类常见的益生菌。双歧杆菌在19世纪末被研究者从婴儿的粪便中发现并提出,经过时间的验证,双歧杆菌被确定为是一种对人和动物有益的,重要的肠道益菌。直到2021年1月已有65个种的双歧杆菌,其中与人类密切相关的就有12种,青春双岐杆菌(B.adolescentis)就是其中之一。青春双岐杆菌属于放射菌门,放射菌纲,放线菌目,放线菌科,双歧杆菌属。青春双歧杆菌是革兰氏阳性菌,菌体多形态,常见形态为短的,弯曲的,偶尔分叉的杆状。它的最适的生长温度在35-37℃,适宜pH值为6.7-7.0,发酵葡萄糖产乳酸。青春双歧杆菌主要存在人和动物的肠道中,人体青春的时期是青春双岐杆菌的存在期。青春双歧杆菌可以有效控制人体肠道内的菌群平衡,它能产生乙酸和乳酸,抑制致病菌的有害发酵,促进肠胃蠕动,使人体正常排便;能够对外来致病菌产生拮抗作用,使外来致病菌无法定植在肠道内,治疗腹泻;能够保护人体细胞免受致癌物质的损害,具有提高人体免疫力的作用
但是现有技术中青春双歧杆菌在冻干后往往存活率较低,无法生产高产量及高冻干存活率的青春双歧杆菌。
发明内容
本发明的目的在于提供一种青春双歧杆菌的培养基,以解决背景技术中的问题。
为达到上述目的,本发明提供如下技术方案:
一种青春双歧杆菌的培养基,包括:10.0g/L的蛋白胨、10.0g/L的酵母膏、20.0g/L的乳糖、10.0g/L的牛肉粉、5.0g/L的乙酸钠、2.0g/L的磷酸氢二钾、2.0g/L的柠檬酸氢二铵、1.0g/L的L-半胱氨酸盐酸盐、0.58g/L的硫酸镁、0.25g/L的硫酸锰、1.0g/L的吐温80以及0.5-4g/L的小肠类器官培养物活性粉末。
进一步地,所述小肠类器官培养物活性粉末的制备方法为:提取猪原代小肠隐窝上皮细胞,以基质胶包埋后用小肠类器官基础培养基培养24小时后,收集所述小肠类器官基础培养基的上清液,经过冻干处理后,制成小肠类器官培养物活性粉末。
进一步地,所述小肠类器官基础培养基的制备方法为:按终浓度计算,将为1%的青链霉素、1%的L-谷氨酰胺、10%的FBS和1%的HEPES加入至DMEM/F-12培养基,再加入50-200ng/mL的细胞生长因子EGF、100-400ng/mL的R-spondin1、0.5-2mM的N-acetylcysteine和50-200ng/mL的Noggin。
本发明的有益效果在于:本发明的培养基引进了小肠类器官培养物活性粉末,相对于普通青春双歧杆菌培养基,提高了青春双歧杆菌的产量及冻干后存活率。
上述说明仅是本发明技术方案的概述,为了能够更清楚了解本发明的技术手段,并可依照说明书的内容予以实施,以下以本发明的较佳实施例详细说明如后。
附图说明
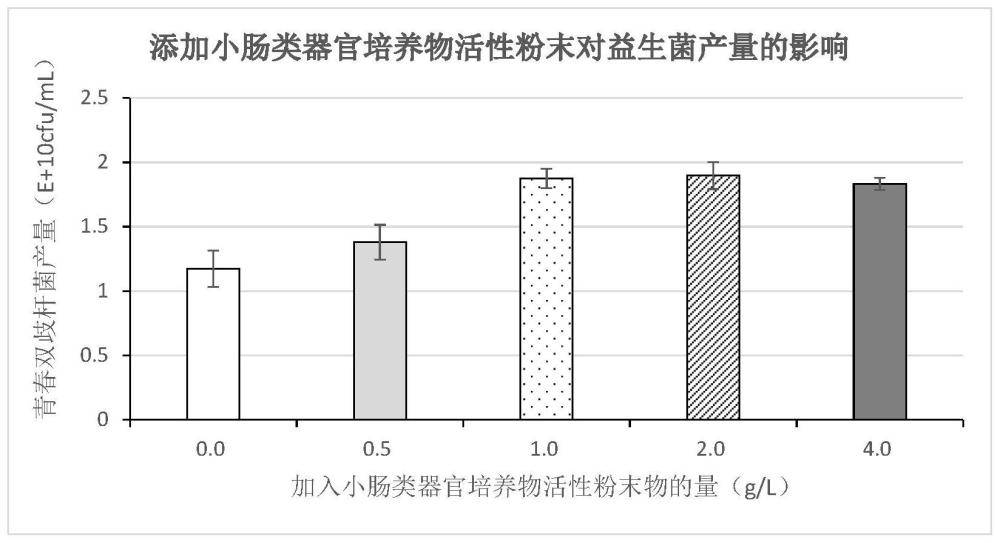
图1为实施例1-4及对比例1培养结果。
图2为实施例2及对比例1培养的青春双歧杆菌冻干存活率。
具体实施方式
下面结合具体实施例对本发明的技术方案作进一步的描述,但本发明不应限于这些实施例,除非特别叙述,均可被其他等效或具有类似目的的替代特征加以替换。除非特别叙述,每个特征只是一系列等效或类似特征中一个例子而已。在本发明中所使用的术语,除非另有说明,一般具有本领域普通技术人员通常理解的含义。以下实施例中,除另有说明的,浓度%是指质量百分数;使用的物质均可通过市售获得。下面结合具体实施例对本发明的技术方案作进一步的描述,但本发明不应限于这些实施例,除非特别叙述,均可被其他等效或具有类似目的的替代特征加以替换。除非特别叙述,每个特征只是一系列等效或类似特征中一个例子而已。在本发明中所使用的术语,除非另有说明,一般具有本领域普通技术人员通常理解的含义。
实施例1
制备小肠类器官基础培养基:按终浓度计算,将为1%的青链霉素、1%的L-谷氨酰胺、10%的FBS和1%的HEPES加入至DMEM/F-12培养基,再加入100ng/mL的细胞生长因子EGF、200ng/mL的R-spondin1、1mM的N-acetylcysteine和100ng/mL的Noggin。
提取猪原代小肠隐窝上皮细胞,以基质胶包埋后用上述小肠类器官基础培养基培养24小时后,收集所述小肠类器官基础培养基的上清液,经过冻干处理后,制成小肠类器官培养物活性粉末。
青春双歧杆菌的培养基,包括:10.0g/L的蛋白胨、10.0g/L的酵母膏、20.0g/L的乳糖、10.0g/L的牛肉粉、5.0g/L的乙酸钠、2.0g/L的磷酸氢二钾、2.0g/L的柠檬酸氢二铵、1.0g/L的L-半胱氨酸盐酸盐、0.58g/L的硫酸镁、0.25g/L的硫酸锰、1.0g/L的吐温80以及0.5g/L的小肠类器官培养物活性粉末。将青春双歧杆菌在37度条件下厌氧培养9小时。
实施例2
制备小肠类器官基础培养基:按终浓度计算,将为1%的青链霉素、1%的L-谷氨酰胺、10%的FBS和1%的HEPES加入至DMEM/F-12培养基,再加入100ng/mL的细胞生长因子EGF、200ng/mL的R-spondin1、1mM的N-acetylcysteine和100ng/mL的Noggin。
提取猪原代小肠隐窝上皮细胞,以基质胶包埋后用上述小肠类器官基础培养基培养24小时后,收集所述小肠类器官基础培养基的上清液,经过冻干处理后,制成小肠类器官培养物活性粉末。
青春双歧杆菌的培养基,包括:10.0g/L的蛋白胨、10.0g/L的酵母膏、20.0g/L的乳糖、10.0g/L的牛肉粉、5.0g/L的乙酸钠、2.0g/L的磷酸氢二钾、2.0g/L的柠檬酸氢二铵、1.0g/L的L-半胱氨酸盐酸盐、0.58g/L的硫酸镁、0.25g/L的硫酸锰、1.0g/L的吐温80以及1g/L的小肠类器官培养物活性粉末。将青春双歧杆菌在37度条件下厌氧培养9小时。
实施例3
制备小肠类器官基础培养基:按终浓度计算,将为1%的青链霉素、1%的L-谷氨酰胺、10%的FBS和1%的HEPES加入至DMEM/F-12培养基,再加入100ng/mL的细胞生长因子EGF、200ng/mL的R-spondin1、1mM的N-acetylcysteine和100ng/mL的Noggin。
提取猪原代小肠隐窝上皮细胞,以基质胶包埋后用上述小肠类器官基础培养基培养24小时后,收集所述小肠类器官基础培养基的上清液,经过冻干处理后,制成小肠类器官培养物活性粉末。
青春双歧杆菌的培养基,包括:10.0g/L的蛋白胨、10.0g/L的酵母膏、20.0g/L的乳糖、10.0g/L的牛肉粉、5.0g/L的乙酸钠、2.0g/L的磷酸氢二钾、2.0g/L的柠檬酸氢二铵、1.0g/L的L-半胱氨酸盐酸盐、0.58g/L的硫酸镁、0.25g/L的硫酸锰、1.0g/L的吐温80以及2g/L的小肠类器官培养物活性粉末。将青春双歧杆菌在37度条件下厌氧培养9小时。
实施例4
制备小肠类器官基础培养基:按终浓度计算,将为1%的青链霉素、1%的L-谷氨酰胺、10%的FBS和1%的HEPES加入至DMEM/F-12培养基,再加入100ng/mL的细胞生长因子EGF、200ng/mL的R-spondin1、1mM的N-acetylcysteine和100ng/mL的Noggin。
提取猪原代小肠隐窝上皮细胞,以基质胶包埋后用上述小肠类器官基础培养基培养24小时后,收集所述小肠类器官基础培养基的上清液,经过冻干处理后,制成小肠类器官培养物活性粉末。
青春双歧杆菌的培养基,包括:10.0g/L的蛋白胨、10.0g/L的酵母膏、20.0g/L的乳糖、10.0g/L的牛肉粉、5.0g/L的乙酸钠、2.0g/L的磷酸氢二钾、2.0g/L的柠檬酸氢二铵、1.0g/L的L-半胱氨酸盐酸盐、0.58g/L的硫酸镁、0.25g/L的硫酸锰、1.0g/L的吐温80以及4g/L的小肠类器官培养物活性粉末。将青春双歧杆菌在37度条件下厌氧培养9小时。
对比例1原培养系统
青春双歧杆菌的培养基,包括:10.0g/L的蛋白胨、10.0g/L的酵母膏、20.0g/L的乳糖、10.0g/L的牛肉粉、5.0g/L的乙酸钠、2.0g/L的磷酸氢二钾、2.0g/L的柠檬酸氢二铵、1.0g/L的L-半胱氨酸盐酸盐、0.58g/L的硫酸镁、0.25g/L的硫酸锰、1.0g/L的吐温80以及4g/L的小肠类器官培养物活性粉末。将青春双歧杆菌在37度条件下厌氧培养9小时。
实施例1-4及对比例1青春双歧杆菌培养结果如图1所示,可以看出在添加小肠类器官培养物活性粉末大于等于1.0g/L的浓度下,对青春双歧杆菌的产量是有显著提高的;添加浓度大于1.0g/L时,提高的产量差别不明显;在4.0g/L的时候产量略有下降。对比例1原培养方法青春双歧杆菌培养基培养的活菌数1.17×10
将实施例2和对比例1培养得到的青春双歧杆菌采取相同工艺进行冻干处理,包括菌体收集、菌体重悬、吸去水分及冷冻干燥。然后在常温和冷藏(4℃)的条件下保存0天、7天、14天、30天、90天和180天,分别复苏并测定菌种的冻干存活率。结果显示:第14天:冷藏条件下,实施例2的菌种冻干存活率为88.02%,比对比例1的菌种冻干存活率为72.11%有显著的提高;常温条件下,实施例2的菌种冻干存活率为68.68%也比对比例1的60.45%要高。180天后,冷藏储存的菌种的存活率要显著高于常温储存,常温储存条件下,对比例1原培养系统和实施例2对菌种冻干存活率的影响无显著差异。在冷藏条件下,实施例2的新系统菌种冻干存活率为73.49%,也显著高于原培养系统的菌种冻干存活率52.35%。
菌种存活率计算方法如下:
冻干(储存)后的活菌数
菌种存活率(%)=———————————————×100%。
冻干(储存)前的活菌数
以上所述实施例的各技术特征可以进行任意的组合,为使描述简洁,未对上述实施例中的各个技术特征所有可能的组合都进行描述,然而,只要这些技术特征的组合不存在矛盾,都应当认为是本说明书记载的范围。
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
