一种高溶剂-钠盐比的电解液及钠离子电池
文献发布时间:2023-06-19 12:19:35
技术领域
本发明涉及钠电池材料技术领域,尤其涉及一种高溶剂-钠盐比的电解液及钠离子电池。
背景技术
钠离子电池由于其成本低、来源丰富等特点,一直以来被认为是锂离子电池的有益补充。与锂处于同一主族的元素钠具有与锂非常相似的物理和化学性质,并且钠在地球上的丰度比锂要高,成本较低,所以发展钠离子电池作为大规模储能设备成为一个比较好的选择。时至今日,钠离子电池的相关技术研究已经在学术和工业领域引起了广泛的关注。
钠离子电池电解液是钠离子电池中离子传输的载体。一般由钠盐和有机溶剂组成。电解液在锂电池正、负极之间起到传导离子的作用。
在长期的研究中,我们发现,目前业内常用的钠离子电池电解液,为了获得良好的离子电导率,其溶剂-钠盐摩尔比基本在10:1或者更低,且存在随着比值的降低,电解液中钠离子与阴离子的作用增强,黏度上升,在低温条件下黏度升高更为明显。这会导致电解液对极片与隔膜的浸润性变差,影响低温循环性能。在高温条件下应用时,阴离子在高温下分解加剧,副产物增加,也同样会影响高温循环性能。
业内也有采用在电解液中使用成膜添加剂以提高电极-电解液界面层稳定性、电池循环稳定性的常用方法,但是仍然存在在极端温度下容易失效、成本高、未能解决低温下因黏度高对电极浸润性差等问题。
发明内容
本发明的目的是针对现有技术的缺陷,提供一种高溶剂-钠盐比的电解液及钠离子电池。
有鉴于此,在第一方面,本发明实施例提供了一种高溶剂-钠盐比的电解液,所述电解液包括钠盐、溶剂和添加剂;所述溶剂与钠盐的摩尔比为20:1~70:1;所述添加剂的添加量占所述电解液的质量比为0.5%~5%;
其中,所述钠盐包括高氯酸钠(NaClO
优选的,所述溶剂包括碳酸乙烯酯(EC)、碳酸丙烯酯(PC)、碳酸丁烯酯(BC)、碳酸亚乙烯酯(VC)、氟代碳酸乙烯酯(FEC)、碳酸甲乙酯(EMC)、碳酸二甲酯(DMC)、碳酸二乙酯(DEC)、碳酸二丙酯(DPC)、碳酸甲丙酯(MPC)、碳酸乙丙酯(EPC)、γ-丁内酯(BL)、1,3-丙烷磺酸内酯(1,3-PS)、丙酸甲酯(MP)、丁酸甲酯(MB)、乙酸乙酯(EA)、丙酸乙酯(EP)、丙酸丙酯(PP)、丁酸乙酯(EB)、1,3-二氧戊环(DOL)、乙二醇二甲醚(DME)、二乙二醇二甲醚(DEGDME)、三乙二醇二甲醚(TRGDME)、四乙二醇二甲醚(TEGDME)、甲磺酸乙酯(EMS)或二甲基亚砜(DMSO)中的一种或多种。
优选的,所述添加剂包括硝酸钠、二氟草酸硼酸钠、碳酸亚乙烯酯(VC)、氟代碳酸乙烯酯(FEC)、1,3-丙烷磺酸内酯(1,3-PS)、乙二醇二甲醚(DME)、二乙二醇二甲醚(DEGDME)、三乙二醇二甲醚(TRGDME)、四乙二醇二甲醚(TEGDME)、甲磺酸乙酯(EMS)、二甲基亚砜(DMSO)、二甲基砜(MSM)、丁二腈(SN)、丙烯基-1,3-磺酸内酯(PST)、硫酸乙烯酯(DTD)、乙氧基(五氟)环三磷腈(EFPN)、磷酸三甲酯(TMP)、甲基膦酸二甲酯(DMMP)、甲基九氟丁醚(MFE)、三(2,2,2-三氟乙基)亚磷酸盐(TFEP)或联苯(BP)中的一种或多种。
优选的,所述添加剂的添加量占所述电解液的质量比为0.5%~2%。
优选的,所述电解液的工作温度范围在-40℃~80℃。
第二方面,本发明实施例提供了一种包括上述第一方面所述的高溶剂-钠盐比的电解液的钠离子电池。
优选的,所述钠离子电池的工作温度范围在-40℃~80℃。
第三方面,所述高溶剂-钠盐比的电解液的钠离子电池用于太阳能发电、风力发电、智能电网调峰、分布电站、后备电源或通信基站的大规模储能设备。
本发明提供了的高溶剂-钠盐比的电解液,通过优化电解液中的溶剂-钠盐比,电解液的黏度低、对极片和隔膜浸润性好、在高温下产生的易破坏电极-电解液界面层的分解产物少;在高温下工作具有良好的循环性能,应用该电解液的钠离子电池的放电比容量和首周库仑效率相比应用现有常规溶剂-钠盐比的电解液的更高;在低温下工作能够获得更好的放电比容量和容量保持率,同时能够满足电导率的要求;因此可以有效拓宽锂离子电池的工作温度范围,满足钠离子电池适应更大工作温度范围的工作要求。应用本发明电解液的钠离子电池,在高温、室温和低温条件下(-40℃~80℃)均能进行可逆充放电,循环稳定性好。
附图说明
下面通过附图和实施例,对本发明实施例的技术方案做进一步详细描述。
图1为本发明实施例1~5中的电解液与对比例1、2中的电解液在室温(25℃)下的黏度对比图;
图2为本发明实施例1~5中的电解液与对比例1、2中的电解液在低温(0℃)下的黏度对比图;
图3为本发明实施例1~5中的电解液与对比例1、2中的电解液在室温(25℃)下的电导率对比图;
图4为本发明实施例1~5中的电解液与对比例1、2中的电解液在室温(0℃)下的电导率对比图;
图5为本发明实施例4和对比例2的全电池于55℃下,以0.1C倍率进行恒流充放电测试的首周充放电曲线图;
图6为本发明实施例4和对比例2的全电池于25℃下,以0.1C倍率进行恒流充放电测试的首周充放电曲线图;
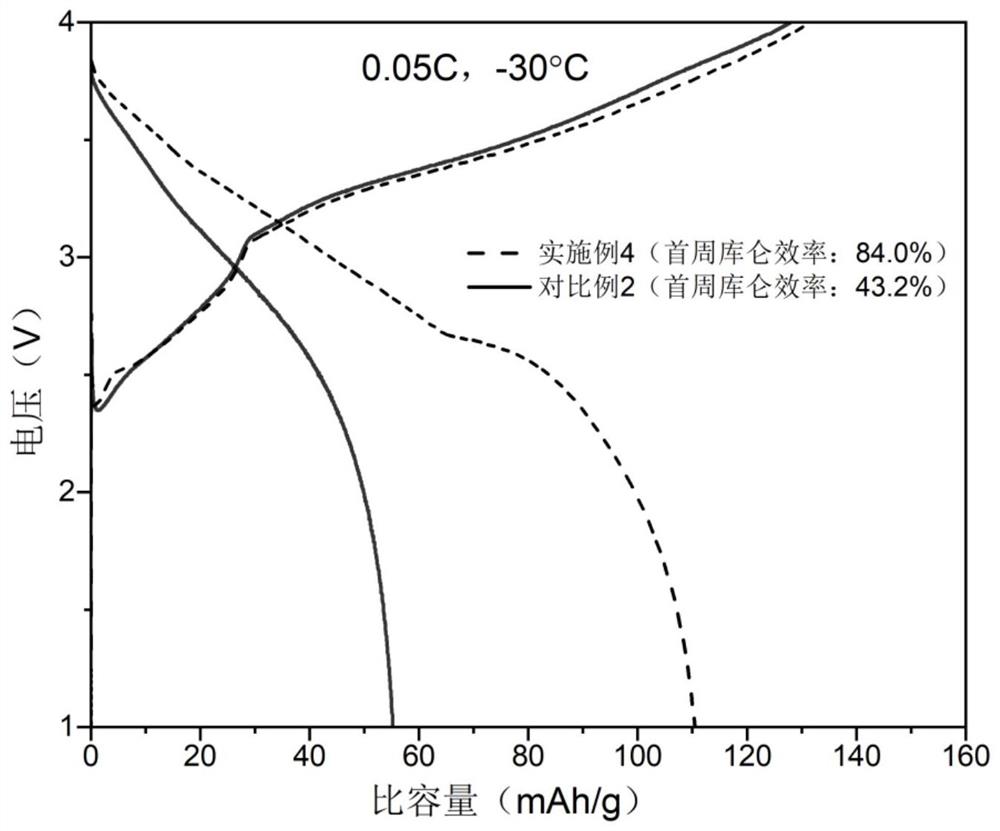
图7为本发明实施例4和对比例2的全电池于-30℃下,以0.05C倍率进行恒流充放电测试的首周充放电曲线图;
图8为本发明实施例4、5和对比例1、2的全电池于25℃下,以0.3C倍率进行充放电循环的循环稳定性图;
图9为本发明实施例13和对比例10的全电池于25℃下,以0.3C倍率进行充放电循环的循环稳定性图;
图10为本发明实施例4和对比例2的全电池于55℃下,以1C倍率进行充放电循环的循环稳定性图;
图11为本发明实施例9和对比例6的全电池于55℃下,以0.3C倍率进行充放电循环的循环稳定性图;
图12为本发明实施例17和对比例14的全电池于55℃下,以0.3C倍率进行充放电循环的循环稳定性图;
图13为本发明实施例14和对比例11的全电池于80℃下,以0.3C倍率进行充放电循环的循环稳定性图;
图14为本发明实施例4和对比例2的全电池于0℃下,以0.3C倍率进行充放电循环的循环稳定性图;
图15为本发明实施例13和对比例10的全电池于0℃下,以0.3C倍率进行充放电循环的循环稳定性图;
图16为本发明实施例17和对比例14的全电池于0℃下,以0.3C倍率进行充放电循环的循环稳定性图;
图17为本发明实施例6和对比例3的全电池于-40℃下,以0.1C倍率进行充放电循环的循环稳定性图;
图18为本发明实施例4和对比例2的电池在25℃、0℃和55℃下循环,循环后使用X射线光电子能谱对正极-电解液界面膜进行组分测试的C+O所占原子百分比与刻蚀时长的变化对比图;
图19为本发明实施例4和对比例2的电池在25℃、0℃和55℃下循环,循环后使用X射线光电子能谱对正极-电解液界面膜进行组分测试的P+F所占原子百分比与刻蚀时长的变化对比图;
图20为本发明实施例4和对比例2的电池在25℃、0℃和55℃下循环,循环后使用X射线光电子能谱对负极-电解液界面膜进行组分测试的C+O所占原子百分比与刻蚀时长的变化对比图;
图21为本发明实施例4和对比例2的电池在25℃、0℃和55℃下循环,循环后使用X射线光电子能谱对负极-电解液界面膜进行组分测试的P+F所占原子百分比与刻蚀时长的变化对比图。
具体实施方式
本发明实施例提供了一种高溶剂-钠盐比的电解液及钠离子电池。
本发明实施例提供的高溶剂-钠盐比的电解液包括钠盐、溶剂和添加剂;溶剂与钠盐的摩尔比为20:1~70:1;添加剂的添加量占所述电解液的质量比为0.5%~5%,优选为0.5%~2%。
其中,钠盐包括高氯酸钠(NaClO
溶剂包括碳酸乙烯酯(EC)、碳酸丙烯酯(PC)、碳酸丁烯酯(BC)、碳酸亚乙烯酯(VC)、氟代碳酸乙烯酯(FEC)、碳酸甲乙酯(EMC)、碳酸二甲酯(DMC)、碳酸二乙酯(DEC)、碳酸二丙酯(DPC)、碳酸甲丙酯(MPC)、碳酸乙丙酯(EPC)、γ-丁内酯(BL)、1,3-丙烷磺酸内酯(1,3-PS)、丙酸甲酯(MP)、丁酸甲酯(MB)、乙酸乙酯(EA)、丙酸乙酯(EP)、丙酸丙酯(PP)、丁酸乙酯(EB)、1,3-二氧戊环(DOL)、乙二醇二甲醚(DME)、二乙二醇二甲醚(DEGDME)、三乙二醇二甲醚(TRGDME)、四乙二醇二甲醚(TEGDME)、甲磺酸乙酯(EMS)或二甲基亚砜(DMSO)中的一种或多种。
添加剂包括硝酸钠、二氟草酸硼酸钠、碳酸亚乙烯酯(VC)、氟代碳酸乙烯酯(FEC)、1,3-丙烷磺酸内酯(1,3-PS)、乙二醇二甲醚(DME)、二乙二醇二甲醚(DEGDME)、三乙二醇二甲醚(TRGDME)、四乙二醇二甲醚(TEGDME)、甲磺酸乙酯(EMS)、二甲基亚砜(DMSO)、二甲基砜(MSM)、丁二腈(SN)、丙烯基-1,3-磺酸内酯(PST)、硫酸乙烯酯(DTD)、乙氧基(五氟)环三磷腈(EFPN)、磷酸三甲酯(TMP)、甲基膦酸二甲酯(DMMP)、甲基九氟丁醚(MFE)、三(2,2,2-三氟乙基)亚磷酸盐(TFEP)或联苯(BP)中的一种或多种。
本发明提供的高溶剂-钠盐比的电解液的工作温度范围在-40℃~80℃。
该高溶剂-钠盐比的电解液用于钠离子电池中,电池可以在-40℃~80℃温度范围内可逆充放电与循环。
本发明的提出是基于在研究中发现:常规钠离子电池电解液(溶剂-钠盐摩尔比在10:1以下)随着溶剂-钠盐摩尔比的降低:钠离子与阴离子相互作用逐渐增强,电解液黏度增大,对电极材料和隔膜的浸润性变差,尤其在低温(<0℃)情况下黏度显著高于同等条件下的高溶剂-钠盐比电解液,致使含所述常规溶剂-钠盐比电解液的钠离子电池在低温(<0℃)下循环稳定性下降甚至不能实现可逆充放电;因为电解液中钠盐含量较高,因此阴离子数量较多,在高温下(>30℃)下中阴离子分解严重,分解产物破坏电极-电解液界面层,致使含所述常规溶剂-钠盐比电解液的钠离子电池循环稳定性下降甚至失效。
本发明高溶剂-钠盐比电解液能有效解决上述常规钠离子电池电解液的缺点。
一,随着溶剂-钠盐摩尔比的增加,钠盐充分解离,有更多富余的不与钠离子形成配位的自由溶剂分子,使得电解液的黏度降低,尤其在低温下黏度降低的幅度更大,对电极和隔膜浸润性更好,使得含所述高溶剂-钠盐电解液的电池在低温条件下也能实现稳定循环。
二,由于电解液中钠盐含量少,钠盐阴离子在高温下破坏电极-电解液界面层的分解产物(如HF)少,可以有效提高电极-电解液界面层的稳定性,提升高温下的循环稳定性。
三,对于常规溶剂-钠盐比的钠离子电池电解液,一般认为其在电解液-电极界面形成的界面层多以无机物为主,如NaF等,这些无机物结构较为疏松,对钠离子传输性质较差,且会因为持续产生的钠盐阴离子分解产物(如HF)等与电极材料的持续反应而不断堆积,使电解液-电极界面层变厚,变粗糙,影响电池的循环稳定性;而本发明电解液由于钠盐占比较小而有机溶剂占比较大,有机溶剂主导电解液-电极界面层的组成,相应地多以有机物和有机聚合产物为主,因而能形成更为致密、均一、较薄的电解液-电极界面层,保护内部电极材料,兼顾钠离子传导,有利于提高电池的循环稳定性。
应用本发明电解液的钠离子电池,在高温、室温和低温条件下(-40℃~80℃)均能进行可逆充放电,循环稳定性好。除此之外,由于上述常规钠离子电池电解液由于钠盐在电解液中占比大,而钠盐成本约为溶剂成本的十倍,因而使用本发明的高溶剂-钠盐比电解液则能大幅降低钠盐的比重,有利于电解液成本的降低。
应用本发明的高溶剂-钠盐比的电解液,可以与正极、负极以及置于正极和负极间的隔膜一起组成钠离子电池。其中具体的,正极包括正极集流体和正极集流体上的正极材料,正极材料包括正极活性物质、导电剂和粘结剂;负极采用金属钠,或者负极包括负极集流体和负极集流体上的负极材料,负极材料包括负极活性物质、导电剂和粘结剂。以上所组成的钠离子电池可以用于太阳能发电、风力发电、智能电网调峰、分布电站、后备电源或通信基站的大规模储能设备。
下面结合一些具体的实例,对本发明的高溶剂-钠盐比的电解液,及其应用和性能进行进一步详述。
实施例1
电解液的制备方法如下:
室温下,在水含量、氧含量均小于0.1ppm的手套箱中,将碳酸乙烯酯(EC)和丙烯酯(PC)以体积比1:1混合后形成溶剂,向溶剂中按照溶剂:钠盐=20:1(摩尔比)加入六氟磷酸钠(NaPF
以NaCu
实施例2-26及对比例1-17
按照实施例1的实施方法,改变实施例1中溶剂与钠盐的摩尔比、钠盐种类、溶剂种类、正极活性物质和负极活性物质,得到实施例2-26及对比例1-17,电解液的组成及所用电极活性物质如表1所示。
表1:实施例1~26及对比例1~17的电解液组成、电极活性物质选择:
对在以上实施例和对比例中抽取部分进行性能测试:
A、黏度测试
选取实施例1~5中的电解液与对比例1~2中的电解液在室温(25℃)下,使用Anton Paar MCR502流变仪及所属系统进行黏度测试,测试结果如图1,同样方法在低温(0℃)下的测试结果如图2。室温(25℃)下实施例1~5电解液黏度明显低于对比例2电解液黏度,低温(0℃)下这一差距更为明显。
B、电导率测试
选取实施例1~5中的电解液与对比例1~2中的电解液在室温(25℃)下,使用上海罗素双电极电导笔组成电解池,利用Zahner IM6e电化学工作站测得电解池的交流阻抗,再利用电导笔的电解池常数计算得到电解液的电导率,其测试结果如图3。同样方法在低温(0℃)下的测试结果如图4。
结合上述黏度测试和离子电导率测试可以发现,在黏度方面,实施例1~5和对比例1都明显低于对比例2,且从变化趋势来看,随着溶剂比例的升高,实施例1~5和对比例1的黏度差别较小,而在对比例2与实施例1之间黏度存在显著差距,亦即溶剂-钠盐比在20:1以上的电解液具有远低于常规溶剂-钠盐比电解液的浓度;在电导率方面,对比例2电导率最高,对比例1电导率最低,实施例1~4的电导率几乎随溶剂-钠盐摩尔比值增加线性递减。对比例2作为常规溶剂-钠盐比电解液的实例,虽然离子电导率高,但黏度也最大;而作为高溶剂-钠盐比的一种极端情况,黏度最低的对比例1的离子电导率则过低(从目前研究来看,电解液的室温电导率一般都至少在3mS/cm以上),且所含载流子过少也会在实际电池充放电循环中也会因为扩散和迁移不及时而造成较为明显的浓差极化,影响循环性能,在高倍率下表现尤为明显,在下面的室温循环性能测试中的对比可以发现二者的差距。
C、首周充放电性能测试
将实施例4和对比例2的全电池分别于55℃、25℃和-30℃条件下,对应地以0.1C、0.1C和0.05C倍率进行恒流充放电测试,首周充放电测试结果分别如图5、图6和图7所示。室温(25℃)下实施例4与对比例2首周充放电曲线差异较小,在高温(55℃)下和低温(-30℃)下实施例4的放电比容量和首周库仑效率明显高于对比例2,在低温(-30℃)下实施例4的放电比容量几乎为对比例的2倍。
D、室温(25℃)循环性能测试
实施例4~26和对比例1~17在室温(25℃)下的循环性能测试结果如表2所示。
将实施例4~5、对比例1~2所述全电池于室温(25℃)下,以0.3C倍率进行充放电循环,测试结果如图8所示(事先用小电流循环活化,图中未显示)。循环50周后,实施例4容量保持率94.9%,实施例5容量保持率为93.4%,对比例1容量保持率为87.8%,对比例2容量保持率为96.8%。实施例4容量保持率略低于对比例2,但实施例4的库仑效率均高于对比例2;实施例5虽然活化后比容量较实施例4和对比例2有所降低,但容量保持率仍然和实施例4相接近;而作为高溶剂-钠盐比的一种极端情况,对比例1不仅活化后比容量明显低于其他三者,在容量保持率方面也显著低于其他三者。
将实施例13和对比例10所述全电池于室温(25℃)下,以0.3C倍率进行充放电循环,测试结果如图9所示。循环100周后,实施例13容量保持率86.5%,对比例10容量保持率84.8%,实施例13容量保持率略高于对比例10。
表2:实施例4~26和对比例1~17的在室温(25℃)下的循环性能对比:
通过以上测试对比可以发现,尽管含有本发明高溶剂-钠盐比电解液钠离子电池在室温下电导率有所降低,但仍能取得与含有常规溶剂-钠盐比电解液的相比拟的活化后放电比容量和循环稳定性。但作为一种极端情况,当溶剂-钠盐比高于70:1时(对比例1100:1),电池循环稳定性劣化严重。室温下的循环稳定性测试仅作为一般对比参考,本发明所述的电解液在高温和低温下较常规电解液具有更明显的优势。
E、高温循环性能测试
实施例4、实施例6~26和对比例2~17在高温下的循环性能测试结果如表3所示。
将实施例4和对比例2全电池于高温(55℃)下,以1C倍率进行充放电循环,测试结果如图10所示(事先用小电流循环活化)。实施例4在高温、高倍率下的循环稳定性明显优于对比例2。
将实施例9和对比例6所述全电池于高温(55℃)下,以0.3C倍率进行充放电循环,测试结果如图11所示(事先用小电流循环3周活化)。循环50周后,实施例9容量保持率94.5%,对比例6容量保持率83.4%,实施例9明显优于对比例6。
将实施例17和对比例14所述全电池于高温(55℃)下,以0.3C倍率进行充放电循环(事先用小电流循环活化),测试结果如图12所示。实施例17在高温下的循环稳定性显著优于对比例14。
将实施例14和对比例11所述全电池于高温(80℃)下,以0.3C倍率进行充放电循环,测试结果如图13所示(事先用小电流循环活化,图中未显示)。实施例14循环50周后容量保持率86.3%,对比例11循环50周后容量保持率47.6%,实施例14循环稳定性显著优于对比例11。
表3:实施例4、实施例6~26和对比例2~17的在高温下的循环性能对比
通过上述测试可以看出,含本发明所述电解液的钠离子电池在高温下均明显比含常规电解液的钠离子电池具有更好的循环稳定性,可以很好地扩展钠离子电池的应用温度上限。
F、低温循环性能测试
实施例4、实施例6~26和对比例2~17在低温下的循环性能测试结果如表4所示。
将实施例4和对比例2所述全电池于低温(0℃)下,以0.3C倍率进行充放电循环,测试结果如图14所示(事先用小电流循环活化)。循环50周后,实施例4容量保持率95.8%,对比例2容量保持率95.0%,实施例4容量保持率略优于对比例2。
将实施例13和对比例10所述全电池于低温(0℃)下,以0.3C倍率进行充放电循环,测试结果如图15所示(事先用小电流循环活化)。循环50周后,实施例13容量保持率91.1%,对比例10容量保持率86.9%,实施例13容量保持率高于对比例10。
将实施例17和对比例14所述全电池于低温(0℃)下,以0.3C倍率进行充放电循环,测试结果如图16所示(事先用小电流循环活化)。循环50周后,实施例17容量保持率93.4%,对比例14容量保持率92.6%,实施例17容量保持率略高于对比例14。
将实施例6和对比例3所述全电池于低温(-40℃)下,以0.1C倍率进行充放电循环,测试结果如图17所示(事先用小电流循环活化)。循环20周后,实施例6容量保持率84.2%,对比例3容量保持率48.9%,对比例3的活化后比容量仅为实施例的一半,循环稳定性也远差于对比例3。表4:实施例4、实施例6~26和对比例2~17的在低温下的循环性能对比
通过上述测试可以看出,含本发明所述电解液的钠离子电池在低温下的循环稳定性均优于对比例,且在极低温(-40℃)下其初始比容量和容量保持率都远优于常规电解液,可以很好地扩展钠离子电池的应用温度下限。
G、电极-电解液界面层组分测试
使用X射线光电子能谱(XPS)对循环后的实施例4和对比例2所述电池的正极和负极在循环过程中与电解液所形成的表面的组分进行刻蚀分析,以测定界面层在不同深度(刻蚀时长越长,深度越深)的组分,即不同组分在垂直于电极表面方向的分布信息。
在室温(25℃)、低温(0℃)和高温(55℃)下,测得实施例4和对比例2的电池正极表面的C+O所占原子百分比如图18所示,P+F所占原子百分比如图19所示。可以看出,上述三种温度下,实施例4的C+O所占原子百分比始终大于对比例2,表明实施例4电池的正极-电解液界面中有机成分所占比例更多;上述三种温度下,实施例4的P+F所占原子百分比始终小于对比例2,表明实施例4电池的正极-电解液界面中无机成分所占比例更少。
室温(25℃)、低温(0℃)和高温(55℃)下,实施例4和对比例2所述电池负极表面的C+O所占原子百分比如图20所示,P+F所占原子百分比如图21所示。可以看出,上述三种温度下,实施例4的C+O所占原子百分比始终大于同等温度下的对比例2的,表明实施例4电池的负极-电解液界面中有机成分所占比例更多;上述三种温度下,实施例4的P+F所占原子百分比始终小于同等温度下的对比例2的,表明实施例4电池的负极-电解液界面中无机成分所占比例更少。
上述有机成分主要来源于溶剂的分解成膜,上述无机成分主要来源于钠盐所含阴离子的分解(例如:PF
同时,在不同温度下,实施例4无论是在正极-电解液界面还是负极-电解液界面,其成分随刻蚀时间(深度)和温度变化的幅度更小,证明在极端温度下界面更稳定,这也是使得采用所述高溶剂-钠盐比电解液后电池在高温和低温下性能提高的原因。
通过以上实施例对比可以看出,相对于常规钠离子电池电解液,本发明所述高溶剂-钠盐比电解液黏度较低,对电极和隔膜浸润性好,在高温下破坏电极-电解液界面层的分解产物少,可以有效提高电极-电解液界面层的稳定性。应用本发明电解液的钠离子电池,在高温、室温和低温条件下均能进行可逆充放电,循环稳定性好。同时,由于常规钠离子电池电解液由于钠盐在电解液中占比大,而钠盐成本远高于溶剂成本,因而电解液整体成本较高,使用本发明所述高溶剂-钠盐比电解液能大幅降低钠盐的比重,有利于电解液成本的降低。
以上所述的具体实施方式,对本发明的目的、技术方案和有益效果进行了进一步详细说明,所应理解的是,以上所述仅为本发明的具体实施方式而已,并不用于限定本发明的保护范围,凡在本发明的精神和原则之内,所做的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 一种高溶剂-钠盐比的电解液及钠离子电池
- 一种全氟溶剂高电压电解液及其在锂离子电池中的应用
