检测甲基化水平的试剂及其在制备HPV阴性的头颈鳞状细胞癌诊断产品中的应用
文献发布时间:2024-04-18 19:58:21
技术领域
本发明涉及生物医学技术领域,特别是涉及一种检测甲基化水平的试剂及其在制备HPV阴性的头颈鳞状细胞癌诊断产品中的应用。
背景技术
头颈部肿瘤主要起源于口腔、咽部或喉部的黏膜上皮细胞,且90%以上的头颈部肿瘤为鳞状细胞癌,因此将这些部分的肿瘤统称为头颈鳞状细胞癌(Head and NeckSquamous Cell Carcinoma,HNSCC)。
口腔癌和喉癌通常与吸烟、酗酒相关,而咽癌部分归因于人类乳头瘤病毒(HumanPapilloma Virus,HPV)的感染(主要为HPV-16型)。根据感染HPV与否,可将HNSCC患者分为两类:HPV阳性(HPV+HNSCC)和HPV阴性(HPV-HNSCC);通常,HPV阳性的HNSCC患者具有较好的预后。在过去的30年中,HNSCC患者的存活率有所提高,主要归因于HPV阳性的HNSCC患者的存活率有所提高;而HPV阴性的HNSCC患者的存活率并未得到改善,即现有的诊断和治疗手段并没有提高HPV阴性的HNSCC患者的存活率。
HPV阴性的HNSCC是由黏膜上皮细胞经历过度增生到异型增生再发展为侵袭性癌,但是大多数患者在临床上不会出现明显的癌前病变,确诊时往往已经发展为癌症晚期,且出现淋巴结转移,因此HPV阴性的HNSCC的预后较差。
此外,目前还没有用于筛查头颈部肿瘤的有效方案,其诊断主要依赖于对病变部位进行组织活检,以及利用影像学检测方法对患者进行病理分期。因此,迫切需要对HPV阴性的HNSCC患者的筛查和诊断方法进行改进。
发明内容
基于此,本发明提供了一种简单便捷、高灵敏度、高特异性的检测甲基化水平的试剂在制备HPV阴性头颈鳞状细胞癌的诊断产品中的应用。
具体技术方案如下:
根据本发明的一个方面,提供了检测目标区域的甲基化水平的试剂,以GRch38.p14为参考基因组,所述目标区域包括Chr2:118849988~118850355负链的全长或部分区域。
在其中一个实施例中,所述目标区域的部分区域包括区域1~2中的一个或多个:
区域1为Chr2:118849988~118850180负链,以及
区域2为Chr2:118850154~118850355负链。
在其中一个实施例中,所述试剂通过如下方法中的一种或几种实现对目标区域的检测:
甲基化特异性PCR、亚硫酸氢盐测序法、甲基化特异性微阵列法、全基因组甲基化测序法、焦磷酸测序法、甲基化特异性高效液相层析法、甲基化特异性高分辨率溶解曲线法、甲基化敏感性限制性内切酶法和荧光定量PCR法。
在其中一个实施例中,所述试剂包括检测所述目标区域的甲基化水平的核酸产品;
可选地,所述核酸产品包括引物对和检测探针中的一种或多种。
在其中一个实施例中,所述核酸产品包括如下引物对中的一对或多对:
检测区域1的甲基化引物对,核苷酸序列如SEQ ID NO.7~8所示;
检测区域1的非甲基化引物对,核苷酸序列如SEQ ID NO.9~10所示;以及
检测区域2的甲基化引物对,核苷酸序列如SEQ ID NO.11~12所示。
在其中一个实施例中,所述核酸产品包括如下引物对和检测探针的组合中的一组或多组:
(1)核苷酸序列如SEQ ID NO.13~14所示的引物对;检测探针的核苷酸序列如SEQID NO.15所示;
(2)核苷酸序列如SEQ ID NO.16~17所示的引物对,检测探针的核苷酸序列如SEQID NO.18所示;
(3)核苷酸序列如SEQ ID NO.19~20所示的引物对,检测探针的核苷酸序列如SEQID NO.21所示;
(4)核苷酸序列如SEQ ID NO.22~23所示的引物对,检测探针的核苷酸序列如SEQID NO.24所示;
(5)核苷酸序列如SEQ ID NO.25~26所示的引物对,检测探针的核苷酸序列如SEQID NO.27所示;以及
(6)核苷酸序列如SEQ ID NO.28~29所示的引物对,检测探针的核苷酸序列如SEQID NO.30所示。
在其中一个实施例中,检测的样本包括血液样本、口腔脱落细胞样本或唾液样本。
根据本发明的另一方面,提供了一种检测HPV阴性头颈鳞状细胞癌的试剂盒,包含上述任一项所述的试剂。
在其中一个实施例中,所述试剂盒中还包括核酸提取试剂、甲基化转化试剂、PCR反应试剂、测序试剂、阴性对照品和阳性对照品中的一种或多种;
可选地,所述PCR反应试剂包括扩增缓冲液、dNTPs、DNA聚合酶和Mg
根据本发明的另一方面,提供了上述任一项所述的试剂或上述任一项所述的试剂盒在制备HPV阴性的头颈鳞状细胞癌诊断产品中的应用。
与传统技术相比,本发明具有如下有益效果:
本发明通过检测Chr2:118849988~118850355负链DNA的全长或部分区域的甲基化水平,能够对不同病理分期和不同类型的HPV阴性头颈鳞状细胞癌患者进行诊断,且检测的灵敏度和特异性高,能够为HPV阴性头颈鳞状细胞癌患者的筛查和诊断提供新思路。
附图说明
为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施方式,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
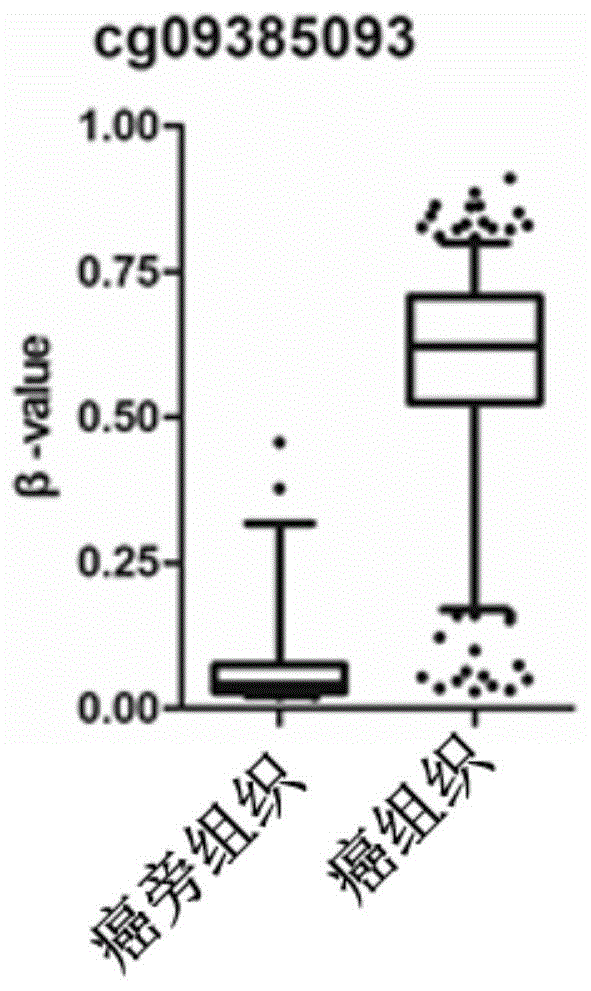
图1为cg09385093在HNSCC癌组织和癌旁正常组织中的甲基化水平的统计图。
具体实施方式
为使本发明的上述目的、特征和优点能够更加明显易懂,对本发明的具体实施方式做详细的说明。在下面的描述中阐述了很多具体细节以便于充分理解本发明。但是本发明能够以很多不同于在此描述的其它方式来实施,本领域技术人员可以在不违背本发明内涵的情况下做类似改进,因此本发明不受下面公开的具体实施例的限制。
除非另有定义,本文所使用的所有的技术和科学术语与属于本发明的技术领域的技术人员通常理解的含义相同。本文中在本发明的说明书中所使用的术语只是为了描述具体的实施例的目的,不是旨在于限制本发明。除非另有特别说明,本发明中用到的各种原材料、试剂、仪器和设备等均可通过市场购买得到或者可通过现有方法制备得到。
术语
除非另外说明或存在矛盾之处,本文中使用的术语或短语具有以下含义:
本文所使用的术语“和/或”、“或/和”、“及/或”的选择范围包括两个或两个以上相关所列项目中任一个项目,也包括相关所列项目的任意的和所有的组合,所述任意的和所有的组合包括任意的两个相关所列项目、任意的更多个相关所列项目、或者全部相关所列项目的组合。需要说明的是,当用至少两个选自“和/或”、“或/和”、“及/或”的连词组合连接至少三个项目时,应当理解,在本申请中,该技术方案毫无疑问地包括均用“逻辑与”连接的技术方案,还毫无疑问地包括均用“逻辑或”连接的技术方案。比如,“A及/或B”包括A、B和A+B三种并列方案。又比如,“A,及/或,B,及/或,C,及/或,D”的技术方案,包括A、B、C、D中任一项(也即均用“逻辑或”连接的技术方案),也包括A、B、C、D的任意的和所有的组合,也即包括A、B、C、D中任两项或任三项的组合,还包括A、B、C、D的四项组合(也即均用“逻辑与”连接的技术方案)。
本发明中涉及“多个”、“多种”、“多次”、“多元”等,如无特别限定,指在数量上大于2或等于2。例如,“一种或多种”表示一种或大于等于两种。
本文中所使用的“其组合”、“其任意组合”、“其任意组合方式”等中包括所列项目中任两个或任两个以上项目的所有合适的组合方式。
本文中,“合适的组合方式”、“合适的方式”、“任意合适的方式”等中所述“合适”,以能够实施本发明的技术方案、解决本发明的技术问题、实现本发明预期的技术效果为准。
本文中,“优选”、“更好”、“更佳”、“为宜”仅为描述效果更好的实施方式或实施例,应当理解,并不构成对本发明保护范围的限制。
本发明中,“进一步”、“更进一步”、“特别”等用于描述目的,表示内容上的差异,但并不应理解为对本发明保护范围的限制。
本发明中,“可选地”、“可选的”、“可选”,指可有可无,也即指选自“有”或“无”两种并列方案中的任一种。如果一个技术方案中出现多处“可选”,如无特别说明,且无矛盾之处或相互制约关系,则每项“可选”各自独立。
本发明中,以开放式描述的技术特征中,包括所列举特征组成的封闭式技术方案,也包括包含所列举特征的开放式技术方案。
本发明中,“诊断”包括辅助诊断、复发风险评估、癌变风险和癌变程度的评估、预后判断等方面。本发明中,诊断产品是包含任何化合物的任何产品,其可以对来自患者的生物样本进行检测,以对患者是否患有某些疾病进行诊断测定或测试。在一些情况下,该诊断产品的检测结果可以作为临床诊断的辅助或参考,或者提示患者患有某些疾病的风险。本发明中,诊断产品是包括本文中试剂的任何产品;在一些实施例中,诊断产品是本发明的试剂盒,或者诊断产品是包括本发明试剂盒和其他元件的套组,例如,其他元件可以是取样装置和/或基于其他方法的检测元件。
本发明中,“甲基化”为DNA化学修饰的一种形式,能够在不改变DNA序列的前提下,改变遗传表现。DNA甲基化是指在DNA甲基转移酶的作用下,在基因组CpG二核苷酸的胞嘧啶第5号碳位共价结合一个甲基基团。DNA甲基化能引起染色质结构、DNA构象、DNA稳定性及DNA与蛋白质相互作用方式的改变,从而控制基因表达。
本发明中,“甲基化水平”指的是一段DNA序列中一个或多个CpG二核苷酸中的胞嘧啶是否发生甲基化,或发生甲基化的频率/比例/百分数,既代表定性的概念又代表定量的概念。在实际应用中,可根据实际情况采用不同的检测指标比较DNA甲基化水平。如在一些情况下,可根据样本检测的Ct值进行比较;在一些情况下,可计算样本中基因甲基化的比例,即甲基化分子数/(甲基化分子数+非甲基化分子数)×100,然后再进行比较;在一些情况下,还对各个指标进行统计学上的分析整合,得出最终的判定指标。
本发明中,“引物”是指可以用在扩增方法(例如聚合酶链式反应PCR)中,基于与目标基因或其一部分区域相对应的多核苷酸序列来扩增目的序列的寡核苷酸。通常,用于扩增多核苷酸序列的PCR引物中的至少一个对于该多核苷酸序列是序列特异性的。引物的确切长度取决于很多因素,包括温度、引物来源以及所用方法等。例如,对于诊断和预后应用,根据靶序列的复杂度,寡核苷酸引物通常含有至少10、15、20、25或更多个核苷酸,但是也可以含有更少的核苷酸。
本发明中,“引物对”是指能与目标DNA分子的双链杂交或能与目标DNA分子中位于待扩增核苷酸序列两翼的区域杂交的一对引物。
本发明中,“TaqMan探针”是指包含5’端荧光报告基团和3’端荧光淬灭基团的一段寡核苷酸序列。当探针与DNA上的相应位点结合时,因为荧光基团附近存在淬灭基团,探针不会发出荧光。在扩增过程中,如果探针与被扩增的链结合,DNA聚合酶(如Taq酶)的5’-3’核酸外切酶活性会消化探针,荧光基团远离淬灭基团,其能量不被吸收,即产生荧光信号。每经过一个PCR循环,荧光信号也和目的片段一样,有一个同步的指数增长的过程。
本发明的一些实施方式提供了一种检测目标区域的甲基化水平,以GRch38.p14为参考基因组,上述目标区域选自Chr2:118849988~118850355负链的全长或部分区域。在其中一些实施方式中,目标区域的部分区域为区域1和区域2中的一个或多个;
区域1为Chr2:118849988~118850180的负链DNA,以及
区域2为Chr2:118850154~118850355的负链DNA。
可理解地,上述试剂可以同时检测区域1和区域2的全长或部分区域,也可以单独检测区域1或区域2的全长或部分区域。所述部分区域至少包括一个CpG二核苷酸。
在其中一些实施方式中,上述的试剂通过但不限于如下方法中的一种或几种实现对目标区域的检测:
甲基化特异性PCR、亚硫酸氢盐测序法、甲基化特异性微阵列法、全基因组甲基化测序法、焦磷酸测序法、甲基化特异性高效液相层析法、甲基化特异性高分辨率溶解曲线法、甲基化敏感性限制性内切酶法和荧光定量PCR法。
在其中一些实施方式中,试剂包括检测上述目标区域的甲基化水平的核酸产品。
可选地,核酸产品包括引物对,还可以包括与引物对对应的检测探针。
在其中一些示例中,核酸产品包括检测区域1的甲基化引物对,核苷酸序列如SEQID NO.7~8所示。
在其中一些示例中,核酸产品包括检测区域1的非甲基化引物对,核苷酸序列如SEQ ID NO.9~10所示。
在其中一些示例中,核酸产品包括检测区域2的甲基化引物对,核苷酸序列如SEQID NO.11~12所示。
在其中一些示例中,核酸产品包括检测目标区域的全长或部分区域的引物对和检测探针的组合。
在其中一个具体示例中,核酸产品包括检测Chr2:118850012~118850119负链区域的引物对和检测探针;引物对的核苷酸序列如SEQ ID NO.13~14所示,检测探针的核苷酸序列如SEQ ID NO.15所示。
在其中一个具体示例中,核酸产品包括检测Chr2:118850012~118850119负链区域的引物对和检测探针;引物对的核苷酸序列如SEQ ID NO.16~17所示,检测探针的核苷酸序列如SEQ ID NO.18所示。
在其中一个具体示例中,核酸产品包括检测Chr2:118850214~118850307负链区域的引物对和检测探针;引物对的核苷酸序列如SEQ ID NO.19~20所示,检测探针的核苷酸序列如SEQ ID NO.21所示。
在其中一个具体示例中,核酸产品包括检测Chr2:118850214~118850307负链区域的引物对和检测探针;引物对的核苷酸序列如SEQ ID NO.22~23所示,检测探针的核苷酸序列如SEQ ID NO.24所示。
在其中一个具体示例中,核酸产品包括检测Chr2:118850279~118850346负链区域的引物对和检测探针;引物对的核苷酸序列如SEQ ID NO.25~26所示,检测探针的核苷酸序列如SEQ ID NO.27所示。
在其中一个具体示例中,核酸产品包括检测Chr2:118850279~118850346负链区域的引物对和检测探针;引物对的核苷酸序列如SEQ ID NO.28~29所示,检测探针的核苷酸序列如SEQ ID NO.30所示。
进一步地,上述任一示例的检测探针为TaqMan探针;在检测探针的5’端和3’端分别标记有荧光基团和淬灭基团。
可选地,荧光基团为FAM、ROX、VIC或CY5;淬灭基团为TAMRA、BHQ或MGB。当反应体系中包括多个不同的检测探针时,每个探针含有不同的荧光基团。
在其中一些示例中,核酸产品还包括检测内参基因的引物对和对应的检测探针。
在一个具体示例中,内参基因为ACTB基因,检测内参基因ACTB的引物对的核苷酸序列如SEQ ID NO.31~32所示,对应的检测探针的核苷酸序列如SEQ ID NO.33所示。
可理解地,内参基因的检测探针标记有和目标区域的检测探针不同的荧光基团和淬灭基团。
在其中一些实施方式中,检测的样本包括血液样本、口腔脱落细胞样本或唾液样本。
本发明中,通过检测Chr2:118849988~118850355负链的全长或部分区域,能够快速、高灵敏度、高特异性地检出HPV阴性的头颈鳞状细胞癌患者样本;为HPV阴性的头颈鳞状细胞癌患者的诊断和筛查提供了新的思路。
本发明的另一些实施方式提供了一种检测头颈鳞状细胞癌的试剂盒,包含上述任一实施方式所定义的试剂。
在其中一些实施方式中,上述试剂盒中还包括核酸提取试剂、甲基化转化试剂、PCR反应试剂、测序试剂、阴性对照品和阳性对照品中的一种或多种。
可理解地,在其他一些具体示例中,上述试剂盒可以不包括核酸提取试剂、甲基化转化试剂、PCR反应试剂、测序试剂、阴性对照品和阳性对照品中的任意一些试剂,不包括的试剂可以合理从外部获得。
可选地,PCR反应试剂包括扩增缓冲液、dNTPs、DNA聚合酶和Mg
本发明将检测Chr2:118849988~118850355负链的全长或部分区域的试剂制备成试剂盒,采用该试剂盒能够快速、便捷、精确地检出头颈鳞状细胞癌。
本发明的另一些实施方式还提供了上述任一实施方式的试剂或任一实施方式的试剂盒在制备HPV阴性的头颈鳞状细胞癌诊断产品中的应用。
验证发现,上述检测目标区域甲基化水平的试剂用于检测HPV阴性的头颈鳞状细胞癌时,检测的灵敏度和特异性均较高,能够有效地区分头颈鳞状细胞癌患者和健康人。
下面将结合具体实施例和对比例对本发明作进一步说明,但不应将其理解为对本发明保护范围的限制。
实施例1:
采用桑戈尔测序法分析目标区域的甲基化水平,并检测HPV阴性的HNSCC患者组织样本的性能。具体步骤如下:
1.1样本收集
共招募106例经病理组织活检确诊的HNSCC患者(所有患者均为HPV-16和HPV-18血清抗体阴性,即未曾感染过人乳头瘤病毒16型和18型),分别获取其活检确认的癌组织样本和对应的癌旁正常组织样本。所有样本均为经过福尔马林浸泡和石蜡包埋的组织样本,所有样本的收集过程经过伦理委员会的审批,且所有志愿者在样本收集前都签署了知情同意书。上述106例HNSCC患者的病理信息如表1所示。
表1 HPV阴性的HNSCC患者的病理信息
1.2样本DNA的提取
使用QIAamp DNAFFPE Tissue Kit(56404)提取石蜡包埋的组织样本的基因组DNA,具体操作按照试剂盒说明书进行。
1.3亚硫酸氢盐转化
采用武汉艾米森生命科技有限公司核酸转化试剂(鄂汉械备20200843号)对步骤1.2中提取的DNA进行亚硫酸氢盐转化,并对转化的DNA进行纯化,用于后续实验,具体操作步骤参见试剂盒说明书。
1.4 PCR扩增及桑戈尔测序
以GRCh38为参考基因组,目标区域为Chr2:118849988~118850355负链DNA,使用PCR法扩增经亚硫酸氢盐转化和纯化的组织样本基因组中的目标区域,再将PCR扩增产物送测序公司进行桑戈尔测序。
为了有效地扩增目标区域,将其分为两个区域分别扩增:区域1(Chr2:118849988~118850180,负链)和区域2(Chr2:118850154~118850355,负链),区域1和区域2对应的未经转化、完全甲基化且经亚硫酸氢盐转化、完全未甲基化且经亚硫酸氢盐转化的DNA序列如表2所示。
表2区域1和区域2的DNA序列信息
分别以步骤1.3中提取的经亚硫酸盐转化后的DNA样本为模板;使用甲基化引物对(SEQ ID NO.7~8)和非甲基化引物对(SEQ ID NO.9~10)扩增区域1,使用简并引物(SEQID NO.11~12)扩增区域2,引物对的序列信息如表3所示。
表3用于PCR扩增和桑戈尔测序的引物信息
人工合成表3所示的所有引物对,以经亚硫酸氢盐转化和纯化的组织样本DNA为模板,按照表4的配方配置PCR反应体系,再按照表5提供的反应程序进行PCR扩增。对于每个待测样本,当扩增目标区域1时,需配置2管反应体系,分别使用甲基化引物对(SEQ ID NO.7~8)和非甲基化引物对(SEQ ID NO.9~10)进行扩增;当扩增目标区域2时,仅需配置1管反应体系,使用简并引物对(SEQ ID NO.11~12)扩增即可。PCR扩增结束后,使用与PCR扩增相同的引物对扩增产物进行桑戈尔测序,同时从5’端和3’端测序。
表4 PCR反应体系
表5 PCR扩增程序
1.5结果分析
对于经亚硫酸氢盐转化的DNA序列,若转化前的初始DNA序列上的CpG二核苷酸位点的测序结果仍为CG,则认为该位点是完全甲基化的;若初始DNA序列上的CpG二核苷酸位点的测序结果为双峰,即同时存在CG和TG,则认为该位点为部分甲基化;当初始DNA序列上的一个CpG二核苷酸位点的测序结果为TG,则认为该位点是非甲基化的。
1.5.1区域1的甲基化水平诊断HNSCC的灵敏度和特异性分析
区域1内共有17个CpG位点,若待测样本在区域1内有16个及以上的CpG位点为甲基化的(包括完全甲基化和部分甲基化),则认为该样本在区域1内为甲基化阳性;若待测样本在区域1内的17个CpG位点均为非甲基化的,则认为该样本在区域1内为甲基化阴性。
根据上述标准对本实施例中收集的212例癌组织样本和癌旁组织样本进行甲基化分析,统计分析使用桑戈尔测序法检测目标区域1来诊断HPV阴性的HNSCC患者的灵敏度和特异性。其中,209例样本测序成功、3例样本测序失败;桑戈尔测序法检测区域1的甲基化水平诊断HNSCC组织样本的灵敏度和特异性如表6和表7所示。
灵敏度为病理检测结果为癌症阳性的样本中甲基化阳性样本所占的比例,特异性为癌旁正常样本中甲基化阴性样本所占的比例。
表6区域1的甲基化水平诊断HNSCC不同组织样本
由表6可知,使用桑戈尔测序法分析区域1的甲基化水平进而诊断HPV阴性的HNSCC患者的效果良好。通过检测该区域的甲基化水平诊断HNSCC的灵敏度很高,诊断口腔癌、咽癌和喉癌的灵敏度均大于96%,检测特异性均达75%以上。
表7区域1的甲基化水平诊断不同病理分期的HNSCC组织样本
虽然收集的病理分期为Ⅰ期的样本量较少,但由表7可知,通过检测区域1的甲基化水平诊断Ⅰ期口腔癌组织样本的灵敏度达100%。此外,通过检测区域1的甲基化水平诊断其它不同分期的HNSCC同样具有较高的灵敏度。表明根据区域1的甲基化水平可以有效区分HNSCC癌组织和癌旁正常组织。
1.5.2区域2的甲基化水平诊断HNSCC的灵敏度和特异性分析
区域2内共有19个CpG位点,若待测样本在区域2内有17个及以上的CpG位点为甲基化的(包括完全甲基化和部分甲基化),则认为该样本在区域2内为甲基化阳性;若待测样本在区域2内的19个CpG位点均为非甲基化的,则认为该样本在区域2内为甲基化阴性。
根据上述标准,统计分析使用桑戈尔测序法检测目标区域2来诊断HPV阴性的HNSCC患者的灵敏度和特异性,结果如表8和表9所示。
表8区域2的甲基化水平诊断HNSCC不同组织样本
由表8可知,使用桑戈尔测序法分析目标区域内区域2的甲基化水平进而诊断HPV阴性的HNSCC患者的效果也十分优异:根据区域2的甲基化水平诊断HNSCC癌组织样本的灵敏度不低于93.94%,特异性高于82%。
由表6和表8可知,与区域1相比,根据区域2的甲基化水平诊断HNSCC的特异性相对更高。
表9区域2的甲基化水平诊断不同病理分期的HNSCC组织样本
由表9可知,通过测序分析区域2的甲基化水平诊断不同分期的HNSCC癌组织的灵敏度也较高,其对Ⅰ期和Ⅱ期癌组织样本的灵敏度不低于83.33%,而对Ⅲ期和Ⅳ期癌组织样本的检测灵敏度大于91%。
综上,Chr2:118849988~118850180负链DNA和Chr2:118850154~118850355负链DNA在超过100例HPV阴性的口腔癌、咽癌和喉癌中均为高度甲基化的,以Chr2:118849988~118850180负链DNA和Chr2:118850154~118850355负链DNA作为目标区域,通过分析目标区域的甲基化水平可高效地区分HNSCC癌组织样本和癌旁正常组织样本。
此外,发明人通过对TCGA数据库中IIlumina Human Methylation 450K芯片的甲基化数据进行分析,筛选出位于区域2的cg09385093探针,其在HNSCC癌组织和癌旁正常组织中具有显著的甲基化水平差异。如图1所示,cg09385093在癌组织中的甲基化水平明显高于其在癌旁正常组织中的甲基化水平。这一结果与本实施例1对组织样本的检测结果一致。
实施例2:
根据实施例1的结果可知,通过液体活检的方法检测所述目标区域的甲基化水平来诊断HNSCC是可行的。因此,本实施例通过荧光定量甲基化特异性PCR法(quantitativemethylation specific PCR,qMSP)检测目标区域的甲基化水平,并根据甲基化水平诊断HNSCC患者体液样本。
2.1样本收集
共招募258名志愿者(所有志愿者均为HPV-16和HPV-18血清抗体阴性),其中78例为经病理组织活检确诊为口腔鳞状细胞癌的患者、77例为经病理组织活检确诊为咽部鳞状细胞癌的患者、53名为经病理组织活检确诊为喉部鳞状细胞癌患者,其余50名志愿者为健康人。分别获取每名志愿者的血液样本和口腔脱落细胞样本(一些不愿意取口腔脱落细胞样本的患者改为取唾液样本)。所有样本的收集过程经过伦理委员会的审批,且所有志愿者在样本收集前都签署了知情同意书。上述208名癌症患者的病理分期信息如表10所示。
表10 HNSCC患者的病理分期
志愿者血浆样本、口腔脱落细胞样本和唾液样本的收集方法具体如下:
抗血浆样本的收集:从每名志愿者体内抽取大于8mL静脉血,收集的抗凝血样本经室温静置后,3000rpm离心10分钟,获得血浆样本。
口腔脱落细胞样本的收集:志愿者在取口腔脱落细胞样本前需刷牙或漱口,然后使用棉签在受试者口腔两侧、口咽部、舌面部、牙龈等部位至少刮取20次以上,再将棉签投入脱落细胞保存液中润洗,脱落细胞保存液经离心后取细胞沉淀,备用。
唾液样本的收集:志愿者在取唾液样本前需刷牙或者用清水漱口,然后要求其以舒适的姿势坐直并低头,让唾液在口中聚集10分钟左右,然后将唾液收集至无菌的50mL离心管中。收集的唾液样本在4℃、500g的条件下离心10分钟,弃上清液后取细胞沉淀,即口腔脱落细胞样本,冻存备用。
2.2样本DNA的提取
使用天根生化科技(北京)有限公司的磁珠法血清/血浆游离DNA(cfDNA)提取试剂盒(DP709)进行提取血浆样本的cfDNA,具体操作按照试剂盒说明书进行。
使用天根生化科技(北京)有限公司的血液/细胞/组织基因组DNA提取试剂盒(DP304)对口腔脱落细胞样本的基因组DNA进行提取,具体操作按照说明书进行。
2.3样本DNA的转化
采用武汉艾米森生命科技有限公司的核酸转化试剂(鄂汉械备20200843号)对所有样本DNA进行转化,并对转化后的DNA进行纯化,具体操作步骤参见试剂盒说明书。
2.4 qMSP反应
针对区域1和区域2的部分区域设计用于甲基化特异性荧光定量PCR的引物对和TaqMan检测探针,引物对和检测探针的组合及序列信息如表11所示。上述的引物对具有良好的扩增特异性,仅扩增发生甲基化的DNA模板,而不扩增未发生甲基化的DNA模板,同时其也不会引起其它非特异性扩增;并且上述的引物对具有良好的扩增效率,即其对各个目标区域的扩增效率在90%~110%之间。
表11甲基化检测引物对和检测探针
基于TaqMan探针的qMSP反应可以实现在一个反应体系中同时检测多个目标基因,只需每个目标基因特异性的检测探针5’端所携带的荧光基团不同即可。本实施例中,每个qMSP反应体系需检测2个靶基因:目标区域和内参基因ACTB。用于扩增目标区域的TaqMan探针5’端的荧光基团为FAM,其3’端为非荧光淬灭基团NFQ;用于扩增内参基因ACTB的TaqMan探针5’端的荧光基团为ROX,3’端荧光淬灭基团为BHQ。
以步骤2.3中经亚硫酸氢盐转化后的DNA为模板,使用表11所示的引物对和探针进行qMSP反应,扩增体系如表12所示,反应程序如表13所示。
表12 qMSP反应体系
表13 qMSP反应程序
在对每个样本进行qMSP反应时,均需提前检测内参基因ACTB的量,用以监测样本质量及结果判读。在每块PCR反应板内,还需要同时设置阳性对照孔和阴性对照孔。阳性对照孔的DNA模板为10
qMSP反应结束后,调整基线(一般将第3~15个循环所对应的信号值设置为基线水平),并设置阈值(阈值必须位于指数扩增期内),穿越阈值且与X轴平行的直线称为阈值线,阈值线与扩增曲线的交点所对应的循环数即为Ct值。
qMSP反应的结果满足如下条件则认为检测结果可信,否则当次实验无效:①阴性对照管无扩增(即不起线);②阳性对照PCR管有明显的指数增长期,且阳性对照PCR管中目标基因的Ct值在26~30之间;③待测样本的内参基因ACTB的Ct值小于等于33。
2.5结果分析
2.5.1 qMSP法检测区域1或区域2的甲基化水平诊断HNSCC血浆样本的灵敏度和特异性
对于血浆样本,阳性判断值为45,若使用其中一组引物组合进行扩增的Ct值≤45,认为该样本在此扩增区域为甲基化阳性;若使用其中一组引物组合进行扩增的Ct值>45,认为该样本在此扩增区域为甲基化阴性。
根据上述标准,获取区域1和区域2的甲基化水平,并分析通过qMSP法检测区域1或区域2的甲基化水平从而诊断HNSCC血浆样本的灵敏度和特异性,结果如表14所示。
表14 qMSP法检测区域1或区域2的甲基化水平诊断HNSCC血浆样本
由上表可知,使用引物组合1~6进行qMSP反应,检测区域1或区域2的甲基化水平能够有效地区分HNSCC患者的血浆样本和健康人的血浆样本。
检测区域1甲基化水平的引物组合1和引物组合2的检测效果相当:引物组合1和引物组合2用于检测口腔癌血浆样本的灵敏度分别为78.21%和79.49%;检测咽癌血浆样本的灵敏度分别67.53%和66.23%;检测喉癌血浆样本的灵敏度均为66.04%;两个引物组合的检测特异性均为96%。
检测区域2甲基化水平的引物组合3~6的检测效果也没有明显差异:引物组合3~6检测口腔癌血浆样本的灵敏度介于71.79%~73.08%之间,检测咽癌血浆样本的灵敏度介于71.43%~74.03%之间,检测喉癌血浆样本的灵敏度介于71.70%~75.47%之间,检测HNSCC的特异性介于96%~98%之间。
综上,通过检测区域1的甲基化水平诊断口腔癌血浆样本的灵敏度高于区域2;而检测区域2的甲基化水平诊断咽癌和喉癌的灵敏度高于区域1。
2.5.2 qMSP法检测区域1或区域2的甲基化水平诊断HNSCC口腔脱落细胞样本的灵敏度和特异性
对于口腔脱落细胞样本,阳性判断值为37,若使用其中一组引物组合进行扩增的Ct值≤37,认为该样本在此扩增区域为甲基化阳性;若其中一组引物组合进行扩增的Ct值>37,认为该样本在此扩增区域为甲基化阴性。
通过qMSP法检测区域1或区域2的甲基化水平从而诊断HNSCC口腔脱落细胞样本的灵敏度和特异性,结果如表15所示。
表15 qMSP法检测区域1或区域2的甲基化水平诊断HNSCC口腔脱落细胞样本
由上表可知,使用引物组合1~6进行qMSP反应,检测区域1或区域2的甲基化水平能够有效地区分HNSCC患者的口腔脱落细胞样本和口腔脱落细胞样本。
与血浆样本的检测结果类似,检测区域1甲基化水平的引物组合1和引物组合2的检测效果相当:引物组合1和引物组合2用于检测口腔脱落细胞样本的灵敏度均为91.03%;检测口腔脱落细胞样本的灵敏度均为75.32%;检测喉癌口腔脱落细胞样本的灵敏度分别为73.58%和75.47%;两个引物组合的检测特异性均分别为92%和94%。
检测区域2甲基化水平的引物组合3~6的检测效果无明显差异:引物组合3~6检测口腔癌脱落样本的灵敏度介于83.33%~85.90%之间,检测咽癌脱落样本的灵敏度介于79.22%~81.82%之间,检测喉癌脱落样本的灵敏度介于79.25%~83.02%之间,而检测HNSCC的特异性介于94%~98%之间。
上述对口腔脱落细胞样本的检测结果与血浆样本的检测结果一致,通过检测区域1的甲基化水平诊断口腔癌脱落样本的灵敏度高于区域2;而检测区域2的甲基化水平诊断咽癌和喉癌脱落样本的灵敏度高于区域2。
实施例3:
通过荧光定量甲基化特异性PCR法,分析区域1和区域2联合检测HPV阴性HNSCC患者体液样本的性能。
由实施例2可知,区域1对于口腔癌样本的检出率优于区域2,而区域2对咽癌和喉癌样本的检出率优于区域1,两个区域的检测性能可能具有协同效应。因此,基于实施例2中516例样本(258例血浆样本和258例脱落细胞样本)的qMSP检测结果进行分析;联合检测区域1和区域2时,甲基化阳性样本的判断标准与单个区域的判断标准不同,具体判断标准如下:
对于血浆样本,若qMSP法扩增区域1的Ct值≤45,认为区域1为甲基化阳性,若qMSP法扩增区域1的Ct值>45,认为区域1为甲基化阴性,区域2的判定同上。若某一待测样本的区域1或区域2中至少一个为甲基化阳性,则认为该样本为HNSCC阳性样本;反之则为HNSCC阴性样本。
对于脱落细胞样本,若qMSP法扩增区域1的Ct值≤37,认为区域1为甲基化阳性,若qMSP法扩增区域1的Ct值>37,认为区域1为甲基化阴性,区域2的判定同上。若某一待测样本的区域1或区域2中至少一个为甲基化阳性,则认为该样本为HNSCC阳性样本;反之则为HNSCC阴性样本。
3.1区域1和区域2联合检测HPV阴性HNSCC患者血浆样本的性能
选择扩增区域1的引物组合2和扩增区域2的引物组合6进行qMSP反应,从而分析两个区域联合检测HNSCC血浆样本的效果。区域1和区域2单独检测或联合检测不同病理分期的HNSCC患者血浆样本的灵敏度、特异性如表16~17所示。
表16区域1、区域2单独或联合检测不同病理分期的HNSCC血浆样本的灵敏度
由表16可知,区域1或区域2单独检测HNSCC患者血浆样本的灵敏度较好,但是其检测Ⅰ期和Ⅱ期HNSCC患者血浆样本的灵敏度相对较低,这可能与癌症早期时,肿瘤细胞释放到血液中的游离DNA的量较少有关。
区域1和2联合检测Ⅰ期口腔癌、咽癌、喉癌血浆样本的灵敏度分别为66.67%、66.67%和62.50%;检测Ⅱ期HNSCC血浆样本的灵敏度分别为84.00%、73.33%和83.33%;检测Ⅲ期和Ⅳ期所述3种HNSCC血浆样本的灵敏度均高于80%。表明区域1和2联合检测的效果明显优于单个区域的检测效果。
表17区域1、区域2单独或联合检测HNSCC血浆样本的灵敏度和特异性
由表17可知,区域1、区域2联合检测HNSCC患者血浆样本的灵敏度相较于单区域诊断有了明显的提升。具体地,区域1和2联合检测口腔癌、咽癌和喉癌患者血浆样本的灵敏度可分别提高至84.62%、79.22%和81.13%,其检测健康人血浆样本的特异性为94%。
3.2区域1和区域2联合检测HPV阴性HNSCC患者脱落细胞样本的性能
与血浆样本的检测方法相似,选择扩增区域1的引物组合2和扩增区域2的引物组合6进行qMSP反应,从而分析两个区域联合检测HNSCC脱落细胞样本的效果。结果如表18~19所示。
表18区域1、区域2单独或联合检测不同病理分期的HNSCC脱落细胞样本的灵敏度
由表18可知,通过区域1或区域2的甲基化水平诊断Ⅲ期和Ⅳ期HNSCC患者脱落细胞样本的灵敏度优于其各自检测Ⅰ期和Ⅱ期样本的灵敏度。此外,由表16和表18可知,通过检测脱落细胞样本诊断HNSCC患者,对于不同癌症类型、不同病理分期的检测灵敏度均高于血浆样本。
同时,与单独检测相比,区域1、区域2联合检测Ⅰ期和Ⅱ期HNSCC患者脱落细胞样本的灵敏度有明显的提升,其检测Ⅰ期口腔癌、咽癌和喉癌患者脱落细胞样本的灵敏度分别为80.95%、83.33%和75%,其检测Ⅱ期口腔癌、咽癌和喉癌患者脱落细胞样本的灵敏度分别为100%、80%和83.33%。另外,区域1和2联合检测Ⅲ期和Ⅳ期的不同病理分期HNSCC脱落细胞样本的灵敏度均不低于88.89%。
表19区域1、区域2单独或联合检测HNSCC脱落细胞样本的灵敏度和特异性
由表19可知,区域1、区域2联合检测HNSCC患者脱落细胞样本的灵敏度相较于单区域诊断的效果更佳。具体地,区域1和2联合检测口腔癌、咽癌和喉癌患者脱落细胞样本的灵敏度可分别提高至94.87%、88.31%和88.68%,其检测健康人脱落细胞样本的特异性为92%。
综上,通过联合检测区域1和区域2的甲基化水平,从而诊断HNSCC患者的体液样本具有灵敏度高、特异性高等优点;并且,通过检测上述区域的甲基化水平能够特异性地对早期病变样本进行检测。
本发明的上述实施例提供了基于血浆样本或脱落细胞样本诊断或辅助诊断头颈鳞状细胞癌的试剂,通过检测受试者样本中Chr2:118849988~118850180负链DNA区域和Chr2:118850154~118850355负链DNA区域中的一个或多个区域的甲基化水平,从而诊断患者是否患有头颈部鳞状细胞癌,具有高灵敏度和高特异性等优点,能够为HPV阴性HNSCC患者的诊断和筛查提供新的思路。
以上所述实施例的各技术特征可以进行任意的组合,为使描述简洁,未对上述实施例中的各个技术特征所有可能的组合都进行描述,然而,只要这些技术特征的组合不存在矛盾,都应当认为是本说明书记载的范围。
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
- 检测甲基化水平的试剂在制备膀胱癌诊断产品中的应用以及膀胱癌诊断试剂盒
- 检测FOXO6基因中目标区域的甲基化水平的试剂在制备膀胱癌诊断产品中的应用
