一种肾细胞癌的生物标志物及其应用
文献发布时间:2024-04-18 19:58:30
技术领域
本发明涉及生物医药技术领域,特别是涉及一种肾细胞癌的生物标志物及其应用。
背景技术
肾细胞癌(RCC)是泌尿系统常见的恶性肿瘤,发病率仅次于前列腺癌和膀胱癌,近20年来呈持续上升趋势。
原发性肾细胞癌的主要治疗方法是根治性肾切除术。然而,尽管及时进行手术,近三分之一的患者最终会复发。因此确定调控RCC进展的关键机制对于预测RCC的复发和潜在治疗至关重要。
在哺乳动物细胞中,基因表达受到一个复杂网络的调控。该网络的主要组成部分是非编码RNA(ncRNA)。大约80%的人类基因组序列可以转录成ncRNA。环状RNA(circRNAs)是一种新发现的非编码RNA(ncRNAs)。环状RNA(circRNA)是一个重要的ncRNA亚家族,它具有独特的共价、单链、闭环结构,缺乏信使RNA(mRNA)的典型5'帽和3'poly-A尾。越来越多的证据表明,环状RNA可能在各种恶性肿瘤的发病机制中发挥关键作用。已经发现在RCC的发展和进展过程中,某些circRNA发挥着不可或缺的作用。本发明旨在挖掘肾癌潜在的生物标志物和新的治疗靶点的信息。
发明内容
本发明的目的是提供一种肾细胞癌的生物标志物及其应用,以解决上述现有技术存在的问题,该生物标志物可以有效预测肾细胞癌,为肾细胞癌提供了新的诊断标志物。
为实现上述目的,本发明提供了如下方案:
本发明提供一种肾细胞癌的生物标志物,所述生物标志物为环状RNAcirc0003856,其核苷酸全序列如SEQ ID NO.1所示,成环序列如SEQ ID NO.2所示。
本发明还提供检测上述的生物标志物的试剂在制备肾细胞癌的诊断试剂盒中的应用。
进一步地,所述试剂包括核苷酸序列如SEQ ID NO.6-7所示的引物对。
本发明还提供一种肾细胞癌的诊断试剂盒,包括检测上述生物标志物的试剂。
进一步地,所述试剂包括核苷酸序列如SEQ ID NO.6-7所示的引物对。
本发明还提供降低环状RNAcirc0003856表达量的试剂在制备治疗肾细胞癌的药物中的应用,所述环状RNAcirc0003856的核苷酸全序列如SEQ ID NO.1所示,成环序列如SEQ ID NO.2所示。
进一步地,所述试剂为干扰RNA;所述干扰RNA的正义链如SEQ ID NO.13所示,反义链如SEQ ID NO.14所示。
本发明还提供一种治疗肾细胞癌的药物,包括降低环状RNAcirc0003856表达量的试剂。
进一步地,所述试剂为干扰RNA;所述干扰RNA的正义链如SEQ ID NO.13所示,反义链如SEQ ID NO.14所示。
进一步地,所述药物还包括药学上可接受的辅料。
本发明公开了以下技术效果:
本发明研究发现环状RNAcirc0003856可以作为肾细胞癌的生物标志物,利用受试者工作特征曲线分析环状RNAcirc0003856对肾细胞癌的预测价值,可以得到AUC=0.86,显示环状RNAcirc0003856对肾细胞癌的预测价值较高。
本发明还发现降低环状RNAcirc0003856表达量,可显著抑制肾癌细胞的细胞活力,促进肾癌细胞凋亡,并抑制肾癌细胞的迁移和侵袭能力,因此环状RNAcirc0003856可以作为新的肾细胞癌的治疗靶点。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
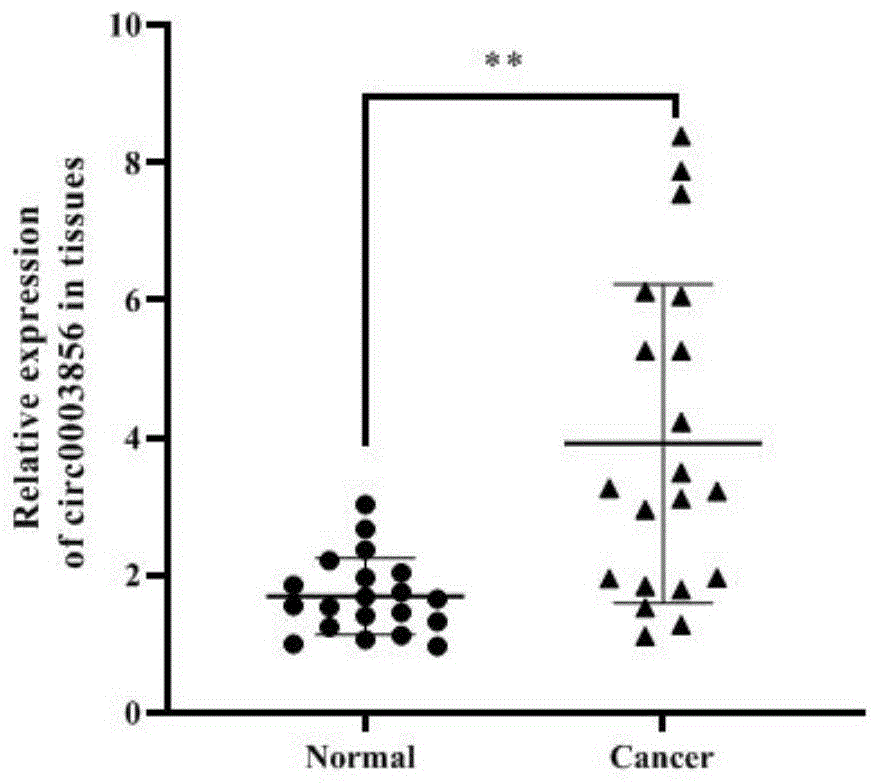
图1为qPCR检测肾细胞癌和癌旁患者组织中circ0003856表达水平的结果;
图2为circ0003856的受试者工作特征曲线;
图3为3条circRNA的干扰效率验证结果;NC代表空白对照,1-3分别代表合成的3条干扰序列hsa_circ_0003856-si1、hsa_circ_0003856-si2和hsa_circ_0003856-si3;
图4为CCK8检测各组细胞的增殖水平结果;其中,KC:肾癌细胞;antag是miR-140-5p的抑制剂;
图5为各组细胞的学显微镜观察结果;其中,图中标尺均为20μm;
图6为各组细胞凋亡水平定量图;
图7为Transwell小室实验检测各组细胞的迁移图像(A)和定量统计结果(B);
图8为Transwell小室实验检测各组细胞的侵袭图像(A)和定量统计结果(B)。
具体实施方式
现详细说明本发明的多种示例性实施方式,该详细说明不应认为是对本发明的限制,而应理解为是对本发明的某些方面、特性和实施方案的更详细的描述。
应理解本发明中所述的术语仅仅是为描述特别的实施方式,并非用于限制本发明。另外,对于本发明中的数值范围,应理解为还具体公开了该范围的上限和下限之间的每个中间值。在任何陈述值或陈述范围内的中间值,以及任何其他陈述值或在所述范围内的中间值之间的每个较小的范围也包括在本发明内。这些较小范围的上限和下限可独立地包括或排除在范围内。
除非另有说明,否则本文使用的所有技术和科学术语具有本发明所述领域的常规技术人员通常理解的相同含义。虽然本发明仅描述了优选的方法和材料,但是在本发明的实施或测试中也可以使用与本文所述相似或等同的任何方法和材料。本说明书中提到的所有文献通过引用并入,用以公开和描述与所述文献相关的方法和/或材料。在与任何并入的文献冲突时,以本说明书的内容为准。
在不背离本发明的范围或精神的情况下,可对本发明说明书的具体实施方式做多种改进和变化,这对本领域技术人员而言是显而易见的。由本发明的说明书得到的其他实施方式对技术人员而言是显而易见得的。本发明说明书和实施例仅是示例性的。
关于本文中所使用的“包含”、“包括”、“具有”、“含有”等等,均为开放性的用语,即意指包含但不限于。
本发明所指的circ0003856,是一种环状RNA,其核苷酸全序列如SEQ ID NO.1所示,成环序列如SEQ ID NO.2所示。本发明所指的miR-140-5p,核苷酸序列如SEQ ID NO.3所示。
SEQ ID NO.1:
GTAATCAATATTATCAATGCTGCCCAGGAAAGTAGTCCCATGCCTGTGACAGAAGCCCTAGACCGTGTGCTGGAAATTCTAAGAACCACTGAGTTATATTCACCACAGTTTGGTGCTAAAGATGATGATCCCCATGCCAATGACCTTGTTGGGGGCTTAATGTCTGTAAGTATATTTGACTAGACTCTTGGCTAGAGCCTGTCTGTTCTTGGTTGTTTTCTCAGAGGTTATTCACTTAAACAGATATTGAAGAGGCAGGCAGGGCTCTGTAGGGTTCAGTCAAGACCTAAACTCTCCTCCATTGCCTGGGTTCTGCTATTCTCTGGCCAAGCACCCACCTGCTGCCTGCCTCCTAGGGAGAGCTTAGCTTGGAGCAGAGCAGGGAGGAATGTAATCCTGACAGTCTGCTGAGCACCAGTTCTCCAGTGTTGCTTAGGGCTTCTACAGTAGTTTATCTAAATAAAGCTTGTTTAGTTGTATTAAAGATCTTCAAAACTGGGACAGTGTAGAACAGAAAGATTGTCTTTCTCCCGCCATATGTATTTAAAATGGTGCCGGGGGTGCAACAGTTTGGCCTTCAAAGCATCCCACACACATTTAGATGACTGTAGGAAAGAGGGATTTGGGAATCTTTCACTAGAAGGGGGCTTTGTGTCATAGACTCTTGAGGGGTCCTGGATGCCTCCTTCAGCATGTCTGGTGTAGAGCTCTCACAAGAGAGGGACAACTTTGTGCAGCACAGATTATTCCATTGCTCTCTGTCAGCTTTTGTCTTGGTCAGAAGCAAAATCCACCTCCCTCCCAATTACTGCTTTCTGAAGTCACTGGATTTTA TAAAAATAAGGTTCCAGGCAGAAATCTAGAAGGTAGAGTGTTTACAATGCTGATAATATCTCACTGTGGTCTTGCCTATTTGAGACAGGGTCTCCTCCAGACTGCAGGTAAGAGGTGAAAATGATGAGGGATGGGGGTAGGATAGTGTCCTGGAGGCGAGCAGATGAGAATAGCCACAGGACTGGAGAAAAGGGGCTGCTGAGAGTACGGGTTTGGGCCAGGTGGTCTGGAAGCAGTGGTGAGGAGCCCAGGAGAGTCAACTGTGGGGAATGAGGTCACTTATGAGGTGAGAGAGGAGCTAATGTTTCCAGGAAAGCCTCGTGTCCTCAGAGTGAGGAGGGTTGCACGAAAATGGAGGAGAAGGACTGAGGGCAGAGCACAGTTGTCCCTAAGAAACCAAATGGTCCTGGAGTGCAAGCAAGAATGCTGGGCTTAAAGACCACCCACCCCTCAAAAGATGCAGGCTCACCTCCCGGGTGTTGACCTTGCTCCTGAGTTTAGCTTCCAACAGGGCCAGGACCATCCTTCCCAGCATTAGCCTGTTGTGCTCTCCAGTAAGTGACTGAGGTCAGTGGTCAATCACAGGGGTGGACCTGCTGGGCCCAGGGCAGCCTTGAGTGCATTGGTGGAGAGGGCTGCCCTGAGTTGTCCTGTGGGAGGACCACCTGGAGTTTCCAGGAAGGAAAGAATAGTTGTGACTTTTCTTTTTCTTGTTTCCTTGATTTTTATCAGGATGGTTTGCGAAGACTATCAGGGAATGAATATGTTCTTTCAACAAAAA。
SEQ ID NO.2:
GTAATCAATATTATCAATGCTGCCCAGGAAAGTAGTCCCATGCCTGTGACAGAAGCCCTAGACCGTGTGCTGGAAATTCTAAGAACCACTGAGTTATATTCACCACAGTTTGGTGCTAAAGATGATGATCCCCATGCCAATGACCTTGTTGGGGGCTTAATGTCTGATGGTTTGCGAAGACTATCAGGGAATGAATATGTTCTTTCAACAAAAA。
SEQ ID NO.3:
TGTGTCTCTCTCTGTGTCCTGCCAGTGGTTTTACCCTATGGTAGGTTACGTCATGCTG TTCTACCACAGGGTAGAACCACGGACAGGATACCGGGGCACC。
实施例1
1.方法
利用circRNA测序技术,从5例肾细胞癌组织样本和5例癌旁组织样本中筛选差异circRNAs,最终筛选得到一个目标circRNA,即circ0003856。另取其他肾细胞癌组织样本20例,癌旁组织20例,对circ0003856进行qPCR验证。
qPCR验证方法如下:
(1)Trizol法提取RNA
a.取-80℃冰箱中保存的新鲜冰冻组织,重量约为100mg,加入1mLTrizol试剂,用匀浆器研磨成浆,移至无RNase的1.5mL EP管中,裂解10min。
b.加入200μL氯仿,剧烈颠倒混匀数次,室温放置5分钟。
c.4℃,12000rpm,离心15min,可见分成上(RNA)中(蛋白)下(DNA)三相。
d.转移上层水相于另一新1.5mL EP管中,加入400μL异丙醇,混匀后室温静置10min。
e.4℃,12000rpm,离心10min,管底可见白色的RNA沉淀。
f.弃上清,加入无RNase的75%乙醇1mL,涡旋混匀后,4℃,10000rpm,离心5min。
g.重复步骤6一次。
h.弃上清,空气中干燥RNA沉淀5min,将沉淀溶于20μLDEPC水中。
i.取溶解后的RNA2μL用微量分光光度计测定OD
根据OD
将总RNA放于-80℃冰箱内保存以备用。
(2)RT逆转录成cDNA
逆转录反应体系如表1所示:
表1逆转录反应体系
反应条件如表2所示:
表2逆转录反应条件
(3)实时荧光定量PCR检测
复孔重复数:3;cDNA稀释倍数:5。
反应体系如表3所示:
表3实时荧光定量PCR反应体系
反应程序如表4所示:
表4实时荧光定量PCR反应程序
引物序列如表5所示:
表5引物序列表
2.结果
qPCR验证的结果如图1所示,结果显示,整体上肾细胞癌组织中circ0003856的表达相比癌旁组织高。利用受试者工作特征曲线分析circ0003856对肾细胞癌的预测价值,结果见图2,可以得到AUC=0.86,显示circ0003856对肾细胞癌的预测价值较高。
实施例2
敲低circ0003856后,利用CCK8实验检测circ0003856对肾癌细胞的调控作用:
1.siRNA的设计
设计到3条siRNA:
hsa_circ_0003856-si1:正义链为CUUUCAACAAAAAGUAAUCTT(SEQ ID NO.8);反义链为GAUUACUUUUUGUUGAAAGTT(SEQ ID NO.9);
hsa_circ_0003856-si2:正义链为CAAAAAGUAAUCAAUAUUATT(SEQ ID NO.10);反义链为UAAUAUUGAUUACUUUUUGTT(SEQ ID NO.11);
hsa_circ_0003856-si3:正义链为CAAUCAACUUUAAGUAAUATT(SEQ ID NO.12);反义链为ACAATTCUUUAAGUUGAAAGTT(SEQ ID NO.13)。
空白对照NC:正义链为UUCUCCGAACGUGUCACGUTT(SEQ ID NO.14);反义链为ACGUGACACGUUCGGAGAATT(SEQ ID NO.15)。
2.circ0003856干扰序列效率验证
qPCR步骤以及引物同实施例1。
转染过程为:
(1)取冻存的肾癌细胞Osp-C2细胞,37℃快速解冻后,1200r/min离心5min,用DMEM培养基清洗2次,用DMEM基础培养基重悬后再离心。
(2)加入完全培养基进行培养,每天换一次培养基。
(3)观察细胞生长状况,长满后备用。
(4)待细胞长满后调整细胞浓度为2×10
(5)细胞贴壁后按照转染试剂Lipofectamine
a)用25μL无血清培养基稀释母液为20μM的siRNA(用量为40pmol),轻轻混匀;
b)取1.6μL Lip 3000,加入A液中,轻轻混匀,室温孵育15min。
(6)将培养上清液吸掉,PBS清洗细胞。
(7)按组别每孔分别加入各组别转染溶液,补基础培养基至500μL。
(8)37℃,5%CO
circ0003856干扰序列效率验证结果见图3,实验结果表明hsa_circ_0003856-si1干扰效果最好,hsa_circ_0003856-si2次之。后续实验选择hsa_circ_0003856-si1进行相关实验。
3.细胞实验
设置4个实验组:
实验组1:Osp-C2细胞生长到对数期后,给予si-NC转染,培养54h;
实验组2:Osp-C2细胞生长到对数期后,给予si-circ0003856转染,培养54h;
实验组3:Osp-C2细胞生长到对数期后,给予si-circ0003856转染后6小时后,再给予antag-NC处理,并继续培养48h;
实验组4:Osp-C2细胞生长到对数期后,给予si-circ0003856转染后6小时后,再给予antag-miR-140-5p处理,并继续培养48h。
4.CCK8实验检测circ0003856对肾癌细胞的调控作用
各组Osp-C2细胞转染并培养后,每孔加入10μL CCK8,37℃培养4h,酶标仪测定各孔吸光值OD
实验结果如图4所示,结果显示,相比对照组,敲低circ0003856可显著抑制肾癌细胞的细胞活力,同时抑制miR-140-5p后上述现象被逆转,肾癌细胞活力恢复,增殖水平升高。
5.TUNEL细胞凋亡检测实验
各组Osp-C2细胞转染并培养后,制备细胞切片,进行如下操作:
(1)细胞切片用二甲苯浸洗2次,每次5min。
(2)用梯度乙醇(100、95、90、80、70%)各浸洗1次,每次3min。
(3)PBS漂洗2次用ProteinaseK工作液(20μg/mL),在37℃处理组织15min。
(4)加入PBS,室温反应5min,PBS漂洗2次。
(5)制备TUNEL反应混合液,处理组用50μLTdT、450μL荧光素标计的dUTP液混匀,而阴性对照组仅加50μL荧光素标记的dUTP液,阳性对照组先加入100μLDNase 1,25℃下反应10min,后面步骤同处理组。
(6)玻片干后,用滤纸小心吸去切片周围多余液体,加50μLTUNEL反应混合液(阴性对照组仅加50μL荧光素标记的dUTP液),于标本上,加盖玻片(或封口膜)在暗湿盒中反应37℃,1h。
(7)加入已预热到37℃的洗涤与终止反应缓冲液,37℃保温30min,PBS漂洗3次。
(8)可以加1滴PBS在荧光显微镜下计数凋广细胞(激发光波长为450~500nm,检测波长头515~565nm)。
(9)玻片干后加50μLDIG-POD干标本上,加盖玻片或封口膜,在暗漏盒中反应37℃,30min。
(10)PBS漂洗3次;在组织外加100μLDAB(3,3′二氨基联苯胺四盐酸盐)底物,20℃反应10min。
(11)PBS漂洗3次;拍照后再用苏木素(或甲基绿)复染,几秒后立即用自来水冲洗。梯度酒精脱水、二甲苯透明、中性树胶封片。
(12)加一滴PBS(或甘油)在视野下,用光学显微镜观察凋亡细胞(共计200~500个细胞)并拍照。
实验结果如图5-6所示,荧光显微镜下组织切片上凋亡的细胞呈红色荧光,细胞核呈蓝色荧光;敲低circ 0003856后细胞凋亡水平增加,而同时加入miR-140-5p抑制剂后细胞凋亡水平又降低,表现出相反的趋势。
6.Transwell检测细胞的迁移
各组Osp-C2细胞转染并培养后,进行如下检测:
(1)取处理好的各组细胞,加入3mL的PBS清洗细胞,0.25%胰酶分别消化收集,1000rpm,5min离心,去上清,PBS润洗两次,清洗掉残余血清。
(2)无血清MEM培养基重悬细胞,细胞计数板计数,无血清培养基稀释细胞浓度至2×10
(3)在24孔板中预先加入800μL 10%FBS的MEM培养基(含双抗),并放入transwell小室,1h后在transwell上室分别接入200μL各组细胞悬液,37℃,5%CO
(4)取出transwell,用PBS小心清洗小室一遍,用70%冰乙醇溶液固定细胞1h。
(5)用0.5%结晶紫染液染色,室温中放置20min,PBS清洗一下,用干净的棉球将上室一侧的未迁移的细胞擦干净,显微镜下观察拍照。
实验结果如图7所示,与对照组相比,敲低circ0003856可显著抑制肾癌细胞的迁移能力,同时抑制miR-140-5p肾癌细胞的迁移出现能力增强,迁移数增多。
7.Tranwell检测各组细胞的侵袭能力
各组Osp-C2细胞转染并培养后,进行如下检测:
(1)取处理好的各组细胞,加入3mL的PBS清洗细胞,0.25%胰酶分别消化收集,1000rpm,5min离心,去上清,PBS润洗两次,清洗掉残余血清;
(2)无血清MEM培养基重悬细胞,细胞计数板计数,无血清培养基稀释细胞浓度至2×10
(3)将Matrigel在4℃提前一天融化,transwell小室、24孔培养板和枪头在-20℃过夜预冷;
(4)用的无血清培养基稀释Matrigel至终浓度1mg/mL,冰上操作;
(5)在24孔板中加入4℃预冷800μL 10%FBS的MEM培养基(含双抗),并放入transwell小室,在transwell小室上室底部中央垂直加入100μL终浓度为1mg/mL的Matrigel,37℃温育4h使其干成胶状,待Matrigel干成胶状后在transwell上室分别接入200μL各组细胞悬液,37℃,5%CO
(6)取出transwell,用PBS小心清洗小室一遍,用70%冰乙醇溶液固定细胞1h;
(7)用0.5%结晶紫染液染色,室温中放置20min,PBS清洗一下,用干净的棉球将上室一侧的未迁移的细胞擦干净,显微镜下观察拍照。
结果如图8所示,与对照组相比,circ0003856敲除后肾癌细胞的侵袭能力下降,同时抑制miR-140-5p后肾癌细胞的侵袭能力增强。
以上所述的实施例仅是对本发明的优选方式进行描述,并非对本发明的范围进行限定,在不脱离本发明设计精神的前提下,本领域普通技术人员对本发明的技术方案做出的各种变形和改进,均应落入本发明权利要求书确定的保护范围内。
- 一种与肝癌相关的非编码RNA生物标志物及其应用
- 一种用于类风湿性关节炎诊断的生物标志物及其应用
- 一种检测阿尔茨海默症标志物的拉曼生物传感器及其制备方法和应用
- 一种用于区别肝癌和非肝癌的肠道微生物基因标志物及其应用
- 一种检测肾细胞癌甲基化生物标志物的引物的应用
- 一种透明细胞肾细胞癌诊断用生物标志物及其检测试剂和应用
