一种预防和治疗癌症的药物组合物及其应用
文献发布时间:2023-06-19 10:21:15
技术领域
本发明属于生物医药领域,涉及一种预防和治疗癌症的药物组合物及其应用,特别是涉及一种预防和治疗前列腺癌的药物组合物及其应用。
背景技术
现有研究发现,线粒体能量代谢异常与肿瘤发生密切相关。在肿瘤细胞中,由于细胞处于低分化状态或者环境因素引起线粒体有氧呼吸受抑制或被破坏,而糖酵解途径取而代之。该现象被称为瓦氏效应(Warburg effect),早在20世纪20年代即已提出,在越来越多的肿瘤类型中被证实。肿瘤细胞能量代谢最近受到极大关注,相关蛋白被认为是新的肿瘤标志物。认识肿瘤细胞的能量代谢对肿瘤的早期诊断和靶向治疗具有重要意义。
无论是哪种呼吸模式,线粒体内和胞浆内产生的ATP都是由ANT蛋白(Adeninenucleotide translocase,腺苷酸转运体)进行交换的。ANTs是一种线粒体内膜蛋白,对于肿瘤细胞生长时的能量代谢改变至关重要。人的ANT家族蛋白包括四个亚基:ANT1-4;ANT1、ANT2、ANT3的结构非常同源;而ANT4则和其他三个亚基大约有60%的蛋白序列同源。每个ANT亚型因细胞特异组织特异,在不同的发育和分化阶段均有不同表达。ANT1主要表达在肌肉组织、心脏和大脑内;ANT3则在所有的细胞中存在广泛表达;ANT4主要在睾丸和精子中特异存在;ANT2特异地在低分化细胞如淋巴细胞或有在分化能力的细胞如肾脏细胞和肝脏细胞中表达。有研究发现:ANT2在肿瘤细胞中异常分布,在乳腺癌、非小细胞肺癌以及肝癌,特别是激素相关的癌症中高表达,然而,ANT2对于肿瘤细胞发生发展的相关性以及作用机制并不明确。
前列腺癌(prostate cancer,PCa)是泌尿系统最常见的肿瘤之一,发病率也在逐年上升。虽然手术、根治性放疗等治疗手段对于早期局限性前列腺癌有很好的疗效,但对于采取内分泌治疗的前列腺癌患者,其治疗中位缓解时间18-24个月后逐渐发展为去势抵抗前列腺癌(castration resistant prostate cancer,CRPC),临床治疗棘手,往往束手无策,从而导致治疗失败,预后不佳。而目前对于前列腺癌发生发展及转移的分子机制尚未明确,且对于ANT2在前列腺癌的预防、治疗以及预后过程中的相关作用及影响更是未曾研究过,临床治疗缺乏有效的治疗手段。因此,阐明前列腺癌发生发展的分子机制,寻找可治疗前列腺癌的关键靶标及药物至关重要。
发明内容
本发明的目的在于解决现有技术中所存在的癌症尤其是前列腺癌发生发展及转移的分子机制不够明确、缺乏有效的治疗手段的技术问题,从而对前列腺癌发生发展机制进行了研究,针对前列腺癌提供了一种新的预防及治疗手段。
为了解决上述技术问题,本发明是通过如下技术方案得以实现的。
本发明第一方面提供了一种预防和/或治疗癌症的药物组合物,包括ANT2抑制剂。
作为优选地,所述癌症选自肺癌、肾癌、肠癌、胃癌、淋巴癌、肝癌、前列腺癌中的一种或多种;最优选地,所述癌症选自前列腺癌。
作为优选地,所述ANT2抑制剂选自基于ANT2基因设计的siRNA(siANT2)、miR-137和/或miR-137模拟物(miR-137 mimics)中的一种或多种。
作为优选地,所述基于ANT2基因设计的siRNA(siANT2)序列如SEQ ID NO:1所示。
作为优选地,所述miR-137模拟物(miR-137 mimics)序列如SEQ ID NO:2所示。
作为优选地,所述药物组合中还包括顺铂、环磷酰胺、5-氟尿嘧啶、阿霉素、丝裂霉素中的一种或多种。
本发明第二方面提供了上述药物组合物用于制备预防和/或治疗癌症药物中的用途。
作为优选地,所述癌症选自肺癌、肾癌、肠癌、胃癌、淋巴癌、肝癌、前列腺癌中的一种或多种;最优选地,所述癌症选自前列腺癌。
本发明第三方面提供了一种预防和/或治疗癌症的药物制剂,包括ANT2抑制剂以及至少一种药学上可接受的载体。
作为优选地,所述癌症选自肺癌、肾癌、肠癌、胃癌、淋巴癌、肝癌、前列腺癌中的一种或多种;最优选地,所述癌症选自前列腺癌。
作为优选地,所述ANT2抑制剂选自基于ANT2基因设计的siRNA、miR-137和/或miR-137模拟物(miR-137 mimics)中的一种或多种。
作为优选地,所述基于ANT2基因设计的siRNA(siANT2)序列如SEQ ID NO:1所示。
作为优选地,所述miR-137模拟物(miR-137 mimics)序列为如SEQ ID NO:2所示。
作为优选地,所述药物组合中还包括顺铂、环磷酰胺、5-氟尿嘧啶、阿霉素、丝裂霉素中的一种或多种。
作为优选地,所述药物制剂中还包括顺铂、环磷酰胺、5-氟尿嘧啶、阿霉素、丝裂霉素中的一种或多种。
作为优选地,所述药物制剂的剂型选自片剂、胶囊剂、注射剂、喷雾剂、气雾剂、粉雾剂、凝胶剂、栓剂中的一种或多种。
作为优选地,所述药学上可接受的载体选自填充剂、崩解剂、润滑剂、粘合剂、着色剂、防腐剂、矫味剂、抗氧化剂、溶剂中的一种或多种。
本发明第四方面提供了ANT2抑制剂用于制备预防和/或治疗癌症药物中的用途。
作为优选地,所述癌症选自肺癌、肾癌、肠癌、胃癌、淋巴癌、肝癌、前列腺癌中的一种或多种;最优选地,所述癌症选自前列腺癌。
作为优选地,所述ANT2抑制剂选自基于ANT2基因设计的siRNA、miR-137和/或miR-137模拟物(miR-137 mimics)中的一种或多种。
作为优选地,所述基于ANT2基因设计的siRNA(siANT2)序列如SEQ ID NO:1所示。
作为优选地,所述miR-137模拟物(miR-137 mimics)序列如SEQ ID NO:2所示。
本发明第五方面提供了miR-137和/或miR-137模拟物(miR-137 mimics用于制备预防和/或治疗癌症药物中的用途。
作为优选地,所述miR-137模拟物(miR-137 mimics)序列如SEQ ID NO:2所示。
作为优选地,所述癌症选自肺癌、肾癌、肠癌、胃癌、淋巴癌、肝癌、前列腺癌中的一种或多种;最优选地,所述癌症选自前列腺癌。
现有技术对于癌症尤其是前列腺癌发生与发展的原因和机制尚不明确,同样地,对于ANT2在癌症尤其是前列腺癌中的作用未有报道,而ANT2在在前列腺癌细胞发生、增殖、迁移、侵袭、凋亡等活动中的具体调节机制更是未有阐明。
本发明发明人通过大量研究,发现ANT2在肿瘤细胞的糖酵解代谢中起关键作用,ANT2蛋白在正常前列腺组织中低表达,而在前列腺癌组织中高表达,前列腺癌中ANT2的mRNA水平是正常前列腺组织的3倍多。通过收集临床病人的标本进行免疫组化,与前列腺囊肿的病人标本相比,前列腺癌中的ANT2蛋白水平显著提高,且与肿瘤的病理分级程度相关,进一步验证了上述结论。Western blot检测也证明ANT2在前列腺癌组织中的高表达。由此可见,ANT2与前列腺癌息息相关,能促进前列腺癌发生发展,可能成为前列腺癌治疗的潜在靶标。
进一步地,本发明发明人观察了前列腺癌细胞系中ANT2的表达。与正常前列腺细胞相比,前列腺癌细胞系LNCaP、DU145、PC3中的ANT2水平均升高,与其在肿瘤组织中的趋势一致。针对Human ANT2的mRNA序列,本发明发明人设计了siRNA的干扰片段,通过转染LNCaP细胞,验证了该siRNA片段的有效性及特异性,并且发现将ANT2基因沉默后,LNCaP细胞的增殖能力减弱。因此证明ANT2与前列腺癌相关,能促进前列腺癌发生发展,其可能成为前列腺癌治疗的潜在靶标。
为了明确ANT2与前列腺癌的关系,本发明发明人通过研究发现,在前列腺癌细胞中过表达ANT2,细胞的糖酵解水平显著升高,过表达ANT3则不产生影响。氧剥脱使得线粒体呼吸链停止,导致线粒体膜电位ΔΨm消失,最终会导致细胞凋亡;而前列腺癌细胞能在氧化磷酸化完全被抑制的条件下生存,主要依赖糖酵解给线粒体提供ATP维持线粒体ΔΨm。ANT2的主要功能是将胞浆ATP运输入线粒体并且维持线粒体的势能,使细胞不进入凋亡程序。前列腺癌细胞中ANT2表达水平高使得肿瘤能在低氧环境下生存,进而确定ANT2是一个抗凋亡的癌基因。
更进一步地,本发明发明人对于ANT2蛋白调控前列腺癌细胞生长的机制进行了研究,发现ANT2为miR-137的靶点而受其调控,miR-137可显著抑制ANT2的表达。
微小RNA(microRNAs,miRNAs)是一类进化上高度保守,长约22个核苷酸的非编码单链小分子RNA,通过与靶mRNAs的特异性结合导致其降解或抑制其翻译,对基因进行转录后的调控。miRNAs通过调控细胞信号中某些信号分子如转录因子、细胞因子、生长因子、促凋亡和抗凋亡基因的表达,从而调节细胞增殖、分化和细胞凋亡等行为。近年来,越来越多的miRNAs被证明在癌症发生发展过程中起着重要作用。
基于此,本发明发明人进行了大量研究,发现miR-137为调节ANT2的关键因素所在。通过对临床样本分析发现,qPCR的结果显示miR-137的表达水平在前列腺癌样本中显著降低;通过生物信息学分析发现,miR-137可以靶向ANT2;通过Targetscan预测,ANT2的UTR区存在保守的miR-137的调控位点,并通过构建包含human ANT2 3’UTR序列的报道基因并转让验证了miR-137可显著抑制ANT2的表达。
本发明相对于现有技术具有如下技术效果:
(1)本发明充分揭示了ANT2蛋白在前列腺癌细胞中的作用及与其相关调控的靶基因,阐明了ANT2调控前列腺癌的新机制,找到抑制前列腺癌的关键靶点,为了解前列腺癌的发病机制以及为临床治疗和药物开发提供确实的实验证据和科学依据。
(2)本发明对ANT2在前列腺癌发生、发展、迁移、侵袭、凋亡等过程中的具体机制进行了深入研究,明确了miR-137对ANT2表达的调控作用,确定了miR-137与ANT2对前列腺癌细胞凋亡、增殖及迁移和侵袭能力的影响,具体为:前列腺癌中miR-137表达水平被抑制,使其靶蛋白ANT2水平升高,肿瘤细胞糖酵解速率升高能量供给充足,从而促进前列腺癌细胞生长。而提高miR-137的水平,可显著抑制ANT2的表达,进而抑制前列腺癌细胞的糖酵解,切断肿瘤细胞的能量线粒体转运,诱发细胞凋亡从而抑制肿瘤细胞的生长。本发明对于前列腺癌的发生发展机制进行了全新的阐明,对于后期相关药物开发以及临床诊断和治疗提供了全新的思路,具有极大的社会意义及市场前景。
附图说明
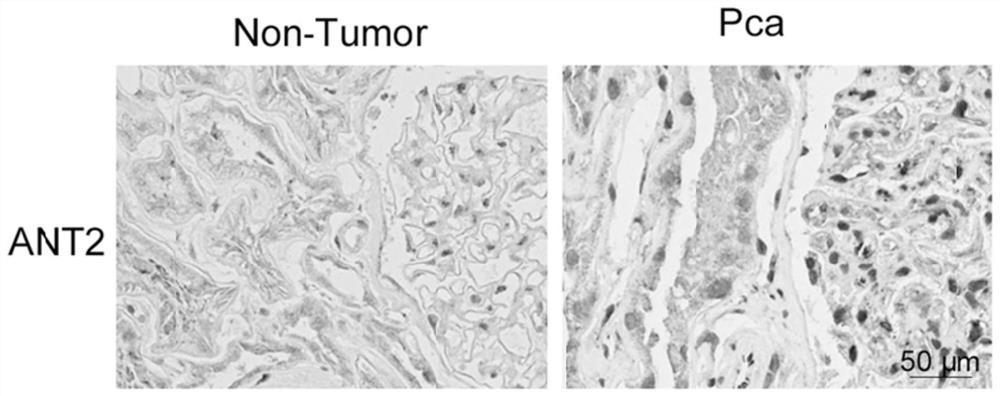
图1为正常前列腺组织与前列腺癌组织的免疫组化染色对比图。
图2为荧光定量PCR检测正常前列腺组织及前列腺癌组织中ANT2蛋白水平示意图。
图3为荧光定量PCR检测正常前列腺组织及前列腺癌组织中miR-137水平示意图。
图4为WB检测正常前列腺组织及前列腺癌组织中ANT2蛋白水平示意图。
图5为WB定性检测前列腺癌细胞LNCaP、DU145、PC3以及正常前列腺细胞RWPE-1中ANT2表达水平示意图。
图6为WB定量检测前列腺癌细胞LNCaP、DU145、PC3以及正常前列腺细胞RWPE-1中ANT2表达水平示意图。
图7为WB检测ANT2的过表达质粒中ANT2表达水平示意图。
图8为ANT2过表达对DU145细胞增殖影响示意图。
图9为ANT2过表达对LNCaP细胞增殖影响示意图。
图10为WB检测转染有siANT2的LNCaP细胞中ANT2表达水平示意图。
图11为siANT2对DU145细胞增殖影响示意图。
图12为siANT2对LNCaP细胞增殖影响示意图。
图13为流式细胞术检测siANT2对DU145细胞凋亡影响示意图。
图14为siANT2对DU145和LNCaP细胞细胞凋亡影响示意图。
图15为ANT2 基因过表达及ANT2基因沉默分别对DU145细胞迁移及侵袭能力影响示意图。
图16为ANT2 基因过表达及ANT2基因沉默分别对DU145和LNCaP细胞迁移能力影响示意图。
图17为ANT2 基因过表达及ANT2基因沉默分别对DU145和LNCaP细胞侵袭能力影响示意图。
图18为ANT2 基因沉默对DU145细胞中Bax、Bcl-2及Caspase-3超高表达水平影响示意图。
图19为ANT2 基因过表达对DU145细胞中MMP-2、MMP-9、TIMP-1、TIMP-2水平影响示意图。
图20为ANT2 基因沉默对DU145细胞中MMP-2、MMP-9、TIMP-1、TIMP-2水平影响示意图。
图21为miR-137Mimics对DU145和LNCaP细胞中ANT2表达水平影响示意图。
图22为siANT2、miR-137 Mimics、miR-137 Inhibitor对DU145和LNCaP细胞中ANT2表达水平影响示意图。
图23为WB检测siANT2、miR-137 Mimics、miR-137 Inhibitor对DU145细胞中ANT2表达水平影响示意图。
图24为siANT2、miR-137 Mimics、miR-137 Inhibitor对DU145和LNCaP细胞中ANT2表达水平影响示意图。
图25为miR-137 Mimics及ANT2对DU145细胞增殖能力影响示意图。
图26为miR-137 Mimics及ANT2对LNCaP细胞增殖能力影响示意图。
图27为miR-137 Mimics及ANT2对DU145细胞迁移、侵袭能力影响示意图。
图28为miR-137干扰及ANT2基因过表达后对LNCaP、DU145细胞的迁移能力影响示意图。
图29为miR-137干扰及ANT2基因过表达后对LNCaP、DU145细胞的侵袭能力影响示意图。
图30为miR-137干扰及ANT2基因干扰后裸鼠体内瘤体示意图。
图31为为miR-137干扰及ANT2基因干扰后对裸鼠肿瘤体积的影响示意图。
图32为miR-137干扰及ANT2基因干扰后对裸鼠肿瘤的大小影响示意图。
具体实施方式
为使本发明的目的、技术方案及效果更加清楚、明确,以下参照实施例对本发明作进一步详细说明。应当理解,此处所描述的具体实施例仅用以解释本发明,并不用于限定本发明。
在无特别说明的情况下,本发明上下文中所列出的包括PC3、LNCaP和DU145等细胞系从American Type Culture Collection(ATCC、Manassas、VA、USA)购入并根据ATCC指南进行培养。所有细胞系均通过中国典型培养物保藏中心(武汉)的短串联重复分析鉴定,并使用PCR检测试剂盒(上海Biothrive Sci)验证是否存在支原体污染,同时在液氮中冷冻保存并用于后续实验。本发明所使用的试剂中,均通过市售获得。对于临床标本的使用,均与患者签署了知情同意书,相关程序及方法符合医学伦理学要求以及药物临床试验质量管理规范。本发明所使用的实验方法,例如肿瘤细胞培养、动物实验、Western blot、钙磷沉淀法转染基因、分子克隆、小分子干扰技术、免疫组化、免疫荧光染色、流式细胞术、Transwell实验、划痕实验、Brdu标记等均为本领域的常规方法和技术。
生物学实验重复中选择具有代表性的结果呈现在上下文附图中,数据按照图示中规定的以mean±SD和mean±SEM展示。所有实验至少重复三次。数据采用GraphPad Prism5.0或SPSS 20.0软件进行分析。采用t检验或方差分析比较两组或两组以上的平均值差异。p<0.05被认为是一个显著的差异。
实施例1 ANT2以及miR-137表达水平与前列腺癌相关性研究
(1)收集前列腺癌患者手术切除的前列腺癌组织及癌旁组织,并与患者签署知情同意书;
(2)将每块组织样本分成两部分,一部分在离体 30分钟内冻存于液氮中,随后转-80℃;另一部分保存于3.7%多聚甲醛中;
(3)将-80℃中样本用于用于蛋白的提取及Western blot(WB)和qPCR实验;将多聚甲醛中样本用于病理切片及随后的免疫组化染色。
病理诊断根据TNM分期按照美国癌症联合(AJCC)制定的分期标准。收集临床随访资料:年龄、性别、临床分级、复发及转移与否、放化疗与否、病理分型、肿瘤大小及生存预后情况(病例数至少50例以上)。
实验结果如图1-图5所示,其中图1为正常组织与前列腺癌组织的免疫组化染色对比图,显示ANT2在前列腺癌组织中高表达。
以正常前列腺组织为对照,通过荧光定量PCR检测前列腺癌组织中ANT2蛋白以及miR-137的转录水平,结果分别如图2和图3所示。结果显示,ANT2在前列腺癌组织中高表达,而miR-137水平则在前列腺癌组织中显著降低。
随后,将正常前列腺组织及前列腺癌组织进行WB实验,以检测其中ANT2水平,结果如图4所示,同样显示ANT2在前列腺癌中高表达。
进一步地,选取前列腺癌细胞LNCaP、DU145、PC3以及正常前列腺细胞RWPE-1,通过WB实验检测其中ANT2表达水平,结果如图5-图6所示。结果与上述对前列腺癌组织的检测结果一致,即在ANT2在前列腺癌细胞LNCaP、DU145、PC3中均为高表达。
根据上述结果可知,与正常前列腺组织相比,前列腺癌中ANT2蛋白水平显著提高,而miR-137的水平则显著降低,且ANT2与肿瘤的病理分级程度相关(参见表1),显示ANT2与miR-137的表达水平与前列腺癌具有十分密切的关系。
表1ANT2与肿瘤的病理分级相关程度
实施例2 ANT2及ANT2抑制剂对前列腺癌细胞增殖及凋亡的影响
从前列腺癌细胞(DU145和LNCaP细胞)中提取RNA并逆转录,PCR扩增ANT2 cDNA并构建到相关载体中,测序及蛋白表达验证,得到了ANT2的过表达质粒,通过WB检测验证其有效性及特异性,结果如图7所示。
随后采用不同浓度的ANT2过表达,分别处理24、48及72小时,采用CCK-8对细胞进行检测,结果如图8-9所示,可以看到,在ANT2基因过表达后,DU145和LNCaP细胞的增殖能力显著增强。
进一步地,针对Human ANT2的mRNA序列设计并合成了siRNA(siANT2),其中siANT2序列为如如SEQ ID NO:1所示,为GGUGACUGCCUGGUUAAGAUC,将其转染至LNCaP细胞中,通过WB检测验证了该siANT2的有效性及特异性,结果如图10所示。
进而采用不同浓度的siANT2片段,分别处理24、48及72小时,采用CCK-8、Brdu标记、流式细胞术等方法对细胞进行检测,结果如图11-14所示,可以看到,在利用siANT2对ANT2基因进行沉默后,DU145和LNCaP细胞的增殖能力显著减弱,且可显著抑制前列腺癌细胞生长并诱导细胞凋亡,使得DU145和LNCaP细胞的凋亡率明显升高,差异具有统计学意义。
实施例3 ANT2及ANT2抑制剂对前列腺癌细胞迁移及侵袭的影响
选取DU145和LNCaP细胞进行细胞迁移及侵袭实验,利用qPCR及WB检测细胞中MMPs及TIMPs相关基因的表达情况,并通过基质黏附实验测定细胞黏附能力,通过划痕实验检测细胞迁移能力,通过Transwell侵袭实验检测细胞侵袭能力。结果如图15-21所示。
其中图15-17显示了ANT2基因过表达后,DU145细胞及LNCaP细胞迁移及侵袭能力显著增强;而在利用siANT2对ANT2基因予以沉默后,DU145及LNCaP细胞的迁移及侵袭能力得到了显著的降低,差异具有统计学意义。
由图18可以看到,在ANT2基因沉默后,显示Bax低表达,Bcl-2高表达,Caspase-3超高表达,表明ANT2基因的沉默对诱导LNCaP及DU145细胞的凋亡具有显著性增强。
根据图19-20,则发现在ANT2基因过表达后,显示MMP-2、MMP-9、TIMP-1、TIMP-2高表达,表明ANT2基因的过表达可使得DU145及LNCaP细胞的迁移及侵袭能力增强;而在ANT2基因沉默后,显示MMP-2、MMP-9、TIMP-1、TIMP-2低表达,表明ANT2基因的沉默可显著降低DU145及LNCaP细胞的迁移及侵袭能力。
实施例4 miR-137对前列腺癌细胞作用机制研究
(1)构建ANT2 3’UTR(野生及突变)驱动的双荧光素酶报道基因(序列为AAGCAAUA,AGAGCCAA),使用pGL4-luc-Basic荧光报告基因载体;
(2)将合适细胞数量的细胞铺到12孔板;
(3)24h后,将0.5μgANT2 3’UTR(野生及突变)驱动的双荧光素酶报告基因及0.1μgpRL-TK(Promega)内参质粒共转染到细胞,转染试剂为LipoFECTamine2000;
(4)加入miR-137Mimics处理不同时间点后(24及48h),根据Dual-LuciferaseReporterAssayKit的说明,用TopCountNXYmicroplateluminescencecounter分别测定Firefly及Renilla的活性,取它们的比值获得相对的荧光素酶活性,结果如图21所示。
图21显示,miR-137 Mimics在ANT2 3’UTR(野生)中的荧光素酶活性低,在ANT2 3’UTR(突变)中的荧光素酶活性差异无统计学意义,表明miR-137 Mimics可降低LNCaP、DU145的ANT2 3’UTR(野生)区启动子活性,而对LNCaP、DU145的ANT2 3’UTR(突变)区启动子活性的影响不明显。
在不同浓度的siANT2(如SEQ ID NO:1所示,为GGUGACUGCCUGGUUAAGAUC)、miR-137Mimics(序列如SEQ ID NO:2所示,为UUAUUGCUUAAGAAUACGCUAG)、miR-137 Inhibitor(序列如SEQ ID NO:3所示,为ACGCGUAUUCUUAAGCAAU)处理前列腺癌细胞不同时间后,检测miR-137对ANT2 3’UTR区启动子活性的影响,同时对miR-137的靶向序列进行突变以作为对照,结果如图22所示。由图22可以看到,miR-137 Inhibitor处理组中ANT2高表达,siANT2及miR-137 Mimics处理组中ANT2低表达,显示ANT2是miR-137的靶基因。
进一步地,在体外培养的DU145及LNCaP细胞中,以miR-137 Mimics、Inhibitor干扰miR-137的表达,同时沉默ANT2,采用WB检测细胞,结果如图23-24所示。可以看到,ANT2在miR-137处理组中高表达,而在siANT2及miR-137 Mimics处理组低表达,显示siANT2及miR-137 Mimics效应相同,使ANT2表达降低,miR-137 Inhibitor使ANT2表达明显增高,进一步显示ANT2是miR-137的靶基因。
实施例5 miR-137/ANT2对前列腺癌细胞行为及功能的影响
(1)构建ANT2 3’UTR(野生及突变)驱动的双荧光素酶报道基因(序列为AAGCAAUA,AGAGCCAA),使用pGL4-luc-Basic荧光报告基因载体;
(2)将合适细胞数量的细胞铺到12孔板;
(3)24h后,将0.5μgANT2 3’UTR(野生及突变)驱动的双荧光素酶报告基因及0.1μgpRL-TK(Promega)内参质粒共转染到细胞,转染试剂为LipoFECTamine2000;
(4)使用ANT2或miR-137Mimics(序列如SEQ ID NO:2所示,为UUAUUGCUUAAGAAUACGCUAG)处理不同时间点后,通过CCK-8、Brdu标记、Transwell实验或划痕实验等进行检测。结果如图25-29所示。
根据图25-27可以发现,miR-137 Mimics+ANT2处理后,LNCaP、DU145细胞的增殖能力均减弱,且DU145细胞的迁移以及侵袭能力也得到了显著的降低,显示miR-137对于ANT2的活性以及前列腺癌细胞的增殖、迁移及侵袭能力具有很好的抑制作用。
由图28-29可以看到,在对ANT2基因进行过表达后,LNCaP、DU145细胞的迁移及侵袭能力均增强;而在利用miR-137 Mimics+ANT2基因过表达处理后,LNCaP、DU145细胞的迁移及侵袭能力则得到了显著的降低,进一步验证了miR-137对于ANT2的活性以及前列腺癌细胞的迁移及侵袭能力具有很好的抑制作用。
实施例6 miR-137/ANT2在体内对前列腺癌的影响
(1)将18只裸鼠随机分为3组,每组6只;其中组1于皮下注射正常PC3细胞,组2和组3于皮下注射ANT2 siRNA PC3稳定细胞株;
(2)待成瘤后,对组1和组2每天于肿瘤部位注射200μl生理盐水,对组3小鼠每天于肿瘤部位注射200μl miR-137 Inhibitor(序列如SEQ ID NO:3所示,为ACGCGUAUUCUUAAGCAAU);
(3)定期记录每组小鼠的生长状态及体重,一个月后,处死小鼠,收集肿瘤测量体积。
实验结果如图30-32所示。由结果可以看到,相较于对照组组1,接种ANT2 siRNAPC3稳定细胞株后裸鼠体内的肿瘤生长明显被抑制。而在组3小鼠肿瘤部位注射miR-137Inhibitor后,肿瘤体积明显有所增大,进一步验证了对于ANT2的抑制和/或miR-137的激活在体内亦能够显著抑制前列腺癌细胞生长。
综合上述结果,本发明充分揭示了ANT2蛋白在癌症尤其是前列腺癌细胞中的作用及与其相关调控的靶基因,阐明了ANT2调控前列腺癌的新机制,找到抑制前列腺癌的关键靶点。本发明对ANT2在前列腺癌发生、发展、迁移、侵袭、凋亡等过程中的具体机制进行了深入研究,明确了miR-137对ANT2表达的调控作用,确定了miR-137与ANT2对前列腺癌细胞凋亡、增殖及迁移和侵袭能力的影响。本发明对于前列腺癌的发生发展机制进行了全新的阐明,对于后期相关药物开发以及临床诊断和治疗提供了全新的思路,具有极大的社会意义及市场前景。
以上具体实施方式部分对本发明所涉及的分析方法进行了具体的介绍。应当注意的是,上述介绍仅是为了帮助本领域技术人员更好地理解本发明的方法及思路,而不是对相关内容的限制。在不脱离本发明原理的情况下,本领域技术人员还可以对本发明进行适当的调整或修改,上述调整和修改也应当属于本发明的保护范围。
序列表
<110> 暨南大学附属第一医院(广州华侨医院)
<120> 一种预防和治疗癌症的药物组合物及其应用
<160> 3
<170> SIPOSequenceListing 1.0
<210> 1
<211> 21
<212> RNA
<213> 人工序列(Artificial Sequence)
<400> 1
ggugacugcc ugguuaagau c 21
<210> 2
<211> 22
<212> RNA
<213> 人工序列(Artificial Sequence)
<400> 2
uuauugcuua agaauacgcu ag 22
<210> 3
<211> 19
<212> RNA
<213> 人工序列(Artificial Sequence)
<400> 3
acgcguauuc uuaagcaau 19
- 用于预防和治疗癌症的药物组合物以及用于预防和治疗癌症的含有该药物组合物的保健食品
- 具有抗癌活性的肽,以及包含其作为活性成分的用于预防和治疗癌症的药物组合物、保健功能性食品组合物和功能性化妆品组合物
