一种提高苹果叶片胚性愈伤诱导率的组织培养方法
文献发布时间:2023-06-19 18:37:28
技术领域
本发明属于植物组织培养技术领域,具体涉及一种提高苹果叶片胚性愈伤诱导率的组织培养方法。
背景技术
苹果是基因高度杂合的木本植物,其童期较长,导致育种周期长、效率低。且传统的定向选育使得苹果的遗传性趋于一致,使得传统育种面临挑战。随着基因工程技术的发展,新的育种方式可以突破种间界限、拓宽基因来源,对苹果在增强抗病虫能力、抵抗环境胁迫、改良栽培性状、增强贮藏性能、缩短童期等方面提供了无限可能。
离体再生是研究体细胞突变和遗传转化的基础,同时也是苹果基因工程中的关键一步。许多苹果品种离体再生具有极强的基因型依赖性,再生效率极低,因此建立与苹果主栽品种基因型相应的高效再生系统、完善再生技术非常必要。目前存在的遗传转化体系中,多利用离体叶片直接再生不定芽作为基因转化的受体材料,但基因转化频率极低。
而以细胞为受体的转化体系则可以拓宽细胞来源,大大提高转化效率。胚性愈伤具有能够发育为完整植株的全能性,具有繁殖系数高和遗传稳定的优点。胚性愈伤的获取除了通过胚性组织,叶片和根尖组织也是获取高活力胚性细胞的来源。但对于苹果,仍缺乏成熟的胚性愈伤再生率高的诱导体系。
发明内容
本发明的目的在于提供一种提高苹果叶片胚性愈伤诱导率的组织培养方法,从而为后续的体细胞胚分化、苹果胚胎发生途径和基因育种奠定基础。
为实现上述目的,本发明提供以下技术方案:
一种提高苹果叶片胚性愈伤诱导率的组织培养方法,包括以下步骤:
(1)取苹果无菌组培苗顶部1~4节幼嫩、生长健壮、平展的叶片,置于无菌培养皿上,用解剖刀垂直于主叶脉横切,只切断主叶脉不切断叶缘,保持叶片完整;
(2)将造成伤口的叶片接种于添加2,4-D的胚性愈伤诱导培养基上进行培养。
优选的,所述的胚性愈伤诱导培养基还添加水解酪蛋白、蔗糖和琼脂。
优选的,所述的胚性愈伤诱导培养基配方为:MS培养基+2.0mg/L2,4-D+30g/L蔗糖+7.2g/L琼脂+100mg/L水解酪蛋白,pH=5.8。
优选的,所述的培养是在26℃下黑暗培养21天。
本发明以主栽品种‘富士’苹果的叶片为试验材料,建立苹果叶片胚性愈伤诱导体系,从而为后续的体细胞胚分化、苹果胚胎发生途径和基因育种奠定基础,大大缩短育种时间,还可以将单基因或主基因控制的性状导入现存的苹果基因型中,为实现苹果定向育种提供可能。
附图说明
图1为富士苹果叶片接种10天后叶片产生的愈伤组织。
图2为实施例3诱导产生的胚性愈伤。
图3为实施例中出现的非胚性愈伤。
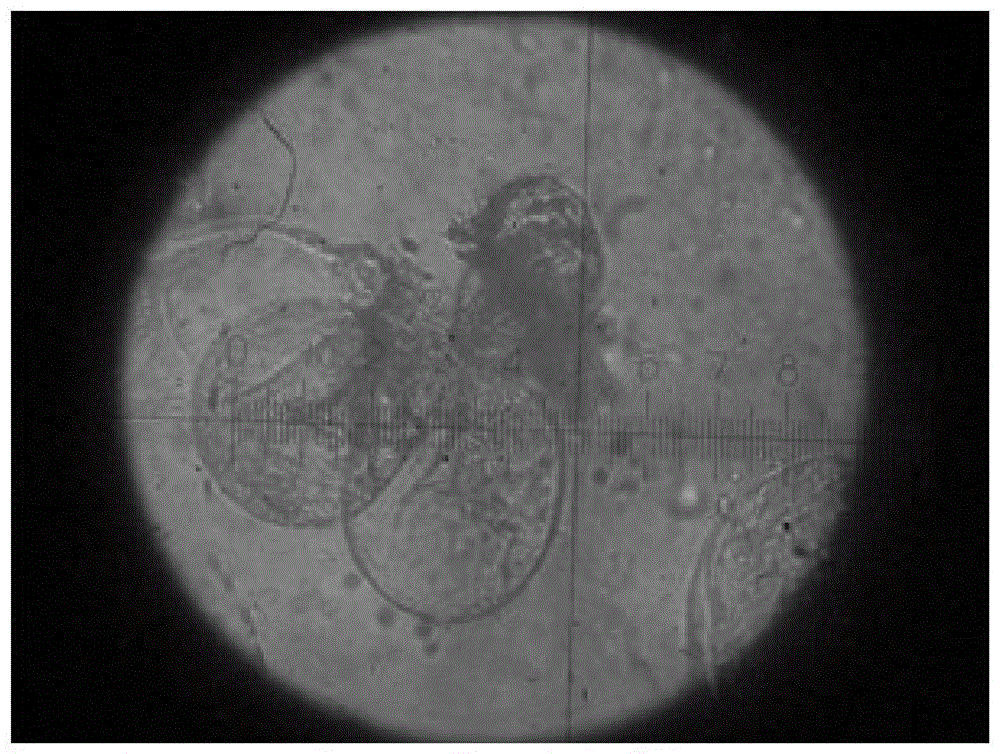
图4为实施例3诱导产生的胚性愈伤在镜检下显示的胚性细胞。
图5为实施例中出现的非胚性细胞和胚性细胞。
具体实施方式
以下实施例是对本发明的进一步说明,而不是对本发明的限制。
实施例1
(1)取富士苹果无菌组培苗顶部1~4节幼嫩、生长健壮、平展的叶片,选取在大小、形状和色泽上基本一致的叶片,保持叶片样品在生理、生化状态上基本一致;
(2)将无菌叶片置于无菌培养皿上,用解剖刀垂直于主叶脉横切,伤口间距约2mm,只切断主叶脉不切断叶缘,保持叶片完整;
(3)将造成伤口的叶片接种于胚性愈伤诱导培养基上,该培养基的配方为:MS培养基+1.5mg/L 2,4-D+0.4mg/L 6-BA+30g/L蔗糖+7.2g/L琼脂+100mg/L水解酪蛋白(CH),pH=5.8,在26℃下黑暗培养;
(4)黑暗培养21天后观察愈伤组织生长状况,计算愈伤组织诱导率,镜检观察细胞生长形态。
实施例2
(1)取富士苹果无菌组培苗顶部1~4节幼嫩、生长健壮、平展的叶片,选取在大小、形状和色泽上基本一致的叶片,保持叶片样品在生理、生化状态上基本一致;
(2)将无菌叶片置于无菌培养皿上,用解剖刀垂直于主叶脉横切,伤口间距约2mm,只切断主叶脉不切断叶缘,保持叶片完整;
(3)将造成伤口的叶片接种于胚性愈伤诱导培养基上,该培养基的配方为:MS培养基+1.5mg/L 2,4-D+0.1mg/L KT+30g/L蔗糖+7.2g/L琼脂+100mg/L水解酪蛋白(CH),pH=5.8,在26℃下黑暗培养;
(4)黑暗培养21天后观察愈伤组织生长状况,计算愈伤组织诱导率,镜检观察细胞生长形态。
实施例3
(1)取富士苹果无菌组培苗顶部1~4节幼嫩、生长健壮、平展的叶片,选取在大小、形状和色泽上基本一致的叶片,保持叶片样品在生理、生化状态上基本一致;
(2)将无菌叶片置于无菌培养皿上,用解剖刀垂直于主叶脉横切,伤口间距约2mm,只切断主叶脉不切断叶缘,保持叶片完整;
(3)将造成伤口的叶片接种于胚性愈伤诱导培养基上,该培养基的配方为:MS培养基+2.0mg/L 2,4-D+30g/L蔗糖浓度+7.2g/L琼脂+100mg/L水解酪蛋白(CH),pH=5.8,在26℃下黑暗培养;
(4)黑暗培养21天后观察愈伤组织生长状况,计算愈伤组织诱导率,镜检观察细胞生长形态。
实施例4
(1)取富士苹果无菌组培苗顶部1~4节幼嫩、生长健壮、平展的叶片,选取在大小、形状和色泽上基本一致的叶片,保持叶片样品在生理、生化状态上基本一致;
(2)将无菌叶片置于无菌培养皿上,用解剖刀垂直于主叶脉横切,伤口间距约2mm,只切断主叶脉不切断叶缘,保持叶片完整;
(3)将造成伤口的叶片接种于胚性愈伤诱导培养基上,该培养基的配方为:MS培养基+2.0mg/L 2,4-D+0.2mg/L 6-BA+30g/L蔗糖+7.2g/L琼脂+100mg/L水解酪蛋白(CH),pH=5.8,在26℃下黑暗培养;
(4)黑暗培养21天后观察愈伤组织生长状况,计算愈伤组织诱导率,镜检观察细胞生长形态。
实施例5
(1)取富士苹果无菌组培苗顶部1~4节幼嫩、生长健壮、平展的叶片,选取在大小、形状和色泽上基本一致的叶片,保持叶片样品在生理、生化状态上基本一致;
(2)将无菌叶片置于无菌培养皿上,用解剖刀垂直于主叶脉横切,伤口间距约2mm,只切断主叶脉不切断叶缘,保持叶片完整;
(3)将造成伤口的叶片接种于胚性愈伤诱导培养基上,该培养基的配方为:MS培养基+2.0mg/L 2,4-D+2.0mg/L NAA+30g/L蔗糖+7.2g/L琼脂+100mg/L水解酪蛋白(CH),pH=5.8,在26℃下黑暗培养;
(4)黑暗培养21天后观察愈伤组织生长状况,计算愈伤组织诱导率,镜检观察细胞生长形态。
上述实施例1-5的胚性愈伤诱导培养基添加物配方见表1。
表1.实施例1-5的胚性愈伤诱导培养基添加物配方
经观察,实施例1-5的外植体均在接种后10天左右开始产生少量愈伤(图1)。随着培养时间增加,愈伤组织生长量逐渐增多,对实施例1-5的愈伤生长情况进行了调查(表2),实施例3和4的愈伤组织诱导率达到了100%,实施例2和5均达到了90%及以上,实施例1最低也达到了86.7%。其中,实施例2和3诱导的愈伤组织呈现淡黄色且质地致密(图2),在外观上与胚性愈伤最相似,其他实施例外观则多为偏白色且较为松散,呈现非胚性愈伤外观形态(图3)。随后对愈伤组织进行镜检观察其细胞形态和生长状况,实施例3的细胞多为圆型和椭圆形细胞,且内容物较多(图4),形态符合胚性细胞;其他实施例则多以长形细胞为主,且内容物较少(图5),形态符合非胚性细胞。
表2.实施例1-5的胚性愈伤诱导情况
以上仅是本发明的优选实施方式,应当指出的是,上述优选实施方式不应视为对本发明的限制,本发明的保护范围应当以权利要求所限定的范围为准。对于本技术领域的普通技术人员来说,在不脱离本发明的精神和范围内,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
