一株缺陷短波单胞菌YB075修复Cr(VI)污染上的应用
文献发布时间:2024-04-18 19:58:30
技术领域
本发明涉及一株还原菌,还原菌在还原Cr(VI)上的应用,属于生物技术领域。
背景技术
铬污染是指由于铬和它的化合物造成的对环境的污染。改善生态环境是人们的普遍愿望,但治理污染依然任重而道远。随着铬盐、制革、印染、电镀等行业的不断发展,导致了环境中铬污染的不断增加,对人体健康构成了严重威胁。中国的铬产业规模大、分布广,世界上约有70%的铬化工企业在中国,其所处区域的环境污染问题日趋严峻,急需治理。如今,我国也已经成为了世界上的毛皮加工交易中心之一,拥有1200多家皮毛及制品企业。从2005年的行业调查情况来看,皮革毛皮制造业废水排放量达到了1.8亿吨。王廷涛等通过对一处铬渣堆场地土壤和地下水的测定,发现场地土壤和地下水中 Cr(VI)含量最高为421mg/kg,而地下水中 VI含量最高为16.1 mg/L,可见场地中 VI含量非常之高。
近年来,以六价铬为代表的重金属铬污染引起的环境污染事件时有发生,例如,2009年7月,长沙湘和化工公司的违法排污行为,使湘江流域内鱼类种类及数量急剧下降,致使湘江沿岸上千亩农田出现严重减产,部分区域的鱼类、粮食、蔬菜等被污染,影响了我国4千万人的饮水安全。云南省陆良化工有限公司在2011年8月因非法倾倒了一批剧毒的铬渣,导致周边水体被六价铬污染,致使周边村庄77只家畜因剧毒而死亡。同时,调查表明,金属业是六价铬污染的最大污染源,占总排放量的55%-60%,因而,金属业特别是电镀企业六价铬污染及其防控受到了全国的广泛重视。铬盐行业排放的废水、废气、废渣等对人体及环境造成了极大的危害,亟需对其进行治理。
铬污染修复技术
自然水体中铬的质量浓度一般大于1μg/L、小于40μg/L,以Cr
微生物修复是污染环境重金属生物修复方法的重要组成部分。涉及到微生物固定与转化两个方面。前者是指微生物利用带电的细胞表面对重金属离子进行吸附,或者通过对所需营养素的主动吸收,使其在细胞表面或细胞内积累;后者则是利用微生物的生命活动,使重金属的存在形式发生变化,或者使其生物可利用性下降,例如:Cr
通过间隔相同培养时间,测定菌株在相同Cr(Ⅵ)浓度下的OD
在筛选耐 Cr (Ⅵ)还原菌方面,刘爱霖研究小组从电镀工厂污水管线排放口的含铬土壤中,筛选到了20株 Cr (Ⅴ)还原菌,其中8株对150 mg/L,200 mg/L的 Cr (Ⅳ)溶液有耐受性,并对8株菌株的生长曲线、 pH值和还原能力进行了分析,从中选出了对 Cr 溶液有较强还原能力的菌株。ZJ-8有望作为一种新型的重金属铬污染修复菌种,应用于重金属污染治理中。
起始铬浓度的不同,会对菌株的生长和还原都起到一点程度的影响,例如起始 Cr(Ⅵ)浓度太低,菌株就不能迅速而有效地获得 Cr(Ⅵ),从而造成还原率达到一定程度后,就不能继续进行还原;同时,当起始 Cr(VI)浓度增加到一定阈值后,细菌的耐受性下降,生长受阻,铬对细菌的致毒作用增强,细菌的铬还原酶活性被抑制,还原效率下降;当 Cr(Ⅵ)浓度适宜时, Cr(Ⅵ)还原效率最高。
Cr在制革、电解电镀、染料生产等方面具有重要的经济意义,但造成了一类重要的重金属污染,对人类健康有很大影响。因此,对其进行系统的筛选与分离,并对其降解六价铬的最佳条件与机制进行研究,对其降解六价铬具有重要意义。常规的物理化学方法主要有调节 pH值、絮凝沉淀、离子交换、活性炭吸附等,这些方法不仅需耗费其它能量,还需添加大量的化学物质,不仅费用高,还容易造成二次污染。然而微生物能够持续的增殖、增殖,对环境的适应性极强,利用微生物处理 Cr(VI)污染,不仅投资低,能耗低,而且没有二次污染,已逐渐成为一种廉价、便捷、彻底的铬污染治理途径,这也促使人们将目光从传统的化学和物理方法转移到了微生物方法上。
六价铬Cr(VI)的微生物修复技术是当前六价铬污染研究的热点。目前已发现多种耐六价铬及还原菌,但能实现工业化的菌株较少。因此,筛选出一株能高效降解六价铬的菌株,并将其用于实际应用只,是一项非常有意义的研究工作。
发明内容
针对上述技术问题,本发明提供一种还原菌,分类命名
所述的还原菌在还原Cr(VI)上的应用。
所述的还原菌在非厌氧条件下还原Cr(VI)上的应用。
所述的还原菌在含氧环境下还原Cr(VI)上的应用,优选为好氧环境。
所述的Cr(VI)的浓度低于100mg/L,进一步优选为低于50mg/L,进一步优选为低于25mg/L。
所述还原菌在还原Cr(VI)过程中,pH值为3.8-9.8,进一步优选为7.8-8.8。
一种Cr(VI) 还原菌,该还原菌为所述保藏的还原菌。
所述的还原菌或所述的Cr(VI) 还原菌在含Cr(VI)废水中还原Cr(VI)上的应用。
所述的含Cr(VI)废水包括餐厨垃圾的渗滤液、或含盐废水,所述的含盐废水包括含硝酸盐、亚硝酸盐、卤盐废水。
所述的还原菌或所述的Cr(VI) 还原菌作为耐盐菌的应用,所述的盐为NaCl,所述的NaCl的浓度为5.0-20.0g/L。
本发明的技术方案中,底物浓度对菌株还原六价铬的影响:菌株YB075在Cr(Ⅵ)浓度为25mg/L的2天可完全还原,50mg/L的6天可完全还原,75-200mg/L的Cr(Ⅵ)不能完全还原,并呈现一定的递减还原趋势。
起始环境理化性质对菌株还原六价铬的影响。对于不同氧气状态下,菌株5天还原率为好氧94.94%、微好氧69.25%、厌氧50.30%,好氧条件时还原效果最好;对于不同pH值,菌株在pH3.8-9.8均对Cr(Ⅵ)(50mg/L)都有一定的还原能力,最适pH在7.8-8.8之间;对于不同盐浓度条件时,发现高盐度会影响菌株的Cr(Ⅵ)还原能力,即菌株在0-20g/L的盐浓度下菌株都可以还原一定量的铬,但浓度越低还原率越高。即菌株YB075可用于盐浓度偏高的铬污染废水处理。
菌株用于模拟铬污染餐厨渗滤液的治理实验。实验组和空白组相比,实验组的还原率明显高于空白组,即证明加了菌液的实验组,对六价铬起到了较好的还原作用,5d还原率都可达60%左右,证明该菌可用于治理被六价铬污染的废水,且有一定的治理效果,为微生物还原六价铬又提供了一种菌群,同时也为六价铬污染环境治理提供了一个可行的途径
附图说明
图1为根据实验数据所绘得Cr(VI)标准曲线。
图2不同氧气状态下菌株生长情况随时间变化图。
图3 不同氧气状态下Cr(VI)浓度随时间变化图。
图4 不同氧气状态下Cr(VI)还原率随时间变化图。
图5不同铬浓度时菌株生长情况随时间变化图。
图6 不同铬浓度时Cr(VI)浓度随时间变化图。
图7不同铬浓度时还原率随时间变化图。
图8不同pH环境下菌株生长情况随时间变化图。
图9不同pH环境下Cr(VI)浓度随时间变化图。
图10 不同pH环境下还原率随时间变化图。
图11 不同盐浓度时菌株生长情况随时间变化图。
图12 不同盐浓度时Cr(VI)浓度随时间变化图。
图13不同盐浓度时还原率随时间变化图。
图14中A为餐厨垃圾浸泡2h后的样品,B为制得的渗滤液。
图15实际应用时Cr(VI)浓度随时间变化图。
图16 实际应用时还原率随时间变化图。
具体实施方式
菌株
菌株为专利申请号:2023103607250得到的YB075,进行了生物保藏,在-80℃下使其停止生长,长时间保持低活性。使用时,需提前活化再使用。一般活化培养至第二代,使用第二代的菌落继续实验研究。进行如下试验。
培养基
培养基,需要根据微生物的营养需求进行配置,有多数菌所需要的共同营养物质,也有每个菌所需要的特殊营养物质,如生长因子等。在此所使用培养基为LB培养基,即50ml培养基中,含胰蛋白胨0.5g、氯化钠0.5g、酵母浸粉0.25g,如需使用固体培养基,再加入1g琼脂。同时,培养基需满足微生物生长所需的条件,如pH,本实验培养基pH为7.2-7.5,同时也要根据后期加入的六价铬量(弱酸性),对培养基pH继续调整。
铬标准液及显色剂
5 g/L Cr(Ⅵ)标准液:称取烘干的(120 ℃,2 h)重铬酸钾 2.8400 g 溶于 200mL 去离子水中,过滤除菌,置于 4 ℃冰箱中备用。
显色剂(I):称量0.2克二苯基碳酰二肼,将其溶解在50ml丙醇溶液中,加入清水,直至100毫升标线,摇匀。储存于褐色的试管内,放入冰箱内,如有变色,则不可再用。
铬标准溶液(I):取5毫升铬标样储备液,倒入500毫升的容量瓶内,以水稀释,直到标线为止。即每毫升的溶液中含有1.0微克的六价铬,次试剂应当天用当天配。
实施例1
Cr(VI)标准曲线的绘制
①将0,0.20,0.50,1.0,2.0,4.0,6.0,8.0,10.0 mL的铬标准液(I)加入50 mL的试管,以水稀释到标线,再加入(1+1)的硫酸0.5 mL和(1+1)的磷酸0.5mL,摇匀。
②加入2毫升显色试剂(I),摇晃均匀;5-10分钟后,在波长540 nm下,使用10毫米的比色皿,以水为参照,测量吸光度,并进行空白修正。
③以测定的吸收量为基础,进行空白修正,分析绘制出吸收量与六价铬含量之间的标定曲线。图1为根据实验数据所绘得Cr(VI)标准曲线。
实施例2
氧气条件对菌株还原Cr(VI)的影响
实验步骤
(1)从二代活化平板上取单菌落至装有10mL LB培养基(pH7.5)的试管,摇床28℃培养24h。
(2)待菌长出,从试管中取2ml菌液至装有50mL LB培养基(pH7.5)的锥形瓶,摇床28℃培养24h。
(3)从锥形瓶取1mL样,测得OD
(4)将计算体积种子液分别加入10mL LB培养基(pH7.4)的试管,分别置于摇床、静置培养箱、无氧培养瓶28℃培养。
(5)定时取样测OD
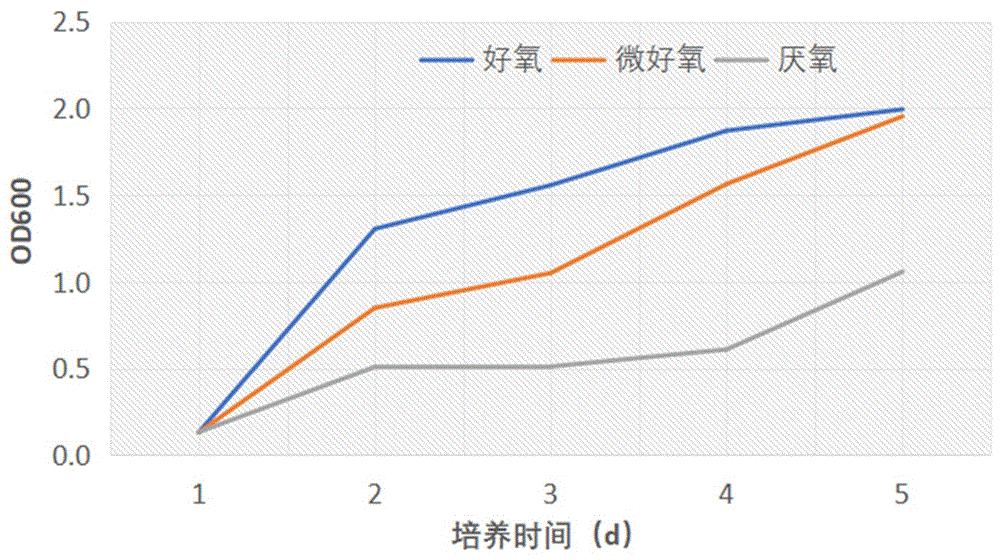
如图2所示,菌株在Cr(Ⅵ)浓度为50mg/L时,供给不同的氧气状态进行培养,即摇床培养(好氧)、静置培养(微好氧)、无氧培养瓶培养(厌氧),菌株随着培养时间和不同氧气状态的不同,呈现不同的生长情况,总体为好氧>微好氧>厌氧,培养初期,好氧条件下菌株生长旺盛,随着培养时间的增长,生长速率减缓,即该菌株为好氧菌,在好氧条件下生长最好。
如图3、4所示,菌株在其它条件相同情况下,供给不同的氧气状态进行培养,即摇床培养(好氧)、静置培养(微好氧)、无氧培养瓶培养(厌氧),菌株都可以还原Cr(Ⅵ),但还原率有差异,即5天还原率为好氧94.94%、微好氧69.25%、厌氧50.30%,还原能力为好氧>微好氧>厌氧,好氧条件还原效果最好。六价铬还原反应应该是被还原,但是该菌株在有氧条件下还原效果反而最好,可能原因是菌株体内还原六价铬的酶类,在有氧条件下合成的数量和种类都更多,在微好氧、厌氧条件下,菌株体内对应还原六价铬的酶类数量和种类都少于好氧情况下,故菌株在好氧条件下,菌株生长较好,且还原六价铬的还原率最高。
实施例3
不同铬浓度对菌株还原Cr(VI)的影响
实验步骤
(1)从二代活化平板上取单菌落至装有10mL LB培养基(pH7.5)的试管,摇床28℃培养24h。
(2)待菌长出,从试管中取2ml菌液至装有50mL LB培养基(pH7.5)的锥形瓶,摇床28℃培养24h。
(3)从锥形瓶取1mL样,测得OD
(4)将计算所需体积种子液分别等量加入10mL LB培养基(pH7.4)的试管,并向试管中加入Cr(VI)使试管中Cr(VI)浓度分别为0mg/L、25mg/L、50mg/L、75mg/L、100mg/L、150mg/L、200mg/L,并置于摇床28℃培养。
(5)定时取样测OD
细菌生长还原时,Cr(Ⅵ)浓度会产生较大影响。超过一定Cr(Ⅵ)浓度范围,Cr(Ⅵ)会抑制菌株生长,甚至使菌株停止生长。由图5可知,菌株YB075在0、25、50mg/LCr(Ⅵ)浓度下生长都较好,即0-100mg/LCr(Ⅵ)培养液中,菌株的生长没有受到抑制,都可以正常生长。但是Cr(Ⅵ)浓度达到150mg/L后,菌株的生长出现一定抑制,当Cr(Ⅵ)浓度达到200mg/L时,抑制更加明显。通过对比,可以说明随着培养液中Cr(Ⅵ)浓度增加,菌株的耐受性降低,可能是随着Cr(Ⅵ)浓度的升高,Cr(Ⅵ)对菌体的致毒性增强,因而出现抑制菌体生长的现象。
菌株YB075在不同Cr(Ⅵ)浓度下的还原趋势,如图6、7所示。还原率随着初始Cr(Ⅵ)浓度的升高而下降,Cr(Ⅵ)浓度为25mg/L的2天可完全还原,50mg/L的6天可完全还原,75mg/l的只能最终只能还原到91.85%,100mg/l的只能还原到86.23%,150mg/l的能还原到72.95%,200mg/l的能还原到69.61%,即0-50mg/L的Cr(Ⅵ)可以还原完全,75-200mg/L的Cr(Ⅵ)不能完全还原,呈现一定的还原趋势。这可能是初始Cr(Ⅵ)浓度的升高,使得菌体的生长受到抑制,进而抑制了YB075体内铬还原酶的能力,表现出还原率递减趋势。
实施例4
不同pH环境对菌株还原Cr(VI)的影响
实验步骤
(1)从二代活化平板上取单菌落至装有10mL LB培养基(pH7.5)的试管,摇床28℃培养24h。
(2)待菌长出,从试管中取2ml菌液至装有50mL LB培养基(pH7.5)的锥形瓶,摇床28℃培养24h。
(3)从锥形瓶取1mL样,测得OD
(4)将计算所需体积种子液分别等量加入10mL LB培养基的试管,培养基pH分别为3.8、4.8、5.8、6.8、7.8、8.8、9.8,并置于摇床28℃培养
(5)定时取样测OD
pH值对菌株生长的影响大多是以控制培养基的初始pH值来进行,菌株的生长速度会受pH值的变化而变化,菌株的代谢途径及细胞结构亦会受到影响不合适的培养基pH值会导致菌株生长速度减慢,从而影响菌株的活性。起始pH值对菌株YB075生长的影响曲线见图。由图8可知,菌株YB075在pH7.8-pH9.8都生长较好,pH为3.8-4.8时,菌株几乎不能生长,pH为5.8时,菌株在实验第二天开始生长,但是生长缓慢。pH为6.8时,前3天菌株都能生长,但是生长较慢,第4天菌株较快生长,可能是由于菌株代谢物持续累计改变了培养基酸碱度,达到菌株生长所需的pH,故生长较快。
如图9和10所示,菌株在pH3.8-9.8均对Cr(Ⅵ)(50mg/L)都有一定的还原能力,不同pH值5天还原率分别40.48%、40.29%、43.35%、90.46%、94.37%、97.85%、92.93%,即pH3.8-5.8菌株还原率在40%左右,pH6.8-9.8的还原率都可以达到百分之九十,其中pH为8.8的还原效果最好,几乎可以完全还原,pH至9.8还原率降低,即菌株最适pH应该在7.8-8.8之间。
实施例5
不同盐浓度对菌株生长及Cr(Ⅵ)还原影响
实验步骤
(1)从二代活化平板上取单菌落至装有10mL LB培养基(pH7.5)的试管,摇床28℃培养24h。
(2)待菌长出,从试管中取2ml菌液至装有50mL LB培养基(pH7.5)的锥形瓶,摇床28℃培养24h。
(3)从锥形瓶取1mL样,测得OD
(4)将计算所需体积种子液分别等量加入到10mL不同盐浓度(用NaCl配制)培养基的试管,培养基盐浓度分别为0g/L、5g/L、10g/L、15g/L、20g/L,并置于摇床28℃培养。
(5)定时取样测OD
当盐分含量偏低或偏高时,细菌会由于脱水或过多的水分而引起细菌数量的减少。针对实际生产中偶有高盐含铬废水的情况,研究了该菌对 NaCl的耐受能力和六价铬的还原能力。
如图11所示,为不同NaCl浓度条件下菌株YB075的生长曲线。由图可知,菌株在盐度为0.0g/L时生长最好,没有受到抑制,菌株在盐度为5.0-20.0g/L时,生长都受到不同程度的抑制且呈现一定趋势,即随着NaCl浓度的增加,菌株的生长受到抑制增加,但菌株也可耐20.0g/L的高盐环境。
不同盐浓度对菌株还原Cr(VI)的影响
如图12和13所示,为菌株在不同NaCl浓度下对50mg/L Cr(Ⅵ)的还原趋势图。由图可知,在0.0g/L NaCl浓度下,菌株的生长状况较好,相对应的Cr(Ⅵ)去除能力最强。在2d时,菌株可还原超过50%的Cr(Ⅵ),在3d时菌株还原率达到90%;在5g/L 和15g/L NaCl浓度下,菌株的还原能力依然较强,5d可将50mg/L Cr(Ⅵ)还原至9.6mg/L,还原率可达82.10%;而在20g/L NaCl浓度下,相对0g/L而言,菌株对Cr(Ⅵ)的还原率受到明显抑制,还原率仅为58.26%。说明高盐浓度会抑制菌株对Cr(Ⅵ)的还原能力,在0-15g/L NaCl浓度下,菌株还原能力较强,且在20.0g/LNaCl浓度时,5d还原率也到60%左右,故菌株YB075可应用于盐浓度偏高的铬污染废水处理。
实施例6
菌株在处理实际含Cr废水中的应用
模拟Cr(VI)污染的餐厨垃圾渗滤液
(1)餐厨滤液的制备方法
将餐厨垃圾装入容器中待用后,加入400ml去离子水,静置浸泡2h左右。取滤液,先用普通滤纸抽滤一次,将滤液装入烧杯中,再去除油层。再将去油后的滤液再次过滤,使用滤膜为0.45μm水性滤膜,抽滤1次,收集滤液,放入冰箱待用。图实验时所用的滤液样品。如图14为餐厨垃圾浸泡时的过程记录图和最终处理后的渗滤液展示图。
(2)实验步骤
将制得的滤液调节pH到8.5,如有沉淀产生,则8000r/min离心5min,收集滤液。
取20mL滤液到100mL烧杯中,制成9瓶,121℃高压蒸汽灭菌20min。每瓶各加入5g/L的Cr(VI)母液2mL,混匀。
其中3瓶各加入1mLOD值为2.6的菌群接种液,3瓶加入硝酸钾使其浓度为1g/L且同时加入1mLOD值为2.6的菌群接种液,另外3瓶不接种作为对照。全部放入到恒温振荡培养箱中28℃培养。
每间隔24h取样,测定Cr(VI)的含量。
如图15和16所示,由于菌株为从转化氮源的菌株中筛选得出,且考虑菌群可能存在协同作用,即菌株在有自身可代谢的营养物质环境下,可能可以代谢原本不能代谢的物质,故设置1.0g/L硝酸钾和OD值为2.5的菌液、OD值为2.5的菌液、空白组共三组实验。
(1)渗滤液三组实验的相互对比。由六价铬浓度随培养时间变化图、还原率随培养时间变化图可知,随着时间变化,三组实验中的六价铬浓度都在随着时间的推移而降低,但还原率却有较大区别。
①实验组和空白组相比,实验组的还原率明显高于空白组,即证明加了菌液的实验组,对六价铬起到了较好的还原作用,5d还原率都可达60%左右,证明该菌可用于治理被六价铬污染的废水,且有一定的治理效果,为微生物还原六价铬又提供了一种菌群,同时也为六价铬污染环境治理提供了一个可行的途径。
②两实验组之间,由两图综合可知,只加了菌液的实验组比加了菌液和硝酸钾的实验组,还原率高了2%左右,由前面实验“盐浓度对菌株还原六价铬的影响”可知,盐浓度的增加会抑制菌株还原效果,故此处有可能是由于硝酸钾增加了菌株生存环境的盐浓度,盐的存在,抑制了菌株的生长代谢和还原,导致还原率略有降低。
(2)由图得空白组也有较高还原率的分析。餐厨垃圾成分复杂,可能会在浸泡过程中,部分饱和脂肪酸和不饱和脂肪酸进入渗滤液中,在实验培养时,脂肪酸断链释放电子到培养液环境中,部分环境中的电子被六价铬获得,导致六价铬还原。
(3)硝酸钾存在的影响。实验设计时,考虑到菌株可能存在协同作用,即原本无法在渗滤液培养液中代谢六价铬,但是由于硝酸钾的存在,菌株在代谢硝酸钾的同时,可能产生某些酶类,使得菌株可以代谢部分六价铬。但是实验证明,菌株在此环境中,并不存在协同作用,无法增加菌株还原率,反而由于盐浓度的增加降低了还原率。
(4)应用实验与条件探索实验的对比。由不同底物浓度、氧气状态、pH环境、盐浓度对菌株还原的影响实验数据可知,菌株基本上都可以在5d内完全还原50mg/L的六价铬,但是实际应用却只能还原至65%左右,空白组校正后的还原率甚至只能达到25 %左右,可能原因如下:
①条件探索实验所用培养基为LB液体培养基,含有胰蛋白胨和酵母浸粉,可以普遍满足各种微生物生长所需的营养物质,但是实际应用即渗滤液作为培养液时,可能其中缺乏某些营养元素或者生长因子,导致菌株无法很好生长,不能达到以LB为培养基时的还原率。
②由结论分析(2)可得,渗滤液中的不饱和脂肪酸和饱和脂肪酸可能在培养过程中断链释放电子,释放的部分电子直接被六价铬获取,而不通过菌株的作用,就直接被还原,导致在实际应用中还原率较低。
