用于生成微滴和执行数字分析的系统和方法
文献发布时间:2024-04-18 19:58:53
交叉引用
本申请要求于2021年3月5日提交的美国临时申请号63/157,292的优先权,其全部内容作为参考引入本文。
技术领域
本公开一般涉及与样品处理和数字分析相关的领域,更具体地,涉及用于在这种领域中生成分割区和对分割区进行数字分析的新的和有用的系统和方法。
背景技术
在生物技术和其他应用中,分割技术在实现进行微尺度和纳米尺度分析(例如,单个细胞、单个分子、其他分析物等)的能力中起着重要作用。关于数字分析(例如,数字聚合酶链式反应)和其他生物测定,以一致和可靠的方式将样品分散在分割区上对于细胞和分子生物学中的各种测定具有实用性。以分割的形式提供的隔离和独立的反应环境可以进一步大大减少所需的样品和工艺流体体积,降低与样品处理相关联的成本。从这种测定返回的结果可用于各种病症的临床和非临床表征。
发明内容
目前,用于以快速和一致的方式在分割区上分布样品的方法和系统,其方式是分割区内容物稳定地隔离而不泄漏或合并相邻的分割区内容物,以及其方式是能够实现从来自分割区的信号的读出,都受到严重限制。商业上可用的平台通过使用涉及复杂设置的微流控装置进行分割。然而,这种平台可能是昂贵的,分割样品速率缓慢,是劳动密集型的,或者可能导致样品污染。因此,在样品处理领域需要为分割区的生成和数字分析创建新的和有用的系统和方法。
因此,本公开描述了用于数字分析的样品的快速分割的系统、方法和组合物的实施方式、变体和示例。
本公开的一方面提供了用于快速生成分割区(例如,来自样品流体的微滴、乳液的微滴)的装置的实施方式、变体和示例,其中,该装置包括:限定包括贮器入口和贮器出口的贮器的第一基板;耦合到贮器出口并且包括孔的分布的隔膜;和包括被配置为保持收集容器与贮器出口对齐的开口的支撑体。在操作期间,第一基板可以与支撑体耦合并包围收集容器,贮器出口与收集容器对齐和/或落座在收集容器内。在操作期间,贮器可以包含样品流体,其中对装置或样品流体施加力,以极高的速率(例如,至少200,000个微滴/分钟、至少300,000个微滴/分钟、至少400,000个微滴/分钟、至少500,000个微滴/分钟、至少600,000个微滴/分钟、至少700,000个微滴/分钟、至少800,000个微滴/分钟、至少900,000个微滴/分钟、至少1百万个微滴/分钟,至少2百万个微滴/分钟,至少3百万个微滴/分钟等)在收集容器内生成多个微滴,其中所述微滴在收集容器内稳定在适当位置(例如,以密排形式,在平衡静止位置)。值得注意的是,微滴在与各种数字分析和其他测定有关的宽范围温度(例如,1℃至95℃,大于95℃,小于1℃)内是稳定的,其中所述微滴在形态上保持一致并且保持与相邻微滴未合并。
在实施方式、变体和示例中,隔膜包括具有低密度(例如,明显低于涉及多孔隔膜的典型过滤应用的密度)的孔的分布。
在实施方式、变体和示例中,装置可以包括贮器组(例如,在第一基板处)、在该贮器组的出口处的隔膜组,以及用于收集容器组的支撑体,以便在分割过程期间提供多个样品的并行处理和/或样品处理材料的组合。
在实施方式、变体和示例中,装置可以包括配置为进一步从收集容器内的底座表面或液体界面分离隔膜的间隔物,从而实现从隔膜中冒出的微滴在到达各自平衡位置之前经过空气或另一初始流体相的操作模式。
本公开的一方面提供了用于以极高的速率在收集容器内快速生成分割区(例如,来自样品流体的微滴、乳液的微滴)的方法的实施方式、变体和示例,多个微滴中的每一个包括用于数字分析的水性混合物(例如,核酸材料、蛋白质材料、氨基酸材料、所述的其它分析物),其中在生成时,多个微滴在连续相(例如,作为具有由收集容器限定的整体形态的乳液)内稳定在适当位置(例如,以密排形式,在平衡静止位置等)。在多个方面中,分割区生成可以通过驱动样品流体穿过隔膜的孔的分布来实施,其中施加的力可以是离心的、与施加的压力相关联的、磁性的或以其他方式物理施加的中的一个或多个。
在实施方式、变体和示例中,生成的微滴可以形成乳液,单独的微滴在收集容器内分离并稳定在适当位置。乳液可以是粘性流体、剪切增厚流体、凝胶(例如,具有单独的离散微滴的凝胶)或具有表面的另一流体。当根据所述的方法的变体凭借离心作用来执行微滴生成时,驱动样品流体穿过隔膜可以包括在第一旋转方向上旋转样品流体、隔膜和收集容器,并使该旋转方向反向,从而调整包括收集容器内的多个微滴的乳液的表面轮廓。对于涉及乳液的截面的光学探询的数字分析,调整表面轮廓(例如,通过在离心作用期间产生更均匀/水平/平坦的表面)可以改善接近乳液的所有表面的信号的读出。
当根据所述方法的变体凭借离心作用执行微滴生成时,驱动样品流体穿过隔膜可以包括以第一旋转速度和小于该第一旋转速度的第二旋转速度旋转在离心机内的样品流体、隔膜和收集容器,从而调整包括收集容器内的多个微滴的乳液的表面轮廓。对于涉及乳液的截面的光学探询的数字分析,调整表面轮廓(例如,通过在离心作用期间产生更均匀/水平/平坦的表面)可以改善接近乳液的所有表面的信号的读出。
对于收集容器保持封闭(例如,收集容器没有出口,没有收集容器的流出,以避免样品污染)的单管工作流程,方法可以进一步包括根据测定方案将热量传递到封闭的收集容器内的多个微滴和从封闭的收集容器内的多个微滴传递热量。对于具有合适的透明度(例如,具有或不具有折射率匹配)的乳液的生成,方法可以进一步包括从来自封闭的收集容器内的单独的微滴的信号的传递,用于读出(例如,通过光学检测平台,通过另一个合适的检测平台)。
在方法包括在封闭的容器内传递热量到多个微滴或从多个微滴传递热量的情况下,微滴在与各种数字分析和其他生物测定有关的宽范围温度(例如,1℃至95℃,大于95℃,小于1℃)内是稳定的,其中微滴在形态上保持一致并且保持与相邻微滴未合并。
分割区生成方法的示例可以包括在具有体积容量(例如,小于50微升、50至100微升以及更大等)的收集容器内生成极高数量(例如,大于2百万个微滴、大于3百万个微滴、大于4百万个微滴、大于5百万个微滴、大于6百万个微滴、大于7百万个微滴、大于8百万个微滴、大于9百万个微滴、大于1,000万个微滴、大于1,500万个微滴、大于2,000万个微滴,大于2,500万个微滴、大于3,000万个微滴、大于4,000万个微滴、大于5,000万个微滴、大于1亿个微滴等)的微滴,其中微滴具有特征尺寸(例如,1-50微米、10-30微米等),该特征尺寸是与数字分析、单个细胞捕获、目标检测、单独的分子分割或其它应用有关的。
取决于应用用途,本公开提供了能够在比现有技术大10-100倍的宽动态范围内进行数字分析的系统、装置和方法。在与核酸计数有关的示例中,本公开提供了可以具有从1到1亿的动态范围的系统、装置和方法,这是由于生成了极高数量的均匀分割区,从所生成的分割区可以读取信号,并且由于以目标对分割区的低占有率(例如,小于20%的占有率、小于10%的占有率、小于9%的占有率、小于8%的占有率、小于7%的占有率、小于6%的占有率、小于5%的占有率等)进行分割的能力。
在具体的应用中,所述的分割装置和方法可以执行:经由微滴内捕获的单独的核酸分子的扩增,然后在纯化的DNA、cDNA、RNA、寡核苷酸标记的抗体/蛋白质/小分子上的光学可检测信号(例如,通过聚合酶链反应(PCR)方法扩增、通过等温方法(如环介导等温扩增(LAMP))、通过重组酶聚合酶扩增(RPA)、通过解旋酶依赖性扩增(HDA)、通过链置换扩增(SDA)、通过切口酶扩增(NEAR)、通过转录介导的扩增(TMA)、通过RNaseH介导的扩增、通过使用phi29的全基因组扩增(WGA)、通过滚环扩增等)的检测或者直接从裂解物(例如,血液裂解物)中检测光学可检测信号来检测和计数核酸分子;用荧光标记的核酸(例如,PNA、LNA、DNA、RNA等)的荧光原位杂交(FISH)或使用DIG或生物素的间接原位杂交方法,其中信号随后通过抗体与碱性磷酸酶或过氧化物酶的缀合而被放大,以产生由一种或多种基板(例如,硝基蓝四唑(NBT)、5-溴-4-氯-3-吲哚基-磷酸盐(BCIP)、HNPP等)检测的颜色变化;体外转录或翻译测定,从而使用比色或荧光报告分子进行检测;施加于衍生自单个细胞(例如,原核生物、真核生物)、细胞器、病毒颗粒和外来体的样品的微滴PCR;蛋白质或肽分子的计数(例如,通过邻近连接测定等);测序应用(例如,单个分子测序应用);监测或检测从单个细胞(例如,从免疫细胞释放的白介素)释放的产物(例如,蛋白质、化学物质);监测单个细胞的细胞存活和/或分裂;监测或检测涉及单个细胞的酶反应;单个细菌的抗生素抗性筛选;样品中病原体的计数(例如,有关感染、败血症,有关环境和食品样本等);样品中异质细胞群的计数;单独的细胞或病毒颗粒的计数(例如,通过用与酶耦合的物种特异性抗体将细胞包封在微滴中,该酶与微滴中的基板组分反应以产生信号等);单个宿主细胞的病毒感染的监测;液体活检和伴随诊断;遗传疾病(例如,非整倍性、遗传性疾病)的产前诊断,例如用无细胞核酸、胎儿细胞或含有胎儿和母体细胞混合物的样品;来自各种生物样品的癌症形式的检测(例如,来自无细胞核酸、组织活检、生物流体、粪便的癌症的检测);微小残留病的检测和/或监测;监测对治疗的反应;移植器官的排斥事件的检测或预测;与其他健康状况相关联的其他诊断;其他生物状态的其他表征;和其它合适的应用。
在具体的应用中,用于在单管工作流程中分割的系统和方法可以执行乳液数字PCR相关联的过程。
在实施方式中,根据数字分析和/或其它生物测定技术分析的目标材料可以包括以下一种或多种:核酸材料(例如,DNA、RNA、miRNA等)、蛋白质材料、氨基酸材料、其它小分子、其它单独的分析物、其它多重分析物和/或样品的其它合适的目标材料。在实施方式中,样品可以包括或另外衍生自整体组织结构、组织部分(例如,组织学组织切片、福尔马林固定的石蜡包埋的(FFPE)组织、冷冻组织、活检组织、新鲜冷冻血浆、接种的天然支架、接种的合成支架等)、器官、整体生物体、类器官、细胞悬液(例如,在用系统处理之前分离的冷冻细胞悬液,保持在介质/水凝胶介质等中的细胞悬浮液)、细胞核悬浮液、单个细胞、细胞器、亚细胞器结构、细胞器内组分、病毒、微生物和其它样品。
本公开的附加方面提供了一种方法,该方法包括:以至少100万个微滴/分钟的速率在收集容器内生成多个微滴,所述多个微滴中的每一个包括用于核酸材料的数字分析的水性混合物。
在一些实施方式中,在生成时,在收集容器的区域内,多个微滴以连续相内的密排形式稳定在适当位置。在一些实施方式中,生成多个微滴包括驱动样品流体穿过包括孔的分布的隔膜,该隔膜耦合到用于样品流体的贮器的贮器出口,并且该贮器与收集容器对齐。在一些实施方式中,孔的分布具有小于5000个孔/cm
本公开的附加方面提供过了一种用于生成微滴的系统,该系统包括:限定包括贮器入口和贮器出口的贮器的第一基板;耦合到贮器出口并且包括孔的分布的隔膜;和包括配置为保持收集容器与贮器出口对齐的开口的第二基板,其中该系统包括:第一操作模式,其中第一基板与第二基板耦合并包围收集容器,贮器出口落座在收集容器内,第二操作模式,其中贮器包含样品流体,所述样品流体包括用于核酸材料的数字分析的水性混合物,和第三操作模式,其中隔膜响应于施加到样品流体的力,以至少1百万个微滴/分钟的速率在收集容器内生成多个微滴,以及第四操作模式,其中多个微滴在收集容器的区域内以密排形式稳定在适当位置。
在一些实施方式中,隔膜在贮器出口的周边处结合到贮器出口。在一些实施方式中,孔的分布具有小于10,000个孔/cm
本公开的附加方面提供了一种方法,包括:在收集容器内生成多个微滴,所述多个微滴中的每一个包括用于核酸材料的数字分析的水性混合物,其中生成多个微滴包括朝向收集容器的封闭端驱动水性混合物穿过径迹蚀刻隔膜的孔的分布以到达稳定位置,以及其中多个微滴的特征在于小于13%的多分散性的变异系数。
在一些实施方式中,生成多个微滴包括以至少600,000个微滴/分钟的速率生成多个微滴。在一些实施方式中,多个微滴的特征在于小于10%的所述核酸材料对微滴的占有率。本公开的另一方面提供了一种包括机器可执行代码的非瞬态计算机可读介质,所述机器可执行代码在由一个或多个计算机处理器执行时实现本文以上或其它地方的任何方法。
本发明的另一方面提供了一种系统,该系统包括一个或多个计算机处理器和与其耦合的计算机存储器。计算机存储器包括机器可执行代码,该机器可执行代码在由一个或多个计算机处理器执行时实现本文以上或其它地方的任何方法。
通过以下详细描述,本领域技术人员将很容易了解本发明的其他方面和优点,其中仅显示和描述了本发明的说明性实施方式。本公开能够具有其它和不同的实施方式,并且其若干细节能够在各种明显的方面进行修改,所有这些都不脱离本公开。因此,附图和描述应被视为本质上是说明性的,而不是限制性的。
援引并入
本说明书中提及的所有出版物、专利和专利申请均通过引用并入本文,其程度如同每个单独的出版物、专利或专利申请都具体且单独地指明通过引用并入。
此外,如果提供数值范围,应当理解的是在该范围的上限和下限之间的每个中间值以及该规定范围内的任何其他规定或中间值都包含在本发明中。这些较小范围的上限和下限可以独立地包括在较小范围内,并且也包括在本发明内,受该规定范围内的任何明确排除的极限限制。如果所述范围包括一个或两个极限,则不包括这两个包括的极限的范围也包括在本发明中。
附图说明
图1描绘了用于生成微滴的系统的实施方式。
图2描绘了用于生成微滴的系统的第一示例。
图3描绘了用于生成微滴的系统中紧固件构造的变体。
图4描绘了用于生成微滴的系统中紧固件构造的变体。
图5描绘了用于组装用于生成微滴的系统的部件的方法的示例。
图6描绘了用于生成微滴的系统的构造的变体。
图7A描绘了用于生成微滴的系统的第二示例。
图7B描绘了用于生成微滴的系统的第三示例。
图7C描绘了用于生成微滴的系统的收集容器的示例。
图8描绘了用于生成微滴的方法的实施方式的流程图。
图9A至图9C描绘了用于产生根据所述方法生成的乳液的所需表面特征的方法的示例。
图10描绘了用于生成微滴的方法的实施方式的流程图。
图11示出了被编程或以其他方式被配置为实现本文提供的方法的计算机系统。
具体实施方式
虽然本发明的各种实施方式已在本文中显示和描述,但对于本领域的技术人员来说,这些实施方式显然仅以举例的方式提供。在不脱离本发明的情况下,本领域技术人员可以想到许多变化、改变和替换。应当理解,可以采用本文所述的本发明的实施方式的各种替代方案。
1.概述
本公开涵盖系统、装置、由该系统和装置执行的方法,以及制造和组装该装置的方法。通常,装置的实施方式包括贮器、功能化隔膜和用于收集容器的支撑体的组件,其中组件快速产生用于数字分析或其它应用用途的乳液的微滴。由这种装置产生的微滴在封闭的收集容器内以三维形式稳定,从而提供了“单管”工作流程,该工作流程从最初样品的接收到将样品分布在极高数量的分割区上,到在单独的分割区内执行反应,再到检测来自封闭的收集容器的单个分割区的内容物所产生的信号,消除了样品交叉污染的风险。
本文公开的系统、方法和装置可以提供相对于其它系统和方法的若干附加益处,并且这种系统、方法和装置被进一步实现到跨各个学科的许多实际应用中。
本公开的装置、方法和系统可以以极高速率生成多个微滴,其中微滴在收集容器内稳定在适当位置(例如,以密排形式、处于平衡静止位置)。值得注意的是,微滴在与各种数字分析和其他生物测定有关的宽范围温度(例如,1℃至95℃,大于95℃,小于1℃)内是稳定的,其中微滴在形态上保持一致,并且保持与相邻微滴未合并。乳液的连续相内的微滴的稳定性进一步以乳液具有高透明度(例如,大于50%的光透射率、大于60%的光透射率、大于70%的光透射率、大于80%的光透射率、大于90%的光透射率、大于99%的光透射率等)的方式执行,使得可以探询(例如,使用3D成像技术、使用平面成像技术等)来自收集容器内乳液的截面的信号。
本文公开的装置、系统和方法可以进一步以一致和受控的方式生成微滴(例如,作为具有低程度多分散性的单分散的、均匀的微滴),用于生物技术(例如,关于微米和纳米级测定)或其他领域的应用。
本文公开的装置、系统和方法进一步提供了一种使用微流控装置生成微滴的具有成本效益的替代方案,其方式是以一致和可靠的方式生成微滴。在具体的示例中,系统和装置可以包括具有径迹蚀刻隔膜的组件,用于以一致和受控的方式(例如,作为单分散/均匀微滴)产生微滴。在这些示例中,隔膜的孔密度和/或孔间间距明显低于可用于基于隔膜过滤的隔膜。
本公开还提供了从微滴生成到单独的微滴内的反应性能,到微滴内容物的光学探询使用单管和封闭管工作流程生成微滴从而在整个数字分析处理期间防止样品交叉污染的一次性装置和方法。
附加地或可备选地,在变体中,本文公开的装置、方法和系统可适于传递极高数量的微滴,其中微滴以极高速率生成到各种井形式和管形式,从而提高现有的基于微滴的系统的性能。
在示例中,本公开的系统、方法和装置可应用于核酸分子的数字扩增(例如,数字聚合酶链式反应(PCR)、数字环介导等温扩增(LAMP)、数字多重置换扩增(MDA)、数字重组酶聚合酶扩增(RPA)、数字解旋酶依赖性扩增、逆转录、体外转录和翻译、重叠延伸扩增等)。
在示例中,本公开的系统、方法和装置可应用于单个细胞和细胞器捕获(例如,用于哺乳动物细胞、细菌细胞、病原体、病毒颗粒、细胞器等)。
在示例中,本发明的系统、方法和装置可应用于单乳液、双乳液或其他乳液的生成。例如,本文公开的系统、方法和装置可以使用离心作用、压力或其它力中的一种或多种来将流体作为微滴穿过彼此不混溶的一层或多层流体(即,“连续流体”)来分散,形成乳液。
在示例中,本公开的系统、方法和装置可应用于其他应用的微粒生成和脂质体生成。
附加地或可备选地,所述系统、装置或方法可赋予任何其他合适的益处。
2.系统
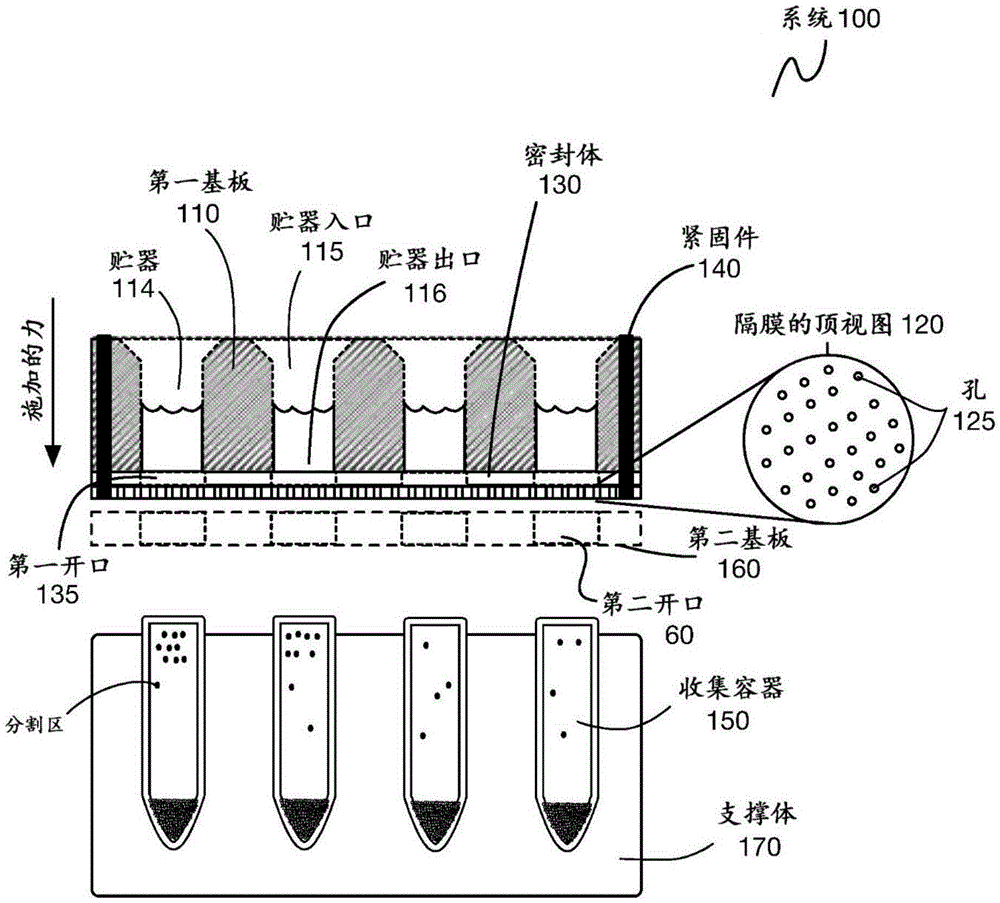
如图1所示,用于微滴生成的系统100的实施方式包括:限定了贮器组114的第一基板110,每个贮器具有贮器入口115和贮器出口116;邻近所述贮器组114的贮器出口定位的一个或多个隔膜120,所述一个或多个隔膜120中的每一个包括孔125的分布;以及可选地,邻近一个或多个隔膜120定位并包括与贮器组114对齐的开口组135的密封体130;以及可选地,配置为将第一基板110、一个或多个隔膜120以及可选密封体130相对于收集容器组150保持在适当位置的一个或多个紧固件(包括图1所示的紧固件140)。在变体中,系统100可附加地包括第二基板160,其中一个或多个隔膜120和密封体130(可选地)通过一个或多个紧固件在第一基板110和第二基板160之间保持在适当位置。
系统100的实施方式用作以极高速率(例如,至少200,000个微滴/分钟、至少300,000个微滴/分钟、至少400,000个微滴/分钟、至少500,000个微滴/分钟、至少600,000个微滴/分钟、至少700,000微滴/分钟、至少800,000微滴/分钟,至少900,000个微滴/分钟、至少1百万个微滴/分钟、至少2百万个微滴/分钟、至少3百万个微滴/分钟等)生成多个微滴,其中微滴在收集容器内稳定在适当位置(例如,以密排形式,处于平衡静止位置)。微滴生成的速率可以是根据施加的力的持续时间确定的平均速率。
系统的实施方式可以进一步用作以一致和受控的方式可靠地生成用于各种应用的微滴(例如,作为具有很少到没有多分散性的单分散和均匀的微滴),所述应用例如数字扩增和分析以及其它测定;在细胞、亚细胞和分子尺度上目标材料的捕获;得益于微滴生成的样品分析;或其它合适的应用。系统100的实施方式还用作以具有成本效益的方式使用非微流控的、一次性的或可重复使用的装置来生成微滴。
系统100的实施方式可用于实施下文第3节所述方法的一个或多个步骤。然而,系统100可以附加地或可备选地被配置为执行其他合适的方法。
2.1系统-支撑基板/外壳
2.1.1支撑基板-第一基板
图1描绘了系统100的实施方式,其中系统100包括限定贮器组114的第一基板110,每个贮器114具有贮器入口115和贮器出口116。第一基板110可用作提供耦合机构的至少一部分,用于相对于一个或多个收集容器150保持系统100的其它元件的位置,如下文更详细描述的。第一基板110还用作接收和分级要穿过隔膜层120传递的流体以形成微滴。第一基板110可被配置为一次性的(例如,由廉价的、可回收的和/或可堆肥的材料组成),使得系统100可提供用于微滴生成的具有成本效益的替代方案。附加地或可备选地,第一基板110可被配置为可重复使用的元件(例如,可用于在系统100的多次运行中的微滴生成)。
为了提供与其他系统元件(例如,收集容器150的支撑体、下文所述的第二基板160等)耦合的坚固机构,第一基板110可由具有合适的机械属性的材料组成。在变体中,第一基板110的材料可被配置为提供与归因于流过贮器组114的应力有关的合适的机械性能(例如由于离心作用引起的应力、由于加压引起的应力、径向应力、剪切应力、纵向应力、拉伸应力、压缩应力、与使用期间对系统100的冲击相关联的应力;由于热膨胀引起的应力、由于热收缩引起的应力以及视应用用途而定的其它相关联的应力)。
附加地或可备选地,第一基板110可由具有合适的热属性的材料组成。在变体中,第一基板110的材料可被配置为提供与以下一个或多个有关的合适的热属性:热导率(例如,与系统100生成微滴的流体的加热或冷却有关)和视应用用途而定的其它热属性。
附加地或可备选地,第一基板110可由具有合适的物理或表面属性的材料组成。在变体中,外壳121的材料和/或界面120的其他方面可被配置为提供与以下一个或多个有关的合适的物理或表面属性:与样品材料的非反应性;低孔隙率(例如,以便不吸收样品材料);高疏水性;和其它合适的物理或表面性质。
附加地或可备选地,第一基板110可由具有合适的光学属性(例如,用于样品材料的光学探询,用于保护样品材料免受电磁辐射等)的材料组成。在变体中,第一基板110是半透明的、透明的或者具有高透明度,以支持对贮器组114内的样品材料或样品处理材料的光学探询。此外,第一基板110的半透明或透明特征可以启用操作模式,在该操作模式中,贮器组114的内容物可被可视化(例如,在手动填充期间、在自动填充期间),使得在使用系统100生成分割区之前可以验证每个贮器内的材料水平。因此,第一基板110可由具有合适的透明度水平的材料组成。仍然可备选地,第一基板110可由不透明材料组成。
在变体中,第一基板110可由合成材料或天然材料组成。在示例中,第一基板110可由聚合物材料(例如,聚醚醚酮、乙缩醛、丙烯腈丁二烯苯乙烯、尼龙、聚碳酸酯、聚丙烯、聚苯乙烯等);金属材料、陶瓷材料、复合材料或其它合适的材料组成。第一基板110可以通过机械加工、打印(例如,3D打印)、模制(例如,注射模制)或通过另一种合适的方法来制造。
在变体中,第一基板110可以具有宽表面,在该宽表面处(例如,穿过开口)进入贮器组114。如图1所示,每个贮器可以具有贮器入口115和贮器出口116。贮器入口115可以被定义为在第一基板110的宽表面处的开放表面,并且贮器出口可以被定义为在第一基板110的第二表面处的开放表面。每个贮器可以定义用于接收从中生成微滴的流体的空腔。在示例中,空腔可以具有从1μL至100mL的体积;然而,空腔的变体可以具有另一合适的体积。空腔从贮器入口115到贮器出口116的截面(例如,横截面)可以是恒定的。可备选地,空腔从贮器入口115到贮器出口116的截面可以不是恒定的。例如,靠近贮器入口115的空腔的一部分可以包括被配置与流体输送装置(例如,移液管尖端)互补的形态(例如,钟形形态),从而便于流体转移到系统100用于微滴生成。附加地或可备选地,空腔可以限定从贮器入口115到贮器出口116的非直线或非线性路径。此外,在变体中,贮器组114中的贮器可以在第一基板110的任何其他合适的表面处具有贮器入口115,在第一基板110的任何其他合适的出口处具有贮器出口116,或者限定从贮器入口115到贮器出口116的另一合适的流体路径。
一个或多个过滤器可以进一步定位在贮器组114内和/或以其他方式定位在下文进一步详细描述的一个或多个隔膜120的上游,其中过滤器可以用作去除不期望的材料并防止不期望的材料进入微滴或破坏微滴形成。在示例中,过滤器可以被构造为允许来自样品的目标(例如,核酸、蛋白质、细胞、病毒材料、化学品、分析物等)通过,用于分布在多个微滴上,其中这种过滤器可以相应地具有合适的大小、多孔性、疏水性、表面电荷和/或其它特征。
图2所示的第一基板110a的示例包括对应于用于生成的微滴的四个收集容器(例如,互补设备的)的四个贮器;然而,第一基板110可备选地限定另一合适数量的贮器(例如,从1至10000个贮器)。此外,贮器的数量可以不以一对一的方式对应于收集容器的数量。例如,第一基板110可以限定比收集容器的数量少的一定数量的贮器入口,其中贮器可被配置为沿着它们各自的长度分支并且在对应于收集容器的出口处终止。因此,多个样品可以分布在多个收集容器上,其中收集容器的数量大于样品的数量。可备选地,第一基板110可以限定比收集容器的数量大的一定数量的贮器入口。因此,多个贮器的内容物可以在分布到收集容器组之前组合(例如,在生成微滴之前样品和处理材料在贮器内混合的变体中)。因此,贮器组的贮器数量可以不同于收集容器组的收集容器数量,并且第一基板可以包括从贮器组到隔膜组的一个或多个流控路径(或两个或更多个流控路径)。
第一基板110可以包括配置为接收或定位紧固件组140(在下文更详细描述的)的特征件,用于与系统100的其他元件耦合,以便能够使系统100的元件相对于彼此保持在适当位置。这种特征件维持系统元件之间的对齐和相对定位,并提供元件的适当的密封(例如,隔膜到贮器出口)。在图2所示的示例中,紧固件组140a可以包括在第一基板110a处的突起组,所述突起组与第二基板160a处的突片互补。
可备选地,如图3所示,第一基板110c可以包括限定了穿过凸缘的通孔的凸缘组,该凸缘具有平行于第一基板110b的宽表面的取向,使得包括紧固件140b的紧固件组平行于宽表面经过互补元件(例如,第二基板110b、收集容器支撑体等)的相应开口。在这个变体中,第一基板110与互补元件的分离将对所述紧固件组施加剪切。
仍然可备选地,第一基板110可以不限定任何开口或通孔,但能够使用另一合适的机构紧固。例如,第一基板110可以包括以下一个或多个:在第一基板110c和互补元件(例如,第二基板160c、收集容器支撑体等)的凹槽之间形成搭扣配合机构的一部分的突起(例如,突片,如图4所示);能够与互补元件(例如,第二基板110、收集容器支撑体等)磁耦合的磁性元件;与互补元件(例如,第二基板110、收集容器支撑体等)耦合的粘性元件;和其它合适的耦合机构。图2、图3和图4所示的构造提供了系统100的元件之间的可靠耦合,而不会对进入第一基板的贮器提供障碍。
附加地或可备选地,第一基板110可以包括配置为接收或定位用于耦合到系统100的其他元件的紧固件组140的特征件,以便能够使系统100的元件相对于彼此保持在适当位置。在一个变体中,第一基板110可以包括垂直于第一基板110的宽表面穿过的通孔组,以便能够在第一基板和互补元件(例如,第二基板110、收集容器支撑体等)之间进行紧固,其中隔膜层120和密封体130(可选地)定位(例如,夹入、压缩)在第一基板110和互补元件之间。在这个变体中,第一基板110与互补元件的分离将对所述紧固件组150施加张力。
2.1.2支撑基板-第二基板
在变体中,系统100可以附加地包括第二基板160,其中一个或多个隔膜120和密封体130(可选地)通过一个或多个紧固件140保持在第一基板110和第二基板160之间的适当位置,下文将对此进行更详细的描述。在变体中,第二基板160可以限定与贮器组114和/或收集容器组150相对应的开口(包括图1所示的第二开口60),使得在流体穿过一个或多个隔膜120传递时形成的微滴经过第二基板160的开口并进入收集容器组150中。第二基板160的开口可以进一步将收集容器保持在适当位置和/或与相应的贮器出口对齐,使得生成的微滴直接转移到收集容器中。
第二基板160的示例显示在图2中,其中包括紧固件140a的紧固件组将第一基板110a耦合到第二基板160,隔膜120a保持在第一基板110和第二基板160之间的适当位置。第二基板160a可以在上述材料成分和/或属性方面与第一基板110相同或不同。此外,第二基板160a可以包括或限定通道,流体穿过该通道以期望的方式进入收集容器。
在图2所示的示例中,贮器114a部分地由第一基板110a和贮器通道14a形成,其中贮器通道14a和第一基板110a的开口配合以限定体积,材料(例如,样品流体、工艺流体等)可被接收到该体积中以用于分割。如图2所示,第一基板110a和贮器通道14a可以抵靠彼此密封(例如,由密封件130a,通过使用兼容材料,使得抵靠贮器通道14a偏压第一基板110a形成密封等)。此外,如图2所示,隔膜120a可定位在贮器通道14a的出口处,并落座在第二基板160a内,或者经过第二基板进入各自的收集容器150a。在变体中,隔膜120a可以结合到贮器通道14a的贮器出口,或者以另一种方式(例如,通过落座在贮器通道14a和第二基板160a之间)保持在适当位置。
虽然上述第一基板110的实施方式、变体和示例包括贮器组的描述,但第一基板110和/或第二基板160的变体可备选地限定进入单个收集容器的单个贮器或路径。
2.2系统-隔膜
如图1所示,系统100可以包括与所述贮器组114的贮器出口相邻定位的一个或多个隔膜120。所述隔膜层120包括孔125的分布,来自所述贮器组114的流体经过所述孔125的分布或被驱动生成用于各种应用的微滴。一个或多个隔膜120可以进一步用作为微流控装置提供用于生成微滴的具有成本效益的替代方案,其中一个或多个隔膜120连同所述系统100的其它元件可以以一致(例如,具有高均匀性、低融合性、低多分散性)和可靠的方式,并以极快的速率生成期望形态的微滴(例如,与样品体积和分割区的目标总数有关的目标微滴大小)。
对于以受控方式生成微滴,系统100的隔膜120可以包括具有精确限定的孔大小、隔膜厚度和孔密度的一个或多个径迹蚀刻隔膜(例如,隔膜片)或由其组成。为了生成微滴,凭借施加的力(例如,离心作用、加压气体等)迫使隔膜层120上游的一个或多个贮器中的流体穿过孔125的分布。在离开孔125的分布时形成的微滴然后从隔膜120传递到一个或多个各自的收集容器中,如下文更详细描述的,其中收集容器包含流体(例如,空气、与微滴材料不混溶的流体等)。虽然隔膜120可以被以精确的方式径迹蚀刻(例如,关于大小、形状和密度)以生成孔的分布,但是隔膜120可以可备选地在没有离子径迹技术的情况下生成。例如,隔膜120可备选地使用另一种方法(例如,激光蚀刻、化学蚀刻、电穿孔等)生成。
如图1所示,一个或多个隔膜120被配置为邻近第一基板110的贮器出口116保持在适当位置。在变体中,隔膜120因此可以定位在上述贮器组114的贮器内。可备选地,隔膜120可以定位在第一基板110的贮器出口的外面(例如,在贮器114的外部终端部分,贮器出口116的下游处)。
在变体中,隔膜120可以包括材料的连续体,该材料的连续体例如通过将隔膜120夹在或以其他方式将隔膜120在第一基板110的贮器出口下游保持在适当位置,而定位在贮器组的所有一个或多个贮器出口上。可备选地,一个或多个隔膜120可以包括定位在第一基板110的终端区域或贮器内的分离的材料体或区域。在一个或多个隔膜120包括分离的材料体或区域的变体中,分离的材料体/区域均可以具有不同的特征(例如,关于携带不同类型流体的贮器,关于不同大小微滴的生成等)。因此,在一些变体中,每个贮器可以具有其自身的与相邻隔膜区域分离的相关联的隔膜区域。在一个或多个隔膜120被分开的变体中,单独的隔膜区域可被物理屏障(例如,间隙、无孔/非吸收性材料体等)分开,或被另一合适的屏障分开。
一个或多个隔膜120可以与其他相邻的系统元件(例如,第一基板110、贮器出口116、可选密封体130,第二基板160等)通过以下一个或多个方式耦合:黏合剂、热结合、机械结合、化学结合、激光焊接、超声波焊接、光固化黏合剂、热固化黏合剂、湿固化黏合剂、注射成型(作为使用包覆成型的单片)和/或另一合适的结合机构。
图5描绘了在贮器出口116d的周边处将隔膜120d结合到贮器116d的贮器出口16d的示例方法。如图5所示,光固化(例如,紫外光固化)黏合剂12d被施加到贮器出口16d的外部部分的周边。然后,隔膜的材料(例如,行迹蚀刻的聚碳酸酯、行迹蚀刻的聚乙烯等)在周边处被施加到贮器出口16d,接着在隔膜120d的材料上施加离型膜17d。然后,将光固化黏合剂12d暴露于适合的波长的光(例如,紫外光),接着去除离型膜17d和隔膜120d的多余材料。然而,在变体中,隔膜120可以以另一合适的方式耦合到第一基板110和/或贮器116。
在变体中,一个或多个隔膜120可由聚合物材料(例如,聚碳酸酯、聚酯、聚酰亚胺)组成。在第一具体示例中,一个或多个隔膜120是聚碳酸酯径迹蚀刻(PCTE)隔膜。在第二具体示例中,一个或多个隔膜120是聚乙烯径迹蚀刻隔膜。然而,一个或多个隔膜120可备选地由以另一合适方式处理的另一合适材料组成。
在变体中,孔120的分布可以在体隔膜材料中生成,所述体隔膜材料具有具体的孔直径、孔深度(例如,与隔膜厚度有关)、纵横比、孔密度和孔取向,其中,结合流体参数,隔膜的结构可获得期望的流速特征,具有降低或消除的多分散性和融合性,以及微滴的平稳形成(例如,没有从隔膜孔喷射流体)。
在变体中,孔直径可在0.2微米至30微米的范围内,且在示例中,孔可具有平均孔直径,该平均孔直径可以是0.02微米、0.04微米、0.06微米、0.08微米、0.1微米、0.5微米、1微米、2微米、3微米、4微米、5微米、6微米、7微米、8微米、9微米、10微米、20微米、30微米、任何中间值,或大于30微米(例如,使用厚度大于或以其他方式有助于大于100微米的孔深度的隔膜)。
在变体中,孔深度的范围可以是1微米至200微米(例如,与隔膜层的厚度有关)或更大,且在示例中,孔深度(例如,由隔膜厚度控制(govern))可以是1微米、5微米、10微米、20微米、30微米、40微米、50微米、60微米、70微米、80微米、90微米、100微米、125微米、150微米、175微米、200微米或任何中间值。
在变体中,孔的纵横比可在5:1至200:1的范围内,且在示例中,孔的纵横比可以是5:1、10:1、20:1、30:1、40:1、50:1、60:l、70:l、80:l、90:l、100:l、125:l、150:l、175:1、200:1或任何中间值。
在变体中,孔密度的范围可以是100个孔/cm
在变体中,孔间间距的范围可以是5微米至200微米或更大,且在示例中,孔间间距为5微米、10微米、20微米、30微米、40微米、50微米、60微米、70微米、80微米、90微米、100微米、125微米、150微米、175微米、200微米或更大。在具体示例中,孔间间距大于10微米。
在变体中,隔膜120可具有1微米至50微米的直径或其它特征尺寸,且在示例中,直径或其它特征尺寸可以是1微米、2微米、3微米、4微米、5微米、6微米、7微米、8微米、9微米、10微米、20微米、30微米、40微米、50微米或任何中间值。
在示例中,孔取向可以是基本垂直的(例如,在与占主导地位的重力有关的使用期间),否则通过孔的分布与施加力的方向对齐,或者相对于隔膜层120的参考平面成另一合适的角度。
在具体的示例中,隔膜层的厚度可以是23-125微米,孔密度小于10,000个孔/cm
但是,也可以使用其他流体组合物和特征,如2021年11月2日授权的美国专利No.11162,136中所述的,其全部内容作为参考引入本文。
对于表面属性,隔膜层120可用疏水性材料处理或涂布,以便改进微滴的一致性(例如,有关一致的微滴大小、有关受控的微滴大小、有关单分散性等)。疏水材料附加地可以用作改善微滴的热稳定性。在变体中,疏水性材料可以包括以下一种或多种:油、聚硅氧烷(例如,羟基封端的聚二甲基硅氧烷)、具有聚合物粘结剂的氟碳涂覆的二氧化硅;具有或不具有基板(例如,纳米颗粒基板)分布的全氟烷基甲基丙烯酸酯共聚物;聚苯乙烯材料(例如,氧化锰聚苯乙烯、氧化锌聚苯乙烯)、沉淀碳酸钙、碳纳米管、氟化硅烷、含氟聚合物涂层、二氧化硅基涂层、纳米涂层和/或其它合适的疏水或超疏水材料。材料涂层可被处理或以其它方式选择以产生与接触角特征(例如,静态接触角、接触角滞后)、滑动角特征和/或其它合适的特征有关的期望特征。
在变体中,可通过以下一种或多种技术将疏水/超疏水材料施加至隔膜层120:浸涂、喷涂、沉积(例如,化学气相沉积)、原位生长、聚合、等离子体涂布和/或另一种合适的涂布技术。
附加地或可备选地,隔膜层120可以包括其它部件或涂层或用所述其它部件或涂层处理,以提供与以下一项或多项有关的期望功能:静电荷屏蔽(例如,防止蛋白质和其它生物分子的吸附,以提高微滴稳定性)、保护隔膜层(例如,防止降解)和/或另一合适的功能。
基于与隔膜层120和所施加的力相关联因素组,可以产生期望的微滴尺寸。隔膜层120的参数可以改进,以生成与任何一个或多个韦伯数有关的单分散微滴;与流体惯性、表面张力或其他因素有关的其他因素。在关于韦伯数的更多细节中,隔膜层120可被配置有合适的特征孔尺寸D(例如,孔深度、孔直径)、预期的流体密度ρ、在微滴生成期间控制的流体速度v、以及流体表面张力σ,其中韦伯数We=ρv
与之相关的是,可以改进与隔膜层120、流体特征和施加的力特征相关联的参数,以生成具有期望尺寸的微滴。在利用隔膜层120和收集容器内的收集流体之间的空气间隙形成微滴的变体中,微滴半径R是孔半径r
在用于在隔膜层120和收集容器内的收集流体(例如,油)之间没有空气间隙的微滴形成的变体中,微滴半径R是孔半径r
在具体的示例中,所得微滴大小可以是10微米至80微米;然而,隔膜层120和/或系统100的变体,以及施加的力、待滴化的流体和接收流体的流体密度、待滴化的流体的界面张力可被配置为生成具有任何其他合适尺寸的微滴。
2.3系统-密封件
如图1所示,系统100可选地可以包括一个或多个密封体130,所述密封体130与隔膜层120相邻定位,并包括与贮器组114对齐的开口组135。所述密封体130用作以期望的方式促进流体从第一基板110的贮器传递并穿过隔膜层120到收集容器,而不会以不期望的方式从系统100泄漏。然而,在一些变体中,系统100可以省略密封体,如在其中隔膜层120例如经由可光固化结合、热结合或激光焊接直接结合到其它系统元件的变体中(例如,图7A-7B中所示的示例并在下文关于图5进行描述)。
在变体中,密封体130可以包括隔膜层120上游的第一部分。附加地或可备选地,密封体130可以包括隔膜层下游的第二部分。在这种变体中,密封体130的部分可被压缩或以其它方式抵靠隔膜层(例如,通过紧固件组150、第一基板110和/或第二基板160)保持。在这些变体中,密封体130部分可以包括或以其它方式限定与贮器组114或收集容器组对齐并对应的开口,如下文更详细描述的。附加地或可备选地,在图6所示的变体中,密封体130可附加地或可备选地包括定位在第一基板110的贮器内的部分(例如,垫圈或O形环),以便抵靠流体输送或加压装置密封,所述流体输送或加压装置被配置为将流体驱动到隔膜层120或驱动该流体穿过隔膜层120用于微滴形成。
在变体中,密封体130可以包括以下一种或多种:黏合剂(例如,光固化黏合剂)、热结合密封件、密封元件(例如,O型环、垫圈等)、密封隔膜或密封膏或其他密封元件。
2.4系统-紧固件和收集容器
如图1所示,系统100可以包括配置为相对于收集容器组150将第一基板110、隔膜层120和密封体130保持在适当位置的一个或多个紧固件140。在微滴形成期间,关于施加到系统的力,一个或多个紧固件140用作将系统100的元件压缩或以其它方式正确地保持在适当位置。
在变体中,紧固件140可以包括以下一个或多个:螺钉、销、柱塞、突起(例如,凸片)、凹槽(例如,配置为与突起配合的凹槽)、磁性元件、黏合剂、结合耦合器(例如,热结合耦合器)和/或其他合适的紧固件。紧固件的变体如图2、3和4所示,如上所述,其中在图4所示的变体中,紧固件140包括与互补元件(例如,第二基板110、收集容器支撑体等)的凹槽形成搭扣配合机构的一部分的突起。
如图1、2、6和7A-7C所示,系统100可被配置为与一个或多个收集容器150互补、配合或以其他方式对接,用于接收生成的微滴。图7A描绘了系统100的示例,其具有贮器组,所述贮器组包括限定在第一基板110e内的贮器,其中包括隔膜120e的隔膜组结合到所述贮器组的贮器出口(例如,使用关于图5所示和所述的过程)。图7A所示的系统进一步包括第二基板160e,该第二基板160e支撑包括收集容器150e的收集容器并使收集容器与贮器组对齐,使得在系统的使用期间,隔膜组定位在收集容器内。在使用期间,第一基板110e因此与第二基板160e和收集容器组装在一起,定位在支撑体170e内,用于施加力以生成微滴。
在变体中,系统100可以以在系统100和收集容器之间有间隙(例如,用于空气,用于另一流体)的方式配置。在这种变体中,其中一个如图7B所示,第二基板可被配置为将(在各自贮器出口处的)隔膜120f与收集容器150f的底面50f分离的间隔物160f。因此,在收集容器150f内用一个或多个流体层生成微滴期间,隔膜120f可在流体层上方隔开(图7B,右上),使得从隔膜生成的微滴在撞击流体层之前经过空气或其它流体。然而,基板160可以不被配置为间隔物,如图7B(右下)所示,从而将贮器出口116e直接定位在用于微滴生成的流体层(例如,用于水性样品流体的非水相、油相)内。因此,系统100可以以在系统100和收集容器之间没有间隙的方式配置,并且生成的微滴直接从系统传递到各自收集容器内的液体层中。
在变体中,收集容器可以包括任何合适数量的具有期望体积容量的容器。在示例(其中一些在图7A-7C中示出)中,收集容器150可被配置有一种或多种以下形式:0.2ml管形式、条管(例如,8x条管形式)、微量滴定板形式(例如,96孔板形式、48孔板形式、24孔板形式、12孔板形式等)、1.5ml管形式、锥形管形式(例如,15ml锥形形式、50ml锥形形式等)或另一合适的形式。收集容器可以是一次性的或可重复使用的。在一些变体中,收集容器可以由支撑体170支撑,该支撑体170被配置为关于施力设备正确地定位系统100。如图1和图2所示,收集容器可分别由支撑体170、170a支撑,其可用作水平吊斗,用于将系统100定位在离心机内以施力,从而生成微滴。然而,支撑体可以以另一合适的方式配置。
然而,系统100可以包括以期望的方式生成微滴的其他合适元件。此外,系统100可被配置为在各种操作模式之间转换,这些操作模式包括:第一操作模式,其中第一基板与第二基板耦合并包围收集容器,贮器出口落座在收集容器内(图7A中所示的示例);第二操作模式,其中贮器容纳样品流体(图1中所示的示例);以及第三操作模式,其中隔膜响应于施加到样品流体的力以高速率(例如,至少1百万个微滴/分钟,以所述的其他速率)在收集容器内生成多个微滴;以及第四操作模式,其中多个微滴在收集容器的区域内以密排形式稳定在适当位置。关于所述的操作模式,系统的结构配置或系统的内容物可以以前所未有的速率产生用于数字分析和其它应用的具有低程度的多分散性的微滴(例如,小于15%的多分散性的变异系数、小于14%的多分散性的变异系数、小于13%的多分散性的变异系数、小于12%的多分散性的变异系数、小于11%的多分散性的变异系数、小于10%的多分散性的变异系数、小于9%的多分散性的变异系数、小于8%的多分散性的变异系数、小于7%的多分散性的变异系数、小于6%的多分散性的变异系数、小于5%的多分散性的变异系数等),如上所述。
因此,生成多个微滴可以包括朝向收集容器的封闭端驱动水性混合物穿过隔膜(例如,径迹蚀刻隔膜)的孔的分布到稳定的位置,多个微滴具有明显的低多分散性,如上所述。
方法的各方面由下文更详细描述的系统100的实施方式、变体和示例执行。
3.方法
如图8所示,用于微滴生成的方法200的实施方式可以包括:在收集容器内以高速率生成多个微滴,所述多个微滴中的每一个包括用于数字分析的水性混合物S210。在实施方式中,在收集容器的区域内,在生成时,多个微滴以连续相内的密排形式(例如,三维密排形式、六边形密排形式、矩形密排形式等)稳定在适当位置S220。
方法200的实施方式可以在数字分析和其他测定的背景下用作以极高和前所未有的速率生成多个微滴,其中微滴在收集容器内稳定在适当位置(例如,以密集形式,处于平衡静止位置)。方法100的实施方式进一步可以用作以一致和受控的方式可靠地生成微滴用于各种应用(例如,作为具有很少到不具有多分散性的单分散和均匀的微滴),该应用例如数字放大和分析以及其它测定;在细胞、亚细胞和分子尺度上捕获目标材料;得益于微滴生成的样品分析;和/或其它合适的应用。方法的实施方式可以用作以成本有效的方式使用非微流控的、一次性的或可重复使用的装置来生成微滴。
方法200的实施方式、变体和示例可由或通过上文第2节所述的系统100的部件的实施方式、变体和示例来实现。然而,方法200可以附加地或可备选地被配置为执行其他合适的方法。
3.1方法-微滴生成
对于步骤S210中的以高速率生成微滴,方法200的变体可以使用上述系统元件的实施方式、变体和示例以至少200,000个微滴/分钟、至少300,000个微滴/分钟、至少400,000个微滴/分钟、至少500,000个微滴/分钟、至少600,000个微滴/分钟、至少700,000个微滴/分钟和至少800,000个微滴/分钟的速率、至少900,000个微滴/分钟、至少1百万个微滴/分钟、至少2百万个微滴/分钟、至少3百万个微滴/分钟或更大的速率来产生微滴。对于孔密度、孔间间距、孔直径、隔膜厚度、孔纵横比、隔膜材料和/或其它特征,使用上述隔膜120的实施方式、变体和示例,可以以高速率生成微滴。
对于步骤S210中的微滴生成,极高数量的微滴可以在收集容器内生成,其中,在变体中,大于2百万个微滴、大于3百万个微滴、大于4百万个微滴、大于5百万个微滴、大于6百万个微滴、大于7百万个微滴、大于8百万个微滴、大于9百万个微滴、大于1,000万个微滴、大于1,500万个微滴、大于2,000万个微滴、大于2,500万个微滴、大于3,000万个微滴、大于4,000万个微滴、大于5,000万个微滴、大于1亿个微滴、大于2亿个微滴、大于3亿个微滴或更多可以在收集容器内生成。
在变体中,收集容器的体积容量可小于50微升或50至300微升或更大。收集容器的示例可以包括体积容量是20微升至50微升的PCR条管;然而,在上文第2节中更详细地描述了收集容器的其它变体和示例。在步骤S210中生成的微滴可以具有与数字分析、单细胞捕获、目标检测、单独的分子分割或其他应用相关的特征尺寸(例如,1-50微米、10-30微米、所述范围内的中间值等)。
在步骤S210中生成多个微滴可以包括驱动样品流体穿过包括孔的分布的隔膜,该隔膜与用于样品流体的贮器的贮器出口对齐或耦合。驱动样品流体可以包括施加离心力(例如,通过离心作用)以驱动样品流体穿过隔膜的孔。在变体中,离心力可以以1,000g、2,000g、3,000g、4,000g、5,000g、6,000g、7,000g、8,000g、9,000g、10,000g、11,000g、12,0000g、13,000g、14,000g、15,000g、16,000g、17,000g、18,000g、19,000g、20,000g、30,000g、任何中间值或大于30,000g施加。旋转的持续时间可以是2分钟、3分钟、4分钟、5分钟、6分钟、7分钟、8分钟、9分钟、10分钟、11分钟、12分钟、13分钟、14分钟、15分钟、16分钟、17分钟、18分钟、19分钟、20分钟、30分钟,40分钟、50分钟、任何中间值或大于50分钟,其中旋转的持续时间是根据所述方法被滴化的样品流体的量的函数。
对于乳液的微滴生成(例如,通过驱动样品流体穿过流体的一个或多个不混溶层以形成多相乳液),其中生成的所得乳液具有粘性、剪切增厚属性和/或凝胶状属性(例如,正如在生成乳液时出现的一样,其中微滴是由与第一相不混溶的第二相膜围绕的第一相,并且微滴由与第三相不混溶的连续的第三相围绕),离心作用可以产生具有不平坦的顶面/上表面(例如,沿归因于离心作用的径向方向的力轴,离收集容器的底部最远的表面)的乳液,其示例如图9A所示。由于较高的背景、降低的透明度和/或其他因素,这种不平坦的表面可以增加来自靠近顶面/上表面(例如,离收集容器的底部最远的乳液表面)的微滴的信号的读出的难度。
因此,方法200可以进一步包括步骤S214,如图9B所示,涉及在第一旋转方向上旋转离心机内的样品流体、隔膜和收集容器,并使该旋转方向反向,从而调整包括收集容器内的多个微滴的乳液的表面轮廓。调整表面轮廓可以改善表面轮廓的水平度、平面度或其它特征中的一个或多个,以提高读出的能力。对于S214,在第一方向和第二方向上的旋转可以在离心力处于提供的上述范围内或在所述范围外的情况下执行。此外,在第一方向上的旋转可以以第一旋转速度执行,并且在第二方向上的旋转可以以不同于第一旋转速度的第二旋转速度执行。
附加地或可备选地,方法200可以进一步包括步骤S216,其如图9C所示,涉及以第一旋转速度和小于第一旋转速度的第二旋转速度旋转离心机内的样品流体、隔膜和收集容器,从而调整包括收集容器内的多个微滴的乳液的表面轮廓。调整表面轮廓可以改善表面轮廓的水平度、平面度或其它特性中的一个或多个,以提高读出的能力。对于S216,以第一旋转速度和第二旋转速度的旋转可以在离心力处于提供的上述范围内或在所述范围外的情况下执行。此外,对于步骤S214和S216,达到第一旋转速度和/或第二旋转速度可以以斜坡上升或加速速率来执行,以便改善乳液的表面特点。
在备选的变体中,施加的力可以与施加的压力、磁性施加或其他物理施加以驱动样品流体穿过隔膜相关联。
对于用于生成乳液的收集容器内的样品流体和/或流体层的成分,收集容器内的样品流体和流体层可以具有一定密度、粘度、表面张力、水性、疏水性、不混溶特征或其它特征中的一种或多种。取决于应用,实现的流体可以具有1至3000kg/m
在实施方式中,当生成时,在收集容器的区域内,多个微滴可以在连续相内以密排形式(例如,三维密排形式、六边形密排形式、矩形密排形式等)稳定在适当位置S220。对于所述的隔膜,生成多个微滴可以包括朝向收集容器的封闭端传递微滴(例如,来自隔膜的孔的微滴的二维阵列),从而朝向收集容器的封闭端以三维密排形式稳定多个微滴。可备选地,多个微滴可以以非密排形式朝向收集容器的封闭端或不同区域稳定(例如,在连续相内、在定位在收集容器内的基质内、在收集容器内的网孔内等)。例如,在封闭的收集容器内非密排的微滴或可以相对于彼此移动的微滴仍然可以由光学探询处理,如在下文第3节中更详细地描述的(例如,通过相对于光学探询仪器的扫描路径固定封闭的收集容器的位置)。附加地或可备选地,有关密排或非密排形式,乳液的微滴可以通过固化(例如,用光、用热、用pH位移、用其它交联、凭借电场、凭借磁场等)乳液的分散相、连续相或两者来稳定在适当位置。仍可备选地,微滴可能不会稳定在适当位置或以密排形式稳定(例如,微滴可能在容器内相对于彼此移动,例如对于油包水或水包油乳液等)。
在一些变体中,如图8所示,方法200可以进一步包括:在热传递操作期间,在收集容器内,将热量传递到多个微滴并从多个微滴传递热量S230。热传递可以与冷藏(例如,冷藏、冷冻等)、热循环(例如,在扩增期间)、孵育、裂解、酶活化或另一种热传递操作相关联。在变体中,在热传递操作期间,温度可在0℃至95℃之间变化,且在具体的示例中,温度可在所述范围内的温度之间转变,维持微滴的稳定性。特别地,给定所述微滴生成技术和材料,在热传递操作期间,多个微滴中的单独的微滴以密排形式保持与相邻微滴未合并。
在一些变体中,如图8所示,方法200可以进一步包括:在收集容器内对多个微滴执行光学探询操作,其中光学探询操作可以包括来自多个微滴中的微滴的信号(例如,光信号、荧光信号、比色信号等)的读出S240。特别地,可以使用在通过引用并入的申请中描述的技术,对收集容器内的多个微滴的截面执行读出。
在变体中,荧光信号的读出(例如,从分散相的微滴内的标记分析物,从分散相的微滴内的分析物的产物等)可通过3D扫描技术(例如,光片成像、共焦显微镜等)和平面成像技术(例如,拍摄封闭容器的截面的图像)中的一种或多种来执行。附加地或可备选地,在一些应用中,可以通过3D成像技术(例如,使用光场成像的3D明场构造等)来执行与分散相的微滴相关联的比色变化的读出。在多个颜色通道上(例如,2个颜色通道、3个颜色通道、4个颜色通道、5个颜色信道、6个颜色信道、7个颜色信道等),可以对多个微滴/收集容器的截面组中的每一个执行读出。
对于颜色通道组中的每一个,在封闭的收集容器内,可以对多个微滴的10个截面、多个微滴的20个截面、多个微滴的30个截面、多个微滴的40个截面、多个微滴的50个截面、多个微滴的60个截面、多个微滴的70个截面、多个微滴的80个截面、多个微滴的90个截面、多个微滴的100个截面、多个微滴的200个截面、多个微滴的300个截面,多个微滴的400个截面、多个微滴的500个截面和多个微滴的600个截面、任何中间值或更多执行读出。
在具体的示例中,取决于(例如,用于照亮微滴并诱发荧光的光源的)信噪比、光学传感器灵敏度、激发功率或其它特征,可以在5分钟、4分钟、3分钟、2分钟、1分钟、30秒、20秒、10秒或更短的持续时间内对每一通道执行与数字分析(例如,计数、量化等)相关联的读出。
在其它变体中,可以执行来自分散相的微滴的非荧光信号的读出。例如,由分散相的单独的微滴内的反应得到的产物可以在折射率、光吸收、光散射、光反射、光透射或不同于空的或未反应的微滴的其它光相互作用特征中的一个或多个方面产生变化,用于通过各种技术(例如,分光光度技术、比浊技术等)进行检测。
因此,视应用用途而定,所述方法能够在比现有技术大10-100倍的宽动态范围内进行数字分析。在与核酸计数有关的示例中,本文所公开的方法可以具有从1到1亿的动态范围,这是由于生成了极高数量的均匀分割区,从所生成的分割区可以读取信号,并且由于以目标对分割区的低占有率(例如,小于20%的占有率、小于15%的占有率、小于10%的占有率、小于9%的占有率、小于8%的占有率、小于7%的占有率、小于6%的占有率、小于5%的占有率等)进行分割的能力。在变体中,这种低占有率可以实现感兴趣的目标的表征,而不需要与泊松统计相关联的用于分割误差或其他误差的校正因子。
在示例中,在封闭容器内大量微滴的生成(如所述)可以在持续时间内以所述速率(例如,在1百万个微滴/分钟的量级上)执行,并且用于数字分析的每个通道的读出可以以高速率(例如,在多个颜色通道上,每个通道小于1分钟)执行,从而能够实现在分钟或小时的量级(具有如上所述的持续时间)上对数百万个分割区的数字分析的读出。
因此,针对数字分析的通道组中的每一个,用于通过多个所述微滴的读出来生成微滴的方法可以在1分钟、2分钟、3分钟、4分钟、5分钟、6分钟、7分钟、8分钟、9分钟、10分钟,11分钟,12分钟、13分钟、14分钟、15分钟、20分钟、25分钟、30分钟、35分钟、40分钟、45分钟、50分钟、55分钟、1小时、2小时、3小时、4小时或任何中间值的持续时间内执行。在示例中,一旦已经执行了微滴生成和扩增/标记,就可以取决于(例如,用于照亮微滴并诱发荧光的光源的)信噪比、光学传感器灵敏度、激发功率或其他特征中的一个或多个,在5分钟、4分钟、3分钟、2分钟、1分钟、30秒、20秒、10秒或更短时间内执行来自每个通道的信号的读出。
因此,通过多个微滴的读出来生成微滴的方法可以包括:在持续时间(例如,所述的持续时间)内,执行来自样品的目标核酸材料的数字分析,其中执行该数字分析包括:生成多个微滴(例如,在封闭的收集容器内),所述多个微滴包括由所述样品和用于扩增反应的材料的组合生成的多个微滴,单独隔离所述多个微滴(例如,在乳液的连续相内),接收热量(例如,通过封闭的收集容器),从而扩增所述目标核酸材料,并且传递信号(例如,从包括封闭的收集容器内的多个微滴的乳液的截面组中),用于使用检测系统(例如,与封闭的收集容器相互作用的检测系统)的通道组读出。
3.1.1方法-实现
如图10所示,用于微滴生成的方法300的实施方式包括:提供组件S310,该组件包括:限定一个或多个贮器的第一基板,包括定位在所述一个或多个贮器下游的孔的分布的隔膜层,与隔膜层相邻定位并包括与贮器组对齐的开口组的一个或者多个密封体以及可选地,被配置为相对于容纳第一流体的一个或多个收集容器将组件保持在适当位置的一个或多个紧固件;可选地,将第二流体接收到所述一个或多个贮器中S320,其中所述第二流体旨在用于微滴形成并且与所述第一流体不混溶;以及向贮器/组件的内容物施加力(例如,离心作用、加压等)S330,从而驱动第二流体从一个或多个贮器穿过隔膜层并进入一个或多个收集容器。
方法300的实施方式用作可靠地生成用于各种应用的单分散微滴(如上所述,并且以上述的速率),所述应用例如数字放大;在细胞、亚细胞和分子尺度上捕获目标材料;得益于微滴生成的样品分析;或其它合适的应用。方法300的实施方式还可以用作以具有成本效益的方式使用非微流控的、一次性的或可重复使用的装置来生成单分散微滴。
在具体的应用中,方法300可用于生成微滴,其应用于以下一个或多个:乳液生成(例如,单乳液生成,双乳液生成)、微粒生成、脂质体生成、水凝胶微粒生成、在纯化的DNA、cDNA、RNA上的核酸扩增(例如,通过聚合酶链反应(PCR)方法、通过例如环介导等温扩增(LAMP)的等温方法、通过重组酶聚合酶扩增(RPA)、通过多重置换扩增(MDA)、通过解旋酶依赖性扩增(HDA)、通过链置换扩增(SDA)、通过切口酶扩增(NEAR)、转录介导的扩增(TMA)、数字解旋酶依赖性扩增、RNaseH介导的扩增、全基因组扩增(WGA)、滚环扩增等),或者直接从溶胞产物(例如,血液裂解物)的核酸扩增;使用荧光标记的核酸(例如,PNA、LNA、DNA、RNA等)的荧光原位杂交(FISH)或使用DIG或生物素的间接原位杂交方法;通过体外转录或翻译测定(例如,借此使用比色或荧光报告分子进行检测);施加于来自单细胞(例如,原核生物、真核生物)、细胞器、病毒颗粒和外来体的样品的微滴PCR;蛋白质的微滴分析(例如,通过邻近连接测定等);测序应用(例如,单个分子测序应用);监测或检测从单个细胞(例如,从免疫细胞释放的白介素)释放的产物(例如,蛋白质、化学物质);监测单个细胞的细胞存活和/或分裂;监测或检测涉及单个细胞的酶反应;在细胞(例如,哺乳动物细胞、细菌细胞、病原体、病毒等)和亚细胞(例如,细胞器、分子等)尺度上捕获目标材料;样品中异质细胞群的计数;单独的细胞或病毒颗粒的计数(例如,通过用与酶耦合的物种特异性抗体将细胞包封在微滴中,所述酶与微滴中的底物成分反应以产生信号等);监测单个宿主细胞的病毒感染;和其它合适的应用。
方法300可以通过上述系统100的实施方式、变体或示例来实现,或者可以通过另一合适的系统来实现。
4.计算机系统
本公开提供了计算机系统,其被编程以实现本公开的方法。图11示出了计算机系统1101,其被编程或以其他方式配置为例如以预定速率或多分散性变化在收集容器内生成多个微滴,将热量传递到收集容器内的多个微滴或从收集容器内的多个微滴传递热量,或者对收集容器中的多个微滴执行光学探询操作。
计算机系统1101可以调节本公开的分析、计算和生成的各个方面,例如,以预定速率或多分散性变化在收集容器内生成多个微滴,将热量传递到收集容器内的多个微滴或从收集容器内的多个微滴传递热量,或者用收集容器中的多个微滴执行光学探询操作。计算机系统1101可以是用户的电子设备或关于电子设备远程定位的计算机系统。电子设备可以是移动电子设备。
计算机系统1101包括中央处理器(CPU,本文也称为“处理器”和“计算机处理器”)1105,其可以是单核或多核处理器,或用于并行处理的多个处理器。计算机系统101还包括存储器或存储器位置1110(例如,随机存取存储器、只读存储器、闪存)、电子存储单元1115(例如,硬盘)、用于与一个或多个其他系统通信的通信接口1120(例如,网络适配器)以及外围设备1125(例如,高速缓存、其他存储器、数据存储和/或电子显示适配器)。存储器1110、存储单元1115、接口1120和外围设备1125通过通信总线(实线)(例如,主板)与CPU 1105通信。存储单元1115可以是用于储存数据的数据存储单元(或数据储存库)。计算机系统1101可以在通信接口1120的协助下可操作地耦合到计算机网络(“网络”)1130。网络1130可以是因特网、互联网和/或外联网、或与因特网通信的内联网和/或外联网。
在一些实施方式中,网络1130是电信和/或数据网络。网络1130可以包括一个或多个计算机服务器,其可以实现分布式计算,例如云计算。例如,一个或多个计算机服务器可以使网络1130上的云计算(“云”)能够执行本公开的分析、计算和生成的各个方面,例如,以预定速率或多分散性变化在收集容器内生成多个微滴。这种云计算可以由例如Amazon WebServices(AWS)、Microsoft Azure、Google Cloud Platform和IBM Cloud的云计算平台提供。在一些实施方式中,在计算机系统1101的协助下,网络1130可以实现对等网络,其可以使耦合到计算机系统101的装置能够作为客户端或服务器。
CPU 1105可以包括一个或多个计算机处理器和/或一个或多个图形处理单元(GPU)。CPU 1105可以执行机器可读指令序列,其可以在程序或软件中体现。指令可以储存在例如存储器1110的存储器位置中。指令可以指向CPU 1105,该CPU 1105可以随后编程或以其他方式配置CPU 1105以实现本公开的方法。由CPU 1105执行的操作的示例可以包括获取、解码、执行和写回。
CPU 1105可以是电路的一部分,例如集成电路。系统1101的一个或多个其他部件可以包括在电路中。在一些实施方式中,该电路是专用集成电路(ASIC)。
存储单元1115可以储存诸如驱动程序、库、保存的程序等文件。存储单元1115可以储存用户数据,例如,用户偏好和用户程序。在一些实施方式中,计算机系统1101可以包括在计算机系统1101外部的一个或多个附加数据存储单元,例如位于通过内联网或因特网与计算机系统1101通信的远程服务器。
计算机系统1101可以通过网络1130与一个或多个远程计算机系统通信。例如,计算机系统1101可以与用户的远程计算机系统通信。远程计算机系统的示例包括个人计算机(例如,便携式PC)、平板PC(例如,
本文所述的方法可以通过储存在计算机系统1101的电子存储位置上(例如,在存储器1110或电子存储单元1115上)的机器(例如,计算机处理器)可执行代码来实现。机器可执行或机器可读代码可以以软件的形式提供。在使用期间,代码可以由处理器1105执行。在一些实施方式中,代码可以从存储单元1115中检索并储存在存储器1110上,以便处理器1105随时访问。在一些情况下,电子存储单元1115可以被排除,并且机器可执行指令储存在存储器1110上。
代码可被预编译并被配置为与具有适于执行代码的处理器的机器一起使用,或者可以在运行期间被编译。代码可以以编程语言提供,该编程语言可被选择以使代码能够以预编译或编译的方式执行。
本文提供的系统和方法的实施方式,例如计算机系统1101,可以在编程中体现。技术的各个方面可以被认为是通常以机器(或处理器)可执行代码和/或相关联的数据的形式的“产品”或“制造品”,所述机器可执行代码和/或相关联的数据在一种类型的机器可读介质上运载或体现。机器可执行代码可以储存在电子存储单元上,例如存储器(例如,只读存储器、随机存取存储器、闪存)或硬盘。“存储”类型介质可以包括计算机、处理器等的任何或所有有形存储器或其相关联的模块,例如各种半导体存储器、磁带驱动器或磁盘驱动器,其可以在任何时间为软件编程提供非暂时性存储。软件的全部或部分有时可以通过因特网或各种其他电信网络进行通信。这种通信例如可以使得能够将软件从一个计算机或处理器加载到另一个计算机或处理器中,例如从管理服务器或主计算机加载到应用服务器的计算机平台中。因此,可以承载软件元件的另一类型的介质包括光、电和电磁波,例如通过有线和光学陆线网络以及通过各种空中链路在本地设备之间的物理接口上使用的。运载这种波的物理元件,例如有线或无线链路、光学链路等,也可以被认为是承载软件的介质。如本文所使用的,除非限于非暂时性的、有形的“存储”介质,否则例如计算机或机器“可读介质”等术语是指参与向处理器提供指令以供执行的任何介质。
因而,机器可读介质(如计算机可执行代码)可采用多种形式,包括有形存储介质、载波介质或物理传输介质。非易失性存储介质包括例如光盘或磁盘,例如任何计算机等中的任何存储设备,例如可用于实现数据库等,如图所示。易失性存储介质包括动态存储器,例如这种计算机平台的主存储器。有形传输介质包括同轴电缆;铜线和光纤,包括构成计算机系统内总线的导线。载波传输介质可以采用电或电磁信号、或者声波或光波的形式,例如在射频(RF)和红外(IR)数据通信期间生成的那些。因此,计算机可读介质的常见形式包括例如:软盘、柔性盘、硬盘、磁带、任何其他磁介质、CD-ROM、DVD或DVD-ROM、任何其他光介质、打孔卡、纸带、具有孔图案的任何其他物理存储介质、RAM、ROM、PROM和EPROM、FLASH-EPROM、任何其他存储器芯片或盒式磁带、传输数据或指令的载波、传输这种载波的电缆或链路,或者计算机可以从其读取程序代码和/或数据的任何其他介质。在将一个或多个指令的一个或多个序列运载到处理器以供执行时,可以涉及许多这些形式的计算机可读介质。
计算机系统1101可以包括电子显示器135或与之通信,电子显示器135包括用于提供例如视觉显示的用户界面(UI)1140,其指示在收集容器内以预定速率或多分散性变化生成多个微滴,将热量传递到收集容器内的多个微滴或从收集容器内的多个微滴传递热量,或对收集容器内的多个微滴执行光学探询操作。UI的示例包括但不限于图形用户界面(GUI)和基于网络的用户界面。
本公开的方法和系统可通过一个或多个算法实现。在中央处理器1105执行时,算法可以通过软件来实现。例如,该算法可以在收集容器内以预定速率或多分散性变化生成多个微滴。
5.结论
附图说明了根据优选实施方式、示例配置及其变体的系统、方法和计算机程序产品的可能实现的架构、功能和操作。就这一点而言,流程图或框图中的每个框可以表示代码的模块、片段或部分(如果适用的话),其包括用于实现指定逻辑功能的一个或多个可执行指令。还应当注意,在一些可备选的实现中,框中所注的功能可以不按附图中所注的次序发生。例如,取决于所涉及的功能,连续示出的两个框实际上可以基本上同时执行,或者框有时可以以相反的次序执行。还将注意到,框图或流程图图示中的每个框以及框图或流程图图示中的框的组合可以由执行指定功能或动作的基于专用硬件的系统或者专用硬件和计算机指令的组合来实现。
从上述内容中可以理解,虽然已经说明和描述了特别的实现,但可以对其进行各种修改,并在本文进行预期。本发明也不受说明书中提供的特定示例的限制。虽然已经参考上述说明书描述了本发明,但是本文对优选实施方式的描述和说明并不意味着是限制性的。此外,应当理解,本发明的所有方面并不限于本文所述的特定描述、配置或相对比例,其取决于各种条件和变量。本发明实施方式的形式和细节上的各种修改对于本领域技术人员将是显而易见的。因此,预期本发明还应涵盖任何这种修改、变体和等同物。下面的权利要求旨在限定本发明的范围,并且在这些权利要求及其等同物的范围内的方法和结构由此被覆盖。
