一种前列腺癌诊断和预后评估试剂盒
文献发布时间:2023-06-19 11:37:30
技术领域
本发明属于生物技术领域,具体涉及一种前列腺癌筛查、诊断和预后评估的试剂盒。
背景技术
前列腺癌(prostate cancer,PC)是指发生在前列腺的上皮性恶性肿瘤,是男性泌尿生殖系统最常见的恶性肿瘤。前列腺癌病理类型上包括腺癌(腺泡腺癌)、导管腺癌、尿路上皮癌、鳞状细胞癌和腺鳞癌,其中腺癌占95%以上。通常前列腺癌就是指前列腺腺癌。
目前前列腺癌的筛查和诊断主要是依靠PSA(prostate specific antigen,前列腺特异性抗原)、直肠指检和穿刺活检。其中PSA筛查应用最为广泛,但是前列腺良性增生也有PSA升高的迹象,因此特异性也比较高,导致PSA误诊率较高。直肠指诊简单易行,但其诊断敏感性低,且容易受医生水平、经验等因素的影响。直肠超声引导下行穿刺活检是临床前列腺癌确诊金标准,但穿刺操作有创,且有感染可能。因此,目前临床急需一种敏感性和特异性双高、检测简便无创的前列腺癌筛查诊断方法,以提高前列腺癌早期诊断率、减少不必要的活检。
染色体不稳定通常与肿瘤相关,具体包括整个染色体或者染色体片段拷贝的缺失或扩增。含有与肿瘤发生相关的染色体或者染色体片段的扩增和缺失经常是肿瘤发生所特有的,检测肿瘤染色体不稳定区域对于研究肿瘤发生和开发肿瘤诊断技术都至关重要。
中国专利201910712588.6中公开了一组染色体不稳定区域在制备诊断多发性骨髓瘤的试剂或试剂盒中的应用,所述的染色体不稳定区域包含以下7个:1p、1q、6q、11q13.3、13q、14q、17p。该发明中7个常见染色体不稳定区域在多发性骨髓瘤中总的携带率高达89.3%,对临床上多发性骨髓瘤的诊断、治疗、监测计预后评估具有很大的意义,为下一步进行早期诊断和制定个体化治疗方案提供科学依据。
当前临床上有使用原位荧光杂交的方法对染色体上部分区域的不稳定性进行检测,但缺少前列腺癌患者整个基因组层面染色体不稳定性的分布特征,不利于全面的指导前列腺癌的诊断及预后。
PCA3基因是一种前列腺癌生物标志物,在前列腺以外的组织不表达,在正常前列腺组织、良性前列腺增生(BPH)细胞中呈低水平表达,而在PCa细胞和转移坏死灶中表达量升高。大部分的前列腺癌患者存在PCA3基因的过度表达。在大多数前列腺癌组织中,属于ETS转录因子家族的ERG基因可以与其他基因发生融合,非随机的基因重排是人类恶性肿瘤中最多见的基因变异形式。因此,PCA3基因过表达和ERG基因融合对前列腺癌筛查、早期诊断与治疗具有十分重要的意义。
通过二代测序可以同时检测基因组上多个区域和基因变异区域,可以很好的应用于全基因组或者基因组上大量区域同时检测分析。
发明内容
为了解决上述问题,本发明在研究前列腺癌所特有的染色体不稳定性区域和相关分子标志物的基础上,公开了优化的全基因组二代测序方法的具体过程和染色体不稳定区域和基因变异区域,发现了16个与前列腺癌发生常见的染色体不稳定区域和基因变异区域,为应用二代测序技术对前列腺癌的临床筛查、早期诊断、制定个体化治疗方案及评估预后提供科学依据。
本发明中涉及的染色体不稳定区域和基因变异区域的编号依据本领域惯用编号规则进行限定,例如不稳定区2q在本领域惯用规则中指第2号染色体的长臂,不稳定区域7p指7号染色体短臂。
一方面,本发明提供了一组染色体不稳定区域和基因变异区域的组合。
所述的染色体不稳定区域和基因变异区域包括:2q、3q、5q、6q、7p、7q、8p、8q、9p、12q、13q、14q、16q、18q、PCA3、ERG。
所述的染色体不稳定包括整个染色体或者染色体片段拷贝的缺失或扩增;所述的基因变异包括PCA3基因过表达和ERG基因融合。
所述的7p扩增导致表皮生长因子EGFR(原癌基因)高表达,促进肿瘤进展。
所述的8q扩增导致原癌基因MYC高表达,促进肿瘤进展。
所述的8p11.21、13q24、16q、17q12区域或丢失或扩增丢失也导致相关抑癌基因低表达,促进肿瘤进展。
所述的PCA3即前列腺癌基因3,位于常染色体9q21-22,并在前列腺上皮细胞内表达的非编码mRNA。
所述的PCA3可调控前列腺癌细胞的存活和凋亡,与肿瘤的侵袭性密切相关。
所述的ERG基因,位于21号染色体q22上,属于ETS转录因子家族,是前列腺癌细胞中一种常发生过表达的原癌基因,与前列腺癌的发生、发展相关。
所述的16个染色体不稳定区域和基因变异区域在前列腺癌患者中总的携带率为91.5%。
另一方面,本发明提供了一种文库接头。
所述的文库接头的序列选自SEQ ID NO.1和/或SEQ ID NO.2。
所述的文库接头用于检测前述的染色体不稳定区域和基因变异区域的组合。
再一方面,本发明提供了前述的染色体不稳定区域和基因变异区域的组合和/或文库接头在制备用于筛查和/或诊断和/或预后评估前列腺癌的试剂或试剂盒中的应用。
又一方面,本发明提供了一种用于筛查和/或诊断和/或预后评估前列腺癌的试剂或试剂盒。
所述的试剂或试剂盒包括但不限于:前列腺癌筛查的试剂或试剂盒、前列腺癌早期诊断的试剂或试剂盒、前列腺癌病情监测的试剂或试剂盒。
所述的试剂用于二代测序中检测前述的染色体不稳定区域和基因变异区域的组合。
所述的试剂盒中包括用于二代测序中检测前述的染色体不稳定区域和基因变异区域的组合的试剂。
所述的试剂盒中还包括前述的文库接头。
所述的试剂盒中还包括阳性参考品、阴性参考品、缓冲液、酶、可检测标签、核酸提取试剂、核酸纯化试剂中的一种或多种。
进一步地,所述的酶包括打断酶、DNA聚合酶、DNA连接酶、RNA消化酶、DNA消化酶及逆转录酶中的一种或多种。
进一步地,所述的阳性参考品为混合有前述的16个区域变异的细胞系;所述的阴性参考品为无染色体变异的细胞系。
可选择地,所述试剂盒还包含临床上用于前列腺癌的筛查、诊断、治疗方案选择、监测和预后评估的其它试剂,以辅助或验证通过检测上述16个染色体不稳定和基因变异区域所得到的结果。
又一方面,本发明提供了前述试剂或试剂盒的使用方法。
所述的使用方法包括但不限于数字PCR、原位荧光杂交、核酸探针杂交法等。
所述的试剂或试剂盒可检测的临床样品包括但不限于:体液、穿刺针冲洗液、组织、细胞等。
所述试剂盒的操作方法包括以下步骤:
(1)从检测对象获得待测样品;
(2)待测样品与利用本发明的检测试剂接触;
(3)检测待测样本上述16个染色体不稳定和基因变异区域;
(4)根据检测结果进行前列腺癌的筛查、诊断、治疗方案选择、监测和预后评估。
又一方面,本发明还提供了一种用前述文库接头构建基因文库的方法。
所述的构建基因文库的方法中包括使用前述文库接头进行文库的构建。
又一方面,本发明还提供了前述的文库接头和构建基因文库的方法在制备前列腺疾病的筛查、诊断、预后评估或病情监测的试剂或试剂盒的应用。
具体地,所述的试剂盒包括但不限于:前列腺癌筛查的试剂或试剂盒、前列腺癌早期诊断的试剂或试剂盒、前列腺癌病情监测的试剂或试剂盒。
本发明的有益效果:
1、16个染色体不稳定区域和基因变异区域在前列腺癌患者中高达91.5%;
2、使用本专利16个染色体不稳定区域和基因变异区域作为分析标识,通过二代测序诊断前列腺癌具有很高的灵敏度和特异性。
附图说明
图1为16个染色体不稳定区域和基因变异在2号染色体和3号染色体上的分布图。此图为分析软件直出图,如果对阴影部分进行人为修改不利于结果判读,因此保留了灰度图片。
图2为16个染色体不稳定区域和基因变异在7号染色体上的分布图。此图为分析软件直出图,如果对阴影部分进行人为修改不利于结果判读,因此保留了灰度图片。
图3为16个染色体不稳定区域和基因变异在8号染色体和9号染色体上的分布图。此图为分析软件直出图,如果对阴影部分进行人为修改不利于结果判读,因此保留了灰度图片。
图4为16染色体不稳定区域和基因变异在12号染色体、14号染色体和18号染色体上的分布图。此图为分析软件直出图,如果对阴影部分进行人为修改不利于结果判读,因此保留了灰度图片。
图5为ERG基因融合示意图。
图6为计算本分析方法的灵敏度和特异性得到的ROC曲线。
具体实施方式
下面结合具体实施例,对本发明作进一步详细的阐述,下述实施例不用于限制本发明,仅用于说明本发明。以下实施例中所使用的实验方法如无特殊说明,实施例中未注明具体条件的实验方法,通常按照常规条件,下述实施例中所使用的材料、试剂等,如无特殊说明,均可从商业途径得到。
实施例1染色体不稳定区域和基因变异区域的筛选
对临床病理确诊的106例前列腺患者、113例健康人的核酸进行建库,上机进行全基因组和转录组高通量测序或者目标区域靶向捕获测序,对染色体拷贝数和基因变异进行分析,识别发生染色体不稳定和基因变异区域。分析统计肿瘤患者和对照组在染色体不稳定和基因变异方面的差别。
经过上述操作,发现了与前列腺相关性很高的16个常见染色体不稳定区域和基因变异区域,包含2q、3q、5q、6q、7p、7q、8p、8q、9p、12q、13q、14q、16q、18q、PCA3、ERG。
从携带频率来看,16个染色体不稳定区域和基因变异区域在前列腺癌患者中高达91.5%,共计97例患者携带上述染色体不稳定区域和基因变异区域。基因变异PCA3基因过表达,发生频率48.11%,ERG基因融合发生频率25.47%。染色体不稳定以18q最为常见,发生频率49.06%;其次是8q、7q、9p,其发生频率分别是35.85%、23.58%和14.15%。
实施例2一种外泌体的获取方法
本实施例选用的试剂盒购SBI公司,货号:01.SBI.EXOTC10A-1。
a.取5mL尿液转移至15mL离心管中,3000g离心15min,去除细胞或细胞碎片;
b.将上清转移至灭菌管中,加入的ExoQuick试剂1mL;
c.上下颠倒离心管,混匀;4℃或室温静置过夜;
d.1500g离心30min,管底可见淡黄色至白色沉淀,吸除上清;
e.1500g再离心5min,吸除残留上清;
f.加入无菌蒸馏水或PBS,重悬外泌体沉淀。
实施例3尿液脱落细胞基因组DNA与总RNA共提取
本实施例选用的试剂盒购自QIAGEN公司(货号:80204)。
a.将获取的尿液样本转移至15mL离心管中,1600g离心10min,小心倒去上清液,再用移液枪小心吸弃剩余的上清液。
b.加入350μL 1×Buffer RL/DTT至新的1.5mL离心管中,用一次性20号针头的注射器小心抽打裂解液至少5次打散细胞。
c.把DNA纯化柱装在2mL收集管中。把细胞裂解液转移至gDNA过滤柱中。14000g离心2min。
d.保留DNA纯化柱,按n-s步骤进行抽提。
e.加入等倍体积70%乙醇至滤液中,用移液枪吸打3-5次。
f.把RNA纯化柱装在2mL收集管中。转移≤750μL混合液至柱子中,12000g离心30-60s。
g.(可选:当混合液超过750μL)倒弃滤液,把柱子装回收集管中。转移剩余的混合液至柱子,12000g离心30-60s。
h.倒弃滤液,把柱子装回收集管。加入500μL Buffer RW1至柱子上,12000g离心30-60s。
i.倒弃滤液,把柱子装回收集管。加入500μL Buffer RW2至柱子上,12000g离心30-60s。
j.倒弃滤液,把柱子装回收集管。加入500μL Buffer RW2至柱子上,12000g离心30-60s。
k.倒弃流出液,把柱子重新装回收集管中。12000g离心2min。
L.将柱子转移至1.5mL离心管中,加入20-100μL无RNA酶水至柱子膜中央。室温静置2min。12000g离心1min。
m.丢弃结合柱,把RNA保存于-20℃。
n.取DNA纯化柱(d步骤)装在2mL收集管中。加入500μL Buffer DW1至柱子中,静置2min。10000g离心30-60s。
o.倒弃流出液,把柱子装回收集管中。加入500μL Buffer RW2至柱子中。10000g离心30-60s。
p.倒弃流出液,把柱子装回收集管中。加入500μL Buffer RW2至柱子中。10000g离心30-60s。
q.倒弃流出液,把柱子套回空的收集管。13000g离心2min。
r.将DNA柱子装在1.5mL离心管中。加入30-50μL预热至65℃无核酸酶水至柱子膜中央。室温静置3min。13000g离心1min。
s.弃去DNA柱,把DNA保存于2-8℃或-20℃。
本实施例中的尿液脱落细胞可以替换为穿刺针冲洗液或实施例2所制备的外泌体。
实施例4尿液上清游离DNA与游离RNA提取
本实施例选用的试剂盒购自QIAGEN公司(货号:55184)。
a.将获取的尿液样本转移至15mL离心管中,1600g离心10min。
b.小心吸取4mL上一步离心后的上清液至两个2mL离心管中,16000g离心10min。
c.在新的15mL离心管中加入600μL缓冲液RPL。
d.加入4mL上清至上一步反应液中,涡旋5s混匀。室温放置3min。
e.加入400μL缓冲液RPP涡旋20s混匀,冰上孵育3min。
f.3000g,离心10min。
g.转移4mL上清液至新的15mL离心管中(冰上操作)。
h.加入4mL冰异丙醇,涡旋混匀。
i.将RNA纯化柱放入15mL收集管中,将上述混合液转移4mL至RNA纯化柱中,5000g,离心1min,倒弃废液。
j.将剩余的混合液按照i步骤重复一次。
k.加入4mL缓冲液RWT至柱中,5000g,离心1min,倒弃废液。
l.加入2.5mL缓冲液RPE至柱中,5000g,离心5min,倒弃废液。
m.将纯化柱放入一个新的15mL收集管中。小心地将200μL的无RNA酶水加入纯化柱膜中央。
n.全速离心20000g,离心1min,洗脱核酸。
本实施例中的尿液上清可以替换为实施例2制备的重悬的外泌体。
实施例5文库接头的制备
本实施例接头序列经由生工生物(上海)公司进行合成。
接头-1序列为SEQ ID NO.1,接头-2序列为SEQ ID NO.2。
接头-1的5’端进行磷酸化修饰,接头-2的3’端G和T之间进行硫代磷酸修饰。
使用退火缓冲液(Annealing buffer)将接头-1和接头-2的干粉分别稀释成10μM,将两者稀释液等比例混合,得到的混合液置于PCR仪中,运行程序如表1:
表1
实施例6 16个染色体不稳定区域和基因变异区域作为分析标识筛查、诊断前列腺癌的基因组DNA文库构建。
本实施例中相关试剂盒购自NEB公司,货号:E7645S。
1、基因组片段化:取20ng人基因组DNA(来源为临床确诊样本),配制如表2所示的酶切反应体系,按照表3程序进行反应。本实施例中人基因组DNA的浓度为2ng/μL,反应体系中需加入10μL。
表2
振荡混匀、离心(避免气泡)后在PCR仪上运行以下程序:
表3
2、末端加A反应
如果人基因组DNA为无细胞的游离DNA,如血液中的cfDNA,则不需要经过基因组片段化,直接进行末修加A,取20ng cfDNA,配制如表4所示的酶切反应体系,按照表6程序进行反应。本实施例中cfDNA的浓度为2ng/μL,反应体系中需加入10μL。上一步反应产物按照表5进行配置。
表4
表5
振荡混匀、离心(避免气泡)后在PCR仪上运行以下程序:
表6
3、接头连接反应:将接头连接酶(5μL/样本)、接头连接增强剂(30μL/样本)按照所检测的样本数目吸取适当的体积进行混合后,吸取35μL混合液加入到上一步的反应产物中,再吸取5μL实施例5中制备的混合接头加入到上述反应液中,振荡混匀、离心。最终形成下表7中的反应体系。
表7
将上述体系置于PCR仪中,运行程序:20℃,30min,热盖关闭。
4、连接反应后纯化步骤:
a.提前取出文库纯化磁珠,室温静置至少30min,使用前需混匀。
b.将上述步骤中的接头连接反应液转移到相应编号的1.5mL离心管,加入84μL重悬的文库纯化磁珠,使用适当量程的移液器匀速吸打20次,室温孵育5min。
c.将离心管置于磁力架上,待溶液澄清后,弃上层清液。
d.向其中加入新鲜配置的200μL 80%的乙醇,静置30s后,弃上层清液。
e.重复步骤d一次。
f.磁力架上取下离心管,瞬时离心3s,离心管放回磁力架上,吸弃掉残留的80%乙醇,注意不要吸到磁珠。打开管盖,室温晾干2-10min。
g.待磁珠成亚光色,离心管中加入17μL无核酸酶水,轻微震荡使磁珠重悬,室温孵育5min。
h.将离心管置于磁力架上,静置2min。待溶液澄清后,取15μL上清留待下一步扩增反应。
5、PCR扩增:依下表8,加入相应试剂至PCR管中:
表8
其中,P7端标签引物和P5端标签引物经由生工生物(上海)公司合成。具体序列如下:
表9
将混合好的PCR管放入至PCR仪中,运行以下程序:
表10
6、PCR产物纯化参考步骤3纯化步骤,其中:
步骤b中重悬的文库纯化磁珠的用量为45μL;
步骤g中Low TE缓冲液(或者无核酸酶水)加入量为31μL;
步骤h中取30μL上清留待下一步操作。
7、文库定量上机
上述纯化文库使用Qseq生物片段分析系统对片段大小进行分析,使用
实施例7 16个染色体不稳定区域和基因变异区域作为分析标识筛查、诊断前列腺癌
本实施例选用的试剂盒购自NEB公司,货号:E6310、E7770。
1、RNA样品与探针杂交:取10-50ng RNA,取出探针杂交缓冲液冰盒上融解,按照探针杂交缓冲液(3μL/样本)、rRNA探针混合液(H/M/R)(2μL/样本)配制探针杂交预混液,配制表11反应体系(冰盒上操作),用移液器轻轻吹打混匀,瞬时离心。
表11
X代表10-50ngRNA样本体积(如:RNA浓度为25ng/μL,投入50ngRNA,则X=50/25=2μL)。
置于PCR仪中,运行以下程序:
表12
杂交结束后,立即将样本从PCR仪中取出放在冰盒上,立即进行下一步操作。
2、RNase H消化:提前将10×RNase H Buffer取出冰上融解,按照下表13体系配制RNase H反应预混液。
表13
将5μL RNase H反应预混液加至第1步骤的反应溶液中,使RNase H反应体系达到20μL,移液器轻轻吹打混匀,瞬时离心。
将反应体系置于PCR仪(热盖≥45℃)中,37℃30min,进行RNase H反应。RNase H消化结束后,立即将样本从PCR仪中取出放在冰盒上,立即进行下一步操作。
3、DNase I消化:提前将10×DNase I Buffer取出冰上融解,按照下表14体系配制DNase I反应预混液。
表14
将30μL DNase I反应预混液加至第2步骤的反应溶液中,使DNase I反应体系达到50μL,移液器轻轻吹打混匀,瞬时离心。
将反应体系置于PCR仪(热盖≥45℃)中,37℃30min,进行DNase I反应。DNase I消化结束后,立即将样本从PCR仪中取出放在冰盒上,立即进行纯化。
4、去除rRNA的RNA纯化:
a.提前将RNA纯化磁珠从2-8℃取出,静置平衡30min至室温,使用前涡旋或者振荡混匀;
b.DNaseⅠ反应结束后,每个反应管中加入110μL RNA纯化磁珠(2.2×),吹打混匀;
c.室温静置5min,然后转移至磁力架上5min,直至溶液变澄清,小心弃除上清;
d.将离心管保持在磁力架上,加入200μL 80%乙醇,静置30s,弃除全部上清;
e.重复d步骤,将磁珠用80%乙醇再洗1次。用10μL枪头将残留液体彻底吸干;
f.干燥磁珠2-3min,待酒精挥发完全后,加入7μL无核酸酶水,吹打混匀;
g.室温静置2min,磁力架上1min,待溶液变澄清,小心吸取5μL上清至另一新的离心管中;
h.上清管中加入5μL片段化缓冲液,吹打混匀后,按照下表15程序(热盖105℃)进行RNA打断(游离RNA不需要此步片段化,直接补水至10μL进行下一步操作):
表15
当温度降至4℃时,将其取出,瞬时离心后置于冰上,立即进行下一步第一链cDNA的合成。
5、第一链cDNA合成:取出RT链特异性试剂室温融解,冰上配制下表16体系,移液器轻轻吹打混匀,瞬时离心。
表16
置于PCR仪中,运行以下程序:
表17
6、第二链cDNA合成:按照下表冰盒上配制反应体系,移液器轻轻吹打混匀,瞬时离心。
表18
置于PCR仪中,运行16℃,60min,热盖关闭。
反应结束后立即进行纯化,步骤如下:
a.提前将RNA纯化磁珠从2-8℃取出,静置平衡30min至室温,使用前涡旋或者振荡混匀;
b.每个反应管中加入144μL RNA纯化磁珠(2.2×),吹打混匀;
c.室温静置5min,然后转移至磁力架上5min,直至溶液变澄清,小心弃除上清;
d.将离心管保持在磁力架上,加入200μL 80%乙醇,静置30s,弃除全部上清;
e.重复d步骤,将磁珠用80%乙醇再洗1次。用10μL枪头将残留液体彻底吸干;
f.干燥磁珠2-3min,待酒精挥发完全后,加入39μL无核酸酶水,吹打混匀;
g.室温静置2min,磁力架上1min,待溶液变澄清,小心吸取37μL上清至另一新的离心管中。
7、末端修复加A:将末修缓冲液提前拿出,冰盒上融化,按照末修缓冲液(10μL/样本),末修酶(3μL/样本)配制预混液,在上一步纯化产物中加入13μL预混液,移液器吹打混匀,瞬时离心(冰盒上操作)。具体体系如下:
表19
置于PCR仪中,运行以下程序:
表20
8、接头连接:将连接缓冲液(16.5μL/样本)、连接酶(3μL/样本)按照所检测的样本数目吸取适当的体积进行混合后,吸取19.5μL混合液加入到上一步的反应产物中,再吸取2.5μL制备的混合接头加入到上述反应液中,振荡混匀,瞬时离心。最终形成下表21反应体系。
表21
置于PCR中,运行22℃,15min,热盖关闭。
接头连接产物纯化:
a.提前RNA纯化磁珠从2-8℃取出,室温静置至少30min,使用前需混匀。
b.将上述步骤中的接头连接反应液转移到相应编号的1.5mL离心管,加入56μL重悬的磁珠,使用适当量程的移液器匀速吸打混匀,室温孵育5min。
c.将离心管置于磁力架上,待溶液澄清后,弃上层清液。
d.向其中加入新鲜配置的200μL 80%的乙醇,静置30s后,弃上层清液。
e.重复步骤d一次。
f.磁力架上取下离心管,瞬时离心3s,离心管放回磁力架上,吸弃残留的80%乙醇,注意不要吸到磁珠。打开管盖,室温晾干2-10min。
g.待磁珠成亚光色,离心管中加入21μL无核酸酶水,轻微震荡使磁珠重悬,室温孵育5min。
h.将离心管置于磁力架上,静置2min。待溶液澄清后,取20μL上清留待下一步扩增反应。
9、PCR扩增:按照下表22配制反应体系,混匀,瞬时离心。
表22
放至PCR仪中,运行以下程序:
表23
PCR产物纯化:
a.提前将RNA纯化磁珠从2-8℃取出,室温静置至少30min,使用前需混匀。
b.将上述步骤中的接头连接反应液转移到相应编号的1.5mL离心管,加入40μL重悬的磁珠,使用适当量程的移液器匀速吸打混匀,室温孵育5min。
c.将离心管置于磁力架上,待溶液澄清后,弃上层清液。
d.向其中加入新鲜配置的200μL 80%的乙醇,静置30s后,弃上层清液。
e.重复步骤d一次。
f.磁力架上取下离心管,瞬时离心3s,离心管放回磁力架上,吸弃残留的80%乙醇,注意不要吸到磁珠。打开管盖,室温晾干2-10min。
g.待磁珠成亚光色,离心管中加入42μL无核酸酶水,轻微震荡使磁珠重悬,室温孵育5min。
h.将离心管置于磁力架上,静置2min。待溶液澄清后,取40μL上清留待下一步扩增反应。
10、文库质检:上述纯化文库使用
结果分析讨论:
上机测序数据经过分析后,得到染色体不稳定和基因变异分布图,如图1-4所示。
染色体不稳定分析结果由三部分组成:染色体编号,染色体分区以及染色体测序深度分布。染色体测序深度分布区域中圆点为染色体小区域拷贝数分布情况,当其在纵轴scores值在-3到3之间时判定无不稳定发生,当其scores值大于3时判定为扩增,当其scores值小于-3时判定为缺失,对于发生扩增或缺失的区域使用灰色背景与正常区域进行区分。通过分析结果查看是否有上述染色体不稳定发生,若发生判定为阳性,若未发生判定为阴性。
基因变异分析:PCA3基因过表达,首先计算PCA3和PSA的相对reads数,再计算PCA3评分=(PCA3相对reads数/PSA相对reads数)×1000,当PCA3评分高于25即为PCA3基因过表达;ERG基因融合,将筛选后的测序数据比对整个基因组序列,ERG基因位于21q22,若比对结果在其他位置上,则判为ERG基因融合。ERG基因融合示意图见图5。
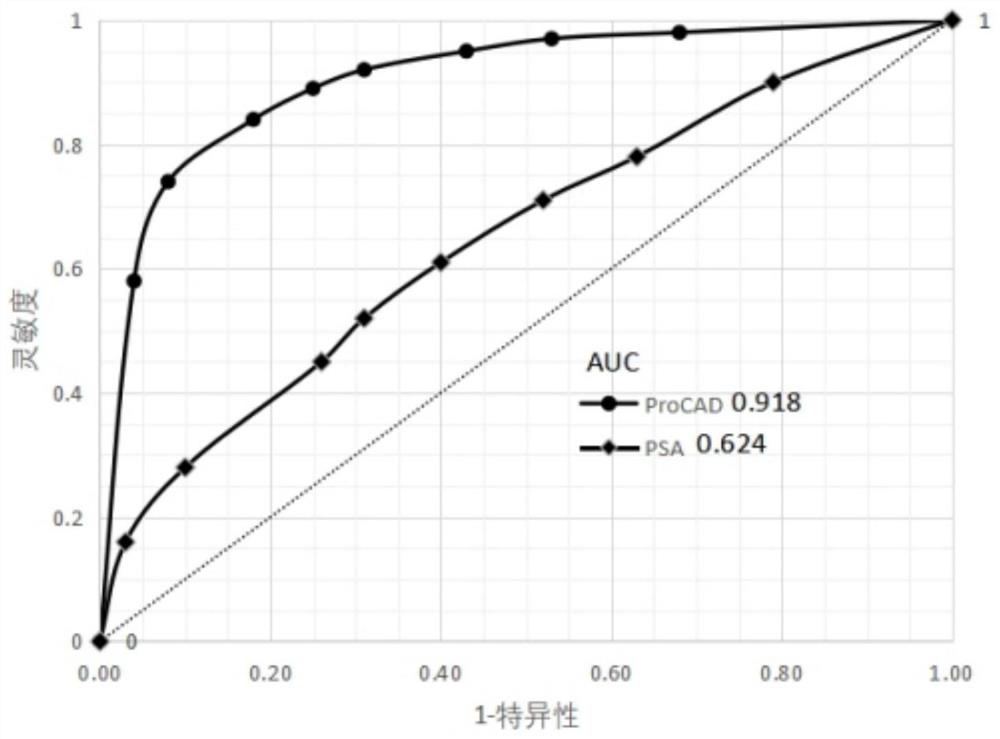
将二代分析结果与病理结果进行比较,计算本分析方法的灵敏度和特异性,得到ROC曲线,如图6所示。本方法ROC曲线的AUC面积达到0.918,说明使用本专利16个染色体不稳定区域和基因变异区域作为分析标识,通过二代测序诊断前列腺癌具有很高的灵敏度和特异性。
序列表
<110> 苏州宏元生物科技有限公司
<120> 一种前列腺癌诊断和预后评估试剂盒
<160> 18
<170> SIPOSequenceListing 1.0
<210> 1
<211> 31
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 1
gatcggaaga gcacacgtct gaactccagt c 31
<210> 2
<211> 40
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 2
acactctttc cctacacgac gctcttccga tctatcacgt 40
<210> 3
<211> 66
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 3
caagcagaag acggcatacg agatcagtgc ttgtgactgg agttcagacg tgtgctcttc 60
cgatct 66
<210> 4
<211> 66
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 4
caagcagaag acggcatacg agatagctaa gcgtgactgg agttcagacg tgtgctcttc 60
cgatct 66
<210> 5
<211> 66
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 5
caagcagaag acggcatacg agatcaatag ccgtgactgg agttcagacg tgtgctcttc 60
cgatct 66
<210> 6
<211> 66
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 6
caagcagaag acggcatacg agatgaatcc gtgtgactgg agttcagacg tgtgctcttc 60
cgatct 66
<210> 7
<211> 66
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 7
caagcagaag acggcatacg agatagctac cagtgactgg agttcagacg tgtgctcttc 60
cgatct 66
<210> 8
<211> 66
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 8
caagcagaag acggcatacg agatggttga acgtgactgg agttcagacg tgtgctcttc 60
cgatct 66
<210> 9
<211> 66
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 9
caagcagaag acggcatacg agatgcgtta gagtgactgg agttcagacg tgtgctcttc 60
cgatct 66
<210> 10
<211> 66
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 10
caagcagaag acggcatacg agataaccag aggtgactgg agttcagacg tgtgctcttc 60
cgatct 66
<210> 11
<211> 70
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 11
aatgatacgg cgaccaccga gatctacact tgcttgcaca ctctttccct acacgacgct 60
cttccgatct 70
<210> 12
<211> 70
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 12
aatgatacgg cgaccaccga gatctacacg agaggttaca ctctttccct acacgacgct 60
cttccgatct 70
<210> 13
<211> 70
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 13
aatgatacgg cgaccaccga gatctacaca cctggttaca ctctttccct acacgacgct 60
cttccgatct 70
<210> 14
<211> 70
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 14
aatgatacgg cgaccaccga gatctacaca agcggaaaca ctctttccct acacgacgct 60
cttccgatct 70
<210> 15
<211> 70
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 15
aatgatacgg cgaccaccga gatctacacc ggaacaaaca ctctttccct acacgacgct 60
cttccgatct 70
<210> 16
<211> 70
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 16
aatgatacgg cgaccaccga gatctacacg gtaagctaca ctctttccct acacgacgct 60
cttccgatct 70
<210> 17
<211> 70
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 17
aatgatacgg cgaccaccga gatctacact gtggcataca ctctttccct acacgacgct 60
cttccgatct 70
<210> 18
<211> 70
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 18
aatgatacgg cgaccaccga gatctacaca ctacggaaca ctctttccct acacgacgct 60
cttccgatct 70
- 一种前列腺癌诊断和预后评估试剂盒
- 去势抵抗型前列腺癌诊断和/或预后评估标志物LncRNA ZNF518A及其应用
