一种茶叶中叶绿素及其降解产物组分的分析方法
文献发布时间:2023-06-19 12:05:39
技术领域
本发明属于食品或植物品质成分分析检测领域,具体涉及一种茶叶中叶绿素及其降解产物组分的分析方法。
背景技术
茶叶色泽是茶叶“色、香、味、形”品质属性的重要因子之一,是消费者最直接的视觉感知,美观光润的色泽是消费者选择的重要依据。茶叶色泽包括干茶、汤色和叶底三方面。以绿茶为例,绿茶因其“三绿”的品质特点而备受消费者喜爱,包括茶汤绿、干茶绿、叶底绿。茶叶呈色物质包括叶绿素及其降解衍生产物、类胡萝卜素、黄酮类物质、茶色素(茶黄素、茶红色、茶褐素)等;因其溶解度不同,亦可分为水溶性色素和脂溶性色素。茶汤的呈色物质主要是水溶性色素,而干茶、叶底的主要呈色物质是脂溶性色素。其中,叶绿素是重要的呈色物质。在茶叶加工过程中,叶绿素在叶绿素酶介导或非酶介导的热反应等条件触发下,可发生一系列转化(如异构化、脱镁化、脱植基化等),降解衍生出丰富多样、色泽各异的产物。
现有文献报道常用的茶叶中叶绿素的测定方法有分光光度法、薄层色谱法以及液相色谱法。分光光度法涉及酸处理、皂化处理等复杂前处理,只能粗略测定叶绿素组分,灵敏度低。薄层色谱法耗时久,且组分间分离效果不佳。液相色谱法检测虽然可提高不同组分间的分离,但同样预处理复杂,耗时长。上述方法对叶绿素及其降解组分的检测覆盖度均有待提高,难以实现对叶绿素降解通路上多个衍生产物(水溶性、脂溶性)的同时提取和测定,且难以分离化学结构、性质接近的差向异构体。上述技术的局限性难以满足对茶叶中叶绿素素组分详细表征及对其转变过程系统研究的需求。
基于此,本申请人设计了一种基于甲基叔丁基醚(MTBE)/甲醇(MeOH)/水(H
发明内容
针对现有技术存在的问题,本发明旨在提供一种茶叶中叶绿素及其降解产物组分的分析方法。本发明采用甲基叔丁基醚(MTBE)/甲醇(MeOH)/水(H
本发明具体采用以下技术方案实现:
所述的一种茶叶中叶绿素及其降解产物组分的分析方法,其特征包括以下步骤:
1)待测茶叶中叶绿素及其降解产物的提取
采用基于甲基叔丁基醚/甲醇/水的双相提取技术,结合双相混合策略,进行提取,并在提取过程中引入内标化合物;
2)待测茶叶中叶绿素及其降解产物的LC-MS分析
基于UHPLC-q-Exactive高分辨液质联用技术,采用优化后的色谱梯度洗脱条件,进行高分辨全扫描分析;
3)待测茶叶中叶绿素及其降解产物的相对定量分析
通过提取目标化合物和内标化合物的高分辨提取离子流色谱图,获得其强度,通过将目标化合物与相应的内标化合物进行校正,对目标化合物进行相对定量分析。
所述的一种茶叶中叶绿素及其降解产物组分的分析方法,其特征在于所述的步骤1)具体包括以下步骤:
①待测茶样磨粉后,过30目筛,备用;
②称取约20.0mg±0.1mg茶粉至离心管中,加入300μL含内标化合物的甲醇溶液,涡旋30s;所述内标化合物为溶血磷脂酰胆碱LPC 19:0,浓度为2.00μg/mL;磷脂酰胆碱PC38:0,浓度为1.33μg/mL;
③加入1mL甲基叔丁基醚,涡旋30min;
④加入300μL超纯水,涡旋30s;
⑤静置10min后,10000rpm高速离心10min,使分层;
⑥取上层600μL,下层250μL,转移至新的离心管中,低温离心浓缩干燥,备用。
所述的一种茶叶中叶绿素及其降解产物组分的分析方法,其特征在于所述的步骤2)具体包括以下步骤:
进样分析前,将低温离心浓缩干燥的样品进行复溶,复溶溶液为乙腈/异丙醇/水溶液,乙腈/异丙醇/水的体积比为65/30/5;
UHPLC-q-Exactive分析条件为:
仪器:UHPLC-ESI-q-Orbitrap;
色谱条件:色谱柱为UPLC T3色谱柱,流动相A为乙腈/水=6/4v/v,含10mM醋酸铵;流动相B为异丙醇/乙腈=9/1v/v,含10mM的醋酸铵;流速为0.26mL/min,梯度洗脱程序为:0-2.0min,32%B;2.0-4.0min,32%B-60%B;4.0-13.0min,60%B-97%B;13.0-17.0min,97%B;17.0-17.1min,97%B-32%B;17.1-20.0min,32%B;
质谱条件:在ESI正离子模式下进行高分辨全扫描,m/z范围为200~1200,喷雾电压、毛细管温度和气体加热器温度分别为3.2kV、320℃和450℃,鞘气和辅助气流量分别为40arb和10arb。
所述的一种茶叶中叶绿素及其降解产物组分的分析方法,其特征在于所述的步骤2)UHPLC-q-Exactive分析方法能够检测叶绿素a、叶绿素a'、叶绿素b、叶绿素b'、脱镁叶绿素a、脱镁叶绿素a'、羟基脱镁叶绿素a、羟基脱镁叶绿素a'、脱镁叶绿素b、焦脱镁叶绿素a、焦脱镁叶绿素b、脱镁叶绿酸a、脱镁叶绿酸a'、脱镁叶绿酸b、焦脱镁叶绿酸a、焦脱镁叶绿酸b、脱植基叶绿素a、脱植基叶绿素a'和脱植基叶绿素b共19个叶绿素及其降解产物组分,上述19种化合物的分子式、保留时间、离子化模式和质荷比见表1。
表1 19个叶绿素及其降解产物组分的分子式、保留时间、离子化模式和质荷比
所述的一种茶叶中叶绿素及其降解产物组分的分析方法,其特征在于所述的步骤3)具体包括以下步骤:
采用Xcalibur软件,基于表1中的保留时间、质荷比,对目标化合物进行高分辨提取离子流色谱图EIC分析,同样地,也对内标化合物进行EIC分析,获得其峰强度;
将目标化合物归一化至相应的内标化合物进行校正,获得其相对定量结果,其中,目标化合物叶绿素a、叶绿素a'、叶绿素b、叶绿素b'、脱镁叶绿素a、脱镁叶绿素a'、羟基脱镁叶绿素a、羟基脱镁叶绿素a'、脱镁叶绿素b、焦脱镁叶绿素a和焦脱镁叶绿素b对应的内标化合物为PC 38:0,目标化合物脱镁叶绿酸a、脱镁叶绿酸a'、脱镁叶绿酸b、焦脱镁叶绿酸a、焦脱镁叶绿酸b、脱植基叶绿素a、脱植基叶绿素a'和脱植基叶绿素b对应的内标化合物为LPC19:0,校正后进行相对定量的计算方法为:目标化合物相对强度=目标化合物峰面积/相应的内标化合物峰面积。
与现有技术相比,
本发明的优点如下:(1)样品预处理简单快速,且可同时提取溶解性不同的叶绿素及其降解产物组分(水溶性、脂溶性);(2)分析速度快,每个样品的LC-MS分析时间仅需20分钟;(3)对茶叶中叶绿素及其降解产物组分的检测覆盖度高,可实现对叶绿素降解通路中酶介导降解、非酶热降解途径上共19个组分的全面覆盖。总之,该方法简单、快速,且分析更为系统全面。
附图说明
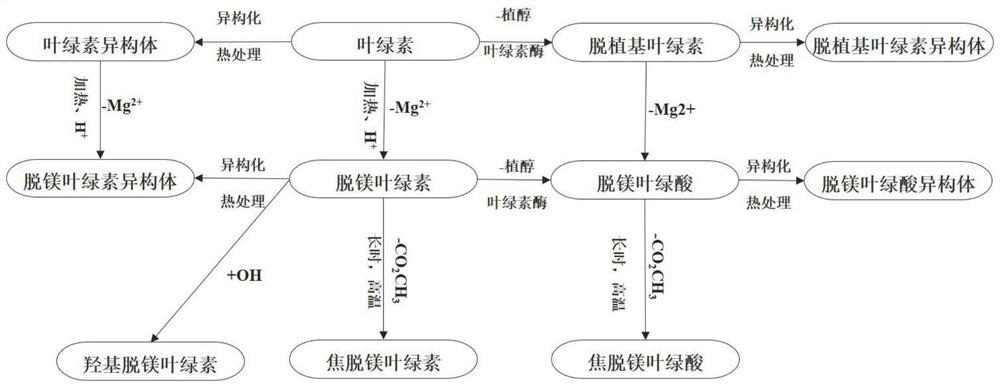
图1为绿茶加工过程中叶绿素降解通路。
图2为五种不同足火方式下绿茶中叶绿素及其降解产物组分的正交偏最小二乘法判别分析(OPLS-DA)(A)得分图、(B)20次置换检验图、(C)因子载荷图。
具体实施方式
以下结合实例及附图来对本发明做进一步的解释说明。本实例仅用于具体说明该方法,而并非对本发明的范围进行限制,任何依照本发明的教导所做出的改动或改进,均属于本发明的保护范围。
实施例1
1)待测茶叶中叶绿素及其降解产物的提取
①待测茶样磨粉后,过30目筛,备用;
②称取约20.0mg±0.1mg茶粉至离心管中,加入300μL含内标化合物的甲醇溶液,涡旋30s。内标化合物为溶血磷脂酰胆碱LPC19:0,浓度为2.00μg/mL;磷脂酰胆碱PC38:0,浓度为1.33μg/mL;
③加入1mLMTBE,涡旋30min;
④加入300μL超纯水,涡旋30s;
⑤静置10min后,高速离心(10000rpm*10min),使分层;
⑥取上层600μL,下层250μL,转移至新的离心管中,低温离心浓缩干燥,备用。
2)待测茶叶中叶绿素及其降解产物的LC-MS分析
进样分析前,将低温离心浓缩干燥的样品进行复溶,复溶溶液为乙腈/异丙醇/水=65/30/5(v/v/v);
所建立的基于UHPLC-q-Exactive的叶绿素及其降解产物的分析方法如下:
仪器:UHPLC-ESI-q-Orbitrap(Thermo Fisher);
色谱条件:色谱柱为UPLC T3色谱柱(2.1×100mm,1.8μm,Waters),流动相A为乙腈/水=6/4(v/v),含10mM醋酸铵;流动相B为异丙醇/乙腈=9/1(v/v),含10mM的醋酸铵,流速为0.26mL/min,梯度洗脱程序为:0-2.0min,32%B;2.0-4.0min,32%B-60%B;4.0-13.0min,60%B-97%B;13.0-17.0min,97%B;17.0-17.1min,97%B-32%B;17.1-20.0min,32%B;
质谱条件:在ESI正离子模式下进行高分辨全扫描,m/z范围为200~1200,喷雾电压、毛细管温度和气体加热器温度分别为3.2kV、320℃和450℃,鞘气和辅助气流量分别为40arb和10arb。
在上述分析条件下,本发明可检测19个叶绿素及其降解产物组分的分子式、保留时间、离子化模式和质荷比见表1。
3)待测茶叶中叶绿素及其降解产物的相对定量分析。
采用Xcalibur软件(版本2.2,Thermo Fisher,美国),基于表1中的保留时间、质荷比,对目标化合物进行高分辨提取离子流色谱图(EIC)分析,同样地,也对内标化合物进行EIC分析,获得其峰强度;
将目标化合物归一化至相应的内标化合物进行校正,获得其相对定量结果,其中,表1中目标化合物1~11对应的内标化合物为PC 38:0,目标化合物12~19对应的内标化合物为LPC 19:0,校正后进行相对定量的计算方法为:目标化合物相对强度=目标化合物峰面积/相应的内标化合物峰面积。
实施例2:绿茶中叶绿素降解通路分析
(1)取绿茶茶样,按照实施例1的方法进行分析。每个茶样分别取3份进行检测,作为技术重复。
(2)绿茶中叶绿素降解通路分析:结果显示,本发明中所涉及的19个叶绿素及其降解产物均可在绿茶样品中检测到,覆盖不同性质的酶降解、非酶降解产物。通路分析可知(图1),绿茶加工过程中涉及到如下反应:①异构化:叶绿素a和b转化为各自的同分异构体a’和b’。②酶促脱植基反应:在叶绿素酶的作用下发生水解反应,生成水溶性的脱植基叶绿素。③脱镁降解反应:酸性或加热条件下,促进了卟啉环上Mg
实施例3:不同足火方式下绿茶中叶绿素及其降解产物的比较分析
(1)制绿茶:自然摊放(室内温度25~28℃、相对湿度70%~80%,待含水率降至70%左右)→滚筒式杀青(投叶量150kg/h、260℃、75s)→摊凉(1h)→揉捻(30kg投叶量、转速50~52r/min、轻揉30min)→烘毛火(110℃、20min,待含水率降至20%左右)。然后分别用五种不同的足火方式(远红外足火、微波足火、提香机足火、理条机足火和六角辉锅足火)进行足火干燥,制得绿茶。
(2)将不同足火方式所制得绿茶,按照实施例1的方法进行分析。每个茶样分别取3份进行检测,作为技术重复。
(3)五种不同足火方式下绿茶叶绿素组分的正交偏最小二乘法判别分析(OPLS-DA):以19个不同叶绿素及其降解组分的含量为X变量,五种不同足火方式为Y变量,进行OPLS-DA分析。结果显示不同足火方式所得茶样得到明显的分离(R2X=0.998,R2Y=0.902,Q2=0.715)(图2A)。其中,微波和远红外足火所制绿茶在得分图上距离较远,提示两者的叶绿素组成差异更为显著。提香机足火、理条足火、六角辉锅足火热传递方式在得分图上相对较为接近,提示三者对叶绿素降解的作用更为接近。对模型Y变量进行交叉验证(20次的置换检验)(图2B),截距分别为R2=(0.0,0.335),Q2=(0.0,-1.48),表明模型未过拟合。对OPLS-DA做载荷分析(图2C),显示微波足火影响较大的叶绿素组分为Phe a、Phe b、Chl a、Phe a’、Chl b等,而远红外足火影响较大的叶绿素组分为PyrPhe a、PyrPhe b、Phe b等。
(4)不同足火方式对绿茶中叶绿素及其降解产物组分变化影响的比较:
对不同足火方式制得绿茶中的19种叶绿素及其降解组分进行单因素方差分析(表2)。发现不同足火方式所制得绿茶中PyrPo a、Chl b、Ch1 b’、Chl a、Pheb、Chl a’、HydPhea、PyrPhe b、HydPhe a’、Phe a、Phe a’、PyrPhe a的含量均存在显著性差异(p<0.05)。其中除水溶性焦脱镁叶绿酸(PyrPo a)外,其他均为脂溶性。Chl b、Chl b’、Chl a、Phe b、Phea、Phe a’含量在微波足火中最高,而在远红外足火中最低,相应组分含量比微波足火低1.6、1.4、2.4、1.1、1.3、1.3倍。这些叶绿素组分均为绿色、橄榄绿或暗绿色。同时,Pyrpo b、PyrPo a、PyrPhe b、PyrPhe a组分含量在远红外足火所制得绿茶中最高,分别比微波足火高10.8、4.4、4.3、3.8倍,微波足火所制得绿茶中相应组分含量最低。这四种叶绿素降解组分均是通过脱镁降解和脱羧甲基化反应产生,均为褐色。而提香机足火、理条足火、六角辉锅足火的叶绿素及其降解组分含量均介于微波足火和远红外足火之间。基于上述结果,说明微波足火对茶叶中叶绿素的保留量更高,更有利于绿茶的色泽,而远红外足火则对叶绿素的破坏程度较高,导致绿茶色泽劣变。对上述五种不同足火方式所制得茶样进行色泽感官分析,亦显示微波足火所制得绿茶黄绿明亮、尚润,而远红外足火所制得绿茶黄绿稍暗,与成分分析的结果相一致。
表2五种足火方式下绿茶中19个叶绿素及其降解产物组分的含量及差异分析
注:表中所示数据为叶绿素组分的含量相对定量结果(平均值±标准偏差,n=3),同行字母不同表示差异显著(p<0.05)。
最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。
- 一种茶叶中叶绿素及其降解产物组分的分析方法
- 一种茶叶中挥发性组分的分析方法
