一种细菌、真菌、病毒DNA核酸提取的方法
文献发布时间:2023-06-19 12:08:44
技术领域
本发明涉及基因工程领域,特别是一种细菌、真菌、病毒DNA核酸提取的方法。
背景技术
近年来在感染性疾病中不同种类病原微生物的多重感染趋于增加,多重感染严格地说,指多种病原微生物同时作用,产生的感染。多重感染性疾病在临床上相当常见,但由于病因复杂所以难以确证。
随着分子诊断技术的发展,使聚合酶链式反应(PCR)和使用NGS测序技术检测样本中含有的细菌、真菌、病毒成为可能。高通量测序技术的第一步就是模板核酸的制备,即样品中核酸的提取,这直接影响着检测的结果。
长期以来,样本中核酸的提取和纯化一直是耗时,繁琐的过程,虽然目前各种病原微生物混合样本中的核酸提取方法有很多,并且这些方法的原理和操作过程各不相同,但是没有一个适用的满足高通量测序技术需求的、对多种细菌混合物进行核酸进行高效提取的方法。因此,如何从细菌、真菌、病毒的混合物中高效、快捷的提取核酸进行检测已成为了目前高通量测序技术的推广和应用的瓶颈;本发明解决这样的问题。
发明内容
为解决现有技术的不足,本发明的目的在于提供一种细菌、真菌、病毒DNA核酸提取的方法,能快速提取、纯化的获取细菌、真菌和病毒的DNA的方法,提升了现有磁珠法提取DNA的适用范围和提取效率。
为了实现上述目标,本发明采用如下的技术方案:
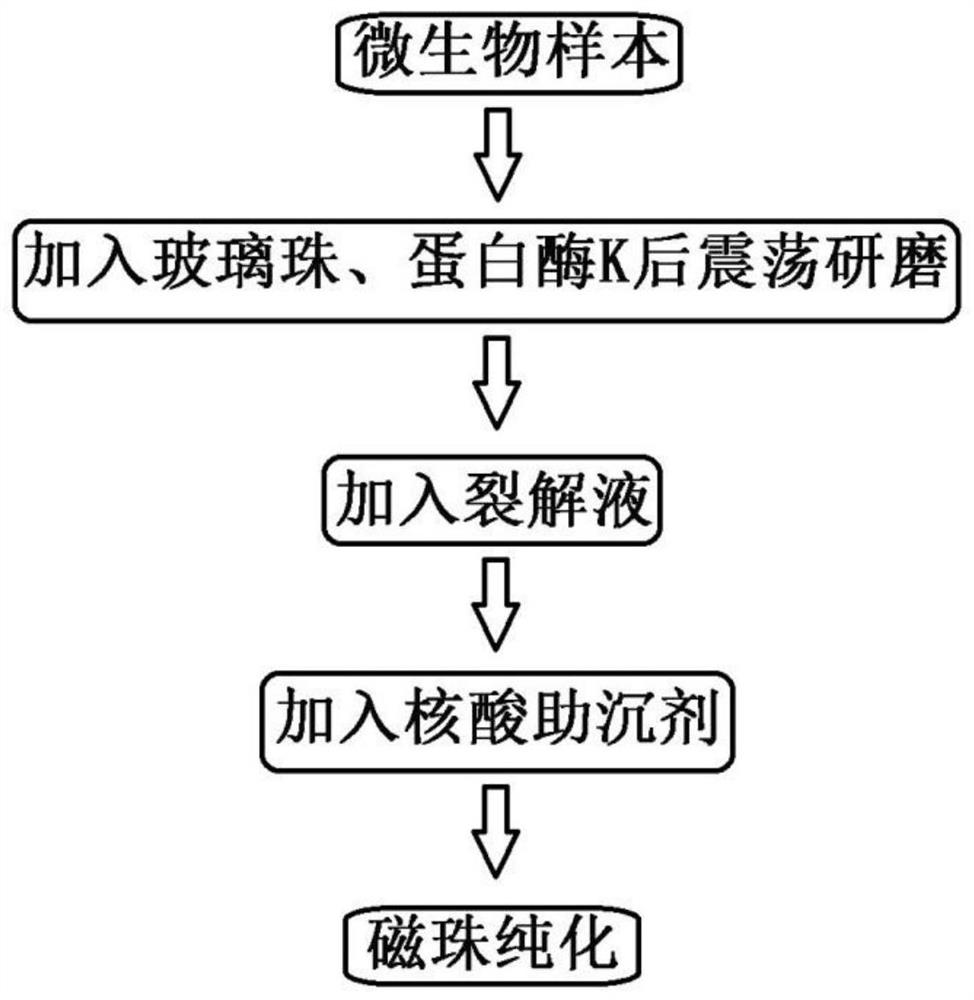
一种细菌、真菌、病毒DNA核酸提取的方法,包括如下步骤:
步骤一,将含有微生物的样本加入到离心管中作为微生物样本;
步骤二,向微生物样本中加入灭菌后的玻璃珠、蛋白酶K,震荡研磨;
步骤三,取研磨后的微生物样本,加入裂解液,放置;
裂解液的成分为2-6mol/离液盐、10-25mmol/L二水合柠檬酸三钠、20-100mmol/LEDTA、5-15mmol/L pH为4.0-8.0的Tris-HCl、0.5-2%N-月桂酰基肌氨酸钠,1-5%非离子表面活性剂;
步骤四,向微生物样本中加入核酸助沉剂,漩涡混匀;
步骤五,对微生物样本进行磁珠纯化,得到纯化后的DNA。
前述的一种细菌、真菌、病毒DNA核酸提取的方法,步骤二中的微生物样本与蛋白酶k的体积比为400:5,蛋白酶K的浓度≥30units/mg protein。
前述的一种细菌、真菌、病毒DNA核酸提取的方法,步骤四中的核酸助沉剂为无水乙醇或异丙醇,微生物样本与核酸助沉剂的体积比为1:1。
前述的一种细菌、真菌、病毒DNA核酸提取的方法,
步骤五中的磁珠纯化,具体步骤包括:
1)加入磁珠,漩涡混匀,室温放置;
2)将向微生物样本置于磁力架上,待磁珠完全聚集后,吸出上清液;
3)将第一洗涤液加入微生物样本中,静置,吸出上清液;
4)将第二洗涤液加入微生物样本中,静置,完全吸出上清液;
5)向微生物样本中加入60-200μl洗脱液,漩涡混匀,室温放置;
6)将微生物样本置于磁力架上,磁珠聚集后,吸出上清液,得到纯化的DNA。
前述的一种细菌、真菌、病毒DNA核酸提取的方法,第一洗涤液的成分为2-6mol/L离液盐、5-45mmol/L EDTA、10-100mmol/L氯化钠和5-25mmol/LpH为4.0-8.0的Tris-HCl。
前述的一种细菌、真菌、病毒DNA核酸提取的方法,第一洗涤液的体积与微生物样本的体积比为1:1。
前述的一种细菌、真菌、病毒DNA核酸提取的方法,第二洗涤液的成分为80%乙醇溶液。
前述的一种细菌、真菌、病毒DNA核酸提取的方法,第二洗涤液的体积与微生物样本的体积比为2:1。
前述的一种细菌、真菌、病毒DNA核酸提取的方法,洗脱液的成分为无核酸酶水。
前述的一种细菌、真菌、病毒DNA核酸提取的方法,磁珠是粒径为0.1-1μm的硅羟基磁珠,用量为20ul。
本发明的有益之处在于:
本发明通过将物理机械破碎以及酶法破壁相结合的方式,提升了病原微生物的提取效率,相较通常的离心柱法提取试剂盒,提升了破壁以及提取效率,以便于后期病原菌的检出;
本发明机械破壁与酶相结合的方法,大大提高了DNA产物的检测极限,同时DNA的提取效率和产物纯度也能得到最大程度的保障,具有意想不到的效果;
本提取方法大大提高了所提取的病原菌丰度,提高了其最低检测线,可用于各类测序产品的应用;
本发明有利于推进DNA提取自动化的实现。
附图说明
图1是本发明的一种实施例的流程图;
图2为实验二不同核酸对真菌实时荧光定量PCR结果的对比图;1为3号提取核酸的目标靶点扩增曲线,2为5号提取核酸的目标靶点扩增曲线,3为3号模板的内参扩增曲线,4为5号模板的内参扩增曲线;
图3为实验二不同核酸对细菌实时荧光定量PCR结果的对比图;1为3号提取核酸的目标靶点扩增曲线,2为5号提取核酸的目标靶点扩增曲线,3为阴性样本目标靶点扩增曲线,的4为3号模板的内参扩增曲线,5为5号模板的内参扩增曲线,6为阴性样本内参扩增曲线;
图4为实验二不同核酸对病毒实时荧光定量PCR结果的对比图;1为3号提取核酸的目标靶点扩增曲线,2为5号提取核酸的目标靶点扩增曲线,3为3号模板的内参扩增曲线,4为5号模板的内参扩增曲线。
具体实施方式
以下结合附图和具体实施例对本发明作具体的介绍。
一种细菌、真菌、病毒DNA核酸提取的方法,包括如下步骤:
步骤一,将含有微生物的样本加入到离心管中作为微生物样本;微生物的样本包括:肺泡灌洗液、脑脊液、痰液、胸腹水等,这里不穷举。
步骤二,向微生物样本中加入灭菌后的玻璃珠、蛋白酶K,震荡研磨;作为一种优选,玻璃珠直径为0.2mm,蛋白酶K的浓度≥30units/mg protein。
作为一种优选,步骤二中的微生物样本与蛋白酶k的体积比为400:5。
步骤三,取研磨后的微生物样本,加入裂解液,56℃放置30min;
裂解液的成分为2-6mol/离液盐、10-25mmol/L二水合柠檬酸三钠、20-100mmol/LEDTA、5-15mmol/L pH为4.0-8.0的Tris-HCl、0.5-2%N-月桂酰基肌氨酸钠,1-5%非离子表面活性剂;作为一种优选,离液盐浓度为2-4mol/L;二水合柠檬酸三钠浓度为15-25mmol/L;EDTA的浓度为20-50mmol/L;Tris-HCl的浓度为10-15mmol/L,pH为5.0-7.0;N-月桂酰基肌氨酸钠的浓度为0.5-1.5%;非离子表面活性剂的浓度为1-3%;离液盐可以为盐酸胍、硫氰酸胍、碘化钠、高氯酸钾等离液序列高的盐,非离子表面活性剂可以为Tween-20、Triton X-100、NP-40、Span-80等;需要说明的是:这里的举例并非穷举,只要是能够实现离液盐和非离子表面活性剂的功能的试剂都能应用于本发明,不受限制。
步骤四,向微生物样本中加入核酸助沉剂,漩涡混匀;
作为一种优选,核酸助沉剂为400μl无水乙醇或300μl异丙醇,微生物样本与核酸助沉剂的体积比为1:1。
步骤五,对微生物样本进行磁珠纯化,得到纯化后的DNA。
具体步骤包括:
1)加入磁珠,漩涡混匀,室温放置25-30min;作为一种优选,磁珠是粒径为0.1-1μm的硅羟基磁珠,优选用量为20ul。
2)将向微生物样本置于磁力架上,待磁珠完全聚集后,吸出上清液;
3)将第一洗涤液加入微生物样本中,静置30s,吸出上清液;作为一种优选,第一洗涤液的成分为2-6mol/L离液盐、5-45mmol/L EDTA、10-100mmol/L氯化钠和5-25mmol/LpH为4.0-8.0的Tris-HCl;进一步的优选,更进一步地,离液盐浓度为3-4mol/L;EDTA的浓度为5-20mmol/L;Tris-HCl的浓度为10-20mmol/L,pH为5.0-7.0;氯化钠的浓度为50-100mmol/L;第一洗涤液的体积与微生物样本的体积比为1:1。
4)将第二洗涤液加入微生物样本中,静置30s,完全吸出上清液;作为一种优选,第二洗涤液的成分为80%乙醇溶液,第二洗涤液的体积与微生物样本的体积比为2:1。
5)向微生物样本中加入60-200μl洗脱液,漩涡混匀,室温放置2-20min,作为一种优选,室温放置的时间为8-15min;作为一种优选,洗脱液的成分为无核酸酶水Nuclease-Free ddH2O,洗脱液的体积为60-150μl。
6)将微生物样本置于磁力架上,磁珠聚集后,吸出上清液,得到纯化的DNA。
通过以下实验验证本发明的效果:
实验准备:试剂准备与配置
1.裂解液
将7.2g高氯酸钾,0.3gN-月桂酰基肌氨酸钠,0.15g EDTA,0.29g二水合柠檬酸三钠,400ul 1M Tris-HCl(PH8.0),1ml NP-40置于烧杯中,加入15ml灭菌后的去离子水充分搅拌,完全溶解后定容至20ml。
2.洗涤液
将3.3g高氯酸钾,0.06g氯化钠,0.11g EDTA,150ul 1M Tris-HCl(PH8.0)置于烧杯中,加入8ml灭菌后的去离子水充分搅拌,充分溶解后定容至10ml。
3.第二洗涤液
将8ml无水乙醇与2ml Nuclease-Free ddH2O充分混匀后待用。
4.核酸助沉剂
无水乙醇
5.磁珠
50mg/ml硅羟基磁珠悬液
6.蛋白酶K
10mg/ml蛋白酶k
7.参比试剂盒
核酸提取试剂盒(天根)
实验一:磁珠加入量的提取效果测试;
1.提取DNA
1)取400ul痰液作为样本(其中已知含有细菌、真菌以及病毒)
2)使用本实验方法提取DNA
3)向400ul样本液中加入实验准备的裂解液400ul,5ul蛋白酶K,5ul溶菌酶,涡旋混匀后56℃裂解30min,加入400ul无水乙醇作为核酸助沉剂,震荡混匀后加入10/15/20/25ul硅羟基磁珠,震荡混匀,室温孵育30min;置于磁力架上,待磁珠完全吸附后,吸弃上清液,加入第一洗涤液,震荡混匀,置于磁力架上,待磁珠完全吸附后,吸弃上清液;加入第二洗涤液,清洗30s后将其完全吸出;晾干磁珠后加入100ul洗脱液洗脱,10min后吸出,转移到另一离心管中。
4)使用天根细菌提取试剂盒提取DNA
5)向200ul样本液中加入210ul GB溶液、20ul蛋白酶K,震荡混匀后56℃裂解10min;向管内加入200ul无水乙醇,将所有液体转移至离心柱内,14000r/min离心30s;加入600ul GD,14000r/min离心30s;加入600ul PW,14000r/min离心30s,重复2次;14000r/min离心2min;加入50ul洗脱液,孵育10min后14000r/min离心1min30s,得到目标产物。同时提取两份,将产物混合,得到100ul产物。
2.核酸浓度检测
取洗脱液1ul,加入199ul Qubit working solution,震荡混匀后,静置2min,使用Qubit 4.0对其进行核酸浓度标定。标定结果见表1:
表1
3.实验结果分析
从核酸提取的最终浓度进行比较,本实验方法内部比较,20ul的磁珠用量即可以充分满足核酸提取的性能要求;与市面上的天根细菌提取试剂盒相比,提取效率更高。
实验二:进行提取效果性能测试
1.样本
使用实验一中表1序号3、5两组核酸样本作为原始样本
2.真菌扩增检测
将3号样本和5号样本提取的核酸分别作为一号模板和二号模板且在同样的条件下进行扩增检测,设计扩增反应混合液体系如表2,并进行相同的扩增反应程序如表3,然后对荧光定量PCR扩增结果得到的Ct值进行统计如表4,扩增曲线如图1所示。
表2扩增反应混合液体系
表3扩增反应程序
表4荧光定量PCR扩增结果统计
3.细菌扩增检测
将3号样本和5号样本提取的核酸分别作为一号模板和二号模板且在同样的条件下进行扩增检测,反应体系、程序同上以及温度然后对荧光定量PCR扩增结果得到的Ct值进行统计如表5,扩增曲线如图2所示。
表5荧光定量PCR扩增结果统计
4.病毒扩增检测
将3号样本和5号样本提取的核酸分别作为一号模板和二号模板且在同样的条件下进行扩增检测,反应体系、程序同上以及温度然后对荧光定量PCR扩增结果得到的Ct值进行统计如表6,扩增曲线如图3所示。
表6荧光定量PCR扩增结果统计
5.实验结果
从同一样本的各类型病原菌实时荧光定量PCR的结果来看,本提取方法大大提高了所提取的病原菌丰度,提高了其最低检测线,可用于各类测序产品的应用。
以上显示和描述了本发明的基本原理、主要特征和优点。本行业的技术人员应该了解,上述实施例不以任何形式限制本发明,凡采用等同替换或等效变换的方式所获得的技术方案,均落在本发明的保护范围内。
- 一种细菌、真菌、病毒DNA核酸提取的方法
- 一种用于动物样本中病毒/细菌核酸提取的方法及试剂
